Аркадий Искандерович Курамшин Элементы: замечательный сон профессора Менделеева
0.0. Предисловие
Идея этой книги пришла ко мне в декабре 2017 года, когда я и многие мои коллеги поняли, что в 2019 году шанс вспомнить про Периодический закон, Периодическую систему, Дмитрия Ивановича Менделеева и химию появится у всех жителей планеты Земля.
В декабре 2017 года Организация Объединенных Наций провозгласила 2019 год «Международным годом Периодической системы химических элементов». Как отмечено в Резолюции ООН, такое решение принято: «…в целях повышения осведомленности мировой общественности о фундаментальных науках и расширения образования в области фундаментальных наук, уделяя особое внимание странам развивающегося мира, для повышения качества повседневной жизни и в том числе для будущих достижений в области научных исследований и разработок…».
С предложением сделать 2019 год годом Периодической системы выступало несколько международных и национальных научных организаций, в том числе Международный союз теоретической и прикладной химии (ИЮПАК), Российская академия наук, Королевское химическое общество Великобритании и Российское химическое общество имени Д. И. Менделеева. Причина такого решения проста — в марте 2019 года исполняется 150 лет со дня, когда на заседании Русского химического общества его председатель — Николай Александрович Меншуткин от имени Дмитрия Ивановича Менделеева прочитал доклад «Соотношение свойств с атомным весом элементов», и 18 марта официально считается днем рождения Периодического закона.
Чтобы отметить это событие, мне захотелось рассказать обо всех химических элементах, известных к настоящему времени. Это немного облегчалось тем, что в 2016 году ИЮПАК одобрил названия четырёх элементов, открытых в начале XXI века, и Периодическая система оказалась временно заполненной до конца — последний из известных элементов — элемент № 118, оганесон, замыкает седьмой ряд Периодической системы. Насколько я знаю, на момент написания книги не появлялось даже пилотских сообщений о синтезе элемента № 119 и последующих за ним. Учитывая, что в наше время от открытия элемента до его появления в Периодической системе под утвержденным названием проходит не менее десяти лет, эта книга может стать попыткой описания всех известных науке химических элементов минимум на десятилетие.
Рассказывая о каждом химическом элементе, я старался приводить о каждом из них как можно больше полезных и интересных фактов. Некоторые из историй, связанных с открытиями и свойствами элементов, появись они в художественной литературе, могли бы быть раскритикованы читателями, как «притянутые за уши» — слишком нереалистичными кажутся иные повороты сюжета. Я старался не рассказывать об общеизвестных вещах, физико-химических свойствах (уверен, что при необходимости пытливый читатель сможет найти информацию о температуре плавления, кипения, минералах, из которых добывают элементах в справочниках или библиотеках), без нужды часто применять специализированные, понятные только специалисту-химику термины, записывать уравнения химических реакций. Всё это сделано сознательно — издатель в своё время говорил Стивену Хокингу: «Каждая формула в научно-популярной книге сокращает число читателей вдвое». Моя цель была — максимально привлечь и заинтересовать читателя, чтобы он захотел продолжить интересоваться химией и далее, а если будет интерес, то и до формул, и до терминов человек дойдёт сам, своими силами. Вместе с тем полагаю, что и те, кто уже давно знают и любят химию, найдут в книге что-то интересное и полезное для себя.
Понятно, что о каждом из известных химических элементов можно написать отдельную книгу, я и сам знаю, что посвящать каждому из них пять-шесть страниц преступно мало. Те, читатели, которые хотят узнать больше всегда могут продолжить свой экскурс в химию, прочитав, например, ту книгу, которой я и сам зачитывался в детстве: «Популярная библиотека химических элементов» В. В. Станцо, М. Б. Черненко. Следует только учитывать, что последнее издание этой книги датируется 1983 годом, в ней описано всего 107 химических элементов, некоторые из них приведены под устаревшими названиями, и за 35 лет некоторые элементы успели найти новые области применения. Кроме «Популярной библиотеки» об элементах и их веществах можно узнать больше в рубрике журнала «Химия и жизнь» под названием «Факты и фактики», других книгах, энциклопедиях и справочниках, а я буду очень рад, если моя книга поможет читателям по-новому посмотреть на удивительный мир химии и её элементов и полюбить его. Приятного чтения!
1. Водород
В классическом анекдоте химиков говорится о том, что жена никогда не понимала Дмитрия Ивановича Менделеева и часто выговаривала ему за то, что он, дескать, ставил на первое место не семью, а водород. С точки зрения истории химии и Периодического закона, анекдот, увы, неверен — в составленной Менделеевым таблице до водорода стояли короний и ньютоний — формы светозарного эфира, в существование которого верил Дмитрий Иванович. Тем не менее, самый простой и самый элегантный химический элемент, в состав которого входит всего один протон и один электрон в полной мере стоит на первом месте.
Водород занимает первое место в Периодической системе, водород — первый химический элемент, который появился во Вселенной, водород стал «сырьём», необходимым для появления всех остальных элементов. Несмотря на то, что появление водорода можно отсчитывать почти с начала времён нашего мира — согласно модели Большого горячего взрыва первые атомы водорода появились в нашей Вселенной через 380 000 лет после начала её расширения, и за миллиарды лет огромное количество звезд превращали водород в гелий, водород до сих пор составляет 75 % от всего наблюдаемого вещества космоса.
Ещё одно отличие водорода от всех остальных элементов в том, что только его изотопам даны уникальные названия. Простейший атом водорода, состоящий из протона и электрона называют протием, нуклид, ядро которого состоит из протона и нейтрона (с ядром все также связан один электрон) называют дейтерием (др.-греч. δεύτερος «второй») или тяжелым водородом, атом, в ядре которого два нейтрона и протон — тритием (др. — греч. τρίτος «третий») или сверхтяжёлым водородом. Никакой другой «квартирант» Периодической системы не заслужил, чтобы его изотопы получили свои собственные имена.
Маленькое терминологическое отступление, которое необходимо здесь и далее для понимания. Как человек, придерживающийся строгих правил в терминологии, поясняю. Нуклид — вид атомов с определённым массовым числом и определённым атомным номером, часто вместо этого термина в научно-популярной и даже научной литературе можно встретить термин «изотоп», но это неправильно — мы можем говорить «изотопы элемента» «радиоактивные изотопы», термин «изотоп» не предполагает применения в единственном числе, только во множественном, поэтому здесь и далее, если нужно сказать о каком-то конкретном типе атомов, будет применяться правильный термин «нуклид».
Водород чрезвычайно важен для вселенной, жизни и всего такого прочего. Без водорода не сформировалось бы дающее нам свет и тепло Солнце. Водород входит в состав тех органических соединений, которые мы считаем строительными блоками жизни, и, что не менее важно, без водорода не было бы того вещества, которое столь важно для существования жизни — воды. Можно сказать, что пользоваться жидкой водой мы можем тоже благодаря «сверхспособности» водорода, точнее его способности участвовать в образовании водородных связей. Водородные связи — прочные межмолекулярные взаимодействия, которые возникают между молекулами, в которых водород связан с кислородом, азотом или фтором и являются причиной многих особых свойств веществ, молекулы которых притягиваются друг ко другу за счет этих связей. Если бы не существовало водородных связей, температура кипения воды составляла бы –70 °C, и на Земле просто не могло бы существовать жидкой воды.
Невольным первооткрывателем водорода можно считать Парацельса — швейцарского алхимика шестнадцатого века, также известного как Филипп Ауреол Теофраст Бомбаст фон Гогенхайм. Парацельс заметил, что растворении большинства металлов в кислотах выделяются пузырьки воспламеняемого «воздуха», причем чаще всего свойства этих пузырьков не зависели ни от природы металла, ни от взятой для его растворения кислоты. Чуть позже, независимо от Парацельса выделение горючих пузырьков наблюдал английский химик Роберт Бойль, вполне возможно, что это могли наблюдать и другие алхимики.
Тем не менее, официальным первооткрывателем водорода, человеком, который предположил, что водород является индивидуальным веществом, был Генри Кавендиш. С 1760 по 1780 год Кавендиш выделил водород, назвал его «негорючим воздухом» и обнаружил, что при горении в «дефлогистированном воздухе» (сейчас мы называем его кислородом) образуется вода. Современное название — водород — «рождающий воду» было предложено Антуаном Лораном Лавуазье.
Высокая горючесть молекулярного водорода и то, что это самый легкий из газов, не дает возможности водороду накапливаться в атмосфере Земли в виде простого вещества — сейчас он, если и появляется в атмосфере, то тут же окисляется кислородом воздуха. Ранее, когда атмосфера Земли еще не была окисляющей, до «большого кислородного события», в ходе которого кислород появился в земной атмосфере и стал вторым газом по содержанию, в четырнадцать раз более легкий чем азот и в двадцать два раза более легкий чем углекислый газ, водород просто поднимался в верхние слои атмосферы и улетучивался в космическое пространство (сейчас по такой же схеме наша атмосфера теряет гелий, образующийся в земной коре во время процессов распада радиоактивных элементов). Небольшая плотность молекулярного водорода привела к тому, что прежде всего он начал применяться в воздухоплавании. Первый заполненный водородом воздушный шар был построен в 1783 году французским ученым Жаком Александром Сезаром Шарлем, вскоре после первого полета братьев Монгольфьер. Шарль справедливо рассудил, что замена горячего воздуха на более легкий газ увеличит подъёмную силу шара и создал свое «воздухоплавательное судно» — заполнил водородом оболочку шара из шёлка, для увеличения герметичности пропитанного природным каучуком (с тех пор воздушный шар, наполняемый водородом или другим газом легче воздуха, стали называть «шарльер»).
Казалось, благодаря водороду, воздухоплавание и летательные аппараты легче воздуха ждет большое будущее. Особые надежды на такие аппараты стали возлагаться с заменой мягких оболочек воздушных шаров на оболочки, усиленные внутренними каркасами. Изобретателем и энтузиастом создания воздухоплавательного парка из таких машин был немецкий граф Фердинанд фон Цеппелин, в честь которого такие воздушные суда стали называть цеппелинами (нам они известны как дирижабли). Золотой век дирижаблей пришелся на 1920–1930-е годы, когда они использовались и для перевозки грузов, и людей, в том числе и через Атлантический океан. Тем не менее, водород, обеспечил не только расцвету эры управляемых шарльеров, но и их закату — главной проблемой водорода является его реакционная способность и высокая горючесть. Из-за того, что наполнявший оболочки воздушных шаров водород загорался, часто случались аварии, а после 6 мая 1937 года, когда возгорание цеппелина «Гинденбург», унесшее жизни 36 человек, было заснято на киноплёнку (справедливости ради, были аварии дирижаблей и с большим количеством жертв, но они не попадали в кинохронику), люди всерьез задумались о безопасности перемещения по воздуху на шаре, наполненном водородом. К счастью, дальнейший прогресс авиации позволил безболезненно прекратить использование дирижаблей. Тем не менее, водород и сейчас не теряет своего значения для средств передвижения. Правда, в наши дни водород привлекает инженеров уже не из-за небольшой плотности, а из-за того, что он сгорает с выделением большого количества энергии. В двигателях многих ракет НАСА топливом является сжиженный водород, который сгорает в чистом кислороде.
Ещё одна тенденция нашего времени — попытка рассматривать водород как альтернативу другим видам топлива, в первую очередь — получаемым с помощью переработки нефти. Конечно, с точки зрения экологии водород выглядит более привлекательным, чем бензин или дизельное топливо — хотя бы потому, что он сгорает только с образованием воды, не давая парниковых газов. Однако, с точки зрения инженера или логиста, переход на водородное топливо не так просто. Наиболее вероятный способ использовать водород — не сжигать его (это может привести к взрыву), а применять как топливо для электрохимической реакции, выделяющийся в результате которой электрический ток и будет приводить в действие двигатель автомобиля. Несмотря на то, что уже сообщается о создании работающих прототипов водородных автомобилей, есть сомнения в том, что в будущем их производство станет массовым. Во-первых, для обеспечения работы таких машин потребуется сеть «водородных заправок», а со времен аварии Гинденбурга водород ни стал не менее взрывчатым, ни менее огнеопасным. Еще одна проблема в том, что из литра бензина можно получить в три раза больше полезной энергии, чем из литра сжиженного водорода, и, очевидно, понятно, что для сжижения легкого газообразного водорода энергию нужно потратить. Нельзя не упомянуть и то, что в настоящее время у нас нет и достаточно эффективных способов получения водорода — его получают либо из углеводородов (попутно при этом образуются парниковые газы), либо электролизом воды, а электричество для процесса тоже может быть получено с помощью «грязных технологий».
Но, даже если в будущем нас не ждёт эра водородных автомобилей, водород может стать топливом для более энергоёмкого процесса — управляемого термоядерного синтеза. Скорее всего, разработки промышленных термоядерных реакторов для получения электроэнергии придётся ждать еще десятилетия, но термоядерные процессы — процесс слияния атомов водорода в гелий, точно такие же, которые протекают в звезде по имени Солнце и в других звездах, с именами и без, позволит добиться получения наиболее чистой и безотходной электроэнергии. И, какое бы применение мы уже не нашли водороду, и, какое применение мы еще найдем для него, он навсегда останется элементом № 1, тем элементом, с которого начинается и Периодическая система, и началась Вселенная.
2. Гелий
С гелием, по крайней мере с шариками, наполненными гелием, знакомы практически все. Правда всякий раз, когда я вижу, как на мероприятиях или праздниках пускают в небо шары, надутые гелием, я чувствую себя слегка опечаленным. Это происходит не из-за того, что я не люблю веселиться (веселиться я даже очень люблю) и даже не из-за того, что меня волнует судьба оболочки шара. Когда-нибудь гелий «сдуется», оболочка упадёт и пополнит и без того немалое количество полимерного мусора, накапливающегося в окружающей среде (хотя, людям, запускающим шарики в небеса, стоило бы задумываться и об этом).
Когда я вижу летящие шарики, надутые гелием, меня, как химика, заботит то, что с ними мы практически навсегда теряем ценный ресурс — гелий. Вероятно, корни чувств, которые я испытываю при этом лежат в прошлом — в 1992–1995 году в аспирантуре я с помощью газожидкостной хроматографии изучал кинетику реакций, газом-носителем для хроматографа был гелий. Когда баллоны с гелием заканчивались, работа прекращалась на длительный срок до появления средств на новую порцию гелия — с тех пор я привык бережно относиться к этому инертному газу.
Гелий второй по распространенности элемент во Вселенной, но здесь, на Земле он редкий гость. Многие предполагают, что гелий получают переработкой воздуха, но на самом деле этот инертный газ добывают из пробуренных в земле скважин. Гелий в следовых количествах входит в состав природного газа, в некоторых месторождениях его больше, в некоторых меньше, но в любом случае гелий добывают из природного газа с помощью низкотемпературной фракционной перегонки (разделения при низкой температуре). Возникает вопрос — как же гелий мог оказаться под землей и смешаться с природным газом. Ответ в том, что в отличие практически от всех остальных химических элементов Периодической системы, которые мы можем найти в земной коре, гелий на Земле появился много позже образования нашей планеты.
Гелий образуется в ходе естественного радиоактивного распада таких элементов, как уран и торий. Эти тяжёлые элементы образовались до формирования земной коры, их ядра не стабильны, и очень медленно распадаются. Оба изотопа урана — уран-235 и уран-238 подвергаются α-распаду — при самопроизвольном разрушении их ядер выделяется α-частица, которая представляет ничто иное, как ядро атома гелия. Сам атом гелия рождается после того, как ядро захватывает электроны.
Распад изотопов урана протекает исключительно медленно, период полураспада (время, за которое распадается половина радиоактивных атомов) для урана-238 составляет 4,4 миллиарда лет, а для урана-235 — 0,7 миллиардов лет. Геологический возраст Земли составляет 4,54 миллиарда лет, и можно сказать, что гелий непрерывно образуется в земной коре с момента образования нашей планеты. Большая часть гелия просачивается через поры земной коры в атмосферу, медленно покидая ее, но, к счастью, часть гелия в подземных резервуарах смешивается с природным газом и может быть выделена из него.
В космосе все совсем иначе. Солнце состоит на 73,5 % из водорода, 24,9 % из гелия, оставшаяся масса приходится на более тяжёлые элементы. Солнце, как и другие звезды, представляют собой естественные термоядерные реакторы, в которых при высоких температурах протоны, представляющие собой ядра водорода, сливаются с образованием гелия. В результате слияния более легких ядер и образования более тяжелых элементов выделяется огромное количество энергии, и этот способ ее получения, как упоминалось в предыдущей главе, хотят воспроизвести на Земле.
Раз уж гелий составляет почти четверть от массы Солнца, неудивительно, что его удалось обнаружить на Солнце полтора века назад. Скорее, более удивительно то, что на Земле его смогли найти только через четверть века после того, как его нашли в космосе.
С конца восемнадцатого века, с появлением такого сильного окислителя, как хлорат калия (бертолетова соль) стало понятно, что некоторые химические элементы могут окрашивать пламя в определенные цвета. Это открытие позволило создать и пиротехнические составы, в которых, например, зеленый цвет создается солями бария или бора, а красный — лития или стронция. Помимо создания индустрии красочных фейерверков окраска элементами пламени позволила научиться идентифицировать элементы по цвету, в который они окрашивают пламя, позже — в результате совместной работы Бунзена и Кирхгоффа появился прибор под названием спектроскоп, в котором цвет, создаваемый элементом в пламени, с помощью призмы (сейчас — с помощью дифракционной решетки) расщеплялся на спектр — совокупность тонких и чётких окрашенных линий. Набор таких линий оказался строго индивидуальным для каждого элемента, как отпечатки пальцев индивидуальны для человека. С той поры идентификацию известных и открытие новых элементов стали проводить уже не просто по цвету, а по набору его спектральных линий (с помощью спектроскопа Бунзен и Кирхгоф смогли открыть такие элементы, как рубидий и цезий).
В какой-то момент ученые решили, что спектроскоп может пригодиться не только на Земле и попробовали использовать этот прибор для изучения химического состава Солнца. Такой подход позволил обнаружить на Солнце натрий, магний, кальций и железо. В 1868 году независимо друг от друга француз Пьер Жансен англичанин Норман Локьер, независимо друг от друга обнаружили в солнечном спектре чёткие линии, которые не соответствовали ни одному из известных в то время металлов (в том, что это был именно металл, ни у Жансена, ни у Локьера сомнений не было). Локьер предложил для этого «металла» название «гелий» в честь древнегреческого бога Солнца — Гелиоса. В течение двух десятков лет гелий так и не был обнаружен на Земле, и Локьер стал становиться мишенью для насмешек. Однако в 1895 году Уильям Рамзай обнаружил гелий в газе, полученном при обработке кислотой урансодержащего минерала клевеита. В спектре газа была обнаружена та же ярко-жёлтая линия, которую Жансен и Локьер наблюдали в солнечном спектре. Образец был направлен для дополнительного исследования английскому учёному-спектроскописту Уильяму Круксу, который подтвердил, что наблюдаемая в спектре образца жёлтая линия совпадает с линией D3 гелия, обнаруженного на Солнце. Гелий, образующийся при радиоактивном распаде, поглощался горной породой, и при растворении породы в кислоте высвобождался. Итак, элемент, окрещённый Локьером, был обнаружен на Земле, но оказался не металлом, а крайне инертным газом. И в наши дни, когда элементов в Периодической системе больше, чем во времена Локьера и Рамзая, гелий остается единственным инертным газом, чьё латинское название оканчивается суффиксом «-ium», применяющимся обычно в названиях элементов-металлов.
Уникальные химические свойства — малая плотность и химическая инертность, позволяет применять гелий не только для заполнения шаров для развлечения и метеорологических зондов. Так, смесь гелия с кислородом может применяться для лечения новорожденных с проблемами дыхания или в качестве дыхательной смеси для аквалангистов, опускающихся на значительную глубину, подъем с которой при дыхании воздухом может привести к вскипанию пузырьков азота в крови — кессонной болезни. У гелия самая низкая температура кипения из всех веществ, она составляет –269 °C. Это свойство обуславливает применение гелия в системе охлаждения магнитов ядерных магнитных спектрометров и аппаратов МРТ в больницах.
Чаще всего там, где гелий применяется, его улавливают и используют повторно. Если такого не происходит, он попадает в атмосферу, но не накапливается в ней. Гелий настолько лёгок, что он не удерживается полем тяготения Земли, и, попадая, в верхние слои атмосферы, покидает нашу планету навсегда — это и есть судьба гелия, которым заполняют летающие шары, его наша планета теряет навсегда. Не исключено, что через сотню лет наши потомки будут отказываться верить в то, что мы добровольно потеряли столько гелия просто ради развлечения.
3. Литий
Несмотря на то, что литий, наряду с водородом и гелием, входит в число элементов, образовавшихся вне звезд, в начале Большого горячего взрыва, его во Вселенной мало.
В земной коре этот элемент был обнаружен в 1817 году шведским учёным Йоханом Августом Арфведсоном при изучении минерала петалита ((Li,Na)[Si4AlO10]), который при контакте с огнём давал яркое малиново-красное пламя. Арфведсон и работавший с ним Йохан Берцелиус пришли к выводу, что в петалите содержится неизвестный металл, который Берцелиус назвал литием от греческого слова, обозначающего «камень» — это название должно было отразить, что литий был обнаружен в твердом минерале, в отличие от калия, про который было известно, что он содержится в золе или крови животных. Шведские химики предположили, что литий представляет собой новый щелочной металл, более лёгкий, чем натрий, но выделить его из солей не смогли. Небольшой образец металлического лития в 1821 году получил Уильям Томас Бранде, проведя электролиз оксида лития (аналогичный метод в 1818 году Хэмфри Дэви использовал для получения металлического натрия), и, наконец, в 1855 году Бунзен, действуя электрическим током на расплавленный хлорид лития, смог выделить такое количество этого щелочного металла, которого хватило для изучения его физических и химических свойств. В настоящее время в мире ежегодно производится 40 000 тонн соединений лития и 7500 тонн металлического лития, который производит по методу, предложенному Робертом Бунзеном — ведут электролиз нагретого до 450 °C расплава хлорида лития в стальных электролизерах.
В 1940-х годах была обнаружена умеренная токсичность лития — состояние пациентов, которых пытались вылечить от сердечно-сосудистых заболеваний, заменяя в рационе поваренную соль на хлорид лития, ухудшалось, а не улучшалось. Тем не менее, небольшие дозы соединений лития прописывают для лечения биполярного расстройства (раньше это заболевание называли маниакальной депрессии). То, что соединения лития действуют на мозг как успокоительные, было обнаружено в 1949 году австралийским врачом-психиатром Джоном Кейдом. Кейд внутривенно вводил морским свинкам 0.5 % раствор карбоната лития, и, к его удивлению, эти, обычно резвые животные становились вялыми, иногда успокаиваясь настолько, что просто могли по несколько часов сидеть, не меняя положения. Кейд ввёл аналогичный раствор своему пациенту, симптомы заболевания которого проявлялись исключительно в острой форме. Состояние пациента улучшилось так, что через пару дней его уже можно было перевести из палаты для особо буйных в общую, а через пару недель больной выписался из больницы и вернулся на работу. К аналогичным результатам привели и литиевые инъекции у других пациентов. Это был прорыв в психиатрии — до этого маниакальную депрессию в особо острой форме лечили либо электрошоком, либо лоботомией. В настоящее время карбонат лития применяется для купирования приступов биполярного расстройства во всем мире, хотя и до сих пор непонятен механизм терапевтического эффекта. Предполагается, что литий тормозит образование сигнальных молекул в ткани мозга, приступы же начинаются именно при избытке таких молекул.
Применение лития не ограничивается психиатрией. Оксид лития применяется при изготовлении стекол и керамики. Небольшое количество металлического лития, которое добавляют в сплавы увеличивает их прочность и уменьшает плотность. Литий-магниевый сплав используют для изготовления защитных покрытий, а алюминий-литиевый позволяет делать более лёгкие самолеты, тем самым экономя топливо. Стеарат лития, который получают с помощью реакции гидроксида лития со стеариновой кислотой представляет собой отличную смазку и входит в состав многих смазочных материалов. Это соединение может работать как смазка даже при температурах ниже –60 °C и применяется для машин, работающих в Антарктике. Самой, пожалуй, известной областью применения лития сейчас являются литий-ионные источники питания, которые используются везде, где нужна компактность и лёгкость. Первоначально литиевые источники питания применяли в медицине — срок службы литиевых батареек, приводивших в действие кардиостимуляторы, при создаваемом ими напряжении в 3 вольт и более составляет 10 и более лет. Более привычные нам источники питания с выходным напряжение в 1.5 вольта, как правило, перезаряжаемые и используются для питания многочисленных смартфонов, плееров, планшетов, пульсометров и шагомеров.
Металлический литий представляет собой мягкий серебристо-белый металл, первый среди металлов в Периодической системе и первый щелочной металл. Как и все щелочные металлы он активно реагирует с водой, и хранить его не так просто. Если другие щелочные металлы защищают от кислорода воздуха и влаги воды, храня под слоем керосина, для лития этот вариант не подходит — плотность лития мала, и в керосине он не тонет. Чтобы литий не реагировал с окружающей средой приходится вплавлять его в кусок парафина. В отличие от других щелочных металлов литий не реагирует с кислородом при низких температурах, чтобы пошла реакция, нужно нагреть этот щелочной металл хотя бы до 100 °C. Зато, опять же в отличие от других щелочных металлов, при гораздо меньшем нагревании литий реагирует с другим компонентом атмосферы — азотом, образуя красно-коричневый нитрид лития, Li3N.
И ещё одно применение лития, возможно не самое приятное, хотя тоже связано с энергетикой — термоядерный боеприпас или водородная бомба. «Взрывчатым веществом» водородной бомбы является гидрид лития (LiH), в котором с изотопом литий-6 связан тяжелый водород (дейтерий). Схема действия этого оружия такова — «запалом» водородной бомбы является атомная бомба. Взрыв атомной бомбы высвобождает нейтроны, которые, поглощаясь ядром лития-6, вызывают его разрушение с образованием гелия и сверхтяжелого водорода (трития), который затем вступает во вторичные реакции изменения состава атомного ядра. Термоядерные боеприпасы не только в состоянии обеспечить большую, чем у обычных атомных бомб, общую мощность взрыва, но и отличаются значительно большим количеством радиоактивных осадков, так что, надеюсь, в этой области литий никогда не будет применяться на практике.
4. Бериллий
Бериллий — первый элемент Периодической системы, который не образовался во время Большого взрыва, а появился позже — после появления первых звезд. Именно после — бериллий образовался не в термоядерных топках звёзд, подобных нашему Солнцу.
Бериллий, как и многие другие элементы образуется во время разрушения звёзд — тогда, когда энергия вспышки сверхновой разрывает ядра тяжелых атомов на более легкие. То, что бериллий образуется не во время активной работы звезд, а при их разрушении, объясняет сравнительно малую распространённость этого элемента и в космосе, и в земной коре.
Одной из форм существования бериллия в земной коре являются минералы берилл и изумруд, оба эти минерала известны еще с античности. По легенде, император Рима Нерон смотрел на гладиаторские поединки через большой берилл, который природа отшлифовала так, что его можно было использовать в качестве подзорной трубы. Зелёную окраску бериллу и изумруду придают следовые количества хрома. Анализ изотопного состава кислорода в содержащих бериллий драгоценных камнях позволяет определить источник камня — это возможно, так как соотношение изотопов кислород-16 и кислород-18 на разных участках земной коры различается, и современные методы анализа позволяют обнаружить это различие. Изотопный анализ камней драгоценных камней показал, что происхождение изумрудов Римской империи — Альпы, точнее их район, ныне расположенный на территории Австрии, хотя некоторые из камней прибыли в Рим из более дальних мест — оттуда, где сейчас расположен Пакистан. Гораздо более интересно то, что некоторые изумруды, принадлежавшие правителям Империи Великих Моголов, судя по изотопному анализу — южноамериканские, их залежи могли располагаться на территории современной Колумбии. Косвенно это является свидетельством того, что государство, существовавшее на территории современных Индии, Пакистана, Бангладеш и юго-восточного Афганистана могло отправлять экспедиции в Южную Америку через Тихий Океан, хотя подтверждающих это исторических источников нет. К основным минералам бериллия относятся алюмосиликаты берилл и бертрандит. Бывает, что бертрандит образует кристаллы огромного размера. Рекордный образец бертрандита был найден в американском штате Мэн — длина кристалла составляла 5 метров, а весил он 20 тонн.
Предположение о том, что берилл и изумруд содержат новый химический элемент, появилось в восемнадцатом веке. Драгоценные камни проанализировал Луи Никола Воклен и 15 февраля 1798 объявил, что обнаружил новый элемент, хотя и не смог выделить его из оксида. Металлический бериллий был получен только в 1828 году в результате реакции хлорида бериллия (BeCl2) с калием. Сам Воклен предложил дать новому элементу название «глюциний», бериллием элемент назвал немецкий химик Клапрот.
Бериллий сыграл важную историческую роль в изучении строения атома — этот элемент помог обнаружить такую элементарную частицу, как нейтрон. Открытие произошло в 1932 году. Джеймс Чедвик бомбардировал образец бериллия α-лучами (потоком ядер атомов гелия), которые испускались претерпевающими радиоактивный распад атомами радия. Чедвик обнаружил, что бериллиевая мишень испускает новый тип элементарных частиц, масса которых была практически одинаковой с массой протона, но не имевших электрического заряда. Комбинацию радия и бериллия до сих пор применяют для получения нейтронов в исследовательских целях, хотя эффективность этого способа невелика — миллион α-частиц позволяют получить всего лишь 30 нейтронов.
Бериллий — серебристо-белый, блестящий металл. Он довольно мягок и отличается небольшой плотностью. Бериллий довольно инертен — он не взаимодействует с водой даже при очень высоких температурах. Сплавы меди и никеля с бериллием не только характеризуются большей электро- и теплопроводностью, чем чистые медь и никель, но также приобретают исключительно высокую эластичность. Именно благодаря эластичности такие сплавы применяются для изготовления пружин, сплав меди с бериллием также применяют для изготовления искробезопасных инструментов, которыми и только которыми можно работать в опасных производственных помещениях, например, нефтехранилищах.
Низкая плотность бериллия и его высокая прочность позволяли предполагать, что этот металл станет основным материалом для аэрокосмической техники и заменит алюминий, но этому предположению так и не удалось воплотиться в жизнь. Благодаря высокой теплоотдаче при горении бериллия его порошок когда-то использовали как твёрдое ракетное топливо, но и в этой области он сейчас не используется. Причина тому, что бериллий не стал продуктом крупнотоннажного металлургического производства стала его высокая токсичность — из-за сейчас в мире ежегодно получают не более 500 тонн металлического бериллия.
Бериллиевая пыль вызывает хроническое воспаление лёгких и проблемы с дыханием. Кратковременный контакт с большим количеством бериллия или долгосрочное вдыхание малых количеств бериллиевой пыли вызывает бериллиоз лёгких. От отравления бериллием до проявления симптомов бериллиоза может пройти до пяти лет, и эта болезнь чаще всего приводит к преждевременной смерти или инвалидности. В основной группе риска находятся работники предприятий, на которых изготавливают металлический бериллий и бериллиевые сплавы. Впервые токсичность бериллия установили в 1940-х годах ухудшения состояния рабочих на производстве флуоресцентных ламп первого поколения, в люминофорный слой которых входил оксид бериллия. В 1950-е годы производство таких ламп было запрещено.
Бериллий помогает делать выводы и о геофизическом прошлом нашей планеты. В земной коре бериллий представлен только одним стабильным изотопом — бериллием-9, изотоп бериллий-10, попадающий в верхние слои атмосферы с космическими лучами, радиоактивен, период его полураспада составляет 1.5 миллиона лет. Этот радиоактивный изотоп бериллия был обнаружен в ледниках Гренландии и морских донных отложениях. Содержание бериллия-10, накопившегося там за последние 200 лет, возрастает и понижается параллельно увеличению и уменьшению солнечной активности. Содержание же этого изотопа в морских донных отложениях, сформировавшихся во время последнего ледникового периода, на 25 % выше, чем в отложениях более поздних периодов. Эти наблюдения позволяют говорить о том, что магнитное поле Земли во времена ледникового периода было слабее, чем сейчас.
5. Бор
В наши антропоцентричные времена появилась тенденция на гуманизацию животных, растений и даже неодушевлённых предметов. Художники, проявляя различную степень мастерства, гуманизируют даже химические элементы, изображая их в виде людей, принадлежащих разным профессиям и обладающих различными чертами характера. Некоторые из элементов — те, которые больше на слуху, легко представить в виде людей. Так, золото можно изобразить блестящим финансистом-миллионером, не стремящимся к образованию прочных отношений.
Гелий мог бы выглядеть юношей с шевелюрой цвета Солнца, гербом благородного дома и высоким голосом. А что же с бором? Я бы приготовил для этого элемента два изображения. Большую часть времени бор ведет себя как рядовой менеджер среднего звена и средних лет, одетый в коричневые брюки и твидовый пиджак, но приходит время, он раскрывается с необычной стороны — предпочитает коктейль из мартини с водкой по рецепту «Смешать, но не взбалтывать», сложные спецоперации и гонки на мотоциклах.
Впервые в виде бор был получен в 1808 году французскими химиками Жозефом Гей-Люссаком и Луи Тенаром с помощью реакции оксида бора (борного ангидрида) B2O3 с металлическим калием. Чуть позже, в том же бор электролизом расплавленного B2O3 Хэмфри Дэви удалось получить большее количество бора. В виде простого вещества бор представляет собой аморфное вещество коричневого цвета, который вряд ли может привлечь кого-то.
По-настоящему бор раскрывается с неожиданной стороны, когда речь идёт о его производных. Возьмём нитрид бора — BN. Взятые в соотношении 1:1 элемент № 5 и элемент № 7 связаны такими прочными связями, что кристаллическая решетка нитрида бора такая же прочная, как кристаллической решётка, состоящая из элемента № 6 — алмаза. Трифторид бора BF3 представляет собой типичную кислоту Льюиса. В отличие от справедливых для водных растворов теорий Аррениуса и Бренстеда-Лоури, в которых к кислотам относят вещества, образующие в воде ион гидроксония Н3О+, теория кислот и оснований Льюиса универсальна, и в ней кислотой считается вещество или частица, которая может выступать акцептором пары электронов. Самая простая кислота Льюиса — протон, частица, которую мы обозначаем как Н+. Соединение BF3 может выступать в качестве кислоты Льюиса из-за того, что за счет собственных трех электронов бора и трех электронов от атомов фтора электронная оболочка бора содержит шесть электронов. Для формирования устойчивых электронных оболочек, в соответствии с правилом, впервые установленным самим Льюисом, необходимо восемь электронов. Бор в трифториде бора и подобных соединениях формирует устойчивую восьмиэлектронную оболочку, принимая в свободную электронную ячейку-орбиталь два электрона, заряжаясь при этом отрицательно.
Именно это свойства бора позволяет применять гексагидрид дибора, он же диборан (В2Н6) в спецоперациях органического синтеза. Гидрида бора со строением ВН3 нет, но об этом чуть позже. Диборан быстро и избирательно присоединяется к двойным связям углеводородов, а продукт этого присоединения легко разрушается щелочным раствором перекиси водорода, образуя при этом спирты. Реакция протекает очень легко, не образуя побочных продуктов, и самое главное её достоинство в том, что она позволяет получать первичные спирты, которые нельзя получать присоединением воды к двойной связи непредельного углеводорода — там, в соответствии с правилом Марковникова, можно получить только вторичные спирты.
Свое название бор получил благодаря минералу, из которого был выделен — буре, Na2B4O7×10H2O, действуя сильной кислотой на буру, можно получить борную кислоту H3ВО3, которую раньше можно было купить в аптеке. Борная кислота применялась как мягкое асептическое средство, средство для обработки щелочных ожогов кожи и даже инсектицид, правда сейчас борную кислоту стараются не использовать — она попала под подозрение как слабый канцероген. В борной кислоте с атомом бора вязано три гидроксильные группы — ОН, если одну группу ОН заместить на остаток ароматического углеводорода — арильную группу, получается арилборная кислота, способная реагировать с арилгалогенидами с образованием связи С-С в каталитической реакции, известной как реакция Сузуки. За эту реакцию, которая позволяет получать новые органические соединения с большой скоростью и избирательностью, образуя целевые продукты с большими выходами, её первооткрыватель — Акиро Сузуки в 2010 году был награжден Нобелевской Премией.
Свою роль бор сыграл и в теории химии, точнее, в теории химической связи. Произошло это тогда, когда в 1940-е годы ученые начали задумываться о том, почему молекулы BH3 не существует, а простейший бороводород — диборан, формула которого B2H6.
Элементы главных подгрупп, к которым относится бор, стремятся заполнить внешнюю оболочку до восьми электронов. В соответствии с правилом электронных октетов, устойчивой электронной оболочкой является оболочка, изоэлектронная инертным газам. Образуя химические связи (как ионные, так и ковалентные), атомы стремятся отдавать или принимать такое количество электронов, которое обеспечит наличие восьми электронов на их внешнем слое.
У бора на внешнем (валентном) уровне всего три электрона, поэтому в гипотетическом соединении BH3 на внешнем электронном слое бора будет располагаться шесть электронов. Такая конфигурация не будет устойчивой, и, соответственно, соединения с шестиэлектронной оболочкой не будут устойчивы и просто не смогут существовать. Для увеличения стабильности своих соединений бор стремится принять на эту орбиталь пары электронов уже сформированных ковалентных связей. В конечном итоге образуются так называемые многоцентровые связи, в которых пара (или большее число электронов) может одновременно принадлежать более чем двум ядрам.
Состав соединений с многоцентровыми ковалентными связями часто отличается от состава, который можно было бы предсказать, основываясь на привлечении «привычной» теории валентных связей, где одинарная, двойная или тройная связи могут образовываться только между двумя атомами (то есть облако электронов может единовременно принадлежать только двум атома — двум центрам, формирующим связь).
Изучение химической связи в боранах позволило определить, что теория валентных связей и классические валентные состояния не всегда могут предсказать и описать состав и строение химических веществ. Обнаружение для атомов бора многоцентровых многоэлектронных связей поставило перед химиками вопрос о необходимости нового определения валентности и других характеристик ковалентной связи, тем более что существующее в настоящее время определение валентности по IUPAC нельзя считать идеальным: «Валентность — максимальное количество одновалентных атомов, которое может соединиться с элементом или фрагментом, или с тем, чем может быть заменен этот атом». Очевидно, что давать определение феномена, используя слово, являющееся производным этого феномена, немного нелогично.
6. Углерод
Поскольку любой химик (как, впрочем, и любой человек) является углеродной формой жизни, об углероде он может разговаривать часами. Любой, кроме химиков-органиков. Они, конечно тоже углеродные формы жизни, внешне неотличимые от людей, но поскольку они работают над получением новых соединений, содержащих линейные, разветвленные и замкнутые цепочки из атомов углерода и полагают, что все остальные элементы.
Периодической системы нужны лишь для исполнения грандиозного замысла — построения главной углеродной цепочки, которая их волей свяжет и скуёт все остальные углеродные цепи, они могут говорить об углероде сутками.
Органическая химия, конечно, интересна, и действительно об органических соединениях можно говорить много и долго (говорю об этом ответственно, до того, как стать химиком-элементооргаником, я тоже был органиком), но и в виде простых веществ, веществ, состоящих только из атомов углерода, углерод весьма интересен. Углерод образует много разновидностей простых веществ — аллотропных модификаций. Кажется, что в последнее время каждая из таких модификаций получает своё «десятилетие славы» — в 1990-е годы своеобразным «хитом» стали полые «мячики» из атомов углерода — фуллерены, в начале 2000-х внимание химиков и специалистов по материаловедению приковали углеродные нанотрубки, и наконец последнее десятилетие, после вручения в 2010 Нобелевской Премии по физике Андрею Гейму и Константину Новосёлову самой «хайповой» формой углерода стал графен — двумерный материал или слой углеродов толщиной в один атом.
Однако, говоря об углероде, больше бы хотелось рассказать не о его новых обличьях, а о представителях той его форме, которые известны как лучшие друзья девушек, об алмазах. Да, в английской песне, которую пела Норма Джин Бейкер (более известная, как Мерлин Монро), речь шла об алмазах, бриллианты — те же алмазы, но огранённые, с правильной формой, упомянуты в более поздней песне, которую пела Вера Галушка (она же Вера Брежнева).
Тысячелетиями алмазы ассоциировались с достатком и богатством — блеск ограненных камней украшал перстни вельмож, короны монархов и тиары понтификов. К сожалению, у алмазов есть и своя темная сторона — почти у каждого крупного камня есть своя кровавая история, известные случаи, когда алмазами небольшого размера финансировались локальные конфликты и небольшие гражданские войны.
Твёрдость алмазов и блеск граней бриллиантов многие века заставлял алхимиков и химиков пытаться получать эти камни искусственным путём. Первый удачный синтез алмаза был осуществлен в почти одновременно в США и Швеции. Для синтеза исследователи воспользовались тем способом, с помощью которого алмазы формируются в земной коре — первая технология получения искусственных алмазов основывалась на превращении графита в алмаз при высоких температурах (более 3000 °C) и высоких давлениях (более 130 атмосфер). Демонстрация возможностей получения алмазов впечатляла, но, увы, затраты энергии на создание температуры и давления, необходимых для такого получения алмазов, не позволяли рассматривать новую технологию как способ промышленного производства — по расходам на их получение первые синтетические алмазы стоили гораздо дороже, чем алмазы природного происхождения. С той поры способ получения алмазов сжатием при высокой температуре был модернизирован, использование катализаторов позволяет снизить и давление, и температуру синтеза. Конечно, этот способ не идеален — если кристалл алмаза в пару микрон диаметром можно вырастить за пару минут, то алмаз в один карат нужно растить несколько недель.
Тем не менее, разработанная технология означает, что в настоящее время появилась возможность синтезировать алмазы, практически неотличимые от природных, из любого углеродсодержащего материала. Конечно, отличить природные алмазы, сформировавшиеся в кимберлитовых трубках, от алмазов, синтезированных, скажем, из наших волос, можно с помощью специального оборудования (например, определив их изотопный состав), но принципиальное значение такая возможность представляет только для алмазов, поступающих на рынок ювелирных изделий (природные алмазы дороже синтетических) — химические и физические свойства синтетических алмазов полностью идентичны свойствам природных камней.
С точки зрения химика или физика, описывая физические, химические и электронные свойства алмазов, мы рискуем слишком часто использовать превосходную форму сравнения. До настоящего времени алмаз является самым твёрдым материалом, известным человеку и одним из самых химически устойчивых веществ — он выдерживает воздействие самых сильных кислот. У алмаза также наиболее высокая теплопроводность из известных материалов, он легко рассеивает тепло, поэтому алмаз всегда прохладен на ощупь. Благодаря распределению электронов алмаз можно считать хрестоматийным примером диэлектрика, и опять же благодаря своему электронному строению алмаз — твердый материал с идеальной пропускаемостью электромагнитного излучения в широкой области спектра. Все эти свойства делают алмазы лучшими друзьями не только девушек, но и учёных. Твердость и химическая стойкость алмаза позволяет применять его для изготовления защитных покрытий, устойчивых к истиранию, химической коррозии и радиационному повреждению. Высокая теплопроводность и диэлектрические свойства идеально подходят для изготовления электроники. Прозрачность алмаза позволяет делать из него оптические устройства, а биологическую совместимость алмаза можно использовать, изготавливая покрытия для имплантов. Эти свойства алмазов известны несколько веков, почему же случаи практического применения алмазов достаточно редки? Причина этому в том, что как размеры природных алмазов, равно как и алмазов синтетических, тех, которые получают при высоких давлениях и высоких температурах, ограничены и обычно не превышают нескольких миллиметров, и их можно резать и формовать только вдоль определённых граней. Сложности с обработкой алмазов не дают применять их в большинстве областей, в которых их можно было бы применить.
Около десятилетия назад появилось решение, позволяющее расширить возможности применения алмазов — был разработан новый способ их синтеза при низком давлении с помощью метода химического осаждения из газовой фазы. Для этого газовую смесь, состоящую из 99 % водорода и 1 % метана пропускают над нитью накала, в результате чего происходит термическая активация компонентов газовой смеси, и в ней образуются реакционноспособные радикалы водорода и метильные радикалы, реакции которых приводят к тому, что газ, осаждаясь на твердой охлажденной подложке, формирует на ней тонкую плёнку из алмаза. Первоначально образуется углеродная плёнка, состоящая из и графита, и алмаза, но в условиях реакции отложения графита разрушаются, и остается только алмаз. Формирующиеся алмазные плёнки поликристаллические, они состоят из кристаллитов алмаза микронного размера. Несмотря на непривлекательный внешний вид, такие пленки можно осадить на поверхности, которые отличаются друг от друга и размером, и материалом, и формой, что, очевидно, увеличивает шансы практического применения алмазов.
Конечно, для полноценного применения алмазных плёнок, полученных с помощью химического осаждения паров, ещё необходимо выяснить, какие химические процессы протекают (и протекают ли) там, где алмазная плёнка контактирует с поверхностью, на которую её нанесли, а также уточнить наиболее оптимальный способ применения плёнок — алмазные плёнки предоставят химикам, физикам, специалистам по материаловедению и инженерам многие годы работы. Однако эти перспективы уже сейчас позволяют говорить, что алмазы собираются завести гораздо более широкий круг друзей, чем у них был до недавнего времени.
7. Азот
Достаточно часто в блогах, статьях и даже школьных планах поурочного планирования со ссылкой на Большую Советскую энциклопедию 1952 года приводится цитата, сравнивающая «социалистический» и «капиталистический» азот. Действительно, в соответствующей словарной статье такое противопоставление есть, но, справедливости ради, её авторы не придумали это сравнение сами, а процитировали лозунг, появившийся лет за двадцать до издания энциклопедии.
Полностью этот энциклопедический пассаж, конечно, не лишен идеологизированности, но звучит немного более мягко: «Царская Россия азотной промышленности совершенно не имела. Азотная промышленность в Советском Союзе была создана в годы первых сталинских пятилеток; к ней в полной мере относятся слова И. В. Сталина, сказанные в 1933: «У нас не было серьезной и современной химической промышленности. У нас она есть теперь» (Сталин, Вопросы ленинизма, 11 изд., стр. 373). … В противоположность капиталистическим странам, где азотная промышленность работает в первую очередь для нужд войны, в СССР азотная промышленность имеет своей целью удовлетворить возрастающий спрос социалистического сельского хозяйства на азотные удобрения. «Азот в сложении с капитализмом — это война, разрушение, смерть. Азот в сложении с социализмом — это высокий урожай, высокая производительность труда, высокий материальный и культурный уровень трудящихся» (из передовой газ. «Правда», 1932, 25 апреля, № 115) ". В действительности же, азот как двуликий Янус — независимо от формы государства и его строя, соединения азота готовы нести жизнь, удобряя поля, и сеять смерть, входя в состав взрывчатых веществ.
Несмотря на то, что воздух вокруг нас примерно на 80 % состоит из азота, и открывать азот человечеству пришлось долго — до азота алхимики и химики не только узнали о всех его «соседях» по Периодической системе — фосфоре, мышьяке, сурьме и висмуте, но и начали активно использовать их соединения. С другой стороны, все элементы из группы азота, кроме самого азота, твердые, а то, что твердые вещества, «земли» не были единым элементам, стало известно уже даже во времена алхимии. А вот осознания того, что воздух не является единым элементом пришлось подождать до эпохи «пневматической химии» — этапа развития химии, на котором был определен и состав воздуха, и получены, и изучены другие газы.
У истоков открытия азота стоял Генри Кавендиш, который изучал «связанный» или «мефитический воздух», впервые полученный шотландским химиком Джозефом Блэком в 1750-х годах — углекислый газ. «Связанным» его называли благодаря получению — обработке кислотой некоторых минералов, например, известняка, из которого он высвобождался. «Мефитическим», то есть ядовитым воздухом углекислый газ был назван по той причине, что он не поддерживал дыхание лабораторных животных, быстро убивая их. После ряда экспериментов Кавендиш посчитал, что получил другую форму ядовитого воздуха — он обнаружил, что газ, остающийся после горения свечи в закрытом объёме тоже смертелен для животных (ни азот, ни появившийся в результате горения углекислый газ дыхание не поддерживают). Однако после серии экспериментов Кавендиш понял, что его «мефитический воздух» — смесь. При пропускании газовой смеси, получившейся в ходе экспериментов Кавендиша, через раствор щелочи или негашёную известь часть газа поглощалась, причем из твердых продуктов реакции действием кислоты можно было выделить тот же «мефитический воздух», который описывал Блэк (об этом можно было судить по плотности газа). Часть же газа щелочью не поглощалась, образуя весьма инертный и не поддерживающий дыхание «воздух», плотность которого была чуть-чуть меньше, чем атмосферного воздуха — это и был азот (молекулярная масса азота N2 равна 28, молекулярная масса атмосферного воздуха равна 29). Кавендиш не опубликовал свои результаты, а сообщил о них в письме коллеге Джозефу Пристли, одному из первооткрывателей кислорода. В конечном итоге, первооткрывателем азота можно считать шотландского химика Даниэля Резерфорда (дяди Сэра Вальтера Скотта, автора рыцарских и исторических романов). В 1772 году Резерфорд защитил магистерскую диссертацию «О связанном или мефитическом воздухе», в которой расписал основные свойства азота (инертное вещество, не реагирует со щелочами, не поддерживает горения, непригоден для дыхания).
Название «азот», происходящее от древнегреческого «безжизненный» этому элементу в 1787 году дал, занимавшийся в то время упорядочением химической номенклатуры Антуан Лавуазье, опираясь все на те же свойства, что, азот, дескать, воздух испорченный, дыхание не поддерживающий и быстро убивающий любого, кто его вдохнёт. Спустя некоторое время оказалось, что такие свойства можно приписать любому газу, кроме разве что кислорода, длительное вдыхание которого, впрочем, тоже не безопасно для организма. Ну а вскоре после того, как стало ясно, что азот не такой уж и «безжизненный» и входит в состав молекул жизни — белков, нуклеиновых кислот, номенклатурное латинское название азота и название азота на ряде языков сменилось на «nitrogenium» — «рождающий селитры». В основу этого названия легли наблюдения всё того же Генри Кавендиша, описавшего, что, если подействовать на воздух электрическим разрядом, а потом пропустить его через раствор щелочи, получаются селитры (nitre). В итоге азот остался одним из немногих элементов, название которого в разных языках строится по разным принципам. В русском, французском, итальянском и турецком языках азот остался азотом, в английском и испанском название строится как производное от официального латинского nitrogenium, по-немецки этот элемент называется Stickstoff (удушающее вещество), что-то похожее есть и в некоторых славянских языках (например, хорватское dušik).
Приручить азот, точнее использовать в качестве сырья для производства азотсодержащий удобрений и азотной кислоты, удалось только в XX веке. «На бумаге» задача решалось легко — заставляем азот воздуха реагировать с кислородом воздуха же, получаем оксиды азота, которые превращаем в кислоту или нитраты, но на практике ходить приходилось по огромным и крутым «оврагам» — заставить азот реагировать с кислородом удавалось только в лаборатории и только при температуре не менее 3000 °C, что, естественно не могло стать основой для промышленного производства. Причина столь большой инертности азота в чрезвычайно прочной тройной связи между атомами в двухатомной молекуле N2 (до сих пор в лабораторной практике для создания инертной атмосферы можно использовать не только инертный газ аргон, но и азот).
В начале 1900-х годов химические технологи первоначально пошли путём Кавендиша и заменили нагрев электрическим разрядом. В 1903 году норвежские ученые Кристиан Олаф Бернхард Биркеланд и Самуэль Эйде сконструировали в электрическую печь для промышленного получения азотной кислоты и нитрата кальция (который с тех пор стал называться «норвежской селитрой») из воздуха. Метод, получивший название «Метода Биркеланда-Эйде» требует больших затрат и может применяться только при условии наличия дешёвой электроэнергии (например, приливной, геотермальной и т. д.) и в настоящее время практически не имеет промышленного значения.
Разработать же применяющийся сейчас способ связывания атмосферного азота удалось немецким ученым Фрицу Габеру и Карлу Бошу, которые вместо того, чтобы и дальше штурмовать идущую с поглощением реакцию горения азота в кислороде, нашли обходный манёвр. Этим маневром стала протекающая с выделением теплоты равновесная реакция азота с водородом, приводящая к образованию аммиака, который затем и сжигают с образованием оксидов азота. Процесс связывания азота по Габеру-Бошу дешевле, чем метод Биркеланда-Эйде, но и в этом случае расходы энергии колоссальны — на связывание азота в аммиак ежегодно тратится около 1 % всей энергии, вырабатываемой человечеством. Большей частью все эти кило- и мегаватты тратятся на сжатие и нагрев азото-водородной смеси, необходимых для того, чтобы направить равновесие туда, куда надо. В 1918 году Фриц Габер получил Нобелевскую премию по химии, что тут же вызвало негодование многих учёных, особенно являющихся гражданами стран, воевавших с Германией во время Великой войны. Причина этого в том, что Габер не только создал условия для ведения современного сельского хозяйства с химическими удобрениями, но стал автором концепции химической войны — первая газобалонная атака кайзеровской армии на франко-бельгийские позиции 22 апреля 1915 году проходила под непосредственным руководством будущего Нобелевского лауреата.
Полученный по методу Габера аммиак может стать аммиачной селитрой, которую можно применять и как удобрение, и как материал для бомб-самоделок — связывание азота действительно может использоваться двояко. А вот процесс, в результате которого молекулярный азот выделяется, используется для спасения жизней. В системе, управляющей подушками безопасности в автомобиле имеются емкости с азидом натрия (NaN3 — восстановитель) с нитратом калия (KNO3 — окислитель). При аварии эти вещества смешиваются и вступают в химическую реакцию, в результате которой образуется большой объем азота, надувающего подушку безопасности, тем самым сохраняя жизнь и здоровье тем, кто находится в автомобиле.
8. Кислород
Первая революция на нашей планете началась очень давно, а её плодами мы пользуемся до сих пор, точнее — она создала нас с вами.
На рубеже архея и протерозоя 2.2–2.6 миллиардов лет назад произошло глобальное изменение состава атмосферы Земли, которое называют «Великим кислородным событием» или «Кислородной революцией». 2.8 миллиардов лет назад появились цианобактерии, которые освоили новый способ преобразования солнечной энергии в химическую — активируемая солнечным светом комбинация углекислого газа и воды, побочным продуктом которой был кислород (фотосинтез, то есть превращение солнечной энергии в химическую, существовал и ранее, но в фотосинтетических процессах, свойственных более эволюционно древним организмам, кислород не выделялся). Выделяющийся при фотосинтезе цианобактерий кислород, токсичный для многих организмов той эпохи, стал менять ландшафт нашей планеты — окислять восстанавливающие компоненты атмосферы и земной коры. В какой-то момент содержание кислорода в атмосфере резко возросло, газовая оболочка Земли превратилась из восстанавливающей в окисляющую, простейшие организмы, для которых кислород был ядом, вымерли или оказались в бескислородных «резервациях» биосферы — анаэробных карманах. Существование больших количеств молекулярного кислорода в атмосфере Земли привело к образованию озонового слоя, позволившего живым организмам расширить области своего обитания существенно расширившего границы биосферы, и привело к распространению дающего большее количества энергии кислородного дыхания. Началась эра кислорододышащих или аэробных форм жизни, эволюция которых, привела к появлению в том числе и человека.
Сейчас наша атмосфера содержит около 21 % кислорода (по объёму) или 23 % (по массе), но кислород не только в воздухе, которым мы дышим. Если говорить о кислороде как о химическом элементе, а не о молекуле О2, он третий по распространённости элемент во Вселенной (после водорода и гелия) — он является основным продуктом термоядерного синтеза в массивных звёздах-гигантах. В земной коре кислород — самый распространённый элемент, земные скальные породы содержит до 46 % по массе, главным образом, в форме диоксида кремния. Большая часть металлов, которые мы добываем, содержится в земной коре в форме оксидов — бокситные руды алюминия, железняки и т. д. Одно из самых важных соединений кислорода — вода, колыбель жизни, любая биологически активная молекула в нашем организме — белки, нуклеиновые кислоты, сахара и жиры содержат кислород.
Благодаря кислороду работают не только живые системы. Кислород (и воздух его содержащий) — самые распространённый и доступный окислитель в химической промышленности. Его применяют для окисления углеводородов в спирты, альдегиды и органические кислоты. В металлургии кислород применяется для обжига сульфидных руд и для удаления углерода из чугуна и переплавки чугуна в сталь. Кислород-ацетиленовая горелка может достигать температуры до 2000 °C и применяться как для резки, так и для сварки металлов. Использовавший в качестве топлива водород, а качестве окислителя кислород жидкостный ракетный двигатель РД-0120 применялся в качестве двигателя второй ступени ракеты-носителя «Энергия», доставившей на орбиту советский космический корабль многоразового использования «Буран».
С пальмой первенства за открытие кислорода вопрос не менее запутанный, чем с первооткрывателем азота. Название «кислород — oxygenium» этому элементу дал позволивший химии перейти на новый уровень Антуан Лоран Лавуазье, который, собственно и ввёл уже близкое для нас, но не окончательное понятие «химический элемент» для обозначения веществ, которые нельзя было разрушить с помощью каких-либо методов химического анализа (сейчас такие вещества называют «простыми»). До Лавуазье и появления понятия «элемент» образование кислорода наблюдали и описывали Джозеф Пристли — при разложении оксида ртути, и Карл Шееле — при разложении селитры. И Пристли, и Шееле считали, что они получили «дефлогистированный воздух» — воздух, лишённый некоей первичной материи, наполняющей все горючие вещества и выделяющейся при горении. Лавуазье, конечно, известен нам тем, что отказался от флогистонной теории и разработал современную теорию горения и кислорода как газа, необходимого для горения, однако эти рассуждения можно считать просто другой (хотя и более строгой) интерпретацией открытий, сделанных ранее Кавендишем и Шееле.
И ещё одна форма молекулярного кислорода, важная для сохранения жизни на Земле — трикислород или озон, О3. Озон ядовит, более того токсичность озона выше токсичности хлора, и его вдыхание (а образуется он в результате горения автомобильного топлива или при длительной работе лазерных принтеров и множительной техники), может приводить к болезням органов дыхания. Но озон, опасный для нас в тропосфере, нижней области атмосферы, защищает нас и все живое, располагаясь в стратосфере от ультрафиолетового излучения. В последнее время многие технологии, в которых используется хлор (отбелка бумаги, дезинфекция водопроводной воды) заменяются на озоновые технологии. Да, сам по себе хлор менее опасен, чем озон, но при его применении образуются опасные и зачастую канцерогенные хлорсодержащие органические и неорганические вещества, а «химический след» озона менее опасен — это, как правило, перекись водорода, быстро разрушающаяся до воды и кислорода О2 или кислородсодержащих органических соединений, которые хотя и тоже нельзя назвать полностью безопасными, но все же представляют не такую прямую и явную угрозу, как обладающая канцерогенностью хлорорганика.
9. Фтор
Одними из первых с соединениями фтора познакомились металлурги Европы. Уже в 15–16 веках сначала алхимики, а потом и отец минералогии Георг Бауэр, более известный как Георгий Агрикола, описали свойства минерала, способного снижать температуру плавления руды и шлака. Они называли этот минерал «флюор» или «флюорит» (от латинского fluere — течь).
В России этот минерал, основной компонент которого фторид кальция (CaF2), стал известен под названием «плавиковый шпат». Интерес к этому веществу был вполне обоснован — технология извлечения металлов из руд и получения стекла развивалась, но печи, применявшиеся в химической промышленности того времени, не могли давать температуру, достаточную для плавления многих материалов, которые хотелось использовать в качестве сырья. Естественно, можно себе представить, какое значение для металлургов того времени имел минерал, ускоряющий процесс выплавки металлов и делающий металлургический шлак более текучим (текучесть шлака нужна была для эффективности отделения металлов от отходов производства). В 1670 году флюорит раскрыл себя с новой, неожиданной стороны — художник из Нюрнберга Ганс Шванхард обнаружил, что смесь флюорита и серной кислоты, нанесённая на стекло, позволяет матировать стекло и наносить на его поверхность рисунки. В 1725 году рецептура для травления стекла изменилась — твердый флюорит и серную кислоту заменили на жидкость, образующуюся в результате реакции CaF2 с концентрированной азотной кислотой. Так, вероятно, был впервые получен грязный раствор плавиковой кислоты. Чистую плавиковую кислоту (раствор, в котором содержалась только вода и HF) в 1768 году получил Андреас Сигизмунд Маргграф — один из последних ярких химиков, придерживавшихся флогистонной теории горения, а чистый фтороводород тридцать лет спустя смогли выделить Жозеф-Луи Гей-Люссак и Луи Тенар.
С момента открытия (а может и до открытия) плавиковая кислота разъедала не только стекло, но и здоровье, и жизни людей. Вот далеко не первая и увы не последняя жертва плавиковой кислоты — во время обработки окаменелостей 37-летний палеонтолог пролил себе на колени около сотни миллилитров плавиковой кислоты. Тут же он принял все меры предосторожности — промыл ноги водой из раковины в лаборатории и, ожидая приезда скорой помощи даже погрузился в институтский бассейн, чтобы увеличить эффективность промывания. Однако, через неделю после инцидента ему ампутировали ногу, а еще через неделю он скончался в больнице.
Чем же объясняется такая токсичность плавиковой кислоты при попадании на кожу? В отличие от своих других галогеноводородных кислот — соляной и бромоводородной (водные растворы HCl и HBr соответственно), плавиковую кислоту можно отнести к слабым кислотам — в водном растворе она распадается на ионы крайне неохотно. Слабая диссоциация на ионы и крайне небольшой размер молекулы HF позволяет ей легко проникать через кожу и быстро мигрировать вглубь организма, где, наконец, и происходит её диссоциация с образованием фторид-иона. Фторид-ион F— прочно связываются с катионами кальция и магния, превращая их в нерастворимые в воде соли, которые отлагаются в окружающих биологических тканях. Ионы кальция и магния — кофакторы многих ферментов (низкомолекулярные вещества, способствующие правильной работе белков-катализаторов). Без кофакторов ферменты, критически важные для обмена веществ, прекращают работать, клетки начинают умирать, вышечная ткань разжижаться, а костная — разрушаться. Быстрая потеря организмом ионов кальция может привести к тому, что сердечная мышца прекращает свою работу. Смертельно опасным может оказаться ожог концентрированной плавиковой кислотой, поражающий всего 2.5 % поверхности тела.
Токсичность и опасность плавиковой кислоты унесли жизни немалого числа химиков девятнадцатого века, среди которых были пытавшиеся выделить элементарный фтор бельгиец Полен Луйе и француз Жером Никле. В конечном итоге в 1886 году F2 удалось получить Анри Муассану, использовавшему платиновый реактор для электролиза сжиженной при низких температурах HF (судьбе Анри Муассана в «Жизни замечательных устройств» я посвятил отдельную главу). В промышленных масштабах фтор до сих пор получают с помощью метода Муассана.
Иронично, что, хотя элементный фтор и фтороводород смертельно опасны для человека, атомы фтора входят в состав 20 % фармацевтических препаратов, выведенных на рынок к настоящему времени. И антидепрессант прозак®, и понижающий уровень холестерина препарат липитор, и антибактериальное средство ципрофлоксацин своим успехам обязаны именно фтору и, если и демонстрируют какие-либо побочные эффекты, то явно не те, которые связаны с фторидными отравлениями. Реакционная способность фтора помимо прочего объясняется тем, что он образует очень прочные химические связи с другими элементами, в первую очередь — с углеродом. Благодаря этим прочным связям фторорганические соединения являются одними из самых устойчивых и инертных. Фактор фторирования, известный фармацевтам, позволяет изменить химические свойства всей молекулы. Так, введение фтора в фармакологически активную молекулу позволяет защитить её от разрушения ферментами, увеличив тем самым время, в течение которого такое вещество будет находиться в организме, не разрушаясь, а это в свою очередь, может снизить дозировку препарата. Другой эффект от введения фтора — форма молекулы-лекарства может быть слегка изменена, чтобы обеспечить ей более прочное связывание со своей мишенью — белком или нуклеиновой кислотой. Для этих манипуляций не нужен молекулярный фтор или плавиковая кислота, поэтому их можно осуществить в обычной химической лаборатории, снабжённой стандартными мерами безопасности.
Многие из нас могут поблагодарить фтор за белоснежную улыбку — в состав зубных паст, предотвращающих развитие кариеса, входят фторид натрия и фторфосфат натрия. Фторид-ион не столько сокращает содержание в ротовой полости вырабатываемых микроорганизмами кислот, разрушающих эмаль (нейтрализовать эту кислоту мог бы и обычный карбамид-мочевина), сколько участвует в процессе восстановления зубов, образуя фторапатиты (фторфосфаты кальция), более устойчивые к действию кислот, чем образующие зубную эмаль апатиты (фосфаты кальция). Впрочем, лекарствами и зубными пастами роль фтора в заботе о нашем здоровье не оканчивается — фторированные анестетики изофлуран и десфлуран заменили огнеопасный эфирный наркоз; фторированные углеводороды рассматриваются как материалы для получения «искусственной крови» — кислород растворяется во фторуглеводородах гораздо лучше, чем в любых других безопасных для организма жидкостях. Радиоактивный же нуклид фтора 18F применяется в позитрон-эмиссионной томографии, позволяющей, например, обнаружить злокачественные образования на ранних стадиях.
Фторсодержащими соединениями занимается не только тонкий органический синтез, отвечающий за получение новых лекарств, но и крупнотоннажная химия. Самый известный представитель этой крупнотоннажной химии — фторсодержащий полимер тефлон, не дающий продуктам пригореть на сковородке и защищающий спирали электрического чайника от накипи (истории и свойствам тефлона посвящена отдельная глава в «Жизни замечательных веществ). Нагрев и растяжение позволяет получить из тефлона материал Gore-Tex, применяющийся для изготовления мембранной одежды для занятий спортом и активного отдыха.
Долгое время фтор считали «диким зверем химии». И, хотя «тёмная сторона фтора» никуда не делась, мы вполне обоснованно можем сказать, что приручили его. Более того, известно очень немного фторсодержащих органических веществ природного происхождения, так что мы точно можем заявлять, что нашли этому элементу лучшее применение, даже чем сама Природа.
10. Неон
Название этого элемента давно стало именем нарицательным, обозначающим способность просто светиться: «Неоновые огни реклам», «У мене внутре… гм… не… неонка», «Это бит вечерних авто, это бит ночного метро, это бит неоновых фонарей». Список можно продолжать. Боле ста лет назад, в 1910 году была сконструирована первая газоразрядная лампа, заполненная неоном, и вскоре огни различных ламп, работающих по одинаковому принципу и объединенные общим названием «неоновые» проникли в язык и культуру.
Будем откровенны — во многих «неоновых лампах» неона вообще нет. Неоном заполнена только газоразрядная лампа, дающая красный цвет. Остальные 150 цветов, которыми могут светить «неоновые» лампы получают, заполняя их аргоном или ксеноном, парами ртути и люминофором в различных соотношениях и при разном давлении. Но именно то красное свечение и объявило миру об открытии нового элемента.
Первым инертным газом, который был открыт на Земле, был аргон — он был выделен в 1894 году, в 1895 был получен первый «земной» образец гелия, и оказалось, что «солнечный металл» — совсем не металл (см. главу 2). В какой-то момент Сэр Уильям Рамзай осознал, что, если взглянуть на его находки через призму Периодического закона коллеги Менделеева, получается, что он нашел первый и третий химический элементы новой группы. Чтобы доказать обнаружение нового класса химических элементов, попутно подтвердив всесильность и верность Периодического закона Рамзаю нужно было заполнить пустоту между гелием и аргоном.
В 1898 году Рамзай с Моррисом Траверсом поставили удачный эксперимент — они позволили твёрдому аргону, окружённому сжиженным воздухом, медленно испаряться при пониженном давлении, отбирая фракцию, первой переходящую в газообразное состояние. Отобранную фракцию поместили в атомный спектрометр, и, как записал в дневнике Траверс: «… малиновое свечение в трубке рассказывало свою собственную историю, оно было зрелищем, от которого было сложно оторваться…».
Популярный русскоязычный анекдот говорит, что Рамзай тут же телефонировал своему коллеге, лорду Рэлею, и между ними произошёл следующий диалог:
— А мы тут с Траверсом новый инертный газ открыли…
— Опять аргон, наверное?
— Нет, не он!
Естественно, такого не было, но реальная история получения элементом № 10 имени не менее анекдотично. Тринадцатилетний сын Рамзая предложил назвать новый газ «новумом» (от латинского — новый). Рамзай-папа одобрил идею Рамзая-сына, но решил, что греческое слово «неон» будет благозвучнее. Так, новый элемент занял свое временное положение в Периодической системе (первоначально инертные газы, как элементы, проявляющие «нулевую» валентность, были поставлены в нулевую группу таблицы Менделеева), а Рамзай в 1904 году получил Нобелевскую премию по химии.
Первоначально неон и другие инертные газы казались «неведомыми зверушками» Периодической системы — их инертность не давала возможности учёным представить, где же их можно применять. Потребовалось воображение французского химика, инженера и изобретателя Жоржа Клода, который первым догадался посмотреть, что произойдет, если пропускать электрический разряд через неон, находящийся в запаянной стеклянной трубке. Появлявшееся при пропускании тока красное свечение натолкнуло Клода на мысль создать источник света, альтернативный лампам накаливания. Он изготовил несколько таких лама (сейчас мы называем их газоразрядными) и впервые продемонстрировал их на Технической выставке в Париже 11 декабря 1910 года. Демонстрация поразила зрителей, но ни один из них не приобрел ни одной лампы — освещать свои дома красным светом люди не были готовы. Однако неудача с быстрой коммерциализацией новых ламп не обескуражила Клода — в 1915 году он запатентовал изобретение, а позже, пытаясь все же заработать на нём, понял, что с помощью стеклодува можно превратить трубки в буквы, которые будут светиться. Это предопределило применение неона — в 1923 году была организована компания Клод Неон, начавшая продажи неоновой рекламы в Соединённых штатах Первоначально неоновые лампы называли «жидкими огнями», а изготовленные из них вывески горели круглосуточно, завлекая любопытствующих прохожих. Неон получали фракционным сжижением воздуха, и нескольких тонн, ежегодно добываемых в 1920-е годы вполне хватало на нужды рекламы.
Неон не только заставил рекламу светить, он помог раскрыть секреты самого важного из источников света для нашей планеты — Солнца. В солнечном ветре (частицах, вырывающихся из Солнца и разлетающихся по Вселенной) содержится два изотопа неона — неон-20 и неон-22. Эти же изотопы находятся в лунных скальных породах, что, впрочем, неудивительно — миллиарды лет солнечный ветер «обдувал» наш естественный спутник, не имеющий защитной атмосферы, и частицы солнечного ветра попадали на Луну. Удивительно было другое — в глубине лунных пород соотношение 22Ne/20Ne было выше, чем у поверхности. Первоначально эти результаты интерпретировались тем, что когда-то Солнце было более активно, чем сейчас, выбрасывая частицы с большей энергией, которым удавалось «глубже зарыться» в породу. Однако изучение пробывшего в космосе два года металлического стекла — фрагмента потерпевшего в 2004 году крушение космического Genesis, заставило изменить предположение. Оказалось, что распределение изотопов неона в металлическом стекле такое же, как и в лунной породе — сверху больше легкого неона-20, в низлежащем слое — неона-22. Поскольку даже теоретически было сложно предположить существенное изменение солнечной активности за два года, не говоря уже про то, что слежение за Солнцем во время полёта Genesis говорило о том, что средняя активность нашего светила не менялась, объяснение различного изотопного содержания на разных глубинах стали объяснять явлением космической эрозии — удары микрометеоритов и других частиц просто способствуют удалению части неона с поверхности породы, так что поведение Солнца оказалось более предсказуемым. Жидкий неон также можно использовать в качестве охладителя в криогенных установках, смесь неона и гелия используют как рабочую среду в газовых лазерах, а также неоном разбавляют кислород для работающих на глубине водолазов для предотвращения ряда состояний, известных в общем случае как глубинные или кесонные болезни.
11. Натрий
Когда я был студентом, у нас была доставшаяся от предшественников традиция — в майские праздники нагружаться рюкзаками, палатками и спальниками, садится в поезд Казань-Йошкар-Ола и отправляться на 100 километров от Казани праздновать День Химика у марийской реки Юшута в месте, известном как «Большая химическая поляна».
Однажды, на рубеже восьмидесятых и девяностых годов прошлого века, когда старые запреты уходили в прошлое, а новые ещё не появлялись, к поляне, где уже разбили свой лагерь студенты, аспиранты и молодые преподаватели химфака Казанского университета, в сумерки пришвартовалось несколько байдарок, и высадившиеся из них в стиле викингов из современных сериалов бывалые туристы (тм) заявили, что это поляна их, и нам, туристам-салагам, стоит сняться с бивака и найти себе новое место. Нас было больше раза в три, уступать поляну мы не хотели, и в результате переговоров стороны решили, что «места всем хватит», и бывалые туристы уже начали разгружать свои суда. Именно тут у берега оказался наш профорг, который в момент переговоров ходил за валежником, и с криком: «Ну что, начинаем праздновать», — бросил что-то в воду. Сумерки марийской лесной реки озарились вспышками, вниз по течению поплыли ярко-жёлтые огоньки, которые не тушила вода, и в свете этих огней байдарки с туристами довольно резво поплыли вверх по течению — трюк, для исполнения которого на быстрых реках марийской тайги требуется хорошая физическая подготовка вкупе с резким выбросом адреналина. Так бывалые туристы (тм) познакомились с реакцией между натрием и водой. Дело в том, что традиционным ритуалом Дней химика в те времена было стравливание в речной воде кусочков натрия, оставшихся в лабораториях химфака после очистки растворителей и синтезов. Студенты и аспиранты начинали готовиться к этому «фейерверку» с сентября месяца, и чем выше было пламя, тем более удавшимся считался очередной День химика. От той же традиции и пошла кричалка: «Не хотите быть калекой? Киньте дальше натрий в реку».
Как это часто бывает в химии, металлический натрий опасен, если работать с ним без предосторожности, а его соединения есть на каждой кухне — ионы натрия являются важными для жизнедеятельности всех живых организмов. Высокая химическая активность натрия, в частности та самая его способность активно реагировать с водой и другими веществами приводит к тому, что в земной коре натрий встречается только в виде соединений и никогда — в свободном виде. Натрий достаточно распространён в Земной коре — он составляет 2.6 % от её массы. Наиболее распространёнными соединениями натрия в природе являются хлорид натрия (каменная или поваренная соль) и цеолиты.
Человечество давно применяет соединения натрия — во времена палеолита наши предки начали использовать каменную соль, не ставшую ещё поваренной (поваренное искусство еще не появилось), в качестве консерванта охотничьи трофеев. В Древнем Египте появляется первое письменное упоминание о производных натрия — появляется иероглиф, который читается как «натар» и обозначает смесь поваренной соли и кристаллической соды (десятиводного карбоната натрия Na2CO3×10H2O). В Египте натар применялся как мыло, а также был обязательной частью составов для бальзамирования и мумификации — натар хорошо поглощает воду, а его щелочная среда позволяла истреблять бактерии. Нетрудно заметить, что международное латинское название натрия, равно как и современное его название в русском и ряде других языков восходит к древнеегипетскому термину. Английское название натрия — sodium, тоже имеет восточные корни, но уже арабские. В средневековой Европе карбонат натрия использовали для врачевания головной боли, это снадобье называлось «соданум», а этот термин, в свою очередь, происходил от арабского «суда» — головная боль. В нашем языке арабский корень остался в названиях различных форм карбонатов натрия — сод и даже натриевой щёлочи — каустической соды, хотя, конечно, в наши дни последнее название безнадёжно устарело. Именно при пропускании постоянного электрического тока через расплавленную каустическую соду сэр Хэмфри Дэви впервые выделил металлический натрий — расплавленной натриевой щёлочи (NaOH). Процесс разрушения веществ с помощью электрического тока получил название «электролиз», и Дэви с его помощью смог получить также и другие активные металлы — калий, кальций, магний и барий.
Металлический натрий, как и большинство металлов, серебристо-белый, его легко можно разрезать ножом или столь популярным в наших лабораториях скальпелем. Однако блестящим и серебристым натрий остается недолго — он быстро окисляется на воздухе и загорается при контакте с водой, ну а выделяющийся при этом водород, взрываясь, добавляет зрелищу красочности и звуковых эффектов. Способность натрия реагировать с водой применяется в лабораториях для очистки от воды некоторых органических растворителей, просто кипятя растворитель над кусочками натрия (главное, чтобы сам органический растворитель не реагировал с натрием, и воды в нём было не так уже много). Если мы очищаем от воды, например, бензол нам приходится нарезать кусочек натрия на тонкие-тонкие пластинки, а если толуол, такой необходимости нет. В чем причина? Металлический натрий «ловит» воду только поверхностью, а его шинковка увеличивает площадь поверхности, следовательно, увеличивая эффективность реакции. Однако, натрий очень легкоплавкий, его температура плавления равна +98 °C, то есть в растворителях с более высокой температурой кипения (у толуола температура кипения +110.6 °C) кусочки натрия все равно расплавятся и сольются в почти идеально шарообразную каплю натрия, рабочая поверхность которой постоянно будет очищаться. Как и другие свои родственники — щелочные металлы, натрий и его соединения можно определить по цвету пламени — при внесении соли натрия в бесцветное пламя газовой горелки пламя окрашивается в интенсивный жёлто-оранжевый цвет — в интернете можно найти немало красочных роликов-демонстраций на эту тему.
Натрий и его соединения применяются в столь разнообразных областях, что вряд ли можно перечислить их все даже в отдельной книге. Из наиболее интересных можно привести в пример применение натрия для охлаждения ядерных реакторов — он достаточно легко плавится, как и все металлы отличается хорошей теплопроводностью и, если вода закипает через два градуса после того, как натрий переходит в жидкое состояние, натрий начинает кипеть при температуре 883 °C, оставаясь жидким теплоносителем в широком интервале температур. Наш домашний реактор-лаборатория тоже не обходится без натрия — при готовке мы применяем пищевую соду или гидрокарбонат натрия. Очень часто мы используем это вещество для бездрожжевой выпечки — при 70 °C пищевая сода разлагается с выделением углекислого газа, который и заставляет бездрожжевое тесто подниматься.
Ион натрия важен для организма — совместно с калием натрий создает условия для мышечных сокращений, нормализует водный баланс организма и активирует некоторые ферменты. В среднем человеку необходимо не более двух граммов натрия в день, который он, в основном потребляет с поваренной солью. Если посчитать, за год нормальной дозой поваренной соли для человека будет 1.85 килограмм, то есть, чтобы съесть пресловутый пуд соли на двоих нужно потратить 4–5 лет (именно поэтому, вероятно и появляется кризис пятилетки отношений — за пять лет партнёры узнают друг друга во всех подробностях, что не всегда вяжется с их ожиданиями).
12. Магний
Лето 1618 года выдалось очень засушливым для Европы — и люди, и животные были готовы удалить жажду из любого мутного ручейка, в который превратились многие полноводные реки. Однако, в разгар засухи фермер из английского графства Суррей Генри Викер заметил водоём, заполненный прозрачной и чистой водой, из которого, отказывались пить даже очень страдающие от жажды овцы.
Викер обнаружил, что вода из водоёма горька на вкус, а при её испарении образуется белая соль, обладающая слабительным действием. Так была обнаружена горькая, она же эпсомская, она же английская соль (сульфат магния, MgSO4), которая три с половиной века применялась для лечения запоров.
О том, что магний является элементом, первым в 1755 году предположил шотландский химик Джозеф Блек. Загрязнённый большим количеством примесей металлический магний, нагревая смесь древесного угля и порошка магнезии (оксида магния MgO) впервые выделил в 1792 австриец Антон Руппрехт. Руппрехт назвал элемент «аустурием» в честь Австрии. Название «магний» дал элементу Хэмфри Дэви, в 1808 году получивший образец этого элемента в чистом виде. В качестве исходного вещества для своего эксперимента Дэви взял минерал магнезит (MgCO3), названный в свою очередь в честь греческого города Магнесия, в окрестностях которого его издревле добывали.
Магний играет ключевую роль для всех аэробных организмов на Земле — он находится в активном центре хлорофиллов, позволяющих растениям запасать солнечную энергию в химическую, превращая молекулы углекислого газа и воды в глюкозу, которая затем превращается в целлюлозу или крахмал, равно как и многих других критически важных для обмена веществ молекул. С пищей человек в среднем потребляет 300–400 миллиграмм магния в сутки, что обычно покрывает суточную потребность организма в этом элементе. Дефицит магния может приводить к развитию таких состояний, как бессонница, хроническая усталость, остеопороз, артрит мышечные спазмы, аритмия или запоры. Незначительный недостаток магния в организме можно пополнить, поедая миндаль, кешью, сою, мозги или шоколад — все они богаты магнием. Магния много в некоторых марках британского пива, вероятно из-за того, что при его варке применяют воду с высоким содержанием сульфата магния (остается надеяться, что слабительный эффект от такого пива проявляется позже освежающего).
Магний седьмой по распространенности элемент в земной коре и третий — в расплавленной мантии Земли, состоящей преимущественно из силикатов магния — оливина и пироксена. Магния много в морской и океанской воде, так что фотографам конца XIX — начала XX века было из чего добывать магний, чтобы размалывать его в порошок и применять в первых фотовспышках. В наши дни металлический магний получают электролизом расплава его хлорида.
Магний горит, выделяя огромное количество тепла, и, если он загорается, потушить его практически невозможно — горение магния поддерживает не только кислород и азот атмосферы, но и самое распространённое средство пожаротушения — вода. Во время второй мировой войны американские оружейники разработали зажигательную авиационную бомбу М69, большая часть от 2.7 килограмм которой приходилась на магний. При активации боеприпаса загоралась термитная смесь (смесь порошков оксида железа и металлического алюминия), термит поджигал магний, который содержался как внутри корпуса бомбы, так и представлял большую часть её корпуса, ну а горящий магний поджигал на поверхности земли все, что могло гореть, попутно понижая содержание кислорода. Как свидетельствуют отчеты американских ВВС, особенно эффективными такие зажигательные боеприпасы оказались при бомбежках Японии, в городах которой было очень мало каменных строений.
В земной коре содержится немало минералов, в состав которых входит магний, но наиболее распространённые — уже упоминавшийся магнезит и доломит (карбонат кальция-магния, CaMg(CO3)2), добыча которых составляет десятки миллионов тонн ежегодно. Чаще всего из обоих руд выделяют магнезию (оксид магния), которая затем применяется как пищевая добавка для скота, средство для понижения кислотности почвы, армирующий агент для получения полимерных композитных материалов и для изготовления огнеупорного кирпича.
13. Алюминий
Давным-давно, в эпоху исторического материализма, когда на литературе проходили роман Н. Г. Чернышевского «Что делать?», учителя пытались объяснить нам, что «Четвертый сон Веры Павловны» — гениальное пророчество, и автору романа, или его лирической героине с приснившимися зданиями из алюминия удалось увидеть не только самый настоящий развитой социализм, но и предсказать появление архитектурного стиля индустриального конструктивизма.
Сейчас я склонен думать, что это не так, и через Веру Павловну Николай Гаврилович описал примерно такой же утопический Город Солнца, как и Кампанелла, только с молочными реками, кисельными берегами и невиданной роскошью — во времена Чернышевского стоимость алюминия не меньше, чем у серебра, и не только в России. Лондонское химическое общество, желая произвести впечатление дороговизной подарка, в 1889 году подарило Дмитрию Ивановичу Менделееву весы из золота и алюминия. Сомнительно, что Чернышевский мог предвидеть то, что придёт время и, благодаря химикам, алюминий станет самым дешёвым металлом на Земле.
Алюминий — третий по распространённости после кислорода и кремния элемент в Земной коре и самый распространённый металл. Несмотря на то, что алюминий можно найти в огромном количестве минералов и в глиняной почве, до 1808 года об этом металле никто не знал. Первооткрывателем алюминия и учёным, давшим ему имя, был тот же самый Хэмфри Дэви, давший название магнию (судя по всему, 1808 год у Дэви складывался весьма удачно). Учёный назвал алюминий в честь сырья, из которого выделил — квасцов (по латыни — alum), с античности применявшихся для закрепления окраски на тканях, правда Дэви удалось выделить грязный образец металла.
Первый образец чистого алюминия (легкого серебра) был получен в 1825 году датчанином Гансом Кристианом Эрстедом. Сложности извлечения алюминия из его оксидов позволяли получать лишь килограммовые количества алюминия, из-за чего какое-то время алюминий относили к драгоценным металлам. Цилиндр из алюминия выставлялся с королевскими регалиями на парижской выставке 1855 года, у Наполеона III был столовый набор, который подавали только самым почётным гостям.
Всё изменилось в 1886 году, когда Чарльз Мартин Холл, двадцатидвухлетний учёный любитель из Америки, разработал способ получения алюминия, который позже оказалось возможным масштабировать до целой отрасли металлургии. Для развития этого стартапа ему даже не пришлось прибегать к краудфайндингу, нанимать персонал и арендовать помещения — хватило старшей сестры в качестве ассистента и собственного сарая-мастерской. Холл растворил оксид алюминия (компонент белой глины или каолина) в расплавленном гексафтиоралюминате калия (более известном, как криолит) и пропустил через расплав постоянный ток большой силы. Удивительно, но в то же самое время другой двадцатидвухлетний изобретатель — француз Поль Луи Эру, ничего не зная о Холле и его работах, изобрел точно такой же способ, заставив патентные конторы Америки и Европы определять, чей способ получения считать приоритетным. В любом случае, химия проще и, наверное, честнее некоторых законов об интеллектуальной собственности. Разработанный независимо друг от друга молодыми людьми метод получения алюминия сейчас называется методом Холла-Эру, и до сих пор применяется для ежегодного получения миллионов тонн алюминия.
Перестав быть благородным металлом, алюминий быстро нашёл себе работу. К началу 1900-х годов провода из алюминия практически полностью вытеснили медные провода из электростанций и линий передачи электроэнергии. Гибкость, лёгкость и дешевизна алюминия компенсировали его меньшую по сравнению с медью электропроводность. Потом настала пора алюминиевых сплавов, со временем заменивших дерево и перкаль при строительстве летательных аппаратов тяжелее воздуха. Из лёгких магний-алюминиевых сплавов делают автомобильные детали, рамы для велосипедов (рама, основным компонентом которой являются магний и алюминий с примесями цинка и других легирующих добавок такая же прочная, как рама из стали, но весит раза в три меньше).
Пищевая промышленность и связанные с ней отрасли тоже не обошли стороной самый распространённый металл на Земле. Тонкая фольга из алюминия стала популярным упаковочным материалом, он стал применяться в изготовлении посуды, консервных банок. Процесс нанесения фторсодержащего полимера — тефлона, на алюминий привел к созданию компании, утварь и техника которой всегда думает о нас.
Однако в металлическом блеске алюминия есть и свои темные стороны. Несмотря на распространённость алюминия на Земле, эволюция так и не разработала ни одного биохимического процесса, в котором алюминий мог бы приносить клеткам или внеклеточным формам жизни хоть какую-то пользу. Более того растворимая форма алюминия — соли, содержащие катион Al+3 токсичны для растительных клеток. В кислых почвах высвобождение Al3+ из минералов ускоряется, урожайность культур, растущих на таких почвах падает, а к кислым относится чуть ли не половина всех возделываемых земель. Обмену веществ людей алюминий тоже не нужен, но он регулярно попадает к нам в организм с воздухом, которым мы дышим, едой и питьём. Следовые количества алюминия всегда присутствовали в нашем рационе даже у наших далеких предков, предпочитавших питаться, сидя на ветвях дерева, однако сейчас мы преднамеренно увеличиваем его содержание в нашей пище — некоторые пищевые добавки содержат алюминий. Незначительное количество алюминия может попадать в наш организм через кожу, когда мы пользуемся содержащими оксид алюминия антиперспирантами, но все эти источники не могу поднять содержание алюминия в нашем организме до опасного уровня. Иронично, но самые ударные дозы алюминия мы получаем с лекарствами — антацидами, цель которых снизить кислотность желудка. Существуют исследования, в которых говорится о связи алюминия и болезни Альцгеймера, но является алюминий фактором формирования ответственных за это заболевание амилоидных бляшек или наоборот, сами бляшки интенсивно копят алюминий — неясно. В любом случае, чтобы не насыщать свой организм алюминием сверх меры стоит перекладывать не съеденное сразу содержимое консервных банок в контейнеры из других материалов (ионы алюминия начнут попадать в пищу, только тогда, когда начнет контактировать с воздухом, то есть только после вскрытия банки) и наоборот — не следует готовить кислую пищу в алюминиевой посуде.
14. Кремний
Классе в седьмом в какой-то библиотечке фантастики (не помню ни автора, ни даже был ли он нашим или зарубежным писателем) я прочитал сюжет о том, как какой-то злой гений разработал состав, превращающий человека в кремниевые формы жизни.
Всё это делалось для создания суперсолдат, которым были бы не страшны пули, но что-то, как обычно, пошло не так и перерождённые кремниевые солдаты были медлительны, а по интеллекту представляли что-то среднее между памятниками и сидящими на них голубями. Сейчас я понимаю наивность того произведения, но тогда оно меня впечатлило и, будучи на даче, я с опаской пил мутноватую колодезную воду, зная, что муть — это песок, содержащий кремний. Мне не хотелось становится медленным и тупым кремниевым памятником самому себе.
На нашей железокаменной планете кремний — второй по распространённости элемент, а то, что мы обычно называем «камнями» — различные формы оксида кремния, в которых кремний связан с кислородом. Элементарной единицей любого «камня» является тетраэдр, в котором атом кремния окружён четырьмя атомами кислорода, а вот от взаимного расположения этих тетраэдров и от незначительных примесей, которые содержит оксид кремния, зависит, какие свойства и внешний вид будут у его минерала — будет ли это песок, кварц, опал, халцедон или что-то еще. Самая чистая форма оксида кремния, практически не содержащая других элементов, кроме кремния и кислорода — кварц или горный хрусталь. В монокристаллических образцах кварца тетраэдры SiO4 располагаются, формируя спирали, закрученные по или против часовой стрелки. Для кварца вполне может получиться так, что он образует два кристалла, одинаковых как отражения друг друга в зеркале. Надеюсь, многие знают об оптической изомерии — существовании молекул, одна из которых является зеркальным отображением другой, но большая часть людей считают, что такое различие форм присуще только производным углерода — органическим соединениям. Это не так, оптическая изомерия может проявляться даже у такого простого и распространённого в земной коре неорганического вещества, как диоксид кремния. Если чуть-чуть усложнить структуру кремниевого минерала, и заменить часть атомов кремния атомами алюминия, можно получить цеолиты — неорганические «соты» или, как их называют — молекулярные сита. Различные формы природных и синтетических цеолитов различаются размерами внутренних пор-каналов и могут применяться, например, для разделения газов, одни из которых будут свободно проходить через эти поры, а другие не пройдут.
Что же представляет сам по себе элемент кремний, без которого в наше время не заработает ни одно электронное устройство? Разложить кварц или песок на кремний и кислород сложно, для этого требуются колоссальные затраты энергии. Упомянутый в двух предыдущих главах Хэмфри Дэви занимался и кремнием — он, вероятно, первый догадался, что кварц или песок представляет собой соединение нескольких элементов, а не отдельный элемент и даже попытался его выделить. Дэви пропускал пары металлического калия над оксидом кремния, получая темное вещество, которое при сжигании снова давало оксид кремния. Образец кремния, полученный Дэви, был сильно загрязнен примесями, грязные образцы получили и его последователи — Жозеф Луи Гей-Люссак и Луи Жак Тенар. В конечном итоге чистый образец кремния в 1825 году получил Йёнс Якоб Берцелиус, который и дал ему международное латинское название «silicium» (от лат. silex — кремень). Русское название «кремний» появилось в 1834 году. Его ввёл химик Герман Иванович Гесс, взяв за основу древнегреческое слово «кремниос», означающее утёс или гора.
Свойства элементарного кремния — типичные свойства металлоида (раньше такое обозначение при менялось для обозначения химических элементов типа «ни рыба, ни мясо» — тех, кого нельзя отнести ни к типичным металлам, ни к типичным неметаллам. Внешне кремний похож на металл — темно-серый цвет, похожий на металлический блеск, но, в отличие от металлов, чистый кремний, во-первых, плохой проводник электричества, а во-вторых, с увеличением температуры проводимость кремния и других полупроводников растет (нагретые металлы, наоборот, хуже проводят электричество) — увеличение температуры полупроводника позволяет его электронам получить больше энергии и стать более эффективными переносчиками заряда. Есть ещё один способ увеличить электропроводность полупроводника — как это не парадоксально, контролируемого ввести в него загрязнения, например, атомы алюминия или фосфора. Если на внешнем электронном слое таких «загрязнителей», которые, конечно правильно называть «легирующими добавками», количество электронов отличается от количества внешних электронов кремния, полученный материал сможет проводить ток либо за счет избыточных электронов (если, например, легирующие добавки — фосфор и другие пятивалентные элементы) или электронных вакансий, «дырок» (в том случае, если к кремнию подмешивают алюминий и другие трехвалентные элементы). Такие полупроводники, как кремний и германий вот уже почти шесть десятков лет являются сердцем электрических схем радио- и телеприемников, компьютеров, смартфонов и другой бытовой и применяющейся в более сложных целях микроэлектроники.
Как кремний относится к жизни? Увы, по-разному. С одной стороны, несколько форм асбеста — кремнийсодержащего минерала образуют волокна, размеры которых могут перфорировать стенки клеток легких, постепенно разрушая их слизистую оболочку (есть даже такое профессиональное заболевание шахтеров, как силикоз легких). С другой, многообразие форм кремния позволило природе заставить работать этот элементов живых системах. Так, в мелких шипах крапивы прячутся острые мини-лезвия из оксида кремния, задача которых проколоть мягкую кожу неосторожного туриста и ввести в прокол незначительное количество раздражающей нервные окончания муравьиной кислоты. Диатомовые водоросли, на которые приходится четверть всего органического вещества планеты, приспособились защищаться панцирями из оксида кремния. Что же касается перспектив существования кремниевых форм жизни, они довольно призрачны (особенно для условий, аналогичных условиям на нашей планете). Почему? Одним из факторов, обеспечивающих успешно протекающий обмен веществ, является способность быстро и обратимо и образовывать, и разрушать связи элемент-кислород. Углерод этому «трюку» обучен хорошо — связь С — О сможет и легко образоваться, и легко разрушиться, а вот связь кремний-кислород, одна из самых прочных химических связей, образуется легко, а вот разрушается со скоростью никак не отвечающий требованиям обмена веществ организма, который должен быстро реагировать на изменения условий окружающей среды.
15. Фосфор
Благодаря работавшим в Казанском императорском университете Бутлерову, Зайцеву и Марковникову про город Казань, в котором я живу и работаю, говорят, что он «Мекка органической химии». Для химиков дня сегодняшнего Казань ещё и мировая столица химии фосфора — в Казани были открыты два важнейших для химии этого элемента процесса — перегруппировка Арбузова и реакция Пудовика. Существует легенда о том, как один из ведущих ученых, изучавших органические соединения фосфора в СССР, академик Мартин Израилевич Кабачник объяснял этот факт.
В советское время в общественных столовых раз в неделю обязательно был день, который граждане СССР называли «рыбным», а в распорядках самих столовых он значился как «не мясной» — в этот день (в зависимости от географии в разных частях 1/6 части суши этим днем была среда или четверг) в меню столовых мясо и птица не значились, и гражданам СССР предлагали уху из минтая, жаренный минтай и котлеты из хлеба, смешанного с фаршем минтая. Может где и была другая рыба, но в столовых Казани другой рыбы, кроме минтая не водилось, более того, «не мясные» дни в казанских столовых случались чаще, много чаще одного раза в неделю.
Благодаря успехам наших учёных на ниве фосфорорганических соединений в Казани время от времени проводились конференции и школы по химии фосфорорганических соединений. На заключительном банкете одной из таких конференций питавшийся всё время конференции в столовой нашего университета Мартин Израилевич сказал, что он разгадал секрет продуктивности казанской химической школы: «В Москве немясные дни в столовой бывают раз в неделю, а в Казани мясные дни бывают раз в неделю. Вы, казанские химики, едите рыбу почти каждый день, и именно поэтому вы такие умные и продуктивные!» Тост был связан с той легендой, что в рыбе много фосфора, и поэтому она очень полезна для ума. Всё же для ума полезно чтение хороших книг и постоянная интеллектуальная деятельность. Иначе самым высоким интеллектом бы обладали люди, регулярно сочетающие сушёную рыбу с «проказами хмеля и солода», но рациональное зерно в сочетании ума и рыбы есть — по одной из версий питание речной рыбой с большим содержанием энергетически ёмкой молекулой АТФ позволила нашим далёким предкам получать больше энергии, которая в итоге и была направлена на эволюцию нашей нервной системы.
Когда же и с чего началась химия фосфора? Впервые фосфор был получен в 1669 году в Гамбурге Хеннигом Брандтом. Руководствуясь алхимическим принципом подобия, алхимик решил выделить золото из мочи (подобие заключалось в сходстве цветов целевого продукта синтеза и исходного вещества), испаряя биологическую жидкость и нагревая сухой остаток до красного каления. Над осадком поднимались светящиеся пары белого фосфора, которые Брандту удалось сконденсировать. В итоге получались крупицы белого воскоподобного вещества, которое ярко горело и к тому же светилось в темноте. Брандт, подумав, что, пусть с золотом ему не повезло, но, вероятно он получил что-то подобное философскому камню. Однако полученное алхимиком вещество было бесполезно в превращении свинца и ртути в золото и, поняв, что оно не философский камень, алхимик назвал это вещество phosphorus mirabilis (лат. «чудотворный носитель света»), позднее в названии осталось только «носитель света». Столетие после открытия Брандта белый фосфор получали исключительно из мочи, ну а поскольку содержание фосфора в этом сырьем невелико, выход продукта был небольшой, и применения фосфор не находил. В восемнадцатом веке стало понятно, что выделять фосфор из костей выгоднее во всех отношениях, в том числе и эстетическом, и масштабы получения светоносного элемента увеличились. Кости растворяли в серной кислоте, получая фосфорную кислоту, которую затем прокаливали с древесным углём. Тогда же оказалось, что фосфор может существовать в разных формах — кроме белого есть также и красный (белый, красный и черный фосфор представляют собой аллотропные модификации). Сейчас фосфор получают из минералов-апатитов (фосфатов кальция). В честь этих полезных ископаемых назван город Апатиты в Мурманской области.
Фосфор и его производные находят широкое применение в военном деле. В XX веке белый фосфор применялся для изготовления трассирующих пуль, зажигательных боеприпасов и дымовых гранат. Во время второй мировой войны на Гамбург, где впервые был получен фосфор в ходе операции «Гоморра» 25 июля — 3 августа 1943 года британские и американские военно-воздушные силы сбросили в том числе и 25 000 зажигательных фосфорных бомб. В результате погибло около пятидесяти тысяч человек и около миллиона жителей были вынуждены покинуть разрушенный и сгоревший город. Многие производные фосфора — фосфонаты, относятся к нервнопаралитическим отравляющим веществам. Самый печально известный из них, наверное, зарин, с помощью которого 20 марта 1995 года сторонники запрещённой в России тоталитарной секты Аум Синрикё провели теракт в токийском метро. Распыление зарина в токийской подземке убило 12 человек, около тысячи значительно пострадало (многие необратимо потеряли зрение). Шестого июня 2018 года основатель секты Сёко Асахара и шесть других её руководителей были казнены.
Конечно, применение фосфора не ограничивается только военным делом. Так, в 1830 году 19-летний французский химик Шарль Сориа изобрёл фосфорные спички, состоявшие из смеси бертолетовой соли, белого фосфора и клея, которые затем неоднократно модифицировались. В разных странах началось развитие спичечной промышленности, которая, однако, угрожала здоровью занятых на производстве работников. Вдыхание паров белого фосфора и образующегося из него фосфина приводило к развитию фосфорного некроза нижней челюсти. К 1900-м годам производство фосфорных спичек с белым фосфором было запрещено повсеместно, и появились современные спички, головка которых содержит либо красный фосфор, либо сульфид фосфора. Фосфор остается «несущим свет» и во многих других областях. Так, фосфид магния применяется для производства самовозгорающихся сигнальных огней — контакт этого вещества с водой приводит к образованию горючего газообразного дифосфина, который, воспламеняясь, поджигает остальной состав сигнального огня. Фосфиды галлия и индия используют в светоизлучающих диодах.
В свободном виде ни одна из аллотропных модификаций фосфора не встречается в земной коре, в минералах фосфор находится в виде фосфатов. Фосфатный остаток играет важную роль для живых систем — остатки фосфорной кислоты связывают друг с другом звенья нуклеиновых кислот — РНК и ДНК, принимая и отдавая фосфатные группы в превращении АТФ-ФДФ и обратно, организм регулирует энергетический обмен. Неорганические соединения фосфора также важны — фосфат кальция входит в состав костей и зубной эмали. С обычным питанием мы получаем достаточное количество фосфора для нашего обмена веществ. Особо богаты фосфором тунец, мясо птицы, сыр и яйца. Какое-то количество фосфора мы получаем, даже когда пьем колу — в ней содержится фосфорная кислота (бояться, что она разъест нам желудок не стоит — в наших желудках плещется более концентрированная, чем в коле и более сильная, чем фосфорная соляная кислота).
В настоящее время большую часть фосфатных минералов превращают в фосфорную кислоту, ежегодное производство которой достигает пятидесяти миллионов тонн. Затем фосфорную кислоту и растворимые фосфаты применяют для изготовления удобрений, пищевых добавок для животных, замедлителей коррозии, стиральных порошков и таблеток для посудомоечных машин. Некоторую часть фосфатных минералов превращают — химические в фосфор, трихлорид фосфора, а далее в фосфористую кислоту и ее производные — фосфонаты. Органические фосфонаты могут применяться как антипирены и пестициды — наверняка, каждому приходилось в быту использовать такой убивающий насекомых фосфонат, как дихлофос и, наверняка каждый слышал хоть что-то про гербицид глифосат. Сульфиды фосфора снижают коэффициент трения моторных масел, увеличивая долговечность двигателя.
16. Сера
В 1982 году, когда я впервые в жизни оказался на море, пассажирский поезд «Казань-Адлер», чуть-чуть не доехав до своей конечной станции, около трех часов простоял напротив сочинской Мацесты. На эти три часа основное противостояние летних пассажиров общественного транспорта: «Откройте окно, дышать нечем — закройте окно, дует», перешло из разряда метафизических в экзистенциальное. Дышать в наглухо закрытом вагоне было действительно нечем, но и открытые окна облегчения не приносили через них в вагон проникал запах сероводорода. Зато каким приятным и свежим показался всем запах моря, когда до него, наконец, удалось добраться.
На самом деле и запах сероводородных источников Мацесты, и запах свежего моря — запах веществ, образованных одним и тем же элементом. Более того, запах моря и запах, унюхав который, мы узнаём об утечке газа — запах одного и того же серосодержащего соединения — диметилсульфида. Так бывает — одно и то же вещество в зависимости от концентрации в окружающем воздухе может пахнуть и отвратительно, и привлекательно. Но если честно, сере с запахом ее соединений действительно не повезло их, объединяя под общим термином «запах серы» всегда относили к чему-то инфернальному: «И пролил Господь на Содом и Гоморру дождем серу и огонь от Господа с неба, и ниспроверг города сии, и всю окрестность сию, и всех жителей городов сих, и произрастания земли» — Бытие, 19, ст. 24, 25. Или: «Так видел я в видении коней и на них всадников, которые имели на себе брони огненные, гиацинтовые и серные; головы у коней — как головы у львов, и изо рта их выходил огонь, дым и сера. От этих трех язв, от огня, дыма и серы, выходящих изо рта их, умерла третья часть людей» — Откровение святого Иоанна Богослова, 9, ст. 17, 18. Цитировать можно и дальше. Сложно сказать, что имели в виду древние под термином «запах серы». Это мог быть сернистый газ, продукт горения серы, тогда бояться этого запаха были все основания — увеличение концентрации сернистого ангидрида в воздухе могло говорить о пробуждении вулкана, природном явлении, которое опасно для людей и тогда, и сейчас (можно вспомнить не только судьбу Помпей, но и то, как незначительный выброс пепла исландским Эйяфьядлайёкудлем в 2010 году закрыл воздушное пространство над Европой на несколько дней).
Другой вариант «запаха серы» — запах сероводорода и других производных двухвалентной серы. Эти газы тоже образовывались в результате вулканической деятельности, но отрицательное отношение к ним людей могло проявиться еще раньше. Запах сероводорода — запах гниения, и, скорее всего, ещё наши далёкие предки научились чувствовать его в очень малых дозах и избегать, чтобы не отравиться трупными ядами. Одно из самых интенсивно пахнущих производных серы — этилмеркаптан человеческий нос может почувствовать, если его в воздухе будет содержаться три миллиардные доли. При этом три миллиардных доли воспринимаются именно как та самая морская или речная свежесть — планктон попадает на берег и медленно разлагается, выделяя этилмеркаптан, который быстро распределяется по воздуху за счет диффузии и движения ветра. Если же концентрация сероорганики увеличивается (разлагается много организмов, помещение закрыто, газовые службы специально добавили одорант в природный газ), тут уже, прошу прощения за каламбур, свежестью и не пахнет.
Резкие и предупреждающие об опасности запахи объясняют предубеждение, сложившееся у человечества к сере. Добавим сюда ещё и то, что элементную серу — желтое вещество, тоже можно было найти около вулкана (её называли «желчью вулкана»), и вряд ли эллины или персы, или любые другие культуры, зачастую считавшие Землю живым существом, могли предполагать, что Мать-Земля выбрасывает из своих глубин что-то хорошее. Однако, для некоторых бактерий слово «сера» и слово «жизнь» — одно и то же. Эволюция дала возможность ряду бактерий использовать для дыхания окисленную форму серы — сульфат-анион. Точно также, как в наших организмах в процессе жизнедеятельности кислород, приобретая электроны, восстанавливается до углекислого газа или воды, в организме этих бактерий сульфат восстанавливается до сероводорода. Образующиеся в результате жизнедеятельности таких бактерий бескислородные осадочные отложения зачастую содержат металлы — сульфиды большинства металлов, в особенности переходных, плохо растворимы в воде. В осадочных породах можно встретить пирит (сульфид железа), киноварь (сульфид ртути), галенит (сульфид свинца) и многие другие сульфидные минералы, применяющиеся для промышленного производства металлов. При обжиге сульфидных руд выделяется сернистый газ, который, не желая допустить его попадания в атмосферу (там, соединяясь с водой он, как минимум формирует смог, а как максимум — формирует кислотные дожди), его применяют для производства серной кислоты, применение которой разносторонне — от производства минеральных удобрений и искусственных красителей до приготовления соевого соуса. Мировое производство серной кислоты около 200 млн тонн в год, никакое другое вещество не производится в таких огромных масштабах.
Хоть сера и казалась нашим далёким предкам чем-то инфернальным, некоторые климатологи сейчас на полном серьёзе предполагают, что сера сможет замедлить глобальное потепление и спасти планету. Диметилсульфид образуется при разложении диметииилсульфонпропионата, гормона, который вырабатывается океанским планктоном. Летучесть диметилсульфида и его плохая растворимость в воде приводит к тому, что ежегодно в атмосферу попадает около 20 миллионов тонн диметилсульфида, который окисляется до серной кислоты, играющей в атмосферной химии роль зародышеобразования облаков, экранирующих поверхность Земли от излучения Солнца. Получается так — потепление приводит к увеличению роста и биологической активности планктона, в результате своей деятельности выделяющего больше вещества, которое, как солнечный зонтик, не дает планете перегреваться или даже охлаждает её. Неплохо для серы, аромат которой долгое время считали символом проклятия и приближающихся катаклизмов.
17. Хлор
Многие считают, что знакомы с запахом хлора, зачастую считая своим долгом заметить, что или водопроводная вода пахнет хлором, или вода в бассейне пахнет хлором. Тем не менее, характерный для бассейнов запах — отнюдь не запах хлора, а запах трихлорида азота (NCl3), который образуется в результате взаимодействия хлора с мочевиной. Откуда попадает в бассейн мочевина?
Во-первых, с потом — не зря перед посещением бассейна рекомендуют принимать душ, а во-вторых, скажем так — в ходе одного из социологических опросов 17 % американцев признались, что у них был случай, когда они «спутали» бассейн с туалетом. Хлор способен отравлять не только микроорганизмы, но и живые формы большего размера, и 22 апреля 1915 года будущий лауреат Нобелевской премии по химии Фриц Габер, о котором говорилось в главе про азот, испытал на западном фронте Великой войны новый тип оружия — удушливые газы смертельного действия, а дебютировал в этой незавидной роли опять же хлор.
Элементный хлор при комнатной температуре представляет собой газ жёлто-зелёного цвета. Название, предложенное Хэмфри Дэви, было из-за цвета («хлорос» на древнегреческом означает «цвет молодой листвы» или просто «жёлто-зеленый»). Заметим, что до газобалонной атаки слово «хлор» не имело ярко выраженной негативной коннотации, скорее наоборот — было символом обновления. Так, например, у моего земляка, поэта Гавриила Романовича Державина есть стихотворение «Ода к царевичу Хлору»:
Прекрасный Хлор! Фелицын внук,
Сын матери премилосердной,
Сестер и братьев нежный друг,
Супруг супруге милый, верный —
О ты! чей рост, и взор, и стан
Есть витязя породы царской,
Который больше друг, чем хан
Орды, страны своей татарской!
Впервые хлор был получен в 1774 году Карлом Вильгельмом Шееле в результате реакции соляной кислоты с диоксидом марганца, носам Шееле не смог правильно интерпретировать полученные результаты, считая, что получил не простое вещество, а соединение, содержащее кислород. Именно Дэви, воспроизведя эксперименты Шееле в 1810 году, сделал вывод о том, что получил его коллега и назвал элемент.
Хлор, как и фтор относится к галогенам — крайне активным неметаллам, и, конечно, не встречается на Земле в свободном виде, только в виде соединений. Основные минералы, в которые входит хлор — каменная соль (NaCl), сильвинит (KCl) и карналлит (KCl.MgCl2.6H2O). В школе на уроках химии хлор является единственным химическим элементом, для которого учителя химии рекомендуют использовать нецелочисленное значение атомной массы — 35.5 а.е.м. Это объясняется тем, что хлор в земной коре состоит из двух изотопов — на 75 % из 35Cl и на 25 % из 37Cl, масса которых при усреднении и дает значение 35.5 (строго говоря, как составитель большого количества химических задач олимпиадного уровня я бы советовал и для многих других элементов использовать значения атомных масс, округлённые до десятых).
Большая часть хлора, производимая в настоящее время, используется синтетической органической химии — в превращениях с участием органических соединений хлор может принимать участие в реакциях, относящихся к трём основным механизмам.
Во-первых, это свободно-радикальное замещение — реакция, в ходе которой молекула хлора распадется на два радикала (чаще всего в результате фотохимической активации) и в результате всех превращений из основных компонентов нефти и природного газа — насыщенных углеводородов, получаются хлорпроизводные и хлороводород (который тоже находит своё применение).
Второй тип реакций хлора с органическими веществами — электрофильное присоединение хлора к двойным или тройным связям. Хлор, будучи электроотрицательным элементом, стремится туда, где много электронов (электрофильный — любящий электроны), а двойные и тройные связи богаты электронной плотностью. В результате присоединения тройная связь углеводорода превращается в двойную, а двойная — в одинарную, и образуется две новых связи углерод-хлор. Чаще всего присоединение хлора к кратным связям проводят в темноте, чтобы идущий на свету процесс замещения не добавлял побочных продуктов.
Третий тип реакции электрофильное замещение, протекающее при взаимодействии хлора с ароматическими углеводородами (также непосредственно встречающимися в составе нефти). В результате процесса, известного, как реакция Фриделя-Крафтса, получаются хлорпроизводные ароматических углеводородов и опять же хлороводород. Катализатором этой реакции являются хлорид алюминия или хлорид трехвалентного железа.
Области применения хлора многочисленны. Сотни и тысячи тонн хлора используют в целлюлозно-бумажном производстве, для получения хлорированных полимеров (наиболее известный из которых поливинилхлорид — ПВХ) и для получения органических растворителей — хлороформа, дихлорметана и дихлорэтана. Чуть меньшее количество хлора идет на получение красителей, лекарств, антисептиков и даже спичек и фейерверков. Луи Бертолле предложил применять в качестве окислителя пиротехнических составов хлорат калия (KClO3), который мы сейчас называем «бертолетовой солью». В настоящее время и в пиротехнических составах, и для изготовления спичек применяют менее опасный и более богатый кислородом перхлорат (KClO4), он же применялся как окислитель в разгонных реактивных двигателях американских шаттлов.
Ну и, конечно, наиболее известное применение хлора — отбеливающие и дезинфицирующие составы, а также обеззараживание питьевой воды и воды для закрытых и открытых бассейнов. Хлорировать питьевую воду начали в Лондоне после эпидемии холеры 1850 года. Тогда английский врач и основатель учения о гигиене Джон Сноу выяснил, что эпицентром заболевания является колодец в лондонском районе Сохо, воду в колодце обработали хлорной известью, и эпидемия пошла на убыль. Джон Сноу известен доведением до ума способа практического применения ещё одного производного хлора — хлороформа (CHCl3). С помощью хлороформа и разработанного лично им ингалятора Сноу провел обезболивание родов хлороформом королеве Англии Виктории в 1853 и в 1857 годах.
Соединения хлора также применялись для изготовления аэрозольных баллончиков и холодильников. Пропеллантом («выталкивателем») вещества из баллона и хладагентом в системе холодильника выступали хлорфторуглеводороды, также известные как фреоны. Однако в 1974 году Марио Молина, Шервуд Роулэнд и Поль Крутцен показали, что продукты превращений фреонов в атмосфере, в первую очередь — радикалы хлора могут способствовать разрушению озонового слоя. В 1995 году Молина, Роуленд и Крутцен получили Нобелевскую премию по химии, а раньше этого, с января 1989 года начал действовать Монреальский протокол, запрещающий производство ряда хлорфторуглеводородов. С момента начала действия протокола прошло почти двадцать лет, и озоновый слой в приполярных регионах действительно начал восстанавливаться, однако, как показывают результаты исследований 2018 года, озоновый слой над крупными годами в умеренном и тропическом поясах не восстанавливается, а кое-где даже продолжает разрушаться, что, очевидно говорит о необходимости искать других виновных в образовании озоновых дыр помимо радикалов хлора.
18. Аргон
В Периодической системе только у тринадцати химических элементов символ содержит одну латинскую букву. Это водород, бор, углерод, азот, кислород, фтор, фосфор, сера, калий, ванадий, иттрий, йод и уран.
Несколько десятков лет к этому клубу относился и аргон, однако через шесть десятков лет после обнаружения аргона, в 1957 году Международный союз по теоретической и прикладной химии (ИЮПАК) решил, что однобуквенный символ для инертного газа (пусть и первого инертного газа, открытого человеком) — непозволительная роскошь и заменил символ аргона А на привычный нам сейчас Ar. Правда, эта замена привела к другому казусу — в органической химии символом Ar (от aryl) принято обозначать ароматические фрагменты. Часто бывает, что незнакомый с этим обычаем студент или школьник, открывая продвинутый учебник по органической химии, думает, что органики настолько всемогущи, что получили огромное количество соединений инертного аргона.
О богатых химических свойствах аргона говорить не приходится. В настоящее время известно только одно химическое соединение этого элемента — гидрофторид аргона (HArF). Оно было получено в 2000 году в группе финского химика Маркку Рясянена в университете Хельсинки. Исследователи при температуре −265 °C облучали ультрафиолетом смесь аргона и фтороводорода, находящихся на подложке из иодида цезия. Нагрев меньше, чем на десять градусов — до –256 °C приводит к разрушению гидрофторида аргона на аргон и фтороводород. Оно и понятно — название происходит от древнегреческого слова «аргос» — ленивый, медленный, неактивный, а о лени этого элемента можно судить по тому, что от его открытия до получения его соединения с другими элементами пошло более ста лет.
Аргон — самый распространенный благородный газ, именно поэтому он и был найден первым из элементов своего класса. На долю аргона приходится около 0.94 % атмосферы Земли и около 1.6 % атмосферы Марса. Разрежённая атмосфера Меркурия содержит до 70 % аргона. Если не учитывать пары воды, аргон третий по распространённости газ в земной атмосфере после азота и кислорода. Абсолютное его содержание в атмосфере Земли составляет сорок триллионов тонн. Это количество медленно возрастало по мере геологического старения Земли — практически весь аргон нашей атмосферы является результатом радиоактивного распада нуклида 40К, период полураспада которого составляет 12.7 миллиардов лет. Аргон был обнаружен в 1904 году в результате совместной работы физика Лорда Рэлея (Джона Уильяма Стретта) и химика Уильяма Рамзая, ставших в 1904 году лауреатами Нобелевских премий по физике и химии соответственно.
История открытия началась, когда Рэлей обнаружил, что образец азота, полученный из воздуха, отличается большей плотностью, чем азот, полученный разложением соединений аммиака. Различие было заметным, и учёные решили разделить усилия, пойдя двумя путями. Рамзай собирался найти более тяжёлый газ в азоте, выделенном из воздуха, а Рэлей — посмотреть, не образуется ли при разложении солей аммония более лёгких газов. Рамзай поглотил весь азот из «воздушного» образца, пропуская его над нагретым магниевым порошком — азот с магнием прореагировали с образованием нитрида магния (Mg3N2), однако 1 % газа не реагировал ни с чем, плотность его была больше, чем у азота. В атомном спектре нового газа содержались новые красные и зелёные линии, что подтвердило открытие нового элемента. Сейчас очевидно, что выделенный Рамзаем образец аргона был загрязнён другими инертными газами, содержащимися в нашей атмосфере. Рамзай, кстати, не был первым человеком, выделившим аргон — в 1785 Генри Кавендиш, экспериментируя с газами, обнаружил, что примерно 1 % газов из земной атмосферы не вступает в химические реакции, однако вывода об обнаружении нового газообразного элемента не сделал.
Основное применение аргона — металлургия, а точнее переплавка чугуна в сталь. В ходе этого процесса через расплавленный чугун пропускают смесь аргона с кислородом. Пузыри аргона перемешивают расплавленный металл, а кислород выжигает из чугуна лишний углерод, превращая его в углекислый газ. Аргон применяют там, где следует избежать появления кислорода — сварка активных металлов, производство титана или проведение органических и элементоорганических синтезов в атмосфере инертного газа. Заметим, что в ходе аргоновой или аргоноводуговой сварки металла нагрев и плавление металла ведут не струей аргона, а электродом, дающим электрическую дугу, а ток аргона нужен для защиты расплавленного металла от окисления (например, при сварке алюминия электрической дугой на сварной шов должно подаваться 10–20 литров в минуту). В атмосфере аргона также хранят старые архивные документы и артефакты, которые могут разрушиться от контакта с кислородом. Аргоновые лазеры, дающие синее излучение, применяются в хирургии для сварки кровеносных сосудов, разрушения опухолей и коррекции зрения с помощью микроопераций на глазе.
Аргон, как и другие инертные газы, оказывают наркотическое воздействие на организм. С 2014 года аргон считается допингом. Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от удушья (в результате кислородного голодания).
Одно, пожалуй, из самых спорных применений аргона — закачка им шин автомобилей люксового класса. Полезность этой процедуры, мягко говоря, сомнительна, так как износу шин в первую очередь, способствует качество дорожного полотна, а не то, чем они задуты. Однако, как говорится, понты дороже денег, и, если есть индивидуумы, желающие самоутвердиться перед окружающими тем, что крутые шины его крутой тачки заполнены не абы чем, а инертным газом, организации, которые помогут этим индивидуумам самоутвердится в обмен на денежные знаки, будут процветать: «На дурака не нужен нож, Ему с три короба наврешь, И делай с ним, что хошь».
19. Калий
Когда я долго и серьезно занимался проведением химических олимпиад школьников в Казани и Татарстане, я понял, что калий — роковой элемент. Еще можно было понять, что многие участники путают калий с кальцием — грешен и сам, в моей «Жизни замечательных веществ» в паре мест есть такие опечатки (хотя я, в отличие от школьников не путаю магний с марганцем).
Хуже другое — многолетние наблюдения показали, что некоторые участники региональной олимпиады, решая, например, задачу с вопросом: «Запишите, что произойдёт при прокали вании нитрата аммония», — самозабвенно начинали писать уравнение несуществующей реакции нитрата аммония с калием. Правда, как показывает опыт общения с англоязычными коллегами, у них почти та же беда. Слово «прокаливание» по-английски пишется «calcination», в патентной литературе до сих пор иногда проскакивает «кальцинирование», и школьники с Алабамы или Небраски в качестве ответа на аналогичный вопрос могут начать изобретать реакцию нитрата аммония с кальцием.
На самом деле название калия никакого отношения к прокаливанию не имеет, оно происходит от арабского слова аль-кали — поташ (или растительная зола) — именно из веществ, получавшихся переработкой древесной золы, и был получен этот элемент. Основой названия, которое дал калию его первооткрыватель — Хэфмри Дэви (potassium) и сохранившееся в английском, французском, испанском, португальском и польском языках, также происходит от слова «поташ». Само по себе слово «поташ» в английском языке появилось в результате сочетания слов pot (горшок) и ash (зола). Для получения поташа древесину плотных пород дерева дожигали до золы, золу несколько суток вываривали в воде в специально приспособленных для этого медных горшках. В результате этой обработки соли калия преимущественно переходили в раствор, раствор фильтровали или сливали, отделяя от осадка, после чего упаривали, получая твердую соль — поташ. Основным компонентом поташа был карбонат калия (его до сих пор называют поташом), но также содержал и другие соли калия — сульфат и хлорид (садоводы-огородники знают, что зола, оставшаяся после сжигания веток или листвы — хорошее калийное удобрение). Зачем нужны были все описанные выше мучения? До появления мыла поташ применялся для умывания рук и мойки посуды, его добавляли в смесь для производства стекла вместо соды, получая в результате хрусталь. Из поташа также можно было получить «едкий поташ» — раствор, преимущественно содержавший калиевую щёлочь. Для этого в раствор поташа добавляли известковую воду (гидроксид кальция, Са(ОН)2), протекала обменная реакция, плохо растворимые в воде карбонат и сульфат кальция выпадали в осадок, а из жидкости, оставшейся над осадком, можно было выделить гидроксил калия — едкий поташ. Именно из гидроксида в 1807 году Дэви и смог выделить первый образец металлического калия. Это открытие стало вехой в истории химии — калий стал первым металлом, для получения которого воспользовались электричеством.
За два десятка лет до открытия Дэви итальянский врач Луиджи Гальвани заметил, что прикосновение стального ножа к внутренним бедренным нервам мертвой лягушки мышцы её ноги сокращались. Дальнейшие опыты показали, что такую реакцию вызывают все металлы. Земляк Гальвани Алессандро Вольта объяснил наблюдения Гальвани электрическими явлениями и сконструировал источник постоянного тока — вольтов столб.
Применение электричества в химии началось с демонстрационных экспериментов — в 1800-х годах английский химик Уильям Николсон на своих лекциях с помощью электричества демонстрировал разложение (электролиз) воды на составляющие её водород и кислород. Дэви решил, что электричество можно использовать и в научных целях, а не только для получения уже известных веществ, и начал эксперименты с едким поташом.
И Дэви, и его современники уже представляли, что ни просто поташ, ни едкий поташ не являются самостоятельными химическими элементами, но точный состав этих веществ был неизвестен — многие в то время даже предполагали, что поташ — соединение фосфора с азотом или серой. Первые попытки Дэви окончились неудачей — электролиз водного раствора гидроксида калия приводил только к разложению воды на водород и кислород, и тогда Дэви решил избавиться от воды и подвергнуть электролизу расплавленный гидроксид калия. В октябре 1807 года эксперимент, проведённый в Королевском Институте Лондона дал свои плоды. Как позже писал в дневнике ассистировавший Дэви его кузен Эдмунд Дэви: «Мельчайшие шарики калия прорывались сквозь твердую корку поташа и загорались при контакте с атмосферой. Он [Хэмфри Дэви] не мог сдержать радости — он пританцовывал от восторга; ему потребовалось немного времени, чтобы успокоиться и подготовиться к продолжению эксперимента…».
Радость Дэви можно было понять — он не только доказал, что едкий поташ не содержит фосфора, но и получил неизвестный металл — об это говорил серебристый блеск нового элемента, который, однако на воздухе быстро исчезал из-за реакции калия с кислородом (в настоящее время для того, чтобы калий и другие щелочные металлы не окислялись, их хранят под керосином). Ещё одной необычной особенностью калия было то, что его плотность меньше воды, то есть он вполне мог бы плавать на поверхности воды, если бы не реагировал с ней. Активность калия столь высока, что он реагирует даже со льдом. Калий оказался во многом первым — первый выделенный в свободном виде щелочной металл, первый металл, полученный с помощью электричества — метода, который немного позже назвали электролизом. Дэви не стал почивать на лаврах и использовал отработанную на получении калия методику для получения металлических натрия, кальция, магния и бария.
Большая часть производящихся в настоящее время соединений калия применяются в качестве удобрений. Калий является одним из трех базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором. При его недостатке в организме растения нарушается структура мембран хлоропластов — клеточных органелл, в которых проходит фотосинтез, что можно увидеть по пожелтению и затем отмиранию листьев.
Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в атомных силовых установках на быстрых нейтронах, где требуется отводить больше тепла, чем может отвести только натрий. Интересен сплав, содержащий 12 % натрия, 47 % калия и 41 % цезия. Он остается жидким до −78 °C.
Суточная норма калия в нашем рационе составляет от 3500 до 4700 миллиграмм, хотя в некоторых случаях, к которым относятся хронический алкоголизм и синдром хронической усталости, его может потребоваться больше. К богатым калием продуктам питания относятся орехи, авокадо, цитрусовые, бананы, арбуз, помидоры, фасоль, картофель, зелень, шпинат, соевые продукты, морепродукты и мясо.
20. Кальций
Когда-то, когда я учился в школе нам говорили о четырёх вкусовых ощущениях — кислом, сладком, горьком и солёном. Где-то на рубеже двадцатого и двадцать первого веков вкус перестали рассматривать, как субъективное ощущение и «привязали» к белкам-рецепторам, которые распознают те или иные вещества. Тогда стали говорить о пятом ощущении вкуса — умами (острое, белковое), в котором задействованы рецепторы, распознающие глутамат-ион.
В 2008 году ощущений вкуса стало шесть — оказалось, что на языке крыс есть рецепторы, распознающие ионы кальция, а в 2012 году стало известно о том, что аналогичные белки-рецепторы есть и на языке человека. Мы можем чувствовать вкус кальция, но на уровне субъективных ощущений этот вкус похож на горький.
Очевидно, что все сформировавшиеся у нас за время эволюции вкусовые ощущения несут какую-то практическую цель — сладкий вкус, например, помогает нам понять, что еда богата энергией. Для чего же у нас сформировался «вкус кальция»? Дело в том, что кальций важен для обмена веществ и для нашего организма (вот только в волосах, вопреки рекламе и рогах, вопреки известному анекдоту его нет). В среднем, тело человека содержит около килограмма кальция, причем 99 % этого элемента приходится на костную ткань (это только кажется, что мало, учтите, что неорганическая матрица кости преимущественно состоит из фосфата кальция Ca3(PO4)2, так что суммарная масса фосфора и кислорода добавит к неорганической составляющей костей ещё 1.6 килограмм, а в костной ткани есть еще и белковые компоненты… Кальций — пятый по распространённости химический элемент в земной коре, где он преимущественно содержится в виде карбоната (мела или известняка). Ион кальция — пятый по распространённости ион в морской и океанской воде.
Своё название кальций получил от латинского слова calx (известь, мягкий камень). Крёстный отец и первооткрыватель кальция опять же Хэмфри Дэви, получивший его в 1808 году после успеха с выделением металлического калия. Чтобы получить кальций, Дэви подвергал электролизу смесь влажного гидроксида кальция и оксида ртути. Сейчас для промышленного производства кальция применяют электролиз расплавленного хлорида кальция. На воздухе металлический кальций быстро тускнеет, покрываясь бледно-серой пленкой, в состав которой входят оксид и нитрид. В отличие от магния, кальций сложнее поджечь, но, будучи подожжён, он горит ярким кирпично-красным пламенем.
Металлический кальций используются для получения таких металлов, как хром, торий и уран, с помощью гранул из металлического кальция удаляют следы воздуха из электровакуумных приборов. Применение соединений кальция гораздо более разнообразно и масштабно. Хроники раннего средневековья говорят о том, что строительный гипс применялся для фиксации конечностей при переломах уже в 975 году. А вот когда и где появилась технология производства того самого строительного гипса, а также цемента — уже сложно определить. Считается, что способы производства вяжущих веществ строительных с применением известняка были изобретены в третьем-четвертом тысячелетии до нашей эры одновременно в нескольких не контактировавших друг с другом культур — примерно одновременно применение кальцийсодержащих строительных материалов началось в Древнем Египте, на территории Китая и в Мезоамерике.
Вода, которую мы пьём, тоже содержит ионы кальция. То, что мы называем «жёсткой водой» — вода, содержащая повышенное количество ионов кальция и магния. Ионы этих металлов попадают в воду из-за того, что она контактирует с находящимися в земной коре соединениями кальция — карбонатом (образующим меловые или известковые залежи), сульфатом или фосфатом. Регулярное потребление жёсткой воды может вызывать формирование камней в почках, а также на зубной эмали и в суставах, образующаяся при нагревании жёсткой воды накипь может приводить в негодность нагревательные элементы чайников, стиральных и посудомоечных машин. Интересно, что часто вкус пива определяется концентрацией ионов кальция в воде, применявшейся для пивоварения, и некоторых премиум сортах концентрация кальция даже выше, чем в жёсткой воде.
Суточная норма потребления кальция составляет 1000–1300 миллиграмм. В ходе процесса биоминерализации образуются кости и зубная эмаль. Кости в нашем организме играют не только опорную функцию, они также запасают кальций. Кальций может покидать кости в результате деминерализации, например, при беременности — кальций мигрирует в формирующийся плод. Патологическая деминерализация — болезнь под названием остеопороз. При остеопорозе со временем кости теряют кальций необратимо, их масса уменьшается и, они становятся более ломкими — в конечном итоге появляется «возрастная склонность» к переломам.
Но кальций — это не только кости, это ещё и межклеточная коммуникация высших организмов. Изменение концентрации иона Ca2+ в результате действия гормонов или электрических импульсов нервно ткани заставляет работать ферменты, управляющие различными биологическими процессами, в первую очередь — сокращением мышц. Ион кальция также важен для процесса свертывания крови — при начале кровотечения тромбоциты собираются у раны или пореза и пытаются сформировать тромб и блокировать текущую кровь. Процесс тромбообразования регулируется ионами кальция, витамином К и белком-фибриногеном. При дефиците кальция (или витамина К) кровь будет сворачиваться медленнее.
21. Скандий
Скандий — первый в Периодической системе d — элемент. Он не только один из химических элементов, существование свойства которых были предсказаны Менделеевым, он элемент с непростой судьбой. Можно сказать, что в истории его открытия было три этапа, приходящиеся на 1870, 1879 и 1960 годы.
Наша научная и научно-популярная литература всегда заостряет открытие скандия с триумфом предсказательной способности Периодического закона и гораздо меньше говорит о том, что открытие скандия неразрывно связано с обнаружением его соседей по группе — иттрия и лантана. В восемнадцатом-девятнадцатом веке самым важным для химиков внезапно оказался шведский остров Резарё, благодаря которому было открыто семнадцать химических элементов. В карьере у селения Иттербю, расположенного на этом острове, было найдено два тяжелых минерала, в которых впоследствии были открыты металлы, которые мы сейчас называем редкоземельными — скандий, иттрий, лантан и четырнадцать лантаноидов.
В 1788 году шведский химик и лейтенант артиллерии Карл Аксель Аррениус обнаружил около Иттербю минерал тёмного цвета, который он назвал «иттербитом» и переслал финскому коллеге Юхану Гадолину для изучения. Хотя сам Аррениус даже стажировался у Лавуазье, поддерживая его революционные взгляды на химию, сам он довольствовался лишь открытием минерала. Карла Аррениуса можно скорее назвать военным химиком — его исследования были связаны с разработкой новых составов порохов, благодаря чему он дослужился до полковника, сначала стал членом Королевской Шведской Академии военного искусства (1799), и только потом — членом Королевской Шведской Академии наук (1817). Позже оказалось, что названный Аррениусом минерал иттербит — два минерала, получившие названия гадолинит и эвксенит.
В 1879 году шведский химик Ларс Нильсон, ученик Йёнса Якоба Берцелиуса, который сам открыл три новых химических элемента: церий, торий и селен, выделил оксид нового элемента из гадолинита. Нильсон назвал элемент скандием в честь Скандинавии. Открытие скандия, пусть и входящего в состав оксида было очень важно, так как за девять лет до этого Менделеев, пользуясь Периодическим законом и тенденциями в изменениях свойств элементов и их соединений, предсказал существование десяти, на то время ещё неизвестных элементов, весьма детально расписав при этом свойства четырёх «белых пятен». Одним элементом из этой четвёрки был элемент, свойства которого были близки бору, названный Менделеевым «экабор» (подобный бору). Экспериментально изученные свойства соединений скандия во многом совпадали с предсказаниями Дмитрия Ивановича, демонстрируя, что Периодическая система — не просто способ систематизации, а отражение фундаментальных законов природы.
Так, Менделеев предсказывал для экабору атомную массу 44 и формулу оксида Eb2O3; атомная масса скандия равняется 45, формула его оксида Sc2O3. Конечно, нельзя сказать, что сбылись все предсказания Дмитрия Ивановича — так он считал, что карбонат экабора будет нерастворим в воде, но карбонат скандия растворим. Не сбылось предсказание Менделеева и о способе открытия нового элемента. Дмитрий Иванович предполагал, что экабор откроют спектрально, однако у скандия нет чётких спектральных линий, и этот метод анализа для него бесполезен. Впрочем, идею о способе открытия Менделеев предположил не на основании Периодического закона, а просто на том, что в 1870-е годы спектральные исследования начали теснить привычные химикам прошлых лет методы химического анализа. Сходство свойств соединений скандия со свойствами гипотетического экабора заметил не Нильсон, а другой шведский химик — Пер Теодор Клеве, тоже специализировавшийся по редкоземельным элементам, так что за эмпирическую проверку теоретических построений Дмитрия Ивановича благодарить нам нужно двух человек — Нильсона и Клеве. От открытия оксида скандия до выделения чистого металлического скандия прошло более восьмидесяти лет — оксид скандия отличается химической инертностью, в образцах солей и оксидов скандия могут встречаться примеси других редкоземельных элементов. Всё это привело к тому, что первые 450 грамм чистого металлического скандия были выделены только в 1960 году.
Будучи первым d-элементом, скандий достаточно сильно отличается от других d-элементов химическими свойствами тем, что для него не характерно разнообразие валентных состояний и степеней окисления переходных металлов, говоря точнее — как и у бор, по свойствам которого предсказывал свойства скандия Менделеев, скандий может быть в своих соединениях только трёхвалентным.
Соединения скандия интенсивно применяются в органической химии — его соли являются сильными кислотами Льюиса (веществами, способными «захватить» электронную пару другой молекулы), что позволяет активировать органические молекулы для участия в химических превращениях. С помощью скандия также удается получать естественное искусственное освещение. Понятно, это звучит как оксюморон, но дело в том, что небольшие добавки йодида скандия в ртутные лампы дают свет по параметрам практически не отличимый от дневного солнечного освещения. Светильники в которых используется йодид скандия применяются в кинопроекторах и для прожекторов, освещающих аэропорты и стадионы (скорее всего, на Чемпионате мира по футболу 2018 скандию пришлось внести свою посильную лепту).
Небольшие добавки скандия к алюминию позволяют получить очень легкий и прочный сплав, из которого изготавливают рамы гоночных и горных велосипедов. В наше время в велостроении алюмо-скандиевый сплав уступает в популярности титановым сплавам и композитным материалам на основе углеродных волокон, однако до сих пор применяется в конструкции двухколёсных коней.
Биологической роли скандий не играет. Его мало в земной коре (около 10 грамм на одну тонну), хотя известны столь же редкие переходные металлы, выполняющие тем не менее хоть какую-то работу в клетке. Второй, а точнее главной причиной является то, что скандий проявляет только одно валентное состояние и не может участвовать в окислительно-восстановительных процессах, протекающих в клетке.
22. Титан
Элемент № 22, титан, как и стоящий перед ним в Периодической системе скандий, не является биологически значимым элементом — его атомы не принимают участие ни в одном биохимическом процессе.
Тем не менее, если в организме человека скандий, если и можно найти, то только в следовых количествах, то количество титана в некоторых человеческих телах исчисляется граммами и десятками граммов (думаю, что в моём теле титана наберётся на пару грамм) — химическая инертность титана делает этот металл «физиологически дружественным», из-за чего его применяют для изготовления имплантов зубов, искусственных суставов и других протезов, которые должны непосредственно контактировать с тканями организма.
Правда, на практике преимущественно применяется не металлический титан, а его оксиды. В мире ежегодно используется около четырёх миллионов тонн оксидов титана рутила и анатаза, каждый из которых отвечает формуле TiO2 — это 95 % случаев применения титана. Те читатели, кто уже изучал органическую химию, знают, что органические вещества с одинаковым составом могут различаться строением и свойствами — в органике это явление называется «изомерией». Однако, различие строения и свойств при одинаковом составе характерно не только для органических веществ, но и для неорганических. Иногда, когда неорганические вещества образуют молекулы, это явление также называется изомерией, но для оксидов титана, образующих не молекулы, а атомные кристаллические решетки наличие нескольких форм, отвечающих формуле TiO2, называется «полиморфизмом». Кристаллические решётки слегка различаются межатомным расстоянием титан-кислород, расположением атомов титана и кислорода друг относительно друга, и, вуаля — твердость рутила по шкале Мооса составляет 7 единиц, а анатаза — 5.5 единиц.
На практике преимущественно применяется более мягкий анатаз — он нужен везде, где нам нужен химический инертный, нерастворимый и не обладающий токсичностью порошок белового цвета. Диоксид титана применяется для изготовления таблеток лекарств, входит в состав зубных паст. В пищевой промышленности оксид титана, промаркированный как пищевая добавка E171, с помощью которой добавляют белизны в кондитерские изделия, сыры и мороженное. Оксид титана применяется в солнцезащитных кремах — он практически не прозрачен для ультрафиолета. То, что оксиды титана поглощают ультрафиолетовое излучение, позволяет использовать эти вещества как фотокатализаторы. Закон сохранения энергии отменить нельзя, и, поглотив энергию УФ излучения фотокатализатор рассеивает её, испуская фотоэлектроны, которые способствуют формированию свободных радикалов, которые, например, могут расщеплять воду на кислород и водород. Что касается кремов против загара, очевидно, что менять одну потенциальную опасность для здоровья (ультрафиолет) на другую (активные радикалы), входящие в состав солнцезащитных кремов частицы TiO2 покрывают защитным слоем из оксида кремния или оксида алюминия. В других случаях радикалы даже полезны — они могут убивать патогенные микроорганизмы. В настоящее время проходят испытания дезинфицирующие поверхности, покрытые тонким слоем частиц TiO2. Хорошие перспективы фотокаталитического способа обеззараживания обуславливаются ещё и тем, что, как показали новые исследования, легирование диоксида титана серебром или азотом позволяет получать активные радикалы без ультрафиолета — просто при облучении видимым светом.
Диоксид титана практически одновременно и независимо друг от друга в 1791 году сделали английский викарий Уильям Грегор и немецкий химик Мартин Генрих Клапрот. Грегор растворил образец руды, с которой работал (он называл её «менакеновая земля»), в кислоте, получив бесцветный раствор, который реагировал с цинком, приобретая пурпурную окраску. В 1795 Клапрот открыл в минерале рутиле новый элемент и назвал его титаном, а спустя пару лет сделал вывод о том, что открытый им рутил и образец, с которым работал Грегор, представляет собой одно и то же вещество. Клапрот подобрал новому элементу название из древнегреческой мифологии в соответствии со своими взглядами на химическую номенклатуру, не желая идти на поводу традиций французской химической школы, в соответствии с правилами которой элемент старались называть по его химическим свойствам. Получение металлического титана впервые удалось Йёнсу Берцелиусу, однако до середины XX века ни один из способов получения металлического титана не отвечал требованиям, необходимым для промышленного получения этого металла — выходы были невысокие, а металл получался низкой степени очистки — одна из причин этого заключается в том, что при высоких температурах титан реагирует с азотом с образованием нитрида TiN.
В 1940 году был разработан современный промышленный способ получения титана — процесс Кролла. В соответствии с ним оксид титана превращают в хлорид титана TiCl4, пропуская над смесью порошков диоксида титана и угля хлор, затем в атмосфере аргона хлорид титана обрабатывают металлическим магнием, получая в результате титан (способ получения металлов вытеснением из их соединений другими металлами называется «металлотермия»). Хотя титан — десятый по распространённости в земной коре элемент, сложности с выделением титана из руды делают его промышленное производство, чем производство, например, более редкой для земной коры меди. Это, в свою очередь, обуславливает то, что применение металлического титана затрагивает весьма специализированные области, определяемые его свойствами.
Наиболее ценное свойство металлического титана — его химическая инертность, которая, как и для алюминия объясняется тем, что на поверхности металла образуется защитная оксидная плёнка. Плотность титана (4.5 г/см3) больше чем у алюминия (2.7 г/см3), но титан прочнее алюминия, и для аэрокосмической техники применяют титано-алюминиевые сплавы. Из титанового сплава был выполнен корпус сверхзвукового разведчика ВВС США Блэкбёрд SR-71 — самого быстрого воздушного корабля. Титановые конструкции используются для изготовления двигателей и корпуса пассажирских самолётов. Металлический титан устойчив к действию морской воды, что позволяет делать из него гребные винты надводных и подводных судов, строить корпуса подводных лодок. Любопытно, что тот самый нитрид титана, который долгое время мешал выделению металла тоже нашел своё применение — благодаря его жёлтому цвету, очень похожему на золото, его используют для покрытия инструментов, куполов церквей и в бижутерии.
23. Ванадий
На факультете, котором я работаю, не принято заваливать студентов на экзаменах (многие из них сами отлично справляются с тем, чтобы завалить себя), нет такой привычки и у меня, но, как говорится, в жизни нужно быть готовым ко всему. И, если бы мне вдруг поставили задачу, от которой я бы не смог отказаться — снизить оценки и поставить двойки как можно большему числу первокурсников на экзамене по неорганической химии, я бы смог решить её с помощью всего лишь одного дополнительного вопроса: «Пожалуйста, запишите все формы, в которых ванадий может находиться в растворе, приведя их цвета».
Этот вопрос действительно сможет поставить в тупик многих — названный в честь скандинавской богини любви, красоты и войны Фрейи (истинное имя Фрейи — Ванадис, дочь ванов), ванадий проявляет в соединениях степени окисления от –1 до +5. Соединения ванадия с разными степенями окисления в водном растворе окрашены во все цвета радуги, а способность некоторых форм ванадия участвовать в процессах гидролиза и полимеризации, пожалуй, делает химию ванадия наиболее богатой по сравнению с другими химическими элементами. В водных растворах преимущественно присутствуют три наиболее высоких степени окисления ванадия (+3, +4 и +5) в этих же формах ванадий входит в большинство своих минералов.
Кроме огромного количества форм ванадий может похвастаться и тем, что его открывали и переоткрывали несколько раз. Все началось с того, что первые образцы ванадийсодержащей руды, и записи немецкого естествоиспытателя, барона фон Гумбольдта, отправленные из Мексики в Европу пропали во время кораблекрушения. Повторно ванадий открывали мексиканский химик Андрес Мануэль Дель Рио (который через четыре года после открытия из-за неуверенности отозвал своё сообщение об открытии), Вёлер и Берцелиус. Окончательно расставил все точки над i и наиболее подробно описал свойства соединений нового элемента швед Нильс Сефстрём, которого мы и считаем первооткрывателем ванадия. Название новому элементу, Сефстрём, правда дал с согласия Берцелиуса. Металлический ванадий был получен в 1860-е годы английским химиком Генри Энфилдом Роско.
Ванадий — пятый по распространённости переходный металл в земной коре, часто его можно обнаружить в титановых и железных рудах. Немало ванадия можно обнаружить в каменном угле и нефти. Металлический ванадий — легирующая добавка, которая упрочняет нержавеющую сталь и сплавы, обладающие сверхпроводимостью. Ионные формы ванадия используют как маркеры для спектрального определения активных центров ферментов; соединения ванадия применяются как катализаторы в нефтехимии и лабораториях органического синтеза. Первое масштабное промышленное применение металлического ванадия датируется началом XX века — его использовали в автомобилестроении на заводах Форда; до сих пор основная масса металлического ванадия применяется для производства стали. Ванадий — легкий переходный металл (в учебниках по токсикологии его ошибочно называют тяжёлым), поэтому его добавка позволяет облегчить сталь высокой прочности. В промышленных масштабах также производят пятиокись ванадия, V2O5, катализатор, необходимый для производства серной кислоты.
Существуют организмы, которые могут в миллионы раз концентрировать ванадий, содержащийся в окружающей их среде — на это способны голотурии, асцидии и некоторые виды грибов, правда, какой в этом биологический смысл до конца неясно. Биохимическая роль малых концентраций производных ванадия очевидна — возможность ванадия существовать в различных формах, отличающихся числом принятых или отданных электронов, обуславливает существование ванадийсодержащих металлоферментов — белков, ускоряющих процессы переноса электронов между участниками биохимических процессов. Ванадий оказывает существенное влияние на клеточный рост, хотя вопрос, насколько ванадий нужен людям, открыт до сих пор.
Ванадил сульфат — весьма противоречивая биологически активная добавка, которая очень популярна среди культуристов и бодибилдеров. Ванадат-анион по строению похож на фосфат. Благодаря этому он применяется для изучения активных центров ферментов, отвечающих за перенос фосфатов — фосфатаз и киназ.
Одно из наиболее интересных для биохимии свойств ванадил-иона — его способность активировать работу инсулина. То, что ванадий в форме того же ванадилсульфата помогает инсулинонедостаточным пациентам перерабатывать сахар, было обнаружено в 1899 году во Франции. Позже оказалось, что в отсутствие инсулина производные ванадия не приносят диабетикам облегчения, то есть они являются не заменителями, а усилителями действия инсулина. После появления инсулиновой терапии диабета исследования направленные на изучение роли ванадия в лечении диабета на некоторое время прекратились, однако около четверти века назад работы в этом направлении начались снова, и в настоящее время производные ванадия уже проходят клинические испытания как средства для лечения диабета.
24. Хром
Во всех учебниках и монографиях можно встретить информацию о том, что в России был найден только один химический элемент, встречающийся в коре Земли — рутений. Это действительно так, но, как это часто бывало с химическими элементами, история их открытия начиналась в одном месте, продолжаясь в другом, пока не находился человек, наиболее полно описавший свойства элемента, становившийся в конечном итоге его первооткрывателем.
Если подходить к делу так, то в открытии хрома можно вполне обнаружить «русский след». Первый минерал, содержащий хром — хромат свинца хромат свинца (PbCrO4) обнаружил в 1761 году на Урале и назвал «красной свинцовой рудой» немецкий минералог и геолог Иоганн Готлоб Леман. В том же году Леман был назначен профессором химии университета и директором Императорского кабинета природных материалов в Санкт-Петербурге, так что, если отталкиваться от реалий дня сегодняшнего, когда числящийся в российском университете даже на 0.1 ставки иностранный подданный считается сотрудником университета, плюс к тому, что бывает — университет учитывает в научном отчёте все его научные публикации, вполне можно сказать: «Первое соединение, содержащее хром, было обнаружено в России профессором российского университета». Спустя тридцать два года после открытия Лемана французский химик Луи Воклен показал, что красная свинцовая руда, к тому времени называвшаяся «крокоит» содержит новый химический элемент.
Для выделения хрома из крокоита Воклен использовал несколько стадий. Сначала он смешал с раствором хромата свинца поташ, чтобы осадить свинец. Затем он превратил жёлтый хромат калия в хромовую кислоту, которую затем нагрел её с углеродом, выделив в итоге, как он описывал свои эксперименты «тугоплавкий металл» (скорее всего, Воклен получил смесь металлического хрома с карбидом хрома. Название нового элемента Воклен решил обсудить с друзьями, которые и предложили слово «хром», что на древнегреческом означает «цвет», опираясь на многообразие цветных соединений нового элемента. Первоначально Воклену эта идея не понравилась — металлический хром по окраске ничем не отличался от других металлов, исключая медь и золото, однако в итоге согласился с предложением друзей.
Рассказывая о своём открытии во Французской Академии наук, Воклен, отметив, тугоплавкость металла, его устойчивость к кислотам и щелочами хрупкость, предположил, что металлический хром вряд ли сможет найти применение, заметив, правда, что соединения хрома могут быть полезны для производства красителей. Действительно, соединения хрома очень разнообразны по окраске. Так и получилось. Правда, временами с этим случался перебор — жёлтый хромат свинца и зелёный оксид хрома какое-то время до появления законодательств о безопасности продуктов питания в девятнадцатом веке применяли для окрашивания цветных леденцов. К счастью, в начале XX века эту порочную практику запретили. Пигмент на основе свинца, хромовый желтый, какое-то время в США называли «хромовый жёлтый автобусный» — с 1939 года школьные автобусы в Штатах стали красить в ярко-жёлтый цвет для большей заметности на дорогах. Где-то в 1990-е годы под давлением общественных и природозащитных организаций токсичный «хромовый жёлтый автобусный», заменили менее опасными органическими красителями.
Наиболее эффективно использовать производные хрома в качестве красителей, правда, получилось не у человека, а у природы, причём неживой. Чистые корунд (оксид алюминия) и берилл (если совсем уж упрощать — образовавшие общую кристаллическую решётку оксиды бериллия, кремния и алюминия) бесцветные и неприметные минералы. Однако, стоит к ним добавить немного хрома, и они превращаются в рубины и изумруды. Красный цвет рубина определяется примесью оксида хрома Cr2O3; при увеличении его содержания (до 1.8 %) окраска становится более густой (цвета «голубиной крови»). Изумруду его зелёный цвет также придает примесь оксида хрома, тут его содержание в кристалле идет даже на сотые доли процента — даже следы Cr2O3 окрашивают берилл, превращая его в бледно-зеленый изумруд.
Обеспечивая окраску всех цветов радуги, хром, тем не менее, может предотвращать образование нежелательной окраски — цвета ржавчины. Коррозионно-устойчивая сталь (или, как говорим мы, «нержавеющая сталь») содержит не менее 11 массовых процентов хрома. Механизм защиты таков — входящий в состав сплава хром образует прозрачный наноразмерный слой оксида, который щитом нерушимым встает между остальным куском металла и кислородом, обеспечивая блеск столовых приборов из нержавеющей стали и хромированных деталей автомобилей и мотоциклов.
Ну и еще одно применение хрома — прививать интерес к химии. Думаю, для многих первым с детства запомнившимся химическим экспериментом был «вулканчик Беттгера» — разложение оранжевой горки бихромата аммония, действительно напоминающее извержение вулкана. Я увидел этот эксперимент на первом школьном уроке химии, но сейчас благодаря обилию организаций, сочетающих учение с развлечением, эту реакцию может увидеть даже дошкольник.
25. Марганец
Школьникам, которые изучают химию, приходится свыкаться с марганцем и его химией дважды — на первых шагах знакомства с химией они должны научиться не путать марганец с магнием.
Те же из них, кто продолжает изучение науки о веществах и материалах, затем, готовясь к ЕГЭ, запоминают, в какие реакции окисления-восстановления вступает перманганат калия (известный большему числу людей как «марганцовка») в воде, кислой и щелочной средах (да, задания, в которых так или иначе фигурирует марганец, составители ЕГЭ очень часто включают в комплект). Естественно, информация о марганце не ограничивается этими знаниями.
Марганец — единственный кроме железа металл, который относят к чёрным металлам. Человечество начало применять соединения марганца довольно рано — первобытные люди обнаружили, что, если посыпать на дрова черный порошок, полученный из растертых темных камней, огонь разгорается легче, — при раскопках стоянок неандертальцев археологи нашли куски минерала с повышенным содержанием диоксида марганца, которые явно терли обо что-то. Сейчас мы знаем вероятную причину этой находки — добавление MnO2 к дровам и сухой лучине снижает температуру воспламенения примерно на 100 °C. В Древнем Египте стеклодувы обнаружили, что, если в смесь, предназначенную для изготовления стекла, добавить минералы, которые, как мы сейчас знаем, являются смесью оксидов марганца, получится стекло гораздо более высокого качества — не зелёное и мутное, как при получении стекла из диоксида кремния и соды, а прозрачное и практически бесцветное.
Химические свойства соединений марганца разнообразны. Марганец может существовать в шести различных степенях окисления, однако в природе, где известно о существовании где-то трех сотен различных минералов марганца, он встречается либо в виде растворимых в воде производных со степенью окисления +2, либо нерастворимых соединений (чаще всего оксидов) со степенью окисления +4. Марганец в степени окисления +3 приспособили для своих целей грибки, вызывающие сухую гниль древесины. Древесина помимо целлюлозы содержит биополимер лигнин, который большинство биологических систем не в состоянии разрушить. Однако грибы научились разрушать лигнин — находящийся в их организме фермент марганецпероксидаза окисляет соединения марганца в степени окисления +2 до марганца +3, которые затем проникают в поры древесины. Высокая активность марганца в степени окисления +3 позволяет разрушать химические связи в лигнине, разрушает полимер на низкомолекулярные соединения, которые становятся пищей для грибков. Эти грибки — не единственные организмы, которые смогли приручить марганец, он представляет собой жизненно важный элемент для всех форм жизни.
Наиболее важная реакция для жизни на Земле — фотосинтез, зависит не только от магния, который содержится в хлорофилле, но и от марганца, который играет первую скрипку в фотосистеме II фотосинтеза, обеспечивающей превращение молекул воды в кислород.
Неудивительна причина путаницы, преследующей марганец и магний. В конечном итоге оба металла получили название в честь одного и того же города — фессалийской Магнесии, где с античности шла добыча руд, как содержащих магний, так и содержащих марганец, и первоначально по названию города все руды называли просто «магнезией». В 1600-е годы магнийсодержащие минералы стали называть белой магнезией (magnesia alba), а руды марганца — чёрной магнезией (magnesia nigra). Какое-то время марганец и магний путали учёные мужи (ну не то, чтобы путали, а считали, что это один и тот же элемент). Только в конце XIX века шведский химик Торберн Бергман предположил, что марганец представляет собой отдельный элемент, не имеющий ничего общего с магнием. В 1774 году Карл Шееле, поддерживавший идею Бергмана, представил их на заседании Королевской Академии наук, а чуть позже в этом же году ещё один представитель шведской химической школы — Юхан Ганн получил чистый образец марганца и доказал, что это действительно отдельный химический элемент. Название «марганец» было принято только в 1807 году.
В наши дни марганец и его соединения применяются во многих областях — перманганаты и диоксид марганца применяются как окислители в органическом синтезе, диоксид марганца использовался и используется в источниках постоянного тока. Тем не менее, основное направление применения марганца — изготовление стали. В 1856 году Генри Бесемер изобрёл способ превращения чугуна в сталь, но при нагревании бессемеровская сталь становилась хрупкой. В том же году Роберт Фостер Муше решил проблему хрупкости — оказалось, что добавка небольших количеств марганца к плавящейся стали делает её прочнее. Химизм этого процесса следующий — марганец отличается более сильным сродством к сере, нежели железо, в результате его взаимодействия с серой или легкоплавкими сульфидами железа образуется тугоплавкий сульфид марганца, который может быть отделён от плавящейся стали как шлак. С 1856 года сталь содержит марганец, а 90 % всего производящегося марганца отправляется на выплавку стали.
Временами название марганца заставляет школьников не только путать его с магнием, но и приписывать ему магнитные свойства. Однако чистый марганец не проявляет магнитных свойств, хотя постоянные магниты можно получить из сплава марганца с алюминием, сурьмой и медью.
26. Железо
На средневековых гобеленах, в фильмах и современных реконструкциях рыцарских сражений мы можем увидеть, как железная броня защищает тело бойца. Но человек не единственный биологический вид, который научился применять железо для защиты. В 2001 году экспедиция исследователей отправилась исследовать гидротермальные источники, выбрасывающие высокоминерализованную горячую воду («черные курильщики») в Индийском океане.
Самым необычным из них была улитка Crysomallon squamiferum, раковина которой содержали железо. Раковина улитки разделена на три слоя. Внутренний слой состоит из карбоната кальция, который встречается в раковинах других моллюсков и в экзоскелетах кораллов. Средний слой, самый толстый из двух, органический, наружный же слой раковины состоит из сульфидов железа. Сегодня неизвестно ни одного другого животного, экзоскелет или скелет которого состоял бы из сульфида железа. Однако, несмотря на то что эта особенность делает Crysomallon squamiferum уникальным среди современных животных, она была характерна для многих древних животных кембрийского периода.
Хладное железо властвует над всем. Железо является одним из самых распространённых элементов. Оно составляет около 5.6 % земной коры и почти всю массу земного ядра. Для Земли характерны формы железа в двух степенях окисления — Fe2+ и Fe3+. Слой трёхвалентного железа очень тонок — он простирается вглубь земной коры всего лишь на несколько метров от её поверхности. Так произошло в результате большого кислородного события, обогатившего нашу атмосферу кислородом, который и окислил верхний слой железа до его трёхвалентных форм, практически нерастворимых в воде. Снижение концентрации относительно доступного и растворимого Fe2+ во времена большой кислородной катастрофы стало проблемой практически для всех живых организмов того времени.
Выжившие во время большого кислородного события наземные и океанские микроорганизмы эволюционировали, научившись вырабатывать растворимые молекулы-сидерофоры, позволяющие восстановить контроль над элементом, важным для их выживания. Сидерофоры содержали хелатирующие железо функциональные группы, которые позволяли снова перевести Fe3+ в раствор. Позднее появились более сложные организмы, включая животные, которые стали использовать энергию окисления углеводов для движения. Железо оказалось важным и для этого процесса. Однако тут возникла другая проблема — в процессе дальнейшей эволюции животным пришлось приспосабливать свой организм не только к тому, что столь нужный для обмена веществ нерастворим в нейтральной воде, но и с тем, что набирать его избыточное количество тоже нельзя — железо токсично.
Максимальное значение для живых систем имеют углерод, азот, кислород, сера, кальций, магний, натрий и, может быть, ещё около десятка элементов, однако ни один из этих элементов не в состоянии принести столь значительный вред живому — свободные ионы железа в крови могут реагировать с её компонентами, образуя пероксиды и свободные радикалы, которые повреждают ДНК, белки, липиды и другие клеточные компоненты, что приводит к болезни, а иногда и к смерти. Смертельно опасны 60 миллиграмм железа на килограмм организма человека. Биологические системы эволюционировали, чтобы поддерживать безопасное содержание железа в организме, а также «закупорить» его в безопасных и полезных формах — этим занимаются ферменты трансферрины и гемосидерины. Однако, эффективность этих ферментов не 100 %-на, и в ряде случаев железо может осаждаться в клетке в опасной для неё форме.
В ряде биологических тканей клетки, содержащие избыточное количество железа, могут быть уничтожены организмом, однако этот процесс не работает для перегруженных железом нейронов. За время свой жизни в организме нейроны управляют тысячами процессов — для этого необходимо формирование нейронных сетей. В процессе развития взрослого человеческого мозга большой процент клеток полностью обновляется, но это происходит постепенно — одновременное прекращение работы большого числа клеток в работающем мозге по какой-то причине невозможно без последствий.
Чаще всего такой причиной, нарушающей работу мозга, является медленное осаждение железа в тканях, которое может продолжаться в течение десятилетий. В менее сложных тканях, таких как клетки печени, заместить повреждённые клетки можно, запуская выработку новых стволовых клеток, однако для продуктивной работы мозга необходимы тренированные, взаимосвязанные друг с другом нейроны, которые накапливаются в течение всей жизни. Таким образом, результат осаждения железа в клетках мозга — медленно прогрессирующие нейродегенеративные заболевания. Тем не менее, природа разработала механизм, защищающий клетки от избытка железа. Существует два или три десятка белков, решающих проблему железа в клетках мозга — эти белки связывают железо и перемещают его из одного участка организма в другой, направляя его в безопасные «контейнеры» — гемоглобин, гемоферритин и трансферрин, однако мутации генов, отвечающих за выработку этих белков могут попадать в клетки уже в виде свободных ионов и, формировать внутриклеточные отложения оксидов и гидроксидов железа, попутно образуя реакционноспособные кислородсодержащие частицы. Оба процесса — и осаждение железа в клетках, и формирование кислородных радикалов лежат в основе процессов старения организма.
Ну и напоследок — в интернете гуляет легенда о «французском химике Мери», который в 19-м веке обнаружил железо в крови, решил подарить возлюбленной кольцо из железа своей собственной крови и, естественно, умер. Это легенда. Во-первых, если и существовал такой французский химик, то он умудрился прославиться, не оставив после себя ни одной статьи и ни одного воспоминания коллег по цеху. Первым предположение о наличии железа в крови сделал итальянский врач Доменико Галеати в 1746 году, доказал это предположение в 1747 году итальянский же химик Винченцо Антонио Менгини.
Ну и небольшой расчет. Содержание железа в крови (в составе гемоглобина) у взрослого мужчины составляет 11–30 мкмоль/литр, то есть в одном литре крови содержится 0.6138–1.674 миллиграмма железа. Даже если мы возьмём максимальное содержание железа и разработаем процесс, который будет «выпаривать железо из крови» без потерь, для того чтобы добыть хотя бы 1 грамм железа потребуется около 600 литров крови. Допустимо сдавать разово 450 мл цельной крови, в год — 5 раз. Следовательно, на получение одного грамма железа должно уйти где-то 270 лет.
27. Кобальт
Я впервые познакомился с соединениями кобальта, а заодно и познакомил одноклассников, когда я был в седьмом классе. Раздобыв в мамином кабинете по химии образец кристаллогидрата хлорида трехвалентного кобальта (CoCl3×6H2O), я начал показывать криптофокусы в области тайнописи — палочкой или даже стальным пером на бумагу наносился бледно-розовый разбавленный раствор соли кобальта, который, высыхая, оставался практически невидимым. Затем бумага аккуратно нагревалось на электрической плитке или даже над пламенем спиртовки, бледно-розовый кристаллогидрат терял кристаллизационную воду, и на бумаге появлялись ярко-синие письмена. Позже я узнал, что цветные соединения кобальта применяют для производства синего и зелёного стекла.
Как и многие другие металлы, кобальт не присутствует в земной коре в свободном виде. Чаще всего в природе его можно встретить в виде сульфидных минералов, чаще всего сопутствующих минералам меди или железа. Из-за того, что кобальт залегает в месторождениях с другими металлическими рудами, зачастую для добычи и производства кобальта ведётся переработка отходов производства меди или железа. Однако, железные и медные месторождения — не единственные потенциальные источники кобальта и других переходных металлов — оксидные минералы кобальта и марганца в значительном количестве можно найти не дне мирового океана.
Тот факт, что кобальтовые руды обычно сопутствуют рудам других металлов, привело к тому, что он был открыт достаточно поздно — в 1735 году его выделил в металлическом виде и очистил шведский химик Георг Брандт. Кобальт встречается и в смешанных рудах, содержащих мышьяк, именно такую руду разрабатывал Брандт, что, возможно и обусловило причины выбора для названия этого элемента. Название «кобальт» происходит от слова «кобольд». Для тех, кто не играет в компьютерные игры и не читает сказки для взрослых, поясню, что кобольды — мелкие и при этом враждебные к человеку персонажи германского фольклора (те кобольды, которые на судах Вильгельма Завоевателя доплыли до Англии, впоследствии сменили фамилию и теперь известны как гоблины). Кобальт стал «гоблинским металлом» из-за того, что мышьяк-кобальтовые руды практически было невозможно обрабатывать, не надышавшись при этом парами соединений мышьяка. Многие металлурги, работавшие с рудой, которую изучал Брандт теряли здоровье и умирали, что воспринималось как месть кобольдов за добычу руды в горах, принадлежащих этому малому народцу, служившему Неблагому Двору Фей.
Кобальт нельзя назвать распространённым в земной коре элементом. Несмотря на то, что это лёгкий переходный металл, который также, как и железо образуется во время вспышек сверхновых, содержание кобальта в Земной коре примерно в 2500 ниже, чем железа. Тем не менее, этот металл важен для жизни и в следовых количествах. Кобальт входит в состав ряда биологически активных веществ, чаще упоминаемых под общим названием «кобаламины» или витамин В12. Кобаламины способствую протеканию ряда биохимических процессов, связанных с реакциями окисления или переноса групп атомов. Одним из недавно обнаруженных следствий дефицита кобаламина является появление клинических депрессий у людей пожилого возраста.
Окрашенные соединения кобальта были известны и применялись уже в третьем тысячелетии до нашей эры — людей древности, как и меня в седьмом классе, привлекла их яркая и насыщенная окраска. В египетских гробницах находят надписи, сделанные кобальтовыми пигментами и содержащие кобальт синие ожерелья. Первое синее кобальтовое стекло, найденное на территории Греции, датируется сотым веком до нашей эры. В Китае во времена династии Тан также применяли кобальт для окраски стекла. Строго говоря, до начала XX века единственное для чего применялся кобальт — изготовление пигментов, однако с развитием металлургии ситуация поменялась.
Кобальт — очень твёрдый твердый металл серебристо-блестящего цвета, один из трёх переходных металлов, проявляющих ферромагнитные свойства в чистом виде (кроме кобальта в эту троицу входят железо и никель). Металл отличается высокой механической прочностью и высокой температурой плавления, он сохраняет магнитные свойства при температуре, самой высокой для всех ферромагнитных элементов. Высокая прочность и температура плавления позволяют использовать кобальт в том, что называется «суперсплавы» — сплавы, сохраняющие прочность при высоких температурах. Суперсплавы и покрытия из кобальта применяют для изготовления таких конструкций, как цепи электропил или турбины реактивных двигателей самолетов.
Магнитные свойства кобальта были использованы японскими металлургами в тридцатые годы они изобрели сплав, материал для постоянных магнитов альнико (alnico magnets), в которые кроме алюминия (Al), никеля (Ni) и кобальта (Co) входило железо. Во второй половине XX века редкоземельные металлы стали основой для более прочных и более сильных постоянных магнитов. Один из таких материалов, сплав самария с кобальтом сохраняет магнетизм при нагревании до 800 °C, не теряя при этом прочности — его применяют в высокоскоростных моторах. Кобальт также применяется в источниках питания, для записи информации на магнитные ленты или жёсткие диски.
Однако элементом кобольдов кобальт быть не перестал. В 1960-е годы некоторые пивоваренные заводы добавляли в свое пиво хлорид кобальта, потому что он помогал стабилизировать пивную пену. К 1967 году более 100 потребителей «пива с кобальтом» начали страдать от сердечной недостаточности, и почти половина из них умерла. Исследования показали, что в описанных случаях вред кобальта наложился на плохое здоровье потребителей пенного напитка. Вскоре после диагностики патологий, получивших название «кардиомиопатия кобальта-пива», применение хлорида кобальта в качестве пищевой добавки было запрещено.
28. Никель
С никелем крепкими узами связан учёный по фамилии Монд, хотя и не он открыл этот элемент, но он, как минимум, обнаружил производное этого элемента, давшее начало целому классу интересных химических веществ — с тремя представителями этого класса работаю я и моя исследовательская группа. То самое обнаруженное Мондом производное никеля когда-то во времена позднего СССР, в те времена, когда ветеринарные клиники не были распространены как сейчас, один из моих старших коллег использовал для избавления от мучений страдавшего терминальной стадией рака кота.
Никель был открыт в 18 веке двумя шведскими химиками — Акселем Фредериком Кронштедтом и Торберном Улафом Бергманом. В 1751 году Кронштедт изучил красный никелевый колчедан (NiAs), получил оксид зелёного цвета, из которого выделил новый металл, названный никелем. Своим названием никель, как и его сосед кобальт обязан злым горным духам. Шахтёры в Саксонии хорошо знали руду, похожую на медную — именно её и изучал Кронштедт. Эта руда даже находила применение — ей окрашивали стёкла в зелёный цвет. Но вот незадача, все попытки получить из этой руды медь оказались неудачными, в связи с чем в конце XVII в. Руду назвали название купферникель (Kupfernickel) — «медь Никкела». Никкел был еще одним персонажем фольклора немецких горняков — по одной версии разновидностью кобольда, по другой — неупокоенным духом шахтера Николаса, которого коллеги бросили в обваливающейся шахте. В любом случае Никкел не желал добра рудокопам, подкидывал им неправильную руду, из которой нельзя было выделить медь, опять же дававшую при обжиге ядовитые пары, содержащие мышьяк. В 1775 году Бергман получил более чистый образец никеля, сделал вывод о том, что этот металл гораздо ближе по свойствам железу, нежели меди.
После разработки промышленного способа выплавки никеля этот металл стал использоваться для изготовления сплавов и нанесения металлических покрытий — никелирование придавало блеска металлическим изделиям, никелевое покрытие защищало металлы от коррозии и какое-то время даже делались попытки использовать никель в ювелирном деле. Но тут старый Никкел показал, что это все же его металл — оказалось, что не корродирующее даже во влажном воздухе никелевое покрытие совсем незначительно растворяется в поте человека, надевающего такое ювелирное изделие, но этого «чуть-чуть растворяется» было достаточно для раздражения кожи, в некоторых случаях переходившего в сильную экзему.
Людвигу Монду — немецкому химику, эмигрировавшему в Великобританию в 1862 году, удалось обнаружить новый класс химических соединений, попутно разработав способ получения высокочистого никеля. Открытие, как это часто бывает, началось с проблемы — в ходе эксперимента Монд пропускал моноксид углерода (СО, угарный газ) через краны и клапаны из никеля и, хотя эти же краны обеспечивали герметичное соединение при работе с кислородом и другими активными газами, СО они не могли удержать. Раз за разом наблюдая, как из-за недостаточно герметичной системы газовых коммуникаций срывается эксперимент, Монд решил выяснить, что же не так с этими никелевыми кранами и обнаружил нечто неожиданное — никель корродировал в токе моноксида углерода, образуя тетракарбонилникель (Ni(CO)4). Так были открыты карбонильные комплексы, полученные затем и для других металлов. Ещё одной неожиданностью для Монда и его коллег было то, что в отличие от соединений металлов, известных в XIX веке и представлявших собой при комнатной температуре либо твердые тела, либо жидкости с достаточно высокой температурой кипения, тетракарбонилникель был легколетучей жидкостью, кипящей при температуре 44 °C. Низкая температура кипения и высокая летучесть тетракарбонилникеля требует особых мер предосторожности при работе — если вдохнуть это вещество, в организме оно разлагается с выделением токсичного ударного газа, попутно формируя отложения никеля на легких. Тетракарбонилникель очень ядовит — его предельно допустимая концентрация составляет 0.0005 мг/м³ (если сравнивать, для хлора она в 60 раз выше — 0.03 мг/м³). Однако Монда привлекла не токсичность обнаруженного соединения, а то, что при нагревании Ni(CO)4 легко разрушается на никель и СО — это давало возможность просто выделять никель из смеси с другими металлами и очищать его (моноксид углерода при этом можно было бы применять повторно).
Монд был не только наблюдательным химиком, но и человеком с коммерческой жилкой. Он запатентовал процесс очистки никеля и организовал компанию, которая могла себе позволить продавать сверхчистый никель дешевле конкурентов. Доходы от продаж шли в развитие, и в 1926 году компания Mond Nickel Company стала одной из четырех крупных химических компаний Британии, слияние которых породило промышленного гиганта Imperial Chemical Industries (в 2008 году ICI вошла в состав промышленного конгломерата AkzoNobel).
В 1960-е годы началось применение никеля в нефтехимической промышленности — немецкий химик Гюнтер Вильке нашёл и внедрил в производство реакции органических соединений, катализируемые никелевыми комплексами. В XX веке появились новые никелевые сплавы особого назначения — инвар (сплав железа с никелем), который практически не расширяется и не сжимается при изменении температуры, монель (сплав никеля с медью), который настолько устойчив к коррозии, что его не берёт даже фтор, нитинол (сплав титана с никелем) — ещё один коррозионно устойчивый сплав, который ещё и обладает памятью формы. Это свойство заключается в том, что если деталь из нитинола сложной формы подвергнуть нагреву до красного каления, то она «запомнит» эту форму. После остывания до комнатной температуры форму детали можно изменить, но при нагреве выше 40 °C она восстановит первоначальную форму. Ну и, наконец, во многих странах никель стал монетным металлом — из него чеканят металлические деньги, а в США до сих пор имеющая хождение монета достоинством в 5 центов носит разговорное название «никель».
29. Медь
Если никель стал монетным металлом сравнительно недавно, то медь используется для изготовления эквивалента товаров с начала товарно-денежных отношений — чеканка монет из меди, серебра и золота начинается с того момента, когда деньги были изобретены. Из трёх древнейших монетных металлов о меди сложилось впечатление как о Золушке: «Золото — хозяйке, серебро — слуге, медяки — ремесленной всякой мелюзге», и, благодаря художественной литературе и фильмам складывается впечатление, что получавшие по несколько медяков в день ремесленники и подёнщики Средневековья еле выживали и при любом удобном случае бежали в условный Шервуд к условному Робину Гуду.
Это не так. Например, в XIV веке в Англии на один медный пенс (тот самый медяк) можно было купить или курицу, или дюжину яиц, или галлон (около 4 литров) дешёвого пива. Медные копейки, введённые в России Петром I (до Петра Алексеевича российская копейка чеканилась из серебра) имели близкую покупательную способность. Понятно, что на несколько медяков в неделю шиковать не приходилось, но свести концы с концами было можно. Можно ли сейчас купить что-то на пятицентовик (в котором на самом деле никеля только 25 %, а остальное — медь), я так и не нашёл.
Скорее всего проблема меди была в другом. Если из серебра и золота можно было и чеканить монеты, и изготавливать ювелирные изделия, то медь явно не годилась на кольца и ожерелья — этот металл будет взаимодействовать с компонентами пота, окрашивая кожу в месте контакта в зелёный цвет.
Историки уверены, что медь — это первый металл, который люди начали добывать и извлекать из руд. Есть исторические свидетельства в пользу того, что инструментами, полученными обработкой металлической меди, пользовались уже десять тысяч лет назад, хотя «официально» энеолит, медный век длился IV–III тысячелетия до н. э. Около тысячи лет человечеству хватило на понимание того, что медь сама по себе металл мягкий, и в ряде случаев инструменты из неё по долговечности уступают традиционному камню, и эра чистой меди сменилась этой её сплава с оловом — наступил Бронзовый век.
В славянских языках происхождение слова «медь» неясно. По одной версии, его предок — древнегерманские слова smida (металл) и schmied (кузнец, ремесленник), по другой — регион, который мог служить источником меди — Мидия. То, откуда произошло международное латинское название меди — cuprum произошло от названия острова Кипр, где в античности существовали медные рудники и производилась выплавка меди. Поскольку на Кипре по легенде родилась Афродита — богиня в том числе и красоты, а первые зеркала делали из отполированных до блеска медных листов, медь быстро стала «женским металлом», и в алхимических традициях соотнесения металла и небесного тела «Семь металлов создал Свет по числу семи планет» изображалась в виде зеркала Венеры.
Переход к железному им нашему, «полимерному» веку не понизил значимость и востребованность меди. Её химическая инертность, относительная дешевизна и высокая электропроводность делают её наряду с алюминием самым распространённым материалом для изготовления проводов. Хотя медь легко подвергается вторичной переработке, и около 80 % всей меди, произведённой человечеством, продолжает использоваться и в наши дни, с 1986 мировая цена на медь выросла в среднем в два с половиной раза.
Медь интересна не только своей ролью, которую сыграла и продолжает играть в развитии человеческой цивилизации как металл — объект мегатоннажного производства. Комплексы одновалентной меди в начале 2000-х годов оказались катализаторами циклоприсоединения по Хьюсгену, ставшего одним из важных процессов, которые относятся к «клик-химии». Этот термин был введен в 2001 году американским химиком Барри Шарплессом для описания быстрых, однозначно протекающих реакций между органическими соединениями, легких в исполнении, а также в выделении и очистке целевого продукта. Такое направление химии интенсивно развивается, позволяя проводить быструю модификацию природных соединений и известных фармацевтических препаратов, разработку новых лекарств, а также создавать новые типы полимерных материалов.
Медь относится к следовым элементам, необходимым для всех высших растений и животных. Практически для всех организмов роль меди сводится к тому, что она присутствует в активных центрах ферментов, ускоряющих процессы окисления/восстановления, тем самым играя значительную роль в процессах усвоения кислорода и клеточного дыхания. В крови головоногих и брюхоногих моллюсков медь входит в состав белка-переносчика кислорода гемоцианина, который выполняет ту же функцию, скажем у кальмара, за которую у человека отвечает гемоглобин. Поэтому кровь осьминогов, кальмаров и каракатиц, обогащённая кислородом будет действительно голубой, однако со вторым признаком благородства происхождения — белой костью, головоногим и брюхоногим не повезло совсем — у них вообще нет костей, ни белого, ни какого-либо другого цвета.
Для взрослого человека рекомендуемая суточная норма потребления меди составляет 0.9 миллиграммов. Дефицит меди может приводить к повышению артериального давления и возрастанию содержания холестерина. Интересно, но перебрать до опасной концентрации медь очень легко — пожалуй, это единственный микроэлемент, для которого различие рекомендуемой и опасной доз очень незначительно — потребление более 3 миллиграмм меди в сутки уже нежелательно. Именно поэтому соли меди (чаще всего медный купорос) применяются как инсектициды и фунгициды, их даже разрешается использовать в «органическом земледелии», хотя насколько это безопаснее синтетических органических пестицидов, применяющихся в традиционном земледелии в дозировках меньших, чем медный купорос — вопрос не простой.
30. Цинк
С точки зрения литературных и общежитейских метафор цинку не повезло. Серые цинковые реки, волны и урны из стихов Бродского, появившаяся в нашей стране с 1980 года страшная фраза «Вернуться домой в цинке». Конечно, цинк, как материал не виноват, что сам по себе он тусклый и серый, а оцинковка — один из самых распространённых способов защиты железа и стали от коррозии.
Цинк, если опять вспомнить Бродского: «Трудолюбив, но незаметен». Он защищает сталь от появления ржавчины, успокаивает солнечные ожоги, препятствует возникновению перхоти, но мы редко обращаем внимание на этот тускло-серый металл. Даже происхождение его названия неясно.
Слово «цинк» впервые встречается в 1650-х годах трудах Парацельса. Возможно это название произошло от немецкого слова «Zinke», означающего «зубец» (мелкие кристаллы металлического цинка действительно похожи на иглы), но это только предположение. Цинк был известен задолго до Парацельса уже римляне использовали не только сплав меди с оловом (бронзу), но и сплав меди с цинком (латунь), однако то, что цинк представляет собой отдельный элемент, не было ясно до семнадцатого века.
Туманное происхождение названия элемента № 30 не даёт возможности приписать его открытие какому-то одному человеку. Косвенные свидетельства позволяют говорить о том, что металлический цинк впервые был получен в Индии уже в двенадцатом веке, самое раннее официальное заявление о получении металлического цинка датируется 1668 годом, процесс извлечения цинка из оксида запатентован в Британии в 1738 году металлургом Уильямом Чемпионом. Тем не менее, лавры первооткрывателя цинка обычно приписывают немецкому химику Андреасу Маргграфу, который в 1746 году описал более эффективный, чем в патенте способ получения металлического цинка и описал его свойства.
Несмотря на запутанную историю цинка, в пользе этого элемента никто не сомневается — оцинковка стали позволяет получать блестящие материалы для крыш, водосточных труб и вёдер. В настоящее время в промышленности преимущественно применяется цинкованием методом погружения, в ходе которого сталь или железо погружают в ванну с цинком, нагретым до 460 °C, что на сорок градусов выше его температуры плавления, для цинкования деталей с особо сложной формой покрытие наносят с помощью электрохимических методов. Первоначально покрытие просто защищает железо от воздуха, однако при механическом повреждении такая защита продолжает действовать — цинк и железо образуют электрохимическую пару, в которой более активный цинк играет роль «жертвенного анода», отдавая железу свои электроны, не давая ему окисляться и защищая его от коррозии длительное время. Для сравнения можно отметить, что другой популярный способ от коррозии — лужение (покрытие оловом) при малейшем повреждении слоя олова начинает способствовать разрушению железа, которое будучи более активным, чем олово, «жертвует» ему свои электроны и корродирует, сохраняя защитный слой. Роль анода цинк играет не только на оцинкованной стали, но и в химических источниках тока. Существуют марганцево-цинковый элемент, серебряно-цинковый аккумулятор и т. д. Так, в щелочных аккумуляторах анод изготовлен из порошкообразного цинка (измельчение цинка увеличивает площадь поверхности электрода, обеспечивая более эффективный перенос электронов), а катод — из диоксида марганца.
Невзрачная окраска цинка теряется, когда мы получаем его сплав с медью — латунь золотистого цвета (внешне латунь бывает так похожа на золото, что, например, потерявший на дуэли нос астроном Тихо Браге носил латунную накладку-протез носа, выдавая её за золотую). Латунные дверные ручки и сантехнические устройства можно найти во многих домах. Латунь — именно она заставляет блестеть трубы духовых оркестров. Да, хотя мы называем валторны, трубы и тромбоны «медными духовыми инструментами», иногда используя эпитет «бронза духовых оркестров», эти инструменты делают не из меди и не из бронзы, а из латуни.
Соединение цинка, а точнее его оксид (ZnO) помогает справиться с последствиями солнечного ожога — его содержат такие средства как паста Лассара, судокрем и цинковая мазь. При нанесении на поражённую кожу оксид цинка уменьшает явления, воспаления и раздражения тканей, образует защитный барьер от действия раздражающих факторов. Оксид цинка, известный также как китайские белила, поглощает ультрафиолет, так что противоожоговые средства с этим веществом будут не только быстрее заживлять ожог, но и экранируют его от дополнительных порций ультрафиолета.
Оксид цинка также входит в состав замедлителей горения и продуктов питания, в составе клеевых композиций и резин. Цинк добавляют в хлопья и мюсли по двум причинам — во-первых, это позволяет сделать эти продукты питания более плотными, и не дает им разваливаться, набухая в молоке или йогурте. Во-вторых, цинк относится к микроэлементам, важным для нашего здоровья (в особенности мужского), и, хотя существуют продукты питания с богатым содержанием цинка, а также витаминно-минеральные добавки, временами производители добавляют цинк в продуты питания (кроме оксида источником цинка является и ацетат цинка — пищевая добавка Е650). Рекомендуемая суточная норма цинка — 11 мг для мужчин и 8 мг для женщин. Соединения цинка (цинк-пиритион) входят в состав шампуней против перхоти, а хлорид цинка в композиции для дезодорантов. Так что и внешне невзрачный и серый цинк в ряде случаев вполне может быть звездой. Кстати, в латунных звёздах шерифов, естественно есть цинк.
31. Галлий
У каждого элемента Периодической системы есть какая-то своя загадка, но, наверное, загадка галлия и его названия — одна из самых интересных. До сих пор идут неофициальные дискуссии о том, в честь чего этот элемент назван, а с другой стороны — если его первооткрывателю так повезло с именем, грех было не воспользоваться этим «бонусом»
Галлий — металл легкоплавкий, он плавится при 30 °C, так что носить его в кармане брюк во время летней жары плохая идея. Есть, конечно, металлы и с меньшей температурой плавления, например, ртуть, но, в отличие от ртути, летучесть галлия крайне низкая. Вообще из всех материалов, известных человеку, при атмосферном давлении галлий остаётся жидким в самом широком температурном интервале — температура его кипения составляет 2400 °C. Галлий одно из немногих веществ, для которых наблюдается аномальная картина плавления (наиболее известным аномально плавящимся и замерзающим веществом является обычная вода, также на это способны висмут и сурьма) — при плавлении плотность жидкого галлия увеличивается и кусочки металлического галлия могут плавать по поверхности расплава, причина такой аномалии до сих пор не выяснена.
Несмотря на все странности поведения галлия, открытие этого элемента не было случайно. Галлий был первым химическим элементом, экспериментальное подтвердившим теоретические выкладки Дмитрия Ивановича Менделеева. Предположив, что с помощью открытого им закона можно предсказывать химические свойства ещё не открытых элементов и в период 1869–71 годов опубликовал ряд соображений на тему, каким должен быть новый элемент, названный им «экаалюминием», вставив его в одну из версий своей таблицы. В 1875 году тридцативосьмилетний французский химик Поль Эмиль Лекок де Буабодран, активно применявший в своей работе появившуюся трудами Кирхгофа и Бунзена спектроскопию — новый в те времена метод идентификации неизвестных элементов, обнаружил в образце извлечённой в Пиренеях цинковой руды фиолетовую спектральную линию, которой там не должно было быть. Предположив, что это след нового элемента, Буабодран начал работу с 52 килограммами этой руды. Французскому химику потребовалось три недели работы в домашней лаборатории, чтобы выделить из половины центнера исходного материала несколько миллиграммов вещества, дававшего ту самую фиолетовую полосу в спектре. Чуть позже, в более оснащённой парижской лаборатории Адольфа Вюрца Буабодрану удалось выделить большее количество нового элемента.
Перед Рождеством 1875 года Лекок представил во французской академии наук 600 миллиграммов нового металла, для получения которых потребовалось переработать 450 килограмм руды. Свойства открытого металла отлично согласовывались со свойствами теоретически предсказанного экаалюминия (на самом деле галлий, открытый Лекоком куда больше был поход на экаалюминий Менделеева, чем полученный Нильсоном скандий на менделеевский экабор) — это было первым подтверждением Периодического закона Менделеева. Как показала дальнейшая история, Буабодран и сам любил теоретические рассуждения и предсказания — вскоре после открытия аргона он высказал впоследствии подтвердившуюся идею о том, что что аргон — лишь первый представитель неизвестного семейства химических элементов. Назвав открытый элемент галлием, Лекок заявил, что это название дается в честь античного названия Франции — Галлии. Вот тут-то и началась интрига. Римское название «Галлия» происходило от латинского слова «галл» — петух (головные уборы галлов напоминали латинянам петушиные гребешки). Одно из имён первооткрывателя галлия — Лекок, также переводится с французского как «петух». И, хотя в 1877 году Лекок даже написал статью, в которой говорил, что отнюдь не имел в виду себя, называя своё открытие, легенда о двусмысленном названии существует и поныне. Буабодран не стал почивать на лаврах, открыв галлий. Впоследствии он занялся открытием и выделением редкоземельных элементов, в чем тоже преуспел.
В наши дни галлий применяется не в столь многих областях — временами металлический галлий и его сплавы применяют как материал для легкоплавких предохранителей для электроприборов. Галлий образует несколько сплавов, жидких при комнатной температуре (в общем случае они называются «галламы», один из них сплав индия, галлия и олова затвердевает только при –19 °C). Жидкие при комнатной температуре сплавы галлия уже много где заменили более опасную и токсичную ртуть — например, в качестве жидких затворов. Несколько лет назад арсенид галлия (Ga3As2) стали изучать как полупроводниковый материал — перспективная замена кремнию для изготовления транзисторов и светоизлучающих диодов. Солнечные батареи из арсенида галлия эффективнее кремниевых и уже применяются для питания космических аппаратов.
Галлий не имеет биологического значения, однако применяется в медицине — его соединения могут использоваться для лечения некоторых состояний онкологических больных и для быстрой остановки кровотечения из глубоких ран. Его производные ускоряют заживление ран и работают как бактерициды.
32. Германий
Германий тот элемент, название которого, хотя и дает аллюзию на «немецкий порядок», на самом деле крайне беспорядочный элемент, который можно было охарактеризовать по-французски — сomme ci, comme ça (ни то ни сё). Соседи сверху германия по Периодической системе — неметаллы углерод и кремний, а снизу — металлические олово и свинец. В итоге германий отличается металлическим блеском, но проводимость у него как у полупроводника. Раньше элементы, которые нельзя было однозначно отнести ни к металлам, ни к неметаллам выделяли в отдельный класс — металлоиды, однако сейчас, вероятно, чтобы не множить сущностей сверх меры, из российской классификации элементов этот термин исчез и германий стали относить к неметаллам.
Германий последний член канонической тройки элементов, свойства которых были предсказаны Менделеевым (на самом деле Дмитрий Иванович предсказывал свойства большего количества элементов, но где-то, как например с экамарганцем-технецием, Менделеев, не имея представления о самопроизвольном распаде атомных ядер, естественно не мог предвидеть, что этого короткоживущего элемента в земной коре просто нет). Свойства германия были предсказаны точнее всего — плотность, серый цвет высокая температура плавления, атомный вес и свойства соединений. Правда, для германия от предсказания до подтверждения свойств прошёл самый большой срок.
В 1886 году немецкий химик Клеменс Винклер выделил новый элемент из минерала аргиродита, обнаруженного недалеко от его родного саксонского города Фрайбурга. Первоначально Винклер планировал назвать новый элемент «нептунием», но за девять лет до его открытия, в 1877 году химик Германн выделил из минерала танталита то, что он ошибочно посчитал новым элементом и назвал его нептунием. Ко времени открытия Винклера открытие Германна было опровергнуто — в танталите не было нового элемента. Считая, что давать элементу ошибочное название неправильно, Винклер назвал новый элемент в честь латинского названия своей страны («правильный» нептуний появится в Периодической системе в 1940 году), взяв за основу её латинское название. В 1870-е годы Германия была новинкой на политической карте мира — она появилась в декабре 1870 года, сменив собой организованный в 1866 году Северогерманский союз.
Пятьдесят лет германий оставался лишь просто заполненной клеткой в Периодической системе ну и живым подтверждением Периодического закона — его промежуточное состояние между металлами и неметаллами не давало возможности придумать, для чего он может пригодиться. Развитие электроники и связанных с ней было технологий показало, что ценность германия как раз состоит в этой двойственности. Будучи полупроводником, материалом, электропроводность которого меньше, чем у металла, но больше, чем у диэлектрика, электропроводность, которую можно регулировать воздействием извне — электрическим полем, облучением, введением легирующих добавок — всё это позволило найти германию область, в которой он смог проявить себя.
Для начала германий стал материалом, который смог заменить один из ключевых электронных приборов, служащих для выпрямления электрического тока — диод. До эры полупроводниковой электроники диод представлял собой вакуумную двухэлектродную электронную лампу, катод которой нагревался до температур, при которых начинал испускать электроны. При подаче на анод отрицательного напряжения все электроны, оторвавшиеся от катода, возвращались на электрод, и электрический ток не протекал через устройство (такое состояние диода называют «запертым»), при подаче на анод напряжения более положительного, чем у катода электроны начинают двигаться направленно к аноду, формируя электрический ток. Диод работает как электронный «ниппель» — позволяет электронам двигаться только в одном направлении.
Полупроводящие свойства германия позволили разработать твердотельный диод, меньший по размеру, чем вакуумная электронная лампа и требующая меньше энергии. Как и все полупроводники, германий может быть легирован добавками, увеличивающими его электронную (доноры электронов, например, мышьяк и сурьма) или дырочную (акцепторы электронов — бор, алюминий) проводимость. Объединение двух образцов германия — с дырочной и с электронной проводимостью позволило создать полупроводниковый диод. Чуть позже германий стал материалом для полупроводникового транзистора — усилителя электрического сигнала. До 1970-х годов транзисторы и диоды изготавливали из германия, но позже германиевые полупроводниковые устройства были вытеснены кремниевыми. Не то, чтобы кремниевые диоды и транзисторы превосходили бы по параметрам германиевые — оба материала давали детали примерно одинакового качества. Просто в 1970-е году уже был намечена тенденция будущей компьютерной и микроэлектронной революции, и, понимая, что рано или поздно компьютер «войдет в каждый дом» производители электроники решили заменить малораспространённый в земной коре германий на один из её главных компонентов — кремний. Ежегодное мировое производство германия составляет около 120 тонн, что конечно бы не хватило на создание работающих сейчас компьютеров, умных телефонов, телевизоров, холодильников и прочей электронной техники.
Наступление «эры кремния» в электронике отнюдь не отправило германий на заслуженный отдых (химические элементы вообще редко выходят на пенсию). Существует целый ряд задач, с которыми может справиться только германий — оптические элементы систем ночного видения, материал для оптико-волоконных кабелей и для устаревшего формата записи компьютерных данных — перезаписываемых дисков DVD.
В отличие от многих других элементов список соединений германия, находящих практическое применение не так широк — сам элемент в виде простого вещества, диоксид германия (GeO2) и тетрахлорид германия (GeCl4), который все равно применяют для получения высокочистых образцов элементарного германия и его диоксида, который, помимо прочего, может применяться как катализатор для получения полиэтилентерефталата — полимера, из которого изготавливают тару для напитков. Предполагается, что германий не токсичен для растений и животных, и это, наверное, единственный неметалл, соединения которого никак не применяются в фармакологии.
33. Мышьяк
В мировой литературе можно найти сюжет про то, как персонаж, известный тёмными делами в молодости, встаёт на дорогу исправления, перевоспитывается и начинает путь служения обществу, временами, правда, давая волю своему тёмному попутчику. Мышьяк вполне бы мог стать героем такого сюжета — соединения элемента, известный с древности как снадобье для отравителей — «король ядов» или «яд королей», сейчас применяется уже в исключительно мирных целях — производные мышьяка используются как инсектициды, пигменты, антисептики для древесины, лекарственные препараты для лечения рака и псориаза и как компоненты пиротехнических составов.
Мышьяк, как и германий, хотя и считается неметаллом, опять же проявляет свойства и металлов, и неметаллов, что и позволяло относить его к металлоидам. В группе Периодической системы, к которой принадлежит мышьяк, все химические элементы, кроме азота токсичны, причём наиболее опасны фосфор, сурьма и, в первую очередь, мышьяк. Токсическое действие соединений мышьяка объясняется тем, что они способны вступать в реакции с фрагментами SH ферментов, дезактивируя их. Инактивация ферментов приводит к нарушению ряда жизненно важных функций в организме, а образующиеся в результате этой реакции арсениты медленно выводятся из организма, попутно повреждая клетки печени. Популярность мышьяка как яда в древние времена связана с тем, что симптомы отравления мышьяком напоминают симптомы холеры, что и позволяло маскировать смерть от отравления под смерть от инфекционного заболевания, которое в те времена вполне могло считаться смертью от естественных причин. Достоверно распознавать отравления мышьяком стало возможно только в начале XIX году. В 1836 английский химик Джеймс Марш разработал для криминалистов качественную реакцию на мышьяк, известную как «проба Марша» (иногда эту реакцию ещё называют реакцией мышьякового зеркала). Первым применением пробы Марша в судебной токсикологии стало рассматривавшееся в 1840 году во французском суде дело об отравлении Шарля Лафаржа его супругой Мари. Судебному эксперту удалось с помощью пробы Марша установить смертельные дозы мышьяка в теле отравленного мужа даже после эксгумации.
Название мышьяка в русском языке происходит от слова «мышь» — его соединения применялись истребления грызунов. Международное название мышьяка на латинском языке — arsenicum, заимствованное греческое слово «arsenicos», которое, в свою очередь является греческой вариацией персидского слова «зарник», означающего аурпигмент (одно из названий руды мышьяка, известной как желтая мышьяковая обманка). Созвучное греческому названию мышьяка слово «arsenikon» означает «обладающий мужской силой», что породило легенду о том, что в отсутствие виагры её роль могли выполнять производные мышьяка. Сложно сказать, использовали ли в античности аурпигмент как возбуждающее средство, но точно известно, что эта мышьяксодержащая руда — трисульфид мышьяка (As2S3) применялась как пигмент уже при отделке древнеегипетских гробниц.
Мышьяк образует несколько аллотропных модификаций. Одна из них — жёлтый мышьяк, выглядит как типичный неметалл, а вторая — хрупкое вещество серо-зелёного цвета, которое называют серый или «металлический» мышьяк. Эти модификации различаются не только цветами. Плотность жёлтого мышьяка — 1.97 г/см3, а серого — 5.73 г/см3. Наиболее стабильной модификацией является серый мышьяк, который плавится при 817 °C. Серый мышьяк легко окисляется кислородом с образованием короля ядов или яда королей — «белого мышьяка», который уже не аллотропная модификация мышьяка, а его оксид — As2O3. Запах белого мышьяка напоминает запах чеснока, и до появления пробы Марша отравление мышьяком диагностировали по чесночному запаху, исходящему от потерпевшего. Иронично, но в 2001 году появилась статья, в которой говорилось о том, что небольшие дозы чеснока могут стать защитой от хронического отравления малыми дозами мышьяка, попадание которых в организм может быть связано с низким качеством питьевой воды (конечно, эксперименты проводились на лабораторных животных).
Хроническое отравление мышьяком в наши дни в отличие от острых отравлений прошлого не носят антропогенный характер. В ряде стран из-за эрозии местных горных пород мышьяк попадает в колодцы и другие источники питьевой воды (наиболее страдает от этого Бангладеш). Симптомы хронического отравления мышьяком начинают проявляться с изменения пигментации кожи и её ороговения (гиперкератоза). Через десять лет постоянного потребления загрязнённой мышьяком воды повреждение кожи перерождается в злокачественные образования кожи. Проблема с мышьяком в питьевой воде была обнаружена в 1990-е годы. С тех пор методы очистки водопроводной воды от мышьяка были модернизированы, людям, пользующихся колодцами и водоёмами разъясняли, какие источники воды безопасны. Однако проблема стоит ещё остро. По оценкам Всемирной организации здравоохранения на 2018 год до 20 миллионов из 45 миллионов жителей Бангладеш подвергаются риску воздействия мышьяка в концентрациях, превышающих национальный стандарт, равный 50 мкг/литр, и рекомендуемую величину ВОЗ, равную 10 мкг/литр.
Ну и напоследок — хотя соединения мышьяка вряд ли когда-то смогли подарить кому-то фантастические эротические ощущения, то на «афтепати» от таких ощущений мышьяк мог присутствовать, начиная с XX века. В 1910 году Пауль Эрлих, двумя годами ранее разделивший с Ильёй Ильичом Мечниковым Нобелевскую премию по физиологии и медицине разработал мышьяксодержащее соединение сальварсан, которое успешно применялось для лечения сифилиса. Сальварсан и его улучшенная версия — неосальварсан, были первые химиотерапевтическими препаратами направленного действия, которые были синтезированы в лаборатории.
34. Селен
Для школьников и студентов, изучающих общие вопросы химии, селен представляется чем-то вроде обратной стороны Луны — известно, что он есть, но что он собой представляет?
В Периодической системе селен расположен в той же группе, что и сера. В большинстве учебников и учебных пособий информация о селене ограничивается упоминанием того, что он, как и сера образует аллотропные модификации, а также образует кислоты, подобные тем, что образует сера. Нет худа без добра — зачастую школьные учителя и преподаватели вузов любят давать задания из серии «Используя ваши знания о свойствах серы, предскажите свойства селена и его соединений». Но, право, селен достоин большего, чем быть просто очередным упражнением на знание Периодического закона.
Селен — один из тех многих элементов, которые с одной стороны важны для жизни, а с другой — при приеме внутрь большого количества этого элемента, токсичны. Для среднестатистического человека безопасным считается потребление ежедневное потребление 400 микрограммов селена в различных формах, суточная потребность в этом элементе составляет 70–100 микрограмм. Селен входит в состав активных центров ферментов, являющихся естественной защитой организма от реакционноспособных кислородсодержащих частиц, также он вовлечен в процессы, отвечающие за нормальную работу щитовидной железы и задействован в биологических процессах, тормозящих развитие вирусных инфекций. Селен входит в состав многих орехов, морской рыбы (в первую очередь тунца) и морепродуктов. В наших широтах передозировки селена можно не опасаться, более того, как показывали исследования 27 регионов Российской Федерации 1999 года, дефицит селена наблюдался у 80 % россиян. Правда, в соответствии с исследованиями 2012 года, в Дальневосточном федеральном округе обнаружено оптимальное для здоровья потребление селена, но это не отражает масштабы всей нашей страны — не нужно забывать, что именно в этом регионе доля морепродуктов в рационе выше, чем в среднем по России, поэтому врачи часто рекомендуют принимать селенсодержащие БАД.
Селен был открыт в 1817 году. Шведские химики Берцелиус и Готлиб Ган нашли его в качестве примеси, содержащейся в серной кислоте. К тому времени уже был открыт ещё один элемент подгруппы серы — теллур, и первоначально обнаруженный осадок был принят химиками именно за этот элемент. Позднее, выяснив, что это не теллур, а новый элемент, Берцелиус назвал его селеном в честь греческого слова, обозначающего Луну (вероятно, противопоставляя теллуру, названному в честь земли). Селен образует несколько своих минералов, сопутствующих минералам серы и сам встречается в её месторождениях.
Роль селена в обмене веществ, причины его токсичности и дозы, при которых может произойти острое или хроническое отравление, стали известны на рубеже XX и XXI веков. Немалую роль в этом сыграли систематические исследования жертв хронического селенового отравления в Китае, возделывавших зерно над залежами каменного угля, богатыми селеном. Отравление селеном — селеноз вызвано действием солей селенатов и селенитов, сам по себе селен. Симптомами отравления селеном являются чесночный запах при дыхании, выпадение волос, утомляемость, раздражительность и повреждения печени, которые могут переродиться в цирроз или злокачественные образования.
Хотя многие аллотропные модификации селена напоминают те, которые образует сера, селен обладает некоторыми уникальными аллотропами с интересными свойствами. Наиболее интересна модификация «серый селен», состоящая из длинных цепочек атомов селена, самоорганизованных в спирали. Селен не относится к металлам, и большая часть его аллотропных модификаций не проводит электрический ток, но серый селен — хороший фотопроводник, он применялся в первых солнечных батареях. И в наши дни селен и его соединения применяются в фотогальванике. Новейшим и самым перспективным примером применения селена является изготовления квантовых точек — фрагментов проводника или полупроводника, настолько малых, чтобы в них становилось существенным проявление квантовых эффектов. Чаще всего материалом для квантовых точек выступает селенид кадмия (CdSe). Первоначально рабочие барабаны лазерных принтеров и копировальных машин делали из селена, но сейчас селен в них, как правило, заменен на органические фотопроводники.
Применение селена не ограничивается БАДами, шампунями для укрепления корней волос, и фотогальваникой. Аллотропную форму, известную как «красный селен», добавляют в стекло для окрашивания в красный цвет, его добавляют в синтетический каучук, придавая ему устойчивость к механическому истиранию, вводят в состав новых сортов бронзы. Возможно, самое необычное применение селену нашла природа. Вещество бутилселеномеркаптан (С4H9SH) — главный ингредиент запаха скунса. Это один из самых зловонных, резких и устойчивых запахов в мире, он напоминает комбинацию запахов гниющей капусты, чеснока, лука и нечистот одновременно. Человеку достаточно 2×10–12 грамм, чтобы почувствовать наличие этого вещества в воздухе. Что же ощущают обладающие лучшим, чем мы обонянием животные, которым не посчастливилось встретиться со скунсом, остаётся только догадываться.
35. Бром
Бром пахнет менее интенсивно, чем выделения скунса, однако в его названии есть указание на дурной запах. Ещё пятьдесят-шестьдесят лет назад ежегодное производство брома составляло 300 миллионов тонн, и он (в виде бромида серебра) применялся в чёрно-белой фотографии, бромид калия врачи прописывали как успокоительное, дибромметан добавляли в этилированный (содержащий в качестве присадки тетраэтилсвинец) бензин и окуривали им продовольственные склады, летучие броморганические соединения применялись в огнетушителях. Сегодня практически все эти эти примеры применения брома можно считать устаревшими.
История брома начинается в 1826 году. Молодой фармацевт Антуан Жером Балар, изучая рассолы средиземноморских соляных промыслов обнаружил образование маслообразной жидкости красного цвета. Предположив, что он обнаружил новый элемент, Балар отправил результаты своих наблюдений во французскую академию наук, которая подтвердила факт открытия. Сам Балар предложил новому элементу название «мурид» (от латинского muria — рассол), однако вскоре Жозеф Гей-Люссак переименовал элемент в бром (от древнегреческого «бромос» — дурной запах, зловоние).
В наше время бром перестали применять отчасти из-за того, что в некоторых бромсодержащих продуктах отпала нужда, отчасти из-за того, что производные этого элемента могут вызывать повреждение озонового слоя. Летучие броморганические соединения способны диффундировать в стратосферу, достигая озонового слоя, где атомы брома оказываются в 50 раз более опасными для нашей естественной защиты от ультрафиолета, чем атомы хлора. Мы чаще вспоминаем Монреальский протокол, как международное соглашение, запрещающее или ограничивающее использование хлорфторуглеводородов (фреонов), однако в этом же соглашении указано, что подписавшие его страны к 2010 году обязуются отказаться от применения летучих броморганических соединений — в особенности от применявшегося в качестве фумиганта бромметана (CH3Br) и применявшегося для пожаротушения электрического оборудования бромдифторхлорметана CBrClF2.
Казалось, самым опасным бромсодержащим веществом, подлежащим запрету, был бромметан, однако, как показала практика, полностью отказаться от применения этого вещества было невозможно. Бромметан, температура кипения которого составляет 3.5 °C, используемый для обеззараживания растительных материалов от щитовок, ложнощитовок и мучнистых червецов, для борьбы с вредителями овощей и фруктов, а также для обработки древесины и почвы (в почве, подвергшейся обработке бромметаном, существенно снижается количество нематод). Как показали исследования, проведённые уже после подписания Монреальского протокола, показали, что, несмотря на низкую температуру кипения, половина бромметана, распыляемого на почву, не испаряется, так как полностью усваивается почвенными бактериями. Также оказалось, что большая часть броморганических соединений в атмосфере не антропогенная по происхождению — планктон и водоросли ежегодно обогащают атмосферу миллионами тон бромметанов, главным образом — бромоформом (CHBr3).
Ещё более удивительным оказалось то, что в мировом океане существует источник пентабромдифенилового эфира, который в своё время производили как антипирен. В 2005 году это вещество было обнаружено в подкожном жире китов и первоначально предполагалось, что всё это следствие загрязнения океана человеком. Более детальное исследование показало, что найденный в организме китов пентабромдифениловый эфир содержит достаточное количество радиоактивного углерода 14C, указывающего на биосферное происхождение вещества. Синтетический антипирен производят из нефтяного сырья, в котором углерод 14C отсутствует. Ещё одно сложное броморганическое соединение со дна океана — пурпурный краситель, которым красили облачение римских и византийских императоров. Пигмент, носивший название «тирский пурпур», получали из организма средиземноморских моллюсков Murex brandaris. Основной компонент этого пигмента 6,6’-диброминдиго.
Если вред органического брома для атмосферы, вероятно, был преувеличен, неорганические соединения брома могут быть опасны для водных ресурсов. Наиболее опасными производными брома считаются броматы, (вещества, образующие при электролитической диссоциации ион BrO3—), нормы содержания которых в питьевой воде очень низки. К несчастью, обычно содержащиеся в воде бромид-ионы могут окисляться до броматов хлором или озоном на стадиях обеззараживания воды. В итоге, сейчас бром наиболее широко применяется в фармацевтике и медицинской химии, где броморганические соединения чаще всего выступают в качестве полупродуктов для производства лекарственных препаратов.
36. Криптон
Иногда названия минералов могут сыграть с нами злую шутку — мы привыкаем к том, что залегающее в земной коре химическое вещество связано своим названием с минералом в его составе, однако бывают и исключения (сам как-то раз писал на Всероссийскую химическую олимпиаду про минерал «селенит», который не имел отношения к селену). В одном я уверен — вряд ли кто из читателей думает, что даже во вселенной DC элемент под названием криптон может входить в состав криптонита. Законы Вселенной везде одинаковы, и на родине Супермена элемент № 36 тоже должен проявлять свойства инертного газа.
Криптон, наряду с ксеноном и неоном, был обнаружен в 1898 году в ходе одного длительного эксперимента, который провели Уильям Рамзай и его коллега Моррис Уильям Траверс. После выделения аргона из воздуха Рамзай решил выяснить, какие ещё компоненты содержится в нём и вместе с Траверсом поставил эксперимент по постадийному испарению сжиженного воздуха. Сначала был получен жидкий воздух, который исследователи медленно испаряли, собирая отдельно каждый из компонентов. После того, как испарились лёгкие компоненты воздуха осталась фракция, спектральный анализ которой выдавал наличие в ней нового элемента. Дальнейшие эксперименты позволили разделить эту фракцию на два компонента, один из которых и получил название «криптон» (от греческого «криптос» — тайный, скрытый). Вторым компонентом смеси был еще более тяжелый газ — ксенон. До сих пор при промышленном получении криптона и ксенона первоначально проводят грубое фракционирование воздуха, получая криптон-ксеноновую смесь, которую затем подвергают более тонкому разделению. Из-за небольшого содержания криптона и ксенона в воздухе сразу получить из него чистые криптон и ксенон невозможно.
Как и другие инертные газы криптон не имеет ни цвета, ни вкуса, ни запаха. В одном кубическом метре воздуха содержится около кубического сантиметра криптона. В атмосфере Земли криптон образуется в результате радиоактивного распада тория и урана, протекающего в земной коре и не только. Любопытно, что поскольку большая часть ядерных реакторов, построенных человечеством, построена в северном полушарии Земли, концентрация криптона в атмосфере у северного полюса Земли примерно на 30 % выше, чем у южного. Криптон — самый легкий из инертных газов, соединения которого могут существовать при положительной температуре. Дифторид криптона (KrF2), впервые полученный в 1960-е годы, разлагается при 20 °C. Это вещество настолько активно, что может окислить металлическое золото до степени окисления +5.
Низкая распространённость криптона (и его высокая стоимость) ограничивает его практическое применение. Его применяли для заполнения ламп накаливания для предотвращения преждевременного перегорания вольфрамовой спирали. Криптон также закачивали между стеклами двойного стеклопакета окон и рам для теплоизоляции (тяжёлый газ плохо проводит тепло), однако и для лампочек, и для теплоизоляции применение аргона более выгодно благодаря соотношению цена/качество.
Всё же некоторые свойства криптона уникальны. При ионизации газообразный криптон испускает яркий белый свет, что позволяет использовать содержащие криптон лампы для вспышек в высокоскоростной фотографии. Способность криптона образовывать устойчивые фториды дала возможность создания криптон-фторидных лазеров. С 1960 по 1983 год криптон, точнее его нуклид 86Kr, был очень важен для измерений и метрологии — в то время в СИ метр определялся через длину волны оранжевой линии в спектре этого атома. Ну и, конечно, криптоном заполняют «неоновые» лампы (см. главу про неон). В отличие от газоразрядных ламп, заполненных неоном, лампы с криптоном дают бледно-розовое излучение.
37. Рубидий
История рубидия началась в 1859 году, когда Роберт Бунзен и Густав Кирхгофф скомбинировали в одном устройстве горелку Бунзена и призму Ньютона, расщепляющую пламя горелки на составляющие, создав устройство под названием «спектроскоп», и в аналитической химии началась новая эпоха.
Рубидий был одним из элементов, открытых непосредственно Бунзеном и Кирхгоффом — при внесении в пламя горелки спектроскопа образца минерала лепидолита в спектре были обнаружены не соответствовавшие ни одному из известных элементов ярко-красные спектральные линии, что позволило дуэту немецких химиков предположить наличие в породе неизвестного элемента, после чего они выделили его из руды. Название рубидий происходит от латинского слова «rubidus» (интенсивно-красный, рубиново-красный), указывающего и на цвет линий в спектре, позволивших обнаружить рубидий и на то, какую окраску придают чистые образцы соединений этого элемента бесцветному пламени газовой горелки.
С одной стороны, рубидий нельзя назвать «химической экзотикой» — это шестнадцатый по распространённости в земной коре химический элемент, его примерно столько же, сколько меди. С другой, в отличие от той же меди, рубидий не относится к минералообразующим элементам — он не образует собственных месторождений, а встречается только как примесь в минералах щелочных металлов. Большую часть сырья для производства рубидия извлекают из лепидолита, в котором он был обнаружен, хотя основная причина разработки лепидолитовых руд добыча не рубидия, а лития. Металлический рубидий получают из его хлорида, восстанавливая металлическим кальцием при 750 °C и пониженном давлении.
Рубидий представляет собой один из щелочных металлов, населяющих первую группу Периодической системы. У всех щелочных металлов на внешнем (определяющем химические свойства) электронном уровне находится по одному электрону, который очень легко оторвать. Это делает щелочные металлы лёгкой добычей таких окислителей, как кислород, галогены или вода. Чем тяжелее щелочной металл, тем дальше единственный электрон внешнего слоя удалён от ядра, тем меньше электростатическое взаимодействие ядро атома — электрон, и тем проще его оторвать, то есть рубидий гораздо активнее лития и натрия и заметно активнее калия. Так, если натрий и калий, контактируя с воздухом, просто медленно окисляются, образуя на своей поверхности плёнку, являющуюся смесью пероксидов, гидроксидов и карбонатов, от контакта с воздухом рубидий может самопроизвольно возгораться, горя ярко-красным пламенем. Хранить металлический рубидий еще сложнее, чем натрий или калий.
Рубидий — элемент чрезвычайно ценный для геологов. Рубидий в земной коре состоит из двух изотопов — стабильного 85Rb, на который приходится около 72 % и радиоактивного 87Rb, период полураспада которого составляет 49.2 миллиарда лет (это примерно в 11 раз больше геологического возраста Земли или в 3,5 раза больше возраста нашей Вселенной). Радиоактивный 87Rb претерпевает β-распад с образованием стабильного нуклида 87Sr. Этот процесс позволяет геологам проводить датировку минералов и горных пород, измеряя соотношение радиоактивного рубидия и продукта его распада.
Рубидий можно назвать «металлом-брахманом», его практически невозможно найти в повседневно окружающих нас технологиях, однако в исследованиях, в особенности в получении знаний чистой теоретической физики, он незаменим. Рубидий используется в атомных часах (хотя атомные цезиевые атомные часы точнее, рубидиевые компактнее и проще устроены). Работа рубидиевых атомных часов основана на переходе между двумя сверхтонкими энергетическими уровнями нуклида 87Rb. За год ошибка хода рубидиевых атомных часов составляет не более 50 миллисекунд.
Рубидий также применяется для изучения необычных свойств такого агрегатного состояния материи, как конденсат Бозе-Эйнштейна. В этом состоянии материал охлажден до температур, близких к абсолютному нулю. Сильное охлаждение приводит к тому, что достаточно большое число атомов оказывается в своих минимально возможных квантовых состояниях и квантовые эффекты начинают проявляться на макроскопическом уровне. Теоретически существование такой формы материи было предсказано в 1925 году Альбертом Эйнштейном на основе работ индийского физика Шатьендраната Бозе. До конца XX века проверить теорию не было возможности — не существовало технологий, способных охладить вещество до таких температур. Первый конденсат Бозе-Эйнштейна был получен в 1985 году Эриком Корнеллом и Карлом Виманом из Университета Колорадо. Исследователи использовали газ из атомов рубидия 87Rb, охлаждённый до 1,7×10−7 К. За этот прорыв им была присуждена Нобелевская премия по физике 2001 года.
Рубидий не представляет особой опасности для человека — все его соединения хорошо растворимы и быстро выводятся. Хлорид рубидия применяли для изучения транспорта ионов калия по организму человека — при его введении в органы обмен веществ пускает его по тем же дорожкам, что и калий, и, отслеживая перемещения ионов рубидия, можно было составить представление о том, как перемещается калий. Тенденция накопления ионов калия опухолевыми клетками позволила разработать способ локализации опухолей мозга с помощью радиоактивного нуклида 82Rb. В 1970-е годы проводились исследования на тему, можно ли использовать хлорид рубидия как антидепрессант для человека (на обезьян он действовал именно так), однако единственное, что удалось выяснить — то, что 23 грамма рубидия (в составе хлорида), которые принимали добровольные участники эксперимента в течение 75 дней, не вызвали в их организме никаких побочных эффектов.
38. Стронций
Моё близкое знакомство с соединениями стронция состоялось в 2011 году, когда я заживлял перелом лодыжки. Хирург, который «вёл» меня, сказал примерно то, что я знал и сам — стронций будут включаться в состав растущей костной ткани также успешно, как кальций, но, не подходя по размеру кальциевым клеточным каналам, не станет причиной развития некоторых побочных эффектов. Теоретически про возможность встраивания стронция в костную ткань, и чем это может грозить, я знал где-то с 1986 года.
В 1787 в Университет Эдинбурга был доставлен необычный минерал из свинцовой шахты, расположенной около маленькой деревушки на берегах озера Санарт на западе Шотландии. Первоначально предполагалось, что эта руда содержит барий. Спустя три года Эдэр Кроуфорд опубликовал статью, что в руде содержатся вещества, образованные новым химическим элементом. Другой химик из Эдинбурга — Томас Хоуп позже получил целый ряд соединений этого элемента, еще раз показав, что это не барий — соединения бария окрашивали пламя свечи в жёлто-зелёный цвет, в то время, как вещества, выделенные из минерала, заставляли свечу гореть красным цветом. Наконец, в 1808 году руда попала в Лондон, где Хэмфри Дэви с помощью электролиза выделил из неё тот самый элемент — активный серебристый металл. Деревушка в Шотландии называлась Стронтиан, обнаруженный около неё минерал получил название «стронтианит», и элемент стал называться стронцием.
В наши дни красные вспышки салюта или красные сигнальные огни обязаны своим появлением переходам электронов между уровнями атома стронция в составе нитрата или карбоната — именно производные стронция чаще всего применяют для получения горящих красным цветом пиротехнических составов. Химические черты стронция очень похожи на свойства его соседей по группе — щелочноземельных металлов — кальция и бария. Блестящая серебристая поверхность стронция быстро тускнеет и желтеет при контакте с воздухом из-за быстрых реакций с кислородом. Естественно, высокая химическая активность стронция позволяет ему существовать в земной коре только в виде соединений. Кроме стронтианита (карбоната стронция) известной стронциевой рудой является голубой целестин, сульфат стронция, который некоторые жители сельской области в английском графстве Глостер использовали, чтобы обозначить дорожки в садах.
Если не считать применения в пиротехнических составах, практических областей применения у стронция немного — карбонат стронция можно было найти в кинескопах телевизоров с электронно-лучевыми трубками, из ферритов стронция можно изготавливать постоянные магниты, а металлический стронций применяют в получении урана. Один из нуклидов стронция — радиоактивный 90Sr имеет дурную репутацию. Период полураспада этого атома составляет 29 лет, и он относится к тем радионуклидам, которые особенно опасны для человека (радиоактивные атомы с большими периодами полураспада дают малоинтенсивное излучение, которое не опасно для живых организмов, короткий период полураспада способствует быстрому разрушению радиоактивных частиц, а вот нуклиды, период полураспада которых соотносим со временем жизни человека наиболее опасны). Образовавшийся в результате ядерных испытаний с 1945 по 1970-е годы, 90Sr по системе пищевых цепей: трава — домашние травоядные — молочные продукты попадал в организм людей, и уже исследования 1950-х годов нашли этот радионуклид в молочных зубах. Стронций может накапливаться и в костях, и, если, стабильные изотопы стронция заживляют сломанную кость без последствий, применяются в лечении остеопороза, то внедрение в костную ткань 90Sr обеспечивает человека «внутренним» источником радиоактивного излучения, что, конечно печально. В 1986 году после аварии на Чернобыльской АЭС в окружающую среду попало значительное количество 90Sr.
У стронция есть и ещё одно интересное применение — измерение изотопного состава стронция, накопленного в костях, и информация о том, что в растительной пище содержание стронция выше, чем в пище животного происхождения, позволяет антропологам и археологам делать выводы об особенностях питания наших предков. Например, в 2014 году австрийские антропологи, определив соотношение кальция и стронция в костях гладиаторов, предположили, что труженики арены, крови и песка были вегетарианцами, потреблявшими только ячмень, бобы и сушёные фрукты (PLoS ONE, 2014, 9(10): e110489). Впрочем, если подумать, что добровольный переход к вегетарианству мода сравнительно новая, а вот вынужденных вегетарианцев, просто не имевших возможности потреблять пищу животного происхождения во все века человечества было много, предположение кажется не таким уж и нелепым. Не факт, что ланисты гладиаторских школ считали необходимым часто кормить свою собственность мясом.
39. Иттрий
Ещё три десятка лет назад даже немногие химики могли рассказать что-то интересное про иттрий. Глядя на Периодическую систему, можно было сказать, что иттрий находится в побочной подгруппе третьей группы между скандием и лантаном. Кто-то мог вспомнить, что иттрий наряду с иттербием, эрбием и тербием назван в честь небольшого шведского города Иттербю, в окрестностях которого была обнаружена руда иттербит (помимо прочего из неё выделили скандий, о чем речь шла выше).
Кто-то мог припомнить историю открытия иттрия — то, как финский химик Юхан Гадолин выделил из иттербита оксид элемента, который, как показал позже Карл Мосандер, являлся смесью оксидов иттрия, эрбия и тербия. Металлический иттрий, содержащий примеси эрбия, тербия и других лантаноидов, впервые был получен в 1828 году Фридрихом Велером. Близость свойств и истекающая из этого сложность разделения редкоземельных элементов и была причиной того, что долгое время эти элементы практически не привлекали внимания учёных.
Ситуация изменилась в 1986 году, когда работавшие в IBM Георг Бердноц и Карл Мюллер обнаружили, что оксид лантана-бария-меди (La5−xCu5O5(3−y)) становится сверхпроводимым при рекордно высокой температуре — 35 Кельвинах (Z. Phys. B., 1986, 64 (1): 189–193). Говоря проще, при –238 °C электрическое сопротивление образца пропадало. В 1987 году Бердноц и Мюллер получили за своё открытие Нобелевскую премию по физике, что простимулировало других ученых поискать искать другие высокотемпературные сверхпроводники среди соединений других лантаноидов.
В 1987 году Мо-Куен Ву и Пол Чу, объединив усилия своих исследовательских групп из Университетов Алабамы и Хьюстона, выяснили, что оксид иттрия-бария-меди (YBa2Cu3O7, часто его упоминают просто как YBCO) становится сверхпроводимым ещё при более высокой температуре — 95 Кельвинах (–178 °C) (Physical Review Letters., 1987, 58 (9): 908–910).
С общежитейской точки зрения и –238 °C, и –178 °C сложно назвать высокими температурами, однако открытие Ву и Чу означало, что для поддержания сверхпроводящего состояния YBCO достаточно охлаждать его жидким азотом, в то время, как для перевода оксида лантана-бария-меди в сверхпроводящее состояние нужно было охлаждать его более дорогим жидкими гелием. Конечно, главная цель всех исследователей, занимающихся поиском сверхпроводящих материалов — вещество, которое сохраняло бы сверхпроводящее состояние хотя бы при комнатной температуре, но пока эта цель недостижима.
Применение YBCO могло бы значительно удешевить ряд современных технологий, основанных на применении сверхпроводимых материалов, например, магниты МРТ можно было бы охлаждать жидким азотом, что понизило бы расходы на эксплуатацию этих аппаратов, но внедрению этого соединения иттрия в повседневные технологии препятствует ряд причин. Во-первых, для того, чтобы потерять электрическое сопротивление при 95 K, в YBCO должно приходиться чуть меньше семи молей атомов кислорода на один моль атомов иттрия, а такое соотношение не так просто достичь. Во-вторых, YBCO жёсткий и хрупкий, а для практического применения было бы желательно его применение в виде гибких плёнок или эластичных проводов Исследователи пытаются разработать сверхпроводящие гибкие и эластичные композиты, содержащие YBCO, но пока значительных успехов в этой области не достигнуто.
Другая область применения иттрия — синтетические минералы, наиболее известным из которых является иттрий-алюминиевый гранат (Y3Al5O12, YAG; Journal of Materials Science., 2000, 35: 713–717). Твердость такого «граната» велика, составляет 8.5 единиц по шкале Мооса, что позволяет использовать YAG как имитацию алмазов для ювелирных изделий. Если же в иттрий-алюминиевом гранате заменить около процента атомов иттрия на неодим, получится рабочее тело для лазера, излучающего в видимой области, YAG с эрбием позволяет получить инфракрасный лазер. Иттрий-алюминиевый гранат, в который ввели трёхвалентный церий, используется в конструкции белых светодиодов.
В настоящее время производные иттрия также применяются в топливных ячейках, вырабатывающих энергию. Небольшое количество оксида иттрия добавляют к оксиду циркония, получая керамический материал «иттрий-стабилизированный оксид циркония» (Acta Materialia., 2009, 57 (18): 5480–5490). Необычное свойство этого сорта керамики в том, что она может проводить оксид-анионы, что даёт возможность применять её и в топливных генераторах электрического тока, и в системе контроля выхлопных газов двигателей внутреннего сгорания, определяющей содержание кислорода в выхлопе и оптимизирующей подачу воздуха в двигатель.
40. Цирконий
Наверное, большая часть населения нашей страны (и других стран постсоветского пространства) узнала о существовании циркония в 1990-е годы, когда воодушевлённые рекламой, вложенной в уста любимых артистов: «Ношу браслет, и всякое давление пропало!», люди, получившие самое лучшее советское образование, массово заказывали «лечебные циркониевые браслеты».
На деле, изделия из циркония стали популярными в изготовлении ювелирных изделий гораздо ранее — с середины 1970-х годов. Речь, правда, не идёт о металлическом цирконии, а о синтетической кубической форме диоксида циркония (ZrO2), технология выращивания которой была разработана в Физическом институте Академии наук СССР (Успехи химии, 1978, Том 47, Номер 3, Страницы 385–427). По сокращённому названию института (ФИАН) эти камни были названы «фианитами». За рубежом искусственно синтезированный оксид циркония называют цирконитом.
Название элемента циркония происходит от персидского слова «заргун» — название золотисто-жёлтого камня, известного с античных времен как «циркон» — ортосиликата циркония ZrSiO4. Кроме золотистых цирконов известны и сероватые, и розовые, и красные, и бесцветные формы.
В средние века интенсивно преломлявшие свет бесцветные кристаллы циркона ошибочно принимали за отличающиеся меньшей твёрдостью «алмазы второго сорта», украшали ими ювелирные изделия и даже властные регалии. То, что циркон не имеет отношение к алмазам, стало ясно в 1789 году, когда немецкий химик Мартин Клапрот проанализировал один из таких камней и сделал вывод о наличии в нём нового элемента, который и назвал «цирконием» по названию минерала. Металлический цирконий был получен спустя 35 лет Йенсом Берцелиусом. В наши дни фианиты и циркониты также применяются в ювелирном деле — их коэффициент преломления выше, чем у алмазов, и они блестят лучше обычных алмазов. От алмазов кубический диоксид циркония отличается меньшей твердостью, составляющей 8.5 единиц по шкале Мооса (у алмаза она равна 10) и большей плотностью — 6.0 г/см3 (плотность алмаза 3.52 г/см3).
В наше время цирконий применяется и в виде металла, и в виде соединений. Этот элемент можно найти в составе керамики, литейном оборудовании, стекле и сплавах. Песок из оксида циркония применяется для изготовления теплоустойчивой футеровки плавильных печей, ёмкостей для расплавленного металла и литейных форм. Добавки ванадия и празеодима к оксиду циркония позволяет получать жёлтые и синие пигменты для окраски керамики и кафельной плитки.
Термическая устойчивость материалов из оксида циркония исключительна — раскалённый до температуры красного каления тигель из оксида циркония можно резко охладить водой, не боясь, что он треснет. Оксид циркония можно найти в ультрапрочной керамике, изделия из которой можно заточить острее, чем изделия из стали — именно из неё делают уже привычные для наших кухонь керамические ножи. Ежегодное мировое производство оксида циркония составляет около 25 000 тонн и, помимо керамики и имитации алмазов, это вещество используется в косметике, для изготовления антиперспирантов и даже для производства упаковки продуктов питания.
Поверхность металлического циркония окислена, это придаёт металлу твердость и устойчивость к химическому воздействию, что оказывается полезным не только для изготовления химических реакторов, но и для медицины. Цирконий и его сплавы применяются в протезировании тазобедренных суставов. Из сплава алюминия с цирконием, прочного и одновременно лёгкого, делают рамы для гоночных велосипедов, которые, в последнее время заменяются композитными материалами. Особую популярность металлический цирконий приобрёл в конце 1940-х годов, когда стало ясно, что это идеальный металл для изготовления внутренней поверхности ядерных реакторов — этот металл ни подвергается коррозии при высоких температурах, ни поглощает нейтроны с образованием радиоактивных изотопов. До настоящего времени потребителем большей части произведённого металлического циркония является атомная промышленность. Руды циркония содержат незначительные примеси гафния (1–3 %). Благодаря близости химических свойств циркония и гафния эти металлы чрезвычайно тяжело разделить, но для применения циркония в атомной энергетике даже мельчайшие примеси гафния должны быть удалены — гафний в отличие от циркония активно поглощает нейтроны.
Можно упомянуть еще два интересных соединения циркония — ниобий-циркониевый сплав становится сверхпроводимым при температурах ниже 35 K (—238 °C), а вольфрамат циркония (ZrW2O8) при нагревании уменьшается в объёме пока, будучи нагретым до 700 °C не разлагается на оксид циркония и оксид вольфрама.
Кто-то после прочтения этой главы может задаться мыслью, а что же не так с циркониевыми браслетами? Всё в порядке. Выглядят они эстетично. Химическая инертность циркония и то, что этот металл ни в какой форме не играет биологической роли, не повредит вашей коже, так что его вполне можно носить. Только корректировать артериальное давление этот браслет, конечно не может.
41. Ниобий
Ниобий назван в честь Ниобы, дочери Тантала, имя которого послужило для названия элемента, расположенного в той же группе, что и ниобий. Если кто помнит, греческую мифологию, Тантал попробовал вести себя с богами-олимпийцами на равных, за что обречён в посмертии терпеть муки, который мы называем танталовыми.
Похоже, что представители этой семьи отличались повышенным уровнем гордыни и весьма скромной способностью к обучаемости. Ниоба стала уверять, что её дети — Ниобиды прекраснее и мудрее детей, рожденных от связи титанессы Лето и Зевса (Артемиды и Аполлона), после чего обитатели Олимпа, вероятно, не желая проверять, какие патологические формы гордыня примет у внуков Тантала и детей Ниобы, просто решили пресечь дерзкий род. Стрелы Аполлона перебили всех ниобидов, а Ниоба волею богов превратилась в каменный памятник самой себе (до сих пор турецкую гору Маниса, из-под которой текут ключи, известную ранее как Сигил показывают туристам как окаменевшую дщерь Тантала).
То, что в Периодической системе Ниоба и Тантал находятся в соседних клетках неудивительно. И ниобий, и тантал совместно содержатся в минерале колумбите, смешанном оксиде, в состав которого входят также железо и марганец. Химические и физические свойства тантала и ниобия настолько близки, что до появления экстракционных методов разделения тантала и ниобия у химиков-неоргаников была шутка о том, что разгружать вагон с углём в дождь легче и продуктивнее, чем отделять тантал от ниобия.
Сначала выделенный из минерала-колумбита в 1801 году английским химиком Чарльзом Хэтчетом элемент назвали по минералу колумбием. В 1802 году швед Андерс Густав Экеберг открыл элемент, который назвал танталом. Свойства «колумбия» и тантала были идентичными, в результате чего долгое время считалось, что в обоих случаях речь идёт об одном и том же элементе. Только в 1844 году немецкий химик Генрих Розе установил, что колумбий и тантал — разные элементы, попутно и переименовав его в ниобий, лишний раз подчёркивая их сходство. В США и Великобритании ниобий назывался колумбием (символ Cb) до официального одобрения названия «ниобий» ИЮПАК, однако и далее по инерции старое название элемента некоторое время продолжало применяться. Последняя статья, в которой я обнаружил старое название ниобия, датирована 1954 годом (A. U. Seybolt Solid Solubility of Oxygen In Columbium // The Journal of The Minerals, Metals & Materials Society — 1954, Volume 6, Issue 6, Р. 774–776), так что, если кому-то придется обращаться к публикациям, изданным до этого времени, не пугайтесь символа Cb — речь идёт не о «закрытом» элементе, а всего лишь переименованном.
В отличие от Ниобы, дочери Тантала, ниобий не ищет сомнительных приключений. В металлическом состоянии он крайне нереакционноспособен. Как и тантал не окисляется даже действием безжалостной к золоту царской водки и сохраняет инертность по отношению к поту. Это обстоятельство наряду с тем, что помощью анодного окисления на поверхности ниобия можно создать тонкий слой оксида, который, действуя как дифракционная решётка будет окрашивать металл в плавно переходящие друг в друга цвета, позволяет использовать ниобий для изготовления ювелирных изделий и чеканки металлических монет. С 2003 года Австрия отчеканила шестнадцать типов сувенирных монет номиналом в 25 Евро, в которых внутри серебряного диска находится окрашенный с помощью электрохимических методов ниобиевый диск.
Одно из самых известных областей применения металлического ниобия в наше время, наверное, сверхпроводящий ниобий-титановый сплав. Это сплав, точнее интерметаллид, становится сверхпроводимым при температурах ниже 10 К (–263 °C). Это свойство сплава применяется для изготовления сверхпроводящих катушек магнитов. На создание Большого адронного коллайдера было потрачено 1200 тонн кабеля из сплава ниобий-титан. Во время работы ниобийсодержащие магниты БАК охлаждаются до 1.9 K. Ниобий-титановые сверхпроводящие магниты используются и в некоторых моделях установок для МРТ.
Ниобий полезный металл для изготовления сплавов специального назначения. Всего 0.1 % ниобия, добавленного в сталь достаточно для значительного повышения её прочности. Этот металл также часто входит в состав некоторых термостойких сплавов, применяющихся для изготовления аэрокосмической техники. Какое-то время из-за высокой температура плавления (2468 °C) ниобий применялся в качестве материала для нитей лампочек накаливания, однако позже был заменён еще более тугоплавким вольфрамом.
Исследований, посвященных неорганической химии ниобия не так уж много, но этот элемент крайне важен для химии органической и металлорганической. В 1979 году Ричард Шрок издает первый обзор, посвящённый химии алкилиденовых комплексов ниобия и тантала — комплексов, в которых металлы связаны с атомом углерода двойной связью (общую структуру можно отобразить следующим образом LxM=C<; Acc. Chem. Res., 1979, 12 (3), pp 98–104). Ниобийорганические и другие металлоорганические соединения с подобным типом строения стали эффективными катализаторами нового способа синтеза органических соединений и полимеров — реакций метатезиса. За исследование метатезиса в 2005 Шроку была присуждена Нобелевская премии по химии (совместно с Робертом Граббсом и Ивом Шовеном).
42. Молибден
Один из моих любимых металлов — молибден. Это не только и не столько потому, что его номер в Периодической системе в соответствии с книгами Д. Адамса совпадает с ответом на главный вопрос Жизни, Вселенной и всего такого прочего. В моей исследовательской группе изучают органические и фосфорорганические производные металлов группы хрома, и с молибденом, временами получаются наиболее интересные результаты. Хотя, если учесть, что молибден позволил уже трём моим ученикам защитить кандидатские диссертации, возможно, что для нас он и действительно быть тем самым ответом хотя бы вопрос о смысле научного поиска.
Молибден стоит в шестой группе между хромом и вольфрамом. В виде простого вещества молибден представляет собой серебристо-белый металл. Неожиданно, но название молибдена на греческом языке означает «свинец». Так получилось из-за того, что минерал молибденит (MoS2), из которого впервые удалось выделить оксид молибдена, путали со свинецсодержащим минералом — свинцовым блеском (PbS), а оба этих минерала, в свою очередь, не могли отличить от графита (свинцовые карандаши, которыми пользовались до карандашей с графитовым грифелем, изготавливали из свинцового блеска. В итоге какое-то время молибденитом называли и сульфид молибдена, и сульфид свинца, и графит. Как отдельный элемент молибден был открыт в 1778 году, когда Карл Шееле смог получить и молибденовую кислоту, и оксид шестивалентного молибдена. В чистом виде — в виде металла, не содержащего посторонних примесей молибден удалось выделить Берцелиусу.
Чистый молибден представляет собой светло-серый металл, достаточно твердый для металла (4.5 единиц твёрдости по шкале Мооса), но, по мере очистки от примесей и «хвостов» становящийся более мягким. Молибден относится к тугоплавким металлам, его температура плавления 2620 °C, а температура кипения — 4639 °C. Металлический молибден используется для легирования сталей, а также как компонент жаропрочных и коррозионностойких сплавов. Взгляните на лампочку накаливания — твёрдые и прочные куски проволоки, которые поддерживают вольфрамовую нить накаливания, обычно сделаны из молибдена.
Одни соединения молибдена находят применение как катализаторы нефтепереработки, другие помогают работать продуктам переработки нефти — добавка сульфидов молибдена в смазочные масла позволяет увеличить их коэффициент скольжения, не давая углеводородам загустеть, перегреться и воспламениться от трения.
Тем не менее, самое главное применение молибдена, то, благодаря которому возможна жизнь на Земле, появилось без участия человека и задолго до его появления. Будучи переходным металлом, способным принимать различные степени окисления, молибден работает в активных центрах ферментов, включая активные центры ферментов-нитрогеназ, позволяющих азотфиксирующим бактериям усваивать атмосферный азот, не только получая из него жизненно свои собственные азотсодержащие соединения — аминокислоты и азотистые основания, но образуя те производные азота, которые могут усваиваться растениями. Выросшие, потребляя связанный с участием молибдена почвенный азот, некоторые растения попадают нам на стол, а некоторые поедаются животными, которые тоже могут оказаться у нас на столе, то есть содержащие молибден ферменты-нитрогеназы обеспечивают и работу пищевых цепей, и круговорот азота в природе. Изучая строение активного центра нитрогеназ, исследователи пытаются имитировать их, получив низкомолекулярные комплексы, способные превращать атмосферный азот в его соединения (в целом, подход, при котором идею для разработки химического метода или вещества берут у природы, называется биомиметическим), однако получить катализатор, который бы помогал связывать азот в столь мягких условиях, при которых справляются ферменты, не получается, а жаль — низкотемпературное связывание азота стало бы такой же революцией в химической технологии, какой в своё время стал процесс Боша-Габера (см. главу про азот). Содержащие молибден ферменты встречаются не только у бактерий. В организме человека молибденсодержащий фермент ксантиноксидаза участвует в обмене пуриновых оснований, а нарушение его работы может приводить к накоплению в суставах солей мочевой кислоты — уратов и развитию «болезни королей» — подагрического артрита, более известного как подагра.
43. Технеций
В 1860–70 года систематизировать химические элементы пытался (и весьма успешно) не только Менделеев. Так, в 1870 немецкий химик Лотар Мейер опубликовал статью «Природа элементов как функция их атомного веса», в которой приводились рассуждения практически аналогичные менделеевским. В 1882 году Лондонское королевское общество присудило золотые медали Дэви совместно Менделееву и Мейеру с формулировкой «За открытие периодических соотношений атомных весов».
Позже, в XX веке, создателем Периодической системы среди мировой научной общественности стал считаться уже только Менделеев, а про Мейера, как автора Периодической системы в наше время чаще вспоминают разве что в Германии. В чем причина? То, и у Мейера, и у Менделеева начиналось как попытка простой систематизации, у Мейера систематизацией им закончилось, а Дмитрий Иванович смог разглядеть в системе фундаментальный закон, который и использовал для предсказаний свойств неоткрытых еще элементов. Наиболее исчерпывающие предсказания Менделеев дал для свойств четырёх к тому времени неизвестных элементов. О трёх из них — галлии, скандии и германии, уже было рассказано выше, а теперь пришла пора рассказать про предсказание, которому не так повезло (естественно — не по вине Дмитрия Ивановича). Четвёртый элемент, свойства которого в деталях предсказал Менделеев был элемент № 43, названный экамарганцем.
После открытия галлия, скандия и германия и превращения Периодической системы из средства систематизации в фундаментальный закон поиски экамарганца начались с утроенной силой. В 1909 году профессор Токийского университета Масатака Огава, большой поклонник идей Менделеева, заявил, что, анализируя минералы торианит, реинит и молибденит, обнаружил элемент № 43, который назвал «ниппонием» (nipponium, Np), однако открытие не было подтверждено. Как показали исследования 2004 года (Spectrochimica Acta Part B, 2004, 59, 1305–1310), «ниппоний» Огавы — это на самом деле открытый еще в 1871 году рений. В 1925 году немецкие химики Ида Ноддак и Отто Берг сообщили об обнаружении элемента № 43 в уральской самородной платине, назвав его мазурием (masurium, Ма) и их открытие тоже не подтвердилось.
С развитием физики стало понятно, почему экамарганец не дается в руки химикам — оказалось, что этот элемент не должен иметь стабильных изотопов. В конце концов элемент № 43 был обнаружен только в 1937 году, причём не химиками, а физиками. Первооткрывателями экамарганца считаются Карло Перрье и Эмилио Сегре из Университета Палермо, получившие его из молибденовой мишени, облучая на ускорителе-циклотроне ядрами дейтерия. В 1936 году Сегре посетил лабораторию Эрнста Лоуренса и принял участие в эксперименте по облучению молибдена. В начале 1937 года Лоуренс переслал Сегре образец молибденовой фольги. Сам Сегре больше разбирался в физике (в 1959 он ещё успеет получить Нобелевскую премию по физике за открытие антипротона), однако вдвоем с минералогом Перрье он обнаружил в образце два радиоактивных изотопа элемента № 43, который было предложено назвать технецием (Nature, 1937, 140: 193–194).
Название происходит от греческого слова «искусственный», оно подчёркивало то, что технеций был первым химическим элементом, полученным человеком. Однако, несмотря на название, следовые количества технеция все же содержатся в земной коре. Технеций — продукт самопроизвольного распада урана, и, хотя у этого элемента нет устойчивых изотопов, из каждого килограмма руды урана — урановой смолки, если сильно постараться можно извлечь 0.2 нанограмма технеция, который, впрочем, быстро распадется сам. С развитием атомной энергетики содержание технеция в земной коре стало расти — элемент № 43 содержится в отработанном ядерном топливе, и, по оценкам химиков и физиков, только на атомных электростанциях за последнюю половину столетия было «наработано» несколько тонн технеция.
Фраза «только на атомных электростанциях» не случайна один из изотопов технеция, нуклид 99Тс, период полураспада которого составляет около 6 часов, получают специально. С помощью этого нуклида ежегодно проводится около 20 миллионов случаев сцинтилляционной медицинской диагностики. Нуклид 99Тс распадается, испуская гамма-излучение. Врачи вводят в организм пациента образец, содержащий технеций (часто его предварительно успевают связать с определёнными органическими молекулами, которые смогут связаться со строго определёнными тканями или даже органоидами клетки), и с помощью детектора гамма-излучения следят за транспортом и накоплением технеция в организме пациента чтобы определить, какие из его органов в порядке, а какие работают не должным образом. Малые количества технеция, нужные для такой диагностики и его малый период полураспада приводит к тому, что организм пациента получает дозу излучения, сравнимую с эффектом ежегодного рентгенологического исследования лёгких (флюорографии).
44. Рутений
Замок и пряжки кожаного чехла, в котором хранится кубок Чемпионата мира по футболу 2018 года, проводившегося в России, сделаны из «самого русского» металла — рутения. Это не только единственный существующий в земной коре элемент, официально открытый в России, но и его название происходит от латинского Ruthenia — Русь, Россия.
Рутений был открыт в Казани, так что можно сказать, что для меня, коренного казанца, к тому же — казанского химика, этот металл ближе вдвойне. Однажды, десять лет назад, беседуя в твиттере, я даже не постеснялся указать редакции журнала Nature Chemistry, что они не правы, и они дважды извинились — за неправильную информацию в редакторской колонке про рутений и за стереотипы в подборе для неё иллюстраций. Колонку, размещённую в интернете они даже исправили (наполовину) — указали, что источником для открытия рутения были уральские руды (в исходном варианте статьи речь шла про сибирские), но картинку матрёшки оставили.
Рутений был открыт профессором Казанского университета Карлом Клаусом в 1844 году. Клаус выделил рутений в виде металла из уральской платиновой руды и указал на сходство между тройками элементов рутений — родий — палладий и осмий — иридий — платина. Название «рутений» Клаус придумал не сам — в 1828 году работавший в России Готфрид Озанн предложил это название для своего открытия, который он по ошибке принял за новый элемент, Клаус, удостоверившись в том, что он действительно открыл новый элемент, дал ему название, предложенное Озанном. В 1844 году Клаус опубликовал о новом элементе большую статью «Химические исследования остатков Уральской платиновой руды и металла рутения» в «Учёных записках Казанского университета», журнале, который издаётся до нашего времени.
Как и другие металлы троек рутений — родий — палладий и осмий — иридий — платина, рутений мало распространён. По содержанию в земной коре он находится на 74-м месте, ежегодно добывается около 12 тонн рутения, а мировые резервные запасы этого металла оцениваются в 5000 тонн. Чаще всего рутений извлекается из руд совместно с другими металлами платиновой группы, а вот его содержание в разных платиновых рудах различается — в рудах, извлекаемых в Южной Африке, содержится до 11 % рутения, а вот в уральских рудах металлов платиновых групп рутения только 2 %.
Футбольный кубок, как и ювелирная продукция для рутения — только хобби. Большую часть времени рутений проводит в химических лабораториях и предприятиях в области тонкого химического синтеза. С 1960-х годов начались ставшие успешными систематические попытки заставить металлы платиновой группы катализировать превращения органических и неорганических веществ. В начале в эффективности вперёд вырвались платина с палладием, которые показали себя успешными в ускорении химических реакций, будучи просто металлами, благодаря чему значительные количества этих металлов стали востребованы нефтехимическими комплексами, в которых эти металлы ускоряют процессы химической переработки нефти, и автопроизводителями — платиновый катализатор очистки выхлопных газов способствует доокислению угарного газа СО в менее опасный углекислый СО2. Металлический рутений не мог похвастаться столь высокой эффективностью, и поэтому объектом исследования стали его соединения. Результатами этих исследований навскидку можно назвать пару Нобелевских Премий. В 2001 году Нобелевским лауреатом стал Рёдзи Ноёри, получивший её за «…за их работу над хиральными катализаторами реакций присоединения водорода…». Катализаторы Ноёри (комплексы рутения с оптически активными β-аминоспиртами и производными 1,2-диаминов) применяются в процессах получения практически чистого (1R,2S,5R) — ментола и исходных веществ для синтеза полиамидных волокон. Комплексы Граббса, которые применяются в получении непредельных органических соединений с помощью реакций метатезиса (за исследования в области метатезиса Нобелевская Премия по химии была присуждена в 2005 году), тоже представляют собой производные рутения.
Металлический рутений не зарекомендовал себя как катализатор, но как металл тоже работает — твёрдость «российского элемента» позволяет использовать его в сплавах с другими металлами платиновой группы, из которых делают износоустойчивые электрические контакты. Около половины производимого рутения используется в другой области электротехники — из диоксида рутения и рутенатов висмута производят детали для тонкоплёночных резисторов — элементов сопротивления в электросхемах. Если вы ещё не растеряли навык письма перьевой ручкой, есть шанс, что вы обладатель небольшого количества рутения. Золочёное перо выпускающихся с 1944 года ручек серии Parker 51 с маркировкой «RU» на 96.2 % состоят из рутения, на 3.8 % — из иридия.
Как и его близкий родственник — железо, рутений может образовывать различные оксиды. Один из таких оксидов — рутениевый красный, применяется для подкрашивания отрицательно заряженных биомолекул, например — нуклеиновых кислот, перед изучением биологических образцов с помощью микроскопии. Некоторые комплексы рутения изучаются как потенциальные противоопухолевые препараты.
45. Родий
С точки зрения строения атомного ядра родий можно считать уникальным — это единственный относительно тяжелый химический элемент, представленный в Земной коре единственным устойчивым нуклидом 103Rh. Радиоактивные изотопы родия также существуют, но период полураспада самого долгоживущего из них — 101Rh всего три года и четыре месяца, поэтому они не накапливаются в земной коре и можно говорить, что родий моноизотопный.
Родий — металл серебристо-белого цвета, который, как и все металлы платиновой группы (рутений-родий-палладий объединены в так называемую «малую платиновую группу») отличается крайне низкой активностью. Царская водка (смесь соляной и азотной кислот), которая быстро и охотно растворяет золото, реагирует с родием только при заметном нагревании. Именно с помощью царской водки родий и был отделён от платины (платина с ней не реагирует совсем). Первооткрывателем родия является Уильям Хайд Волластон. Он выделил этот металл из платиновой руды, доставленной в Британию контрабандой с территории современной Колумбии. Эту руду в канун Рождества 1802 года приобрели Волластон и его друг и коллега Смитсон Теннант.
Контрабандная руда оказалась весьма ценной для обоих ученых. Её исследования позволили получить не только окрашенный в розовый цвет раствор хлорида элемента, который Волластон назвал родием (от греческого «розос» — роза), но и другие находки. Волластон открыл в этом образце ещё и палладий, а Теннант — осмий и иридий.
Чаще всего мы сталкиваемся с родием, работающим в каталитической системе дожигания выхлопных газов от автомобильных двигателей внутреннего сгорания. Правда, в этом случае наш контакт с этим элементом весьма опосредован — каталитическая система, которая служит для обеспечения полного сгорания некоторых небезопасных веществ, покидающих выхлопную трубу, расположена глубоко внутри автомобиля, и к тем деталям, которые можно обслужить своими силами, не относится.
Помимо родия катализаторами дожигания выступают также платина и палладий, но их значение немного различается. Если палладий может выполнять работу платины и наоборот — ускорять окисление угарного газа СО в углекислый СО2, то родий выполняет тот трюк, на который ни платина, ни палладий неспособны. Его мишень — оксиды азота (их часто обозначают как NOx), которые в присутствии аммиака и при посредстве родия разрушают на молекулярные азот и кислород (или воду). Родий работает с производными азота и в другом процессе — до сих пор не существует более эффективного катализатора окисления аммиака воздухом (эта реакция важна для производства азотной кислоты и нитратов). Ежегодно из руд извлекается не более 30 тонн родия, поэтому и отслужившие своё системы дожигания выхлопных газов, и катализаторы сжигания аммиака подвергаются вторичной переработке, и извлечённый из них родий заново пускают в дело.
Ещё один процесс, в котором родий применяется как катализатор — получение уксусной кислоты в результате реакции монооксида углерода (СО) с метиловым спиртом (СН3ОН). В 1960-е годы родий заменил в этом процессе «соседа сверху» — кобальт, сделав процесс более эффективным и протекающим с меньшим количеством побочных продуктов. С помощью родиевых катализаторов до недавнего времени в мире производили около пяти миллионов тонн уксусной кислоты, однако в последнее время на смену родию приходит его «сосед снизу» — иридий, делающий получение уксусной кислоты еще более эффективным.
Родий применяется и в ювелирном деле — например, для того, чтобы серебро не темнело, его покрывают тонким слоем родия. Пожалуй, самое известное ювелирное изделие из родия — родиевый диск-сертификат от Книги рекордов Гиннесса, который получил Пол Маккартни, как самый успешный музыкант и сочинитель песен в истории (на момент вручения он был автором 43 песен, которые были проданы более, чем миллионными тиражами). Всего же Маккартни за свою музыкальную карьеру получил 60 золотых дисков (42 — играя в Beatles, 17 — играя в Wings и 1 — в сотрудничестве с Билли Престоном).
46. Палладий
В апреле 1803 года наиболее известным британских химикам анонимно доставили рекламный листок: «Палладий или новое серебро», в котором были перечислены свойства нового благородного металла и предложение его купить. Реклама указывала единственного поставщика металла — магазин минералов, руд и металлов мистера Джейкоба Форстера в Сохо. Сам мистер Сохо на момент подачи рекламного объявления был в отъезде, и потенциальным покупателям пришлось иметь дело с его женой. Когда редактор британского журнала Journal of Natural Philosophy, Chemistry and the Arts Уильям Николсон попытался выяснить, как попал в лавку этот металл, миссис Форстер ответила, что не оставивший на продажу образцы приятный и вежливый молодой человек пожелал остаться неизвестным.
Николсон перепечатал в своем журнале информацию, указанную в рекламе, но неудивительно, что необычный способ, который помог ученому сообществу обратить внимание на открытие, вызвал у многих подозрение. Проанализировал образец палладия, купленный у миссис Форстер за целую гинею английский химик Ричард Ченевикс заявил, что это никакой не новый элемент, а сплав платины с ртутью. После этой статьи Ченевикса Уильям Хайд Волластон (именно он и был тем самым вежливым молодым человеком, решившим сообщить об открытии нового элемента столь экстравагантным способом) опять же анонимно пообещал награду в 20 фунтов любому, кто получит разумное количество сплава платины со ртутью, соответствующего свойствам палладия. Естественно, награда осталась невыплаченной. В конце концов Волластон вышел из сумрака и в 1805 году опубликовал сообщение об открытии палладия в научном журнале (Philosophical Transactions of the Royal Society of London., 1805, 94: 419–430). Волластон назвал новый элемент по имени астероида Паллада, открытого в 1802 году, незадолго до открытия палладия. В свою очередь, астероид назван в честь Афины Паллады из древнегреческой мифологии.
История объявления об открытии палладия — не единственный пример из жизни этого элемента, имеющий оттенок в определённой степени скандальной славы. В конце XX века палладий на какое-то время стал героем статей, обещающих переворот в мировой энергетике. В 1989 году электрохимики Мартин Флейшман и Стэнли Понс сделали удивительное заявление о том, что они провели термоядерный синтез в электролитической ячейке. Когда исследователи подавали электрический ток на ячейку, по их мнению, атомы дейтерия из тяжёлой воды, проникшие в палладиевый катод, сливались в атомы гелия, а энергия этого процесса превращалась в тепло. Флейшман и Понс утверждали, что этот процесс не может быть результатом ни одной известной химической реакции, и присовокупили к нему термин «холодный синтез». Однако физики-ядерщики и специалисты по физике плазмы не верить в холодный термояд. Было известно, что два ядра дейтерия в принципе могут слиться с образованием ядра 4Не и высокоэнергичного гамма-кванта, но вероятность протекания такого процесса ничтожна. Обычно реакция двух ядер тяжелого водорода завершается рождением ядра трития и протона или же возникновением нейтрона и ядра 3Не, причем вероятности этих превращений примерно одинаковы. Если внутри палладия действительно идет ядерный синтез, то он должен порождать большое число нейтронов, которые можно было обнаружить с помощью нейтронных детекторов, то есть интерпретацию экспериментов Флейшмана и Понса можно было бы подтвердить с помощью стандартной радиометрической аппаратуры.
Однако из этого ничего не вышло. Флейшман убедил сотрудников британского ядерного центра в Харуэлле проверить его «реактор» на предмет образования нейтронов, но нейтроны так и не были обнаружены. Поиск гамма-лучей соответствующей энергии тоже обернулся неудачей. К такому же заключению пришли и физики из Университета Юты. Сотрудники Массачусетского технологического института попытались воспроизвести эксперименты Флейшмана и Понса, но опять же это ничего не дало. В конечном итоге «открытие десятилетия» обернулось закрытием на конференции Американского физического общества 1 мая того же года. Исследование забраковали, а холодный термоядерной синтез пополнил паноптикум лженауки.
Хотя палладию и не удалось стать металлом холодного термоядерного синтеза, в начале нашего века он стал незаменимым элементом для «холодного горения» — палладий применяется в качестве катализатора водородных топливных элементов — устройств, в которых химическая энергия окисления водорода непосредственно преобразуется в электрическую, минуя протекающие с низким коэффициентом полезного действия процессы горения.
Палладий хорошо растворяет водород (при атмосферном давлении в одном объёме палладия растворяется 600 объёмов водорода). Так как поры кристаллической решётки палладия пропускают только водород, его можно использовать для тонкой очистки водорода от других газообразных примесей. То обстоятельство, что палладий взаимодействует с водородом не только поверхностью, но и фактически всем объёмом, делает его хорошим катализатором присоединения водорода к непредельным углеводородам. Палладий применяется для изготовления ювелирных изделий, зубных пломб и зубных коронок, однако, как и родий с платиной большей частью он используется в каталитических конверторах систем очистки выхлопных газов двигателей внутреннего сгорания — на это тратится до 100 тонн палладия из 160 потребляемых разными отраслями промышленности ежегодно.
47. Серебро
Блеск серебра известен и ценится людьми с глубокой древности. Серебро не столь редкий и дорогой металл, как золото, но всё же серебро — монетный металл. Археология говорит о том, что добывать серебро из сульфидных руд, чеканить из этого серебра монеты и делать украшения люди начали еще в четвертом тысячелетии до нашей эры. Серебро становилось основой экономической и военной мощи античных стран Средиземноморья. Так, именно Лаврионские серебряные копи позволили Афинам быстро построить военный флот, который в итоге и принес Элладе победу в греко-персидских войнах, а Афинам на некоторое время стать главным полисом в организованном ими же греческом союзе.
Серебро мягкий и ковкий металл с относительно низкой температурой плавления (962 °C), который легко ковать и отливать в формы. Эти свойства серебра веками позволяли чеканить из него монеты, изготавливать вазы, кубки, тарелки и столовые приборы — столовую утварь, которая веками и до сих пор воспринимают как проявление достатка. Тем не менее, столовое серебро — вещь капризная, оно быстро тускнеет. Даже при том, что соединений серы в воздухе не так уж много, серебро медленно покрывается слоем тёмного сульфида, который нужно удалять механически — именно из-за недолговечности блеска серебро оказалось в тени золота. Однако те же свойства серебра, которые оттеняют его внешний вид, втянули серебро в историю, позволяя фиксировать Историю — делать фотографии.
В 1727 году немецкий физик Иоганн Шульце обнаружил, что на свету паста из мела и нитрата серебра темнеет. Это наблюдение позволило ему получать первые картинки с помощью света, применяя трафареты. Реакция, которую обнаружил Шульце, ставшая началом фотографии, протекала благодаря тому, что соли серебра чувствительны к свету. Фотон выбивает из отрицательно заряженного нитрат-аниона электрон, который, присоединяясь к положительному иону серебра, восстанавливает его, а порошок металлического серебра делает поверхность материала тёмным. Открытие Генри Талботом в 1840 году ещё одного химического фокуса, который назвали «скрытым серебряным изображением», показалось современникам учёного магией или чем-то дьявольским — оказалось, что результат воздействия света на йодид серебра может быть проявлен действием галловой кислоты. Однако в появлении скрытого рисунка не было ничего мистического и тем более инфернального. Это была простая окислительно-восстановительная реакция — галловая кислота способствует восстановлению фотосенсибилизированных ионов серебра до металла. Способы нанесения фоточувствительного слоя на бумагу и прозрачную плёнку из целлулоида позволили появиться двум важнейшим из искусств.
Цветная, а затем цифровая фотография сократили применение серебра в фотографии, однако всё же не полностью заместили. Высокая электропроводность серебра служит свою службу и в цифровой фотографии (как и во всей микроэлектронике) — во многих узлах смартфонов и ноутбуков используются серебряные проволочки-проводники, серебряные контакты и серебряные детали источников питания. В наше время возвращаются даже хорошо забытые старые области применения серебра — на фоне возрастающей резистентности бактерий к антибиотикам ряд ученых предлагает вернуться к бактерицидным нанопокрытиям из серебра. Металлическое серебро убивает большую часть микроорганизмов (хотя природа этого эффекта до сих пор не ясна), но абсолютно безопасно для людей и даже применяется для украшения блюд на чрезвычайно гламурных обедах. Справедливости ради, в наше время применений у серебра меньше, чем в прошлом веке — некоторые благородные металлы выполняют его работу более качественно.
48. Кадмий
Доктор Айболит — вымышленный Корнеем Ивановичем Чуковским персонаж, а вот болезнь «Ай, болит» действительно существует. Точнее, она называется. Болезнь итай-итай, что с японского языка можно перевести как «ой-ой больно», была диагностирована в 1950 году в японской префектуре Тояма, расположенной на 100 километров к северу от Токио.
Симптомы болезни включали не только острые боли в суставах и позвоночнике, но и развитие почечной недостаточности, которая часто приводила к смерти заболевших. Как оказалось, симптомы развивались из-за хронического отравления кадмием — рис, культивировавшийся в очаге заболевания, выращивали на почвах, чрезвычайно богатых солями кадмия — выше по течению реки Дзиндзу, которая использовалась для орошения полей находилось производство горно-металлургической компанией «Мицуи», работа которой привела к загрязнению воды солями тяжёлых металлов, прежде всего, кадмия. В результате этого урожай риса, собранный в Тояме, содержал кадмия в десять раз больше, чем нормальный рис.
Ситуация с болезнью «Ай, болит» заставила производителей опасаться кадмия как огня — производители консервов исключили кадмий из состава припоя для изготовления консервных банок (хотя, строго говоря, кадмий и другие компоненты припоя мог попадать в продукты питания только после вскрытия банки — отсутствие воздуха внутри неё не даёт портиться не только продукту, но и делает невозможным окисление металлов, контактирующих с пищей). В 2010 году Кока-Кола отозвала с рынка США 22 000 стеклянных стаканов с фирменным дизайном, после того как в составе краски, которую использовали для нанесения логотипа, был обнаружен кадмий (хотя логотип был нанесён снаружи стакана и его контакт с напитками был исключён).
Любопытно, но в случаях хронического отравления кадмием превышение этого металла в потребляемой человеком пище было настолько высоко, что смогло преодолеть естественную защиту человеческого организма — малые дозы кадмия человек вполне в состоянии «переварить». Иод кадмия, как и ионы многих других тяжёлых металлов, тиофилен — он образует прочные связи с атомами серы, входящими в состав аминокислот и белков. При попадании в организм человека ионов тиофильных металлов начинается интенсивная выработка металлсодержащего белка металлотионеина, особо богатого серосодержащими аминокислотными остатками. Каждая молекула такого белка может связать до семи ионов кадмия или подобных ему тяжелых металлов и способствовать их выводу из организма. Люди, пострадавшие от болезни итай-итай, длительное время получали такие количества кадмия, с которыми не мог справиться естественный механизм защиты.
Кадмий был открыт в 1817 году немецким химиком Фридрихом Штромейером. Началось с того, что аптекари Магдебурга заподозрили, что в оксиде цинка, попадавшем в их аптеки есть примесь мышьяка. Штромейер выделил из предоставленных образцов коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, которому дал название кадмий. Название элементу было дано по греческому названию руды, из которой в Германии добывали цинк — кадмея. В свою очередь, руда получила своё название в честь Кадма, героя древнегреческой мифологии, легендарного основателя Фив Беотийских и создателя греческого алфавита.
Хотя в последнее время репутация кадмия в общественном сознании — вполне определённая слава отравителя и канцерогена, этот элемент нельзя назвать полностью перешедшим на тёмную сторону. Около 20 % кадмия применяется для изготовления ярких и не тускнеющих со временем красителей и пигментов, преимущественно сульфидов и селенидов кадмия, например — «кадмиевый жёлтый» и «кадмиевый лимонный» (теперь вы знаете, что, если вы занимаетесь живописью, не стоит облизывать кисточку). Ещё 20 % кадмия расходуется на изготовление источников электрического тока — никель-кадмиевых и свинцово-кадмиевых элементов. Наноразмерные кристаллы сульфида и селенида кадмия — полупроводниковые квантовые точки, могут использоваться в дисплеях и для медицинской диагностической визуализации.
И, наконец, есть в природе существа, которым кадмий не страшен — некоторые морские диатомеи «научились» замещать цинк фермента ангидразы на кадмий практически без потери его активности, то есть кадмий вполне может играть роль микроэлемента (Proc Natl Acad Sci U S A., 2000, 97(9): 4627–4631), хотя и не для людей. Мы же, потребляя кадмий с пищей (а иногда и с табачным дымом, можем только испортить себе здоровье.
49. Индий
Самым известным дальтоником среди химиков был Джон Дальтон (собственно говоря, он оказался не только самым известным химиком-дальтоником, но и первым описанным в медицине случаем цветослепоты), который до 26 лет даже не знал о существовании красного цвета, однако Дальтону его проблемы цветового восприятия не помешали заложить основы химической атомистики. Экспериментаторам всегда было сложнее — для открытия и описания новых веществ химикам, страдавшим от дальтонизма, приходилось надеяться на помощь ассистента.
Ещё одним дальтоником, оставившим своё имя в химии, стал профессор Фрайбергской горной академии Фердинанд Райх. Райх был дальтоником и, не различая спектральные линии, не мог воспользоваться всеми преимуществами спектрального анализа, поэтому выполнял работу совместно с помощником Теодором Рихтером. В 1863 учёные решили найти таллий в цинковой обманке, но вместо зелёной спектральной литии этого элемента Рихтер сообщил Райсу о наличии голубой линии. Наблюдение позволило предположить наличие в цинковой руде нового элемента, который вскоре был выделен в виде металла (Journal für Praktische Chemie, 1864, 92 (1): 480–485). К Всемирной Парижской выставке 1867 года уже был получен слиток индия в несколько сот граммов. Своё название элемент получил не в честь Индии, а благодаря интенсивно полосе спектра цвета индиго, которая и помогла найти этот элемент.
Долгое время все мировые запасы металлического индия были представлены тем самым слитком, подготовленным ко Всемирной выставке — индий не мог найти себе подходящее применение. В наши дни около 500 тонн индия ежегодно извлекают из руд и ещё 600–700 тонн получают в результате вторичной переработки отслуживших свой срок индиевых изделий. Благодаря чему так выросла необходимость в этом металле, и что он представляет?
Индий — блестящий, мягкий и ковкий металл. Температура плавления индия сравнительно невысока для металлов (+156 °C), при нагревании выше этой температуры на воздухе индий воспламеняется и горит фиолетовым пламенем. При сгибании чистого индия металл издаёт «крик» — скрип, вызванный перемещением кристаллитов индия друг относительно друга, примерно такой же звук можно услышать и при деформации олова.
Индий уникален тем, что он остается мягким и податливым при очень низких температурах, что позволяет использовать его в оборудовании, работающем около абсолютного нуля. Индий и его сплавы применяют для изготовления криогенных насосов и систем для глубокого вакуума. Индий и некоторые его сплавы могут повторять форму неправильных поверхностей, прочно прилипая к ним. Индий понижает температуру плавления припоев, делает боле прочными и сами припои, и их крепление с местом припайки. Часто индий называют «металлическим витамином» — иногда даже деципроцентные примеси индия значительно изменяют свойства сплава — например, добавка небольшого количества индия к сплавам золота или палладия делает их более твёрдыми (такие сплавы применяются для изготовления коронок в стоматологии). Некоторые детали летательных аппаратов сделаны из сплава с индием, индий в их составе защищает детали от преждевременного износа и замедляет от окисления. Индий применяется в изготовлении электронных устройств и элементов питания.
Ещё одно интересное соединение, которое образует индий — это его оксид. Это вещество прозрачное и электропроводное (на уровне полупроводника), высокой степенью прозрачности и полупроводниковыми свойствами отличается также и смешанный оксид индия-олова (ITO), который и является основным направлением применения индия в настоящее время.
На производство оксида индия-олова расходуется около 45 % всего добываемого индия, смешанный оксид идёт как на производство солнечных элементов, так и жидкокристаллических дисплеев. Кроме оксида индия-олова для изготовления солнечных батарей применяют ещё и арсенид индия-галлия, а также — селенид индия-галлия-меди. Несмотря на большие ожидания от солнечной энергетики и высокой эффективности индийсодержащий полупроводников в фотогальванике, большая часть индия идет на производство экранов телевизоров и компьютерных дисплеев. В 1980–90-е годы цена на индий под влиянием растущего спроса быстро росла, однако сейчас, когда одним из источников стали продукты вторичной переработки, спрос и предложение на этот металл практически уравновесили друг друга.
50. Олово
Сказка Ганса Христиана Андерсена про стойкого оловянного солдатика могла бы быть еще печальнее — если бы солдатик, выпав из окна, не попал бы в желудок рыбы, то рано или поздно с наступлением холодов он бы заболел чумой и рассыпался в прах, не оставив после себя оплавленного сердечка.
Оловянные солдатики, оловянные припои, оловянные консервные банки, лужёное (то есть покрытое оловом) железо — можно придумать много ассоциаций на оловянную тему. В наше время многие области, в которых трудилось олово, можно считать устаревшими, но нужно помнить, что именно олово поменяло вектор развития нашей цивилизации. Бронзовый век сменил короткий (по эволюционным и цивилизационным меркам) медный вскоре после того, как стало ясно, что сплавление меди с оловом даёт более прочный материал, чем просто медь — материал, который можно было не только просто обрабатывать ковкой или отливкой, но материал, который не так быстро как медь затуплялся при использовании.
Бронза — сплав меди с оловом, и во времена античных империй и демократий олово было стратегическим ресурсом. У древних греков ходила легенда об оловянных островах «Касситеридах», которые лежали на северо-запад от побережья известной им Европы. Возможно, этими оловянными островами были британские острова, где действительно находились залежи оловянных руд, хотя эллины и не ввозили олово оттуда — греческие города получали олово морем, но с территорий, расположенных чуть ближе — шахт на Севере Пиренейского полуострова. Когда во времена расцвета Римской Империи границы Европы стали шире, стало известно и об оловянных залежах на территории современного Корнуолла, ради которых в том числе римляне вторглись в Британию.
Олово настолько необычный металл, что он «болеет» чумой. Оловянной чумой называют протекающий при низкой температуре (для чистого олова 13.2 °C, однако примеси в олове понижают её) процесс перехода одной аллотропной модификации олова в другую, которая выглядит как порошок. Появление порошкообразной аллотропной модификации ускоряет трансформацию металлического олова, «заражая» его, поэтому этот процесс и назвали чумой. Оловянная чума — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Путешественники остались без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой». В книге Пенни Лекутера и Джея Берресона «Семнадцать молекул, изменивших мир», оловянной чумой объясняется провал зимней компании Наполеона в России в 1812 году — сильные морозы заставляли оловянные пуговицы на мундирах французских солдат рассыпаться в порошок (возможно, это и было, но вряд ли можно назвать это главной причиной бегства Наполеона из России). Какое-то время проблему оловянной чумы удавалось избежать, применяя вместо олова свинцово-оловянные сплавы, однако в наши дни вопрос вновь стал актуальным. В соответствии с современным законодательством Евросоюза свинец из сплавов было велено убрать, оставив только олово. Тем не менее, законы природы еще никому не удавалось отменить, и переход на чистое олово опять привел к проблемам, главная из которых даже не в том, что при низких температурах металлическое олово рассыпается в серый, не проводящий электрический ток порошок, а в том, что этот порошок может попадать внутрь электронных приборов, при повышении температуры снова образуется электропроводное олово, которое может стать причиной коротких замыканий. Волей-неволей, борясь с оловянной чумой приходится возвращаться назад, в бронзовый век и заменять олово и свинцово-оловянные сплаву на бронзу.
Кстати, с наступлением железного века человечество не отказалось от бронзы, просто немного сузило области его применения. Сейчас бронза, содержащая кроме меди и олова ещё и свинец, применяется для литья колоколов и создания органных труб. Тональность колокола или трубы можно поменять, изменяя соотношение компонентов в сплаве.
51. Сурьма
За годы своего существования человечество знало много войн — за честь, за веру, за любовь, за ресурсы. В 1600-х годах разразилась одна из самых долгих и бессмысленных войн — «сурьмяная война». Эта не была война, в которой, гремя огнём и железом, сходились полки в битве за ценный ресурс (сурьма не относилась к стратегическим ресурсам семнадцатого, равно как и других веков). На сурьмяной войне орудием были перья, чернила и риторика — врачи того времени пытались прийти к консенсусу по поводу одного вопроса, который сейчас кажется нелепым — можно ли лечить сурьмой.
Первым осознанно применять соединения сурьмы для врачевания стал Парацельс, и это раскололо врачей на два лагеря — одни все же считали сурьму лекарством, а другие — просто ядом. Спор о сурьме был решен, когда король Людовик XIV заболел брюшным тифом. Король проболел две недели, после чего к нему пригласили какого-то врача, который обещал исцелить монарха. Королю дали дозу сурьмы, после чего Людовик выздоровел. Королевское выздоровление (которое, скорее всего не имело отношения к сурьме) снова изменило отношение к сурьме, и ее продолжили применять в медицинской практике вплоть до XIX века. Поскольку один из симптомов отравления сурьмой — тошнота и рвота, многие доктора прописывали пациентам «для очищения организма» соли сурьмы. По одной из версий отравление Моцарта было вызвано именно передозировкой препаратов сурьмы при лечении. В девятнадцатом веке, к счастью, медицина отказалась от применения сурьмы, и на какое-то время этот элемент стал орудием отравителей.
Один из важных источников этого элемента-неметалла стибнит — токсичный сульфидный минерал сурьмы. Также стибнит — одно из самых древних косметических средств. Еще в древнем Египте, в третьем тысячелетии до нашей эры, стибнитовую пасту применяли для нанесения рисунков около глаз — не столько для декоративных и ритуальных целей, а в первую очередь для защиты глаз от инфекций и насекомых. Латинское название этой пасты, stibium, происходит от греч. stimmi, которое, в свою очередь, восходит к древнеегипетскому stm. Краска для чернения волос, бровей и ресниц на Руси называлась сурьмой (от турец. sürme) — отсюда выражение «сурьмить брови» и название химического элемента. Применение стибнита в косметике продолжилось и в средние века: считалось, что стибнит обостряет и укрепляет зрение, уменьшает слезотечение и способствует росту ресниц. Из стибнита также делали столовую утварь, что нередко приводило к отравлению из-за попадания в организм производных сурьмы.
Открытие сурьмы приписывают жившему в XVI–XVII веке монаху-алхимику Василию Валентину (Basilius Valentinus). Валентин описал выделение элементарной сурьмы из стибнита в своем трактате «Триумфальная колесница антимония» (Currus triumphalis antimonii). Происхождение названия сурьмы «антимоний» (antimonium), оставшегося в ряде языков (ср. англ. antimony), неясно. Народная этимология толкует его как «действующий против монахов», возможно из-за частых случаев отравления монахов-алхимиков соединениями сурьмы в процессе алхимических изысканий. В начале XIX века шведский химик Йонс Якоб Берцелиус предложил для сурьмы латинское название stibium (так называлась паста из молотого антимонита/стибнита) и символ (Sb).
Сурьма представляет собой твердое и хрупкое вещество с серебристо-белым блеском, которое можно растереть в порошок, она плохо проводит тепло и электрический ток. По распространенности в земной коре сурьма занимает 63-е место, ее содержание ниже, чем у олова, мышьяка и редкоземельных металлов, но больше, чем у висмута, ртути и серебра. Сурьма обычно концентрируется с сульфидными рудами вместе с медью, свинцом и оловом, очень редко встречается в виде простого вещества, но не в самородном виде, а обычно совместно с мышьяком, висмутом или серебром. Второй по важности после стибнита минерал для получения сурьмы — джемсонит. Кроме сурьмы он содержит железо и свинец.
Из стибнита в результате обычного обжига при температуре выше 300 °C получают триоксид сурьмы, до 90 % которого применяется для изготовления огнезащитных материалов. Композитные антипирены, содержащие Sb2O3, могут существенно замедлять скорость движения фронта пламени и даже препятствовать его распространению. Их добавляют в клеевые композиции, краски, полимерные, строительные и текстильные материалы.
52. Теллур
Если верить «Путеводителю для автостопщиков по галактике», на языке других цивилизаций, населяющих наш сектор галактики, название нашей планеты звучит как «Грязь». В этом смысле даже не удивительно, что элемент, названный в честь Земли, добывают из грязи, а, если точнее, из «анодной слизи» — отходах производства, образующихся на аноде во время электролитической очистки сырой меди.
Чистый теллур в основном применяется для вулканизации каучука и получения специальных сортов резины. Введение 0.05 % теллура в свинец снижает потери этого металла в результате растворения в серной кислоте в 10 раз — и это используется при производстве известных каждому автолюбителю свинцово-сернокислотных аккумуляторов. Теллуриды элементов главных, побочных подгрупп и даже лантаноидов представляют собой либо квантовые точки, либо материалы для изготовления солнечных батарей.
Теллур не так ядовит как селен, но все же его лучше не принимать вовнутрь — половина микрограмма теллура (это количество теллура не так просто разглядеть невооружённым глазом) съеденная человеком случайно или преднамеренно, не отразится на здоровье любителя уникальных диет, но снабдит его зловонным дыханием, отчасти напоминающим запах чеснока на целых тридцать часов (да, дорогой читатель, мне самому тоже очень интересно выяснить, как был установлен этот факт — специально или случайно, кто хронометрировал продолжительность несвежего дыхания, чистил ли поедатель теллура при этом зубы, но деталей я не мог найти).
С чесночным запахом, которым теллур одаривает того, кто его хочет съесть, хорошо гармонирует тот факт, что этот элемент впервые был найден в самом вампирском уголке Европы — в Трансильвании. В 1782 году главный горный инспектор золотоносных шахт Франц Йозеф Мюллер понял, что что-то пошло не так с анализом одного из образцов, содержащих золото. Мюллеру удалось выделить из образца то, что он посчитал металлом, и назвал выделенный продукт aurum problematicum (проблемное золото). Образец проблемного золота (который на самом деле был теллуридом золота Au2Te3) был послан Мартину Клапроту, который к 1798 году смог выделить оттуда новый химический элемент, назвав его «теллур». Чтобы выяснить мотивы, которые двигали им в выборе названия, нужно сделать экскурс в историю.
Древнегреческие астрономы, глядя ночью в небеса, заметили, что траектории движения пяти «звёзд» (Меркурия, Венеры, Марса, Юпитера и Сатурна) отличаются от траекторий движения остальных звёзд и назвали эту пятерку «странниками» — «планис», потом это название превратилось в знакомое слово «планета». Прибавление к пяти планетам двух небесных тел — Луны и Солнца, давало высшее магическое число семь. В тот же исторический период людям было знакомо семь металлов — золото, серебро, медь, железо, олово, свинец и ртуть. «Совпадение?» — подумали любители нумерологии, и сами же ответили, что в таком деле никаких совпадений быть не может.
Наверное, многие читатели знают стих про то, как семь металлов создал свет по числу семи планет, но менее известно то, что алхимики предполагали, что невидимые лучи каждой из планет позволяют рудам металлов расти в недрах Земли таким же образом, как лучи Солнца помогают расти цветам и деревьям. Считалось, скажем, что связь Марса и железа не просто символична, а Марс помогает железным рудам, ну и т. д.
К сожалению сторонников такой нумерологического подхода, к естествознанию и горному делу число металлов через некоторое время перевалило за семь — были обнаружены сурьма, висмут, цинк и кобальт. Приверженцы старой нумерологической школы вывернулись сказав, что обнаруженные элементы нельзя считать металлами, однако открытие платины, ставшей на какое-то время восьмым фундаментальным металлом. Открытие металлов продолжалось, а в 1781 году стройная система 7-на-7 пострадала и с другой стороны — английский астроном Уильям Гершель обнаружил новую планету, которую назвал Ураном. В честь этого открытия в 1789 году Клапрот назвал открытый им новый металл ураном. Ну а в 1798 году, когда Клапроту выпал очередной шанс дать название новому элементу, он назвал его в честь единственной планеты Солнечной системы, которая доселе не была связана «именными узами» — в честь Земли. По древней мифологии Теллус-Теллура или Терра или Гея была матерью-богиней Земли (и женой Урана — бога небес). Так появилось название «теллур».
53. Йод
В 1811 году молодой французских химик, работая в своей парижской лаборатории, открыл новый элемент. Отцовское предприятие Бернара Куртуа занималось производством селитры, которая во времена Наполеоновских войн (как, впрочем, и несколькими веками ранее и до конца девятнадцатого века) применялась в производстве дымного пороха.
Семейные традиции предписывали получать селитру из древесной золы, однако войны привели к нехватке древесины, и было решено сжигать морские водоросли, которых на северном побережье Франции всегда было в избытке. Когда Куртуа добавил к золе водорослей концентрированную серную кислоту, он наблюдал выделение фиолетовых паров, которые, конденсируясь на внутренней стороне контейнера, образовывали чёрно-фиолетовые кристаллы. В некоторых интернет-источниках написано, что серную кислоту на золу опрокинул кот, но сдается мне, что эта подробность добавлена сторонниками реставрации культа древнеегипетской кошкобогини Баст, которых немало в интернете в последнее время.
Изумлённый наблюдениями Куртуа отправил образцы кристаллов наиболее именитому французскому химику того времени — Жозефу Гей-Люссаку. Гей-Люссак подтвердил открытие нового элемента и назвал его йодом (от греческого «фиолетовый»). Куртуа продолжил эксперименты с йодом и вскоре обнаружил интересную деталь — обработка кристаллов йода концентрированным аммиаком давала вещество коричневого цвета, которое после сушки взрывалось от любого прикосновения. Куртуа не пострадал от действия обнаруженного им йодистого азота, однако его современник — Пьер Дюлон, работая с этими кристаллами, потерял глаз и несколько пальцев, став первой жертвой этого капризного материала.
Вскоре было обнаружено, что йод токсичен, а его раствор в спирте может останавливать воспаление, и йодную настойку начали применять для дезинфекции ран и царапин. И в наши дни, несмотря на появление новых дезинфицирующих агентов, йодная настойка продается в аптеках, и, увы, многие считают, что это и есть йод (на самом деле йод — черно-фиолетовые кристаллы, а в аптеках продается 2 % раствор йода в спирте). Нелишне напомнить, что при обработке ран и порезов йодной настойкой не стоит мазать ей сами поврежденные ткани, нужно обработать только края раны — йод, хотя и является самым инертным из галогенов, всё же достаточно активный неметалл, и его попадание в рану может вызвать химически ожог и замедлить заживление.
Уже через пару лет после открытия йода женевский врач Жан-Франсуа Кванде предположил, что появление эндемического зоба, связанное, как мы знаем сейчас, с неправильной работой щитовидной железы, обусловлено недостатком йода в пище. Кванде тут же решил проверит свою догадку (ставить медицинские эксперименты в том время было просто — комитетов по этики еще не придумали, да и письменное согласие у участника эксперимента брать не требовалось). Он начал заставлять своих испытуемых принимать йодную настойку вовнутрь чайными ложками (вообще у участников таких экспериментов должны были бы наблюдаться химические ожоги слизистой оболочки рта и пищевода, но история об этом умалчивает). Через 6–10 недель перорального приема спиртового раствора йода зоб у пациентов действительно уменьшался в размере, а иногда и исчезал, однако заметив этот прогресс в лечении коллеги Кванде обвинили его в том, что он лечит не конвенционными пиявками и нюхательными солями, и вообще — не лечит, а травит пациентов. Возможно, осложнения после лечения у пациентов Кванде были, поскольку коллективное обвинение коллег Кванде подействовало, и вскоре врач-экспериментатор боялся выйти на улицу.
Однако жизнь показала. Что Кванде был на правильном пути. Уже в девятнадцатом веке эффективность работы щитовидной железы была соотнесена с йодом, вот только оказалось, что лечить образование зоба нужно менее опасным для здоровья, чем элементарный йод, йодидом калия (йодид калия входил в состав антиструмина, который в школе нам каждую неделю давали бесплатно, он же входит в состав совершенно не бесплатного йодомарина). В начале 1920-х некоторые кантоны Швейцарии первыми в Европе начали использовать йодированную соль для профилактики заболеваний щитовидной железы (в йодированную соль добавляют йодат калия, который в организме превращается в йодид), это успешный опыт переняла Европа, и скоро слово «кретинизм» (гормональное заболевание, вызываемое нарушениями работы щитовидной железы, выраженным снижением функции щитовидной железы, отличающееся задержкой физического и умственного развития), стало из медицинского термина простым ругательством.
54. Ксенон
Как уже упоминалось выше, Уильям Рамзай и его ассистент Моррис Уильям Траверс открыли три инертных газа в ходе одного эксперимента в 1898 году.
Первоначально Траверс предложил дать новому элементу название, опираясь на голубую окраску его спектральной линии, однако у к тому времени был открыт цезий, название которого уже было дано по голубой спектральной линии (к тому же в Периодической системе новый инертный газ и цезий оказывались соседями). В конечном итоге Рамзай и Траверс сошлись на названии «ксенон» от греческого «ксенос» — чужой или странный. Вряд ли, давая это название, они предвидели, каким странным станет этот элемент — первый благородный газ, «потерявший благородство», благородный газ, который будет интенсивно работать в грузоперевозках — освещать дорогу автомобилям и помогать запуску космических кораблей.
Траверсу и Рамзаю потребовалось несколько месяцев, чтобы получить чистый ксенон и измерить его плотность и атомную массу. Это не удивительно — ксенон наименее распространён в атмосфере. Так, окружающий нас воздух содержит 1 % аргона по объему, 18 миллионных долей неона, 5 миллионных долей гелия, одну миллионную долю криптона и только 0.09 миллионных долей ксенона — в 100 м3 воздуха содержится около 9 см3 ксенона. Естественно, что это делает ксенон самым дорогим из инертных газов (имеется в виду, обладающих стабильными изотопами), и в России ежегодно из воздуха получают всего лишь 1500 м3 чистого ксенона.
Хотя ксенон и образует химические соединения, применяется он все же как простое вещество. Несмотря на высокую стоимость, ксенон незаменим в ряде случаев. Ксенон используют для наполнения ламп накаливания (высокая атомная масса газа в колбах ламп препятствует испарению вольфрама с поверхности нити накаливания) и мощных газоразрядных источников света. Ксенон как в чистом виде, так и с небольшой добавкой паров цезия, является рабочим телом для электрореактивных (главным образом — ионных и плазменных) двигателей космических аппаратов. Принцип работы двигателей заключается в том, что при ионизации атомы ксенона разгоняются до скорости около 30 километров в секунду, и, вылетая из сопла двигателя, двигают космический аппарат в противоположном направлении.
Ксенон стал первым инертным газом, который показал, что не такой уж он и инертный. В марте 1962 года химик Нил Барлетт, родившийся в Ньюкасле (Великобритания), и успевший за свою жизнь поработать и в Британии, и в Канаде, и в США, получил первое соединение инертного газа. Первоначально Барлетт обнаружил, что смесь газообразных кислорода и гексафторида платины реагировала с образованием твердого красного вещества — гексафторплатината дикислорода, O2+[PtF6]−. Сопоставив энергии ионизации молекулярного кислорода 1175 кДж/моль) и ксенона Xe (1170 кДж/моль), он попросил у коллег-физиков ксенон для эксперимента и, смешав газообразные ксенон и гексафторид платины, получил первое производное ксенона — гексафторплатинат ксенона — Xe+[PtF6]−. Сейчас список производных ксенона и криптона довольно широк, и термин «химия благородных газов» уже не звучит как оксюморон.
Нерадиоактивный нуклид 129Хе, на который приходится почти четверть природного ксенона, является идеальным контрастом для МРТ. Обычно аппараты магнитно-резонансной томографии позволяют определять ядра водорода, что достаточно для большинства биологических тканей, но бесполезны для того, чтобы узнать, что происходит в лёгких. Ксенон-129 может быть не только легко обнаружен в лёгких, но и при его растворении в крови, что позволяет следить за работой лёгких в режиме реального времени.
С 1 сентября 2014 Всемирное антидопинговое агентство добавило ксенон и аргон в Список запрещенных веществ и методов подготовки спортсменов, причисляя их к допингам. Трудно представить, что химически инертные благородные газы могут улучшить спортивный результат, но тем не менее ксенон проявляет определенную биологическую активность — известно, что он повышает способность крови переносить кислород. Аргон, как полагается, работают таким же образом.
Ксенон может оказывать влияние на белковые рецепторы и ионные каналы, действуя как гипоксия-индуцируемый фактор, аналогичное действие оказывает закись азота (веселящий газ). В течение уже многих десятилетий ксенон, как и закись азота, используется в качестве полного анестетика, в том числе и в России.
Если речь идет об улучшении спортивных результатов, спортсмены начали вдыхать ксенон, заменяя этим газом тренировки на большой высоте, где концентрация кислорода понижена. Ксенон и аргон покинут организм в течение нескольких часов, но последствия вдыхания инертных газов, улучшающих производительность спортсменов, эффект может длиться несколько дней. Правда, в процессе подготовки этой книги я так и не нашел, как Агентство планирует проверять атлетов на предмет ксеноново/аргонового допинга.
55. Цезий
Моя учёба в университете пришлась на расформирование в нём военной кафедры (я один из последних её выпускников). Временами вместо занятий по тактике мы выезжали на базу, где помогали готовить «военку» к закрытию — сортировали имущество, идущее на возврат в армию и на списание (списанный общевойсковой защитный комплект, например, долго мне служил во время походов по лесу, а сорбенты из списанных противогазных фильтров я применял для очистки растворителей во время своей аспирантуры, пришедшейся на глобальное падение финансирование научных исследований).
Да, офицеры относились позволяли брать часть списываемого имущества для личных нужд, но всё же это не был аттракцион неслыханной щедрости — при выходе с базы нам вежливо командовали приготовить карманы и личные вещи к осмотру. Эксцессов не было никогда за исключением одного случая, когда один из моих коллег набил полные карманы кусочками золотистого металла, запаянного внутрь стеклянных капсул. Обнаруживший это майор долго и неприлично смеялся, повторяя, что, если бы не было проверки, парные мужские органы несуна «сварились бы вкрутую», и даже не стал составлять рапорт. Незадачливый студент-курсант рассовал по карманам образцы радиоцезия — радиоактивного нуклида цезия, который применялся (а может и применяется сейчас) для поверки и калибровки войскового малогабаритного рентгенометра-дозиметра ДП-5в.
История сохранила примеры, когда близкое знакомство с радиоцезием закончилось более плачевно. Печально известен произошедший в 1987 году Гоянский инцидент — радиоактивное загрязнение, произошедшее после кражи около 93 грамм радиоактивного 137CsCl из заброшенной больницы в Гоянии (Бразилия). Голубое свечение радиоактивного порошка (хлорид цезия был смешан с люминофором) привлекло внимание людей, к которым он попал в руки. Дело было накануне бразильского Дня Мёртвых и, готовясь к карнавалу, жители Гоянии начали натирать им кожу, используя как грим для вечеринок, дарили его как подарки, в результате чего радиация унесла жизни четырех людей (в том числе и шестилетней девочки), а еще около двух сотен стали жертвами радиоактивного поражения разной степени тяжести.
Многие участники химических олимпиад знают, что существует два металла золотисто-жёлтого цвета — собственно золото и цезий. Теоретически различить их достаточно легко — цезий (теоретически) можно расплавить теплом руки, его температура плавления всего лишь 28.4 °C. Правда, если мы хотим выступать с трюком «рука, которая плавит металл» нужно запаять цезий в стекло или прозрачный полимер — прикосновение незащищённой рукой к металлическому цезию может вызывать интенсивную реакцию щелочного металла с влагой, неизбежно находящейся на наших руках, да и с кислородом воздуха цезий будет реагировать не менее охотно.
Название цезия происходит от древнегреческого слова, означающего «небесно-голубой» — именно этот в этот цвет окрашена характерная спектральная линии цезия. Этот элемент был открыт в 1860 году Робертом Бунзеном и Густавом Кирхгоффом, которые за год до этого собрали первый спектроскоп, ставший инструментом для проведения анализов нового типа. Упрощая, принцип спектроскопии, можно объяснить следующим образом — энергетическое возбуждение атомов, которого можно достигнуть, например, помещая вещество в пламя, заставляет электроны временно заселять более высокие энергетические уровни. Затем они возвращаются на нижние уровни, высвобождая при этом энергию в форме электромагнитного излучения (света). Спектрометр (с помощью призм или дифракционных элементов) расщепляет этот свет на отдельные линии, в результате чего получается спектр — набор тонких цветных линий. Каждый элемент даёт свой уникальный набор таких цветных линий (можно представить этот набор как своеобразный штрих-код). При анализе вод Бад-Дюркхаймского минерального источника Бунзен и Кирхгоф обнаружили «радужный штрих-код», который не соответствовал ни одному из известных в те времена элементов и отличался интенсивной сине-голубой линией. Именно благодаря цвету, который появляется в спектре благодаря оного из электронных переходов цезий и получил своё название. Цезий стал первым химическим элементом, обнаруженным с помощью спектроскопии. В чистом виде цезий впервые в 1882 году выделил шведский химик Карл Сеттербергом. Для этого он использовал электролиз расплава смеси цианида цезия (CsCN) и бария.
Цезий применяется используется в атомных часах — наиболее точных устройствах для определения времени, да и сама секунда с 1967 года определяется через свойства цезия: «Секунда — время, равное 9192631770 периодам излучения, соответствующего переходу между двумя сверхтонкими уровнями основного состояния атома цезия-133» (Положение о единицах величин, допускаемых к применению в Российской Федерации. Федеральный информационный фонд по обеспечению единства измерений. Росстандарт.). Точность атомных цезиевых часов — одна секунда за 300 000 лет. Атомные часы используются в системах спутниковой и наземной телекоммуникации, в базовых станциях мобильной связи, международных и национальных бюро стандартов и службах точного времени.
Как и все щелочные металлы цезий легко окисляется — на его внешнем электронном уровне находится всего один электрон, который легко отрывается действием любого окислителя — кислорода, кислоты или воды. Внешний электрон щелочного металла удерживается у ядра за счет электростатических взаимодействий (ядро атома заряжено положительно, электрон — отрицательно), чем больше радиус атома, тем менее прочная сила связывает электрон с ядром. Электрон цезия держится у ядра слабее всего, и, таким образом, цезий является самым активным щелочным металлом. Конечно в школах и даже институтах говорят, что у франция — щелочного металла, располагающегося в Периодической системе под цезием, расстояние между ядром и внешним электроном ещё больше, и самым активным щелочным металлом (да и металлом вообще) должен быть он. Но это не так, пальма первенства принадлежит всё же цезию.
Дело не в том, что, говоря об активности металлов, мы оцениваем свойства только тех элементов, которые встречаются в земной коре. Цезий действительно активнее франция. Чтобы понять этот феномен, нужно вспомнить о «Гнусной теории Эйнштейна» — франций относится к тем химическим элементам, на свойства которых оказывают значительное влияние так называемые релятивистские эффекты — эффекты, являющиеся следствием специальной теории относительности. Причина появления этих эффектов в том, что обладающее большим положительным зарядом ядро тяжёлых атомов разгоняет электроны до скоростей, составляющих 1–5 % скорости света. В результате этого релятивистская масса электронов увеличивается, и, если моделировать параметры атома франция с учетом эффектов теории относительности, получается, что атомный радиус франция меньше радиуса цезия, следовательно — отобрать электрон у цезия проще, чем у франция. Активность франция и цезия сравнивали не только с помощью теоретических расчетов, но и экспериментально. Потенциал ионизации (энергия, необходимая для отрыва электрона от внешнего уровня) у цезия, франция и рубидия составляют 3.89, 4.07 и 4.18 эВ соответственно. Может это и к лучшему, что самым активным металлом является цезий, а не тот элемент, общее содержание которого в земной коре оценивается в 350 граммов.
56. Барий
Возможно, у кого-то барий может вызывать не самые приятные ассоциации — «бариевая кашка» или «бариевая клизма» представляют собой в равной степени неприятные процедуры для диагностики состояния желудочно-кишечного тракта. Компонентом обоих «коктейлей» является твердый нерастворимый сульфат бария (строго говоря, «кашка» отличается от «клизмы» только способом введения в организм).
Барий непрозрачен для рентгеновского излучения, поэтому его можно будет легко наблюдать при диагностике с помощью рентгеновского аппарата. Непрозрачность сульфата бария в рентгеновских лучах объясняет помимо прочего и то, что, что эту соль бария добавляют в АБС-пластик, из которого делают кирпичики для конструкторов LEGO — бывает, что у родителей появляется подозрение, что чадо заглотило какую-то детальку в процессе игры, и для опровержения или (увы) подтверждения этого подозрения необходимо, чтобы какие-то компоненты кирпичика отражали излучение рентгеновского аппарата. Сам АБС-пластик в рентгеновских лучах прозрачен.
К счастью для пациентов и производителей LEGO сульфат бария не растворяется ни в воде, ни в кислотах умеренной концентрации (к последним можно отнести содержимое нашего желудочного сока). К счастью, потому что ион бария чрезвычайно токсичен — он нарушает согласованную работу нервной системы, в результате чего у человека развивается аритмия, лихорадка и слабость, которая потенциально может при вести даже к смерти от паралича органов дыхания или остановки сердца. Для смертельного отравления барием среднестатистическому человеку потребуется около грамма бария. Какое-то время назад карбонат бария был компонентом крысиной отравы — не растворяясь в воде, как и сульфат, карбонат мог длительное время лежать с приманками, однако в желудке крысы бариевая соль слабой угольной кислоты взаимодействовала с соляной кислотой желудочного сока, и довитый ион бария попадал в организм грызуна.
Оксид бария впервые получили в 1774 году Карл Шееле и Юхан Ган, а металлический барий в 1808 с помощью электролиза выделил уже неоднократно упоминавшийся в этой книге английский химик Хемфри Дэви. Барий — мягкий и тяжёлый металл, относящийся к щёлочноземельным металлам. Среди них он является наиболее активным, и поэтому с помощью металлического бария часто очищают от следов кислорода аргоновые или вакуумные линии.
Отличительная черта соединений бария — высокая плотность. Так, самый известный и распространённый минерал бария — барит (он же сульфат бария BaSO4), иначе называют «тяжёлым шпатом» (его плотность 4.5 г/см3). Название бария происходит от греческого barys — тяжёлый. Благодаря высокой плотности барит применяют в бурении нефти.
Карбонат бария годится не только на то, чтобы травить грызунов — его используют в производстве стекла, барий может усилить его блеск. Сульфат бария добавляют не только в буровые растворы, кашки, клизмы и LEGO — из него делают пигменты, керамические изделия и стройматериалы, немалое количество сульфата бария идёт на производство резины. Нитрат и перхлорат бария являются основой пиротехнических составов, дающих зелёный цвет огням фейерверка или сигнальным ракетам; титанат бария с 2007 года применяется в источниках энергии для электромобилей. Несмотря на то, что барий является четырнадцатым по распространённости в земной коре элементом, многочисленные области применения обеспечивают высокий спрос на этот металл и относительно высокую цену.
Удивительно, но этот токсичный металл, точнее его соединения, может многое рассказать об истории жизни на Земле. Осадочные отложения барита на дне океана образуются пропорционально активности океанического фитопланктона, представляющего собой подножие пищевых пирамид в море и океане. Характер осаждения сульфата бария в осадочных породах позволяет говорить производительности океанической экосистемы в любой момент геологической истории Земли, а то, что сульфат бария в отличие от других осадочных пород, нерастворим, позволяет добывать из него информацию о миллионах лет жизни океана.
57. Лантан
Если внимательно посмотреть на Периодическую систему, можно увидеть, что атомные номера химических элементов в ней идут не непрерывно. В некоторых таблицах после бария с его атомным номером 56 стоит пустая клетка, а после неё идет элемент № 72 — гафний (если таблица отпечатана с учетом требований ИЮПАК от ноября 2016 года), в других (более старых) гафний будет идти не после пустой клетки, а после элемента № 57 — лантана.
В любом случае — две группы по 15 (современная версия Периодической системы) или 14 химических элементов вынесены в отдельные семейства вне рядов и период. Первая такая группа, которую «отпочковал» от Периодической системы в 1921 году Нильс Бор — лантаноиды, а элемент, начинающий группу лантаноидов — лантан. В конце 1980-х годов, когда я постигал неорганическую и прочие химии в стенах Казанского университета, о лантане и лантаноидах нам рассказывали в стилистике рассказа об истории мидян — поскольку непонятно, зачем можно использовать лантаноиды, оставим информацию о них полной тёмных пятен. Прошло три десятка лет, и ситуация изменилась — не знаю, конечно, что рассказывают про лантаноиды первокурсникам на лекциях, но эти элементы и их соединения стали весьма востребованными в современных технологиях от камер смартфонов до плавательных бассейнов.
Но обо всём по порядку — начнём с лантана. Этот элемент был не первый, хотя и один из первых открытых лантаноидов. Первое соединение лантана было открыто шведским химиком Карлом Густавом Мозандером в 1839 году, а первый образец металлического лантана удалось получить только в 1923 году. Лантан неожиданно оказался в минерале церия, с которым работал Мозандер. Появление соединения нового элемента в образце было столь неожиданно для исследователя, что он решил назвать новый элемент лантаном (от греческого «лантано» — скрываюсь от взора. Лантан — один из наиболее активных лантаноидов, он активно реагирует с горячей водой. Лантан вместе с церием и неодимом относится к наиболее распространенным редкоземельным элементам.
В тех областях, в которых применяется лантан, он больше всего напоминает артиста, постоянно исполняющего роли героев второго плана — такие появляются в различных фильмах, постоянно играя разных персонажей и не имея строго амплуа. В настоящее время производство металлического лантана достаточно дёшево, и он часто используется как вспомогательный материал. Небольшие количества лантана добавляют в железо или сталь, при этом понижается их хрупкость, введение лантана в вольфрам позволяет повысить долговечность электродов для дуговой сварки. Кремень зажигалок делают из смеси редкоземельных металлов (мишметалла), и примерно четверть в этой смеси приходится на лантан.
Немалая доля соединений лантана применяется для изготовления стёкол. В течение долгого времени для увеличения коэффициента преломления стекла использовали оксид свинца. Увеличение коэффициента преломления означает, что свет медленнее распространяется в прозрачной среде и меняет направление распространения, попадая из воздуха в стекло, однако в свинецсодержащих стёклах увеличению преломления сопутствует рассеяние света — оптика из свинцовых стекол может быть мутной, что, очевидно, нехорошо. Лантановые стёкла отличаются столь же высоким показателем преломления, как и свинцовые, но меньшим светорассеянием (не говоря уже про то, что замена токсичного свинца на лантан делает процесс стекловарения менее опасным для тех, кто занят при производстве стекла). Стёкла повышенной прозрачности, которые производя, используя оксид лантана, применяются в камерах смартфонах и профессиональных телескопах. Карбонат лантана может применяться и как лекарство при гиперфосфатемии для поглощения избытка фосфатов в организме, и для борьбы с фосфатами водах бассейнов — фосфаты представляют собой хорошие удобрения для сине-зелёных водорослей, и, если не удалить эти анионы из бассейна, он «зацветёт». Ещё одно интересное свойство солей лантана, связанное с изменением цветов — цветная реакция ацетата лантана с йодом, при которой обработанный йодом гель ацетата лантана приобретает тёмно-синий цвет, характерный для йодкрахмальной пробы.
Лантан может быть полезен не только для того, чтобы расширить наши представления о пространстве, глядя в телескоп, но и для расширений наших представлений о времени — он используется в радиоизотопной датировке. Самый известный способ радиодатировки — радиоуглеродный анализ, который проводят с помощью измерения содержания в материале радиоактивного 14С по отношению к стабильным изотопам углерода. Этот метод был предложен лауреатом Нобелевской премии по химии 1960 года Уиллардом Либби в 1946 году. Период полураспада углерода-14 составляет примерно 5700 лет, и где-то через 60 000 лет после прекращения в образце углеродного обмена количество радиоактивного углерода в нём становится столь мало, что заглянуть в прошлое глубже, чем на шестьдесят тысяч лет, с помощью радиоуглеродного анализа невозможно. Тем более невозможно применять радиоуглеродную датировку для образцов неорганического происхождения, например, керамики или скальных пород.
В геологии применяется лантан-бариевая датировка. Она основана на том, что радиоактивный нуклид 138La отличается огромным периодом полураспада — 1,02×1010 лет, образуя при распаде нуклид 138Вa, таким образом измерение соотношений лантана и бария позволяет определить возраст гранита или базальта. Правда, при таком периоде полураспада лантана точность датировки весьма специфична — в одной из статей, посвящённой применению лантан-бариевой датировки, написано, что возраст горной породы был определён с высокой точностью, составлявшей плюс-минус 3.7 миллионов лет.
58. Церий
Первым открытым лантаноидом был церий, и, как это часто было до появления Периодического закона, его открытие было случайным.
Где-то в начале 1800-х годов молодой шведский геолог Вильгельм Хизингер, пополняя коллекцию минералов в поместье своего отца, обнаружил камень, который поразил его неожиданно высокой плотностью. Надеясь, что он обнаружил руду недавно открытого вольфрама, Хизингер направил образец породы Карлу Вильгельму Шееле, который проделал анализы и разочаровал молодого ученого, сказав, что вольфрама в камне нет. Хизингера ответ не устроил, и он продолжил изучать руду совместно с Йёнсом Якобом Берцелиусом. В 1803 году шведские исследователи выделили из образца нерастворимый оксид нового элемента, обладающего металлическими свойствами. Примерно в то же время немецкий аналитик Мартин Клапрот выделил этот же оксид из другого скандинавского минерала. Сообщения Берцелиуса-Хизингера и Клапрота об открытии нового элемента были опубликованы в одном и том же журнале с интервалом в месяц, что, естественно породило споры о том, что же на самом деле был первооткрывателем. Элемент решили назвать в честь самой крупной из малых планет — Цереры, в свою очередь, получившую имя в честь римской богини плодородия. Клапрот настаивал на названии «церерий», но Берцелиус и ряд примкнувших к нему коллег справедливо заметили, что кому-то кроме немцев, такое название будет даваться не без труда, и металл стал церием. Металлический церий удалось получить только в 1870-е годы электролизом его расплавленного хлорида.
Сам по себе металлический церий, как и много других металлов совершенно невзрачен на вид — обычный серебристо-серый металл, который тускнеет на воздухе из-за окисления и образования оксидной плёнки. Более интересен этот металл, измельчённый в порошок — в особенности порошкообразный сплав церия с железом. Этот материал при ударе или трении разбрасывает во все стороны сноп искр, что и позволяет делать из него кремни для зажигалок или искрящие кухонные ножи для телешоу. Чем это можно объяснить? Церий очень электроположительный металл, который легко отдаёт свои электроны, и при образовании оксида церия (СеО2) выделяется много энергии, которая и отвечает за появление искр. Оксид церия очень твёрдый — часто его добавляют в искусственный гранит или искусственную каменную облицовку, а абразив на основе оксида церия — политирит, идеален для шлифовки стекла для зеркал или оптических устройств. Оксид тоже ведёт себя не совсем обычно — хотя его называют оксидом церия(IV), и он должен соответствовать формуле CeO2, в реальности в среднем на один атом церия в этом оксиде приходится немного меньше, чем два атома кислорода — поверхность оксида покрыта многочисленными дефектами, в которых атом кислорода должен был находиться, но на самом деле его нет. Такой, «неправильный» оксид церия применяется в каталитических конверторах легковых и грузовых автомобилей. Проволочная сетка с нанесённом на неё оксидом церия отдаёт свой кислород, окисляя углеводородное топливо во время обеднённой кислородом фазы работы двигателя и пополняет свои кислородные запасы, когда с ней контактирует богатая кислородом топливно-воздушная смесь. Нанопорошок оксида церия, смешанный с дизельным топливом, позволяет добиться более полного сгорания тяжёлых нефтяных фракций и избавить автобусы и грузовые автомобили от их вечных спутников — шлейфов сажи, вырывающихся из выхлопной трубы. Церий находит применение и в медицине — соли этого элемента могут предотвратить симптомы «морской болезни».
59, 60. Празеодим и Неодим
В наше время в Периодической системе нет элемента с названием «дидим» (Di, didymium), однако этот термин применялся и в те дни, когда Менделеев ранжировал химические элементы, и в наши дни это название, как и символ Di можно найти в статьях, посвящённых химии редкоземельных элементов — под видом элемента-дидима почти полвека скрывалась смесь двух химических элементов — неодима и празеодима.
Конечно, все элементы, относящиеся к группе лантаноидов очень сложно отделить друг от друга — даёт знать колоссальная близость их химических и физических свойств (недаром в предыдущих главах упоминался «мишметалл» — техническая смесь этих элементов, которую нет смысле разделить), но даже среди лантаноидов неодим и празеодим оказались «двоими из ларца, одинаковыми с лица».
В 1839 году Карл Густав Мосандер — шведский врач и химик — заявил об открытии нового химического элемента. По забавной иронии судьбы он назвал это элемент «дидимом» от греческого слова «близнец». Мосандер не предполагал, насколько точно его предложение отражает суть того, что он считает индивидуальным химическим элементом — он просто отметил уникальное, на его взгляд, сходство свойств нового «элемента» с лантаном, что и отразил в названии. То, что название отражает суть открытия, и элемент дидим на самом деле — смесь двух элементов-близнецов, стало ясно позднее, когда об индивидуальности элементов и веществ стали говорить, опираясь не только на их физические и химические свойства, но и на появившийся в результате совместной работы Бунзена и Кирхгофа метода спектроскопии. Выше, характеризуя метод спектроскопии, я уже упоминал о том, что для каждого элемента его спектральный «штрих-код» уникален и неповторим, но при этом не меняется в зависимости от происхождения образца элемента. Почти сразу же после того, как Кирхгоф и Бунзен осознали, какие возможности им дает спектроскоп в открытии новых элементов, они же поняли, что с помощью спектроскопии можно установить, насколько чист тот или иной образец.
В 1870-х годах Бунзен заметил, что спектры образцов соединений дидима, полученных из различных источников различались, и на основании этого предположил, что дидим представляет собой смесь элементов. Решить эту задачу он предложил своему ученику — австрийскому химику Карлу Ауэру фон Вельсбаху. После сотен дробных перегонок в 1885 году фон Вельсбаху удалось выделить из дидима два производных разных химических элементов. Один из элементов, соли которого были окрашены в зелёный цвет, получил название празеодим — «зелёный близнец», второй был назван неодимом — «новым близнецом».
Несмотря на то, что в конце девятнадцатого века дидим оказался двумя элементами, и расширил своё влияние на две клетки Периодической системы, сложности в отделении неодима от празеодима и наоборот приводили к тому, что в ряде случаев на практике применялись не отдельные элементы, а их смесь, которую по старой традиции продолжали называть «дидимом». Наиболее известно «дидимовое стекло» — стекло, которое получают, используя неразделённую смесь оксидов неодима и празеодима. Дидимовое стекло сильно ослабляет линии спектра излучения атомов натрия, и, если их такого стекла изготовить очки для стеклодува, ему будет гораздо проще придавать стеклу требуемую форму. В дидимовых очках стеклодув просто не будет обращать внимание на жёлто-оранжевое свечение раскалённого и размягчающегося стекла.
Разделять празеодим и неодим для практического применения научились только в 1940-х годах (несколько сот дробных перекристаллизаций, которые провел фон Вельсбах для выделения граммовых количеств соединений было достаточно для подтверждения открытия нового элемента, но этот метод явно не подходил для применения чистых неодима и празеодима в промышленных масштабах). В 1940-е годы американские химики во главе с Френком Спеддингом разработали методы ионообменной хроматографии, которые позволили избавиться от утомительных перекристаллизаций и в течение пары лет в лабораторных условиях получить килограммовые количества «зелёного и нового близнецов», сделав возможным их практическое применение уже не в виде «дидима».
Оказалось, что сплавы празеодима с германием и кремнием, обладающие свойствами полупроводников, при понижении температуры ведут себя как сверхпроводящие материалы. Сплавление же неодима, железа и бора позволило получить ферромагнитный материал для изготовления сверхмощных постоянных магнитов, которые применяются не только в электрических моторах и электронных устройствах, но и применяются для размещения магнитных картинок и букв на досках в детских садах и начальной школе.
Ярко-зелёные спектральные линии неодима, которые в своё время дали повод Бунзену подумать о том, что дидим — это не один химический элемент, тоже находят применение — небольшое количество оксида неодима, вводящееся в материал для изготовления алюмоиттриевого граната (материала для изготовления рабочего тела лазера) дает возможность лазерному устройству (в том числе и лазерной указке для лекций и презентаций) испускать ярко-зелёное свечение.
61. Прометий
Персонажем греческой мифологии, более всего сделавшем для науки и человечества, однозначно можно считать Прометея. По одной версии его можно считать первым химиком-технологом, который подарил людям секрет добычи и применения огня, по другой, Прометею была не чужда и фундаментальная наука — он обучил людей математике, астрономии, медицине и тому, как возделывать землю.
В поэмах Гесиода даже говорится о том, что Прометей приложил руку к созданию рода человеческого — он вылепил их из глины, а Афина вдохнула в вылепленные из глины тела жизнь и дух. Неопределённость того, что же конкретно Прометей сделал для нас, возможно и является причиной того, что сейчас довольно сложно определиться, кого можно считать первооткрывателем прометия, элемента с порядковым номером 61. Зато мы знаем, что предложил прометию его название. «Крестной матерью» элемента № 61 можно считать Грейс Кориелл, жену американского химика Чарльза Кориелла, который вместе с коллегами Джейкобом Марински и Лоуренсом Гленделином в 1945 году с помощью ионообменной хроматографии выделили прометий из продуктов деления урана (J. Am. Chem. Soc. — 1947. — Vol. 69. — P. 2781–2785). До этого в 1920-е годы с заявлениями об открытии элемента № 61 выступали ученые из Италии и из Иллинойского университета, однако эти заявления не были подтверждены. Вскоре после того, как в результате работы Кориелла и соавторов стало ясно, что искомый элемент № 61 наконец, обнаружен, Грейс Кориелл, вероятно представила мужа и его коллег кем-то в роли титанов, добывающих огонь у богов (а может быть такие эмпиреи не заботили её и на название прометия повлияла программа по созданию атомного оружия, в рамках которой проводили исследования Кориелл, Марински и Гленделин).
Подозрения о том, что такой элемент, как прометий, может существовать, появились уже в 1902 году, когда уже разъяснилась ситуация с празеодимом и неодимом, и был открыт самарий. Чешский химик Иоганн Богуслав Браннер, следя за увеличением атомных масс в ряду Pr — Nd — Sm, предположил, что переход по массе от неодима к самарию слишком резкий, и тенденция изменения атомных масс требует присутствия между неодимом и самарием ещё одного элемента. Догадки Браннера перестали быть просто догадками, когда британский физик Генри Мозли нашёл взаимосвязь между порядковым номером элемента в Периодической системе и характеристической частоты рентгеновского излучения элемента. Закон Мозли дал возможность определить положение элементов в Периодической таблице, просто анализируя его спектр рентгеновского излучения и с принятия физиками и химиками закона Мозли основой классификации химических элементов стал уже порядковый номер атома, а не его масса. В соответствии с рассуждениями Мозли, существование элемента № 61 тоже было бесспорным. Сам Мозли не успел объяснить причины наблюдавшейся им закономерности — он погиб во время Галлиполийской операции в 1915 году.
В конечном итоге порядковый номер элемента в Периодической системе приобрёл физический смысл благодаря Джеймсу Чедвика, который установил, что порядковый номер элемента совпадает с зарядом его ядра.
Одна из причин того, что прометий долго не давался в руки исследователям в том, что это второй из элементов со сравнительно небольшим атомным номером и атомной массой, у которого не существует устойчивых изотопов. Таких элементов с атомным номером меньше, чем 83, всего два — технеций и прометий. Наиболее устойчивый (если так можно говорить про радиоактивные изотопы) нуклид прометия — прометий-145 (145Pm), его период полураспада составляет чуть менее 18 лет. Именно поэтому обнаружить прометий было столь сложно. Да, соединения прометия в крошечных количествах содержатся в урановой смолке — они образуются при самопроизвольном расщеплении урана-238, но на одну тонну урановой руды приходится триллионная грамма прометия, и, очевидно, его нельзя обнаружить в руде. Правда, говорить о том, что в окружающем нас мире существованием прометия можно пренебрегать, тоже нельзя — спектральные методы астрономии позволяют наблюдать, что звезда HR465, расположенная в туманности Андромеды, выбрасывает в пространство вокруг себя большое количество металлов, тяжелее железа среди которых и прометий.
Прометий применяется в радиоизотопных источниках тока, где он присутствует в виде оксида Pm2O3. Распадаясь, прометий испускает β-излучение (поток электронов, образующихся при превращении нейтрона ядра в пару протон-электрон, заряд атомного ядра при β-распаде увеличивается на одну единицу, а масса атома сохраняется). Благодаря тому, что в излучении прометия при распаде отсутствуют гамма-лучи, он сравнительно безопасен. Изначально прометий использовали для замены радия в светящихся стрелках и циферблатах часов — прометий оказался менее опасным, чем радий. Для этого хлорид прометия смешивали с люминофором, который при попадании потока β-частиц светился жёлто-зелёным или голубым светом. В наше время ни один из радиоактивных изотопов не применяется для изготовления бытовых приборов. Это в 1951 году радиации боялись меньше, и в штатах продавался набор «Юный физик-ядерщик» с настоящими радиоактивными препаратами, продавцы которого разорились не из-за радиофобии, а из-за огромной цены — покупательная способность 50 долларов, который тогда просили за чемоданчик сейчас эквивалентна 450 долларам, дороговато для подарка. Сейчас прометий не применяется в товарах повседневного спроса, только для исследований или сертификации в химии или материаловедении.
62. Самарий
Достаточно обычна ошибка школьников, участвующих в химических олимпиадах — они считают, что элемент самарий назван в честь города Самары. Это не так, но история названия самария не менее интересна, всё равно имея отношение к России. Мы с полным правом можем считать самарий первым элементом, который был назван в честь живого человека, а не древнегреческого бога или мифического создания. Своё название самарий получил благодаря обнаруженному около города Миасса на Южном Урале минералу самарскиту, из которого он был выделен.
Такое название минералу дал немецкий минералог Генрих Розе, желая поблагодарить начальника штаба Корпуса горных инженеров с 1845 по 1861 генерал-лейтенанта Василия Евграфовича Самарского-Быховца, который в 1847 году предоставил ему образец минерала для анализа. Самарий в самарските был обнаружен в 1879 году Лекоком де Буабодраном. Металлический самарий впервые был получен только в начале XX века.
Самарий — редкоземельный металл с характерным серебристым блеском. На воздухе он окисляется, а при температуре выше 150 °C воспламеняется. К редкоземельным металлам принято относить скандий, иттрий и пятнадцать лантаноидов (от лантана до лютеция). Термин «редкоземельные» является простым отражением того факта, что эти элементы были выделены из относительно редких оксидных минералов («земель»). В настоящее время редкоземельные элементы приобретают все большую значимость в производстве электроники — компьютеров, смартфонов, фитнесс-трекеров и других устройств.
Самарий позволяет собрать важную информацию о геологической истории Земли. Известно одиннадцать изотопов самария, четыре из которых стабильны, а семь — радиоактивны, причем у трёх — 147Sm, 148Sm и 149Sm исключительно продолжительный период полураспада. Наибольший интерес для геологии представляет 147Sm, период полураспада которого составляет 106 миллиардов лет. Даже по геологическим меркам это огромный промежуток времени — возраст нашей Вселенной оценивается в 13.8 миллиардов лет, а геологический возраст Земли равен миллиардам. Чем так важен для геологии 147Sm? При его распаде образуется неодим, который практически полностью повторяет химические свойства самария. Это, в свою очередь, приводит к тому, что образующийся неодим остается на месте распавшегося самария в кристаллической решетке породы, будь то порода осадочная или магматическая. Более распространённые цепочки распада (наиболее известная из которых — превращение урана в свинец) приводят к образованию элементов, существенно отличающихся от элемента, давшего начало радиоактивным превращениям, в результате чего в местах распада может происходить локальное разрушение кристаллической решётки и потеря минералом части продуктов распада, приводящая к ошибкам в датировке. Слежение за превращением самария в неодим лишено подобного недостатка.
С 1950-х годов самарий применяется в атомной энергетике. Вскоре после Второй мировой войны в США был разработан способ дробной кристаллизации, позволяющий выделить из руд редкоземельных элементов чистый неодим, побочным продуктом которого была смесь самария и гадолиния. Нуклид 149Sm хорошо поглощает нейтроны, и отходы производства неодима стали использоваться как первые поглотители нейтронов в управляющих стержнях атомных реакторов. В наши дни самарий продолжает поглощать нейтроны в реакторных стержнях, но уже в виде так называемого самарий-европий-гадолиниевого концентрата.
Самарий работает и там, где нет радиации — из него делают электроды электродуговых ламп, освещающих съемочные павильоны кино- и телестудий, а также устойчивые к размагничиванию постоянные магниты (наиболее устойчив к размагничиванию полученный сравнительно недавно интерметаллид SmCo5). Такие магниты применяются в динамиках колонок и наушников, а также в производстве электрических гитар. Оксид самария применяют для изготовления стёкол, поглощающих инфракрасное излучение и для легирования кристаллов фторида кальция, предназначенных для оптических лазеров. В последнее время высокотехнологичные сектора производства, требующие применять больше самария и других редкоземельных элементов, растут, что приводит к увеличению спроса на эти элементы и их цены. Заметим, что «китайское чудо» — значительное увеличение производства электронных устройств в Китайской народной республике связано в том числе и с тем, что на территории КНР расположены самые богатые запасы самария и других редкоземельных элементов на Земле.
63. Европий
Как это часто бывает для элементов, открытых в конце девятнадцатого, начале двадцатого века, приписать пальму первенства открытия европия кому-то одному довольно сложно.
К обнаружению европия причастен британский химик и физик Уильям Крукс, который более известен своими работами, которые, в конечном итоге привели к созданию кинескопов для телевизоров и компьютерных мониторов — он обнаружил, что, если приложить к электродам, расположенным внутри стеклянной вакуумированной трубки (трубки Крукса) высокое электрическое напряжение, то в трубке будет наблюдаться необычное свечение. Сам Крукс назвал эффект «катодными лучами», позже стало ясно, что причина свечения — поток электронов, движущихся от катода к аноду; физике также считают Крукса человеком, заложившим основы радиометрии. В 1886 году Крукс проводил спектральный анализ минерала, содержащего иттербий и самарий и заметил, что набор линий, которые позволяет получить спектрометр, указывает на наличие в образце третьего элемента, однако развивать идею и выделять новый элемент из руды Крукс не стал.
Вслед за Круксом спектральные линии нового элемента в соединениях металлов, которые мы сейчас называем лантаноидами, в 1892 году наблюдал Поль Лекок де Буабодран. В конечном итоге чистая соль нового элемента была получена в 1901 году ещё одним французским физиком Эженом-Анатолем Демарсе, который и дал ему название в честь континента Европы. Металлический европий был выделен из соли еще спустя десяток лет. Некоторые специалисты по истории науки сравнивают ситуацию с открытием европия с зеркальным вариантом открытия пенициллина — для нас открытие первого антибиотика связывается с именем Александра Флеминга, однако настоящую пользу пенициллин стал приносить через десять с лишним лет после публикации Флеминга, когда биохимикам Эрнсту Борису Чейн и Хоуарду Уолтеру Флори, о которых помнят только специалисты в области биохимии, удалось выделить пенициллин в чистом виде. С европием ситуация обратная — лавры первооткрывателя этого элемента официально принадлежат Демарсе, а о Круксе и Буабодране почти не вспоминают, хотя, конечно, сравнение было бы более ярким, если бы про европий знало бы примерно столько же людей, сколько знают про пенициллин.
Несмотря на то, что европий не является самым известным химическим элементом, он значительно влияет на наше окружения, применяясь как легирующая добавка. Небольшое количество производных европия добавляют в люминофоры — материалы, которые начинают светиться при воздействии электронов или ультрафиолетового излучения. Люминофоры применялись при изготовлении кинескопов телевизоров и мониторов компьютеров с электронно-лучевыми трубками, в медицине люминофоры используют для рентгена и флюорографию. Способность люминофоров светиться без электрического источника энергии используется в системах эвакуации и пожарной безопасности. Европий позволяет обеспечить свечение двумя цветами — соли трехвалентного европия, добавленные к люминофорам, заставляют их излучать красный свет, а двухвалентного — голубой. Европий является одним из самых дорогих лантаноидов, килограмм металлического европия стоит около 2000 долларов.
Жителям Европы (и не только) довольно часто приходится держать в руках изделия, в которых содержится европий — содержащие этот металл люминофоры применяются для защиты от подделки евробанкнот, что, учитывая происхождение названия элемента, довольно символично.
Длительные трудности с выделением металлического европия, как, впрочем, и его высокая цена связана ещё и с тем, что этот металл проявляет относительно высокую химическую активность (скорость окисления европия кислородом воздуха или взаимодействия с водой сравнимы со скоростью реакции кальция), и при контакте с воздухом европий покрывается слоем жёлтого карбоната Eu2(CO3)3. Европий является хорошим поглотителем нейтронов, но редко применяется в атомной энергетике как из-за высокой стоимости, так и из-за того, что поглощающие нейтроны производные европия выдерживают в ядерном реакторе в полтора раза меньше, чем обычно использующийся для захвата нейтронов карбид бора.
64. Гадолиний
Гадолиний был назван в честь финского химика и геолога Юхана Гадолина, который одним из первых начал изучать образец минерала, найденный около шведского селения Иттербю. В 1792 году Гадолин выделил из минерала иттербита первый редкоземельный металл — иттрий, после чего оказалось, что обильный новыми минералами иттербит — два минерала, один из которых позднее в честь Гадолина был назван гадолитнитом.
Сходство свойств лантаноидов значительно затрудняло возможности их отделения друг от друга в индивидуальном виде, поэтому история гадолиния продолжилась только в 1880 году, когда швейцарский химик Жан де Мариньяк обнаружил в гадолините спектральные линии нового элемента. Шесть лет спустя Лекок де Буабодран выделил из гадолинита оксид нового элемента и назвал его гадолинием. Высокая активность гадолиния, как и других лантаноидов затрудняла его получение в виде простого вещества, и первый образец металлического гадолиния был получен только в 1935 году.
Если посмотреть последнее издание Химической энциклопедии, том с информацией про гадолиний которой был издан в 1988 году, можно увидеть, что и свойствам металла, и его применению в ней уделено буквально несколько строчек. Действительно, информация о химических свойствах гадолиния небогата — так или иначе, она сводится к тому, что гадолиний образует трехзарядный ион Gd3+, который не может похвастаться какой-то интересной окраской солей в растворе — он бесцветный. Тем не менее, именно этот ион и привлекает внимание теоретиков и практиков в последнее время. Уникальность иона Gd3+ в том, что на его 4f-электронном подуровне размещается семь неспаренных электронов, придающих иону большой магнитный момент — именно это свойство гадолиния в последнее время все чаще и чаще эксплуатируется.
Одно из главных направлений применения гадолиния — устройства, которые могут использоваться в холодильных установках, для которых не нужны хладагенты. В настоящее время большая часть промышленных и бытовых холодильных установок работают поддерживают низкие температуры за счет процессов испарения хладагентов — хлорфтоуглеводородов (фреонов), применение которых может быть опасно для озонового слоя. Магнитные элементы, в которых уже работает гадолиний, создают низкую температуру в результате процесса, известного как адиабатическое размагничивание. Работает это следующим образом: под действием постоянного магнитного поля магнитные моменты, создаваемые неспаренными электронами, ориентируются по направлению поля, принимая минимальное значение потенциальной энергии; выделяющаяся при это теплота может отводиться с помощью системы воздушного или жидкостного охлаждения. При отключении магнитного поля магнитные моменты переходят из упорядоченного в хаотичное состояние, и происходит охлаждение материала. С помощью адиабатического размагничивания можно получать температуры вплоть до 0.001 K (Physical Review 1933. —vol. 43, iss. 9. — P. 768), этот способ охлаждения требует на 20–30 % энергии меньше, чем привычные нам системы компрессорного охлаждения, к тому же «магнитным холодильникам» для работы не нужны фреоны.
Магнитные свойства иона гадолиния также успешно применяются как контрасты для магнитно-резонансной томографии, метода медицинской диагностики, который позволяет получать изображения наших тканей и органов. Когда МРТ-исследования применяются для диагностики кровеносной системы или опухолей, гадолинийсодержащие контрастные агенты вводятся внутривенно для улучшения качества изображения.
Радиус иона Gd3+ аналогичен радиусу Ca2+, но заряд гадолиниевого иона больше. Это означает, что простые соли гадолиния нельзя вводить человеку в кровь — организм может «принять» их за кальций, из-за чего нарушится работа ряда биохимических реакций, управляемых ионами кальция. Чтобы обезопасить пациента от токсичного гадолиния, ион Gd3+ «вкладывают в конверт» — получают комплекс иона с лигандом — диэтилентриаминпентауксусной кислотой. С ионом гадолиния связывается одновременно восемь атомов из состава лиганда, что исключает попадание свободного иона в кровь человека (на магнитные свойства иона это связывание не влияет). Комплекс абсолютно безопасен, он циркулирует по кровеносной системе пациента, облегчая диагностику с помощью МРТ, и через некоторое время выводится почками в неизменном виде, не причиняя вреда организму. В целом, для гадолиния постоянно находятся все новые области применения, как, впрочем, и для других редкоземельных элементов, внезапно оказавшихся востребованными в начале XXI века.
65. Тербий
Тербий, ещё один элемент, обнаруженный в той самой руде из-под селения Иттербю, и один из четырёх, названных в честь этого населённого пункта (кроме тербия это иттрий, эрбий и иттербий). Соединения тербия впервые были выделены профессором химии и минералогии Каролинского института в Стокгольме Карлом Густавом Мосандером. Мосандер показал, что оксид иттрия загрязнён двумя другими оксидами — окрашенным в жёлтый цвет оксидом тербия и розоватым оксидом эрбия. Чистые соли тербия удалось получить только в начале XX века с помощью ионного обмена. Это удалось французскому химику Жоржу Урбэну.
Соединения тербия обычно содержат его ион со степенью окисления +3, который стабилен в водном растворе, однако существуют и соединения, в тербий приобретает необычную для лантаноидов степень окисления +4 (правда, соединения, содержащие ион Tb4+, сохраняют устойчивость только в кристаллическом состоянии) — в четырёхокисленном состоянии электронная оболочка тербия идентична по строению оболочке иона Gd3+. Те свойства соединений тербия, благодаря которым они находят применение, являются следствием их оптических и спектральных свойств, тербий вообще можно назвать одним из самых красочных и изученных лантаноидов.
Ион тербия +3 отличается радующим глаз зелёным флуоресцентным излучением (зелёное излучение появляется при облучении производных тербия ультрафиолетом с соответственно подобранной длиной волны). Человеческое зрение особенно чувствительно к зелёному цвету, и флуоресценцию тербия можно заметить даже при небольшом количестве его соединений. Эта особенность тербия делает его производные особенно полезными для производства цветных люминофоров.
Некоторые соединения тербия отличаются весьма экзотическим свойством — они способны к триболюминесценции — излучении света, возникающем при разрушении кристаллических тел, то есть, трещину в кристалле триболюминесцирующего вещества можно обнаружить по характерному свечению. Триболюминесценция производных тербия применяется в волоконно-оптических сенсорах, измеряющих степень механического воздействия на материал — давления, напряжения и вибраций разной природы. Предполагается разработка тербийсодержащих сенсоров, которые будут искать дефекты в крыльях и корпусе летательных аппаратов.
Тербийсодержащие соединения молекулярного строения активно применяются в молекулярной биологии и медицинской диагностики — длительность флуоресценции производных тербия больше, чем у органических флуоресцирующих материалов, к тому же для взаимодействия с тербием можно подобрать такие лиганды, которые будут способствовать тому, что флуоресцентное излучение будет появляться только при контакте с определёнными веществами (например люминесцентные сенсоры на основе тербия применяются для измерения концентрации кислорода в крови). Люминофоры с тербием также могут наноситься на банкноты и документы в качестве защитных меток (иногда совместно с европием), некоторые производные тербия вместе с гадолинием работают в магнитных холодильниках.
Находит применение и металлический тербий. Сплав тербия, железа и диспрозия, известный как терфенол-D, проявляет магнитострикционный эффект — меняет объём и линейные размеры при различной намагниченности. Терфенол используется и для изготовления сонаров подводных лодок, и развлечениях — выполненная на основе этого сплава игрушка «SoundBug» может превратить в динамик практически любую поверхность — стол или стену, заставляя их вибрировать соответствующим образом.
66. Диспрозий
Третий компонент терфенола-D, лантаноид диспрозий, стал ещё одним химическим элементом, который удалось открыть с помощью метода спектроскопии. Так уж получается, что изобретение нового метода или лабораторного устройства позволяло раз за разом находить похожие друг на друга объекты. Так, обнаружение инертных газов было бы невозможно без сосуда Дьюара, трансурановые элементы стали появляться один за другим благодаря созданию атомных реакторов и радиохимии, ну а лантаноиды обязаны своим открытием спектроскопу Бунзена и Кирхгофа.
В 1886 году Эмиль Лекок де Буабодран, уже открывший к тому времени галлий и выделивший самарий из минерала самарскита смог получить чистый оксид диспрозия, выделив его из оксида гольмия с помощью дробной кристаллизации, повторяя процедуры осаждения и растворения фракций около пятидесяти раз, каждый раз проверяя осадок на чистоту с помощью спектроскопии. Когда, наконец, чистый оксид нового элемента был выделен, де Буабодран назвал элемент диспрозием от греческого «диспрозитос» — трудно получить. Металлический диспрозий в 1906 году получил соотечественник Буабодрана Жорж Урбэн.
Близкие химические свойства лантаноидов затрудняли (как, впрочем, и затрудняют сейчас) их выделение и разделение, и можно было бы подумать, что и области применения этих металлов будут близки (хотя и такое есть — например, мишметалл). Однако практическое применение соединений того или иного элемента зависит от их свойств, зачастую магнитных или электронных, а эти свойства определяются числом электронов, которое для каждого лантаноида своё, а значит — каждый из этих внешне одинаковых элементов может решать «свою персональную» задачу.
Так происходит и с диспрозием — йодид диспрозия совместно с йодидом цезия и бромидом ртути применяется в осветительных металлогалогеновых лампах. Это газоразрядные лампы, в которых основным источником света является йодид диспрозия, излучающий в широком диапазоне частот, что приближает излучаемый свет по свойствам к дневному солнечному свету, йодид цезия «калибрует» излучение диспрозия, заставляя лампу светить более тёплым иди более холодным светом, а бромид ртути замедляет коррозию металлических электродов лампы. Первоначально такие источники света применялись в киностудиях, где с их помощью можно было задать нужную «температуру цвета» при съёмках, но сейчас металлогалогеновые лампы светят в автомобильных фарах и обычных квартирных светильниках.
Диспрозий, как и другие лантаноиды отличается большим количеством неспаренных электронов, что придаёт металлу и его ионам высокую магнитную восприимчивость, что позволяет применять их в устройствах для записи информации. Диспрозий используется в дозиметрах для измерения ионизирующего излучения. Для этого кристаллы сульфата кальция или фторида кальция легируются диспрозием. При воздействии излучения на легированные кристаллы атомы диспрозия возбуждаются и начинают люминесцировать, а интенсивность люминесценции указывает на интенсивность ионизирующего излучения.
67. Гольмий
Электрические и магнитные поля очень похожи. Уравнения электрического и магнитного поля, установленные Дж. Максвеллом для обоих полей, отличаются одинаковой формой. Однако между электричеством и магнетизмом имеется большое различие. Существуют частицы — носители положительных и отрицательных зарядов, они создают в окружающем пространстве электрическое поле.
А вот магнитные заряды, ни положительные, ни отрицательные, никогда не наблюдались по отдельности — магнит всегда имеет два равных по величине полюса на двух своих концах — положительный и отрицательный, и магнитное поле вокруг него есть результат действия обоих полюсов. Тем не менее, законы физики допускают существование частиц с одним магнитным полюсом — магнитных монополей и дают для них определённые уравнения поля и уравнения движения, и физики до сих пор продолжают поиск магнитного монополя. Подтверждение существования такой частицы, предсказанной лауреатом Нобелевской Премии по физике 1933 года Полем Дираком, значительно укрепило бы позиции единой физической теории пространства — времени, материи и поля. Направлений поиска магнитных монополей много, и на одно из этих направлений указывает серебристо-серый металл — гольмий.
Гольмий был открыт в 1879 году швейцарским химиком Жаком-Луи Сорэ, который, исследуя образец оксида эрбия, обнаружил раздвоение спектральных линий и понял, что в пробе находится еще один элемент. В том же году швед Пер Теодор Клеве выделил из другого образца оксида эрбия, выделенного из минерала, обнаруженного под Стокгольмом, некоторое количество окрашенных в оранжевый цвет солей элемента, спектральные свойства которого совпадали со свойствами элемента, найденного Сорэ. Клеве предложил назвать новый элемент гольмием в честь древнего латинского названия столицы Швеции Стокгольма (Holmia). Соли гольмия, как и многих других лантаноидов, являются хорошими поглотителями нейтронов и могут использоваться в атомной энергетике, однако наиболее интересное свойство гольмия — его парамагнетизм, который объясняется наличием неспаренных электронов.
Возвращаясь к магнитным монополям — в 1982 году физик из Стэндфордского Университета Блас Кабрера по показаниям сверхпроводимого детектора квантовой интерференции предположил, что поймал эту магнитную элементарную частицу. Для проверки предположения руководство Стэнфорда выделило группе Кабреры дополнительное финансирование для постройки более мощного детектора, но исследователь внезапно отказался от поиска магнитного монополя в пользу не менее таинственного и неуловимого объекта — тёмной материи.
Начиная с 1980-х годов об экспериментальном наблюдении монополей в различных проектах (в том числе и во время работ по поиску бозона Хиггса на Большом адронном коллайдере), но не все же лавры должны доставаться физикам. В 2009 году французские химики-материаловеды заявили, что в кристаллах титаната гольмия обнаружили магнитные компоненты, которые, как они предположили, являются магнитными монополями (Science, 2009, Vol. 326, 5951, Р. 415–417). Кристаллы содержали крошечные северные и южные полюса магнитов, расстояние между которыми составляло около нанометра. Понятно, что, как и во многих других сообщениях о существовании магнитного монополя, обсуждение результатов поставило под вопрос уместность применения этого термина — южные магнитные полюса в кристалле соли гольмия не могли существовать без северных, поэтому, говорить об открытии настоящих монополей преждевременно, однако исследования в этой области активно ведутся до сих пор, в том числе и при изучении солей лантаноидов.
Что ещё можно сказать о гольмии? Это пятьдесят шестой по распространённости элемент в земной коре, его содержание раз в двадцать больше, чем содержание серебра, так что гольмий едва ли заслуживает того, чтобы о нём говорили, как о редкоземельном элементе. Оксид гольмия применяется для подкрашивания оксида циркония — цирконитов или фианитов и имитации драгоценных камней. В незначительных количествах гольмий присутствует в организме и влияет на обмен веществ некоторых бактерий, однако не относится к эссенциальным элементам. Гольмий применяется для легирования кристаллов смешанных оксидов иттрия-алюминия — рабочих тел некоторых медицинских лазеров. Такие лазеры могут выжигать опухолевые клетки, причиняя здоровой ткани минимальный ущерб. Так, благодаря алюминий-иттрий-гольмиевому лазеру, человеку с раком прямой кишки, диагностированном на ранней стадии, можно удалить новообразования за пару часов, не прибегая к общей анестезии.
68. Эрбий
Как, наверное, уже можно было понять по празеодиму и неодиму, которые долгое время были просто «дидимом», лантаноиды — элементы, вокруг которых возникала путаница. Эрбий — не исключение. Впервые этот металл, названный в честь «города трёх элементов», был выделен в 1843 году шведским химиком Карлом Густавом Мосандером из минерала гадолинита.
Мосандер обнаружил примеси в концентрате оксида иттрия и выделил из него три фракции: иттриевую, розовую terbia (которая содержала современный элемент эрбий) и бесцветную erbia (содержала элемент тербий, нерастворимый оксид тербия имеет коричневый оттенок). Тербий был переименован в эрбий после 1860 года, а эрбий в тербий — в 1877 году, но ещё долгое время путаница в том, какой элемент тербий, а какой эрбий сохранялась. Не содержащий примесей оксид трехвалентного эрбия был получен в 1905 году Жоржем Урбэном, а металлический тербий удалось получить только в 1934 году. Сейчас, чтобы не путать тербий с эрбием и наоборот, мы можем не только запомнить, что соли тербия окрашены преимущественно в зелёный цвет, а соли эрбия — в различные оттенки розового, но и то, что у тербия на внешнем уровне 11 электронов, а у эрбия — 14. Электронная конфигурация эрбия и тербия практически не зависит от условий и среды, поэтому в своих соединениях этот металл может проявлять только различные оттенки розового цвета, но не менять окраску кардинально.
Тем не менее, главная ценность эрбия и его соединений не их розоватая окраска, а то, что они могут поглощать электромагнитное излучение в инфракрасном диапазоне. Наверное, многие знают о том, что наряду с электрическими кабелями, по которым идет электрический ток, существуют волоконно-оптические кабеля, по которым передаются оптические сигналы. Эти тонкие нити из стекла можно было бы назвать оптическим совершенством, если бы не одна деталь — в волоконно-оптических кабелях свет рассеивается, а светорассеяние ограничивает длину оптического волокна, по которому можно передавать сигнал.
Происходящее в световоде рассеяние называется Рэлеевским рассеянием — по этой же причине небо над нами синее, а закаты и восходы — красные. Суть явления заключается в том, что, чем короче длина волны электромагнитного излучения (света), тем больше он рассеивается. Если кварцевое стекло, из которого обычно делают волокно для оптического кабеля, легировать оксидом эрбия, может пропускать электромагнитное излучение с длиной волны 1.55 микрон — при этом степень рассеяния света минимальна, а ближний инфракрасный свет практически не поглощается световодом, что делает эрбий идеальной добавкой для оптических волокон и усилителей оптических сигналов — технологий, лежащих в основе современных коммуникаций. Монокристаллы оксида эрбия также применяются как материалы для лазерной хирургии. Рабочая длина волны эрбиевого лазера совпадает с частотой колебаний атомов O — H в воде, благодаря чему луч такого лазера хорошо поглощается преимущественно состоящими из воды биологическими тканями.
69. Тулий
Во времена античности и средних веков, когда географические карты главным образом состояли из белых пятен, на которых ещё и писали «здесь могут водиться чудовища», земли, расположенные за пределами представления жителей Европы, называли «Ultima Thule».
Это название пошло от имени таинственного острова «Тулас», который, по мнению греческого историка и географа Полибия, располагался в шести днях морского пути к северу от британских островов. Со временем слова «Thule», «Tooli» или «Tool» стали нарицательными для обозначения далёких и неизведанных земель, ну а под «Ultima Thule» подразумевалась самая далекая и неизведанная часть далекого и неизведанного, где «…не существует собственно суши, моря и воздуха, а только некая смесь этих элементов, консистенция которой сравнима с желе и в которой нельзя ни идти, ни плыть…».
Таким образом, когда в 1879 году шведский химик Пер Теодор Клеве (позднее, в 1894 году он был награждён Королевским химическим обществом медалью Дэви за открытие четырёх элементов) давал название тулию, он слегка ошибся, написав: «…для оксида [элемента], расположенного между иттербием и эрбием, я предлагаю название тулий (thullium) от слова «Thule», древнего названия Скандинавии…». Всё же изначально под «Thule» по смыслу имелось в виду что-то типа нашего «Тридевятогого королевства», а то, что позднее земли норманнов оказались как раз примерно в районе Туле — это скорее совпадение.
Первоначальное открытие тулия можно считать случайным. Клеве анализировал несколько образцов оксида эрбия, выделенных из минерала, содержащего преимущественно оксид иттрия, и понял, что разные образцы отличаются по чистоте, поскольку для каждого из них получалась индивидуально «своя» атомная масса эрбия, чего, конечно, не могло быть. Дальнейшая работа по разделению образцов позволила выделить оксиды ещё двух элементов — гольмия и тулия (открытие лантаноидов напоминает игру с матрёшками). Металлический тулий был выделен только в 1914 году.
Какое-то время тулий вполне мог считаться «самым бесполезным химическим элементом» — любая задача, для решения которой он мог применяться, успешнее и дешевле выполнялась другим химическим элементом, про него даже писали: «…самый удивительный факт про тулий в том, что про в этом элементе нет вообще ничего удивительного…». Но все же это не совсем так — есть приложения, в которых ничто не может заменить тулий. Средняя добыча этого металла составляет около 50 тонн в год, и, если бы он был самым бесполезным элементом, вряд ли его бы стали извлекать из руд, в которых он чрезвычайно рассеян. Тулий — моноизотопный элемент, единственный нуклид его в земной коре это стабильный 169Tm. Бомбардировка этого сорта атомов тулия нейтронами позволяет получить радиоактивный 170Tm с периодом полураспада в 128 дней. Радиоактивный тулий является хорошим источником рентгеновского излучения, из-за чего с 1950-х годов применяется как источник излучения в небольших по размеру рентгеновских аппаратах (использующихся, например, в стоматологии) и рентгеновских аппаратах для дефектоскопии — поиска повреждений в деталях и конструкциях. Как и многие другие лантаноиды тулий может применяться для легирования рабочих тел иттрий-алюминиевых лазеров, в данном случае польза от тулия в том, что его добавки позволяют перенастраивать рабочую частоту лазерного луча.
Ну и, наконец, тулий помог выиграть Нобелевскую премию по химии. В 1914 году первый образец чистого металлического тулия получил американский химик Теодор Уильям Ричардс, для этого он получил сверхчистый образец бромата тулия, проведя пятнадцать тысяч экспериментов по перекристаллизации. Такая высокая чистота соли тулия потребовалась Ричардс для уточнения молекулярной массы этого металла (Ричардс получил величину 168.93421 а.е.м.). Конечно, Нобелевским лауреатом стал не из-за рекордного количества перекристаллизаций и не за высокочистый тулий, а за то, что его атомная масса была лишь одной из многих, измеренных или уточнённых Ричардсом. Нобелевскую премию ученый получил «…за точное определение атомных масс большого числа химических элементов…», если точнее — Ричардс и его ученики определили и уточнили атомные массы 55 химических элементов, многие из полученных ими значений до сих приводятся в Периодической системе.
70. Иттербий
В опубликованной в 1971 году книге для учителей химии и изучающих её «Понимая химию», написанной Джоджем Пиментелом, написано: «У лантана одна устойчивая степень окисления в водных растворах, +3. За небольшим рядом исключений, это все, что можно рассказать о скучной химии остальных 14 элементов». Действительно, наиболее распространённой степенью окисления лантаноидов является +3, однако иттербий как раз относится к тем исключениям, о которых говорится в книге. Иттербий в соединениях может принимать степень окисления +2, его соединения являются сильными восстановителями, этот металл может реагировать с водой с выделением водорода.
Иттербий — последний из четырёх элементов, названных в честь Иттербю и выделенный из иттербита. Его в 1878 году обнаружил швейцарский химик Жан де Мариньяк, работая с солями эрбия. Де Мариньяк заметил, что при разложении того, что он считал нитратом эрбия, образуется два оксида — красный оксид эрбия и белый порошкообразный оксид нового элемента, который был назван иттербием. Конечно, де Мариньяк выделил не чистый оксид иттербия, очищенная форма была получена позже, в 1907 году.
Несмотря на то, что иттербий был открыт одним из последних лантаноидов, он является одним из самых распространённых элементов этого семейства. Он находится на сорок третьем месте по распространённости в земной коре, и его содержание больше, чем у олова, брома, урана или мышьяка. Металлический иттербий — хрупкий и ковкий металл, который быстро тускнеет на воздухе из-за реакции с компонентами воздуха и водой — иттербий более реакционноспособен, чем остальные лантаноиды. В земной коре имеется семь устойчивых изотопов с атомными массами от 168 до 176, кроме этого известно несколько радиоактивных изотопов иттербия, из которых наибольшее практическое значение имеет излучающий гамма-лучи нуклид 169Yb. Этот радиоизотоп применяется в портативных переносных рентгеновских аппаратах, для работы которых к тому же не нужно электрическое питание. Другой нуклид — 174Yb, рассматривается как потенциально полезный для изготовления высокоточных атомных часов. Атомные часты с этим изотопом иттербия могут быть точнее, чем цезиевые атомные часы, убегая или отставая на секунду за 100 миллионов лет.
Как и все лантаноиды, иттербий в большинстве своих соединений существует в виде иона Yb3+. Тот самый оксид иттербия, благодаря которому его обнаружил де Мариньяк (Yb2O3), применяется для изготовления специальных сортов стекла и керамики. Некоторые материалы, одновременно легированные иттербием и эрбием, могут преобразовывать невидимое человеческому глазу инфракрасное излучение в красный или зелёный цвет. Такие материалы-люминофоры в перспективе могут заменить европиевые или тербиевые люминофорные красители, с помощью которых защищают от подделки документы и денежные знаки. Для такой защиты чтобы установить подлинность купюры, её нужно будет освещать не ультрафиолетом, а инфракрасными лучами, под действием которых «тайные чернила» с иттербием будут светиться красным или зелёным.
Производные иттербия также проявляют люминесценцию в ближнем ИК-диапазоне (длина волны около 980 нм), их рассматривают как альтернативу существующим биологическим люминесцентным меткам, излучающим в видимой области. Это объясняется тем, что, хотя инфракрасное излучение и не воспринимается зрением человека, наши ткани более прозрачны для ИК-лучей, что, в свою очередь позволит применить ИК-визуализацию для того, чтобы заглянуть в ткань поглубже и раскрыть медикам или биологам более детальную информацию о протекании определённого биохимического процесса.
Ещё одна особенность иттербия в том, что его соединения — более эффективные катализаторы, чем аналогичные по структуре производные других лантаноидов. Соли иттербия катализируют целый ряд полезных трансформаций органических веществ, и всё более востребованы химической промышленностью.
71. Лютеций
Лютеций не только последний элемент, замыкающий ряд лантаноидов, он ещё и был открыт позже других лантаноидов. Он был обнаружен в 1907 году независимо тремя химиками — австрийцем Карлом Ауэром фон Вельсбахом, американцем Чарльзом Джеймсом и французом Жоржем Урбеном. Урбен подробнее коллег описал свойства нового элемента, в результате чего приоритет в открытии и право дать название новому элементы было дано ему. Как настоящий француз, Урбен назвал новый элемент в честь поселения кельтского племени паризиев, стоявшего во времена галльских войн Цезаря на месте нынешнего Парижа (Lutetia Parisiorum) лютецием.
В том, что лютеций оказался последним открытым лантаноидом, две причины. Во-первых, по мере увеличения атомного номера химического элемента его содержание в земной коре уменьшается, а распространённость элементов с чётными атомными номерами (как у соседнего с лютецием иттербия) выше, чем у элементов с нечётным атомным номером — эти критерии распространённости химических элементов в земной коре называются правилом Отто-Гаркинса. Во-вторых, так как у лютеция полностью заполнен 4f-электронный подуровень, он не образует окрашенных соединений и не демонстрирует чётких спектральных линий, благодаря чему его было легко «просмотреть». Самый распространённый в земной коре лантаноид — церий, лютеций — наименее распространённый, его в земной коре гораздо меньше, чем серебра, золота и некоторых металлов платиновой группы, что делает лютеций самым дорогим лантаноидом. Лютеций еще и отличается и самым маленьким радиусом среди лантаноидов, и есть исследователи, которые полагают, что в клетке Периодической системы между барием и гафнием должен стоять именно лютеций (с декабря 2016 года по рекомендациям ИЮПАК эта клетку рекомендуются оставлять пустой). Металлический лютеций — серебристо-белый металл, активность которого в реакциях с кислородом воздуха и водой сравнима с активностью магния.
Наибольшее количество лютеция применяется в нефтехимической промышленности — его оксид работает в качестве катализатора крекинга углеводородов. Нуклид 177Lu применялся в радиотерапии рака. Ионы лютеция также используется для легирования гадолиний-галлиевых искусственных гранатов, применявшихся для создания компьютерной памяти, работающей за счёт организации цилиндрических магнитных доменов, которая, правда, довольно быстро была заменена жёсткими дисками с современной архитектурой.
Трифлат (трифторметлилсульфонат) лютеция показал себя эффективным и рециклизуемым катализатором органических реакций, протекающих в воде. Органический синтез в воде в последнее время становится очень популярным — он позволяет обходиться без летучих и токсичных органических растворителей. Тем не менее, высокая стоимость трифлата лютеция вряд ли сделает его более популярным, чем менее эффективные, но более дешёвые трифлаты других лантаноидов.
72. Гафний
Элемент № 72, открытый в 1922 году в Копенгагене и получивший название гафний в честь города, где было сделано открытие (Hafnia — латинское название Копенгагена), стал ещё одним подтверждением Периодического закона.
Открытие, облегчившее поиски новых химических элементов и выявляющее точное количество пустых клеток Периодической системы, было сделано в 1913 году, когда Генри Мозли предложил метод распределения элементов по их атомным номерам, заменив предложенную Менделеевым сортировку по атомной массе. Закон Мозли демонстрировал, что между уже открытыми лютецием (№ 71) и танталом (№ 73) должен находиться ещё один элемент.
Ситуация с семьдесят вторым осложнялась тем, что уже было непонятно, к какому типу металлов он относится — лютеций проявлял свойства редкоземельного элемента (понятие «лантаноиды» тогда ещё не появилось), а тантал — переходного металла, поэтому мнения разделились — большая часть химиков считала, что № 72 будет очередным редкоземельным металлом, продолжая делить на фракции иттербит или гадолинит и другие редкие земли. Тем не менее, часть исследователей на основании того, что в Периодической системе элемент № 72 располагался под клетками типичных переходных металлов — титана и циркония, относили этот элемент к переходным металлам. Знать то, к какому типу относится новый элемент ещё до его открытия было важно для принятия решения о том, в каких минералах его следует искать, и какие подходы для выделения использовать. В конечном итоге в споре химиков решил поучаствовать физик Нильс Бор, который рассмотрел менделеевскую периодичность через призму физики — строения атома. Причина периодичности свойств элементов по Нильсу Бору заключалась в периодическом повторении строения внешнего электронного уровня атома, и электронная конфигурация элемента № 72, предложенная Бором, тоже позволяла относить его к переходным металлам.
В 1922 году Дирк Костер и Дьердь Хевеши решили проверить идею Бора и поискать новый элемент в циркониевых рудах (впоследствии Нобелевский лауреат Хевеши известен ещё и тем, что в 1940 году растворил золотые нобелевские медали немецких физиков Макса фон Лауэ и Джеймса Франка в царской водке, чтобы спрятать их от входивших в столицу Дании немецких войск). Через несколько недель, обнаружив в рентгеновском спектре циркониевой руды линии, предсказанные Мозли для элемента с порядковым номером 72, они выделили его, доказав его сходство с цирконием, подтвердив выкладки Бора и, тем самым, окончательно закрепив теоретические выкладки, и поныне лежащие в основе Периодического закона. Открытие гафния заполнило одну из шести пустых клеток, оставшихся на тот момент в Периодической системе, гафний также стал предпоследним стабильным элементом, обнаруженным в земной коре; последним стал открытый в 1925 году рений.
Гафний нельзя назвать экзотическим для земной коры — при его атомном номере 5.8 грамма гафния на тонну верхнего слоя Земной коры это не так уж и мало. Трудности с его обнаружением были связаны с тем, что гафний не образует своих собственных минералов и руд, сопутствует цирконию, характеризуясь при этом практически таким же атомным и ионным радиусом, что и цирконий, что, естественно, затрудняет его отделение от «металла-хозяина». В наши дни проблема разделения смесей гафний-цирконий решена благодаря методам экстракции, и, позволяет ежегодно добывать около 70 тонн гафния. Хотя этот элемент и не дёшев, затраты на его добычу и извлечение окупаются его уникальными свойствами.
Металлический гафний проявляет исключительную стойкость к коррозии. Более того, гафний легко захватывает нейтроны, что делает его идеальным материалом для изготовления замедляющих стержней ядерных реакторов, в особенности — реакторов, работающих в жёстких условиях подобно наиболее распространённым в атомной энергетике водо-водяным ядерным реакторам.
При сплавлении с металлами гафний даёт суперсплавы, которые способны противостоять высоким температурам, это их свойство эксплуатируется в космической отрасли — из таких суперсплавов делают детали ракет и спускаемых аппаратов. Карбид гафния (HfC) — рекордсмен среди бинарных (состоящих из двух химических элементов) веществ по температуре плавления, она составляет 3890 °C. Смешанный карбид гафния-вольфрама плавится при 4125 °C. Для сравнения, температура плавления металлического вольфрама, считающегося «эталоном» тугоплавкости — 3422 °C.
73. Тантал
Благодаря танталу мы получили возможность носить мобильные телефоны и смартфоны в карманах джинсов или внутренних карманах пиджаков (или терять их, забывая в неподходящих местах) — благодаря этому элементу мобильные телефоны прошли эволюцию от «кирпичей» 1990-х до современной ультратонкой техники.
Смесь порошкообразных тантала и его оксида применяются в аккумуляторах, которые запасают электрический ток не только для смартфонов, но и игровых консолей, ноутбуков, планшетов и цифровых камер. Теми свойствами тантала, которые помогли ему внести свой вклад в миниатюризацию электроники — высокие электро- и теплопроводность металла, а также его прочность, благодаря изделия из тантала небольшого размера не разрушаются при давлении. Бум производства мобильной электроники увеличил спрос на тантал, и, возможно, сейчас интерес к танталу гораздо больше, чем тогда, когда он был открыт.
Тантал был открыт шведским химиком Андерсом Экербергом в 1802 году, который, по одной версии устав при получении нового элемента, по другой наоборот — после бесплодных попыток растворить его в кислоте, назвал его Танталом в честь героя греческой мифологии царя Тантала, возгордившегося своим равенством с богами (олимпийцы действительно приглашали его на обеды) и наказанного в посмертии «танталовыми муками» — невозможностью испить воды, в которой он стоит и утолить голод висящими рядом плодами. Вскоре после открытия тантал начали отождествлять с другим элементом, извлечённым из минерала колумбита, и только к 1844 году стало ясно, что в колумбите содержатся два элемента — тантал и ниобий, о котором уже шла речь выше.
Тантал — металл с серо-синеватым оттенком, который с помощью полировки можно довести до серебряного блеска. Тантал твёрд и в то же время пластичен — его пластичность уступает разве что пластичности золота. Из сплавов тантала делают детали, работающие при высоких температурах — двигателях реактивных самолетов и ядерных реакторов. Температура плавления тантала 3010 °C, более высоко плавятся только рений и вольфрам. Химическая инертность тантала позволяет делать из него хирургические инструменты и кардиостимуляторы, которые не будут ни коррозировать вод воздействием биологических жидкостей, ни раздражать находящиеся с ним в контакте живые ткани.
Одно из перспективных применений тантала — протезирование суставов. Для этого на шаблон протезируемого сустава из пористого углерода наносят слой металла толщиной около 50 микрометров, в результате чего получается жёсткий материал, структура которого подобна костной структуре — это нужно, чтобы протез сустава, собственные кости пациента и его мягкие ткани могли бы сформировать единую систему, не уступающую по свойствам здоровому суставу.
Тантал не слишком распространён, это пятидесятый по содержанию элемент земной коры. В сотовом телефоне содержится около 40 миллиграммов тантала, но, учитывая скорость производства гаджетов наряду с тем, что есть люди, считающие своим долгом стать владельцем новой модели смартфона сразу после её выхода, а не после того, как перестает работать старая, востребованность в тантале велика. За последнее время в год человечество использует около 2500 тонн тантала, 2/3 из которых идет на производство электронных устройств.
Исторически наиболее значительным источником тантала была Австралия, на австралийском месторождении Гринбушес добывается до 30 % танталового концентрата. Залежи тантала (точнее руды, содержащей одновременно ниобий и тантал — колумбит-танталит или «колтан») также находятся в Демократической Республике Конго, и протекавшая в период 1998–2002 года Великая Африканская война (Вторая Конголезская война), в которую отчасти разразилась из-за попыток различных политических сил, участвовавших в войне, контролировать шахты со стратегическим сырьем — колтаном. А ведь почти полторы сотни лет после открытия, до 1950-х годов тантал ни у кого не было ни малейшего представления о том, зачем и кому сможет потребоваться этот металл.
74. Вольфрам
Вольфам, как и никель с кобальтом, получил своё название из-за рассерженных рудокопов, которым когда-то давно он мешал заниматься выработкой ценных в те времена горных пород.
Своё название элемент получил от известного ещё в 1500-е годы минерала вольфрамита, латинское название которого было spuma lupi (волчья пена), а немецкое — Wolf Rahm (волчьи сливки). Такое отношение к минералу было вызвано тем, что входящий в состав оловянных руд вольфрамит сильно мешал плавке олова, превращая его в пену шлаков (в одном из средневековых манускриптов, посвященных выплавке металлов, написано, что вольфрамит «…пожирает олово как волк овцу…»), ну а пена, затем затвердевая образует тяжелые каменные образования. Шведское словосочетание tung sten (тяжелый камень) стало основой для названия вольфрама в англоязычных странах и Франции — tungsten. Любопытно, но в шведском языке вольфрам сейчас называется volfram.
Вероятно, что из-за дурной славы руды вольфрамита никто из химиков не хотел брать на себя приоритет в открытии нового металла. В 1781 году шведский химик Шееле, обрабатывая азотной кислотой минерал, названный в 1824 году шеелитом (это вольфрамат кальция, CaWO4), получил триоксид вольфрама (WO3), но металлический вольфрам не получил. В 1783 году испанские химики братья Хосе и Фаусто Элюар сообщили о получении из вольфрамита как оксида нового металла, так и самого металла. За два года до этого, в 1781 году Фаусто был в Швеции и общался с Шееле. Шееле не претендовал на открытие вольфрама, а братья Элюар не настаивали на своём приоритете, хотя, благодаря выделению металла именно они считаются первооткрывателями.
Несмотря на то, что название нового элемента появилось благодаря не самым приятным для ранних металлургических процессов эпизодам, да и сам металл долгое время считался эдаким (если припоминать немецкие корни) кунштюком, вольфраму все же удалось стать стратегическим материалом — в первую очередь после того, как Александр Николаевич Лодыгин предложил использовать в качестве долговечных нитей накаливания ламп вольфрамовые спирали. Вольфрам наряду с ниобием, молибденом, танталом и рением образует пятёрку тугоплавких металлов. Температура плавления у этих металлов выше 2000 °C, они относительно инертны химически. Высокая температура плавления этих металлов, что детали из них изготавливают с помощью порошковой металлургии, а литьём расплавленного металла в формы.
Сейчас, когда лампы накаливания медленно, но неуклонно замещаются энергосберегающими газоразрядными и светодиодными осветительными элементами, вольфрам не теряет своего значения — его твёрдость, тугоплавкость и химическая стойкость делает его незаменимым для нагревательных элементов и электродов. Вольфрам входит в состав быстрорежущей стали и «суперсплавов», применяющихся для изготовления защитных покрытий. Из-за высокой плотности вольфрама он входит в состав балластов для летательных аппаратов и гоночных болидов Формулы 1, а также бронебойных поражающих элементов в артиллерийских и реактивных снарядах.
До сих пор роль основного источника вольфрама в промышленности принадлежит вольфрамату кальция, минералы с которым до сих пор называются шеелитом и вольфрамитом. Считается, что 75 % залежей вольфрамовых руд находится на территории Китайской народной республики, хотя залежи этого элемента есть ещё в России, Боливии, Португалии и США.
75. Рений
Если бы химические элементы участвовали в многоборье, то по совокупности качеств и свойств рений, элемент № 75, мог бы уверенно претендовать на победу. Во-первых, рений оказался последним открытым элементом, для которого известен стабильный изотоп. Все элементы, которые были открыты позднее рения (в том числе и полученные искусственно), не имели стабильных изотопов. Во-вторых, это один из самых редких элементов в земной коре. В-третьих — он один из самых плотных элементов, тяжелее его только платина, иридий и осмий. В-четвёртых — один из самых тугоплавких, более высокой температурой плавления обладают только вольфрам и углерод. Рений не ставит рекорды ни в одном из состязаний, но по сумме очков рений вырывается вперёд.
Существование рения и часть его свойств были предсказаны Д. И. Менделеевым вскоре после формулировки первой версии Периодического закон. Опубликованная в 1869 году таблица была достаточно забавна — в её седьмой группе находился только один известный к тому времени элемент — марганец, под которым Менделеев расположил «экамарганец», ставший затем технецием и «тримарганец», впоследствии — рений (в англоязычной литературе чаще используется не предложенный Менделеевым термин, а обозначение «двимарганец» (Science Progress in the Twentieth Century (1919–1933), Vol. 20, No. 80, P. 690–692). Получилось так, что более тяжёлый рений был обнаружен первым из двух «как-бы марганцев».
Рений был впервые спектрально обнаружен в 1925 году в Германии супругами Вальтером и Идой Новак и Отто Бергом в ходе спектрального анализа минерала колумбита. К 1928 году исследователи переработали 660 килограмм руды молибденита, выделив из неё один грамм чистого рения. В наши дни извлечение рения из руд проходит более эффективно — его получают из молибден- или медьсодержащих руд, в которых он присутствует в следовых количествах. Ежегодная добыча рения в общемировом масштабе составляет 60–70 тонн.
Новаки и Берг назвали рений в честь главной немецкой реки — Рейна (на латинском Rhenus), они также добросовестно полагали, что открыли и элемент № 43 — экамарганец, и даже назвали его «мазурием», но это, как и многие другие заявки на обнаружение «верхнего соседа» рения, не подтвердилось. Долгое время считалось, что рений не образует своих собственных руд, замещая молибден или медь в их минералообразующих элементах, однако существует редкий рениевый минерал джезказганит (CuReS4), найденного вблизи казахстанского города Джезказгана. В 1992 году было открыто единственное в мире экономически выгодное месторождение рения. Оно находится в России: запасы в нём составляют около 10–15 тонн и расположено в кальдере вулкана Кудрявый на остров Итуруп Курильской гряды. Рений находится здесь в форме минерала рениит (основной компонент которого дисульфид рения (ReS2).
Рений отличается довольно интересными химическими свойствами. Так, он проявляет наибольшее число степеней окисления для металла (а может — и для любого другого химического элемента), пробегая от –1 до наиболее обычной для него +7. Ещё одна интересная особенность рения — до начала 1960-х годов предполагалось, что связь максимальной кратности, которая может возникнуть между двумя атомами — связь тройная, однако в 1964 году Альберт Коттон обнаружил, что в анионе [Re2Cl8]2– атомы рения связаны четырёхкратной связью (Inorg. Chem., 1965, 4 (3): Р. 330–333). Внимание учёных привлекает и еще одно соединение рения с галогеном — дибромид рения, которое по твердости сравнимо с алмазом, но в отличие от алмазоподобных материалов, для его получения не нужно высокое давление.
Металлический рений используется в изготовлении сплавов особого назначения или, будучи сплавленным с платиной, может использоваться в химической переработке нефтяного сырья и получения бензинов с высоким октановым числом. Катализаторы на основе металлического рения устойчивы к действию обычных «каталитических ядов» — фосфора и серы, поэтому рений становится всё более востребованным для производства катализаторов в химической промышленности.
76. Осмий
Даже первооткрыватель осмия относился к своему открытию без должного уважения. Возможно это отчасти из-за того, что впервые выделивший этот металл английский химик Смитсон Теннант уже успел выяснить, что алмаз является всего лишь формой углерода, и жизнь уже подготовила его к тому, что за блеском и роскошью зачастую могут стоять совершенно обыденные вещи. Возможно, изучая осадок, оставшийся после растворения платины в царской водке, он обратил меньшее внимание на сине-серебристый металл и сконцентрировался на другом металле, том, который отличался золотистым блеском, да еще и давал соединения всех цветов радуги — осмий и иридий были открыты в ходе одного эксперимента.
Возможно, Теннанта неприятно поразило, что соединения металла могут пахнуть так отвратительно, так что в итоге в письме об открытии элемента Лондонскому королевскому обществу Теннант упомянул, что наиболее характерным свойством нового элемента является «…острый и стойкий запах…», назвав элемент осмием (по-гречески слово «осме» — запах). Может быть это и не самое красивое название, зато честное — осмий образует тетроксид осмия (OsO4), который не только неприятно пахнет, но является сильным окислителем, может повредить кожу, глаза и лёгкие. Вместе с этим тетроксид осмия применяется в синтезе для окисления органических соединений и в криминалистике — с его помощью собирают отпечатки пальцев на месте преступления.
Осмий твёрдый, тугоплавкий, серебристо-белый переходный металл платиновой группы, обладающий высокой плотностью. По одной версии плотность осмия максимальна для всех известных элементов, по другой — находится на втором месте после открытого одновременно с ним иридия. Удивительно, но даже сейчас, в первой половине XXI века невозможно сказать, что плотнее — осмий или иридий. Дело в том, что благодаря систематическим ошибкам измерения, которых нельзя избежать, экспериментально измеренные значения плотности осмия и иридия равны (в пределах ошибки), а значение плотности, определенное с помощью квантовохимических методов, зависит от выбранной для расчета модели. Поэтому, наверное, проще сказать, что иридий и осмий — делят пьедестал как самые плотные элементы. В конце концов, это справедливо — иридий и осмий были обнаружены в ходе одного эксперимента, они оба относятся к металлам платиновой группы, более того — осмий и иридий в составе сплава осмиридия применяются для изготовления хирургических инструментов и перьев для ручек. Небольшой шарик из осмиридия можно заметить на кончиках перьев перьевых ручек, особенно хорошо его видно на золотых перьях, где он отличается по цвету от самого пера. Осмий также используется для получения катализаторов, а его соединения — для введения цветных меток в образцы, изучаемые с помощью оптической микроскопии.
Осмий не тот металл, который является объектом крупнотоннажного производства, более того, сейчас его годовое производство в масштабах человеческой цивилизации не достигает одной тонны (если честно, в год добывается около 100 килограмм этого металла. Правда, были времена, когда осмий был популярнее, и эту популярность он приобрёл после изобретения в 1879 году Томасом Эдисоном лампы накаливания и необходимости её модификации — подбора такого материала для нити накаливания, который бы светился, но не плавился.
Было перепробовано много вариантов, один из которых предложил австрийский химик Карл Ауэр фон Вельшбах. Исходя из того, что наиболее тугоплавки вольфрам и осмий, он предложил использовать для нитей накаливания ламп сплав осмия с вольфрамом, который назвали «осрам». Начиная с 1906 года осрам некоторое время применялся для изготовлений ламп накаливания, хотя чуть позже стало ясно, что одного вольфрама вполне достаточно. Организованная в 1919 году немецкая компания по производству осветительных устройств стала называться OSRAM Werke GmbH. Компания существует и в наши дни, и на её лампах до сих пор можно наблюдать маркировку «OSRAM», хотя с 2000-х годов она уже не производит лампы накаливания, переключившись на выпуск энергосберегающих источников света — люминесцентных, галогенных и светодиодных ламп.
77. Иридий
В отличие от осмия, иридию повезло — Смитсон Теннант в первую очередь обратил внимание на разнообразную окраску соединений этого металла, а не на их запах, поэтому и назвал новый элемент в честь греческой богини радуги — Ириды (справедливости ради, окраска соединений ванадия более разнообразна).
Повторюсь, что иридий относится к тугоплавким элементам, и что вместе с осмием является самым плотным веществом. Если в плане плотности иридий делит пальму первенства с осмием, в одном он точно не превзойдён. Мы привыкли к тому, что эталонами химической стойкости для нас являются золото и платина, однако способность иридия сопротивляться коррозии гораздо выше, чем у платины. И ещё одно — по сравнению с распространённостью иридия в земной коре золото и платину можно считать весьма распространёнными металлами. В наши дни ежегодно в мире добывается не более трёх тонн иридия, который из-за устойчивости к коррозии и твёрдости преимущественно применяется для изготовления электродов автомобильных свечей зажигания.
Устойчивость иридия стала причиной и того, что этот металл послужил стандартизации измерений и Международной системе единиц. Артефакты из сплава платины с иридием долгое время применялись в качестве первичных стандартов, определяющих единицу измерения длины — метр, и единицу измерения массы — килограмм.
30 марта 1791 Учредительным собранием Франции единица длины «метр» была определена как одна сорокамиллионная часть Парижского меридиана (одна десятимиллионная часть расстояния от северного полюса до экватора по поверхности земного эллипсоида на долготе Парижа). 7 апреля 1795 Национальный Конвент Французской Республики принял закон о введении метрической системы во Франции и поручил учёным выполнить работы по экспериментальному определению единиц длины и массы. В 1799 году из платины был изготовлен эталон метра, длина которого соответствовала одной сорокамиллионной части Парижского меридиана.
На метре как единице длины и килограмме как единице массы была основана метрическая система, которая 20 мая 1875 года была введена «Метрической конвенцией», принятой на Международной дипломатической конференции 17 государств Европы. В 1889 году был изготовлен новый международный эталон метра, сделанный из сплава, содержавшего 90 % платины и 10 % иридия. В наше время Международное бюро по мерам и весам отказалось от привязки метра к парижскому меридиану или материальному носителю, и с 1983 года метр определяется через скорость света, составляющую 299792458 метров в секунду, а секунда — через работу атомных часов (хотя эталонный метр и его копии до сих пор хранятся в Парижской и национальных палатах мер и весов соответственно). Кстати, килограмм до сих пор определяется массой эталонной платиново-иридиевой гири, хранящейся в Париже, однако, учитывая тенденцию переноса единиц СИ с материальных носителей на фундаментальные константы нашей Вселенной, в скором времени следует ожидать и переопределения килограмма, который, вероятно, будет выражен через число Авогадро — число частиц в одном моле вещества.
Иридий выходит с Земли в космос — как безопасный контейнер для плутониевого топлива для ядерно-электрических генераторов космических зондов дальнего радиуса действия и как покрытие для отражателей рентгеновского излучения орбитальных телескопов.
Но тем не менее, чтобы отправиться в космос с Земли иридию сначала пришлось попасть на Землю из космоса. Содержание иридия в метеоритах выше, чем в земной коре (по расчетам большая часть иридия находится в расплавленном ядре Земли). Обладающие гранулярной структурой метеориты-хондриты до сих пор содержат столько же иридия, сколько содержала наша Солнечная система в момент формирования.
В 1980 году лауреат Нобелевской премии по физике 1968 года Луис Уолтер Альварес и его коллеги изучили осадочные глины, которые, в соответствии с калий-аргонным методом датировки, образовались 65 миллионов лет назад на стыке Мелового и Третичного периодов, при котором произошло вымирание большей части динозавров. Осадочные породы, относившиеся по дате к началу вымирания, содержали повышенное содержание иридия, что позволяло предположить о том, что в то время Земля могла столкнуться с большим метеором или астероидом (Science. 1980. 208 (4448): 1095–1108). Гипотеза о том, что массовое вымирание динозавров было вызвано падением астероида с диаметром около 10 км и наступившей в результате падения «астероидной зимой» называется «гипотезой Альвареса».
78. Платина
Платина — особый металл. Часто это синоним достигнутого успеха — платиновые диски у певцов, если поискать в интернете, можно найти предлагаемые успешным людям телефоны из платины и золота, гостиницы и даже хинкальные с названием «Платина».
Из серебристо-белой платины делают ювелирные изделия и устойчивую к действию большинства реагентов химическую посуду. Многие из рассказов о платине, однако, скорее вымысел, чем правда — да, платина химически стойкий металл, но в своей стойкости она во многом сравнима с золотом, например, как и золото, может растворяться в царской водке. Да, платина дорогой металл, но отнюдь не самый дорогой, стоимость её спутников по рудам — осмия и иридия гораздо выше, платина даже не всегда дороже золота, хотя, справедливости ради, волатильность цены на этот металл выше, чем у золота (вот сейчас, например, когда я пишу эти строки, биржевые графики говорят о том, что грамм чистого золота стоит 2486 рублей, чистой платины — 1696 рублей, чистого серебра — 31 рубль и чистого палладия — 1898 рублей, то есть платина обгоняет, причём значительно, только серебро). Тем не менее, платина гораздо более твердый и более тугоплавкий по сравнению с золотом и серебром металл, благодаря чему бывало, что цены на платину были выше цен на золото. Если считать платину метафорой успеха, это сравнение может оказаться наполнено более глубоким смыслом, чем обычно вкладывается в него — история платины может рассматриваться как метафора пути к успеху.
В шестнадцатом веке испанские конквистадоры рассматривали платину как досадную помеху — белый металл, который сопутствует золоту, и который из-за высокой температуры плавления сложно отделить от золота. Название «платина», которое впервые встречается в трактате Юлия Цезаря (Жюля Сезара) Скалигера на испанском представляет уменьшительно-пренебрежительную форму слова «plata» — серебро. Прибывшие в Новый свет испанцы считали, что платина — «незрелое золото» и выбрасывали его обратно в реки в надежде, что оно когда-то дозреет. Загрязнение золота платиной вынуждало бросать перспективные золотые шахты, было и такое. Испанская Корона то вводила запрет на ввоз платины в Европу, то отменяла эти запреты или ввозила некоторые количества платины для проведения «спецопераций» — известны случаи, когда испанцы подделывали серебряные монеты своих стратегических противников, чеканя их из платины.
Высокая температура плавления платины и её химическая стойкость приводили к тому, что до восемнадцатого века ни получить образец чистой платины, ни тем более изучить ее свойства не было возможно. Первым платину отнёс к драгоценным металлам шведский химик Хенрик Шеффер, который смог получить расплав платины, сплавляя её с мышьяком. В конце восемнадцатого века французские химики — Антуан Лавуазье и Арман Сегуин начали совместную работу над плавильной печью, которая давала бы температуру, достаточную для плавления платины без мышьякового флюса. Лавуазье обращался к британцу Джозайе Веджвуду, прося образцы глины, которые могли бы выдерживать высокую температуру, необходимую для плавки платины, а Сегуин подбирал условия, при которых топливо плавильной печи будет работать с максимальной теплоотдачей. Незадолго до своего гильотинирования Лавуазье смог расплавить платину, окисляя топливо чистым кислородом, однако до получения платины в промышленных масштабах оставались многие годы. В 1789 Лавуазье отнёс платину к элементам (Traité Élémentaire de Chimie, présenté dans un ordre nouveau, et d’après des découvertes modernes. — Paris: Cuchet, Libraire, 1789. — P. 192.).
Впервые в чистом виде платину получил английский химик Уильям Волластон в 1803 году. В 1859 году французский химик Анри Этьен Сент-Клер Девиль впервые разработал промышленный способ получения слитков чистой платины, получив за одну плавку 15 килограмм, после чего платину стали применять не только для ювелирных изделий. В конце девятнадцатого века были разработаны первые топливные элементы — устройства для преобразования энергии химических реакций непосредственно в электричество, и из платины стали делать инертные электроды таких источников энергии. Развитие химического эксперимента привело к тому, что та самая химическая инертность и тугоплавкость, которые мешали работать с ней ранее, нашли применение в химии — из платины начали делать лабораторное оборудование.
Одно из самых известных соединений платины — цисплатин (цис-диаминдихлорплатина(II)), которое используется в химиотерапии. Действие соединения было обнаружено в определённой степени случайно. В 1960-х годах Барнетт Розенберг проводил эксперименты с бактериями, изучая влияние электрического тока на рост клеток. В ходе исследований было обнаружено, что бактерии кишечной палочки в ходе эксперимента аномально удлинялись. Первоначально это свойство было приписано действию электрического тока, но, так как эффект наблюдался только при применении платиновых электродов, в конечном итоге стало ясно, что применение таких электродов приводит к появлению в растворе соединений платины, среди которых и был найден влияющий на свойства клеток цисплатин.
Оказалось, что цисплатин ингибирует деление клеток, в случае бактериальных — заставляя их удлиняться. В рамках развивавшейся в то время программы скрининга веществ на противоопухолевую активность цисплатин стали испытывать на подопытных мышах. Первоначальные эксперименты из-за высокой дозировки платинасодержащего агента оптимизма не внушали — мыши гибли от отравления тяжёлым металлом, однако подбор оптимальной дозировки в конечном итоге превратил «яд в снадобье». В настоящее время цисплатин применяется в химиотерапии эпителиальных злокачественных образований, наглядно демонстрируя то, как зачастую много значит в научном поиске счастливая случайность, равно как и то, что планировать заранее крупные прорывы не реально. Систематическое исследование цисплатина позволило разработать и внедрить в клиническую практику платиносодержащие противоопухолевые препараты следующего поколения — оксалиплатин и карбоплатин, ещё ряд веществ проходит испытания.
За последние полвека платина действительно пришла к успеху — платиновые катализаторы используются в нефтепереработке — с их помощью увеличивают октановое число бензина и получают сырье для производства полимеров. В 2007 году Нобелевская премия по химии была присуждена Герхарду Эртлю, исследования которого помимо прочего были посвящены и процессам окисления моноксида углерода (СО) на поверхности платины — процессу, регулярно протекающему в выхлопной системе автомобилей. Именно каталитические свойства платины позволили Иоганну Дёберейнеру сконструировать каталитический источник огня, прототип современных зажигалок — «Огниво Дёберейнера».
79. Золото
Золото, мягкий металл, тот металл, добыче которого мешала платина, один из древнейших металлов, известных человечеству. Международное латинское название золота «aurum» означает «жёлтое» и родственно с утренней зарёй — Авророй (Aurora), славянское «золото» тоже имеет отношение жёлтому цвету. В среднем в Земной коре содержится 4,5 миллиграмма золота на тонну породы. Золото — моноизотопный элемент, единственный нуклид в земной коре это 197Au. Есть ещё 28 радиоактивных изотопов золота, каждый из которых получают искусственным путём.
Золото находится в одной группе с медью и серебром, и именно эти три металла стали известны человеку с древности, начав служить как первые монетные металлы. Результаты раскопок говорят о том, что первые золотые монеты были в ходу уже в Древнем Египте в 3400 году до нашей эры. В те времена золото не было самым дорогим металлом — металлическое железо, попадавшее на Землю с метеоритами, стоило гораздо больше.
Большая часть золота, с которым мы имеем дело в настоящее время, либо добыто в Средиземноморье в древние времена, либо вывезено из Нового Света испанцами и португальцами в Европу в шестнадцатом веке (по оценкам историков только в период с 1541 по 1560 годы испанцы доставили в Европу золотых артефактов от мезоамериканских индейцев общей массой 500 тонн, которые все в соответствии с королевским указом были переплавлены для чеканки монет). Это древнее золото с тех пор постоянно перерабатывается снова и снова.
В 1849 году были найдены золотоносные рудники в Сибири и Калифорнии, в 1851 году — в Новом Южном Уэльсе, в 1884 году — в Трансваале, в 1896 — на Клондайке и в 1900 году — на Аляске, и добыча золота начала расти. В настоящий момент годовая добыча золота составляет около 2300 тонн (в 2010-е годы Россия находится на втором-третьем месте, добывая 250–270 тонн золота ежегодно), а за всю свою историю человечеством добыто около 161 тысячи тонн золота.
Золото стало одним из первых металлов человечества благодаря относительно простому способу его добычи — в природе самородное золото не образует сплавы с другими металлами и, так как это металл плотный, в потоке воды минералы с плотностью меньше золота смываются, и металл концентрируется в тяжёлой фракции. В небольших объёмах такую промывку золота можно проводить вручную с помощью промывочного лотка, что и используется для сбора самородков золота с древности и до нашего времени. Самый крупный золотой самородок назывался «Желанный незнакомец» и был обнаружен в австралийской провинции Виктория в 1869 году, он весил больше 71 килограмма, из которых на чистое золото приходилось 65 килограмм. В ювелирном деле чистое золото обозначается как 24-каратное, сплав, содержащий 75 % золота — 18-каратное золото и сплав, в состав которого входит 50 % чистого золота — 50-каратное золото. В России общепринятыми считаются пять проб золотых ювелирных сплавов: золото 375, 500, 585, 750 и 958, в них проба золота примерно соответствует количеству массовых частей золота на тысячу частей сплава.
Золото очень мягкий металл, в бронзовом веке резать и получать тонкие пластинки золота, расплющивая их, людям удавалось даже с помощью бронзовых и каменных инструментов. Для украшения и в ритуальных целях люди собирали воедино большие количества золота. Так, саркофаг фараона Тутанхамона состоял из 112 килограммов золота. Говорить о том, что на захоронение других фараонов, успевших поцарствовать большие сроки, чем Тутанхамон, умерший в 19 лет, вряд ли уместно — молодой правитель успел провести религиозную реформу, восстановив в Египте культ Амона и старых богов, не преследуя при этом желающих исповедовать культ Атона, остановив религиозные распри.
В настоящее время с помощью орудий, более совершенных, чем доступные современникам Тутанхамона, один грамм золота можно превратить в золотую фольгу площадью 1 квадратный метр и толщиной в 230 атомов. Такая фольга использовалась для нанесения покрытий на стёкла кабины сверхзвукового пассажирского самолёта Конкорд для защиты пилотов от ультрафиолета, а сейчас с помощью этой фольги часто модифицируют стёкла небоскрёбов для защиты как от тепла, так и от ультрафиолета. Из одного грамма золота можно вытянуть 165 метров золотой проволоки толщиной 20 микрометров — она используется в качестве контактов в микроэлектронике. Ещё одно применение золота, которое стало актуальным в 2010-х годах — катализ органических реакций. Из-за того, что долгое время золото так или иначе использовалось для обеспечения национальных финансовых систем, этот металл включился в «каталитическую гонку» позже платины и палладия, однако его соединения тоже могут выступать в качестве эффективных катализаторов.
80. Ртуть
Известные сюжеты башорга про ломы, плавающие в ртути и урановые ломы, тонущие в ртути, увы, не имеют ничего общего с реальностью.
Да, по закону Архимеда стальной лом должен плавать на поверхности ртути (его плотность ниже плотности ртути), а лом из урана — тонуть (кубический сантиметр урана тяжелее кубического сантиметра ртути), однако есть одна деталь — ртуть растворяет в себе металлы, образуя сплавы, которые называются амальгамы. То есть, и стальной, и урановый ломы просто растворятся в чане ртути (можно, конечно их для защиты от амальгамирования предварительно заламинировать, но это уже больше походит на обсуждения с picabu).
Амальгамирование металлов известно и применяется давно — зеркала, изготавливаемые с помощью амальгам серебра, заменили дамам Возрождения отполированные металлические листы. Однако, наиболее яркая и печальная история, связанная с амальгамами — золочение купола Исаакиевского собора.
Купол Исаакиевского собора — самый большой позолоченный купол в мире. На него было израсходовано 100 килограмм золота. Золочение выполнялось огневым методом: на медные листы наносили амальгаму золота с ртутью, а затем, нагревая листы, выпаривали ртуть, а золото прочно связывалось с медными листами. Золочение продолжалось с 1835 по 1843 год. Нанесённая таким способом позолота до сих пор украшает купол Исаакия, даже несмотря на то, что во время блокады купол пришлось покрасить серой корабельной краской, чтобы лишить артиллеристов и летчиков врага такого яркого ориентира. Однако золочение купола Исаакиевского собора стоило жизни шестидесяти позолотчикам, отравившимся парами ртути. Поэтому иногда купол Исаакиевского собора называют «амальгамой на крови».
Ставшее международным греческое название ртути — hydrargyrum (жидкое серебро), очень долго обманывало людей, придававших ртути чудесные физические и сверхъестественные свойства. Временами за игры со ртутью приходилось расплачиваться жизнью и здоровьем. Египтяне помещали в гробницы большие сосуды со ртутью, чтобы похороненный мог рассказать богам в посмертии об умениях и могуществе египетских рудокопах. Древние китайцы пили ртуть в поисках вечной жизни и процветания. Первый Император Поднебесной Цинь Ши Хуанди настолько верил в магические свойства ртути, что принимал в качестве эликсира бессмертия смесь ртути с толчёным нефритом (после очередной дозы такого снадобья он и умер). Древние греки и римляне использовали ртуть для очистки золота, и, хотя знали о токсичности самой ртути и её соединений, не брезговали применять ртуть для изготовления косметических препаратов. Много веков алхимики считали ртуть матерью металлов и пытались использовать ртуть для получения золота. То, что ртуть не является матерью металлов, а просто металлом, только жидким, смогли доказать только Михаил Ломоносов и Иосиф Адам Браун, которые в ходе совместного эксперимента заморозили жидкий металл и показали, что в замерзшем состоянии ртуть сохраняет типичные свойства металлов — ковкость и пластичность.
В девятнадцатом веке стала очевидна связь между психическими заболеваниями и воздействием соединений ртути, но ртуть и её производные применялись во многих технологиях, в которых заменить жидкий металл и его производные чем-то было невозможно. Благодаря ртути появился Безумный Шляпник Льюиса Керрола — этот литературный персонаж обязан своим происхождением английской идиоме «безумен, как шляпник». Происхождение же самой идиомы объясняется тем, что в процессе выделки фетра, использовавшегося для изготовления шляп, применялась ртуть, шляпники вынуждены были вдыхать её пары. Шляпники и работники фабрик часто страдали от ртутного отравления, так как пары ртути вредили нервной системе, вызывая такие симптомы, как спутанная речь и искажение зрения — некоторые особенности поведения Шляпника (в книге, конечно, а не в многочисленных экранизациях) похожи на симптомы хронического ртутного отравления. Знал об опасности ртути и главный архитектор Исаакиевского собора — Огюст Монферран. Пытаясь обезопасить золотильщиков купола, он приказал снабдить их стеклянными колпаками со шлангами для подачи чистого воздуха. Однако так как как ртуть могут впитываться и через кожу, это не спасло рабочих.
Ртуть еще можно найти в технологиях, окружающих нас — амальгамные пломбы в стоматологии, соединения ртути применяются для изготовления некоторых косметических препаратов, ртуть можно найти в люминесцентных лампах и, конечно ртутных термометрах (говоря проще, медицинских градусниках). Однако, в скором времени ртуть и её соединения останутся только в лабораториях и в некоторых областях промышленности. С 2020 года Минаматская конвенция о ртути запретит производство, экспорт и импорт различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и некоторых видов люминесцентных ламп, ртутных термометров и приборов измерения давления. Конвенция также ограничит ряд промышленных процессов и отраслей применения ртути и со временем приведет к тому, что ртуть уйдёт на заслуженный отдых и перестанет быть угрозой для нашего психического и физического здоровья (хотя, конечно, есть угрозы и пострашнее).
81. Таллий
Бесспорно — мастером отравления (естественно в литературных произведениях) является Агата Кристи. Её стиль — точное описание действия снадобья и симптомов, а также разнообразие ядов. Знания по химии и токсикологии Агата Кристи приобрела, будучи помощником аптекаря в пункте выдачи лекарств госпиталя Торки. Во время Первой мировой войны она добровольно пошла работать сестрой милосердия, и ей пришлось выучиться теории и практике химии и фармацевтики. Впоследствии это наложило отпечаток на творчество королевы детектива: природные или синтетические яды применяются в восьмидесяти трех преступлениях, описанных в ее книгах. В опубликованной в 1961 году повести «Белый конь» одним из главных действующих лиц-отравителей можно было бы назвать таллий — многие соли этого мягкого металла растворимы в воде, образуют растворы без вкуса, цвета и запаха, которые медленно, но неотвратимо сводят жертву в могилу.
Кристи так точно и детально описывала детали таллиевого отравления, что её творчество помогало спасать людям жизнь. В 1977 году в одну больницу Лондона поступила девочка, заболевшая загадочной болезнью. Одна медсестра, прочитавшая повесть, поняла, что это типичный случай отравления таллием, после чего была предложена успешная схема лечения. В том же году, в СССР, также были случаи отравления таллием. Расследовавший дело об отравлениях следователь Ямпольский, прочитал практически все книги Агаты Кристи, которые в то время издавались в СССР и смог расследовать дело, которое уже переходило в статус «глухаря». Отравления таллием опасны, так как организм принимает ионы таллия за ионы калия, и Tl+ использует натрий-калиевый мембранный насос клетки для попадания в клетку и блокировки биохимических процессов, в которых участвует калий.
Для тяжелого элемента таллий достаточно распространён в земной коре, он сопутствует цинку, меди и железу и даже образует несколько своих (хотя и редких) минералов. Обнаружен таллий был в 1861 году британским химиком Уильямом Круксом, который наблюдал в спектре свинцовых шламов ярко-зелёную линию и понял, что это новый элемент. Название «таллий» было предложено в честь зелёной линии спектра и происходило от греческого «таллос» — зелёная ветка или побег. В 1862 году Крукс выделил небольшое количество металлического таллия, не зная о том, что параллельно его работе исследование проводит французский химик Клод-Огюст Лами, выделивший значительно большее количество металлического таллия и получивший на Международной лондонской выставке 1862 года медаль «За новый способ получения таллия в больших количествах». После этого Крукс потерял интерес к открытому элементу (хотя Лондонское научное общество приняло его в свои ряды как первооткрывателя нового химического элемента), и таллий продолжил изучать французский химик Жан-Батист Дюма, который нашел свойства нового металла сходными со свойствами серебра, свинца и ртути.
Сырьё, из которого извлекали таллий и Крукс, и Лами было отходами сернокислотного производства. В наши дни промышленное производство таллия проводится по сходной схеме — металл извлекают из продуктов обжига сульфидных минералов железа, цинка или свинца (сульфиды подвергают обжигу для превращения их в оксиды, которые затем восстанавливают до металлов).
Благодаря своей токсичности таллий применялся в качестве средства против грызунов (вообще в романах Агаты Кристи многие экзотические для нас яды отравители покупали в хозяйственных магазинах, что было реалиями времени, от грызунов или для борьбы с насекомыми вредителями мог использоваться и цианистый калий). Понятно, что сейчас существуют менее опасные способы убивать крыс, поэтому применение производных таллия, при котором есть риск их попадания в окружающую среду, сейчас запрещено практически повсеместно. В наши дни таллий применяется в электронике. Наиболее важным веществом в этой области применения является сульфид таллия, проводимость которого меняется в зависимости от его освещённости инфракрасным облучением — это позволяет применять сульфид таллия в производстве фотоэлементов. Кристаллы бромида-йодида таллия используются для изготовления детекторов ИК-лучей. Температура плавления таллиевых стекол (в качестве одного из компонентов для приготовления такого стекла используют оксид таллия Tl2O3), равна 150 °C. Таллиевые стёкла применяют в электронике. Производные таллия также являются перспективными веществами для изготовления сверхпроводимой при высокой температуре керамики.
Для таллия известно два устойчивых и 23 радиоактивных изотопа. Один из них — 201Tl применяется в ядерной медицине. Препарат этого радиозотопа вводят в кровь, и он разносится по организму. Так как таллий переносится по организму через калий-натриевые мембранные насосы, скорость распространения таллия по организму даст информацию врачу о том, где эти молекулярные машины не работают должным образом. В особенности такая диагностика становится нужна для оценки здоровья и функций коронарной артерии. Период полураспада 201Tl составляет 72.5 часа что, вкупе с небольшой дозировкой радионуклида, применяющейся в анализе, делает процедуру диагностики малоопасной (ну или по крайней мере менее опасной, чем несвоевременно диагностированная коронарная недостаточность).
82. Свинец
Свинец — ещё один тяжелый металл, отравляющий всё на своем пути. Тусклый, податливый и тяжелый. Если кто смотрел снятый в начале перестройки фильм Вадима Абдрашитова «Плюмбум или опасная игра», может понять, что герой этого фильма — подросток, решивший всеми правдами и неправдами искоренить преступность в своём городе, сделал своим прозвищем латинское название свинца скорее не по своей воде, а благодаря сценаристам (хотя в те времена слово «токсичный» еще не применялось к людям и отношениям). В древности к Сатурну отношение было не лучше — его «небесным покровителем» была планета Сатурн, которая в свою очередь, была посвящена старому римскому божеству Сатурну (в греческой версии — это титан Кронос), который, когда-то был главным божеством, но, боясь потерять власть, поедал своих собственных детей, и всё же был свергнут Юпитером.
Свинец и его соединения повреждают печень и почки, причём в равной степени опасны и растворимые соединения свинца и его пары, и органические производные свинца. Свинец может вызывать анемию и разновидность подагрического артрита — свинцовую подагру. В древности самым активным производителем свинца была Римская Империя, инженеры которой строили акведуки и системы городского водоснабжения, используя свинцовые трубы (в английском языке происхождение слова «водопроводчик» — «plumber» возводят к латинскому названию свинца), ацетат свинца (свинцовый сахар) применялся римскими виноделами для консервации и улучшения вкуса вина, оксиды и карбонат свинца были материалом для косметики. Нельзя сказать, что все без исключения римляне доверяли свинцу. Врач Авл Корнелий Цельс предостерегал об опасностях, связанных с применением свинцовых белил, а инженер Марк Витрувий Поллион предлагал заменить свинцовые трубы для воды на глиняные, но современники учёных остались глухи к их предложениям по улучшению качества среды обитания, и свинец продолжили использовать.
Человечество вообще учится медленно — свинцовые белила применялись в живописи и для отделочных работ до девятнадцатого века, и в итоге были заменены цинковыми белилами. До появления первого в мире законодательного акта о применении химических веществ в пищевой продукции — (Акт о чистой пище и лекарствах, США, 1906 год) производные свинца применялись даже как красители для леденцов. Всё это было несмотря на то, что индустриализация и увеличение масштабов производства свинцовых красителей приводило к распространению хронических и смертельных отравлений среди рабочих, контактирующих со свинцом. В настоящее время от свинца стараются избавляться. В России в 2002 году запретили использовать тетраэтилсвинец для увеличения октанового числа бензина (в США свинцованный бензин был запрещен в 1986 году, а сейчас разрешён к применению только в Северной Корее, Афганистане и Палестине), в Евросоюзе с 2006 года запрещено использовать свинец в электронике, даже проводятся поиски материала, способного заменить свинец в охотничьих и патронах.
Для алхимиков свинец был низшим металлом — алхимики верили, что, лёжа в земле свинец дозревает до остальных металлов (поздняя практика показала, что все происходит ровно наоборот, и свинец представляет собой конец цепочки распада многих радиоактивных элементов), в том числе и до серебра с золотом. В попытках осуществить «созревание» свинца в золото в лабораторных условиях алхимики смогли получить соединения свинца различных цветов — свинцовые белила, жёлтый свинцовый глёт и красный свинцовый сурик — все эти вещества использовались как пигменты в живописи. Свинцовый сурик, например, долгое время был единственным красным пигментом в Средневековье и Раннем Возрождении. И понятно, что, хотя попытки трансмутировать свинец в золото были обречены на провал, изыскания алхимиков стали первыми систематическими исследованиями свойств и превращений химических веществ.
В настоящее время самыми распространёнными областями применения свинца являются свинцово-сернокислотные аккумуляторы автомобилей и свинцовые экраны, которые защищают пациента от излучения рентгеновского аппарата во время диагностики.
83. Висмут
Висмут — красивый и хитрый элемент, элемент-притворщик. Ядро его наиболее распространённого изотопа — 209Bi долгое время поражало физиков-ядерщиков. Большой порядковый номер и большая атомная масса (и то и другое нечётные) вообще-то должны были приводить к тому, что этот атом должен был быть радиоактивен, однако долгое время висмут притворялся стабильным и даже считался самым тяжёлым из существующих в природе стабильных изотопов.
Однако в 2003 году было экспериментально показано, что он является радиоактивным и распадается с излучением альфа-частиц (Nature, 2003, 422 (6934): 876–878). Правда, период полураспада 209Bi составляет (1,9±0,2)×1019 лет, что при возрасте Вселенной в 13.8 миллиардов лет чуть больше, чем вечность, и становится понятно, почему радиоактивность висмута долгое время просто не удавалось наблюдать. Плотность твёрдого висмута 9.8 г/см3 (это чуть меньше, чем у свинца), а при плавлении висмут ведёт себя аномально — его расплав тяжелее твёрдого вещества, и твердый висмут не тонет в расплаве, а плавает на поверхности (такая редкая аномалия хорошо известная для воды, но системой вода-лёд не ограничивается). Вообще висмут плавится легко, при медленном охлаждении образуя из расплава кристаллы с интересной зигзагообразной формой поверхности, окрашенной во все цвета радуги — тонкий слой оксида, образующийся на поверхности висмута играет роль дифракционной решетки, создавая красивую радужную картинку. В твёрдом состоянии висмут хрупок и полученные кристаллы не так просто сохранить.
Висмут не обладает высокой реакционной способностью, и часто встречается в самородном состоянии. Удивительно, что нет никаких свидетельств в пользу того, что этот металл был знаком людям в античности или средневековье (хотя, с другой стороны, современники Аристотеля и Агриколы часто путали свинец с оловом и наоборот и могли принимать за золото сульфидные минералы-обманки). Европейские трактаты молчат — про висмут ничего не говорится ни в перечислении семи металлов Аристотелем, ни в более поздних трудах. Вместе с тем представители мезоамериканской культуры скорее всего знали о висмуте больше европейцев — обнаруженный при раскопках в Мачу Пикчу инскский нож в форме ламы изготовлен из медного сплава, содержащего 18 % висмута, что вряд ли при сравнительно малой распространённости висмута в земной коре может быть случайностью. В Европе достоверное описание висмута появляется только в пятнадцатом веке — в 1460-е годы его начинают добывать в саксонском Шнеберге, и вскоре металл начинают применять для изготовления серебристых чернил или пигментов для живописи. Живописцы Италии, включая Рафаэля Санти делают краски как на основе металлического висмута, так и трисульфида висмута. Однако этот элемент опять умело притворялся, и алхимик Василий Валентин назвал его «висмут» (белая масса, белый свинец). Другие считали висмут разновидностью олова «ледяным оловом». В конечном итоге статус самостоятельного элемента висмут получил в 1739 году, в начале девятнадцатого века Джон Дальтон предложил в качестве символа висмута латинскую литеру В в кружочке, а современный символ висмута — Bi, ввёл Берцелиус. Он же более подробно изучил химические свойства висмута.
Некоторые соединения висмута применялись в косметике и медицине. Так, основный нитрат — кристалльно-белый осадок, образующийся при взаимодействии висмута с азотной кислотой, использовался как пудра для маскировки загара теми, кто не хотел выглядеть как человек, работающий на солнце, хотя в городах пудра с нитратом висмута темнела в результате взаимодействия с производными серы. Нитрат висмута (часто вместе с молоком или магнезией) использовался для лечения повышенной кислотности желудка; сейчас висмут продолжает работать как антацид, только, конечно не в форме нитрата, а в форме соли с лимонной кислотой. В наших аптеках это препарат можно найти под названием «Де-Нол».
И ещё одно применение висмута — его введение в сплав значительно понижает температуру плавления сплава, что и позволило использовать его в розыгрыше эпохи королевы Виктории — ложке, плавящейся в горячей воде. Ложку делали из сплава изобретённый в 1860 году американским стоматологом Барнабасом Вудом с температурой плавления 68,5 °C, содержит олово (12.5 %), свинец (50 %), висмут (25 %) и кадмий (12.5 %). Сплав Вуда, так называется этот легкоплавкий сплав, действительно может расплавиться в горячей (даже не кипящей воде), однако воду эту пить не стоит — свинец и особенно кадмий, которые могут попасть в воду после такого «розыгрыша», ничего хорошего почкам и печен не сулят. Однако сплав Вуда и его аналоги могут применяться и для серьезных вещей — легкоплавких предохранителей, защищающих электронные устройства от перегрузки напряжения.
84. Полоний
Полоний, элемент № 84, был открыт супругами Пьером Кюри и Марией Склодовской-Кюри. Об открытии они впервые сообщили 18 июля 1898 года на заседании Парижской академии наук. Элемент был назван в честь родины Марии Склодовской-Кюри — Польши, что в определённой степени можно было считать фрондой — на момент открытия Царство Польское входило в состав Российской Империи, с 1887 года в официальных имперских документах и газетах Польшу предпочитают называть «губернии Привислинского края», а с 1897 года топоним «Польша» или «Царство Польское» разрешается применять только в особых случаях, главным образом при полном именовании титула Императора Российской Империи.
Открытию полония предшествовало открытие рентгеновских лучей (ноябрь 1895 года) и излучения, испускаемого урановыми рудами (это открытие в феврале 1896 года сделал Антуан Анри Беккерель). Во время совместной работы супругов Кюри с Беккерелем в Париже Мари предлагает термин «радиоактивность» и исследователи начинают изучать этот феномен. Со временем Кюри и Беккерель приходят к выводу о том, что радиация указывает на разрушение атомов (кстати, именно этот аспект радиации практически и не принял Дмитрий Иванович, считавший атомы нерушимыми). Изучение радиации и того, как разрушаются атомы, в конечном итоге позволило понять то, из чего атомы состоят, в конечном итоге приблизив объяснение Периодического закона. Именно за открытие и изучение радиации Кюри и Беккерель получили Нобелевскую Премию по физике в 1903 году.
Открытие полония не было тривиальной задачей — Кюри и Беккерель вообще были первыми, кто работал с радиоактивными материалами, и советов спрашивать им было не у кого. Им показалось, что интенсивность радиации урановой смолки нельзя было приписать только урану (интенсивность радиации была слишком большая), и исследователи решили найти в руде дополнительные источники радиации. Исследователи работали с рудой, из которой был отделен весь уран, из нескольких тонн вручную были выделены крошечные количества полония. Даже после удаления полония радиоактивность породы сохранилась и уже в декабре 1898 года был выделен еще один радиоактивный элемент — радий. Первый образец полония, содержащий 0.1 мг этого элемента, был выделен в 1910 году, а в 1911 году Мари Кюри получила вторую Нобелевскую Премию по химии — за открытие полония и радия (Пьер Кюри в 1906 году погиб в результате дорожно-транспортного происшествия). Мари Склодовская Кюри стала первым учёным, получившим две Нобелевские премии, и до сих пор остается единственной женщиной — дважды Нобелевским лауреатом.
Радионуклиды полония входят в состав естественных радиоактивных рядов. Встречающийся в урановых рудах 210Ро (самый долгоживущий из изотопов полония, его период полураспада составляет 138 суток) и сейчас входит в состав урановых руд в крайне незначительных количествах — на тонну урановой руды содержится в среднем 100 микрограмм. Этот радионуклид, как и другие изотопы с массовыми числами 211, 212, 214, 215, 216 и 218 распадаются с образованием нуклида свинца 208Pb, существуя крайне недолго — их период полураспада исчисляется секундами или даже наносекундами. Из-за этого применяющийся на практике полоний 210Ро не извлекают из руд, а синтезируют из висмута. Почти нерадиоактивный висмут 209Bi (см. предыдущую статью) в результате облучения нейтронами превращают в 210Bi, который затем самопроизвольно распадается до 210Ро.
Сплавы полония с бериллием и бором применяются в компактных и мощных нейтронных источников, практически не создающих γ-излучения, однако отличающихся малым временем жизни, а сплавы этого металла со свинцом или иттрием применяются в компактных источниках тепла для автономных космических установок. И еще одно применение полония — ионизация воздуха, необходимая для борьбы со статическим электричеством при обращении с особо чувствительной аппаратурой.
85. Астат
Астат стал вторым в истории человечества синтезированным химическим элементом — его получили через три года после того, как технеций был получен Карло Перрье и Эмилио Сегре в Университете Палермо.
Летом 1940 года Сегре проводил исследования на циклотронном ускорителе частиц в Университете Калифорнии в Беркли, куда прибыл на стажировку. Во время стажировки Сегре в Европе уже шла война и, желая угодить своему союзнику, Бенито Муссолини предложил принять ряд антисемитских законов, например, запретить евреям занимать преподавательские и исследовательские должности в университетах, что и было принято правительством. Узнав по это Сегре не вернулся со стажировки, остался в США и вместе с Дейлом Корсоном и Кеннетом МакКензи принял участие в открытии а точнее синтезе элемента, который исследователи назвали астатом — от греческого слова «астатос» — неустойчивый (англоязычная традиция предписывает использовать в названии галогенов суффикс «ine» — chlorine, а, поскольку астат был получен в стране, где английский язык является государственным, исследователи дали ему название astatine; поскольку при заимствовании многие научные термины в русском языке сначала принимались переводом-калькой или аллитерацией, до 1962 года в СССР элемент № 85 называли «астатином»).
Для получения астата Сегре, Корсон и МакКензи бомбардировали фольгу из висмута потоком α-частиц (ядер атомов гелия 4Не) и получили нуклид 211At, период полураспада которого составлял около 7.2 часов, но официально в Периодической системе астат появился уже в 1946 году — Сегре пригласили возглавить одну из групп, работавших над Манхэттенском, и к работе над астатом Сегре с коллегами вернулся уже после окончания Второй Мировой войны, после войны исследователи и предложили название «астат». В очень незначительных количествах астат встречается в природе — он образуется на нескольких побочных маршрутах распада урана. По оценкам, в поверхностном слое земной коры толщиной в километр содержится всего 50 мг астата, что с полным правом позволяет назвать астат самым редким элементом на Земле.
Астат — наименее активный из всех галогенов — тенденции изменений свойств элементов говорят о том, что сверху вниз металлические свойства элемента увеличиваются). Недавно проведённые квантовохимические даже показали, что в твёрдом состоянии астат состоит не из молекул At2, а образует металлический кристалл (Phys. Rev. Lett. 2003, 111, 11, 116404), в отличие от остальных галогенов, образующих молекулярные кристаллы из молекул Hal2. В реакции с водородом астат дает астатоводород (HAt), водный раствор которого, как и водные растворы других галогеноводородов, представляют собой кислоту, однако поскольку электроотрицательность астата и водорода практически равны, в водных растворах астатоводорода наблюдаются не только анионы At—, но и катионы At+. Кристаллы астата (хотя их и не удаётся получить в большом количестве) похожи на кристаллы йода, но темнее. Известно около сорока изотопов астата, все они радиоактивны. Самые устойчивые изотопы (от 207At до 211At) имеют период полураспада больше часа, у самого долгоживущего (210At) из них период полураспада равен восьми часам. Можно подумать, что от столь редкого и нестабильного элемента ждать пользы бессмысленно, но это не так — нуклид 211At, может оказаться полезным для лечения некоторых типов рака.
Радиоактивный йод 131I уже применяется для лечения некоторых видов злокачественных образования щитовидной железы — этот элемент предпочтительно концентрируется в этом органе, что позволяет концентрированно воздействовать на ткани щитовидной железы, минимизируя риск воздействия на здоровые ткани. Проблема в том, что 131I и многие другие радиоизотопы, применяемые в медицине, при радиоактивном распаде испускают β-излучение — поток быстрых электронов, которые могут углубиться в ткань на несколько миллиметров. Это делает бета-эмиттеры идеальными радиопрепаратами для лечения крупных и плотных опухолей, однако их опасно использовать в лечении небольших островков опухолевых клеток, поскольку в таком случае излучение будет воздействовать и на здоровые ткани. Для островных опухолей более предпочтительными были бы радиоизотопы, испускающие α-излучение — поток ядер гелия, которые из-за своей массы могут проникнуть в ткань не глубже, чем на 50 микрометров. Радионуклид 211At не только альфа-эмиттер, от отличается небольшим периодом полураспада и распадается с образованием ядра нерадиоактивного свинца, то есть воздействие радиации на ткань непродолжительно.
Главная проблема в разработке такой терапии — разработка быстрого метода введения атома астата в органическое соединения, которое могло бы распознать определённые раковые клетки. Уже разработаны первые методы получения таких производных и даже проходят их испытания (Curr Radiopharm. 2011, V.4, P. 283–294.), так что и самый редкий элемент может быть полезным.
86. Радон
Впервые информация о проблемах, связанных с появлением газообразного радона в жилых помещениях, появилась в 1984 году в США. Работник атомной электростанции взял с работы дозиметр и решил проверить, на каком участке его пути с работы домой уровень радиации максимальный. Оказалось, что самый неприятный сюрприз ждал его дома — радиоактивный фон в плохо проветриваемом подвале его дома была максимальна и аномально высока — и всё из-за радона.
Радон улетучивается, выделяясь прямо из земли везде на нашей планете, особенно интенсивны эманации радона в областях, содержащих большое количество гранита и сланцев. Уран, который обычно содержится в почве, распадается с образованием радия, а радий, в свою очередь, распадается с образованием радона. Инертный радон легко покидает кристаллическую решётку «родительского» минерала и попадает в подземные воды, природные газы и воздух.
В некоторых странах (например, в Великобритании) излучение природного радона составляет половину или даже три четвёртых ежегодной нормы. В большинстве случаев это «естественный риск», которого нельзя избежать, однако в ряде случаев этот риск многократно возрастает. Статистика для России говорит о том, что как минимум в одной квартире из трех, расположенных на первом этаже концентрация радона может представлять опасность для здоровья человека, и риск возрастает в тех помещениях, где вентиляция либо отсутствует, либо из-за засорения не обеспечивает нормативную скорость циркуляции воздуха (так что почаще проверяйте вытяжную вентиляцию на кухне, в ванной комнате и туалете и вообще — регулярно проветривайте квартиру, в ней и без радона за день накапливается немало неполезных газообразных и летучих веществ).
Радон образуется при распаде и других радиоактивных элементов — тория и актиния. Бесцветный, не имеющий запаха газ, выделяемый этими источниками даже можно собрать с помощью обычных методов отбора газовых проб, но он вскоре распадается. Кюри, положившие начало изучению радиоактивности, заметили, что радий делает радиоактивным окружающий воздух. Открытие радона приписывается немецкому физику Фридриху Эрнсту Дорну, который посчитал, что эта наведённая радием радиоактивность воздуха обуславливается газом, который он назвал «радиевой эманацией» (правда, много людей считают, что первооткрывателем радона следует считать Резерфорда). Сходные эманации наблюдались и для других радиоактивных элементов, эманацию тория называли тороном, эманацию радия — радоном, актиния — актиноном, однако после того, как в 1908 году открывший все остальные инертные газы Уильям Рамзай измерил плотность всех эманаций, оказалось, что речь идёт об одном и том же веществе, которое было идентифицировано как самый тяжёлый инертный газ. Официальное название «радон» появилось в Периодической системе в 1923 году.
Химические свойства радона из-за его радиоактивности и короткого времени жизни (период полураспада самого устойчивого нуклида радона 222Rn — всего 3.8 суток) изучены мало. Ниже температуры кипения радон представляет собой бесцветную жидкость, в твёрдом состоянии — красно-оранжевые кристаллы, флуоресцирующие зелёным. Как и ксенон с криптоном радон реагирует со фтором.
Почему при столь небольшом периоде полураспада радона стоит беспокоиться о его содержании в жилых помещениях. Проблема заключается в том, что при его вдыхании и последующем распаде в легких надолго могут оказаться атомы «дочернего» распада радона — радиоизотопы полония и свинца. Считается, что длительное вдыхание радона является второй причиной заболевания раком лёгких после курения, что, однако, не исключает существования такой медицинской процедуры, как «радоновые ванны», польза которых доказательной медициной так и не подтверждена.
87. Франций
В 1929 году Мари Кюри взяла в парижский Институт радия на должность личного ассистента двадцатиоднолетнюю Маргариту Катерину Перей. Спустя десять лет Перей откроет неуловимый химический элемент № 87, за это открытие она получит степень магистра химии, а затем в 1946 году защитит диссертацию, став PhD (доктор философии, ученая степень, примерно соответствующая нашей степени кандидата наук). В 1962 году Маргарита Перье стала первой женщиной, избранной член-корреспондентом Французской академии наук, даже её начальница и наставница — дважды лауреат Нобелевской премии Мари Кюри.
Однако история элемента № 87 началась лет за шестьдесят до его открытия. В составленной Менделеевым в 1869 году таблице клетка с элементом № 87 не была пустой — в ней Дмитрий Иванович разместил предсказанный им элемент «экацезий». По положению в таблице было ясно, что № 87 должен быть активным щелочным металлом, свойства которого должны были напоминать свойства всего семейства. Опираясь на предсказания, многие исследователи пытались искать № 87 в рудах, содержащих щелочные элементы. Как и в случае технеция, неоднократно делались ошибочные заявления об открытии самого тяжелого щелочного металла, пока, наконец, не стало ясно, что все изотопы элемента № 87 должны быть радиоактивными. После этого стратегия поиска поменялась стали изучаться цепочки распада радиоактивных элементов.
Образование химических элементов в ходе радиоактивного распада подчиняется двум несложным правилам. При α-распаде атомный номер дочернего ядра на две единицы меньше, чем у ядра распадающегося, при β-распаде атомный номер увеличивается на одну единицу. Элемент № 89, который, испуская поток α-частиц, мог дать элемент № 87, был открыт ещё в 1899 году — это был актиний.
Изучение продуктов радиоактивного распада непростое занятие, но Перей хватило экспериментального мастерства, чтобы научиться быстро очищать образец соли актиния, чтобы она могла наблюдать продукты распада только этого элемента. Эксперименты показали, что почти 99 % подвергается медленному β-распаду, образуя элемент № 90 — торий, который затем через α-распад превращается в радий. Однако около 1 % актиния не распадалось по этому механизму, и испускало α-частицы, превращаясь в предсказанный Менделеевым экацезий. Поскольку период полураспада образовавшегося таким путем изотопа франция составлял всего 21 минуту, обнаружить этот процесс и элемент № 87 было вдвойне сложнее.
В ходе экспериментов Перей обозначала элемент № 87 как «актиний-К» (AcK), ссылаясь на путь, благодаря которому он образовывался, однако ей нужно было подобрать подходящее название для внесения его в таблицу. Во время защиты степени PhD она предложила назвать элемент «катий» («catium»), поскольку предполагалось, что это будет самый активный металл, который проще всего потеряет электрон и превратится в катион (выше, в главе про цезий я уже написал, что это не так, и благодаря эффектам теории относительности легче всего расстается с электроном и обладает титулом самого активного металла все же цезий). Название «катий» не понравилось членами комиссии по защите, кто-то даже сыронизировал, что англоязычные химики будут считать, что элемент назван в честь кота. Тогда Перей предложила название «франций», на что комиссия, состоявшая из французов, естественно ничего не смогла возразить.
Франций относится к тем радиоактивным элементам, которые еще содержатся в земной коре (правильнее сказать — регулярно образуются в земной коре в результате распада других элементов), хотя, конечно, содержание этого элемента крайне мало — по оценкам во всей земной коре единовременно присутствует не более килограмма франция. И еще одна деталь — это первый в этой книге химический элемент, который не используется нигде и ни в каком виде — сложности в получении и малый период полураспада не позволяют найти ему применение.
88. Радий
Для поколения, при жизни которого был открыт радий, этот элемент и всё, что с ним связано, было похоже на случившуюся около десяти лет назад эйфорию от создания практически работающих наносистем. Многие читатели наверняка помнят, с каким упоением нам рассказывали про то, что все больше и больше задач могут решить нанотехнологии (и самое интересное — действительно, они могут многое, хотя и не всё, что им приписывают).
Точно также был период, когда чудесный металл радий и его соли обещал нам решение всех проблем. Единственное, что изменилось за сто лет — мы стали несколько опасливее относиться к открытиям (я не имею в виду оголтелую хемофобию, а обычные меры по определению безопасности материалов). Этого не хватало людям, жившим в 1898 году, когда был отрыт радий, и радий быстро появился в зубных пастах, ушных каплях и медицинских процедурах.
Особенно же радий стал популярен благодаря тому, что его соли можно было использовать для получения краски, которая светится в темноте — небесно-голубое свечение солей радия можно было встретить на стрелках и циферблатах наручных часов и просто светящихся в ночи без притока энергии надписях и схемах. Однако через некоторое время оказалось, что у работников, готовящих светящиеся радиевые чернила или наносившие с их помощью надписи, начались регулярные боли, анемия и рак. Стало ясно, что что-то пошло не так, радий перестали применять для изготовления «ширпотреба», но к моменту запрета около сотни рабочих, имевших контакт с радиевыми красками, умерло, и еще большее число стали инвалидами.
Бесспорно, наиболее известной жертвой радия можно назвать её первооткрывательницу — Мари Кюри. Мари и Пьер изучали минерал уранинит (урановую смолку). Уранинит добывали около чешского города, который сейчас носит название Яхимов. Из уранита добывали уран, который шёл на изготовление уранового хрусталя и красок для росписи по стеклу и керамике, а пустую породу сбрасывали в отвал в близлежащем лесу. Отходы добычи урана не только сохраняли радиоактивность, но и были более радиоактивны, чем руда до извлечения урана.
В письме сестре Броне Мари писала, что остаточная радиация вызвана присутствием нового химического элемента, и Мари уверена, что ей удастся найти этот элемент. Переработав несколько тонн уранита и уранита после извлечения урана, супруги Кюри с интервалом в несколько месяцев 1898 года нашли не один, а два химических элемента — полоний и радий. Радий был получен в виде металла в 1910 году. Название элемента переводится с латинского как «луч», а радий оказался наиболее радиоактивным материалом естественного происхождения. Хотя Мари Кюри умерла в 1934 году в возрасте 66 лет, причина её смерти — апластическая анемия более, чем наверняка, является следствием её работы с радиоактивными материалами. Мадам Кюри похоронена в свинцовом гробу, а её и Пьера лабораторные журналы и записи хранятся в коробках, экранированных свинцом, а для их изучения необходимо надевать средства защиты.
В естественных условиях радий встречается в продуктах распада урана, хотя и в малых количествах. Он представляет собой самый тяжелый щелочноземельный металл, близкий по химическим свойствам кальцию и барию. Атомный номер радия 88, в земной коре можно найти изотопы радия с атомными массами 228, 226, 224 и 223, также существует еще 21 искусственный изотоп.
Радий сыграл свою роль в решении проблемы строения атома. Радий был использован Эрнестом Резерфордом в качестве источника α-частиц — ядер атомов гелия, которыми бомбардировали тонкую фольгу из золота. Неожиданно ассистенты Резерфорда — Ганс Гейгер и Эрнест Марсден обнаружили, что очень небольшая доля α-частиц отражается от фольги. Сам Резерфорд, комментировал эту находку так: «Это было почти столь же невероятно, как если бы вы стреляли 15-дюймовым снарядом в кусок тонкой бумаги, а снаряд возвратился бы к вам и нанёс удар». Такое поведение α-частиц позволило Резерфорду сделать вывод о существовании плотных компактных атомных ядер, что, стало первым шагом к созданию современной теории строения атома. Этот самый известный эксперимент Резерфорда был сделан через год после получения Резерфордом Нобелевской премии по химии «…за проведённые им исследования в области распада элементов в химии радиоактивных веществ…». Заметим, что в том, что Резерфорду вручили Нобелевскую премию именно по химии есть некая ирония (или шутка Нобелевского комитета), и именно после известия о присуждения «химического Нобеля» Резерфорд и изрёк свое знаменитое: «Все науки делятся на физику и коллекционирование марок».
В настоящее время радий главным образом применяется в медицине опять же как источник радиации — первые работы в этой области начались во времена Мари Кюри. Сначала было обнаружено, что при контакте с радиоактивными материалами происходит ожог кожи, затем совместная работа Кюри с врачами показала, что радиация в состоянии уменьшать размеры опухолей или разрушать их. Вскоре это стало известно, как «терапия Кюри», радиацию стали изучать, и радиологическая лаборатория Мадам Кюри в Сорбонне со временем превратилась в Радиевый Институт. Сейчас для разрушения опухолей применяют и другие радионуклиды.
Если вы будете держать в руке кусок радия (чего я вам, конечно не советую — все виды радиоактивного излучения, испускаемого радием, повреждают ДНК и могут стать фактором развития опухолей), за счет радиоактивного излучения он будет казаться теплым на ощупь. Белая поверхность радия со временем темнеет из-за реакции с воздухом и образования оксида и нитрида, он легко реагирует с водой, как кальций или барий. Радий достаточно тугоплавкий — его температура плавления составляет около 700 °C. Природные изотопы радия значительно различаются по периоду полураспада — от 1602 дней для наиболее стабильного 226Ra до 11.4 дней для 223Ra. В начале XX века для получения грамма чистого радия, нужно было несколько вагонов урановой руды, 100 вагонов угля, 100 цистерн воды и 5 вагонов разных химических веществ. В то время за 1 г радия нужно было заплатить больше 200 кг золота. В наши дни себестоимость производства радия, конечно, меньше, но он до сих пор входит в число самых дорогих металлов.
89. Актиний
Первооткрывателем актиния считается Андре-Луи Дебьерн, друг и коллега супругов Кюри, который работал совместно с ними над поиском радиоактивных элементов в образцах уранита. Хотя он опубликовал описание элемента в 1899, а затем и в 1900 году, есть некоторые сомнения о том, что методы, которые использовал Дебьерн, позволяли достаточно точно его описать. Независимо от Дебьерна поиском новых радиоактивных элементов занимался французский химик Фридрих Оскар Гизель, который получил актиний в чистом виде в 1904 году и, не будучи осведомленным о работах Дебьерна, назвал элемент «эманием». Гизель был почитателем Кюри и не видел резона в оспаривании приоритета открытия элемента, который был выделен в лаборатории, которой он восторгался. Таким образом, когда стало ясно, что Гизель и Дебьерн работают над изучением одного и того же элемента, Гизель признал приоритет французского коллеги и теперь мы знаем элемент № 89 под именем, которым его наградил Дебьерн (от греческого «актис» — луч).
Кто бы не был первооткрывателем актиния, актиний сыграл очень важную роль в истории химии, оказавшись первым не первозданным элементом земной коры. К первозданным или примордиальным элементам относят те элементы, которые уже существовали в момент формирования Солнечной системы, те, период полураспада которых больше 108 лет. Первозданными являются все элементы, имеющие стабильные изотопы и немало радиоактивных элементов. Химические свойства актиния, который в виде простого вещества представляет собой серебристо-белый металл, практически идентичны свойствам редкоземельных элементов, в первую очередь — лантана.
Известно тридцать шесть изотопов актиния, все они радиоактивные. Наиболее устойчивым из этого семейства является 227Ac, нуклид, которым представлен природный актиний, его период полураспада составляет около 21.8 лет. Период полураспада остальных изотопов актиния меньше десяти часов, у большинства — меньше минуты.
Нуклид 227Ac излучает в сто пятьдесят раз интенсивнее радия, что обуславливает его применение в радиоизотопных источниках энергии. Несмотря на то, что что актиний в следовых количествах присутствует в урановых рудах, проще его получать искусственным путём — облучая мишень из 226Ra пучком нейтронов в ядерном реакторе.
Актиний дает названием семейству из пятнадцати элементов-актиноидов, в это семейство входят элементы от актиния до лоуренсия (от номера 89 до номера 103). Предложение вынести актиноиды в отдельный блок высказал в 1945 году Глен Сиборг, опираясь на аналогии с блоком лантаноидов, появившимся в Периодической системе в 1921 году по инициативе Нильса Бора.
Наряду с работами в области ядерной химии Сиборг известен как пионер ядерной медицины — раздела медицины, в которой радиоактивные изотопы различных элементов применяются для диагностики или лечения заболеваний (некоторые примеры такого использования радионуклидов были описаны выше). Актиний тоже применяется для этого — нуклид 225Ac это активный агент в направленной альфа-терапии — методике, направленной на ингибирование роста вторичных злокачественных образований за счет их облучения. Источником α-частиц в этом виде терапии часто является полученный из 225Ac нуклид 213Bi.
90. Торий
Ведущие казанской лаборатории интерактивных образовательных программ «Естественно, наука!» (Yesnauka), научным консультантом которой я являюсь, заканчивая программу для детей с цветными огнями и взрывами, должны обязательно сказать: «Только не пытайтесь повторить это дома». Однако, были в истории химии люди, которые не прислушивались к таким предостережениям (а возможно им никто это не говорил). Шведский химик Йёнс Якоб Берцелиус с коллегами совершил немало открытий на кухне своей квартиры, расположенной в Стокгольме на углу улиц Ниброгатан и Риддаргатан. Так, в 1815 году Берцелиус выделил новый элемент из образца минерала, присланного ему из шведского шахтёрского городка Фалун. Берцелиус назвал новый элемент торием в честь скандинавского бога грома Тора. Через несколько лет он понял, что поспешил с заявлением об открытии, после ряда анализов определив, что он получил не элемент, а фосфат иттрия. Берцелиус признал свою ошибку, но, похоже, гипотетическое название ему понравилось.
Позже, в 1828 году, когда Берцелиус уже стал непререкаемым авторитетом для большинства химиков, после того, как он действительно стал первооткрывателем трёх химических элементов, он получил образец странного минерала от норвежского священника Ганса Эсмарка. В новой лаборатории, уже не на кухне, а в Шведской Королевской Академии наук Берцелиус выделил свой четвёртый элемент и может из-за того, что ему понравилось «невостребованное» название, а может и из-за того, что норвежский минерал внешне был похож на тот, с которым он 13 лет испытал фиаско, он в очередной раз (на этот раз уже заслуженно) назвал элемент торием и дал ему символ Th.
Берцелиус описал много химических и физических свойств тория, однако главная его характеристика — радиоактивность, избежала внимания шведского химика. Впрочем, это неудивительно, стеклянные фотопластинки, которые в 1896 году помогли Беккерелю обнаружить явление радиации, появились только в 1847 году, за год до смерти Берцелиуса. Сейчас даже при беглом взгляде на Периодическую систему ни у кого не возникает сомнения в радиоактивности тория — его соседство с такими известными радиоактивными элементами как радий, актиний, уран и плутоний позволяет предположить, что торий тоже будет радиоактивным, даже не зная правил стабильности атомных ядер.
Годы после открытия торий и его соединения лежали на лабораторных полках невостребованными, однако в какой-то момент соединения этого элемента стали использовать в газовых фонарях уличного освещения. Такую необычную профессию торий по той причине, что его оксид ThO2 оказался самым тугоплавким из всех оксидов и не плавился в факеле газовой горелки, а раскалялся добела и светил петербуржцам, лондонцам, парижанам и другим жителям столиц и крупных городов.
Значение газового освещения улиц сейчас забыто, но бесспорно это было не меньшее достижение, чем впоследствии изобретение электрических ламп — газовые лампы впервые в истории человечества позволили сделать так, что сначала крупные, а потом и другие улицы после заката не погружались во тьму (раньше, если кому-то нужно было выйти за ворота в темную время суток, ему приходилось брать с собой персональный источник света — факел или фонарь). Первоначально в калильных сетках газовых фонарей применялись и другие оксиды, но, помимо проблем с температурой плавления, они давали свет не очень высокого качества, и в 1891 году австрийский химик Ауэр фон Велсбах, испытав возможность применения в газовом фонаре оксидов магния, лантана и иттрия, остановился на оксиде тория.
Кто-то может подумать, что это было сомнительное инженерное решение — что-то типа отравленной туники Несса, и люди, жившие на освещенных ториевыми газовыми горелками улицах (а это были представители высшего и среднего класса) годами подвергались радиационному воздействию от распадающихся атомов тория и заболевали. К счастью, это было не так — торий распадается, испуская α-частицы (ядра атомов 4Не), пробег которых невелик, и которые могут быть легко остановлены стеклянным колпаком фонаря. Более того — оксид тория до сих пор применяется для изготовления горелок походных плиток, работающих от небольших газовых баллонов. Такие горелки абсолютно безопасны, если, конечно их не облизывать или не размалывать в порошок, а потом вдыхать его. Правда, если вам все-таки не по себе от перспективы находиться рядом с диоксидом тория, покупая туристическое снаряжение, обращайте внимание на маркировку «thorium free».
Итак, оксид тория безопасен, если его не есть, однако какое-то время люди принимали его вовнутрь — оксид тория использовался как рентгеновский контраст торотраст для рентгеноскопии в 1930–40 годах — этому применению способствовала исключительная непрозрачность диоксида тория для рентгеновского излучения. Без сомнения, рентгенограммы, полученные с помощью диоксида тория, спасли немало жизней, а применение радиоактивного контраста рассматривалось как «приемлемый риск». К счастью, в конце 1940-х годов были разработаны менее опасные для здоровья контрасты для рентгеновской диагностики.
В наши дни торий применяется главным образом в энергетике. Содержание тория в земной в три раза больше содержания урана, при этом месторождения урана и месторождения тория далеко не всегда сопутствуют друг другу, и государства, обладающие запасами тория, не обязательно обладают запасами урана и наоборот. Самый распространённый в земной коре нуклид тория — 232Th не способен делиться тепловыми нейтронами и быть ядерным горючим. Однако при захвате теплового нейтрона 232Th превращается в 233U, который способен к делению подобно 233U и 239Pu и применяется в качестве топлива ректоров на быстрых нейтронах.
91. Протактиний
В 1871 году Дмитрий Иванович Менделеев среди ряда других сделал следующее предсказание: «Между торием и ураном можно ожидать элемента с атомной около 235. Формула высшего оксида этого элемента X2O5, как у ниобия с танталом, которым он должен быть аналогичен».
Определенная в наше время атомная масса предсказанного элемента — протактиния близка к 231. Хотя предсказание массы можно посчитать относительно точным, оно всё-таки не сбылось — в предсказаниях атомной массы протактиния Менделеев не мог знать, что протактиний является членом одной из всего лишь четырёх пар «перевёртышей» — пар, в которых более тяжелый элемент располагается перед более лёгким (эти пары — аргон и калий; кобальт и никель; теллур и йод; торий и протактиний). Сейчас мы знаем, что существование таких пар объясняется тем, что периодичность изменения свойств элемента зависит не от массы, а от заряда ядра, но эта концепция была разработана Мозли и Бором уже после смерти Дмитрия Ивановича.
Другие же предсказания Менделеева про протактиний сбылись — свойства протактиния действительно воспроизводят свойства тантала — его высший и наиболее устойчивый оксид Pa2O5, хотя необходимо учесть, что протактиний демонстрирует горизонтальную аналогию свойств с торием и ураном, проявляя степень окисления +4, а вот горизонтальную аналогию свойств Дмитрий Иванович не принимал. Менделеев точно предсказал, что протактиний будет сопутствовать урану в руде ураните (также известной как урановая смолка).
Уран и торий были открыты в 1789 и 1828 годах соответственно, а вот открытия стоящего между ними протактиния пришлось ждать до XX века. Конечно тут, как и во многих других случаях нужно определиться, какой момент можно считать открытием элемента — осознание того, что руда содержит новый элемент, выделение соединения этого элемента из руды или получения нового элемента в виде простого вещества. В зависимости от того, что мы засчитаем за открытие, фактически для любого элемента можно назвать нескольких первооткрывателей. Для протактиния же ситуация еще сложнее.
В 1900 году английский химик и изобретатель Сэр Уильям Крукс выяснил, что в некоторых урановых рудах содержится новое радиоактивное вещество, которое он назвал уран-Х. Позднее оказалось, что уран-Х представляет собой два разных вещества, получившие название UX-1 и UX-2. Второе из них — UX-2 впервые было выделено польским химиком Казимиром Фаянсом в 1913 году. Это был короткоживущий нуклид 234Pa, период полураспада которого был чуть больше минуты. Из-за малого времени жизни Фаянс назвал открытый элемент бревием.
В 1917 году немецкий физик Лиза Мейтнер выделила более устойчивый нуклид этого элемента — 231Pa, который отличался большим временем жизни — его период полураспада составлял около 33 000 лет. В связи с этим Фаянс отказался от названия «бревий», поскольку правила обязывали учёных называть элемент, опираясь на свойства самого долгоживущего из изотопов. Мейтнер предложила несколько громоздкое название «протоактиний», которое потом редуцировалось до привычного протактиния. Выбор названия был продиктован тем, что α-распад протактиния приводит к образованию актиния, элемента № 89. В том же году нуклид 231Pa был выделен автором термина «изотопы» Фредериком Содди и его коллегой Джоном Крэнстоном (оба ученых работали в Университете Глазго).
Протактиний — радиоактивный и высокотоксичный элемент, который не находит практического применения, однако некоторыми аспектами интересен для ученых. Так, например, определение соотношения изотопов 231Pa и 230Th в океанских осадочных породах позволяет океанологам реконструировать перемещение вод в Северной Атлантике после таяния льдов последнего ледникового периода.
В 1961 году Управление по атомной энергии Великобритании, переработав 60 тонн радиоактивных отходов, выделило 125 грамм протактиния. Это и есть самый серьезный по массе мировой запас этого элемента. Создан он для научных нужд — лаборатории всего мира могут закупить протактиний, если он им нужен для экспериментов.
92. Уран
Уран относится к самым известным, наверное — печально известным химическим элементам, Это самый тяжелый из элементов, который можно найти в земной коре, более того — уран более распространен в земной коре, чем серебро. Уран относится к восьми химическим элементам, названным в часть небесных объектов. Блестящий чёрный порошок, который в 1789 году выделил из саксонской руды, названной впоследствии уранитом, Мартин Генрих Клапрот, был не металлическим ураном, а оксидом урана. Клапрот, не зная, что это оксид, назвал новый «элемент» ураном (этим он хотел поддержать предложение Иоганна Боде назвать новую планету «Уран» вместо «Звезда короля Георга», как предложил первооткрыватель этого небесного тела английский астроном Уильям Гершель). Только в 1841 году французский химик Эжен-Мельхиор Пелиго установил, что уран Клапрота это диоксид UO2, превратил его в тетрахлорид урана UCl4 и восстановил хлорид урана калием до металлического урана. Металлический уран ничем не отличается от типичных металлов — вещество с серебристо-белым блеском. Уран быстро тускнеет на воздухе, окисляясь, а если его измельчить — самовозгорается.
Химические свойства урана разнообразны и удивительны. Большой заряд его ядра приводит к тому, что релятивистские эффекты (влияние ядра на электроны, которое можно интерпретировать с помощью специальной теории относительности Эйнштейна) приводят к тому, что электронная конфигурация урана и его производных значительно отличается от таковой неодима, свойства которого должны были бы совпадать со свойствами урана при формальном применении Периодической системы.
Характеризуя химические свойства урана, его называют «самым тяжёлым переходным металлом». Это не совсем метафора — к переходным мы относим металлы с частично заполненным d-электронным подуровнем, а благодаря релятивистским эффектам формула внешнего электронного слоя урана 5f36d17s2, так что его вполне можно относить к переходным металлам (хотя, как правило, при классификации его принято относить к f-элементам, и не рассматривать как переходный металл). Приближает его к свойствам переходного металла и то, что он гораздо разнообразнее неодима и других лантаноидов по химическим свойствам и по окраске своих соединений. Тетрахлорид урана, с которым работал Пелиго, ярко-зелёного цвета, трийодид урана (UI3) тёмно-синий. Большую часть соединений урана сложно получить и охарактеризовать, так как они легко взаимодействуют с кислородом и влагой воздуха, и в области химии урана еще достаточно белых пятен и перспектив для исследования. Конечно же, сейчас химики изучают свойства урана не ради соединений с яркими цветами, а из-за того, чтобы понять, как лучше разбираться с радиоактивными отходами — концентрировать уран и получать соединения, из которых он не мог бы попадать в окружающую среду. В земной коре же и в большинстве известных соединений уран присутствует в форме уранил-катиона UO22+, образующего хорошо растворимые соединения, которые нежелательно использовать для связывания урана из отработанного ядерного топлива (ОЯТ) — в соли уранил-катиона могут медленно «вымываться» водой из захоронений отходов ядерной энергетики. На настоящий момент проблему ОЯТ решают, инкасупсулируя соединения элементов из нераспавшегося ядерного топлива в прочную керамику, которая, однако, в тысячелетней и более перспективе может разрушаться из-за распада входящих в нее радиоактивных компонентов и нарушения структуры кристаллической решетки керамики.
Однако, уран больше знаком большинству людей не по химическим свойствам и окрашенным соединениям, а как ядерное топливо. Если брать гражданскую сторону атомной энергетики (с военной всё ясно и так), отношение людей к атомным электростанциям неоднозначное. С одной стороны, рассуждая рационально, понятно, что атомные электростанции практически ничего не выбрасывают в окружающую среду, работая в замкнутом контуре, а с другой — печальный опыт аварий на Три-Майл-Айленде, в Чернобыле и в Фукусиме не всегда позволяет рассуждать рационально. Для получения топлива для АЭС природный уран, который в основном представлен нуклидом 238U, обогащают — выделяют из него 235U, содержание которого в природном уране всего 0.7 %. Оставшийся после обогащения уран (так называемый обеднённый уран) содержит около 0.2 % 235U. Обеднённый уран на 40 % менее радиоактивен, чем природный материал, и именно его применяют для химических экспериментов в лаборатории (химические свойства различных изотопов химических элементов не различаются, и «рецепты», полученные для 238U, можно будет использовать и для связывания 235U).
Высокая плотность урана позволяет применять его для деталей, которым нужна высокая прочность, например, для изготовления киля морских судов и наоборот — для бронебойных боеприпасов. Радиации от обеднённого урана, который распадается с выделением α-частиц, обладающих малой длиной пробега, следует, но ещё в большей степени опасна химическая токсичность урана, сравнимая с токсичностью ртути или свинца — большей части ветеранов войн в Персидском Заливе, имевшим дело с боеприпасами из обеднённого урана и обратившимся к врачам в связи с ухудшением состояния здоровья было продиагностировано не радиационное поражение, а химическое отравление.
Однако все же не стоит считать уран чем-то демоническим, несущим только тревогу и боль. Атомные электростанции вырабатывают около 17 % мировой электроэнергии, согревая дома. Уран согревает и Землю — предполагается, что внутреннее тепло Земли, обеспечивающее существование расплавленной мантии, обеспечивается распадом урана и тория.
И еще одно, возможно, неожиданное для многих применение хрусталя — в конце девятнадцатого — начале двадцатого века производители стекла получали особый «урановый хрусталь», добавляя к смеси для выплавки стекла неорганические производные урана, главным образом его оксиды.
При обычном дневном освещении урановый хрусталь и изделия из него выглядели желтовато-зелёными, а вот при облучении УФ-светом из-за способности производных урана к флуоресценции начинали светиться ярко-зеленым светом. Урана в стекло добавляли мало, посуда из уранового хрусталя считалась (и на самом деле являлась) не более опасной, чем посуда из хрусталя обычного (того который со свинцом — сервировать и есть пищу можно, а вот использовать для ее длительного хранения — не стоит).
С 1943 года уран стал стратегическим сырьем, на такую ерунду как посуда тратить его было запрещено. К 1958 году стало понятно, что обедненный (не использующийся для получения атомной энергии) уран точно также можно использовать для получения не менее красивого стекла, но к тому времени популярность уранового хрусталя упала, а радиофобия возросла, поэтому такое стекло больше не производится, а изделия из него остались только в музеях и частных коллекциях. Единственное, когда может быть опасен урановый хрусталь — когда его кусочки входят в состав браслета или бус — вот тут-то при длительном контакте такой красивой стекляшки с кожей поток α-частиц может стать причиной радиационного ожога.
93. Нептуний
Тем, кто хоть немного осведомлен об атомной энергетике, известны элементы уран и плутоний, названные в честь седьмой и девятой планет Солнечной системы (плутоний был открыт задолго до 2006 года, когда Плутон потерял статус планеты и полноценных планет у нас в системе осталось восемь). Восьмая планета Солнечной системы — планета, располагающаяся между небесными телами Уран и Плутон — планета Нептун, а между ураном и плутонием в клетке с номером 93 находится нептуний.
В июне 1940 года американские физики Эдвин МакМиллан и Филип Абельсон, работавшие в Радиационной лаборатории в Беркли, опубликовали статью, описывающие процессы, протекающие при бомбардировке урана нейтронами в циклотроне. Удивительно, но опубликованная в открытой печати статья учёных из Беркли говорила о том, как преодолеть главные препятствия на пути к созданию атомного оружия. Статья была опубликована, когда «урановую бомбу» пытались создать по обе стороны Атлантического океана.
В опубликованной статье описывалось, что при поглощении нуклидом 238U медленного нейтрона в реакторе приводило к образованию неустойчивого 239U. Последний разрушался по схеме β-распада — превращению нейтрона в пару протон-электрон, в результате которого электрон (исторически сложилось так, что в данном контексте электрон называют β-частицей). Результатом реакции, обнаруженной МакМилланом и Абельсоном, являлось образование нового элемента, который ранее не наблюдался в природе — он и получил название «нептуний». При этом 239Np тоже неустойчив и подвергается очередному этапу β-распада, в результате чего образуется ядро плутония 239Pu. Плутоний стал материалом для одной из первых в истории атомной бомбы.
Элемент, получившийся в результате экспериментов МакМиллана и Абельсона на самом деле был уже третьей попыткой назвать элемент нептунием. В 1877 году немецкий химик Ганс Рудольф Герман посчитал, что обнаружил в руде танталите новый элемент и назвал его нептунием. В 1886 году еще один немецкий химик Клеменс Винклер, открыв то, что мы сейчас называем германием, первоначально хотел назвать этот элемент нептунием, но, тогда еще не было понятно, что Герман ошибся и название было занято. К 1940 году стало понятно, что Герман ошибся, название вновь высвободилось, и нептуний занял свое окончательное место в Периодической системе.
Нептуний, как и его соседи по семейству актиноидов — серебристый металл. Наиболее устойчив нуклид нептуния 237Np, его период полураспада больше двух миллионов лет, и именно этот тип нептуния образуется в результате «горения» топлива в атомных электростанциях. Получившийся в экспериментах МакМиллана и Абельсона 237Np характеризовался периодом полураспада чуть более двух суток.
Хотя долгоживущий нептуний впервые был обнаружен был впервые обнаружен только в отработанном топливе ядерных реакторов, этот элемент может в незначительных количествах образовываться и в земной коре в процессах, аналогичных, протекающих в реакторах — уран 238U захватывает нейтрон, образовавшийся при распаде другого атома урана, превращается в 239U, который затем за счет β-распада переходит в 239Np, однако основной вклад в образование нептуния вокруг нас вносят другие процессы, и мы гипотетически можем обнаружить нептуний в офисе или даже дома.
Многие датчики задымления, которые обязательном порядке должны монтироваться в присутственных местах, а по желанию и в жилых помещениях, для ионизации воздуха в рабочей камере детектора используют α-частицы, образующиеся при распаде америция 241Am, в результате которого этот элемент медленно превращается в нептуний. Правда, период полураспада 241Am составляет 432 года, и за время эксплуатации детектора нептуний образуется в крайне незначительных количествах.
Практических применений нептуния очень мало — получение плутония и устройства для детектирования нейтронов с высокой энергией. Ежегодно в качестве побочных продуктов работы атомных электростанций образуется более 50 тонн нептуния, часть из которых превращают в плутоний. Обычно с отходами ядерной энергетики обращаются с той же предосторожностью, что и с сырьем для производства горючего для атомных электростанций и ядерного оружия.
94. Плутоний
Гленн Теодор Сиборг открыл, а точнее получил плутоний в декабре 1940 года в Беркли. Весной 1941 года, когда Сиборг установил, что этот элемент в состоянии поддерживать цепную реакцию деления, он написал секретное письмо президенту США Рузвельту, в котором информировал его о возможности применения нового элемента для создания мощного источника энергии.
С этого письма можно отсчитывать начало гонки, направленной на создание значительных количеств плутония, чтобы снабдить Манхэттенский инженерный округ военно-инженерных войск США (мы более знакомы с названием «Манхэттенский проект») достаточным количеством плутония для создания атомной бомбы. Всем известно классическое изображение грибовидного облака ядерного взрыва — символа того, какой разрушительной силой обладает атомное оружие. Плутоний, наработанный во время работы Манхэттенского проекта был использован. Металлической плутониевой сферой с диаметром 10 сантиметров и массой 8 кг была оснащена атомная бомба «Толстяк», которая 9 августа 1945 года была сброшена на Нагасаки.
Если подумать, название элементу досталось мрачное. Сиборг с коллегами предполагал, что плутоний — последний элемент в Периодической системе, и под стать этому предположению предлагал названия — ультимий, экстремий. Однако элемент назвали «плутоний» в честь последней (по представлениям, бытовавшим в те времена) планеты Солнечной системы. Первоначально Сиборг предложил назвать новый элемент «плутием», однако позже решил, что название «плутоний» звучит лучше. Плутон же был назван в честь Плутона-Аида — римского-греческого бога, заведовавшего царством мёртвых.
Однако, если отвлечься от применения плутония в военном деле (в конце концов, наверное, ни один химический элемент нельзя назвать «пацифистом», и вообще, дело не в химических элементах, а людях, которые их используют), плутоний может похвастаться одними из самых интересных химических свойств. При атмосферном давлении существует шесть аллотропных модификаций, каждая из которых устойчива в определённом температурном интервале и ведет себя по-своему. Так, при комнатной температуре плутоний очень хрупкий, но при нагревании до 100 °C превращается в более пластичную и ковкую форму. Пластичность и ковкость плутония можно увеличить, сплавив его с небольшим количество галлия — на практике этим способом и пользуются для того, чтобы с плутонием было проще работать.
Смешение плутония с другими металлами также приводит к получению материалов с интересными свойствами. Так, интерметаллическое соединение плутония с кобальтом и галлием (PuGaCo5) при температуре 18.5 К и ниже ведет себя как сверхпроводник, но, увы, не проявляет эти свойства в течение длительного времени — плутоний распадается с образованием урана, островки образовавшегося урана меняют электронную конфигурацию материала, и, поскольку сверхпроводимость сильно зависит от электронного строения, эффект постепенно исчезает. В каком-то смысле плутоний является врагом самому себе, а его радиоактивность не дает в полной мере раскрыть все богатство его химических свойств.
Однако, несмотря на репутацию, некоторые люди носили плутоний в сердце, причем не в переносном, а в самом что ни на есть прямом смысле. Дело в том, что нуклид 238Pu при радиоактивном распаде выделяет столь значительное количество тепла, что его применяли как источник энергии для служивших чрезвычайно долго термоэлектрических генераторов, обеспечивавших работу ранних кардиостимуляторов. Сейчас в распоряжении кардиохирургов есть более эффективные и более безопасные источники энергии, но плутониевые термоэлектрические генераторы все еще популярны среди ученых и инженеров космических аппаратов. Это позволило сблизить Плутон с плутонием — аппарат «Новые горизонты», детально изучивший в 2015 году Плутон, использует энергию плутониевого радиоизотопного термоэлектрического генератора. Заметим, плутоний стал появляться в космосе не благодаря человеку — изучение космического пространства показало, что есть и нерукотворные источники плутония — он образуется в процессах взрывов сверхновых звезд, но, поскольку период полураспада самого стабильного нуклида плутония — 242Pu, 376 тысяч лет, Земля и Солнечная система, возраст которых составляет примерно 4.5 миллиарда лет, могут похвастаться только рукотворным плутонием.
95. Америций
Периодическая система — занятная вещь. Она позволяет не только предсказывать химические и физические свойства элементов и их соединений, но и искать в ней интересные совпадения, которые зачастую оказываются не совпадениями. Одно из таких совпадений, на которое, может быть, кто-то из читателей и обращал внимание, таково — в Периодической системе аккурат под лантаноидом № 63 с названием «европий» находится актиноид № 95 — америций — Старый свет и Новый свет и здесь стоят друг напротив друга.
Америций не существовал, пока Глен Сиборг с коллегами не получил его в 1944 году, работая над Манхэттенским проектом. Сиборг даже запатентовал элемент № 95 и способ получения (патент US3156523A), так что америций стал первым химическим элементом, который какое-то время защищался патентным законодательством США. Всего Сиборг участвовал в получении десяти искусственных элементов, но почему-то запатентовал только два из них № 95 и № 96.
Ещё один интересный момент из истории америция — америций и кюрий были первыми элементами, об открытии которых учёный сообщил не в письмах коллегам и не в журнале с высоким рейтингом, а в прямом радиоэфире. В 1945 году радиокомпания NBC пригласила Глена Сиборга принять участие в радиопрограмме «Юный всезнайка» (Quiz Kids), и во время эфира Сиборга спросили, не получил ли он новые элементы кроме плутония и нептуния. Поскольку Сиборг все равно планировал официально объявить об америции через пять дней на заседании Американского химического общества, он решил опередить события и рассказал об америции и кюрии радиослушателям. Конечно, заседание Американского химического общества и последующая пресс-конференция тоже состоялись, но на них речь шла уже о технических деталях — способе получения, свойствах новых элементов, но первое сообщение все же было сделано таким экстравагантным по тем временам способом (как я считаю, это был совершенно правильный подход к научным коммуникациям).
Первым синтезированным нуклидом америция был 241Am (период полураспада 433.2 года) — до сих пор наиболее вид атома этого элемента. Чикагская металлургическая лаборатория (еще одно название Манхэттенского проекта) занималась наработкой больших количеств плутония для атомной бомбы и некоторые атомы плутония 239Pu захватывали дополнительные нейтроны, превращаясь в 241Pu, который подвергался β-распаду и превращались в 241Am. Ни один из изотопов америция нельзя назвать стабильным. У самого долгоживущего 243Am период полураспада 7370 лет, большая часть из 18 изотопов этого элемента практически полностью разрушаются за минуты. Как и многие другие актиноиды, америций — серебристо-белый металл с плотностью как у свинца и достаточно высокой температурой плавления — около 1200 °C.
Характерной особенностью америция является то, что это единственный искусственный и радиоактивный элемент, который можно обнаружить в наших домах и рабочих помещениях. Тут следует немного разъяснить ситуацию. Выше было написано, что в воздухе непроветриваемых комнатах домов, в особенности стоящих над гранитом, накапливается радиоактичный радон. По закону больших чисел в воде и воздухе наших квартир могут находиться ничтожные количества атомов плутония, попавшие в окружающую среду во время ядерных испытаний. Нелишне напомнить, что гипотетическая фраза «в водопроводной воде обнаружены соли урана» абсолютно не эквивалентна фразе «в водопроводной воде соли урана обнаружены в опасной для человека концентрации». Вторая действительно говорит об опасности, а первая — просто о совершенстве современно аналитической химии, которая вполне могла бы помочь лирическому герою песни В. С. Высоцкого в его замысле: «Да я в Москве с киркой уран найду при такой повышенной зарплате».
Речь идет о том, что америций — единственный радиоизотоп, изделие с которым который можно купить в строительном магазине, причем покупка и установка этого прибора понизит опасность помещения (а в офисах, гостиницах, магазинах и кинотеатрах такие устройства должны стоять в обязательном порядке). Америций применяется в некоторых типах датчиков задымления. Около 0.3 микрограмма оксида америция располагается в индикаторной камере датчика, где испускаемый америцием поток α-частиц ионизирует воздух, позволяя протекать электрическому току между электродами детектора. Если в воздухе появляются аэрозольные частицы дыма, они поглощают α-частицы, ионизация воздуха в камере прекращается, электрическая цепь в детекторе размыкается и подается сигнал тревоги.
Америций также применяется там, где нужен источник α-частиц и/или γ-излучения — промышленность, медицина, но его применение ограничено только теми областями, где нужно небольшое количество излучающего материала — производство америция стоит дорого. Для справки, один грамм оксида америция, который применяют в датчиках задымления, стоит около 1500 долларов США, а грамм золота — около 30 долларов.
96. Кюрий
Кюрий — очередной химический элемент, который относится к трансурановым элементам, элементам, не встречающимся в земной коре (незначительные количества плутония и нептуния, спонтанно образующиеся в процессах с участием урановых руд, не в счет). Кюрий твердый, хрупкий металл серебристо-белого цвета, который быстро тускнеет на воздухе, этот элемент можно получить только в ядерном реакторе. Нуклид 242Cm был получен в 1944 году во время работы над Манхэттенским проектом Гленом Сиборгом, Ральфом Джеймсом и Альбертом Гиорсо. Для того, чтобы получить этот элемент, исследователи бомбардировали мишень из 239Pu α-частицами. Как и о всех остальных элементах, которые Сиборг с коллегами обнаружил во время работ, основная цель которых была — создание атомной бомбы, информация о кюрии была обнародована уже после окончания Второй Мировой войны — об открытии кюрия, как и америция, американцы впервые услышали в детском радиошоу; на кюрий и способ его получения, как и на америций Сиборг оформил патент (впрочем, и для элемента № 95, и для элемента № 96 срок действия патента истёк еще в 1960-е годы).
Кюрий получил название в честь супругов Кюри — радиоактивный элемент логично было назвать в честь тех, кто заложил основы теории радиации. Кстати, над кюрием в группе лантаноидов находится гадолиний, названный в честь финского химика Юхана Гадолина, посвятившего свою жизнь изучению редкоземельных элементов, так что в названии нового элемента Сиборг продолжал следовать параллели Европий-Америций, выстроенной для элемента с номером 95. Хотя, все могло бы быть совсем не так — близость химических свойств америция и кюрия приводила к колоссальным сложностям в их разделении, и достаточно устав от этой процедуры, Сиборг ли, кто его из коллег, предложил назвать парочку № 95 и № 96 «пандемониум» и «делириум» — «ад» и «бред» на латыни. К счастью, самообладание вернулось к ученым, и элементы с такими названиями в Периодической системе не появились.
Известно девятнадцать изотопов кюрия, все они радиоактивны. Первый из них, 242Cm, в 1947 году был выделен в форме гидроксида, и в 1951 году — в виде металла. Наиболее устойчив 247Cm, его период полураспада около 16 миллионов лет, период полураспада 248Cm 340 тысяч лет, а ядер 250Cm и 245Cm — девять и восемь с половиной тысяч лет соответственно. Все остальные изотопы кюрия распадаются гораздо легче, их периоды полураспада исчисляются годами или месяцами.
Несмотря на неустойчивость, кюрий находит практическое применение — либо как топливо для радиоизотопных термоэлектрических генераторов, которые используют на спутниках, космических зондах или в автономных спускаемых роверах (пока, однако, к ним можно отнести только марсоходы), либо как излучатель α-частиц для α-частичных рентгеновских спектрометров, которыми опять же чаще всего оснащают автономные аппараты для изучения космоса.
Радиоизотопные термоэлектрические генераторы — это электрические генераторы, преобразующие в электроэнергию термическую энергию распада радиоактивного материала. Работает такой генератор по принципу обычной термопары — кюрий, разлагаясь, выделяет тепло, которое нагревает спаянные друг с другом проводники из различного материала, в результате чего образуется электрический ток. Правда, иногда тепло радиоактивного распада кюрия использовалось непосредственно, например, для обогрева марсоходов. Для применения в изучении космического пространства радиоактивный материал должен выделять достаточное количество тепловой энергии на единицу массы, и кюрий в этом отношении привлекательнее плутония и америция, также применяющихся в аналогичных целях.
α-Частичные рентгеновские спектрометры позволяют определять состав образца в результате анализа картины обратного рассеивания α-частиц — с помощью уравнений, составленных Эрнестом Резерфордом можно определить массу ядра, с которым столкнулась α-частица, таким образом, выявив ядра, входящие в состав анализируемой пробы. Рентгеновские спектрометры такого типа давно используются в космосе — от полетов совершивших мягкую посадку на Луну аппаратов Сервейер (α-частичные рентгеновские спектрометры были смонтированы на аппаратах № 5–7 этой серии и изучали состав лунного грунта) до современных марсоходов и космической миссии Розетта, спускаемый аппарат которой — Филы, 12 ноября 2014 года совершил посадку на комету 67P/Чурюмова — Герасименко.
Большая часть кюрия, которая в наше время содержится в окружающей среде — результаты воздушных испытаний атомного оружия, запрещённых в семи странами в 1980-х годах. Более точечные участки загрязнения кюрием — наглядное свидетельство внештатных ситуаций на заводах по производству ядерного оружия или проблем при его хранении/транспортировке. Опасность кюрия в том, что он концентрируется в костном мозге и, благодаря высокой активности α-излучения может стать причиной онкологических заболеваний.
97. Берклий
Элемент № 97 Периодической системы — берклий, один из двух элементов, названный в честь городов, известных благодаря своим университетам (второй, элемент № 110 — дармштадтий, но о нем речь пойдет позже). Берклий назван в честь города Беркли, в котором расположен один из Университетов Калифорнии. Университет, который часто называют просто «Университет Беркли» (в нем Глен Сиборг прошел путь от постдока до ректора) стал для города, как это говорится сейчас, градообразующим предприятием, и история города немыслима без истории университета. Город же, где он расположен, был назван в честь ирландского философа епископа Джорджа Беркли. Университет Калифорнии в Беркли принял первых студентов в 1869, — именно в том году, в котором Менделеев впервые сформулировал Периодический закон.
Берклий был получен в 1949 году в Национальной лаборатории имени Лоуренса Гленом Сиборгом, Стэном Томсоном и Альбертом Гиорсо. Пять лет, которые прошли между синтезом кюрия и последовавшим за ним синтезом берклия были, если так можно сказать, потрачены учеными на получение достаточных количеств америция — первый образец берклия был получен с помощью бомбардировки мишени из 241Am α-частицами. Период полураспада первых ядер берклия — 243Bk, составлял четыре с половиной часа, позднее был получен нуклид 249Bk с периодом полураспада 314 дней. Название, которое Сиборг с коллегами дал элементу № 97, продолжало взятый им курс на синхронизацию повода для названий лантаноида и аналогичного ему актиноида: — европий-америций, гадолиний-кюрий. Элемент № 65, до определённой степени аналогом которого является берклий — тербий, назван в честь Иттербю, города, в руде, обнаруженный рядом с которым, были найдены почти все редкоземельные элементы, ну а берклий назвали в честь славного своим университетом города Беркли, где элемент № 97 впервые увидел свет.
С помощью метода рентгеновской дифракции были изучены такие соединения берклия, как его диоксид (BkO2), трифторид (BkF3) и оксихлорид (BkOCl). В своих соединениях берклий принимает степень окисления +3 и +4 (тербий ведёт себя точно также) Легкость образования соединений со степенью окисления +4 позволила легко отделить соединения берклия от соединений других актиноидов, это было проще, чем разделение америция и кюрия. В 1962 году было получено такое количество берклия, которое при хорошем зрении можно было наблюдать невооружённым глазом — 3 микрограмма, из которого и был получен чистый металлический берклий, который, впрочем, ожидаемо, выглядел как обычный металл серебристо-серого цвета.
Как и другие актиноиды, берклий и хемотоксичен, и опасен за счет излучения. Этот элемент не нашёл себе областей применения кроме исключительно исследовательских целей. Однако, синтез берклия был важным шагом на пути к созданию других сверхтяжелых элементов, позволил разработать новые теории в ядерной физике, ну и еще раз подтвердил высокую предсказательную способность Периодического закона.
98. Калифорний
Хотя вполне логично предположить, что элемент, полученный в Университете Калифорнии в Беркли назван калифорнием в честь штата, в котором он был впервые получен, надо сказать, что для Глена Сиборга и его коллег придумать имя этому элементу оказалось непростым делом — Сиборг пытался играть в «химический кроссворд» и подбирал названия синтезированным актиноидам так, чтобы название актиноида смысловой нагрузке, вложенный в название его аналога-лантаноида: европий-америций, гадолиний-кюрий, тербий-берклий.
Однако, в 1950 году, когда дело дошло до того, чтобы дать название элементу № 98, система дала сбой. Эквивалентом будущего калифорния среди лантаноидов был диспрозий, получивший название благодаря сложности в получении и выделении: «диспрозитос» — трудно найти. Сиборг с коллегами решили исходить от слова «получить», и попытались рассмотреть все варианты, связанные с получением. Предлагались варианты «циклотроний», циклоний» — по названию устройства, в котором был получен элемент № 98, радлабиум — уже по названию подразделения Университета Калифорнии в Беркли, в котором был осуществлен синтез (радиационная лаборатория). В конечном итоге произошёл интересны разворот мысли — Сиборг напомнил, что за столетие до получения элемента № 98 людьми, занимавшимися поисками другого химического элемента было трудно найти безопасный путь до Калифорнии (имелась в виду калифорнийская золотая лихорадка 1848–50 годов), и элемент назвали калифорнием.
Первый нуклид калифорния, который был синтезирован — 245Cf, его период полураспада составлял всего 44 минуты, для получения этого нуклида мишень из кюрия облучали α-частицами в циклотроне — одном из первых типов ускорителей частиц. Циклотроны используются и в наше время, но уже не для решения научных задач, а для получения радиоизотопов, применяющихся в ядерной медицине — радиодиагностике и радиотерапии. В циклотроне частица, которая движется в постоянном магнитном поле, ускоряется переменным высокочастотным электрическим полем, которое заставляет частицу двигаться в круговой камере циклотрона по спирали до столкновения с мишенью. В эксперименте Сиборга столкновение α-частицы с кюриевой мишенью давало атом калифорния и нейтрон.
Калифорний образует около двадцати изотопов (большая часть распадается за минуты и менее), самый устойчивый из которых 250Cf, его период полураспада 898 лет. Эту разновидность калифорния получают, бомбардируя берклий 249Bk нейтронами — образующийся при этом 250Bk испускает β-частицу и превращается в калифорний. Хотя на Земле калифорний можно получить только с помощью «трансмутации XX века» — ядерных реакций, следы этого элемента наблюдаются в космосе как один из множества продуктов, образующихся в результате взрывов сверхновых.
Калифорний является отличным эмиттером нейтронов, что позволяет использовать его для запуска ядерных реакторов, в которых поток нейтронов начинает распад ядерного горючего. Какое-то время предполагалось, что калифорний может стать материалом для ядерного оружия — для 251Cf критическая масса (минимальная масса, при которой начинается цепная ядерная реакция, приводящая к взрыву) составляет пять килограмм, что вдвое меньше критической массы плутония. К счастью, сложности и высокая стоимость получения калифорния избавили нас от перспективы появления ещё и такого оружия массового поражения — цена 1 грамма 252Cf составляет около 250 миллионов долларов, ежегодно получают 20–40 микрограммов, а общий мировой запас этого металла не превышает 8 граммов.
Помимо «зажигательной свечи» для ядерного реактора небольшие количества калифорния применяются в устройствах, в которых нужен поток нейтронов, из которых наиболее известны датчики для разведывания нефтяных месторождений. Эти детекторы направляют поток нейтронов в исследуемый материал, в котором ядра водорода, безусловно присутствующие в составе углеводородов нефти, замедляют поток нейтронов, то есть позволяют искать молекулы, содержащие водород, в подземных резервуарах. Нейтроны, испускаемые калифорнием, также позволяют искать серебро и золото. Метод, применяющийся для поиска этих металлов, называется нейтронно-активационный анализ — область, в которой идет геологическая разведка, облучают нейтронами и расшифровывают картину γ-излучения, выделяющегося в результате взаимодействия образца с нейтронами — характер ответного излучения индивидуален для каждого металла.
99. Эйнштейний
С первого взгляда, нет ничего странного в том, что элемент № 99 называется эйнштейнием, в конце концов — Эйнштейн самый известный физик XX века, причем настолько, что его формулу — Е=mс2 на зачёте по концепциям современного естествознания могут написать даже те студенты гуманитарных специальностей, которые не ходили на лекции и семинары (ну или почти все — в этом году так я действительно повстречал чудо-студента, который на смог ответить на вопрос: «Скажите, кто составил таблицу Менделеева?»). Тем не менее, слава — не единственная причина попасть в клуб «людей и элементов». Есть химические элементы, названные в честь Бора, Флёрова, Резерфорда, Кюри, Сиборга и Оганесяна (в честь двух последних элементы назвали прижизненно), но в Периодической системе нет Ньютона, Дарвина, Бутлерова, Фейнмана или Дирака.
Ключ к тому, почему в Периодической системе появилось имя Эйнштейна, лежит в том, что практически все учёные, именами которых названы химические элементы (кроме разве что одного, но об этом позже) сыграли важную роль в изучении строения атомов. Мы часто вспоминаем Эйнштейна как автора специальной и общей теорий относительности (которые у многих почему-то сливаются воедино), забывая о том, что работы Эйнштейна заложили основы квантовой теории, без которой сложно представить, как современные представления о строении атома, так и теорию химической связи.
По правде говоря, про химический элемент, названный в честь Эйнштейна, нельзя сказать, что он также знаменит, как и его «крёстный» — это один из актиноидов, как и все актиноиды не имеющий стабильных изотопов, самый стабильный из которых — 252Es, характеризуется периодом полураспада в 472 дня, а наиболее просто получающийся — 253Es, периодом полураспада в 20 дней. Тех небольших количеств эйнштейния, которые удалось получить, хватило, чтобы понять, что эйнштейний, как и другие актиноиды, представляет собой серебристо-белый металл.
Можно сказать, что обстоятельства открытия эйнштейния необычны даже по сравнению с другими трансурановыми элементами — рождение эйнштейния подстегнула гонка вооружений. После того, как 29 августа 1949 года на полигоне в Семипалатинске была испытана первая советская атомная бомба, в США поняли, что они лишились своего козыря в противостоянии с СССР и решили разработать еще более мощное оружие. Новая, как тогда это называлось в официальных документах «супербомба» имела следующую принципиальную схему — запал в виде атомной бомбы должен был создать температуру и давление, достаточные, чтобы инициировать протекающее с выделением колоссальной энергии слияние атомов дейтерия (тяжелого водорода), такое же слияние дейтерия с образованием гелия происходит в звездах, в том числе и звезде по имени Солнце. «Супербомба» или как потом её стали называть, водородная бомба уже относится не к ядерному, а к термоядерному оружию. Испытание первого образца этого оружия США провели на атолле Эниветок в южной части Тихого океана. Сомнительная эстетика награждать бомбы именами собственными — Троица, Малыш, Толстяк, была выдержана и здесь. Благодаря вытянутой цилиндрической форме устройство получило название «Сосиска».
США испытали Сосиску 1 ноября 1952 года, мощность взрыва составила 10 мегатонн в тротиловом эквиваленте — в пятьсот раз больше мощности бомбы, сброшенной на Нагасаки. Островок атолла, на котором проводились испытания, был полностью уничтожен. Следует отметить, что на Эниветоке США испытало не водородную бомбу, а термоядерное устройство, показав принципиальную возможность создания оружия такого типа — Сосиска весила 74 тонны, её высота была чуть больше шести метров, то есть на роль бомбы устройство никак не тянуло. Первая же в мире водородная бомба — компактная и легкая настолько, что её можно было бы доставить к цели с помощью ракеты или стратегического бомбардировщика, была испытана менее, чем через год после взрыва Сосиски — 12 августа 1953 года на Семипалатинском полигоне в СССР.
Взрыв на Эниветоке был такой мощности, что породил новый элемент. Как это стало известно? Дело в том, что испытания не ограничивались интересом «взорвется или нет» — тонны материалов, отобранных с места выпадения радиоактивных осадков во время испытания, были отправлены в радиационную лабораторию Беркли. Там среди сгоревших кораллов и пепла Альберт Гиорсо обнаружил атомы элемента с номером 99, который в апреле 1955 года получил название «эйнштейний» (первоначально для обозначения эйнштейния использовался символ «Е», к привычному сейчас символу «Es» перешли в 1960-е годы). Создание и испытания Сосиски были засекречены, и об открытии нового элемента сообщили только спустя три года. В августе 1955 года в журнале Physical Review была опубликована статья об открытии элемента № 99, в которой его предлагали назвать эйнштейнием (Phys. Rev. 1955. 99 (3): 1048–1049).
Как же образовался эйнштейний? Во время взрыва некоторые атомы урана из атомной бомбы-запала смогли поглотить колоссальное количество нейтронов, превратившись на долю мгновения в сверхтяжёлые изотопы урана, которые претерпевали β-распад, в результате чего (если упрощать) «лишние» нейтроны превращались в пары протон-электрон, и порядковый номер элемента увеличивался. Энергия и плотность потока нейтронов во время испытания были столь значительны, что некоторые атомы урана с номером 92 превратились в атомы с номерами 99 и 100. При испытаниях образовался эйнштейний 253Es.
К счастью сейчас, если есть необходимость в эйнштейнии (а такая необходимость может возникнуть, так как этот элемент — хорошая мишень для получения ещё более тяжёлых атомных ядер), нет необходимости взрывать термоядерные боеприпасы. Современный способ получения эйнштейния заключается либо в длительной (продолжающейся несколько лет) бомбардировке плутония нейтронами, либо в бомбардировке урана ядрами азота или кислорода. Сам по себе эйнштейний представляет собой серебристо-белый металл, достаточно летучий и с умеренной для столь тяжёлого элемента температурой плавления — 860 °C. В своих соединениях эйнштейний проявляет степень окисления +2 и +3, известны и изучены такие соединения элемента № 99, как Es2O3, EsCl3, EsOCl и EsBr2.
100. Фермий
Круглые даты и числа всегда привлекали внимание людей, возможно из-за того, что благодаря нашим пятипалым рукам наши далекие предки выбрали десятеричную систему счисления. Заметим, что круглых дат опасались не только в Средние века, ожидая конца времен вот каждого года, кончавшегося двумя нулями — если кто ещё помнит, в 1998–99 годах ходили слухи о так называемой «проблеме 2000», которая идеологически была близка средневековым страданиям в ожидании скорого конца. Тем не менее, заселение электронов по уровням, и, следовательно, Периодический закон и Периодическая система индифферентны к числам, кратным десяти, благодаря чему элемент с номером 100 нельзя назвать каким-то особенным.
Фермий, как и стоящий на одну клеточку раньше эйнштейний, был впервые обнаружен в радиоактивных осадках, образовавшихся в результате испытания первого термоядерного устройства. Собственно, в статье, вышедшей спустя три года после испытания, на двух страницах сообщалось о двух элементах (Phys. Rev. 1955. 99 (3): 1048–1049). Причина образования фермия была такая же, как и эйнштейния — уран, входивший в состав атомной бомбы-запала поглощал большое количество нейтронов, и образующиеся при этом ядра за счет β-распада увеличивали число протонов, а значит — порядковый номер.
Исследователи, обнаружившие элемент № 100, предложили назвать его фермием в честь Энрико Ферми, итальянского физика, получившего в 1938 году Нобелевскую премию по физике 1938 года «…за доказательство существования новых радиоактивных элементов, полученных при облучении нейтронами, и связанное с этим открытие ядерных реакций, вызываемых медленными нейтронами…» и почти что же сразу после церемонии отправившегося со всей семьей из Стокгольма в эмиграцию США (в Италию Ферми не стал возвращаться из-за несогласия с политикой Муссолини), где построил первый ядерный реактор, в котором протекала самоподдерживаемая ядерная реакция (все работы Ферми в Штатах с 1939 по 1945 год прямо или косвенно были посвящены созданию ядерного оружия).
Благодаря магии чисел фермий чуть было не назвали «центурием» — сотым. В 1953 году исследователи из Нобелевского Института в Стокгольме получили фермий 250Fm, бомбардируя уран ядрами кислорода. Поскольку открытие элемента № 100 американскими учеными было сделано в рамках работы над созданием нового оружия, то информация о нём была засекречена, но как только шведские физики выступили с заявлением об открытии элемента с номером сто, информацию о термоядерном устройстве (точнее о последствиях испытания этого устройства) быстро рассекретили. То, что чуть позже команда Беркли не возражала против того, чтобы по инициативе шведских физиков назвать элемент № 102 «нобелием», даже после того, как их заявление о синтезе элемента 102 не воспроизвелось и было признано ошибочным. Возможно, такой ход должен был слегка подсластить пилюлю шведам, у которых элемент № 100 увели из-под носа.
Фермий очередной актиноид, самое главное значение которого, пожалуй, в том, что после него начинается настоящая кунсткамера искусственно синтезированных элементов — элементы с порядковым номером 101 и выше называют «трансфермиевыми». Кроме этого, фермий можно считать последним химическим элементом, для которого (хотя бы теоретически) можно предложить практическое применение.
Речь пока идет еще только о потенциальном применении — 250Fm интенсивно испускает α-лучи, а период его полураспада около 20 часов. Такое сочетание очень привлекательно для радиотерапии — источник радиации подвергает интенсивному облучению опухоль, после чего быстро распадается, однако препятствием на пути применения сотого элемента в медицине лежит, как это бывает и с другими металлами, отсутствие быстрых методов «прививки» радиоактивного металла к органическому фрагменту, который поможет распознать опухолевые клетки и доставит средство борьбы с ними по адресу.
101. Менделеевий
В 1932 году Альберт Эйнштейн посетил Калифорнийский университет в Лос-Анжелесе, где прочёл речь перед студентами, в которой, в частности было сказано: «Наука как нечто существующее и полное является наиболее объективным и внеличным из всего, что известно человеку». Одним из его слушателей был выполнявший свою дипломную работу ещё в области «чистой химии» Глен Сиборг. Эйнштейн, будучи знакомым с одним из профессоров, обучавших Сиборга, нашел время встретиться и переговорить с подающим надежды молодым человеком, и Сиборг, позднее ставший как и Эйнштейн лауреатом Нобелевской Премии, позднее писал, что был приятно поражен добротой и скромностью великого учёного по отношению к никому пока еще не известному студенту. Отношение Эйнштейна к вопросам войны и мира также позволило Сиборгу сформулировать собственное отношение к этим вопросам. Хотя десять лет спустя после встречи Глен Сиборг со своей группой играл одну из ключевых ролей в Манхэттенском проекте, помогая разделять уран и плутоний, он неоднократно заявлял о своём пацифизме и утверждал, что ядерная энергия должна применяться только в мирных целях.
Встреча с Альбертом Эйнштейном очень сильно повлияла и на научные предпочтения, да и на судьбу Сиборга — он заинтересовался физикой и после того, как в 1933 году получил степень бакалавра, остался в Университете Калифорнии ещё на один год, чтобы прослушать ряд курсов по физике, которые не посещал, обучаясь на химическом отделении университета. В Калифорнийском университете Лос-Анжелеса не было возможности выполнять исследования в области физической химии, он поступил в магистратуру Калифорнийского университета Беркли, начав работу с профессором физической химии Гилбертом Ньютоном Льюисом (его, вероятно, многие могут помнить по правилу устойчивости восьмиэлектронных оболочек «октетов Льюиса») и тоже молодым, но подающим надежды специалистом в ядерной физике Эрнестом Орландо Лоуренсом, который в начале 1930-х годов изобрёл циклотрон, за что в 1939 году стал лауреатом Нобелевской премии по физике. Сначала Сиборг занимался с Льюисом химией кислот и оснований, но постепенно отходил от «классической» химии всё дальше и дальше. В 1937 году Сиборг защитил диссертацию на тему: «Взаимодействие быстрых нейтронов со свинцом», и далее занимался уже исключительно ядерной химией, отцом-основателем которой он и считается.
Связь Сиборга и Эйнштейна можно назвать даже в определённой степени мистической — в день смерти Альберта Эйнштейна, 18 апреля 1955 года журнал American Physical Society получил рукопись статьи Сиборга, Альберта Гиорсо и их коллег, в которой сообщалось об открытии нового радиоактивного элемента № 101, который Сиборг предложил назвать в честь Д. И. Менделеева — менделевий (Physical Review., 1955, 98 (5): 1518–1519). Самым устойчивым из изотопов менделевия является атом с массой 258 — его период полураспада составляет чуть больше 51 суток. Химические свойства менделевия изучены только для его соединений в растворе. Доподлинно известно, что он может образовывать соединения со степенью окисления +3 или +2.
Менделевий был не первым элементом, полученным Сиборгом и не самым важным его открытием (скажем так, что патент на способ получения элемента № 95 — америция, принёс Сиборгу очень большие деньги благодаря применению америция в датчиках задымления), но элемент № 101 все равно оказался первым в своём роде — первым из трансфермиевых элементов, элементов с порядковым номером большим, чем 100.
Менделевий был получен на установке, которая называлась просто «60-дюймовый циклотрон», она была спроектирована Эрнестом Орландо Лоуренсом и в 1939 году начала работать. Когда в 1962 году благодаря появлению других, более мощных ускорителей частиц, 60-дюймовый циклотрон был «отправлен на пенсию», в торжественной речи, посвященной этому событию кто-то назвал его «… самым эффективным расщепителем атомов в истории…». Чтобы получить менделевий Сиборг и Гиорсо бомбардировали мишень из эйнштейния α-частицами (следует уточнить — в статье для элемента 101 название «менделевий» предлагалось сразу, а вот эйнштейний ещё не получил официального названия, поэтому в тексте статьи упоминался только как «элемент № 99»). Первоначально исследователи получили только 17 атомов менделевия, позднее он был получен в несколько больших количествах — достаточных для изучения его химических свойств, но всё же слишком маленьких для того, чтобы этот элемент мог найти практическое применение.
В статье в Physical Review, посвящённой открытию первого трансфермиевого элемента, Сиборг объяснили свой выбор названия: «Мы хотели бы предложить название менделевий… в знак признания пионерской роли великого русского химика Дмитрия Менделеева, который первым использовал периодическую систему элементов для предсказания химических свойств неоткрытых элементов». Следует отметить, что для решения назвать новый элемент именем русского ученого от Сиборга и Гиорсо требовалось мужество и гражданская позиция — хотя пик периода политической реакции направленного против левых, либеральных и коммунистических деятелей и организаций, получившего в США название эпохи маккартизма, приходился на 1950–54 годы, отдельные этапы «охоты на ведьм», антикоммунистические и антирусские настроения продолжались до 1957 года, однако, авторитет Менделеева и Сиборга был столь велик, что никаких дискуссий о названии элемента № 101 не было.
102. Нобелий
Если с менделевием дискуссий о названии не возникало, то следующему за ним трансфермиевому элементу так не повезло — около тридцати лет этот элемент был известен под двумя различными именами и окончательно стал нобелием только в 1997 году. Кроме этого временного «двуличия», вызванного вполне объяснимым отсутствием обменом информации физиков-ядерщиков в эпоху Железного занавеса и Холодной войны, нобелий, пожалуй, единственный искусственно полученный химический элемент, названный не в честь места, где его синтезировали и не в честь ученого, хотя, конечно, в честь человека, оказавшего влияние на развитие науки в XX и XXI веке — в честь Альфреда Бернхарда Нобеля.
С определённой натяжкой, конечно, можно назвать Нобеля химиком, но всё же его открытие, хотя и повлияло на развитие технологии и военного дела девятнадцатого века, вряд ли можно считать достойным для попадания в Периодическую систему — элементов, названных в честь изобретателей кордита, нитроцеллюлозы и тринитротолуола нет. Альфред Нобель родился в Стокгольме в 1833 году в семье инженера, с 1842 по 1849 года он получал образование в Санкт-Петербурге, где его отец успешно вёл дела по станкостроению и производству взрывчатых веществ. В 1849 году Нобель-старший по совету Николая Николаевича Зинина отправил Альфреда учиться в Европу. В Париже Альфред Нобель познакомился с синтезировавшем в 1847 году нитроглицерин Асканио Собреро и потратил годы на поиски способа стабилизации нитроглицерина и возможности его практического применения. В конечном итоге, главное изобретение Нобеля, принёсшее ему известность и деньги — динамит, было запатентовано в 1867 году, и новая взрывчатка стала активно применяться в горном деле. Далее история известна — к счастью для мировой науки Альфреду Нобелю удалось прочитать свой некролог (репортеры спутали его с действительно скончавшемся братом Людвигом). И, чтобы не остаться в людской памяти миллионером на крови», «торговцем взрывчатой смертью» и «динамитным королём», он (вероятно к удивлению семьи) указал в завещании, что большая часть его состояния — около 31 миллиона шведских марок, должна была пойти на учреждение премий за достижения в физике, химии, медицине, литературе и за деятельность по укреплению мира.
Тем не менее, считать, что нобелий назван в честь Нобелевских премий, в корне неверно. По правде говоря, элемент № 102 вообще не должен был носить название «нобелий». Впервые он был получен в 1956 году в Объединённом Институте ядерных исследований (ОИЯИ) в Дубне группой академика АН СССР Георгия Николаевича Флёрова с помощью бомбардировки урана 238U ядрами неона. Советские физики-ядерщики назвали элемент «жолиотий» (Jl) в честь умершей в марте 1956 года Ирен Жолио Кюри — дочери Пьера и Мари Кюри и лауреата Нобелевской премии по химии 1935 года, вручённой «…за выполненный синтез новых радиоактивных элементов…». Увы, сообщение советской исследовательской группы о синтезе элемента № 102 было просто проигнорировано научной общественностью во всём мире. Только в 1997 ИЮПАК официально признал приоритет ОИЯИ в синтезе элемента № 102, утвердив при этом название нобелий.
Спустя два года после получения в Дубне жолиотия нобелий был получен на линейном ускорителе тяжёлых ионов в Университете Калифорнии Беркли в группе Альберта Гиорсо и Глена Сиборга. Исследователи из Калифорнии выбрали другую стратегию синтеза — бомбардировку кюрия ядрами углерода 12С. Причинам не верить в синтез элемента № 102 получившим уже около десятка трансурановых элементов Гиорсо и Сиборгу (последний в 1951 году уже успел стать Нобелевским лауреатом) у международной учёной общественности не было, однако не Гиорсо с Сиборгом назвали элемент нобелием — элемент № 102 был известен под этим названием около года.
Дело в том, что в 1957 году ученые Нобелевского института физики в Стокгольме тоже сообщили о синтезе элемента № 102 с периодом полураспада в десяток минут. Шведские физики-ядерщики пошли фактически тем же путём, что год прошли Сиборг с Гиорсо — бомбардировку кюрия ядрами углерода 13С. Неудивительно, что шведы хотели назвать элемент в честь своего института — нобелием, однако что-то пошло не так, и эксперимент шведов не только ни разу не был воспроизведён, но и нуклид элемента № 102, о получении которого они заявили, до сих пор не был синтезирован ни одной из исследовательских групп. Тем не менее, Сиборг с Гиорсо оставили название «нобелий». Как уже было написано выше, это был своеобразный способ уважить шведов, которые действительно получили элемент № 100, о котором исследователи из Беркли молчали несколько лет по соображениям секретности, поскольку обнаружили его как побочный эффект испытания термоядерного боеприпаса. И, хотя де-факто элемент № 102 назван нобелием в честь института, где он на самом деле не был получен, у большей части людей его название ассоциируется с Альфрадом Нобелем, точнее нобелевскими премиями. Возможно, оно и к лучшему, так как по мне название «жолиотий» менее яркое, чем «нобелий».
Хотя к настоящему времени получено около десятка изотопов нобелия, о нём, как и о многих других короткоживущих искусственно синтезированных элементах, известно мало. Теоретически, он должен представлять собой металл с серебристым блеском, но он никогда не был получен в количестве, достаточном для проверки или опровержения этого предсказания. Известно, что в растворе он проявляет степени окисления +2 и +3, причём +2 несколько более устойчива. Измеренное значение стандартного электродного потенциала нобелия (+2.61 В) позволяет говорить, что в свободном виде этот элемент должен проявлять активность, сравнимую с активностью натрия. Как и всем трансфермиевым элементам, нобелию не найдено практическое применение, и вряд ли когда он будет применяться.
103. Лоуренсий
С названием элемента № 103 возникала коллизия не только о названии — до сих пор химики дискутируют о том, где конкретно в Периодической системе он должен располагаться. Формально лоуренсий замыкает ряд актиноидов. Этот элемент был впервые синтезирован 14 февраля 1961 года в Радиационной лаборатории им. Лоуренса при Калифорнийском университете исследовательской группой Альберта Гиорсо — исследователи бомбардировали мишень из трех миллиграмм изотопной смеси кюрия ядрами бора 10B и 11B. Американские ядерные химики предложили название лоуренсий (Lr) в честь изобретателя циклотрона и лауреата Нобелевской премии по физике Эрнестом Орландо Лоуренса.
В 1965 году в ходе независимых исследований советские физики из ОИЯИ в Дубне под руководством Флёрова получили другие изотопы элемента № 103, бомбардируя мишень из америция ядрами кислорода 18О. Учёные из Дубны предложили назвать его резерфордием (Rf) в честь Эрнста Резерфорда, лауреата Нобелевской премии по химии, отца ядерной физики (до 1997 года элементы 102–106 по-разному назывались и по-разному обозначались в Периодических системах разных стран, и по виду Периодической системы можно было определить, на какую из стран — США или СССР ориентируется в политике и экономике то или иное государство). В конечном итоге решением ИЮПАК от 1992 года приоритет в синтезе элемента № 103 и право названия элемента было отдано команде из Беркли.
Начиная с 1969 года химические свойства лоуренсия начали активно изучаться (активно настолько, насколько это позволяло малые количества элемента). Оказалось, что в газовой фазе элемент образует хлорид LrCl3, в водных растворах также стремится принять степень окисления +3. Казалось бы, такого рода эксперименты должны однозначно определить место лоуренсия в Периодической системе, но не тут-то было.
Как это не удивительно, до настоящего времени химики и физики не пришли к единому мнению о том, какое положение должно быть у начинающего ряд лантаноидов лантана (La) и завершающего этот ряд лютеция (Lu), а также начального и конечного элементов в ряду актиноидов — актиния (Ac) и лоуренсия (Lr) соответственно. Теоретические исследования, проводимые разными группами специалистов по квантовой химии, различаются результатами. По одним данным у всех четырех элементов заполняется f-электронный подуровень, то есть их нужно отнести к f-элементам. Другие версии столь же убедительно позволяют считать их d— или p-элементами.
Казалось бы, в чем проблема? Расставлять электроны по ячейкам и изображать электронную конфигурацию элемента учат на уроках химии в школе. Однако правило Клечковского — эмпирическое правило, описывающее энергетическое распределение электронных подуровней в многоэлектронных атомах, без проблем выполняется для только для относительно легких химических элементов. Механически же использовать его для предсказания электронной конфигурации лантаноидов и актиноидов, как, впрочем, и других элементов, начиная с шестого ряда Периодической системы, затруднительно. Дело в том, что увеличение заряда ядра заставляет электроны атома двигаться быстрее, а это, в соответствии с законами специальной теории относительности, увеличивает их массу, что в итоге влияет на распределение электронов по уровням и подуровням. Это — релятивистский эффект в квантовой химии, и не принимать его во внимание при моделировании электронного распределения лантаноидов и актиноидов невозможно.
В 1982 году Уильям Йенсен с помощью квантовохимических методов без релятивистских поправок рассчитал, что у лютеция нет свободных f-орбиталей. Используя полученную с помощью своих расчетов информацию об электронной плотности, а также на основании периодических изменений атомного радиуса, температуры плавления и электроотрицательности, он предложил поместить этот элемент в третью группу в клетку, расположенную под скандием и иттрием. Он же предлагал разместить лоуренсий под лютецием, опираясь, правда, уже не на электронное строение, а на близость свойств лютеция и лоуренсия (J. Chem. Educ., 1982, 59 (8), p 634). По версии Йенсена, блоки f-элементов должны были содержать по 14 элементов и содержать элементы от лантана до иттербия и от актиния до нобелия.
Проведенные примерно в то же время расчеты, в которых релятивистский эффект учитывался, определили, что у атома лоуренсия заполняется р-электронный подуровень, и его внешний электронный слой на самом деле устроен так: 5f147s27p1, а не так: 5f146d17s2 (J. Phys. France. 1980. 41, 943–946). Эти расчеты позволили говорить о том, что атомы лютеция и лоуренсия, у которых нет электронов на d-орбиталях, не должны находиться, как это предполагал, Йенсен, среди d-элементов — элементов, у которых заполняются d-электронные подуровни. Исходя из этих рассуждений, правильные ряды, каждый из которых содержит по четырнадцать лантаноидов или актиноидов, должны выглядеть так: церий — лютеций и торий — лоуренсий (J. Chem. Educ., 2009, 86 (10), p 1187).
В 2016 году финский химик-расчётчик Пекка Пююккё с помощью релятивистской квантовой химии предложил свою интерпретацию реакционных свойств лютеция и лоуренсия, определив, что они практически идентичны между собой, но при этом отличаются от свойств других элементов третьей группы, в которую планировали разместить эти элементы Йенсен и его последователи. Пююкке предложил расширить списки лантаноидов и актиноидов до 15 элементов от La до Lu и от Ac до Lr (Phys. Chem. Chem. Phys., 2016,18, 17351-17355), включив туда все элементы с конфигурацией внешнего уровня от f0 до f14, и это предложение было принято ИЮПАК, который 28 декабря 2016 года официально принял версию Периодической системы с рядами, содержащими по пятнадцать f-элементов.
Однако, это решение устроило далеко не всех химиков-теоретиков, многие из которых заявляли, что элемент с электронной конфигурацией внешнего слоя f0, то есть не содержащий электронов на f-подуровне, не может относиться к f-элементам. Таким образом, вопрос о положении лантана, лютеция, актиния и лоуренсия в Периодической системе обсуждается до сих пор, и моделирование электронной конфигурации и свойств этих элементов продолжается с привлечением разных моделей квантовохимических расчетов. К сожалению, разные допущения, которые неизбежны при применении отличающихся друг от друга расчетных методов могут значительно влиять на их результаты и объяснения, базирующиеся на этих результатах, поэтому поиск идеальной квантовохимической модели, описывающей поведение и положение лантаноидов и актиноидов в Периодической системе, продолжается до сих пор (Physical Chemistry Chemical Physics. 2018. DOI: 10.1039/c8cp01056k).
104. Резерфордий
В 1960-е годы дискуссии о положении элемента № 103 в Периодической системе ещё не велись, методы квантовой химии стали применяться к объектам, содержащим такое большое количество электронов, позже, поэтому в то время лоуренсий-резерфордий (в номенклатуре США и СССР) соответственно однозначно был последним из актиноидов, завершая очередной блок Периодической системы. Конечно же, и у советских, и у американских специалистов по трансфермиевым элементам тут же возникло желание смело идти туда, где не ступала нога человека, и началась гонка за элементом № 104 — соперничество СССР и США шло по всем направлениям. Методология обеих групп была одинаковой — мишени из тяжёлых (зачастую не просто тяжелых и радиоактивных, но и короткоживущих атомов) обстреливали ионами или ядрами более лёгких атомов. Легкие «ядерные пули» нужно было направлять в мишень с такой энергией, чтобы они смогли преодолеть возникающие между ядрами силы электростатического отталкивания и сблизиться настолько, чтобы «заработали» ультракороткодействующие сильные внутриядерные взаимодействия, и два ядра слились бы в одно, более тяжёлое. При одинаковой методологии советских и американских физиков мишени и ядра, летящие в них, различались.
Впервые элемент № 104 был синтезирован в 1964 году учёными ОИЯИ под руководством академика Флёрова. В качестве мишени дубнинские ученые выбрали плутоний 242Pu, который бомбардировали ядрами неона 22Ne. Продукты слияния ядер немедленно хлорировали и хлориды направляли к детекторам. Новый элемент был получен, хотя самые первые эксперименты не позволяли определить, ни массу полученных ядер элемента № 104, ни период его полураспада.
Три года спустя исследователи из Национальной лаборатории имени Лоуренса в Беркли, не будучи в состоянии воспроизвести эксперимент советских коллег-конкурентов поставили свой эксперимент — они бомбардировали ядра калифорния 249Cf ядрами углерода 12С, и были уверены, что получили элемент № 104 с атомной массой 257, который при α-распаде превращался в нобелий 253No, эти результаты были подтверждены в 1973 году другой американской группой. Элемент № 104 также был получен в 1985 году физиками из Дармштадта, облучавшими более лёгкую мишень более тяжёлыми «снарядами» — на фольгу из свинца 208Pb направляли ядра титана 50Ti.
Так как какое-то время обе группы были на 100 % уверены в своём первенстве, каждая из них назвала элемент по-своему — американские физики выбрали название «резерфордий» (Rf) в честь Эрнеста Резерфорда, советские — «курчатовий» (Ku) — в честь Игоря Васильевича Курчатова, советского физика, «отца» советской атомной бомбы, создателя первой в мире атомной электростанции (Обнинская АЭС, запуск 26 июня 1954 года), трижды Героя Социалистического Труда и академика АН СССР.
В 1992 году рабочая группа ИЮПАК по трансфермиевым элементам оценила заявки об открытии элемента 104 из Дубны и Беркли, сделав, в результате, вывод, о том, что обе группы привели достаточные доказательства его синтеза и честь открытия должна быть разделена между ними. Физики из США обиделись и ответили на выводы комиссии, что она придаёт слишком большое значение результатам группы Объединённого института ядерных исследований. В частности, они указали, что за 20 лет советские учёные несколько раз изменяли детали их заявлений о свойствах резерфордия, что, впрочем, наши физики-ядерщики и не отрицали. В ИЮПАК ответили, что это не имеет значения и что они учли все возражения, приведённые американской группой, и заявили, что не находят причин для пересмотра их заключения о приоритете открытия. В конце концов, дискуссия была завершена только в 1997 году, когда ИЮПАК рекомендовал использовать название, предложенное американцами.
Несколько изотопов резерфордия характеризуются периодами полураспада порядка несколько секунд, что позволяет исследовать их химические свойства до разрушения. Периоды полураспада 261Rf, 263Rf и 267Rf составляют минуту, 10 и 30 минут соответственно, но эксперименты обычно проводят с 261Rf — этот нуклид, хоть и отличается небольшим временем жизни, его проще получить. Резерфордий является тем трансфермиевым элементом, о химических свойствах которого еще можно рассуждать (да, в химической литературе можно найти информацию о химических свойствах и более тяжелых элементов, полученную с помощью обобщения и расширения экспериментов, проведенных для десятков или даже единиц атомов, но насколько точно можно переносить полученную таким образом информацию на процессы, в которых участвует количество частиц, превышающее миллиарды — именно с этого момента можно говорить о статистической значимости результатов, не совсем понятно).
Для резерфордия известно, что его химические свойства более похожи на свойства циркония и гафния, а не актиноидов, проявляющих в своих соединениях степень окисления +3. Это, в свою очередь, позволяет сделать вывод о том, что резерфордий относиться к той же группе Периодической системы, где находятся Zr и Hf, и его нельзя считать «суперактиноидом». Формула хлорида резерфордия RfCl4, это вещество возгоняется при 220 °C, подобно тетрахлориду циркония, проявляя при этом летучесть большую, чем тетрахлорид гафния и гораздо большую — чем тетрахлориды актиноидов. Все это говорит, что и у самого края известной на настоящий момент Периодической системы правила периодической изменчивости свойств элементов продолжают работать.
105. Дубний
Соперничество групп Георгия Николаевича Флёрова из ОИЯИ и Альберта Гиорсо из Национальной лаборатории имени Лоуренса в Беркли (бывшей Радиационной лаборатории Калифорнийского университета Беркли) продолжалось. Такие были времена — в нашей стране лозунг: «Догоним и перегоним Америку!» — применялся во всем — в космической гонке, в соперничестве на зимних и летних олимпиадах ну и в том, кто быстрее будет продвигаться в заполнении пустых ячеек Периодической системы (я перечислил те примеры соперничества, которые в любом случае двигали человечество вперёд, однако основное соревнование двух сверхдержав называлось «гонка вооружений»).
В апреле 1968 года исследователи из группы Г. Н. Флёрова бомбардировали мишень из америция 243Am ядрами неона 22Ne и заявили, что получили изотопы элемента № 105 с атомными массами 260 (период полураспада 1.5 секунды) и 261 (период полураспада 1.8 секунд). В 1970 году учёные из Дубны представили еще больше данных, подтверждающих свое открытие и предложили назвать элемент нильсборием (Ns) в честь датского физика Нильса Бора, лауреата Нобелевской премии по физике 1922 года «…за заслуги в изучении строения атома…». В 1970 году Гиорсо с коллегами также получил нуклид элемента № 105 с атомной массой 260, используя реакцию калифорния 249Cf с ядрами азота 15N. В своём сообщении американские учёные также сообщили, что элемент № 105 распадается по схеме α-распада, превращаясь в лоуренсий. В группе Беркли назвали новый элемент ганием (На) в честь лауреата Нобелевской премии по химии 1944 года Отто Гана, получившего её за «…за открытие расщепления тяжёлых атомных ядер…». Соавтор Отто Гана, Лиза Мейтнер, теоретически предсказавшая возможность расщепления тяжёлых ядер, даже была не упомянута в сообщении Нобелевского комитета, но об этом речь пойдёт позже. В СССР продолжили изучать нильсборий, в США — ганий, и оказалось, что элемент № 105 по свойствам напоминает ниобий и тантал, являясь представителем d-элементов с заполняющимся шестым уровнем.
В 1986 году ИЮПАК, который уже стали порядком раздражать «трансфермиевые войны» США и СССР вспомнил, наконец, что согласно своему же собственному решению аж от 1947 года первооткрыватели элемента уже не имели исключительного права давать ему название, а лишь могли предложить его комиссии ИЮПАК по номенклатуре неорганических соединений, а эта комиссия могла рекомендовать предложенное название Совету ИЮПАК для окончательного принятия (естественно предварительно рабочая группа ИЮПАК по трансфермиевым элементам должна была установить, кто же был первооткрывателем). Чтобы избежать двойных названий ИЮПАК предложил называть элементы со спорными именами незамысловато — порядковыми числительными на латинском языке. По рекомендациям ИЮПАК с 1986 года элемент № 105 стали называть уннилпентиумом (Unp). Правда, похоже, что эти рекомендации Международный союз по прикладной и теоретической химии больше сделал для очистки совести — всё мои студенческие годы на стенах аудиторий химического факультета Казанского университета (впрочем, также как и Московского, Новосибирского, Нижегородского, Харьковского и Одесского — говорю о тех университетах, в которых в студенческие годы мне удалось побывать лично) № 105 назывался «нильсборием», а в Периодической системе из США, которую в 1987 году привез мой сокурсник — участник Международной олимпиады по химии, он был «ганием». В 1994 году комиссия ИЮПАК решила добавить путаницы и предложила назвать № 105 жолиотием (Jl), но уже не в честь Ирен Жолио-Кори (как это предложил Флёров для № 102), а её мужа, тоже Нобелевского лауреата Фредерика Жюлио-Кюри. Предложение не прошло, но, говорят, что какое-то количество Периодических систем с этим названием и этим символом было напечатано, хотя такую версию таблицы лично я не видел.
В конечном итоге в 1997 году рабочая группа ИЮПАК по трансфермиевым элементам приняла соломоново решение, заявив, что и Беркли, и Дубна внесли «равный существенный вклад» в открытие элементов № 104 и № 105, а, поскольку вклад Национальной лаборатории имени Лоуренса уже был признан за счёт утверждения их названия для элемента № 104 — резерфордия, элемент № 105 следует назвать дубнием (Db), в честь наукограда, в котором расположен Объединённый институт ядерных исследований.
Хотя дубний был получен в количестве нескольких десятков атомов, небольшая информация о его химических свойствах всё же доступна. Предполагается, что в водном растворе дубний проявляет степень окисления +5 — ионы дубния, содержащиеся в водном растворе адсорбируются стеклом, как и ионы ниобия и тантала, но такое поведение не свойственно производным лантаноидов и актиноидов в степени окисления +3 и +4. Результаты расчётов и некоторые экспериментальные свидетельства позволяют говорить о том, что дубний больше похож по свойствам на ниобий, нежели на близко расположенный к нему в Периодической системе тантал, вероятно это, как и для многих других тяжёлых элементов объясняется релятивистскими эффектами — следствием закономерностей специальной теории относительности.
106. Сиборгий
В Периодической системе есть немало элементов, названных в честь ученых, стоявших у основ создания теории строения атома — Эрнст Резерфорд, Мари Кюри, Энрико Ферми, Нильс Бор, но только двум элементам были даны названия при жизни учёных-«крестников». В 1997 году в честь признания заслуг Сиборга его именем был назван элемент № 106 — сиборгий (Sg), и Сиборг прижизненно стал первым из двух «людей и химических элементов». Вторым человеком, в честь которого назвали химический элемент при его жизни, стал наш, российский физик-ядерщик Юрий Цолакович Оганесян, в честь которого в 2016 году назван элемент № 118 — оганессон (Og).
Сиборг прожил яркую и насыщенную жизнь. Сиборг участвовал в разработке ядерного оружия и атомной энергетики, участвовал в открытии (получении) десяти новых химических элементов. Под его руководством было защищено почти семь десятков диссертаций, он был автором или соавтором пятисот научных статей, научным советником десяти Президентов США и даже участвовал в написании школьного учебника по химии и методических рекомендаций к нему для учителей химии, и его коллеги из Университета Калифорнии в Беркли считали его очевидным кандидатом для увековечения в Периодической системе. Случай представился, когда радиохимикам из Беркли удалось доказать свой приоритет в синтезе элемента № 106. Они получили его в 1974 году, бомбардируя мишень из калифорния 249Cf ядрами кислорода 18O. Полученный элемент подвергался двум последовательным α-распадам, превращаясь в 259Rf, а затем — в 255No (Physical Review Letters. — 1974. — Т. 33, № 25. — С. 1490–1493). Одновременно и независимо работавшая в ОИЯИ группа Георгия Николаевича Флерова и Юрия Цолаковича Оганесяна опубликовала сообщение о синтезе элемента № 106 в результате слияния ядер свинца и хрома (Письма в ЖЭТФ. — 1974. — Т. 20, № 8. — С. 580–585). В 1993 году рабочая группа по трансфермиевым элементам ИЮПАК пришла к выводу, что материалы, предоставленные учеными из Беркли в большей степени позволяют говорить о приоритете американской команды.
Как только приоритет в синтезе элемента № 106 был отдан исследователям из Национальной лаборатории имени Лоуренса, они предложили назвать его сиборгием (Sg). ИЮПАК не оценил идею, сказав, что нет такой традиции называть элементы в честь людей прижизненно. Подключившееся к разбирательствам Американское химическое общество сказало, что в правилах ИЮПАК нет официального запрета на то, чтобы называть элементы в честь живых людей, и напомнило, что механизм названия элемента № 100 фермием был запущен ещё при жизни Энрико Ферми. Комиссия по номенклатуре ИЮПАК вняла доводам американцев, и в начале декабря 1997 года закрепило за элементом № 106 название сиборгий, сделав Глену Сиборгу и команде Беркли Рождественский (а может новогодний) подарок.
В канун 1998 года в почтовые службы разных стран мира люди стали приносить поздравительные открытки, в которых вместо почтового адреса стояло четыре пары букв: Sg, Bk, Cf, Am. Возможно, часть этих открыток затерялась, но большая их часть всё же была исправно доставлена — таким образом люди, знакомые с химией, поздравляли Сиборга с тем, что он прижизненно «прописался» в Периодической системе. Адрес расшифровывался так: Сиборгу — Беркли — Калифорния — Америка. Остальные элементы, которыми был зашифрован адрес — берклий, калифорний и америций, как было описано выше, получены при непосредственном участии Глена Сиборга.
Что же представляет сиборгий? Он является близким аналогом молибдена и вольфрама. Известно, что он проявляет степень окисления +6, образуя очень летучий гексафторид (SgF6), а также умеренно летучий гексахлорид (SgCl6) и оксихлориды SgO2Cl2 и SgOCl4 — соединения, аналогичные соединениям других элементов группы хрома.
Единственной другой степенью окисления сиборгия, кроме +6, является нулевая степень окисления. В 2014 году было показано, что сиборгий, аналогично своим трем более легким соседям по группе, образующим гексакарбонильные комплексы, даёт летучий гексакарбонилсиборгий(0) Sg(CO)6, который также летуч, как и его аналоги (Science, 2014: Vol. 345, Issue 6203, Р. 1491–1493).
107. Борий
Может возникнуть вполне резонный вопрос — зачем тратить столько времени, сил и ресурсов на синтез трансфермиевых элементов? Их сложно синтезировать, но, как показывает практика, их получение представляет собой более простой процесс, чем изучение их химических свойств. Получают их в таких количествах, что можно не думать не об их практическом применении, но и даже нельзя полноценно применять термин «период полураспада», который является статистической величиной и может применяться к сотням и больше тысяч атомов, с определённой натяжкой — к сотням и никогда к десяткам (чтобы осознать что такое статистическая величина, представьте — если вы будете кидать монету тысячу раз, то около пятисот раз выпадет «орёл» и около пятисот раз «решка», но если вы кинете ту же монету десять раз, вряд ли она упадет вверх «орлом» ровно пять раз). Тем не менее, синтез новых элементов и изучение их свойств, это не просто «химическое коллекционирование» и заполнение пустых клеток — эксперименты по синтезу сверхтяжёлых элементов позволяют проверить и уточнить теоретические выкладки, и элемент № 107 сыграл в изучении Периодического закона особую роль.
Особенность элемента № 107 — бория в том, что это первый искусственный химический элемент, полученный с помощью холодного слияния ядер. Суть холодного слияния в том, что эта методология сталкивает мишени и ядра атомов с относительно низкой энергией возбуждения (всего лишь с меньшей энергией, чем 20 МэВ). Понижение энергии столкновения нужно, чтобы дочернее ядро — продукт слияния не обладало избытком энергии и не разрушалось бы сразу после образования, не давая возможности себя обнаружить. Естественно, что холодное слияние протекает не при комнатной температуре (для слияния атомных ядер нужна энергия, эквивалентная температурам в десяток миллионов градусов), и его не нужно путать с псевдонаучной концепцией «холодного ядерного синтеза», анонсированного в 1989 году в сообщении Мартина Флейшмана и Стенли Понса об электрохимически индуцированном превращении дейтерия в тритий или гелий в условиях электролиза на палладиевом электроде или так называемой «биологической трансмутации».
О синтезе элемента № 107 впервые сообщила в 1976 году группа Юрия Цолаковича Оганесяна — исследователи изучали спонтанное деление продуктов реакции слияния ядер висмута 209Bi и хрома 54Cr. Как показали дальнейшие исследования изотопов элементов 107, 105 и 104, в реакции 209Bi+54Cr действительно рождаются ядра 261Bh и 262Bh, но многие выводы, сделанные в 1976 году группой из ОИЯИ, оказались ошибочными. Первый успешный синтез бория с помощью холодного слияния было осуществлено в Центре по изучению тяжёлых ионов имени Гельмгольца в немецком городе Дармштадте — исследователи сталкивали те же ядра, что и учёные из Дубны, но при меньших энергиях, в результате чего было получено несколько изотопов элемента № 107, в том числе и 270Bh с периодом полураспада в 61 секунду.
В сентябре 1992 года учёные Дармштадта и Дубны, изучавшие элемент № 107 совместно договорились, что его следует назвать «нильсборий» в честь датского физика Нильса Бора. В 1993 году рабочая группа по трансфермиевым элементам ИЮПАК признала приоритет немецкой группы, а в 1994 году в своей рекомендации предложил название «борий», так как названия химических элементов не было принято образовывать из имени и фамилии учёного. Это предложение было окончательно утверждено в 1997 году (Pure and Applied Chemistry. — 1997. — Т. 69, № 12. — С. 2471–2473.).
В Периодической системе борий находится в седьмой (по старой номенклатуре — побочной подгруппе седьмой группы) с марганцем, технецием и рением. Однако, применение принципов специальной теории относительности к расчетам, предсказывающим свойства тяжёлых атомов, таких как борий, позволяло говорить о том, что они будут обладать аномальным поведением, отличаясь свойствами от типичных представителей своей группы. Расчёты расчётами, а эксперименты с резерфордием и дубнием действительно позволяли говорить, что свойства этих элементов благодаря релятивистским эффектам несколько отличаются от свойств, которые можно предсказать на основании Периодического закона. Пошли разговоры о том, что создатели трансфермиевых элементов вышли на тот рубеж, где прекращается действие Периодического закона и его графического отображения — Периодической системы.
Однако открытие сиборгия и бория показало, что списывать со счетов Периодический закон рано — да, релятивистские эффекты влияют на свойства элементов, но таким образом, что не меняют свойства элементов кардинальным образом, внося лишь незначительные коррективы, придавая трансфермиевым элементам специфические свойства. Так, изучение свойств оксихлорида бория BhO3Cl и других его соединений показало, что экспериментально определённые свойства бория хорошо согласуются со свойствами «экарения», предсказанными без квантовой механики, а исключительно методами Дмитрия Ивановича Менделеева (Nature, 2000. 407, Р. 63–65). Комментарий новостной службы издательского дома Science к статье о свойствах этого элемента был озаглавлен «Boring Bohrium Behaves as Expected» — «Скучный борий ведёт себя ожидаемо», подчёркивая дополнительно, что борий не демонстрирует никаких экзотических свойств, которые можно было бы приписать релятивистским эффектам.
108. Хассий
В 1984 году произошло много событий: первый выход женщины-космонавта в открытый космос — это сделала Светлана Савицкая с борта орбитальной космической станции «Салют-7», в продажу поступил первый Apple Macintosh, а кинотеатры США порадовали зрителей премьерой фильма «Терминатор». Для химии же и Периодической системы этот год стал известен тем, что в 1984 году учёные дармштадтского Центра по изучению тяжёлых ионов впервые синтезировали элемент № 108, ныне известный как хассий (Hs); период полураспада самого стабильного нуклида хассия — 277Hs составляет около 12 минут.
Правда история элемента № 108 началась немного ранее, как у многих элементов — с ошибочного открытия. Впервые сообщения об открытии элемента № 108 появились в 1970 году и были совершенно неожиданными на фоне накапливаемой физиками-ядерщиками информации о том, что увеличение порядкового номера и атомной массы атома приводит к понижению его стабильности. Экспедиция группы советских учёных в пустынном районе вблизи полуострова Челекен у Каспийского моря под руководством Виктора Викторовича Чердынцева, специалиста в области геохимии изотопов, ядерной геофизики и радиогеологии, человека, впервые обосновавшего происхождение тяжёлых химических элементов в массивных звёздах, наблюдала необычные треки распада на образцах минерала молибденита. На основании этих наблюдений был сделан вывод об обнаружении элемента 108 с атомной массой 267 в природе, информация об этом открытии попала в научно-популярные (но не научные) журналы и даже обсуждалась на заседаниях геохимических и физических институтов АН СССР. Конечно, научная достоверность заключения была оспорена как недостаточно доказанная, но, говоря современным языком, свой медийный отклик заключение получило, в очередной раз доказав, что от ошибок в своей области знания не застрахован даже специалист — главное уметь их признавать и исправлять, а не упорствовать.
Итак, на самом деле элемент № 108 был получен в 1984 группой Петера Амбрустера и Готтфрида Мюнценберга. Для этого исследователи бомбардировали мишень из свинца 208Pb пучком ионов железа 58Fe на Универсальном линейном ускорителе UNILAC. В результате эксперимента было синтезировано 3 ядра 265Hs, образование которых было надёжно подтверждено по параметрам цепочки α-распадов (Zeitschrift für Physik A Atoms and Nuclei. 1984, 317, 2, Р. 235–236). В то же время и независимо, эта же реакция слияния исследовалась и в дубнинском ОИЯИ, однако нашим учёным, увы, не удалось зарегистрировать распад самого ядра элемента № 108, хотя дочерние ядра, продукты его распада наши физики тоже наблюдали. Открытие немецких физиков показало, что к трём площадкам для синтеза сверхтяжелых ядер (ОИЯИ, Национальная лаборатория имени Лоуренса и Нобелевского Института в Стокгольме) добавилась четвёртая.
До 1998 года элемент № 108 назывался унилоктием (сто восьмым). Амбрустер и Мюнценберг предложили назвать его оттоганий (Oh) в честь Отто Гана, в 1994 году ИЮПАК рекомендовал назвать его «ганием» (чтобы как с нильсборием включить в название только фамилию человека, а не его имя), но в 1997 году элементу было дано окончательное название — хассий в честь федеральной немецкой земли Гессен (княжество Гессен, столицей которого был Дармштадт, на латыни называлось Hassia).
Химические свойства хассия удалось изучить только спустя восемнадцать лет после его открытия — в 2002 году. Для этого хассий получали, бомбардируя кюрий 248Cm ядрами магния 26Mg — так было получено семь атомов хассия (смесь изотопов 269Hs и 270Hs, время жизни которых составляло 10 и 4 секунды соответственно). Изучение химических свойств этих семи атомов (если так можно выражаться), показало, что они быстро взаимодействуют с кислородом, образуя тетроксид хассия HsO4 (Nature, 2002, 418, Р. 859–862). Эти результаты (пусть и недостаточные для большой статистики) всё же позволяют говорить, что элемент ведёт себя подобно осмию, в одной группе с которым он находится — очередной атом, подчиняющийся Периодическому закону.
109. Мейтнерий
Элемент № 109 — единственный химический элемент Периодической системы, названный исключительно в честь женщины учёного — физика Лизы Мейтнер (название «кюрий» увековечивает не только Мари Кюри, но и её мужа Пьера).
Лиза Мейтнер родилась в Вене в еврейской семье; её отец Филипп Мейтнер был известным шахматистом. Родители были против её поступления в университет, однако Мейтнер настояла на своём, и 1901 году поступила в Венский университет, где начала изучать физику под руководством Людвига Больцмана и Франца Экснера. В 1905 году она первой среди женщин в университете получила степень в области физики. После этого Мейтнер отправилась в Институт кайзера Вильгельма в Берлин, где начала заниматься радиохимией. В берлинском университете она познакомилась с химиком Отто Ганом, с которым в дальнейшем долго и продуктивно сотрудничала. В 1930-х годах Мейтнер и Ган совместно изучали процессы, протекающие при бомбардировке урана нейтронами, но до завершения работ Мейтнер из-за своего еврейского происхождения (хотя она крестилась и крестилась в 1908 году, обратившись в лютеранство) в 1938 году вынуждена была сбежать из нацистской Германии. Осев в Стокгольме, она продолжила переписку с Ганом. Оба исследователя пытались интерпретировать образование бария, протекающее при облучении урана нейтронами. В декабре 1938 года Мейтнер, беседуя со своим племянником Отто Фришем, тоже физиком, поняла, что нейтроны заставляли ядро урана делиться, образуя ядро бария. Мейтнер и Фриш предположили, что вторым продуктом распада урана должен быть криптон, и Фриш, вернувшись в Копенгаген, где он работал, подтвердил предсказание.
Вторую мировую войну Мейтнер провела в Швеции, отказавшись эмигрировать в США и работать в Манхэттенском проекте, заявив: «Я не буду делать бомбу!» По её словам, эти годы были самые несчастливые для неё — в Швеции мало кто интересовался ядерной физикой, по ряду причин начался конфликт между Мейтнер и президентом международного союза чистой и прикладной физики (ИЮПАП), Нобелевским лауреатом Карлом Манне Георгом Сигбаном, в институте которого она работала. Мейтнер очень сильно переживала по поводу того, что разработанная ей теория деления атомных ядер превратилась в атомные бомбы, уничтожившие Хиросиму и Нагасаки. Не меньшим шоком для неё было то, что Нобелевской премией по химии 1944 года за теорию деления атомных ядер был награжден только её соавтор и коллега Отто Ган (хотя Гану присудили Премию в 1944 году, официальное объявление об этом было сделано в 1945 году, а саму Премию он получил только в 1946 году). Скорее всего, невзлюбивший Мейтнер Карл Манн Георг Сигбан постарался убедить Нобелевский комитет, чтобы он «забыл» про Мейтнер. Сам Отто Ган, с одной стороны, признал вклад Лизы Мейтнер в создание теории деления ядер, передав ей половину суммы от Нобелевской Премии, это признание носило частный характер — в лекциях или СМИ Ган так и не упомянул о роли Мейтнер, что не могло не ранить её. Конечно, в 1946 году Мейтнер получила американскую награду «Женщина года», в 1949 году — медаль Макса Планка, а в 1966 году — премию Энрико Ферми (совместно с Отто Ганом и Фридрихом Штрассманом). В 1960 году Мейтнер переехала в Кембридж, ближе к племяннику Отто Фришу, где умерла в 1968 году, а в 1997 году её вклад в науку был увековечен в названии элемента № 109 — мейтнерий.
Первый атом мейтнения — 266Mt, был впервые получен в 1982 году в группе Петера Амбрустера и Готтфрида Мюнценберга в результате процесса слияния висмута 209Bi с железом 58Fe. Мейтнерий — первый элемент в Периодической системе, химические свойства которого не изучены экспериментально — пока еще не удалось достаточно устойчивых изотопов, чтобы провести такое исследование. Теоретические предсказания позволяют полагать, что нуклид 271Mt (он будет содержать «магическое число» нейтронов — 162), который можно получить слиянием урана с хлором или берклия с магнием будет жить достаточно долго, чтобы изучить химические свойства мейтнерия, однако, несмотря на то, что эксперименты по синтезу такого нуклида проводятся, он пока ещё не получен. Что же касается теоретических предсказаний свойств элемента № 109 в соответствии с Периодическим законом (и квантовохимическими расчётами), ожидается, что мейтнерий должен быть благородным металлом, проявляющим степени окисления +6, +3 и +1, причём в водном растворе наиболее стабильными будут ионы, содержащие мейтнерий в степени окисления +3.
110. Дармштадтий
От рождения до разрушения первого синтезированного нуклида дармштадтия — 269Ds, прошло 270 микросекунд. Такая кратковечность, естественно, стала причиной споров того, кто же на самом деле получил этот элемент первым. В 1987 заявку на его открытие подавал Объединённый Институт ядерных исследований в Дубне, в 1991 году — Национальная лаборатория им. Лоуренса в Беркли, но в обеих заявках было недостаточно твёрдой аргументации. В итоге дармштадтий стал четвёртым элементом, полученным в дармштадском Центре по изучению тяжёлых ионов им. Гельмгольца (GSI). До этого там были получены и выделены борий, хассий и мейтнерий.
Дармштадтий получил свое название в честь города Дармштадта, в котором расположен Центр по изучению тяжёлых ионов. В качестве варианте названия рассматривалось еще и такое как «виксхаусий» по северному муниципальному району Дармштадта Виксхаузену, в котором расположен Центр, но здравый смысл восторжествовал, и элемент был назван в честь всего города (представьте названия «воробьёвогорий» или «китайгородий» вместо «московия», о котором пойдёт речь далее).
В ноябре 1994 года в GSI международная исследовательская группа, руководителями которой были Сигурд Хофманн, Петер Амбрустер и Готтфрид Мюнценберг бомбардировала мишень из свинца 208Pb ионами никеля 62Ni. Несмотря на то, что в свинцовую мишень попадало несколько триллионов ионов никеля ежесекундно, образовалось только три атома дармштадтия 269Ds, который распадался, последовательно образуя ядра хассия, сиборгия и резерфордия. Для того, чтобы получить такие элементы, как дармштадтий, необходимо разгонять частиц, бомбардирующие мишень (в данном случае — ионы никеля) до скорости, составляющей около 10 % скорости света, придавая им достаточно энергии для преодоления электростатического отталкивания ядер, позволяющих им осуществить слияние.
Для разгона ионов никеля до нужной скорости исследователи из Дармштадта ускоряли их на «универсальном линейном ускорителе» UNILAC — 120-метровой камере, снабжённой электромагнитами, придававшими частицам всё большую и большую скорость. Большая часть столкновений не привела к желаемому результату, но несколько случайных слияний (обычно сопровождаемых утратой нейтронов) произошли, и получились ядра дармштадтия, который самопроизвольно распадался с испусканием α-частиц (ядер атома гелия) с образованием более стабильных продуктов.
Поскольку через ускоритель ежесекундно проносятся триллионы частиц, сложности возникают не только в слиянии атомных ядер, но и в отделении продуктов слияния от общего потока частиц. Для этого применяется технология, известная как «Сепаратор тяжёлых ионов — продуктов реакции» (Separator for Heavy Ion reactor Products, SHIP). Устройство SHIP работает как фильтр, в котором электрические и магнитные поля позволяют отделять продукты со строго определённым зарядом ядра (для получения дармштадтия это был заряд 110), в то время, как «ненужные» атомы и ионы меняют направление движения так, что пролетают мимо детектора.
О химических свойствах дармштадтия на настоящий момент не известно ничего. Несмотря на то, что самый стабильный нуклид этого элемента — 281Ds, живёт в среднем 11 секунд, что достаточно для проведения химических исследований, препятствием является слишком медленная скорость синтеза этого нуклида, в результате чего просто не удается получить достаточно материала для обоснования статистически значимых результатов эксперимента. Ожидается, что свойства дармштадтия будут похожи на свойства платины, но это ещё нужно доказать.
Любопытно, что любой из нас, посещая Дармштадт, сможет увидеть Дармштадтий воочию и даже посетить его — в 2008 году мэрия Дармштадта назвала «Дармштадтием» центр для конференций, конгрессов и просто концертов (так, на декабрь 2018 года в Дармштадтии запланировано «Лебединое озеро» в исполнении артистов Русского национального балета).
111. Рентгений
В 2004 году элемент № 111, временный символ которого состоял из трех букв «u» — Uuu (Unununium, унунуний — сто одиннадцатый на латыни), был назван совместной рабочей группой ИЮПАК и ИЮПАП «рентгением» (Rg).
Сам рентгений был синтезирован в декабре 1994 года в Центре по изучению тяжёлых ионов им. Гельмгольца. У первой статьи о синтезе элемента № 111 тринадцать авторов, среди которых кроме представителей команды Дармштадта трое российских учёных из дубнинского ОИЯИ, два словака, болгарин и финн противостояние и «трансфермиевые войны» сменились сотрудничеством (Zeitschrift für Physik A Hadrons and Nuclei, 1995, Volume 350, Issue 4, Р. 281–282).
Эксперимент, в ходе которого был получен рентгений, заключался в бомбардировке мишени из висмута 209Bi ионами никеля 64Ni, ядра никеля сталкивались с мишенью в режиме упомянутого выше холодного слияния, чтобы не допустить накопление дочерним ядром — продуктом слияни, большой энергии, приводящей к его нестабильности.
Успешные, то есть приводящие к слиянию ядер, столкновения протекали нечасто. Причина этого в том, что ядро атома занимает крайне малый объём по отношению к размерам самого атома, границы которого определяются границами его электронной плотности, то есть, если утрировать фраза «мишень из висмута обстреливали ионами никеля» в большинстве случаев может звучать как: «пустоту бомбардировали пустотой». Тем не менее, несмотря на ничтожно малую вероятность «правильного» столкновения ядер в 1994 году удалось наблюдать три успешных столкновения, в результате которых образовалось три атома элемента № 111 с массой 272. Эти атомы бяли крайне нестабильными и за половину миллисекунды распадались, образуя последовательно мейтнерий, борий, дубний и лоуренсий. В ходе последующих экспериментов, проведённых в 2000 году, было получено ещё три атома элемента № 111, цепочку распада которых удалось отследить ещё дальше — до элемента № 101, менделевия.
Около десяти лет элемент существовал под обозначением Uuu — для присвоения элементу имени требовалось независимое подтверждение. В 2003 году исследователи, работавшие на линейном ускорителе в японском Институте физико-химических исследований (RIKEN) получили 14 атомов элемента № 111 с массой 272, после чего открытие нового элемента было признано, и первооткрыватели предложили назвать его рентгением в честь немецкого физика, первого в истории лауреата Нобелевской премии по физике, получившего её в 1901 году за открытие «Х-лучей», которые мы сейчас называем «рентгеновскими лучами».
О химических свойствах рентгения, естественно, ничего неизвестно — все полученные с помощью реакций слияния изотопы этого элемента живут столь недолго, что уже достижением можно считать наблюдение их образования. В Периодической системе рентгений находится в группе монетных металлов — меди, серебра и золота, и рентгений можно назвать «эказолотом». Теоретики, используя весь арсенал квантовой химии, развлекаются, предсказывая его свойства, и сходятся в том, что этот металл должен отличаться крайне низкой реакционной способностью, как золото, правда одни считают, что он должен быть металлом серебристого цвета, а другие — золотистого. В 2004 году, при синтезе элемента № 115 было обнаружено, что при его распаде образуется нуклид рентгения 280Rg со средним временем жизни около 3.6 секунд, однако маловероятно, чтобы этот атом смог бы помочь в установлении химический свойств «эказолота» — слишком сложен путь получения даже этого нуклида, стабильного относительно других изотопов рентгения.
112. Коперниций
Коперниций, шестой (и пока последний) из трансфермиевых элементов, полученных в Центре по изучению тяжёлых ионов им. Гельмгольца, был впервые синтезирован в феврале 1996 года — исследователям удалось детектировать один-единственный атом элемента, ядро которого содержало 112 протонов — элемента № 112 (Zeitschrift für Physik A. — 1996. — Vol. 354, no. 3. — P. 229–230).
В этом эксперименте исследователи бомбардировали мишень из свинца 208Pb ионами и ядрами цинка 70Zn. При простом слиянии таких ядер должно было бы образоваться ядро, содержащее 112 протонов и 166 нейтронов, суммарно — 278 нуклонов (к нуклонам мы относим элементарные частицы, входящие в состав ядра — протоны и нейтроны) или, говоря проще, нуклид с атомной массой 278. Однако любая реакция слияния атомных ядер экзотермическая, и образующееся ядро характеризуется повышенной энергии, которая «стравливается» за счет испускания ядром нейтрона или нейтронов; в случае элемента № 112 испускался один нейтрон, и образовывался нуклид коперниция 277Cn.
Второй атом элемента № 112 был получен в 2000 году, и в 2004 году японские исследователи из RIKEN, используя методологию коллег из Дармштадта, получили еще два атома этого элемента. Более тяжёлые изотопы коперниция были получены в 2000 и 2004 годах в ОИЯИ в качестве продуктов распада изотопов элемента № 114 — флеровия (Physical Review C. — 2004. — Vol. 70. — P. 064609).
Работа японских физиков-ядерщиков стала подтверждением открытия элемента № 112, и ИЮПАК признал приоритет открытия нового элемента за учёными, работавшими в Дармштадте, которым в 2009 году было предложено подобрать элементу название и химический символ. После переписки между принимавшими участие в реализации проекта двадцатью исследователями из четырёх стран и обсуждения в интернете первооткрыватели решили назвать элемент «коперницием». Первоначально для коперниция первооткрывателями предлагался символ Ср, но в ходе общественного обсуждения стало понятно, что это неудобно, потому что этим символом в органической и металлоорганической химии обозначается циклопентадиенил-анион (С5Н5—), и был принят символ Cn, не предполагающий двусмысленного толкования. Исследователи решил назвать элемент в честь Николая Коперника — польского астронома, математика, и механика эпохи Возрождения, с которым в естествознании связывается начало первой научной революции и переход от геоцентрической системы мира Аристотеля-Птолемея к гелиоцентрической системе мира. Правда, таблицы движения небесных тел Коперника вскоре существенно разошлись с наблюдениями и стали проигрывать в точности птолемеевскому «Альмагесту», выведенному для геоцентрической системы — в новой системе Коперник сохранил круговые орбиты планет и равномерность их движения, грубо говоря, просто поменяв Землю и Солнце местами. Точные гелиоцентрические таблицы движения небесных тел позже вывел Иоганн Кеплер, который открыл истинную форму орбит планет, а также признал и математически выразил неравномерность их движения. Тем не менее, сделанное Коперником впервые за две тысячи лет (первую дошедшую до нас гелиоцентрическую систему в начале III века до н. э. предложил Аристарх Самосский) превращение Земли в рядовую планету было предпосылкой для создания законов механики Галилея и Ньютона.
Коперниций расположен в двенадцатой группе (по старой версии — побочной подгруппе второй группы) Периодической системы — под цинком, кадмием и ртутью. Первые эксперименты по изучению адсорбции нескольких атомов коперниция на охлаждённой поверхности золота показали, что свойства этого элемента подобны свойствам ртути. Предполагается, что в макроколичествах он должен быть жидким, возможно даже более летучим, чем ртуть.
113. Нихоний
В японском языке есть два слова для самоназвания родины — «Нихон» и «Ниппон» (дословно — «место, где восходит Солнце»). Как оказалось, в плане открытия новых элементов, это очень удачно для Страны восходящего Солнца, иначе у ней бы не было шансов появиться в Периодической системе.
В главе про технеций уже было написано, как в 1909 году Масатака Огава назвал в честь своей страны «ниппонием» то, что он ошибочно посчитал элементом № 43. К его чести, он не был единственным человеком, кого так подвёл не содержащийся в земной коре в количествах, достаточных для обнаружения, технеций. Тем не менее, японский национальный характер таков, что ошибка Огавы почти век расценивалась японскими химиками и японской наукой как национальный позор, а мечтой японских ученых было исправить ошибку и все же увидеть Японию в Периодической системе. Впервые японские исследователи сообщили о синтезе элемента № 113 методом холодного слияния в 2004 году, причём сразу заявили, что, если все пойдёт как надо, назовут его в честь Японии. Более убедительные доказательства открытия были предоставлены исследователями из RIKEN в 2012-м году. За это время им удалось не только получить три ядра элемента № 113 278Nh с помощью бомбардировки мишени из висмута 208Bi ядрами цинка 70Zn, но и изучить схему его распада — нихоний претерпевает шесть последовательных α-распадов, в итоге превращаясь в менделевий 254Md (Journal of the Physical Society of Japan, 2012, 81, 103201, doi: 10.1143/JPSJ.81.103201).
Свою заявку на открытие унунтрия подавали также российские и американские физики-ядерщики. В 2004 году в результате совместного эксперимента, целью которого был синтез элемента № 115 с помощью горячего слияния ядер, физики из Объединенного института ядерных исследований в Дубне и Ливерморской национальной лаборатории в Калифорнии фиксировали среди продуктов последующего распада сто пятнадцатого элемента, который сейчас называется московием, другой нуклид нихония — 286Nh. В ходе совместной работы российской и американской исследовательской групп над этим проектом было обнаружено около сотни ядер нихония, к тому же 286Nh оказался более стабильным — время его жизни составляло в среднем 19,6 секунд.
Тем не менее, принимая решение о том, кому принадлежит пальма первенства в открытии элемента № 113, комиссия ИЮПАП/ИЮПАК решила, что главное не количество экспериментов, а их качество — эксперименты японских физиков были признаны более чистыми и информативными. Полученные исследователями из RIKEN легкие изотопы нихония в ходе своего распада превращались в уже хорошо изученные нуклиды, например, 266Bh, в то время как распады тяжелых изотопов нихония, полученного российскими и американскими физиками, протекают с образованием новых, ранее не наблюдавшихся ядер, состав и строение которых еще требуют дополнительных доказательств.
В июне 2016 года ИЮПАК рекомендовал назвать элемент № 113 «нихоний» (Nh) по одному из двух вариантов самоназвания Японии — Нихон (название «ниппоний» было скомпрометировано ошибкой Огавы), и, после пятимесячного обсуждения 28 ноября 2016 года название «нихоний» было утверждено (Pure Appl. Chem. 88 (2016) 401), и нихоний стал первым в истории элементом, открытым в Японии и вообще в азиатской стране.
Экспериментально химические свойства нихония не изучены, на основании расчетов предполагается, что нихоний будет больше похож не на своих соседей по группе — галлий и таллий, а на медь или серебро (The Journal of Chemical Physics. — 2001. — 8 August (vol. 115, no. 6). — P. 2456–2464).
114. Флеровий
Охота за элементом № 114, пожалуй, была самой долгой охотой на искусственный трансфермиевый элемент. Обычно от начала получения синтетического элемента до обретения им имени и заполнения клетки в таблице проходило максимум три десятка лет, получение флеровия растянулось более, чем на сорок.
К 1960-м годам было ясно, что с ростом заряда ядра времена существования тяжелых элементов становятся все меньше и меньше, уменьшаясь до отрезков, не позволяющих наблюдать само ядро. «Трансфермиевым войнам» советских и американских физиков, конкурировавших за приоритеты в открытии элементов с номерами № 102–106, позволяли работать теории строения атомного ядра.
В 1949 была создана новая теория строения атомного ядра. Идея Нобелевского лауреата 1963 года по физике, Марии Гёпперт-Майер была проста — ядро атома представляет собой не каплю с хаотично расположенными протонами и нейтронами, а набор оболочек, в пределах которых определённые группы протонов и нейтронов связывались друг с другом прочнее, чем с другими нуклонами.
Эта модель объясняла того факта, что элементы с атомными весами 2, 8, 20, 28, 50, 82, и 126 были чрезвычайно стабильными. Суть объяснения состоит в том, что в ядре образуются оболочки с возможным количеством нуклонов 2, 6, 10 и т. д. — эти числа были названы «магическими». При заполнении очередной оболочки получается чрезвычайно стабильная конфигурация ядра. Сама Гёпперт-Майер сравнивала ядро с танцевальным залом, в котором одни танцоры описывают круги вокруг других, причём диаметр таких кругов должен постоянно увеличиваться.
Теория магических чисел атомных ядер предсказывала, что понижение времени жизни синтетических элементов должно смениться увеличением их стабильности — к моменту, когда будет формироваться магическое ядро. Зона таких стабильных элементов называлась «островом стабильности», и первой очевидной целью для «высадки на остров стабильности» был элемент № 114. Теоретические расчеты 1960–70-х годов оценивали период полураспада этого элемента в несколько миллионов лет, из-за чего синтез элемента № 114 стал мечтой многих физиков-ядерщиков, в том числе и Глена Сиборга, который писал в автобиографии: «Мне все еще было интересно синтезировать элементы, исследовать мечту о поиске сверхтяжелых элементов — элементов в области атомного номера 114. Период полураспада элементов становился все короче по мере того, как они становились тяжелее, но я полагал, что существует «остров стабильности»…»
Эксперименты по синтезу элемента № 114 начались в 1960-е и продолжились в 1970-е. В 1973 году Джеймс Харрис, позднее признанный одним из первооткрывателей резерфордия, ставший таким образом первым афроамериканцем, принявшем участие в открытии нового элемента, в интервью для журнала заявил, что № 114 будет получен в течение ближайшего года. Прошёл год, прошло два десятка лет, но № 114 не появлялся, и энтузиазм учёных в попытках его получить стал угасать — народ стал переключаться на более близкие и доступные цели. Физики-ядерщики вернулись к идее синтеза элемента № 114 в 1990 году, когда Объединённый институт ядерных исследований в Дубне и Ливерморская национальная лаборатория им. Э. Лоуренса подписали договор о сотрудничестве.
Сотрудничество началось со встречи руководителей исследовательских организаций — Джона Наколса и главного соперника Глена Сиборга эпохи холодной войны и «трансфермиевых войн» — Георгия Николаевича Флёрова. Сотрудничество Ливермор-Дубна было совершенно уникальным явлением для обеих сторон. К несчастью, Флёров умер вскоре после судьбоносной встречи, и со стороны России руководителем проекта стал преемник Флёрова — Юрий Цолакович Оганесян, эксперимент было решено проводить на базе ОИЯИ, куда американская сторона направила в своих сотрудников.
Эксперимент начался в декабре 1998 года, исследователи бомбардировали мишень из плутония 244Pu ядрами кальция 48Са, для получения № 114 было выбрано горячее слияние (Physical Review Letters. — 1999. — Vol. 83, № 16. — P. 3154–3157). В первом эксперименте получился один атом флеровия, просуществовавший 30 секунд, что, конечно было меньше ожидаемого времени жизни в миллионы лет, но все равно гораздо больше милли- и микросекунд, за которые успевали распадаться элементы № 111–113. С другой стороны, для того, чтобы дотянуть до магического ядра и острова стабильности полученному нуклиду 288Fl на хватало восемь нейтронов. О синтезе элемента № 114 успели сообщить даже Глену Сиборгу, у которого, по словам, сообщившего ему эту весть Альберта Гиорсо, от радости заблестели глаза (в августе 1998 года Сиборг перенес инсульт, и его речь и мимика не восстановились в полном объеме до его смерти в феврале 1999 года).
В сентябре 2009 года американские учёные из Национальной лаборатории Лоуренса в Беркли синтезировали флеровий, подтвердив таким образом результаты совместной работы американских и российских химиков 1998 года. В результате бомбардировки мишени 242Pu пучком ионов 48Ca были получены два нуклида 114-го элемента с массовыми числами 286 и 287.
Назвать новый элемент оказалось также сложно, как и получить его — сотрудничество сотрудничеством, но американцам и профильному комитету ИЮПАК могла не понравиться идея назвать элемент в честь Георгия Николаевича Флёрова учитывая его роль в создании советского ядерного оружия (по правилам ИЮПАК элементы нельзя называть в честь людей, отношение к которым у разных стран или культур неоднозначно). Было найдено дипломатичное решение — название флеровий было дано не в честь самого Флёрова, а в честь названной его именем Лаборатории ядерных реакций Объединённого института ядерных исследований, где был синтезирован элемент. В итоге флеровий присоединился к сиборгию в Периодической системе, и увековеченными стали имена обоих соперников «трансфермиевых войн».
115. Московий
Объединённый Институт ядерных исследований расположен в Дубне, в 120 севернее от Москвы. Объединённый институт ядерных исследований был создан на основе Соглашения, подписанного 26 марта 1956 года в Москве представителями правительств одиннадцати стран, которые решили объединить усилия в изучении фундаментальных свойств материи. 1 февраля 1957 года ОИЯИ был зарегистрирован ООН.
В ОИЯИ были синтезированы все трансурановые элементы Периодической системы химических элементов, открытые в СССР и России, и повторен синтез большинства трансурановых элементов, открытых в других странах. За Институтом ИЮПАК официально закрепил мировой приоритет открытия многих новых элементов. С момента основания ОИЯИ, из 18 элементов, которые с тех пор были открыты во всём мире — одиннадцать были обнаружены в этом институте.
С 1990 года ОИЯИ работает совместно с Ливерморской национальной лабораторией, и это сотрудничество привело к тому, что в 2012 году в Периодической системе появились результаты этого сотрудничества — элементы № 114 и № 116 — флеровий и ливерморий соответственно, а в 2016 году дубнинский институт со американскими коллегами подбирали названия ещё для трёх элементов — № 115, № 117 и № 118. Методика, которую используют Дубна и Ливермор для синтеза сверхтяжёлых элементов — горячее слияние, при котором мишень облучается пучком ионов или ядер с высокой энергией, достаточной чтобы преодолеть электростатическое отталкивание ядер и заставить их слиться. Ядро, образующееся в процессе горячего слияния может легко распасться, не дав возможности себя обнаружить. Чтобы такое расщепление не произошло, пучок, с помощью которого обстреливают мишень, обычно содержит ядра с аномально большим количеством нейтронов. При слиянии избыточные нейтроны играют роль «балласта», с которым отводится избыток энергии ядра.
Секретное оружие, с помощью которого удалось получить многие трансфермиевые элементы — не мишень, а ядра, которыми эту мишень бомбардируют — ядра кальция 48Са. Это редкий нуклид кальция (он составляет 0,19 % от всего кальция земной коры, он радиоактивен, но период его полураспада [(4,39 ± 0,58)×1019 лет] позволяет считать его условно стабильным. Один грамм такого нуклида стоит около 200 тысяч долларов, во время синтеза сверхтяжёлых элементов на ускорителе расходуется полмиллиграмма 48Са в час.
Именно этот нуклид кальция позволил открыть элементы № 114 и № 116; изменение мишени дало возможность получить № 115, № 117 и № 118.
Физикам из Дубны и Ливермора удалось получить московий двумя способами. Первый — бомбардировка мишени из америция 243Am пучком 48Са, при этом образовывались ядра московия (Physical Review C, 2005, 72, 3, 034611). Среднее время жизни наиболее устойчивых нуклидов составляло 220 миллисекунд. Второй способ — спонтанный распад ядер элемента № 117, теннессина, при котором образовывались изотопы 289Mc и 290Mc с несколько большим временем жизни, но, тем не менее, не превышавшем секунду. Результаты синтеза элемента № 115 были подтверждены контрольными экспериментами международной группы исследователей во главе с физиками из Университета Лунда (Швеция) и в Институте по изучению тяжелых ионов имени Гельмгольца (Дармштадт, Германия). К настоящему времени получено около сотни атомов московия.
Так как в честь Дубны уже назван элемент № 105, ИЮПАК рекомендовал дать элементу № 115 название «московий» (Mc) в честь Московской области, в которой расположен наукоград Дубна и Объединённый институт ядерных исследований (Дубна).
116. Ливерморий
Правила ИЮПАК просты — элемент можно назвать в честь его свойства, мифологического создания, географического объекта, учёного или минерала. Полученные за последние полвека элементы названы в честь учёных или географических понятий. На настоящий момент ливерморий является самым тяжелым элементом, названным в честь города (точнее — расположенной в городе Ливерморе Ливерморской национальной лаборатории имени Лоуренса), элемент № 117 — теннесин, назван в честь штата, а № 118 — оганессон — в честь учёного.
Первые сообщения о синтезе элемента № 116 появились в 1999 году, на его открытие претендовала Национальная лаборатория имени Лоуренса в Беркли в Беркли, но эти эксперименты не удалось воспроизвести и впоследствии они были признаны либо неправильно интерпретированными, либо сфальсифицированными. В июне 2000 года элемент № 116 был получен и учеными из Объединенного Института ядерных исследований в сотрудничестве с Ливерморской национальной лабораторией в результате бомбардировки кюрия 248Cm ионами кальция 48Са. Нуклид элемента № 116 образуется и при α-распаде элемента № 118, оганессона, 294Og.
Все изотопы ливермория чрезвычайно неустойчивы и, претерпевая α-распад, образуют изотопы элемента № 114, флеровия, последующий α-распад которого приводит даёт элемент № 112, коперниция. Образование коперниция было доказано по сходству его химических свойств со свойствами ртути, и эта химическая идентификация коперниция стала, в свою очередь, подтверждением удачного синтеза элементов с атомными номерами № 114 и № 116.
В июне 2011 года открытие элемента 116 утвердил ИЮПАК, в мае 2012 года, одновременно с названием флеровия было утверждено название элемента ливерморий.
117. Теннесин
Американский штат Теннесси давно связан с ядерной физикой. В этом штате был построен первый ядерный реактор, на котором в 1940-е годы получали секретный тогда плутоний для создания атомной бомбы «Толстяк», уничтожившей Нагасаки. В 1945 году исследователи из Оук-Ридж, тогда ещё секретного города, градообразующим предприятием которого был ядерный реактор, открыли прометий. В последующие годы Национальная лаборатория Оук-Ридж была самой результативным из центров по изучению ядерной энергетике, находившихся в подчинении Министерства энергетики США. К 2005 году лаборатория Оук-Ридж осталась одной из двух организаций, способных нарабатывать значительные количества такого элемента, как берклий, который мог требоваться для разных целей, в том числе и исследовательских проектов.
В 2005 году Юрий Цолакович Оганесян, лаборатория которого в ОИЯИ к тому времени уже пятнадцать лет сотрудничала с Ливерморской национальной лаборатории имени Лоуренса, через общих знакомых предложил лаборатории Оук-Ридж принять участие в совместном исследовательском проекте — синтезе элемента № 117. Для реализации этого проекта требовалась мишень из берклия («ядерными пулями» оставались всё те же ионы кальция 48Са), а берклий можно было получить в лаборатории Оук-Ридж.
Первая проблема была в том, что на момент обращения в Оук-Ридж не производил калифорний, а берклий обычно был нужен для синтеза этого элемента, однако ради сотрудничества получение берклия было начато, и к декабрю 2008 реактор Оук-Риджской лаборатории выдал 22 миллиграмма берклия 249Bk с периодом полураспада 314 дней. Тут возникла вторая проблема — физикам из Оук-Ридж никогда ранее не приходилось отправлять заказчику радиоактивные элементы воздушным транспортом (как сами понимаете, это единственный способ оперативно доставить распадающийся материал из США в Россию), и они не успели вовремя и правильно подготовить все документы, которые бы соответствовали требованиям Федерального управления гражданской авиации США и позволили бы взять два десятка миллиграмм радиоактивного препарата на борт. К счастью, все решилось относительно быстро, и посылка была доставлена в ОИЯИ до того, как берклий успел значительно распастся.
Для синтеза 117-го элемента мишень из изотопа 97-го элемента, берклия-249, полученного в Окриджской национальной лаборатории (США), обстреливали ионами кальция-48 на ускорителе У-400 Лаборатории ядерных реакций ОИЯИ. В результате было зафиксировано шесть ядер нового элемента — пять 293Ts и одно 294Ts (Physical Review Letters, Vol. 104 (2010) P. 142502). В июне 2012 года эксперимент был повторён. Было зафиксировано пять ядер 293Ts, а в декабре 2015 года ИЮПАК официально признал открытие 117-го элемента.
Уже через неделю после заявления ИЮПАК о подтверждении синтеза элемента № 117, 7 января 2016 года, британский химик и блогер Кэт Дэй разместила в Интернете петицию, в которой предлагает назвать этот элемент «октарином» (octarine, Oc) в честь «восьмого цвета радуги» из романов о Плоском мире британского писателя Терри Пратчетта, скончавшегося в марте 2015 года. По Пратчетту, октарин видят только волшебники (и еще кошки), тем не менее он вполне реален и указывает на присутствие магии. Тем не менее, ИЮПАК, не веря в магию, назвал элемент № 117 «теннессин» (Ts) в знак признания вклада штата Теннесси, в том числе Национальной лаборатории Ок-Ридж, Университета Вандербильта и Университета Теннесси в Ноксвилле, в изучение сверхтяжёлых элементов.
118. Оганессон
Замыкающий в настоящее время Периодическую систему элемент № 118 — оганесон назван в честь академика РАН Юрия Цолаковича Оганесяна — научного руководителя Лаборатории ядерных реакций им. Г. Н. Флёрова в ОИЯИ. Оганесян присоединился к исследовательской группе Флёрова в 1958 году и с тех пор стал одним из ведущих специалистов мирового масштаба в области синтеза новых химических элементов. В 1970-е году он первым опробовал технику холодного слияния ядер, которая привела к открытию элементов № 107–113. В 1990–2000-х годах с помощью методики горячего слияния Оганесяну с коллегами удалось заполнить седьмой ряд Периодической системы, в том числе и получив элемент своего имени.
Впервые синтезе элемента № 118 сообщили физики из Беркли в 1999 году. Они планировали назвать его в честь своего любимого шефа Альберта Гиорсо «гиорсием» (Gh). Однако мечтам не дано было сбыться — синтез унуноктия по заявленной методике не удалось воспроизвести в нескольких центрах ядерных исследований — российском, немецком и американском, из-за чего это первое заявление было признано ошибочным (Physical Review Letters, 2002, 89, 3, 039901, doi: 10.1103/PhysRevLett.83.1104).
Внутреннее расследование, проведённое в Национальной лаборатории имени Лоуренса, показало, что речь не идёт об ошибочной интерпретации, а о фальсификации результатов, которые были проделаны одним человеком — болгарским исследователем Виктором Ниновым. Внутренний комитет лаборатории пришел к выводу, что Нинов был единственным человеком в проекте, который переводил исходные данные эксперимента в удобочитаемый для человека формат и использовал эту возможность для ввода ложных данных (Nature. 2002. 420 (6917): 728–729). Повторный анализ исходных данных не показывал событий, которые первоначально сообщал анализ Нинова. Для всех руководителей совместных проектов (и даже просто для «шефов» небольших исследовательских групп) отсюда мораль — людям, конечно лучше доверять, но черновые результаты исследований стоит просматривать, особенно в том случае, если подчинённые сообщают вам об экстраординарных результатах, которые они получили под вашим чутким руководством.
В конце концов № 118 получили ученые из ОИЯИ и Ливерморской национальной лаборатории. При получении этого элемента мишенью для луча из ядер кальция 48Са стал калифорний 249Cf (Physical Review C», 2006, 74, 4, 044602). При этом калифорний не был использован специально — он образовывался в результате β-распада берклия, применявшегося для получения московия, и эксперимент по получению элемента № 117 позволил поймать сразу двух «зайцев». Среднее время жизни элемента № 118 составляло 0.2 секунды, он последовательно распадался с образованием ливермория, флеровия и коперниция.
28 ноября 2016 года ИЮПАК утвердил название «оганесон». Название с суффиксом «-он» обусловлено тем, что элемент № 118 входит в группу Периодической системы, заполненную инертными газами, названия которых (за исключением гелия) оканчиваются на «-он». Таким образом, оганесон стал вторым после сиборгия химическим элементом, названным в честь живущего человека. В 2017 году Армения выпустила почтовую марку с изображением Юрия Цолаковича Оганесяна тиражом 40 000 экземпляров. На ней представлены символы сверхтяжелых элементов: оганесона, названного в честь самого ученого, и продуктов распада оганесона, благодаря которым удалось доказать получение этого элемента.
Формально оганесон можно считать самым тяжелым инертным газом. Именно формально: получено достаточно данных в пользу того, что характер заполнения электронной оболочки сверхтяжелых элементов совершенно не таков, как у легких. Дело в том, что из-за большого заряда тяжелых атомных ядер электроны в сверхтяжелых элементах разгоняются до такой скорости, при которой пренебрегать теорией относительности уже нельзя. Конечно же время жизни оганессона слишком мало, и определить экспериментально, будет ли элемент № 118 проявлять свойства инертного газа, невозможно. Тем не менее исследователи из Новой Зеландии и США провели квантово-химические расчеты, результаты которых позволяют считать оганессон уникальным атомом (Phys. Rev. Lett., 2018, 120, 053001) — результаты расчётов предсказывают, что распределение электронов, вращающихся вокруг столь большого ядра, в большей степени теряет свою оболочечную структуру, размываясь в «электронный газ».
Исследователи отмечают, что для оганессона проявление релятивистских эффектов очень существенно — они обусловливают так называемое спин-орбитальное сочетание, то есть взаимосвязь спинового состояния электрона и характеристик его перемещения по орбиталям. При значительном спин-орбитальном сочетании заселенность электронов по уровням со строго определенными энергетическими характеристиками размывается, и электроны, находящиеся около ядра, распределяются практически равномерно, образуя облако электронного газа, или Ферми-газа.
Эффект размывания электронных оболочек постепенно увеличивается вместе с ростом заряда ядра. Согласно расчетам, оганессон существенно отличается от инертных газов, расположенных в той же группе Периодической системы. Состояние электронов в его атоме должно быть очень близким к предельной их делокализации — Ферми-газу. В таком «размазанном» состоянии электроны легко поляризуются, а значит, атомы оганессона будут связываться друг с другом прочными вандерваальсовыми взаимодействиями, и, наиболее вероятно, при комнатной температуре это будет не газ, а твердое вещество. Кроме того, коль скоро внешняя оболочка оганессона — не устойчивый октет, элемент № 118 будет гораздо реакционноспособнее по сравнению с его соседями — инертными газами.
2.0. Вместо эпилога
Незадолго до стопятидесятилетия, которое мы будем отмечать в 2019 году седьмой ряд Периодической системы оказался полностью заполнен, и она стала выглядеть завершённой. Тем не менее, точку ставить рано, и сейчас исследователи пытаются выяснить, есть ли границы у Периодической системы, и сколько химических элементов может еще существовать. Свои ответы на эти вопросы предлагает профессор Университета Мичигана Витек Назаревич.
Работа Назаревича предсказывает, что атомные ядра, в которых протоны и нейтроны будут связаны сильными взаимодействиями, могут существовать до элемента номер 172 — ядро которого будет содержать 172 протона. Сильные взаимодействия смогу стабилизировать такое ядро и не дать ему распасться, но стабилизация будет продолжаться лишь доли секунды. Системы, содержащие более 172 протонов, просто не смогут быть стабилизированы сильными взаимодействиями, то есть на основании предсказаний можно говорить о том, что у Периодической системы все же есть граница.
Расчёты Назаревича дают и ещё один необычный прогноз — по его словам, ядра ряда сверхтяжёлых элементов будут существовать столь короткий промежуток времени, что просто не успеют притянуть к себе хоть какое-то количество электронов и всю свою короткую жизнь буду существовать в виде «голых» комбинаций протонов и нейтронов. Если эти теоретические предсказания когда-то удастся подтвердить эмпирически, учёным придется каким-то образом адаптировать понятие «атом» под новые объекты, которые уже не будут электронейтральными частицами, состоящими из ядра и связанных с ним носителей заряда, противоположного заряду ядра. Правда, удастся ли когда-то получить такие комбинации протонов и нейтронов, а также — могут ли они сформироваться где-то естественным путём, остается загадкой.
Исследователи медленно, но верно углубляются в область сверхтяжёлых ядер, синтезируя элемент за элементом, зачастую не представляя, как будет выглядеть результат синтеза. Сейчас попытки синтезировать элемент № 119 предпринимаются сразу несколькими исследовательскими центрами, но, увы, теория строения атомного ядра в настоящий момент не в силах предсказать оптимальные условия для синтеза новых ядер, поэтому пока в ядерной физике приходится идти путём проб и ошибок до победного исхода — с таким подходом равновероятно, что синтез элемента № 119, открывающего восьмой ряд Периодической системы может произойти и через пару месяцев, и затянуться на долгие годы.
Не менее интересен вопрос о том, могут ли сверхтяжёлые ядра образовываться в космосе. Предполагается, что слияние нейтронных звёзд, процесс, протекающий с колоссальным выбросом энергии, может обеспечить формирование ядер, содержащих большее число протонов, чем самый тяжёлый элемент, полученный в лаборатории — оганессон. Более того, в космическом пространстве около нейтронных звезд концентрация нейтронов высока, и теоретически возникает возможность самопроизвольного синтеза изотопов уже полученных в лабораториях элементов, но более тяжёлых — содержащих большее количество нейтронов. Однако такое может и не происходить — ядра сверхтяжёлых элементов могут успеть распасться еще до того, как в их состав войдут нейтроны и образуются более тяжёлые изотопы того же оганессона. Возможно новые, более точные расчетные модели позволят определит те только, насколько велики шансы образования сверхтяжелых элементов в космических процессах, но и предсказать цепочки распада сверхтяжелых ядер, облегчив физикам-ядерщикам интерпретацию результатов своих экспериментов.





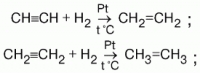


Комментарии к книге «Элементы: замечательный сон профессора Менделеева», Аркадий Искандерович Курамшин
Всего 0 комментариев