Александр Исаакович Китайгородский Кристаллы
Введение
Кристаллы… да ведь это красивые редко встречающиеся камни. Они бывают разных цветов, в большинстве своём прозрачны, и, что самое замечательное, они обладают красивой правильной формой. Обычно кристаллы представляют собой многогранники, стороны (грани) их идеально плоские, рёбра строго прямые. Собранные в минералогическом музее, они радуют глаз чудесной игрой света в гранях, удивительной правильностью строения…
Всё сказанное действительно справедливо, но… кристаллы – совсем не музейная редкость. Кристаллы окружают нас повсюду. Твёрдые тела, из которых мы строим дома и делаем станки, вещества, которые мы употребляем в быту, – почти все они относятся к кристаллам.
Если посмотреть на простой камень в микроскоп, то можно увидеть, что почти каждый камень состоит из маленьких кристалликов. Примером тому рисунок 1; это не булыжная мостовая, а сфотографированная с большим увеличением аметистовая раковина в горной породе.
Рис. 1. Усеянная аметистами полость в горной породе (под микроскопом).
Песок и гранит, поваренная соль и сахар, алмаз и изумруд, медь и железо – всё это кристаллические тела.
В природе находят как мельчайшие кристаллики в форме иголок, таблеток, пирамид, призм, так и огромные кристаллы, размером в человеческий рост (рис. 2). Иногда находят отдельные кристаллики, в других случаях кристаллики срастаются в сложные сплетения, в грозди.
Как же мы отличаем кристалл от не кристалла? Что общего у видимого в микроскоп кристаллического зерна железа и играющего светом алмаза? Мы узнаем, что основным признаком кристалла служит исключительный порядок в расположении составляющих его частиц.
Рис. 2. Крупный кристалл горного хрусталя.
Внешне эта особенность выражается в окаймлении кристаллов плоскими гранями, которые пересекаются по прямым рёбрам. Поэтому легко убедиться в том, что мы имеем дело с кристаллом, если он крупный и одиночный. Микроскоп и рентгеновские лучи помогают нам в исследовании мельчайших кристаллов.
Знание свойств окружающих нас тел немыслимо без ясного представления о кристаллах. Поэтому следует познакомиться с кристаллами поближе. Мы расскажем в этой книжке о том, что такое кристаллы, как они построены, каковы их свойства и где они используются. Мы объясним также, почему знание кристаллов необходимо для понимания свойств твёрдых тел, и расскажем, что общего между куском стали и горным хрусталём.
1. Идеально правильные фигуры
На рисунке 3 представлено несколько многогранников. Их очертания очень совершенны, как говорят, идеально правильны.
В чём заключается совершенность изображённых тел, заслужившая для них название идеально правильных?
Рис. 3. Многогранники: а – куб; б – октаэдр; в – два додекаэдра – слева ромбододекаэдр, справа пентагондодекаэдр; г – шестигранная призма; д – сочетание призмы с двумя шестигранными пирамидами.
Многогранник, показанный на рисунке 3, а, называется кубом; у него 6 граней, 12 рёбер и 8 вершин. На рисунке 3, б показан октаэдр. Слово «окта» по-гречески означает восемь, окончание «эдр» означает грань, название «октаэдр» соответствует русскому слову восьмигранник; у октаэдра 6 вершин и 12 рёбер. На рисунке 3, в изображены два разных двенадцатигранника. Один из них называется ромбододекаэдром (приставка «ромбо» указывает на форму грани, «додека» значит двенадцать.) Все его грани, как видно из рисунка, имеют форму ромба. Подсчитывая число вершин и рёбер у додекаэдра, получим соответственно 14 и 24. Рядом изображён пентагондодекаэдр. У него также двенадцать граней, но грань имеет форму пентагона – пятиугольника («пента» – пять, «гон» – угол).
У перечисленных пока что фигур все грани имеют одну и ту же форму. У куба – это квадраты, у октаэдра – равносторонние треугольники, у додекаэдра – ромбы или пятиугольники.
Эти правильные тела – самые простые. Но существуют и несколько более сложные формы. На рисунке 3, г изображена шестигранная призма. Два основания её – правильные шестиугольники, шесть боковых сторон – прямоугольники. Всего граней 8, рёбер 18 и вершин 12. Рядом (рис. 3, д) показана красивая фигура, состоящая из двух шестигранных пирамид и одной шестигранной призмы. У этого тела 30 рёбер, 14 вершин и 18 граней – 12 граней имеют форму равнобедренного треугольника и 6 прямоугольны.
Мы приводим числа вершин, рёбер и граней, чтобы обратить внимание читателя на одно интересное правило, установленное знаменитым петербургским академиком Леонардом Павловичем Эйлером: число рёбер равно сумме числа граней и вершин, уменьшенной на два. Действительно, имеем для куба 12 = 6 + 8 – 2; для октаэдра 12 = 8 + 6 – 2; для ромбододекаэдра 24 = 12 + 14 – 2; для шестигранной призмы 18 = 8 + 12 – 2; у фигуры на рисунке 3, д 30 = 18 + 14 – 2.
Фигуры, подобные описанным нами, можно выпилить из дерева или изготовить искусственно из какого-либо иного материала. Замечательно, однако, то обстоятельство, что при некоторых предосторожностях (о которых мы будем говорить ниже, стр. 58) кристаллы вырастают в виде идеальных многогранников. В виде кубиков можно получить каменную соль. Алмаз находят в природе в виде октаэдров, а гранит – в виде ромбододекаэдров. Однако значительно чаще кристаллы принимают форму не простых, а сложных многогранников, имеющих несколько разных «сортов» граней. Например, кристаллы кварца довольно часто встречаются в виде только что описанных тел (рис. 3, д) с гранями двух сортов – прямоугольными и треугольными.
2. Кристаллы-близнецы
Рассмотрим внимательно большое количество кристаллов одного и того же вещества. Не все образцы будут представлять собой правильные фигуры. Некоторые кристаллики будут просто обломками, другие будут иметь одну, две грани «ненормально» развитыми. Однако ряд образцов покажется нам достаточно идеальным. Отберём их из общей кучи и зарисуем. Мы увидим тогда, что имеются кристаллы, отличающиеся друг от друга главным образом размером. Если маленький пропорционально увеличить, то он будет в точности повторять большой. Наряду с такими кристалликами мы найдём и другие, чем-то похожие друг на друга, но уже не совпадающие ни при каком пропорциональном изменении размеров (рис. 4).
Рис. 4. Некоторые возможные формы кристаллов кварца.
У разных образцов кристаллов одного и того же вещества может быть представлено (или, как говорят, могут развиться) различное число граней одного «сорта», а также различное число самих «сортов» граней. И всё же такие кристаллики похожи друг на друга, как близкие родственники, как близнецы. В чём же заключается их сходство? В XVII и XVIII веках многие учёные независимо друг от друга искали эти родственные черты.
Одним из учёных, открывших закон, объясняющий это сходство, – закон постоянства углов в кристаллах – был Михаил Васильевич Ломоносов. Изучая драгоценные камни, он неизменно находил одни и те же углы между их гранями.
Посмотрите на рисунок 4, где изображён ряд кристаллов кварца. Все эти кристаллики – близкие родственники. Их можно сделать и совсем одинаковыми, сошлифовывая грани на различную глубину параллельно самим себе. Легко видеть, что таким способом, например, кристалл II может быть сделан совершенно таким же, как кристалл I. Эта возможность следует из того замечательного обстоятельства, что углы между сходственными гранями образцов одинаковы, например, между гранями А и Б, Б и В и т.д.[1]
В этом равенстве углов и заключается «семейное» сходство кристаллов. При сошлифовывании граней параллельно самим себе форма кристалла изменяется, но углы между гранями сохраняют своё значение.
При росте кристалла в зависимости от ряда случайностей одни грани могут попасть в условия более благоприятные, другие в менее удобные для увеличения своих размеров. Кристалл вырастет неправильным, родственные взаимоотношения между выросшими в разных условиях образцами станут незаметными, но углы между сходственными гранями всех кристаллов изучаемого вещества будут всегда одинаковы. Форма кристалла случайна, а углы между гранями отвечают (и мы дальше поймём, почему) его внутренней природе.
Этот очень важный закон природы помогает нам узнавать, с каким веществом мы имеем дело. Два образца могут быть внешне очень непохожими, но если измерение показывает, что углы между гранями одинаковы, то имеются серьёзные основания полагать, что мы имеем дело с одним и тем же веществом. Напротив, отсутствие совпадающих углов между гранями говорит за то, что кристаллы принадлежат разным веществам.
Анализ вещества, построенный на этой идее, был разработан творцом современной кристаллографии – так называется наука о строении и свойствах кристаллов – русским учёным Евграфом Степановичем Фёдоровым.
Е.С. Фёдоров не только указал на возможность определения вещества по форме кристалла, но и составил вместе со своими учениками книгу «Царство кристаллов», плод гигантского труда, длившегося свыше 10 лет. Эта книга содержит в себе основы современной кристаллографии и справочный материал о величинах углов между гранями у огромного количества кристаллов.
Для анализа вещества методом Е.С. Фёдорова требуется иметь маленький кристаллик, размером хоть с песчинку. У этого кристаллика мы измеряем на специальных приборах – гониометрах – углы между гранями. Затем, пользуясь правилами, разработанными Фёдоровым, мы определяем, к какой группе веществ принадлежит исследуемый кристалл, и по совпадению данных измерения с цифрами, приведёнными в «Царстве кристаллов», находим, с каким веществом мы имеем дело. Разумеется, анализ не может быть проведён в том случае, если данное вещество никогда не изучалось и сведений о нём нет в книге.
Анализ методом Е.С. Фёдорова оказал уже не мало услуг промышленности. Например, в 1938 году с помощью определителя кристаллов было обнаружено присутствие в россыпях на Урале важнейшей оловянной руды – касситерита, кристаллы которого были ранее ошибочно отнесены к другому минералу – рутилу (окись титана).
3. Что такое симметрия
Смысл этого слова лучше всего мы поймём на примерах.
На рисунке 5, а изображена скульптура; перед ней стоит большое зеркало. В зеркале возникает отражение, в точности повторяющее предмет. Скульптор может изготовить две фигуры и расположить их так же, как фигуру и её отражение в зеркале (рис. 5, б). Эта «двойная» скульптура будет симметричной фигурой – она состоит из двух зеркально равных частей.
Рис. 5. а – скульптура и её изображение в зеркале; б – симметричная скульптура, состоящая из двух частей.
Действительно, представим себе, что так же, как и на рисунке 5, а, расположено плоское зеркало. Тогда правая часть скульптуры в точности совпадёт с отражением левой её части. Эта симметричная фигура обладает вертикальной плоскостью зеркальной симметрии, которая проходит через середину постамента. Плоскость симметрии – мысленная плоскость, но мы её отчётливо ощущаем, рассматривая симметрично построенное тело.
На рисунках 6 и 7 приведены другие примеры тел, имеющих плоскость симметрии. Плоскостью симметрии обладают тела животных, вертикальную плоскость симметрии можно провести через человека. В животном мире симметрия осуществляется лишь приблизительно, да и вообще идеальной симметрии в жизни не существует. Архитектор может изобразить на чертеже дом, состоящий из двух идеально симметричных половин. Но когда дом будет построен, как бы хорошо его ни делали, всегда можно будет найти разницу в двух соответствующих частях здания: в одном месте есть трещинка, в другом – нет; в одном месте краска положена густо, в другом редко…
Рис. 6. Зеркальную плоскость симметрии имеют тела человека и животных.
Рис. 7. Здание Московского Государственного Университета им. М.В. Ломоносова обладает вертикальной плоскостью симметрии.
Наиболее точная симметрия осуществляется в мире кристаллов, но и здесь она не идеальная: наличие невидимых глазом трещинок, царапин всегда делает равные грани слегка отличными друг от друга.
На рисунке 8 изображена детская бумажная вертушка. Она тоже симметрична, но плоскость симметрии через неё провести нельзя. В чём же тогда заключается симметрия этой фигурки? Прежде всего, спросим себя о симметричных её частях. Сколько их? Очевидно, четыре. В чём заключается правильность взаимного расположения этих одинаковых частей? Это также нетрудно заметить. Повернём вертушку на прямой угол, то есть на 1/4 окружности; тогда крыло 1 встанет на то место, где было крыло 2; крыло 2 – на место 3; 3 – на место 4 и 4 – на место 1. Новое положение неотличимо от предыдущего. Про такую фигурку мы скажем так: она обладает осью симметрии и притом осью симметрии 4-го порядка.
Рис. 8. Бумажная вертушка обладает осью симметрии 4-го порядка.
Итак, ось симметрии – это такая прямая линия, поворотом около которой на долю оборота можно перевести тело в положение, неотличимое от исходного. Порядок оси (в нашем случае 4-й) указывает, что такое совмещение происходит при повороте на 1/4 окружности. Следовательно, четырьмя последовательными поворотами мы возвращаемся в исходное положение.
Оси симметрии различных порядков приблизительно осуществляются у цветов. Цветок на рисунке 9, а обладает осью симметрии 2-го порядка – при повороте на 1/2 окружности цветок совмещается сам с собой. При наличии оси 6-го порядка (рис. 9, б) совмещение происходит при повороте на 1/6 долю полного оборота. Цветы яблони, груши и многие другие имеют ось симметрии 5-го порядка. Помимо вертикальной оси симметрии у цветка на рисунке 9, а есть ещё две вертикальные плоскости симметрии, а на рисунке 9, б – 6 плоскостей симметрии. Сообразите сами, как они проходят.
Рис. 9. Оси симметрии 2-го и 6-го порядков у цветов.
На рисунке 10 приведены примеры более сложных случаев симметрии, встречающихся в природе. Организм на рисунке 10, а обладает осью симметрии 4-го порядка, перпендикулярной плоскости рисунка, четырьмя осями симметрии 2-го порядка, лежащими в этой плоскости, и рядом плоскостей симметрии.
Рис. 10. Примеры более сложной симметрии, осуществляемой природой.
Снежинка на рисунке 10, б имеет ось симметрии 3-го порядка, три оси 2-го порядка и ряд плоскостей симметрии. Возможно очень большое число фигур, различающихся своей симметрией. (Заметим, что подчас совершенно непохожие тела, например человек и бабочка, имеют сходную симметрию.)[2]
Встречаемся ли мы с симметрией любого типа в царстве кристаллов? Опыт показывает, что нет.
В кристаллах мы встречаемся лишь с осями симметрии 2, 3, 4 и 6-го порядков. И это не случайно. Кристаллографы доказали, что это следует из решетчатого строения (см. ниже) кристалла. Поэтому число различных видов или, как говорят, классов симметрии кристаллов относительно невелико – оно равно 32.
4. Внешняя красота – признак внутренней правильности
Почему так красива, правильна форма кристалла? Грани его блестящие и ровные и выглядят так, как будто бы над кристаллом поработал искусный шлифовальщик. Отдельные части кристалла повторяют друг друга, образуя красивую симметричную фигуру.
Эта исключительная правильность кристаллов была знакома уже людям древности. Но представления древних учёных о кристаллах мало отличались от сказок и легенд, сочинённых поэтами, воображение которых было пленено красотой кристаллов. Верили, что хрусталь образуется изо льда, а алмаз – из хрусталя. Кристаллы наделялись множеством таинственных свойств: исцелять от болезней, предохранять от яда, влиять на судьбу человека…
Лишь в XVII–XVIII веках появились первые научные взгляды на природу кристаллов. Представление о них даёт рисунок 11, заимствованный из книги XVIII века. По мнению её автора, кристалл построен из мельчайших «кирпичиков», плотно приложенных друг к другу. Эта мысль довольно естественна. Разобьём сильным ударом кристалл кальцита (углекислый кальций). Он разлетится на кусочки разной величины. Рассматривая их внимательно, мы обнаружим, что эти куски имеют правильную форму, вполне подобную форме большого кристалла – их родителя. Наверно, рассуждал учёный, и дальнейшее дробление кристалла будет происходить таким же образом, пока мы не дойдём до мельчайшего, невидимого глазом кирпичика, представляющего кристалл данного вещества. Эти кирпичики так малы, что построенные из них ступенчатые «лестницы» – грани кристалла кажутся нам безукоризненно гладкими. Ну, а дальше, что же представляет собой этот «последний» кирпич? На такой вопрос учёный того времени ответить не мог.
Рис. 11. Справа кристалл, слева его строение, по мысли учёных XVIII века.
Эта «кирпичная» теория строения кристалла принесла науке большую пользу. Она объяснила происхождение прямых рёбер и граней кристалла: при росте кристалла одни кирпичики подстраиваются к другим, и грань растёт, как стена дома, выкладываемая руками невидимого каменщика. С точки зрения «кирпичной» теории понятно, что правильная форма кристалла есть проявление его внутренних свойств. Из большого кристалла, скажем каменной соли, можно выточить шар. Грани и рёбра кристалла исчезли, но на самом деле они существуют, хотя и в скрытом виде. Начнём медленно растворять шар из каменной соли. Мы увидим, как по мере растворения из шара образуется… куб, то есть та форма, которая свойственна кристаллу данного вещества (см. стр. 54).
5. Поговорим об обоях
Теперь мы хотим дать читателю современные представления о природе кристалла. Для этого сначала нам придётся поговорить… об обоях. Посмотрите на рисунок 12. На нём изображена девочка, играющая в мяч. И не одна девочка, а много совершенно одинаковых фигурок. Найдём на этом рисунке обоев тот наименьший кусок, который надо нарисовать художнику, иначе говоря, тот кусок, простым перекладыванием которого можно составить все обои. Чтобы выделить такой кусок, проведём из любой точки рисунка, например из центра мячика, две линии, соединяющие выбранный мячик с двумя соседними. На этих линиях можно построить, как это видно на нашем рисунке, параллелограмм. Совершенно ясно, что перекладываниям этого кусочка в направлении основных исходных линий мы можем составить весь рисунок обоев.
Рис. 12. Рисунок этих простеньких обоев помогает нам понять решетчатое строение кристаллов.
Этот наименьший кусок может быть выбран по-разному: из рисунка сразу видно, что можно выбрать несколько разных параллелограммов, каждый из которых содержит одну фигурку. Подчеркнём, что для нас в данном случае безразлично, будет ли эта фигурка внутри выделенного куска целой или разделённой на части линиями, ограничивающими этот кусок.
Было бы неверным полагать, что, изготовив повторяющуюся на обоях фигурку, художник может считать свою задачу оконченной. Это было бы так лишь в том случае, если составление обоев можно было бы провести единственным способом – прикладыванием к данному кусочку, содержащему одну фигурку, другого такого же, параллельно сдвинутого. Однако кроме этого простейшего способа есть ещё шестнадцать способов заполнения обоев закономерно повторяющимся рисунком, то есть, всего существует 17 типов взаимных расположений фигурок на плоскости. Они показаны на рисунке 13[3].
Рис. 13. 17 типов симметрии плоского узора; элементарные ячейки выделены.
В качестве повторяющегося рисунка здесь выбрана более простая, но, так же как и на рисунке 12, лишённая собственной симметрии фигурка. Однако составленные из неё узоры симметричны, и их различие определяется различием симметрии расположения фигурок.
Мы видим, что, например, в первых трёх случаях рисунок не обладает зеркальной плоскостью симметрии – нельзя поставить вертикальное зеркало так, чтобы одна часть рисунка была «отражением» другой части. Напротив, в случаях 4 и 5 имеются плоскости симметрии. В случаях 8 и 9 можно «установить» два взаимно перпендикулярных зеркала. В случае 10 имеются оси 4-го порядка, перпендикулярные чертежу, в случае 11 – оси 3-го порядка. В случаях 13 и 15 имеются оси 6-го порядка и т.д.
Плоскости и оси симметрии наших рисунков выступают не по одиночке, а параллельными семействами. Если мы нашли одну точку, через которую можно провести ось (или плоскость) симметрии, то найдём быстро и соседнюю, и далее на таком же расстоянии третью и четвёртую и т.д. точки, через которые проходят такие же оси (или плоскости) симметрии.
Выберем теперь на этих узорах такой наименьший кусок, перемещая который параллельно самому себе на расстояния, равные длинам его сторон, мы сможем воспроизвести всю картину обоев. Мы столкнёмся при этом с несколькими интересными обстоятельствами.
Во-первых, этот наименьший кусок, или, как его принято называть, элементарная ячейка может оказаться параллелограммом (например, случай 1 на рисунке 13), прямоугольником (случаи 3, 4 и др.), ромбом с углом 60° или же квадратом.
Во-вторых, на элементарную ячейку в разных случаях приходится различное число фигурок. Это число равно 1 для случая 1, 4 для случая 8, 6 для случая 17 и т.д.
Принято выбирать элементарные ячейки так, чтобы они были наименьшими, но отражали бы симметрию, присущую узору в целом. Так, в случае 9 можно выбрать прямоугольную ячейку, на которую приходится 8 фигурок, и вдвое меньшую косоугольную. Рисунок указывает на высокую симметрию взаимного расположения фигурок – наличие взаимно перпендикулярных плоскостей симметрии. Косоугольная элементарная ячейка делала бы не очевидной эту высокую симметрию. Поэтому здесь и в других подобных случаях в качестве элементарной ячейки выбирается прямоугольник.
Однако некоторая свобода выбора в расположении элементарной ячейки всегда имеется. Так, совершенно безразлично, поместим ли мы углы ячейки в местах «головок» или «хвостиков» фигурок или же где-либо на белом поле между ними. В случаях 14 или 15 выбор ячейки несколько лучше подчёркивает симметрию обоев, чем, скажем, в случае 8, но сути дела это не меняет, и мы можем, если желаем, произвольно переместить углы ячейки в случае 8, оставляя, конечно, размеры ячейки теми же и стороны её параллельными самим себе.
Способы заполнения элементарной ячейки отдельными фигурками во всех случаях различны. Этим прежде всего и отличаются друг от друга изображённые 17 случаев. Таким образом, художник, выполнивший повторяющийся рисунок обоев, должен указать, кроме того, каким из 17 способов надо построить обои из его рисунка. Например, для случая 8 надо выполненный рисунок расположить в заштрихованной части (одной четверти) элементарной ячейки и отразить его в двух «зеркалах» (рис. 14).
17 типов симметрии плоского узора не исчерпывают, конечно, всего разнообразия узоров, составляемых из одной и той же фигурки: художник должен указать ещё одно обстоятельство, – как расположить фигурку по отношению к граничным линиям ячейки. На рисунке 14 показаны два узора обоев с той же исходной фигуркой, но различно расположенной по отношению к зеркалам. Оба эти узора относятся к случаю 8.
Рис. 14. Два разных расположения фигурок при одинаковом типе симметрии узора.
Мы не станем приводить правила построения обоев во всех остальных случаях.
Какое же отношение имеют обои к кристаллу?
Каждое тело, в том числе и кристалл, состоит из атомов. Простые вещества состоят из одинаковых атомов, сложные – из атомов двух или нескольких сортов. Предположим, что мы могли бы в сверхмощный микроскоп рассмотреть поверхность кристалла поваренной соли и увидеть центры атомов. Рисунок 15 показывает, что атомы расположены вдоль грани кристалла, как узор обоев.
Рис. 15. Схема расположения атомов натрия (I) и хлора (II) на грани куба кристалла каменной соли.
Теперь мы готовы к тому, чтобы понять, как построен кристалл. Кристалл представляет собой «пространственные обои». Пространственные, то есть объёмные, а не плоские элементарные ячейки – это «кирпичи», прикладыванием которых друг к другу в пространстве строится кристалл.
Сколько же способов построения «пространственных обоев» из элементарных кусков? Эта сложная математическая задача была также решена Е.С. Фёдоровым. Он доказал, что должны существовать 230 способов построения кристалла или, как сейчас говорим, 230 фёдоровских групп. Открытие Е.С. Фёдорова принадлежит к величайшим достижениям русской науки. Начатые примерно через 20 лет после вывода Фёдорова опытные проверки его теории – они стали возможными лишь после открытия рентгеновского структурного анализа – привели к блестящему её подтверждению. Не было найдено ни одного кристалла, который не принадлежал бы к той или иной фёдоровской группе.
Все современные данные о внутреннем строении кристаллов получены при помощи рентгеновского структурного анализа, открытого в 1912 году.
Маленький, размером 0,5–1 мм, кристаллик ставится на пути узкого рентгеновского луча. За кристаллом помещается фотопластинка. Наряду с прошедшим сквозь кристалл лучом возникает ряд отклонённых лучей. Мы не будем здесь останавливаться на причине их возникновения. Явление это носит название дифракции.
Проявленная фотопластинка обнаруживает много пятен, по расположению и интенсивности которых можно судить о структуре кристалла. Примерный вид такого снимка – рентгенограммы топаза – приведён на рисунке 16 (в действительности пятна обычно несколько размыты и различаются не столько по величине, сколько по яркости); справа внизу указаны размеры кристаллика. Расшифровка рентгенограмм представляет собой сложную задачу.
Рис. 16. Рентгенограмма кристалла топаза.
Огромное значение для развития рентгеноструктурного анализа имели труды известного русского кристаллографа Г.В. Вульфа. За время, протекшее после открытия рентгеноструктурного анализа, этим методом было изучено строение многих тысяч кристаллов.
6. Невидимые решётки
Существуют простые кристаллы, построенные из атомов одного сорта. Например, алмаз – это чистый углерод. Кристаллы поваренной соли состоят из ионов (электрически заряженных атомов) двух сортов – натрия и хлора. Более сложные кристаллы могут быть построены из молекул, которые в свою очередь состоят из атомов многих сортов.
Однако в кристалле всегда можно выделить наименьшую повторяющуюся группу атомов (в простейшем случае это будет один атом), что соответствует повторяющейся на плоских обоях рисунка 13 одной фигурке.
Как и на рисунке обоев, в кристалле всегда можно найти элементарную ячейку, – то есть такой параллелепипед (для плоских обоев это был прямой или косоугольный параллелограмм), последовательным перемещением которого параллельно самому себе на расстояния, равные его рёбрам, можно воспроизвести весь кристалл.
Повторяющиеся группы атомов (или отдельные атомы) укладываются друг по отношению к другу внутри элементарной ячейки кристалла вполне определённым образом – одним из 230 способов Фёдорова.
Вершины ячейки кристаллографы называют узлами. Обычно их удобнее всего размещать в центрах атомов кристалла. При этом, конечно, не все атомы попадают в вершины ячеек. В самых сложных кристаллах элементарная ячейка будет косоугольным параллелепипедом. В более симметричных кристаллах ячейка имеет форму, например, прямоугольного параллелепипеда. Наиболее симметричные кристаллы – кубические, их ячейка имеет форму куба.
Если изобразить в пространстве строение кристалла, отмечая только узлы и соединяющие их линии, то возникнет своего рода «скелет» кристалла. Этот скелет, сделанный из проволоки и узлов–шариков, показан на рисунке 17; такое изображение кристалла называется кристаллической пространственной решёткой. Изучим сначала «скелет» кристалла, а затем уже будем облекать его плотью.
Рис. 17. Модель кристаллической решётки.
Основная особенность кристаллической структуры заключается в её повторяемости через строго одинаковые расстояния. Предположим, что мы сделали прогулку вдоль одной из проволочек рисунка 17. Выйдя из узла и продвигаясь вдоль проволоки, мы попадали бы всё в новые «местности». Но наши новые впечатления продолжались бы лишь до следующего узла. Начиная же от него, мы увидели бы полное повторение «пейзажа», уже знакомого нам по путешествию от первого до второго узла.
Двигаясь в разных направлениях внутри кристалла, мы наблюдали бы разные картины, но во всех случаях, пройдя некоторое расстояние, мы попадали бы в места, неотличимые от уже пройденных, и это повторялось бы всё время через равные промежутки.
Размеры ячейки могут быть весьма различными. Наименьшие расстояния между соседними узлами встречаются у простейших кристаллов, построенных из атомов одного сорта, наибольшие – у сложных кристаллов белка. Расстояния колеблются от 2–3 до нескольких сот ангстремов (стомиллионных долей сантиметра), в последнем случае соответствуя уже размерам, видимым в электронный микроскоп.
Кристаллические решётки очень разнообразны. Однако свойства, общие для всех кристаллов, безупречно объясняются решетчатым строением кристаллов. Прежде всего, нетрудно понять, что идеально плоские грани – это плоскости, проходящие через узлы, в которых сидят атомы. Но узловых плоскостей можно провести сколько угодно по самым различным направлениям. Какие же из этих узловых плоскостей ограничивают выросший кристалл? Обратим внимание прежде всего на следующее обстоятельство: разные узловые плоскости и линии заполнены узлами не одинаково плотно. Опыт показывает, что кристалл огранён плоскостями, которые гуще всего усеяны узлами, плоскости же пересекаются по рёбрам, в свою очередь, наиболее густо заселённым узлами.
Рисунок 18 даёт вид кристаллической решётки перпендикулярно к её грани; проведены следы некоторых узловых плоскостей, перпендикулярных чертежу. Из сказанного ясно, что у кристалла могут развиться грани, параллельные узловым плоскостям I, и не будет граней, параллельных редко усеянным узлами плоскостям II.
Рис. 18. Схема расположения некоторых узловых плоскостей в кристаллической решётке; плоскости I могут служить внешними гранями, II – нет.
Внешняя симметрия кристалла также определяется типом его решётки. Наиболее симметричными бывают кристаллы с кубической элементарной ячейкой. К высокосимметричным относятся также кристаллы с ячейкой в виде прямой призмы, у которой в основании лежит квадрат или ромб с углом 60°.
Облечём теперь скелеты-решётки плотью, перейдём к рассмотрению упаковки частиц в кристаллах.
7. Биллиардные шары как строительный материал
Мы знаем, что «строительный материал» кристаллов – атомы имеют очень сложное собственное строение: на различных расстояниях от положительно заряженного ядра, состоящего в свою очередь из ряда более мелких частиц, вращаются электроны, несущие отрицательный заряд[4].
Однако в очень многих случаях – позднее мы скажем, в каких именно, – для воспроизведения расположения атомов в кристалле их можно уподобить шарам. Такое представление об атомах отнюдь не отражает всей их сложной природы, но правильно передаёт одно важное обстоятельство, а именно: рентгеновские исследования структуры кристаллов приводят нас к мысли, что кристаллы строятся по принципу наиболее плотной упаковки шаров.
Для того чтобы ясно представить себе сущность этого принципа, возьмём большое количество биллиардных шаров и начнём укладывать их, стремясь создать наиболее плотную упаковку. Прежде всего составим плотный слой – он выглядит так, как биллиардные шары, собранные «треугольником» перед началом игры (рис. 19).
Рис. 19. Один плотный слой шаров.
Отметим, что шар внутри треугольника имеет шесть соприкасающихся с ним соседей. Ясно, что нет другого способа составить плотнейший слой из шаров.
Будем продолжать укладку наложением слоёв друг на друга. Если бы мы поместили шары следующего слоя непосредственно над шарами первого слоя, то такая упаковка была бы неплотной. Желая разместить в некотором объёме наибольшее число шаров, мы должны положить шары второго слоя в лунки нижележащего. Обратим внимание на то, что заполнить все лунки шарами того же самого размера нельзя: лунки заполняются через одну. Отметим на чертеже чёрным лунки первого слоя, оставшиеся пустыми (рис. 20). Плотная упаковка из двух слоёв также существует лишь одна: мы можем, конечно, заполнить шарами второго слоя все «чёрные» лунки, оставив «белые» пустыми, но от этого вид упаковки не изменится. Однако положение меняется, когда мы переходим к третьему этажу.
Рис. 20. Два плотных слоя шаров.
Чтобы получить плотнейшую упаковку, мы должны укладывать шары третьего слоя в лунки второго. Но при этом шары третьего слоя могут быть размещены двумя способами: либо так, чтобы центры этих шаров лежали над центрами шаров первого слоя, либо так, чтобы их центры лежали над «чёрными» лунками.
Наши две трёхэтажные постройки обладают одинаковой плотностью упаковки, но существенно отличаются одна от другой.
При наложении 4-го слоя мы ещё более увеличим число возможных упаковок: из двух трёхслойных упаковок мы можем сделать 4 четырёхслойные. Пятислойных будет уже 8 и т.д.
Ясно, что число различающихся между собой одинаково плотных шаровых упаковок может быть исключительно велико.
Теперь нам надо проследить связь между кристаллической решёткой и шаровой упаковкой. Мы знаем, что основой решётки служат ячейки-кирпичи, прикладыванием которых друг к другу строится кристалл, и какое бы направление мы ни выбрали в кристалле, всегда по этому направлению структура строго повторяется через равные промежутки. А отсюда следует, что кристалл должен представлять собой такую упаковку атомов-шаров, в которой положение слоёв строго повторяется через определённое число слоёв. Если это повторение начинается, например, с 14-го слоя, то это значит, что в высоту ячейка состоит из 13 слоёв. Тогда 14-й слой находится над первым, 15-й – над вторым, 16-й – над третьим и т.д.
Самая простая упаковка – двухслойная: третий слой лежит над первым, четвёртый – над вторым и т.д. Это – так называемая гексагональная плотнейшая упаковка. На рисунке 21 показана её решётка (скелет). Кружки и крестики соответствуют положениям центров атомов. Атомы, центры которых обозначены крестиками, входят в лунки как нижнего, так и верхнего слоёв. Этим способом построены, например, кристаллы магния.
Исключительно большое распространение имеют трёхслойные кристаллы, в которых 4-й слой повторяет первый, пятый – второй и т.д. Рисунок 22, где по-прежнему отмечены лишь центры атомов, показывает, что в такой упаковке можно выбрать кубическую элементарную ячейку. Плотные слои расположены здесь перпендикулярно диагонали куба, соединяющей два атома, центры которых обозначены кружками.
Рис. 21. Скелет плотной гексагональной упаковки.
Рис. 22. Скелет гранецентрированной кубической упаковки. (Отмечены центры шаров).
Попытайтесь представить себе ячейку расположенной так, чтобы эта диагональ шла вертикально. Левый задний кружок окажется при этом внизу и, единственный на нашем рисунке, будет принадлежать первому слою (центры других атомов этого слоя, принадлежащих соседним ячейкам, на рисунок не попали). На первом слое плотно лежит второй слой: центры шести его атомов, попавших на рисунок, – это крестики, расположенные по вершинам и серединам сторон треугольника. Третий плотный слой представлен шестью квадратиками, расположенными также по треугольнику. Наконец, четвёртый слой, повторяющий первый, содержит на нашем рисунке снова только один кружок.
Итак, элементарная ячейка трёхслойной шаровой упаковки – это куб, у которого в вершинах и серединах граней расположены центры атомов. Такую ячейку, называемую кубической гранецентрированной, имеет ряд металлов, например: алюминий, медь, никель, при высокой температуре – железо (о влиянии температуры мы скажем ниже, на страницах 38 и 63).
Мы видим теперь, что реальный кристалл представляет собой систему плотно упакованных частиц, расположение которых повторяется в пространстве. Узлы и линии, соединяющие узлы, – лишь мысленная схема, помогающая нам выделить в кристалле элементарный кирпич и наметить направления, в которых его нужно перекладывать, чтобы заполнить весь кристалл.
Несколько слов о размерах «шаров»-атомов. Точные измерения, произведённые при помощи рентгеновских лучей, привели к следующим данным: радиусы атомов разных веществ колеблются в небольших пределах, примерно от 0,5 до 2 стомиллионных долей сантиметра.
Мы рассматривали упаковки, составленные из одинаковых шаров. Это значит, что пока речь шла о кристаллах химических элементов, содержащих атомы только одного сорта (правда, и элементы не все построены так просто). Перейдём теперь к кристаллам, построенным из атомов нескольких сортов, то есть к кристаллам сложных веществ.
8. Упаковка атомов
Опыты показывают, что кристаллы очень многих сложных веществ мы можем также изобразить, как плотные упаковки шаров. Атомам разных сортов соответствуют шары различных размеров. Строительным материалом кристаллов служат при этом, главным образом, электрически заряженные атомы – ионы[5].
Представим себе, что надо упаковать равное количество крупных и малых шаров. Как сделать упаковку наиболее плотной?
Учёные нашли ответ на этот вопрос. Рассматривая упаковки шаров одинакового размера, мы видим, что не всё пространство заполнено шарами. В упаковках сохраняются пустоты; можно подсчитать, что их объём составляет около 1/4 общего объёма. Пустоты эти – двух разных сортов: одни из них окружены 4 шарами, центры которых размещены в вершинах правильного четырёхгранника – тетраэдра (см. главу 1); другие окружены 6 шарами, причём центры этих шаров образуют правильный восьмигранник – октаэдр. Первые меньше по своим размерам, и их число вдвое больше, чем вторых.
Теперь нам понятно, как упаковать шары двух разных размеров: надо составить плотнейшую упаковку из более крупных шаров и в пустотах разместить меньшие (не обязательно во всех пустотах!).
На рисунке 23 слева наверху показано, как располагается маленький шар в меньшей (окружённой 4 шарами) пустоте. Для наглядности окружающие пустоту крупные шары представлены не целиком, а секторами, вырезанными из них подобно тому, как вырезают клинья из арбузов.
Рис. 23. Вверху: слева – малая, справа – большая пустоты в плотной упаковке шаров; внизу указано, как вырезана правая фигура.
Наверху справа маленький шар расположен в большей пустоте (окружённой 6 крупными шарами), а внизу показан способ вырезания секторов из шести соседних шаров (передний шар при этом убран).
Пустоты обоих сортов можно найти на рисунке 22 (гранецентрированный куб). Например, большая пустота находится в центре куба; центры окружающих её шести атомов – это три крестика и три квадрата на серединах граней.
Можно подсчитать, что в любой плотной упаковке одинаковых шаров на каждый шар приходится одна большая и две меньшие пустоты. Маленькие шары размещаются в этих пустотах; если же они несколько велики для пустот и не помещаются там, то раздвигают соседние крупные шары, разрыхляя плотную упаковку.
То обстоятельство, что упаковки могут быть построены из разного числа слоев и «узор» заполнения пустот маленькими шарами может быть также различен, ведёт к величайшему многообразию структур кристаллов.
Кристаллы поваренной соли представляют собой плотную трёхслойную упаковку крупных ионов хлора (светлые шары на рисунке 24,а); ионы натрия (тёмные шары) заполняют все большие пустоты, поэтому каждый ион натрия окружён шестью ионами хлора.
Сернистое железо (пирротин) представляет собой двухслойную упаковку крупных ионов серы; меньшие ионы железа заполняют все крупные пустоты. В кристалле окиси лития, где по химическому составу на один атом кислорода приходится два атома лития, плотную упаковку образуют крупные ионы кислорода; маленькие ионы лития заполняют все меньшие пустоты. Поэтому каждый ион лития имеет четырёх соседей – ионы кислорода.
В кристалле хлористого кадмия (химический состав его – два атома хлора на один атом кадмия) плотная упаковка образована крупными ионами хлора (крупные шары на рисунке 24,б). Ионы кадмия, изображённые маленькими шарами, заполняют большие пустоты, но не все, а через два слоя ионов хлора. На рисунке 24, б для ясности посредине удалено два слоя крупных шаров, не содержащих между собой малых шаров. Линиями показана элементарная ячейка кристалла.
Рис. 24. Упаковки ионов в кристаллах: а – поваренной соли; б – хлористого кадмия.
Мы привели лишь простейшие «узоры» заполнения пустот плотной упаковки.
Большие работы по описанию кристаллических структур приведённым способом сделаны членом-корреспондентом Академии наук СССР Н.В. Беловым. Эти работы принесли значительную пользу науке, позволили найти много закономерностей, объясняющих механические, оптические и электрические свойства различных минералов.
Напомним, что представление об атомах, как о шарах, правильно отражая одно важное свойство атомов – свойство укладываться в плотные кристаллические упаковки, вовсе не исчерпывает сложнейшей природы атомов и не означает, что атомы – просто твёрдые шарики.
Уподобление атома шарику означает, по существу, следующее. Вокруг ядра атома, как вокруг центра, мы мысленно проводим сферу такого радиуса, что основная часть электронов данного атома попадает внутрь этой сферы. Вот и получается шар, который служит, как говорят, моделью атома.
Воспроизведённая нами картина строения кристалла была бы неполной, если бы мы не сказали ещё о некоторых особенностях поведения атомов в кристалле.
Дело в том, что при объединении атомов в кристалл, некоторая доля их электронов «обобществляется» – начинает принадлежать не отдельным атомам, а всему кристаллу в целом. Постоянное движение около одного атома для этих, так называемых свободных электронов прекращается, и они «бродят» по всему объёму кристалла, пристраиваясь временно к встречным ионам и вновь покидая их. При этом остовы атомов – их ядра с основной массой электронов, то есть ионы кристаллической решётки, совершают лишь малые колебания около положений равновесия в отличие от хаотически движущихся атомов жидкости или газа. Напротив, поведение свободных электронов кристалла при определённых условиях очень сходно с поведением атомов газа. Поэтому свободные электроны называют ещё «электронным газом».
Доля свободных электронов в большинстве случаев очень мала. Так обстоит дело у кристаллов, построенных из разноимённых ионов, например, у кристалла поваренной соли. Здесь практически все 10 электронов положительного иона натрия движутся около ядра натрия, и все 18 электронов отрицательного иона хлора движутся около ядра хлора. (Необходимо различать свободные электроны, не имеющие постоянного «хозяина», и электроны, которые при образовании разноимённых ионов по одному на каждый атом перешли от натрия к хлору. Эти последние цепко удерживаются хлором, который не отпускает их «на свободу».)
Иначе обстоит дело в металлических кристаллах, где атомы отдают, но не могут принимать лишних электронов, и все ионы, таким образом, положительны. Здесь «обобществлённой» оказывается значительная доля электронов. Каждый атом отдаёт в общее пользование 1–3 электрона из числа внешних, всего слабее притягиваемых ядром.
У одновалентных металлов, таких как литий, натрий и т.д., один электрон связан со своим атомом значительно слабее, чем остальные. В кристаллах этих металлов почти каждый атом отдаёт в общее пользование один электрон.
У двухвалентных металлов, таких как кальций, барий и т.д., два электрона связаны со своим атомом значительно слабее, чем остальные. Поэтому в кристаллах этих атомов в общее пользование идут примерно по два электрона с атома.
Кристалл образуется из атомов благодаря притяжению между ними. Сильное притяжение имеет место между разноимённо заряженными ионами, например, между отрицательно заряженными ионами хлора и положительно заряженными ионами натрия.
Каждый ион хлора притягивает к себе 6 ионов натрия, окружив себя таким образом со «всех сторон» частицами другого знака. В свою очередь, каждый ион натрия притягивает 6 окружающих его ионов хлора. Благодаря этому и возникает плотная упаковка частиц в кристалле.
Притяжение ионов уравновешивается отталкиванием, возникающим при их сближении. Силы отталкивания – это силы взаимодействия электронов сблизившихся атомов. Итак, ионы располагаются в кристалле на таком расстоянии, на котором силы притяжения уравновешиваются силами отталкивания.
Но ведь в металлических кристаллах все ионы положительны! Это так. Однако и здесь имеет место взаимное сцепление ионов, приводящее к образованию плотной упаковки. При достаточном сближении атомов происходит описанное выше обобществление части электронов. Эти «общие» электроны образуют своего рода «цемент», скрепляющий ионы атомов в плотно упакованную решётку. Дальнейшему сближению атомов и в этом случае мешает взаимодействие электронов, принадлежащих разным атомам.
9. Упаковка молекул
Характерная особенность описанных выше кристаллов – это отсутствие молекулы в кристалле. Кристалл построен из атомов или ионов, и выделить молекулу в кристалле нельзя. Действительно, вернёмся, например к рисунку 24, а, изображающему строение кристалла каменной соли. Это вещество построено из чередующихся ионов натрия и хлора. Каждый ион натрия имеет 6 соседей – ионов хлора. Все они расположены совершенно одинаково по отношению к иону натрия, и нельзя сказать, что с натрием соединён какой-то один из них. Молекулы каменной соли, состоящей из одного атома хлора и одного атома натрия, в кристалле нет.
Но далеко не всегда дело обстоит подобным образом. Рассмотрим, например, строение кристалла углекислоты, существующего лишь при низкой температуре. Это – так называемый «сухой лёд», который получают при сильном охлаждении сжиженного под давлением углекислого газа.
Кристаллы «сухого льда» построены из молекул. Одна такая молекула изображена на рисунке 25, а. (Подобное представление, конечно, условно, как и изображение атомов шарами.)
Рисунок 25, б поясняет, как молекулы углекислоты упакованы в кристалле: атом углерода (условно изображён меньшим) имеет только двух ближайших соседей – два атома кислорода (большие). Каждый атом кислорода имеет в качестве ближайшего соседа лишь один атом углерода. Тесные группы из трёх атомов – молекулы углекислоты отчётливо выделяются в кристалле.
Рис. 25. а – молекула углекислого газа; б – плотная упаковка молекул.
На рисунке 25 обращает на себя внимание сплющенность шаров молекулы. Дело в том, что силы притяжения между атомами «тройки», то есть между атомами углерода и кислорода одной и той же молекулы, значительно больше сил притяжения между отдельными молекулами. Электронные оболочки атомов углерода и кислорода одной молекулы в значительной степени перекрываются – проникают друг в друга. Это – результат действия химических сил. Из сказанного ясно, как следует изобразить молекулу углекислого газа: взаимное проникновение электронных оболочек можно представить себе как сплющивание шаров, соответствующих отдельным атомам.
Рис. 26. Молекулы бензола (слева наверху), мочевины (внизу) и дифенилртути (справа).
Несколько моделей молекул, построенных из деформированных (искажённых) шаров, дано на рисунке 26. Слева наверху вы видите молекулу бензола, состоящую из шести атомов углерода (в середине) и шести атомов водорода. «Шары» углерода превратились в «дольки»-секторы, а «шары» водорода – в сегменты-полушария.
Слева внизу изображена молекула мочевины. Посредине – атом углерода. Он соединён с одним атомом кислорода (наверху) и с двумя аминогруппами (так называются группы атомов, состоящие из одного атома азота и двух атомов водорода).
Справа – молекула дифенилртути. Фенил – это лишённая одного водородного атома молекула бензола; приставка «ди» указывает на наличие в молекуле двух таких групп. Атом ртути – в центре молекулы.
Многочисленными исследованиями установлено, что к кристаллам, построенным из шаровых атомов или ионов, относятся металлы, сплавы, большинство неорганических соединений (солей, щелочей). Из молекул построены все органические кристаллы и небольшое количество неорганических, например сулема. Спросим себя теперь, каким образом располагаются в кристалле молекулы – тела, обладающие сложной, зачастую причудливой формой?
Как в ионных кристаллах в результате притяжения ионов возникают плотные упаковки шаров, так и взаимное притяжение молекул ведёт к возникновению наиболее плотных молекулярных упаковок.
Общий принцип прост: молекулы укладываются так, что «выступы» одной молекулы заходят во «впадины» другой. Это наглядно показано на рисунке 27 на примере молекул антрацена. Из рисунка ясно, какие расположения молекул осуществляются в природе, какие нет.
Рис. 27. Упаковка молекул антрацена.
Принцип плотной упаковки для молекулярных кристаллов не позволяет такого их устройства, при котором плоскости симметрии проходили бы между молекулами – в этом случае «выступ» одной молекулы приходился бы на «выступ» другой. Таким образом, для молекулярных кристаллов возможны лишь определённые виды симметрии, всего 8–10 фёдоровских групп. На основании принципа плотной упаковки удаётся предсказать характер взаимного расположения молекул, симметрию кристалла и некоторые другие его свойства.
10. Одни и те же атомы, но разные кристаллы
Чёрный матовый мягкий графит, которым мы пишем, и блестящий прозрачный твёрдый, режущий стекло алмаз построены из одних и тех же атомов, а именно, атомов углерода. Почему так резко различны свойства этих двух сходных по составу веществ?
Если бы эти вещества не были кристаллическими, то нам трудно было бы объяснить наличие двух разновидностей углерода. Но эти вещества – кристаллы, а мы знаем, что каждому кристаллу свойственно своё особенное расположение атомов. Значит, заключаем мы, раз между графитом и алмазом, построенными из одних и тех же атомов углерода, есть такое резкое различие в свойствах, то и расположение атомов в кристаллах этих веществ должно быть разным.
Рисунок 28 показывает решётки слоистого графита (справа), в котором каждый атом имеет трёх ближайших соседей, и алмаза, где атом имеет четырёх ближайших соседей. На этом примере с исключительной отчётливостью видно, как резко определяются свойства кристаллов взаимным расположением атомов. Из графита делают огнеупорные тигли, выдерживающие температуру до двух-трёх тысяч градусов, а алмаз горит при температуре выше 700°; удельный вес алмаза 3,5, а графита 2,1; графит проводит электрический ток, алмаз – нет и т.д.
Рис. 28. Слева – решётка алмаза, справа – графита.
Эта особенность давать разные кристаллы принадлежит не только одному углероду. Почти каждый химический элемент, и не только элемент, но и любое химическое вещество, существуют в нескольких разновидностях. Нам известно шесть разновидностей льда, девять разновидностей серы, четыре разновидности железа…
Графит и алмаз устойчивы. Они могут неопределённо долго сохраняться в обычных земных условиях. Так обстоит далеко не со всеми разновидностями одного вещества.
Есть два вида олова: белое и серое. При температуре выше +18° атомы олова располагаются в одной решётке; эта разновидность называется белым оловом; при более низкой температуре атомы начинают менять взаимное расположение: белое олово превращается в серое, которое получается при этом в виде порошка. Новые кристаллики растут из старого кристалла так же, как из жидкости (см. стр. 53).
Рис. 29. Слева – элементарная ячейка гамма-железа, справа – альфа-железа.
Ниже мы узнаем, насколько большое значение имеет для техники существование разновидностей у железа: при высокой температуре атомы железа образуют гранецентрированную решётку (гамма-железо, слева на рисунке 29), при нормальной температуре – объёмно-центрированную решётку (альфа-железо, справа там же).
11. Почему слюда слоистая
До сих пор мы обсуждали вопросы строения кристаллов. Теперь поговорим об их свойствах.
Наиболее замечательная особенность свойств кристалла – это анизотропия. Смысл этого слова, имеющего греческое происхождение, следующий: изотропный – одинаковый по всем направлениям, анизотропный – разный в разных направлениях.
Возьмите кусок стекла (стекло – не кристаллическое тело; см. стр. 61) и попробуйте его сломать, сжимая прессом в каком-либо направлении. Установите величину давления, разрушающего стекло, а затем проделайте над другим таким же куском стекла новое измерение, установив теперь образец под прессом по-иному. Вторая цифра практически совпадает с первой. Хрупкость стекла не зависит от направления, в котором происходит сдавливание. (Конечно, при подобном опыте образцы должны быть одинаковой формы – например, кубики, вырезанные в разных положениях из одного и того же большого литого куска.)
Известно, что тела при нагревании расширяются. Нагреем шар из стекла. Тщательно измерим образец после нагревания. Он сохранил свою шаровидную форму. Во всех направлениях кусок стекла расширился одинаково.
Какие бы свойства куска стекла мы ни изучали, всегда окажется, что во всех направлениях стекло обладает одинаковыми свойствами. Стекло – изотропный материал.
Примеры анизотропных материалов также встречались каждому. Кто не знает, что совсем разные силы надо прилагать, раскалывая полено дров вдоль или поперёк. И другие свойства дерева зависят от направления. Дерево – анизотропный материал.
Причины анизотропии дерева видны невооружённым глазом. Дерево имеет волокнистое строение, волокна вытянуты вдоль его ствола. Разрубить полено вдоль волокон легче, так как требуется лишь отделить одни волокна от других. Разрубить полено поперёк волокон трудно, так как надо перерубить множество волокон.
Так же, как и анизотропия дерева, анизотропия кристаллов объясняется их строением. Анизотропия кристаллов очень отчётливо выражается в их спайности – так называется способность кристаллов раскалываться по определённым плоскостям. Не все кристаллы обладают одинаково хорошей спайностью. Легче всего наблюдать это свойство на каменной соли, кальците, слюде.
Кристаллы каменной соли раскалываются на маленькие кубы и прямоугольные параллелепипеды, кристаллы кальцита – на маленькие ромбоэдры; слюда при самом малом усилии расщепляется на листочки. В перечисленных и других подобных случаях бросается в глаза основная внешняя особенность кристалла – быть огранённым плоскостями.
При разрушении кристаллов менее совершенной спайности может показаться, что образцы разрушаются бесформенно. Однако наблюдение под микроскопом покажет, что это не так. Менее совершенная спайность препятствует разделению кристалла большими плоскостями, но всё равно поверхность осколков имеет «ступенчатый» характер – только величина этих плоских ступенек меньше.
Спайность кристалла показывает как нельзя лучше, что прочность кристалла резко различна в разных направлениях. Следует полагать, что силы сцепления между атомами, из которых построен кристалл, очень слабы в направлении, перпендикулярном плоскостям спайности.
Лучше всего это иллюстрируется примером графита. Расстояние между центрами ближайших атомов внутри слоев, из которых построен кристалл графита (см. выше рис. 28), в 21/2 раза меньше расстояния между слоями. Немудрено, что кристаллы графита встречаются чаще всего в виде тонких чешуек. Наличие столь ярко выраженной плоскости спайности позволяет твёрдому графиту служить смазочным материалом в тех случаях, когда невозможно применение смазочных масел, – например, если скорость движения трущихся частей очень мала, а также при высокой температуре. Графит – твёрдый смазочный материал!
Трение между двумя телами сводится, грубо говоря, к тому, что микроскопические выступы одного тела западают в неровности другого. Усилие, достаточное для того, чтобы расщепить микроскопический графитовый кристаллик, много меньше сил трения, поэтому наличие графитовой смазки значительно облегчает скольжение одного тела по другому.
Мы не приводим схемы строения кристалла слюды – это довольно сложное химическое соединение. Но причина совершенной спайности слюды та же, что и у графита – расположение атомов слоями.
Однако кристалл с совершенной спайностью может и не иметь подобной слоистой структуры.
На рисунке 30, а показана ещё раз упаковка ионов в кристалле каменной (поваренной) соли. Изображён один элементарный куб; его грани состоят из чередующихся ионов хлора и натрия.
Попытаемся разобраться, какие плоскости выделяются здесь среди других, по каким плоскостям легче всего разломать кристалл.
Снимем один вершинный шар – обнажилась плоскость, перпендикулярная телесной диагонали. Эта плоскость состоит из одних ионов натрия (рис. 30, б). Удалим тройку натриевых ионов – следующая параллельная атомная плоскость состоит из одних ионов хлора (рис. 30, в), и так далее.
Рис. 30.
Все эти слои попеременно заряжены с разным знаком: слой хлора – отрицательно, слой натрия – положительно. Поэтому они очень сильно притягиваются друг к другу, и раскалываться по таким плоскостям кристалл не будет.
Напротив, раскалывание легко происходит параллельно грани куба. Как нетрудно сообразить, каждый из разделяемых при этом слоев содержит поровну и положительных и отрицательных ионов. Притяжение между такими в целом не заряженными слоями мало. По этим-то направлениям и проходят в кристалле каменной соли плоскости спайности.
Различие по разным направлениям хрупкости кристаллов, выражающееся в явлении спайности, бросается в глаза.
Анизотропию других свойств кристалла наблюдать несколько труднее.
Вот например, как можно показать неодинаковость теплопроводности кристалла в разных направлениях.
Отполируем грань кристалла и покроем её ровным слоем легкоплавкого воска. Концом нагретой проволоки прикоснёмся к середине грани. От конца проволоки вдоль грани распространяется тепло, и часть воска вокруг плавится. Если кристалл проводит тепло одинаково хорошо во все стороны, то этот участок должен иметь форму круга.
Что же показывает опыт?
Оказывается, если из кристалла кварца вырезать пластинку перпендикулярно главной оси симметрии, то воск расплавится по кругу (рис. 31, слева). В таком же точно опыте на боковой грани кварцевого кристалла мы получим эллипс (рис. 31, справа).
Рис. 31. Так выгладит расплавленный воск на срезе, перпендикулярном главной оси, и на боковой грани кристалла кварца.
Очевидно, можно утверждать, что вдоль главной оси симметрии и перпендикулярно к ней тепло распространяется с разной скоростью. Во всех же направлениях, перпендикулярных главной оси, теплопроводность одинакова.
Анизотропия свойств кристалла связана с его структурой. Поэтому, если все направления, перпендикулярные главной оси, равноценны для распространения тепла, то, вообще говоря, они будут равноценны и для ряда других свойств.
12. Кристаллы и свет
Гладкие грани кристаллов отражают свет подобно самому чистому зеркалу. Наряду с другими, некристаллическими телами: водой, стеклом – кристаллы также преломляют свет. То, что свет, падая из воздуха в более плотную среду, или, наоборот, из воды в воздух, преломляется, знакомо каждому. Кто не наблюдал забавной картины «переломанных» ног у человека, стоящего по колено в прозрачной воде.
Преломляясь в стекле или водяных каплях, белый свет разлагается на радужные цвета. Подобно этому свет разлагается и при преломлении в кристаллах, заставляя искусно огранённые чистые и прозрачные бриллианты «играть всеми цветами радуги».
Преломление света во многих кристаллах происходит совершенно так же, как в воде или стекле. Сюда относятся кристаллы с кубической, то есть самой высокой, симметрией, – например, алмаз и каменная соль. Наибольший интерес представляет для науки и промышленности отношение к световому лучу кристаллов не кубической симметрии.
Взглянем на окружающие нас предметы через маленькое окошко, сделанное из куска прозрачного кристалла кальцита (исландского шпата). Мы увидим странную картину – все предметы раздвоятся. На бумаге написано одно слово. Рассматривая его через кристалл, мы видим два слова (рис. 32). Подобным свойством двойного лучепреломления обладают все некубические кристаллы.
Рис. 32. Двойное лучепреломление в кристалле кальцита (исландского шпата).
Очень важно то, что два луча, на которые расщепился свет, попавший на кристалл, проходят через него в ряде случаев не одинаково легко. Иначе говоря, для одного из лучей кристалл более прозрачен, чем для другого. К таким кристаллам принадлежит, например, турмалин.
Если рассматривать написанное на бумаге слово через турмалиновую пластинку, то мы можем не увидеть раздвоения, так как один из лучей будет во много раз слабее другого.
Чем же отличаются друг от друга два луча, на которые расщепился свет после преломления в кристалле?
Прежде чем ответить на этот вопрос, нам придётся сказать несколько слов о природе света.
Напомним сначала читателю понятия электрического и магнитного полей. Мы говорим, что в некоторой части пространства имеется электрическое поле, если на внесённый туда электрический заряд действует сила. В переменном электрическом поле сила с течением времени меняется.
Совершенно так же мы говорим о магнитном поле, – но здесь действуют магнитные силы.
Свет – это быстропеременные электрическое и магнитное поля, тесно связанные между собою и образующие единое электромагнитное поле, распространяющееся волнообразно вдоль луча.
Частота изменения электрической и магнитной силы в световом луче очень велика – сотни тысяч миллиардов колебаний в секунду, скорость распространения электромагнитного поля – скорость света – составляет 300 000 километров в секунду.
Мысль о родственности световых и электрических явлений была высказана ещё в XVIII веке великим русским учёным М.В. Ломоносовым и подтверждена впоследствии многочисленными опытами. Мы не можем здесь останавливаться на том, как это было сделано на самом деле, и поэтому постараемся наглядно разъяснить некоторые особенности светового луча на примере одного воображаемого опыта. Он состоит в следующем.
Предположим, что мы могли бы наблюдать, как ведёт себя очень маленькое, меньшее чем молекулы веществ, электрически заряженное тело, помещённое на пути светового луча. Мы обнаружили бы тогда, что такое тело очень быстро колеблется. Причиною этих колебаний служит электрическая сила, действующая на заряженное тело, помещённое в луч света. Если мы попытаемся определить величину и направление этой силы, то найдём, что электрическая сила с исключительной быстротой меняется и по величине, и по направлению, причём все её возможные направления всегда расположены в плоскости, перпендикулярной лучу; некоторые из них изображены слева на рисунке 33. Какого-либо преимущественного направления в самой этой плоскости нет – электрическая сила в разные моменты времени принимает в ней любые направления.
Так обстоит дело, если электрический заряд помещён в естественный луч света.
Если же мы проведём подобное испытание лучей, разделённых двоякопреломляющим кристаллом, то обнаружим нечто новое: электрическая сила так же меняется по величине и перпендикулярна лучу, но линия направления электрической силы на протяжении всего луча и во все моменты времени остаётся параллельной самой себе (рис. 33, справа). Такие лучи называются линейно-поляризованными.
Рис. 33. Схема расщепления естественного луча света на два линейно-поляризованных луча.
Открытие это было сделано с помощью других, более сложных приёмов, без применения пробного электрического заряда, так как подобные наблюдения поведения тела в луче, конечно, практически неосуществимы, – хотя бы даже из-за слишком быстрых изменений силы.
Теперь мы поймём, в чём же состоит различие световых лучей, разделённых двоякопреломляющим кристаллом. Оказывается, что эти два луча не только линейно-поляризованы, но направления электрической силы в них взаимно перпендикулярны (см. рис. 33).
Кристаллы, подобные турмалину, кроме того ещё поглощают один из этих лучей, – то есть превращают естественный луч света в единственный линейно-поляризованный луч, или, короче, поляризуют свет.
Пропустим теперь свет, поляризованный пластинкой турмалина, через вторую такую же. Если вращать в своей плоскости одну из пластинок, то при определённом их взаимном расположении свет за второй пластинкой полностью гаснет.
Образно выражаясь, кристаллы имеют как бы «щели», и свет через кристалл может проходить лишь тогда, когда электрическая сила направлена вдоль «щели». Если «щели» двух кристаллических пластинок параллельны, то свет проходит, если «щели» скрещены, то луч гаснет (см. схему рис. 34).
Рис. 34. Схема прохождения луча света через две турмалиновые пластинки.
В случае расположения «щелей» под углом во второй пластинке произойдёт разложение по правилу параллелограмма электрической силы линейно-поляризованного луча, вышедшего из первой пластинки. При этом доля света с направлением силы, параллельным «щели», пройдёт, с перпендикулярным – поглотится.
Точно так же турмалин «разлагает» и естественный луч света, который есть не что иное, как набор линейно-поляризованных лучей со всевозможными направлениями электрической силы.
Причиной этого явления, как и всех явлений, связанных с двойным лучепреломлением, служит всё та же анизотропия кристаллов. Дело в том, что в турмалине и других подобных кристаллах есть определённое избранное направление, связанное с кристаллической решёткой, которое и служит как бы «щелью» для электрической силы.
Двоякопреломляющие кристаллы имеют исключительно широкое применение в разнообразнейших оптических установках научно-исследовательских лабораторий наших институтов и заводов. Например, при помощи поляризационного прибора – сахариметра очень быстро и точно определяется концентрация сахара в растворе.
Около 20 лет тому назад был найден недорогой материал, поляризующий свет. Этот материал может быть получен в любых размерах. Называется он поляроидом. Поляроид – это прозрачная целлулоидная плёнка, равномерно покрытая маленькими, в несколько сотых миллиметра, кристалликами сернокислого иод-хинина. Кристаллики расположены в строгом порядке, сходственными гранями в одну сторону. Благодаря такой укладке вся плёнка ведёт себя, как один кристалл.
Где и для чего применяются поляроиды? Нужда в этом материале станет понятной, если сообщить читателю, что при отражении от стекла, воды, металла свет сильно, а иногда и полностью поляризуется.
Так как поляроид пропускает поляризованные лучи лишь при «подходящем» расположении «щели», то, помещая его соответствующим образом, всегда можно погасить или ослабить отражённый свет. А это важно в очень многих случаях.
Поляроидные очки употребляют в полярных странах для того, чтобы не видеть яркого поляризованного света, отражённого от снега. Через поляроид удобно рассматривать картины в галереях: не будут мешать световые блики. Наблюдателю в перископ подводной лодки мешает поляризованный свет, отражённый от поверхности моря, его действие уничтожит поляроид. Большое значение имеет применение поляроида в фотографии и кинематографии, устраняя лишние блики, мешающий блеск и пр.
13. Пьезоэлектричество
Много своеобразных и полезных свойств имеют кристаллы. Пожалуй, к самым замечательным из них принадлежат пьезоэлектрические свойства.
Пьезоэлектрические свойства присущи очень многим кристаллам, однако не всем, а лишь обладающим определённой симметрией. К таким кристаллам относятся, в частности, турмалин, сахар, кварц.
На рисунке 35 изображён кристалл кварца. Главная ось этого кристалла – ось симметрии 3-го порядка. В перпендикулярной плоскости лежат три оси второго порядка.
Рис. 35. Один из способов вырезания пьезокварцевой пластинки из кристалла кварца.
Указанным на рисунке способом из кристалла вырезают пластинку толщиной около 2 см. Мы видим, что она перпендикулярна главной оси, а оси 2-го порядка лежат в её плоскости.
Затем из этой толстой пластинки перпендикулярно одной из осей 2-го порядка вырезают тонкую пластинку, толщиной около 0,5 мм. С полученной таким образом тонкой пьезокварцевой пластинкой (на рисунке справа она сдвинута вниз) можно произвести интересные опыты.
Сдавим пластинку вдоль направления А, перпендикулярного осям симметрии, а к боковым плоскостям пластинки присоединим электрометр – прибор, обнаруживающий электрический заряд (для того чтобы был электрический контакт, эти плоскости надо посеребрить). Оказывается, что под действием сжатия на гранях пластинки появляются равные разноимённые заряды. Если вместо сжатия применяется растяжение, то заряды меняют знаки: там, где при сжатии возникал положительный заряд, при растяжении возникнет отрицательный, и наоборот. Вот это явление – возникновение электрических зарядов под действием давления или растяжения и получило название пьезоэлектричества.
Пьезокварцевые устройства чрезвычайно чутки: электрические приборы позволяют нам измерять заряды, появляющиеся на кварце при самой ничтожной силе, которую другими способами мы не можем измерить. Пьезокварц способен также отмечать очень быстрые изменения давления, что недоступно другим измерительным приборам. Поэтому описанное нами явление имеет огромное практическое значение, как способ электрической регистрации всякого рода механических действий, в том числе звуков. Достаточно легко дунуть на пьезокварцевую пластинку для того, чтобы откликнулся электрический прибор.
Пьезокварцевые пластинки применяют в медицине – ими выслушивают шумы в сердце человека. Подобным же образом их применяют в технике, проверяя работу машин: нет ли каких-либо «подозрительных» шумов. Но и наоборот, пьезокварцем можно измерять очень большие давления. Пьезокварцевые пластинки приносят большую пользу в артиллерии – с их помощью можно измерить, как меняется давление при движении снаряда в стволе орудия. Использование в качестве измерителя малых и больших, медленно и быстро меняющихся давлений не исчерпывает того, что может нам дать пьезокварц.
Нам нужно теперь остановиться на одном механическом свойстве пьезокварцевой пластинки. Как у всякого твёрдого тела, у пьезокварцевой пластинки есть своя частота колебаний, как говорят, собственная частота.
Оттяните или сожмите пружину, а затем отпустите: груз, подвешенный к этой пружине, будет колебаться с определённой собственной частотой. Отклоните маятник; после того, как вы его отпустите, он будет колебаться также с собственной частотой.
Слегка ударьте чем-либо хрустальную вазу, вы услышите мелодичный звон. Как известно, звук – это колебания воздуха, вызываемые быстрым невидимым дрожанием предметов, излучающих звук. Хрустальная ваза после того, как мы её ударили, начала колебаться с собственной частотой.
Пластинка кварца тоже начнёт колебаться – удлиняться и укорачиваться – с собственной частотой, если её ударить. Можно рассчитать, что пластинка толщиной в 1 см будет совершать около 300 000 колебаний в секунду. Наше ухо способно воспринимать звук лишь с частотой примерно от 16 до 20 000 колебаний в секунду. Следовательно, пьезокварц излучает «неслышимые звуки» или, как говорят, ультразвуки[6].
Однако простым щелчком мы заставим пластинку пьезокварца колебаться лишь на мгновенье. Замечательное свойство пьезокварца превращать механическую энергию в электрическую, и обратно, позволяет довольно легко создать незатухающие колебания кварцевой пластинки. На опытах установлено, что при подключении пьезокварца к источнику электрического напряжения пластинка слегка удлиняется или сжимается в направлении А – в зависимости от расположения полюсов источника.
При включении пьезокварцевой пластинки в цепь переменного тока она то расширяется, то укорачивается, то есть приходит в состояние колебаний с частотой тока. Если ток меняет своё направление 10 000 раз в секунду, то и пластинка будет колебаться с той же частотой. Но эти колебания малы, так как происходят не с собственной частотой пластинки, не «в резонанс».
Как получше раскачать качели? Разумеется, толкать их в такт собственным колебаниям. Поступим так же и с пьезокварцем.
Подберём частоту переменного тока так, чтобы она была равна собственной частоте пластинки, иначе говоря, чтобы электрический ток действовал в резонансе с собственными колебаниями пьезокварца. Пластинка придёт при этом в сильные колебания, энергично излучая ультразвуковые волны.
Источник ультразвуковых волн – пьезокварц – нашёл широкое применение в разных областях техники. Исключительное значение имеют эти волны для подводной сигнализации. Они много удобнее обычных звуковых волн, так как распространяются более направленно. Кроме того, ультразвуковой сигнал нельзя «подслушать» ухом.
Как и всякие волны, ультразвук отражается от препятствий. При помощи ультразвука можно измерять глубину моря и вообще определять отдалённость какого-либо препятствия. Для этого надо лишь знать скорость распространения ультразвука и определить время, через которое вернётся обратно сигнал, посланный в сторону препятствия. Трудно переоценить роль скромного маленького кристалла кварца в решении всех этих задач. Пьезокварц, установленный на корабле, непрерывно излучает ультразвук. Если только на пути корабля имеется невидимое подводное препятствие (скала, айсберг), ультразвуковая волна отразится и, вернувшись обратно, «сообщит» о необходимости перемены курса.
Ультразвуковые волны хотя и отражаются от твёрдых тел, но частично также проникают в них. Поэтому ультразвуками можно просвечивать тела и обнаруживать внутренние невидимые пороки. Такой способ был разработан и с успехом применён советским учёным проф. С.Я. Соколовым. Очень важно также применение пьезокварца в радиотехнике, где он помогает сделать более устойчивой (стабилизировать) работу передатчиков.
Из кристаллов, обладающих пьезоэлектрическими свойствами, особо широкое применение имеет именно кварц. Это объясняется механической и химической стойкостью, а также довольно широкой распространённостью кварца. В Физическом институте и Кристаллографическом институте Академии наук под руководством лауреатов Сталинской премии чл.-корр. Академии наук СССР Б.М. Вул и А.В. Шубникова ведутся работы по получению и поискам других кристаллов с замечательными пьезоэлектрическими свойствами. Советскими физиками достигнуты в этой области блестящие успехи, высоко оценённые правительством.
14. Как растут кристаллы
Водяной пар, вода и лёд – это одно и то же вещество, молекулы которого состоят из 2-х атомов водорода и одного атома кислорода. Можно сказать про лёд, что это – твёрдая вода, или про воду, что это – жидкий лёд. Одно и то же вещество существует в трёх состояниях – газообразном, жидком и твёрдом. Вообще говоря, все вещества могут быть с большим или меньшим трудом получены во всех трёх состояних. Сталь и железо плавятся на металлургических заводах, жидкий воздух изготовляется для разных технических целей и развозится по городу в специальных теплоизолированных сосудах, твёрдый углекислый газ – это хорошо знакомый нам «сухой лёд»…
Почти любое вещество может при известных условиях дать кристаллы. Кристаллы можно получить из раствора или из расплава данного вещества, а также из его паров (например, чёрные ромбовидные кристаллы иода легко выпадают из его паров при нормальном давлении без промежуточного перехода в жидкое состояние).
Начните растворять в воде столовую соль или сахар. Не любое количество удастся растворить. При комнатной температуре (20°) вы сумеете растворить в гранёном стакане 70 граммов соли. Дальнейшие добавки соли растворяться не будут и улягутся на дне в виде осадка. Раствор, в котором дальнейшее растворение уже не идёт, называется насыщенным. Если изменить температуру, то изменится и степень растворимости вещества. Всем хорошо известно, что большинство веществ горячая вода растворяет значительно легче, чем холодная.
Представьте себе теперь, что вы приготовили насыщенный раствор, скажем, сахара при температуре 30° и начинаете охлаждать его до 20°. При 30° вы сможете растворить в 100 граммах воды 223 грамма сахара, при 20° растворяется 205 граммов. Тогда при охлаждении от 30 до 20° 18 граммов окажутся «лишними» и, как говорят, выпадут из раствора. Итак, один из возможных способов получения кристаллов состоит в охлаждении насыщенного раствора.
Можно поступить и иначе. Приготовьте насыщенный раствор соли и оставьте его в открытом стакане. Через некоторое время вы обнаружите появление кристалликов. Почему же они образовались? Внимательное наблюдение покажет, что одновременно с образованием кристаллов произошло ещё одно изменение – количество воды убыло. Вода испарилась, и в растворе оказалось «лишнее» вещество. Итак, другой возможный способ образования кристаллов – это испарение раствора.
Как же происходит образование кристаллов из раствора?
Мы сказали, что кристаллы «выпадают» из раствора; надо ли это понимать так, что неделю кристалла не было, а в одно какое-то мгновение он вдруг сразу возник? Нет, дело обстоит не так: кристаллы растут.
Не удаётся, разумеется, обнаружить глазом самые начальные моменты роста. Сначала немногие из беспорядочно движущихся молекул или атомов растворённого вещества собираются в том примерно порядке, который нужен для образования кристаллической решётки. Такую группу атомов или молекул называют зародышем.
Опыт показывает, что зародыши охотнее образуются при наличии в растворе каких-либо посторонних мельчайших пылинок. Всего быстрее и легче кристаллизация начинается тогда, когда в насыщенный раствор помещается маленький кристалл-затравка. При этом выделение из раствора твёрдого вещества будет заключаться не в образовании новых кристалликов, а в росте затравки.
Рост зародыша не отличается, конечно, от роста затравки. Смысл использования затравки состоит в том, что она «оттягивает» на себя выделяющееся вещество и препятствует, таким образом, одновременному образованию большого числа зародышей. Если же зародышей образуется сразу много, то они будут мешать друг другу при росте и не позволят нам получить крупных кристаллов.
Как распределяются на поверхности зародыша новые порции атомов или молекул, выделяющихся из раствора?
Опыт показывает, что рост зародыша или затравки заключается как бы в перемещении граней параллельно самим себе в направлении, перпендикулярном грани. При этом углы между гранями остаются постоянными. (Мы уже знаем, что постоянство углов – важнейший признак кристалла, вытекающий из его решетчатого строения.)
На рисунке 36[7] даны последовательные очертания трёх кристаллов одного и того же вещества при их росте. Подобную картину можно наблюдать в микроскоп. В случае, изображённом слева, число граней во время роста сохраняется. Средний рисунок даёт пример появления новой грани (вверху справа) и снова её исчезновения.
Рис. 36. Слева – рост кристалла с сохранением числа граней; в середине – грани по мере роста кристалла могут зарастать и появляться вновь; справа – обломок кристалла приобретает при росте правильную форму.
Очень важно отметить, что скорость роста граней, то есть скорость перемещения их параллельно самим себе, неодинакова у разных граней. При этом «зарастают» – исчезают именно те грани, которые перемещаются всего быстрее, например левая нижняя грань на среднем рисунке. Наоборот, медленно растущие грани оказываются самыми широкими, как говорят, наиболее развитыми.
Особенно отчётливо это видно на последнем рисунке. Бесформенный обломок приобретает ту же форму, что и другие кристаллы именно из-за анизотропии скорости роста. Вполне определённые грани развиваются за счёт других всего сильнее и придают кристаллу форму, свойственную всем образцам этого вещества.
Очень красивые переходные формы наблюдаются в том случае, когда в качестве затравки берётся шар, а раствор попеременно слегка охлаждается и нагревается. При нагревании раствор становится ненасыщенным, и идёт частичное растворение затравки. Охлаждение ведёт к насыщению раствора и росту затравки. Но молекулы оседают при этом по-иному, как бы отдавая предпочтение некоторым местам. Вещество, таким образом, переносится с одних мест шара на другие.
Сначала на поверхности шара появляются маленькие грани в форме кружков. Кружки постепенно увеличиваются и, соприкасаясь друг с другом, сливаются по прямым рёбрам. Шар превращается в многогранник. Затем одни грани обгоняют другие, часть граней зарастает, и кристалл приобретает свойственную ему форму (рис. 37).
Рис. 37. Как кристаллический шар превращается в правильный октаэдр.
При наблюдении за ростом кристаллов поражает основная особенность роста – параллельное перемещение граней. Получается так, что выделяющееся вещество застраивает грань слоями; пока один слой не достроен, следующий строиться не начинает.
На рисунке 38 показана «недостроенная» упаковка атомов. В каком из обозначенных буквами положений прочнее всего будет удерживаться новый атом, пристроившись к кристаллу? Без сомнения, в А, так как здесь он испытывает притяжение соседей с трёх сторон, тогда как в Б – с двух, а в В – только с одной стороны. Поэтому сначала достраивается столбик, затем вся плоскость, и только потом начинается укладка новой плоскости.
Рис. 38. Как растёт кристалл.
В целом ряде случаев кристаллы образуются из расплавленной массы – из расплава. В природе это совершается в огромных масштабах: из огненной магмы возникли базальты, граниты и многие другие горные породы.
Начнём нагревать какое-нибудь кристаллическое вещество, например каменную соль. До 804° кристаллики каменной соли будут мало изменяться: они лишь незначительно расширяются, и вещество остаётся твёрдым.
Измеритель температуры, помещённый в сосуд с веществом, показывает непрерывный рост температуры при нагревании. При 804° мы обнаружим сразу два новых, связанных между собой явления: вещество начнёт плавиться, и подъём температуры приостановится. Пока всё вещество не превратится в жидкость, температура не изменится; дальнейший подъём температуры – это уже нагревание жидкости. Все кристаллические вещества имеют определённую температуру плавления. Лёд плавится при 0°, железо – при 1527°, ртуть – при –39° и т.д.
Как мы уже знаем, в каждом кристаллике атомы или молекулы вещества образуют упорядоченную упаковку и совершают малые колебания около своих средних положений. По мере нагревания тела скорость колеблющихся частиц возрастает вместе с размахом колебаний.
Это увеличение скорости движения частиц с возрастанием температуры составляет один из основных законов природы, который относится к веществу в любом состоянии – твёрдом, жидком или газообразном. Зная температуру, можно вычислить, с какой средней скоростью движутся частицы вещества. Скорости эти довольно велики – порядка нескольких сот метров в секунду. При нагревании тела, например от нуля до 1000°, скорость частиц возрастает более чем вдвое.
Когда достигнута определённая, достаточно высокая температура кристалла, колебания его частиц становятся столь энергичными, что аккуратное расположение частиц становится невозможным – кристалл плавится.
С началом плавления подводимое тепло идёт уже не на увеличение скорости частиц, а на разрушение кристаллической решётки. Поэтому подъём температуры приостанавливается. Последующее нагревание – это увеличение скорости частиц жидкости.
В интересующем нас случае кристаллизации из расплава явления наблюдаются в обратном порядке: по мере охлаждения жидкости её частицы замедляют своё хаотическое движение; при достижении определённой, достаточно низкой температуры скорость частиц уже столь мала, что некоторые из них под действием сил притяжения начинают пристраиваться одна к другой, образуя кристаллические зародыши. Пока всё вещество не закристаллизуется, температура остаётся постоянной. Эта температура, как правило, та же, что и температура плавления.
О том, как получить из твердеющего расплава крупные кристаллы, мы расскажем в следующей главе. Это не так просто.
Если не принимать специальных мер, то кристаллизация из расплава начнётся сразу во многих местах. Кристаллики будут расти в виде правильных, свойственных им многогранников совершенно так же, как мы это описывали выше. Однако свободный рост продолжается недолго: увеличиваясь, кристаллики наталкиваются друг на друга, в местах соприкосновения рост прекращается, и затвердевшее тело получает зернистое строение. Каждое зерно – это отдельный кристаллик, которому не удалось принять своей правильной формы.
В зависимости от многих условий и, прежде всего, от быстроты охлаждения твёрдое тело может обладать более или менее крупными зёрнами: чем медленнее охлаждение, тем крупнее зёрна. Размеры зёрен кристаллических тел колеблются от миллионной доли сантиметра до нескольких миллиметров. В большинстве случаев зернистое кристаллическое строение тел можно наблюдать в микроскоп. Твёрдые тела обычно имеют именно такое мелкокристаллическое строение.
15. Выращивание кристаллов
Промышленность и наука часто нуждаются в более или менее крупных одиночных кристаллах. Колоссальное значение для техники имеют кристаллы сегнетовой соли и кварца, обладающие замечательным свойством преобразовывать механические действия (например, давление) в электрическое напряжение (стр. 48).
Оптическая промышленность нуждается в крупных кристаллах кальцита, каменной соли, флюорита и др.
Для часовой промышленности очень важны кристаллы рубинов, сапфиров и некоторых других драгоценных камней. Дело в том, что отдельные подвижные части обыкновенных карманных часов делают в час до 20 000 колебаний. Такая большая скорость предъявляет исключительно серьёзные требования к кончикам осей и к подшипникам. Истирание будет наименьшим, когда подшипником для кончика оси диаметром 0,07–0,15 мм служит рубин или сапфир. Искусственные кристаллы этих веществ обладают очень большой прочностью и очень малым трением по отношению к стали. Замечательно, что искусственные камни оказываются при этом лучше таких же, находимых в природе.
Для изучения свойств металлов важно располагать одиночными крупными кристаллами железа, меди и др.
Итак, надо научиться выращивать кристаллы всех этих веществ до нужного размера. Для этой цели существует ряд способов. Можно растить кристаллы и из расплава и из раствора. Основная трудность состоит в том, что, не принимая специальных мер, мы вместо крупного кристалла получим из расплава мелкокристаллическое твёрдое тело, а из раствора – мелкокристаллический осадок на дне сосуда.
Мы уже говорили, что кристаллы начинают расти из раствора тогда, когда он пересыщен растворяемым веществом. А для разных температур количество вещества, насыщающего раствор, различно. Поэтому выращивание из раствора крупных, хорошо огранённых кристаллов возможно лишь в том случае, если температура раствора поддерживается постоянной при помощи термостата. Без этого прибора температура на протяжении суток колебалась бы, во всяком случае, на 3–4°; при таких условиях кристалл не может расти достаточно «аккуратно».
Термостат – это большая ванна, окутанная войлоком, хорошо закрытая и залитая водой. Внутрь термостата ставится сосуд с раствором. Температура поддерживается на нужном уровне при помощи электрической печи. Автоматический регулятор выключает печь, когда температура слишком повышается, и включает её вновь, когда температура падает. Регулировать температуру при помощи этих приборов можно с точностью до 0,01°.
По мере роста кристалла температуру раствора постепенно снижают. Это надо делать для того, чтобы раствор всё время оставался немного пересыщенным, несмотря на непрерывное выделение из него вещества. Опыты показывают, что большие кристаллы удаётся вырастить только при очень медленном охлаждении раствора, примерно на 0,1° в один-два дня. Рост крупных кристаллов продолжается много недель.
Ценнейший вклад в разработку способов выращивания кристаллов сделан русским кристаллографом Г.В. Вульфом.
Очень трудно выращивать крупные кристаллы и из расплавов. Здесь помогает одно своеобразное явление: при определённых условиях из возникших на стенке сосуда зародышей «выживает» только один, развиваясь за счёт своих менее «удачливых» соседей.
Одиночные кристаллы легкоплавких металлов получают обычно следующим способом (см. рис. 39). Металл расплавляют в стеклянной пробирке А с оттянутым концом. Пробирка подвешена на нити внутри вертикальной цилиндрической печи Б. При помощи нити пробирку медленно опускают вниз. Оттянутый конец постепенно выходит из печи, и металл начинает застывать. При этом из всех кристалликов выживает один; по мере опускания пробирки он продолжает расти вдоль её оси. В конце концов весь металл застывает в виде одиночного кристалла.
Рис. 39. Получение одиночных кристаллов из расплава.
А вот каким образом выращивают тугоплавкие кристаллы рубина лауреаты Сталинской премии чл.-корр. АН А.В. Шубников и С.К. Попов. Мелкий порошок вещества сыплется струёй через пламя. Порошинки плавятся: крошечные капли падают на тугоплавкую подставку. Здесь начинается кристаллизация, и опять-таки из множества кристалликов вырастает лишь один. Наши учёные нашли способ получения длинных кристаллических стержней драгоценного камня, столь необходимого для производства часов и других точных механизмов.
16. «Твёрдая жидкость»
Если плавление всегда начинается при одной и той же температуре, то ход кристаллизации несколько более капризен. Обычно расплав удаётся переохладить ниже температуры плавления. В некоторых случаях это переохлаждение может быть настолько значительным, что вещество, постепенно загустевая, превращается в твёрдое на ощупь, но не кристаллическое тело – атомам так и не удаётся построиться в правильном порядке.
Часто бывает и так, что переохлаждение (то есть уменьшение температуры ниже температуры плавления) удаётся провести лишь на несколько градусов. Затем кристаллизация происходит, причём в отличие от обычного случая она происходит очень быстро, сразу по всему объёму. Переохлаждённое состояние иногда является в высшей степени неустойчивым состоянием. Достаточно слегка встряхнуть сосуд или сделать доступной поверхность жидкости для пылинок, чтобы мгновенно началось образование кристалликов.
При наличии затравки кристаллизация, как правило, начинается «вовремя». Такими затравками могут служить пылинки исследуемого твёрдого вещества, которые имеются в воздухе над затвердевающим веществом. Поэтому кристаллизация в открытом сосуде происходит обычно без переохлаждения.
Одни вещества с трудом переохлаждаются, другие, напротив, кристаллизуются с трудом. К первым принадлежат металлы, ко вторым – такие вещества, как глицерин, стекло, сахарная карамель. Эти последние всегда получаются при охлаждении в виде некристаллических тел. Иногда их кристаллизация обнаруживается после многих лет хранения. Такая запоздалая кристаллизация стекла называется расстекловыванием, кристаллизация карамели – засахариванием.
Что же представляет собой стекло? Можно ли безоговорочно называть его твёрдым телом?
Стекло сохраняет свою форму – это свойство твёрдого тела. Но по расположению своих молекул стекло – жидкость. В расположении молекул стекла нет порядка, даже в небольшом объёме отсутствует упорядоченное решетчатое строение. Тела типа стекла – «твёрдые жидкости» – называют аморфными телами.
В противоположность кристаллам, аморфные вещества не имеют определённой температуры плавления. Стекло не плавится, а размягчается. При нагревании кусок стекла сначала становится из твёрдого мягким: его легко можно гнуть или растягивать; при более высокой температуре кусок начинает изменять свою форму под действием собственной тяжести. По мере нагревания густая вязкая масса стекла принимает форму того сосуда, где оно лежит. Эта масса сначала густа, как мёд, потом – как сметана, и, наконец, она становится почти такой же маловязкой жидкостью, как вода. При всём желании мы не можем здесь указать определённой температуры перехода твёрдого тела в жидкое. Причины этого лежат в коренном отличии строения стекла от строения кристаллических тел.
Стекло не плавится, так как жидкости не приходится плавиться. Плавление – это переход от расположения молекул в строгом порядке к беспорядочному расположению. А в твёрдом стекле молекулы и так расположены беспорядочно. Значит, повышение температуры стекла лишь увеличивает размах колебаний его молекул, даёт им постепенно всё большую и большую свободу перемещения. У стекла и подобных ему веществ нет основного свойства «настоящего» твёрдого кристаллического тела, в отношении которого мы можем уверенно сказать: «до такой-то температуры оно твёрдое, а вот теперь наряду с твёрдым телом начинает появляться – в результате его расплавления – жидкость».
17. Истинно твёрдые тела построены из кристаллов
Итак, подавляющее большинство твердых тел имеет кристаллическое строение. Металлы и камни состоят из маленьких кристалликов – зёрен, видимых большей частью только в микроскоп.
Свойства кристалликов, их размер, их взаимное расположение определяют свойства всего твёрдого тела. Советские учёные затратили много труда на выяснение этой связи и достигли крупнейших успехов.
Постараемся дать читателю представление об огромной важности этих исследований для нашей техники.
Всякая обработка металла сказывается на его зёрнах. Вот получен кусок литого металла: зёрна его расположены беспорядочно, размер их довольно велик. Из металла делают проволоку, протягивают её. Как ведут себя при этом кристаллические зёрна?
Исследования показали, что изменение формы твёрдого тела при протягивании проволоки или другой механической обработке вызывает раздробление кристаллических зёрен. Одновременно под действием механических сил в их расположении появляется некоторый порядок.
О каком порядке может идти здесь речь? Ведь обломки зёрен совершенно бесформенны.
Это верно, внешняя форма обломка может быть какой угодно, но обломок кристалла есть всё же кристалл: ионы в его решётке упакованы так же правильно, как и в хорошо огранённом кристалле. Поэтому в каждом обломке можно указать, как расположена его элементарная ячейка. До обработки ячейки строго упорядочены только в пределах каждого отдельного зерна – общего порядка обычно нет. После же обработки зёрна выстраиваются так, что в расположении их ячеек проступает некоторый общий порядок, называемый текстурой, например, диагонали ячеек всех зёрен устанавливаются примерно параллельно направлению обработки.
На рисунке 40, б текстура изображена на примере упорядоченности некоторых определённых отмеченных нами в зёрнах плоскостей – плоскостей наиболее плотного заполнения ионами, которые обозначены рядами точек.
Рис. 40. Отсутствие текстуры (слева) и её наличие (справа).
Явление текстуры было впервые обнаружено советскими учёными – проф. Н.Е. Успенским и чл.-корр. АН С.Т. Конобеевским.
Различные виды обработки (прокат, ковка, протяжка) приводят к текстурам различных типов. В одних случаях зёрна поворачиваются так, что их элементарные ячейки выстраиваются вдоль направления обработки диагональю, в других случаях – ребром куба и т.д. Чем совершеннее прокат или протяжка, тем совершеннее и текстура кристаллических зёрен металла. Наличие текстуры очень сильно влияет на механические свойства изделия. Изучение расположения и величины кристаллических зёрен в металлических изделиях пролило свет на сущность механической обработки металлов и указало, как следует правильно вести её.
С перестройкой кристаллических зёрен связан и другой важнейший технический процесс – отжиг. Если нагревать прокатанный или протянутый металл, то при достаточно высокой температуре начинается рост новых кристаллов за счёт старых. В результате отжига текстура постепенно разрушается; новые кристаллы располагаются беспорядочно. По мере повышения температуры (или просто при увеличении длительности отжига) новые зёрна растут, старые исчезают. Зёрна могут вырасти до видимых глазом размеров. Отжиг резко меняет свойства металла. Металл становится более пластичным, менее твёрдым. Это происходит потому, что зёрна становятся крупнее и текстура исчезает.
Наиболее сложным и в то же время наиболее интересным является процесс закалки стали, сущность которого была открыта «отцом русской металлургии» Дмитрием Константиновичем Черновым.
Мы рассказывали на стр. 37 о разных упаковках, построенных из одних и тех же атомов. Каждая из упаковок имеет «излюбленный» промежуток температур, в котором она устойчиво существует. К таким веществам принадлежит и железо. При высоких температурах порядка 1000° атомы железа образуют гранецентрированную решётку, при нормальной температуре железу свойственна объёмноцентрированная решётка (см. выше рис. 29). Если температуру понижать медленно, то атомы железа перестраивают свою решётку и образуют при комнатной температуре нормальную упаковку. Иначе будет происходить этот процесс, если температуру снизить быстро, например, бросить раскалённый кусок стали в холодную воду. В этом случае перестройка атомов не успевает произойти, и мы получаем при низкой температуре то строение, которое обычно свойственно лишь высокой температуре.
Для чего же это нужно? А нужно это по той причине, что железо, в котором атомы упакованы в гранецентрированной решётке, имеет значительно лучшие механические свойства: закалённая сталь (железо с небольшой примесью углерода и некоторых других веществ) обладает во много раз большей твёрдостью и крепостью, чем незакалённая.
Зернистое кристаллическое строение определяет свойства не только металлов, но и других твёрдых тел.
Рост дерева сопровождается образованием, ростом и изменением расположения кристалликов целлюлозы.
Свойства молочных продуктов определяются изменениями кристаллов вещества, называемого лактозой.
Прочность каучука зависит от количества в нём кристаллов.
Число примеров легко можно умножить, охватив почти все отрасли народного хозяйства, так как, за небольшими исключениями, все твёрдые тела, окружающие нас, либо одиночные кристаллы, либо состоят из мелких кристаллов. Кристаллическому строению твёрдых тел и влиянию этого строения на их свойства посвящено много книг.
Если слово «кристалл», связанное часто с чем-то редким, драгоценным, исключительным, стало для читателя более знакомым и близким, если читатель понял, что мы живём в мире кристаллов, и если у читателя появился интерес к области изучения свойств, структуры и способов получения кристаллов – области, принесшей уже немало пользы нашей Родине, – то задача этой маленькой книжки выполнена.
Примечания
1
Пробелы между инициалами, а также в общераспространенных сокращениях т.д., т.е. и подобных здесь и далее пропущены, чтобы избежать появления разрывов строк посреди тесно связанных между собой сочетаний слов. – Прим. авторов fb2-документа.
(обратно)2
Фигура 10, а обладает ещё так называемым центром симметрии, совпадающим с центром организма. Центр симметрии характеризуется тем, что в каком бы направлении мы ни провели через него прямую линию, всегда точки на этой прямой, равноотстоящие от центра, будут принадлежать сходным частям тела.
(обратно)3
Этот рисунок, как и ряд других, заимствован из интереснейшей книги А.В. Шубникова «Симметрия», которую мы рекомендуем подготовленному читателю.
(обратно)4
Подробнее о строении атома см., например, Г.А. Зисман «Мир атома», «Научно-популярная библиотека».
(обратно)5
См. книгу проф. А.И. Китайгородского «Строение вещества», «Научно-популярная библиотека».
(обратно)6
Об ультразвуках рассказывается в брошюре «Научно-популярной библиотеки»: проф. Б.Б. Кудрявцев, «Неслышимые звуки».
(обратно)7
Этот рисунок заимствован из книги «Образование кристаллов» члена-корр. АН Шубникова А.В., которому мы обязаны детальными исследованиями механизма роста кристаллов.
(обратно)

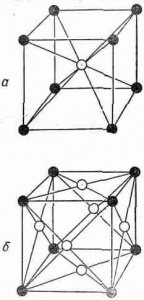
Комментарии к книге «Кристаллы», Александр Исаакович Китайгородский
Всего 0 комментариев