Леонид Иванович Пономарев По ту сторону кванта
От автора
Бытует упорное мнение, что в науке есть факты, которые начинающим с нею знакомиться знать рано, а сообщать искушенным в ней — стыдно. Чаще всего об этом вспоминают, когда пытаются объяснить строение атома. Быть может, поэтому до сих пор не написана книга о квантовой механике достаточно строгая, чтобы не обидеть знатока, достаточно простая, чтобы не отпугнуть новичка, и вместе с тем интересная им обоим.
Эта книга не для знатоков, хотя и они найдут здесь несколько неожиданных фактов. Она для тех, кто заканчивает школу, и для тех, кто пытается посмотреть на мир немного шире, чем позволяет им их специальность — необходимо узкая, чтобы быть продуктивной.
В предлагаемой книге история атома рассказана вполне строго. Но строгость в ней не самоцель: как правило, нам интересны не только сами факты, но и их толкование и обстоятельства, при которых они открыты. Поэтому главное в книге — эволюция идей и понятий атомной физики, образующих единую систему — простую и гармоничную. Именно эта внутренняя красота была побудительной причиной появления книги. Я буду считать свою работу не напрасной, если прочитавший ее почувствует силу логических построений квантовой механики и красоту их неожиданно простых следствий.
1-я часть Факты
Глава первая
Атомы ♦ Лучи ♦ Кванты
На вопрос «Что такое квантовая механика?» ответить осмысленно могут немногие. Все остальные попросту убеждены, что квантовая механика очень трудная наука. Пожалуй, это неправда, но такая уверенность укоренилась не без причин. Логика квантовой механики, по существу, проста, и все же, чтобы привыкнуть к ней, необходимо освоить предварительно несколько понятий, на первый взгляд ничем не связанных между собой. В стройную систему эти понятия складываются не сразу, а лишь при длительном сопоставлении и размышлении.
На это нужны время и силы.
Если вы о квантовой механике знаете только то, что она «…разрешила вековую загадку таинственной страны микромира», и еще: «…перевернула все наше мировоззрение», вы знаете о ней примерно столько же, сколько знают туристы о незнакомой стране, путешествующие по ней, не изучив предварительно ее культуру и язык: они видят вокруг людей, которые спешат, смеются, машут руками, но цель их движений туристам неизвестна, а радость — непонятна. В результате же память путешественников сохраняет только яркие пятна реклам на незнакомом языке.
Квантовая механика — обширная страна с богатой и глубокой культурой. Однако, чтобы приобщиться к ней, необходимо изучить ее язык. Язык этот своеобразен, но, в сущности, ничем не отличается от любого иностранного языка. Как и всякий язык, его нельзя усвоить единым усилием воли — необходима система. Для начала нужно просто запомнить несколько ходовых понятий и пытаться строить из них простые фразы, не очень заботясь о строгости грамматических конструкций. Лишь впоследствии придут та легкость и уверенность владения языком, которые приносят с собой ощущение удовлетворения и радости чистого знания.
Вероятно, почти у всех изучение квантовой механики напоминает процесс растворения соли в воде: вначале брошенные в стакан мелкие кристаллы бесследно исчезают, но затем наступает момент, когда достаточно бросить еще один кристаллик, чтобы из раствора на месте этой маленькой затравки стал постепенно расти большой кристалл.
В дальнейшем мы проследим истоки, идеи и находки квантовой механики, объясним систему ее понятий и образов и, наконец, расскажем о приложениях. Но вначале мы должны растворить в своем сознании несколько кристаллов первоначальных понятий, усвоить те несколько необходимых слов, без которых невозможно построить ни одной осмысленной «квантовой фразы». Иногда это бывает утомительно. Но ведь и перед полетом в космос необходимо бегать, приседать и крутиться на центрифуге, а это далеко не самое романтичное занятие. «Для того чтобы мышца развивалась, она должна уставать», — любил повторять знаменитый физиолог Сеченов. Раз навсегда запретив себе утомляться, нельзя понять волнение поисков, радость открытий и тот бескорыстный интерес к важным деталям, который создал, в сущности, не только квантовую механику, но и всю науку.
Все это сказано здесь, конечно, не затем, чтобы запугать читателя трудностями в самом начале пути, но посудите сами: ведь не существует таблеток, проглотив которые человек просыпается наутро профессором физики. Для начала мы усвоим три идеи, которые лежат в основе всей атомной физики: атомы, лучи, кванты.
Атомы
Итак, что такое квантовая механика? Квантовая механика — это наука о строении и свойствах атомных объектов и явлений.
В этом определении все верно, и тем не менее бесполезность его очевидна, пока мы не объясним понятий, которые в него входят. Действительно: что, например, означают слова «свойства атомных объектов», то есть атомов?
Если речь идет, скажем, о спелом арбузе, такого вопроса не возникает, — свойства его вполне определяются нашими пятью чувствами: он круглый, тяжелый, сочный, пахнет свежестью и с хрустом раскалывается под ножом. Но как быть с атомами (из которых, кстати, этот арбуз состоит)? Ведь непосредственно их нельзя ни увидеть, ни потрогать. Это не означает, что атомов вообще нет, а просто свидетельствует о том, что свойства их совсем другие, чем свойства целого арбуза.
Сейчас мало осталось людей, для которых реальность атомов менее очевидна, чем движение Земли вокруг Солнца. Почти у каждого с этим понятием связано интуитивное представление о чем-то маленьком и неделимом. И все же, какой смысл вкладывает в понятие «атом» нынешняя физика? Как это понятие возникло, что понимали под ним древние, как оно потом развивалось и почему только квантовая механика наполнила реальным содержанием эту умозрительную схему?
Творцом идеи атома принято считать Демокрита, хотя история упоминает также учителя его Левкиппа и — менее уверенно — древнеиндийского философа Канаду, который жил незадолго до нашей эры и учил примерно тому же. («Канада» в переводе с санскрита означает «пожиратель атомов».) По мнению Канады, бесконечная делимость материи — абсурд, поскольку в этом случае горчичное зерно равно горé, ибо «…бесконечное всегда равно бесконечному». Мельчайшая частичка в природе, учил Канада, — это пылинка в солнечном луче; она состоит из шести атомов, из которых каждые два соединены попарно «волею бога или еще чем-либо».
О самом Демокрите мы знаем мало. Известно, что родился он в Абдере на фракийском берегу Средиземного моря; кроме Левкиппа, учился у халдеев и персидских магов, много путешествовал и много знал; прожил около ста лет и в 370 году до н. э. был похоронен за общественный счет гражданами родного города, которые его глубоко почитали. Последующие поколения художников изображали Демокрита высоким, с короткой бородой, в белом хитоне и в сандалиях на босу ногу.
Легенда рассказывает, что однажды Демокрит сидел на камне у моря, держал в руке яблоко и размышлял: «Если я сейчас это яблоко разрежу пополам, у меня останется половина яблока; если я затем эту половину снова разрежу на две части, остается четверть яблока; но если я и дальше буду продолжать такое деление, всегда ли у меня в руке будет оставаться 1/8, 1/16 и т. д. часть яблока? Или же в какой-то момент очередное деление приведет к тому, что оставшаяся часть уже не будет обладать свойствами яблока?» Впоследствии оказалось, что сомнение Демокрита (как почти всякое бескорыстное сомнение) содержало долю истины. По зрелом размышлении философ пришел к выводу, что предел такого деления существует, и назвал эту последнюю, уже неделимую, частицу атомом, а свои умозаключения изложил в книге «Великий диакосмос». Послушайте, это написано более двух тысяч лет назад!
«Начало вселенной — атомы и пустота, все же остальное существует лишь в мнении. Миров бесчисленное множество, и они имеют начало и конец во времени. И ничто не возникает из небытия, не разрешается в небытие. И атомы бесчисленны по величине и по множеству, носятся же они во вселенной, кружась в вихре, и таким образом рождается все сложное: огонь, вода, воздух, земля. Дело в том, что последние суть соединения некоторых атомов. Атомы же не поддаются никакому воздействию и неизменяемы вследствие твердости».
Доказать эти утверждения Демокрит не мог — он предлагал поверить на слово. Но ему не поверили, и не поверил прежде всего Аристотель, его великий современник. Когда умер Демокрит, Аристотелю, будущему учителю Александра Македонского, было 14 лет. В расцвете сил он был худощав, невысок ростом, изыскан, а уважение к нему переходило часто все разумные границы. Конечно, для этого были основания: ведь он владел всеми знаниями той эпохи.
Аристотель учил обратному: процесс деления яблока можно продолжить бесконечно, по крайней мере в принципе. Это учение стало господствующим, Демокрита забыли на многие века, а его сочинения тщательно уничтожались.
Бессмысленно винить древних за такой выбор — для них обе системы были равно разумны и приемлемы: цель своей науки они видели не в практических применениях (они их стыдились), а в том, чтобы с помощью умозрения достигнуть того чувства гармонии мира, которое сообщает человеку всякая законченная философия.
Чтобы освободиться от заблуждений великого авторитета, потребовались две тысячи лет. В XVII веке впервые возникла наука физика и вскоре вытеснила древнюю натуральную философию. Эта новая наука опиралась не на чистое умозрение, а на опыт и математику. Окружающую природу стали изучать: не просто наблюдать, а ставить сознательные опыты для проверки гипотез и записывать результаты этой проверки в виде чисел. Идея Аристотеля не выдержала такого испытания, а гипотеза Демокрита выдержала, хотя, как мы увидим в дальнейшем, от ее первоначального вида почти ничего не осталось.
После двадцати веков забвения идею об атомах возродил к жизни французский философ и просветитель Пьер Гассенди (1592–1655) и за это подвергся гонениям церкви: традиции средневековья преследовали не только гипотезы, но и строгие факты науки, если они противоречили общепризнанным догматам. Тем не менее атомную гипотезу приняли все передовые ученые того времени. Даже Ньютон, с его знаменитым девизом «Гипотез не строю», поверил в нее и изложил по-своему в конце третьего тома «Оптики».
Однако до тех пор, пока гипотезу об атомах не подтвердили опытом, она оставалась, несмотря на всю свою привлекательность, только гипотезой.
Первое наглядное доказательство тому, что прав Демокрит, а не Аристотель, обнаружил шотландский ботаник Роберт Браун (1773–1858). В 1827 году это был уже немолодой директор ботанического отдела Британского музея. В юности он провел четыре года в экспедициях по Австралии и привез оттуда около 4 тысяч видов растений. Двадцать лет спустя он все еще продолжал изучать коллекции экспедиции. Летом 1827 года Браун обратил внимание на то, что мельчайшая пыльца растений произвольно двигается в воде под действием неизвестной силы. Он тут же опубликовал статью, заглавие которой очень характерно для той неторопливой эпохи: «Краткий отчет о микроскопических наблюдениях, проделанных в июне, июле и августе 1827 года над частицами, содержащимися в пыльце растений; и о существовании активных молекул в органических и неорганических телах».
Сначала его опыт вызвал недоумение. Это недоумение усугубил сам же Браун, пытаясь объяснить явление некой «живой силой», которая якобы присуща органическим молекулам. Естественно, такое прямолинейное объяснение «брауновского движения» не удовлетворило ученых, и они предприняли новые попытки для его изучения. Среди них особенно много сделали голландец Карбонэль (1880) и француз Гуи (1888). Они поставили тщательные опыты и выяснили, что брауновское движение не зависит от внешних воздействий: времени года и суток, добавления солей, вида пыльцы и «…наблюдается одинаково хорошо ночью в деревне и днем вблизи многолюдной улицы, где проезжают тяжелые экипажи».
Надо сказать, что первое время странное движение не обратило на себя должного внимания. Большинство физиков о нем вообще не знало, а те, кто знал, считали его неинтересным, полагая, что это явление аналогично движению пылинок в солнечном луче. Лишь сорок лет спустя, вероятно, впервые оформилась та мысль, что видимые в микроскоп беспорядочные движения пыльцы растений вызваны случайными толчками маленьких, невидимых частиц жидкости. После работ Гуи в этом убедились почти все, и гипотеза об атомах приобрела множество последователей.
Конечно, и до Брауна немало людей твердо верили, что все тела построены из атомов. Для них некоторые свойства атомов были очевидны уже без дальнейших исследований. В самом деле, все тела в природе, несмотря на огромные различия между собой, имеют вес и размеры. Очевидно, у их атомов также должны быть и вес и размеры. Именно эти их свойства положил в основу своих рассуждений Джон Дальтон (1766–1844) — скромный учитель математики и натуральной философии в городе Манчестере и великий ученый, определивший развитие химии примерно на сто лет.
У сторонников атомистики сразу же возникал вопрос: а не означает ли многообразие тел такого же многообразия атомов, как утверждал Демокрит? Оказалось, это неверно. Джон Дальтон, подробно исследуя химические реакции, в 1808 году впервые четко сформулировал понятие о химическом элементе: элемент — это вещество, которое состоит из атомов одного типа.
Выяснилось, что элементов не так уж много: в то время их знали около 40 (сейчас 104). Все остальные вещества построены из молекул — разнообразных сочетаний атомов. Сами атомы элементов также различаются между собой. Одно из таких различий нашли довольно быстро: им оказалась масса атома. Приняв за единицу атомный вес легчайшего газа — водорода, удалось через него выразить атомный вес остальных элементов. В этих единицах атомный вес кислорода равен 16, железа — 56 и т. д. Так в науку об атоме впервые проникли числа — событие важности необычайной.
Однако по-прежнему об абсолютных размерах и массах атомов ничего не было известно.
Одна из первых научных попыток оценить величину атомов принадлежит Михаилу Васильевичу Ломоносову (1711–1765). В 1742 году он заметил, что искусные ювелиры могут раскатать лист золота до толщины в одну десятитысячную долю сантиметра (10–4 см), и, значит, атомы золота никак не могут превышать этой величины. В 1777 году Бенджамен Франклин (1706–1790) заметил, что ложка масла (ее объем равен примерно 5 см3), вылитого на поверхность спокойной воды, растекается по ней на площади в 0,2 гектара, то есть 2 тыс. кв. м или 2 · 107 см2.
Очевидно, что диаметр молекулы в этом случае не может превышать величину d = 5 см3/2 · 107 см2 = 2,5 · 10–7 см (то есть две десятимиллионные доли сантиметра).
Однако первой удавшейся попыткой оценить размер и массу атомов следует считать работу преподавателя физики Венского университета Йозефа Лошмидта (1821–1895). В 1865 году он нашел, что размеры всех атомов примерно одинаковы и равны 10–8 см, а вес атома водорода составляет всего 10–24 г.
Впервые мы встречаемся здесь с такими малыми величинами, и у нас просто нет необходимых навыков, чтобы их осмыслить. Самое большее, на что мы способны, это сказать: тонкий как волос, или легкий как пух. Но толщина волоса (10–2 см) в миллион раз больше самого большого атома, а пуховая подушка — это уже нечто весомое и вполне реальное. Чтобы хоть как-то заполнить провал между здравым смыслом и малостью этих чисел, обычно все же прибегают к сравнению.
Если взять «атом арбуза», с упоминания о котором мы начали рассказ, и вишню диаметром в 1 см и одновременно их увеличивать, то в тот момент, когда вишня станет величиной с земной шар, «атом арбуза» начнет походить — и весом и величиной — на хороший арбуз.
Однако относительная ценность таких сравнений, по-видимому, весьма невелика, поскольку для столь малых объектов само понятие размера теряет свой первичный смысл. Поэтому лучше с самого начала оставить попытки представить себе подобные числа наглядно. Несмотря на свою чрезвычайную малость, числа эти не произвольны: важно понимать, что именно такие малые диаметры и массы нужно приписать атомам, чтобы свойства веществ, которые из этих атомов состоят, оказались именно такими, какими мы их наблюдаем в природе.
Лошмидт получил эти числа, изучая взаимную диффузию газов, то есть их способность смешиваться при соприкосновении. (С этим явлением все мы хорошо знакомы, хотя обычно и не вспоминаем о нем, когда нас вдруг остановит запах скошенной травы.) Лошмидт использовал при этом молекулярно-кинетическую гипотезу — предположение, что газы состоят не просто из молекул, но из движущихся молекул. С помощью формул кинетической теории газов он установил также среднее расстояние между молекулами в газе: оно оказалось примерно в 10 раз больше диаметра атомов.
Если газ превратить в жидкость, то его объем уменьшится приблизительно в тысячу раз, а значит, расстояния между атомами уменьшатся в 10 раз. Это означает, что в жидкости и в твердом теле атомы прижаты вплотную друг к другу. Вместе с тем они не перестают двигаться — просто их движение теперь стеснено и подчиняется другим законам, чем законы движения молекул газа.
Лучи
Железо, как и всякое вещество, состоит из атомов. Если один конец железного лома сунуть в печь, он, разумеется, начнет нагреваться. С точки зрения кинетической теории это означает, что атомы железа начнут двигаться быстрее (это можно обнаружить, коснувшись пальцами другого конца лома). Итак, теплота есть энергия движущихся атомов. Однако это далеко не все.
Нагревая лом, мы наблюдаем поразительное явление: с повышением температуры в печи постепенно меняется цвет нагретого железа: от вишнево-красного до ослепительно белого. Причем к лому теперь нельзя не только прикоснуться, но и просто подойти близко. Последнее уже непонятно, если пользоваться только представлением о движении атомов; действительно, мы не касались лома, атомы железа не ударялись о нашу руку — почему же нам стало жарко?
Здесь мы впервые сталкиваемся с положением, о котором предупреждали в самом начале. Мы должны ввести новое понятие, которое на первый взгляд никак не связано с идеей атома. Это понятие — излучение.
Мы говорим: лучи солнца осветили поляну. Значит, свет — это излучение. Но мы говорим также: греться в лучах солнца. Следовательно, и тепло может распространяться в виде лучей. Вообще с излучением мы имеем дело постоянно: когда сидим у костра, смотрим на закат, вращаем ручку настройки приемника или же делаем рентгеновский снимок грудной клетки. Все виды излучений: тепло, свет, радиоволны и рентгеновы лучи — различные проявления одного и того же электромагнитного излучения. Однако мы все-таки различаем виды излучений не только качественно и субъективно, но и строго количественно. По какому признаку? У электромагнитного излучения их много, но нам особенно важен сейчас один — его волновая природа.
Вероятно, в тысяче и одном учебнике свойства волны объяснены лучше и подробнее, чем мы это сделаем сейчас. Однако мы все-таки напомним их по той же самой причине, по которой даже в солидные академические словари иностранных слов помещают вполне понятные обиходные слова.
«Волна» — одно из самых необходимых слов физики.
Каждый представляет ее себе по-разному: один сразу же видит волны от брошенного в пруд камня, другой — синусоиду. Поскольку синусоиду рисовать проще — воспользуемся ею. У этой схематической волны четыре свойства: амплитуда A, длина волны — λ, частота ν и скорость распространения v.
Амплитуда волны — это наибольшая ее высота. Что такое длина волны — понятно из рисунка. А скорость распространения, по-видимому, особых пояснений не требует. Чтобы выяснить, что такое частота, проследим за движением волны в течение одной секунды.
За это время она пройдет расстояние v сантиметров (то есть ее скорость равна v см/сек). Подсчитав, сколько длин волн уместилось на этом отрезке, мы найдем частоту волны (или излучения):
ν = v/λ.
Важнейшее свойство волн — их способность интерферировать. В чем его суть?
Допустите такую возможность: вы с силой бросаете горох в стену так, что он довольно далеко от нее отскакивает. Пусть вам удалось бросать его равномерно, скажем, так, чтобы на один квадратный сантиметр стены в 1 сек. попадало 8 горошин. Теперь мысленно в любом месте между вами и стеной выберите площадку в 1 см2 и сосчитайте число горошин, пролетающих через нее в обе стороны. Ясно, что оно всегда будет равно 16.
А что будет, если от стены отразится волна?
Рассмотрим внимательно рисунок на следующей странице: вначале волна беспрепятственно распространяется вправо (А); затем она достигает стены и отражается (Б); но мы увидим не две отдельные волны, а результат сложения обеих волн: прямой и отраженной. Результат зависит от того, как волна соприкоснулась со стеной (В). Иногда она падает так неудачно, что полностью сама себя гасит (Г, Д). Именно такая способность волны гасить саму себя называется интерференцией. По этому признаку волну всегда можно безошибочно отличить от потока частиц.
Еще одно свойство волны, которое отличает ее от частиц, — дифракция или, говоря попросту, способность волны загибать за угол, к чему частица явно не способна. (Отметим только, что размеры препятствия должны быть сравнимы с длиной волны. И еще: если препятствие невелико, то благодаря дифракции волна может разделиться на две, обойти его с двух сторон и, складываясь снова, погасить себя точно так же, как при сложении прямой и отраженной волны.)
Именно таким способом, обнаружив интерференцию и дифракцию у рентгеновского и других видов излучения, установили, что все они волны, только разной длины. Длина волны излучения и есть тот основной признак, по которому мы различаем виды электромагнитного излучения количественно.
Наибольшая длина у радиоволн: от нескольких километров до нескольких сантиметров.
У тепловых лучей она короче — от 1 см до 10–2 см.
Еще короче волны видимого света, примерно 4 · 10–5–8 · 10–5 см.
Самые короткие волны у рентгеновых лучей — 10–7–10–9 см.
Все эти виды излучения распространяются с одной и той же скоростью — со скоростью света с = 3 · 1010 см/сек. Отсюда по формуле ν = с/λ очень просто вычислить частоту каждого вида излучения. Очевидно, для рентгеновых лучей она будет наибольшей, а для радиоволн — наименьшей.
Очень важно отдавать себе отчет в том, что, конечно, любое излучение — это не синусоида, изображенная на рисунке, а физический процесс, основные характеристики которого (например, периодичность), по счастью, можно выразить на языке таких простых моделей.
У каждого вида излучения свои особенности. Сосредоточимся пока на том его виде, который для нас наиболее важен и привычен, — на солнечном излучении. А поскольку оно подчиняется тем же законам, что и любой вид излучения, то в дальнейшем это поможет нам понять законы теплового излучения, которое оказалось столь важным в истории квантовой механики.
Когда вы греетесь на солнце, вы, наверное, не задумываетесь над тем, из каких волн состоят его лучи. Иногда, правда, вы спрашиваете себя, отчего в горах бывают солнечные ожоги и почему нельзя загореть вечером. Исаак Ньютон (1643–1727) жил в Англии, где солнца не так уж много, но все-таки он задумался над тем, из чего состоит солнечный свет. Вслед за пражским профессором медицины Маркусом Марци он поставил опыт, знакомый теперь каждому школьнику. Пропустив луч солнца сквозь призму, он обнаружил за ней на стене радугу — спектр солнечного луча.
Каждому цвету радуги-спектра соответствует своя волна солнечного излучения: самая длинная у красного цвета — 7 · 10–5 см; у зеленого — 5 · 10–5; у фиолетового — 4 · 10–5. Кроме видимых лучей, в солнечном спектре есть, конечно, и другие, в частности инфракрасные лучи (их длины волн еще больше, чем у красных) и ультрафиолетовые (их волны короче фиолетовых). Следовательно, частота ультрафиолетовых лучей наибольшая, а инфракрасных — наименьшая.
Относительная яркость различных цветов в спектре излучения неодинакова и зависит от температуры излучающего тела: например, в солнечном излучении больше всего желтых лучей. Таким образом, спектр любого излучения показывает, во-первых, какие лучи в нем есть и, во-вторых, сколько их там.
Проходя через атмосферу Земли, солнечный луч изменяет свой спектральный состав, потому что разные лучи солнечного спектра поглощаются атмосферой неодинаково, в частности сильнее всего ультрафиолетовые лучи. На горе слой воздуха меньше, доля ультрафиолетовых лучей больше, и потому обгореть там можно быстрее, чем в долине.
И хотя сам по себе этот факт хорошо известен, мы все-таки напомнили эту важную для дальнейшего деталь: причина солнечных ожогов — ультрафиолетовые лучи, именно они, а не зеленые или красные. Но чтобы обжечь, нужно, во всяком случае, затратить какую-то энергию. Следовательно, наибольшую энергию несут с собой волны наибольшей частоты — ультрафиолетовые, а не инфракрасные (хотя именно они и называются тепловыми). Это очень важный результат.
Итак, всякое тело состоит из атомов, которые мы пока представляем себе как шарики диаметром 10–8 см и разного веса: от 10–24 до 20–22 г. Они очень быстро движутся, колеблются и сталкиваются между собой, причем скорость их движения увеличивается с ростом температуры тела. Это тепловое движение атомов приводит к совершенно новому явлению: к тепловому излучению, свойства которого нам пока неизвестны.
Чтобы узнать их, возвратимся к железному лому, который греется в печи. Чем горячее печь, тем больше тепла излучает лом. Конечно, этот факт знали всегда, но только Джозеф Стефан (1835–1893) в 1879 году эмпирически и Людвиг Эдуард Больцман (1844–1906) в 1884 году теоретически установили количественный закон. Оказалось, что с повышением температуры общее количество излучаемого тепла растет очень быстро — как четвертая степень абсолютной температуры тела.
А что, если в печь вместо лома положить булыжник, как делалось раньше в русских банях? Будет ли его энергия излучения отличаться от излучения железного лома? В 1859 году Густав Роберт Кирхгоф доказал, что не будет, если температура печи в обоих случаях одинакова. Он доказал даже нечто большее, но чтобы понять это нечто, нужно прервать рассказ и более пристально посмотреть на поток излучения, который исходит от нагретого тела.
Так же, как и солнечный свет, этот поток неоднороден. Любое тепловое излучение, во-первых, состоит из лучей различной длины волны, и, во-вторых, их вклад в общий поток излучения различен. Если обе эти характеристики мы знаем, то можем утверждать, что нам известен спектральный состав излучения.
Чтобы подчеркнуть тот факт, что доля излучения с частотой ν в общем потоке излучения зависит от температуры Т, обычно пишут такую формулу:
U = U(ν, Т).
Конечно, если мы будем менять температуру тела, то спектральный состав его теплового излучения также будет меняться. Количественные законы этого изменения установил в 1893 году Вильгельм Вин (1864–1928).
Но даже при одной и той же температуре различные тела излучают по-разному. В этом нетрудно убедиться, если нагревать в темноте одновременно, например, стальной и каменный шары. Вскоре выяснили, однако, что если вместо сплошных шаров нагревать полые, а излучение наблюдать через небольшое отверстие в их стенках, то спектральный состав этого излучения уже не зависит от вещества шара. Такой спектр назвали спектром абсолютно черного тела.
Происхождение этого несколько необычного названия легко понять. Представьте себе, что вы не нагреваете шар, а, наоборот, освещаете его снаружи. Вы всегда увидите перед собой черное отверстие независимо от материала шара. Потому что все лучи, попавшие внутрь полости, многократно там отражаются и почти не выходят наружу.
Реально существующий пример такого абсолютно черного тела — обычная или, еще лучше, мартеновская печь. Кстати, если вы смотрели когда-либо внутрь мартеновской печи, то, вероятно, обратили внимание на интересное явление: из ее отверстия льется ровный свет, который не позволяет рассмотреть детали предметов, расположенных внутри печи. Наши знания об излучении позволяют нам теперь понять и этот факт.
Два равных по величине шара, каменный и стальной, на солнце очень просто различить — слишком неодинаково они блестят: стальной шар отражает гораздо больше лучей, чем каменный. Если теперь эти шары нагреть в темноте, то нетрудно проверить, что каменный шар излучает больше, чем стальной. (Кстати, это одна из причин, почему в банях выгоднее раскалять булыжники, а не стальные болванки.)
Если эти шары бросить в мартеновскую печь, туда, где они не только нагреваются и излучают сами, но также поглощают и отражают излучение других тел, то мы увидим (разумеется, если взглянем в печь раньше, чем шары расплавятся) два совершенно одинаковых шара. Почему? Да потому, что если каменный шар больше излучает «своих» лучей, то он больше и поглощает «чужих», а стальной меньше излучает «своих» лучей, но зато больше отражает «чужих». Поэтому общий поток лучей («своих» и «чужих») от обоих шаров одинаков; и поэтому их нельзя отличить не только друг от друга, но даже и от стенок печи, в которой они лежат.
Именно этот строгий закон был установлен Кирхгофом в 1759 году: отношение излучательной способности тел к их поглощательной способности есть универсальная функция: U = U(ν, Т), независимая от природы тел. В спектральной функции U = U(ν, Т) (ее называют и так) заключена почти вся информация о свойствах теплового излучения. В частности, цвет нагретого тела определяют те волны, которых излучается больше всего.
Важность функции U = U(ν, Т) поняли сразу же во времена Кирхгофа, но в течение 40 лет не удавалось найти для нее формулу, которая бы правильно описывала все эксперименты по тепловому излучению. Однако эти попытки никогда не прекращались: по-видимому, поиски абсолютного всегда привлекательны для человеческого ума.
В нашем рассказе мы подошли к порогу переворота, который совершил в физике Макс Планк (1858–1947). Но прежде чем объяснить его суть, еще раз отметим одну особенность теплового излучения, о которой мы однажды упоминали: изменение цвета тел при нагревании.
Пока температура тела невысока, оно излучает, но не светится, то есть оно испускает только тепловые и инфракрасные волны, невидимые для глаза. При повышении температуры тело начинает светиться: сначала красным цветом, затем оранжевым, желтым и т. д. Например, при 6 тысячах градусов Цельсия больше всего излучается желтых лучей. Кстати, по этому признаку установили, что именно такова температура поверхности Солнца.
Обратите внимание: в случае с солнечным ожогом излучение отдавало тем большую энергию, чем больше его частота. А в данном случае? Чем большую энергию мы затратили на нагревание тела, тем больше частота излучаемых волн. Значит, существует какая-то зависимость между частотой и энергией излучения.
Кванты
В конце прошлого века Макс Планк искал универсальную формулу для спектра абсолютно черного тела. Как он должен был при этом рассуждать? Тепловое излучение не только порождается движением атомов, но и само воздействует на них, так как несет с собой энергию. В результате такого взаимовлияния внутри абсолютно черного тела устанавливается тепловое равновесие: сколько тепла атомы получают извне, столько же энергии от них уносит излучение. Из кинетической теории материи он знал, что средняя энергия колебаний атомов Eкол пропорциональна абсолютной температуре T:
Eкол = kT,
где k = 1,38 · 10–16 эрг/град — множитель пропорциональности, который называется постоянной Больцмана.
Теперь вспомните: энергия излучения растет с его частотой. Знал это, конечно, и Планк. Но как растет? Он предположил простейшее: энергия излучения Eизл пропорциональна его частоте:
Eизл = hν,
где h — другой множитель пропорциональности. (Мысль эта настолько проста, что ее нельзя доказывать и объяснять через более простые понятия. Однако гениальные мысли отмечает именно такая классическая простота.)
Предположив это, Макс Планк угадал формулу для спектральной функции U = U(ν, Т). Да, угадал. Но не надо думать, что все было так уж просто, над своей формулой Планк бился два года.
19 октября 1900 года происходило очередное заседание Немецкого физического общества, на котором экспериментаторы Рубенс и Курлбаум докладывали о новых, более точных измерениях спектра абсолютно черного тела. После доклада состоялась дискуссия, в ходе которой экспериментаторы сетовали, что ни одна из теорий не может объяснить их результаты. Планк предложил им воспользоваться своей формулой. В ту же ночь Рубенс сравнил свои измерения с формулой Планка и убедился, что она правильно, до мельчайших подробностей описывает спектр абсолютно черного тела. Наутро он сообщил об этом своему коллеге и близкому другу Планку и поздравил его с успехом.
Однако Планк был теоретик и потому ценил не только окончательные результаты теорий, но и внутреннее их совершенство. К тому же он не знал еще, что открыл новый закон природы, и считал, что его можно вывести из ранее известных. Поэтому он стремился теоретически обосновать закон излучения, исходя из простых посылок кинетической теории материи и термодинамики. Последовало два месяца непрерывной работы и предельного напряжения сил. Ему это удалось. Но какой ценой!
В процессе вычислений он вынужден был предположить, что излучение испускается порциями (или квантами), величина которых определяется как раз той же формулой E = hν, которую он незадолго перед этим угадал.
В этом — и только в этом — случае удавалось получить правильную формулу для спектра излучения.
Соотношение E = hν нельзя доказать логически, как нельзя обосновать закон всемирного тяготения. Они есть — так устроен мир. Более того, только приняв их и с помощью их можно объяснить другие явления природы. И спектр абсолютно черного тела — тоже.
Формально предположение Планка было предельно ясным и простым но, по существу, противоречило всему прежнему опыту физики и годами воспитанной интуиции. Вспомните, мы много раз подчеркивали, что излучение — это волновой процесс. А если так, то энергия в этом процессе должна передаваться непрерывно, а не порциями — квантами. Это неустранимое противоречие Планк сознавал как никто другой. Когда он вывел свою знаменитую формулу, ему было 42 года, но почти всю остальную жизнь он страдал от логического несовершенства им же созданной теории. У последующих поколений физиков это чувство притупилось: они уже знали готовый результат и научились мыслить по-новому.
Но Планк был воспитан на традициях классической физики и целиком принадлежал ее строгому неторопливому миру. А вышло так: разрешив многолетнюю загадку в теории излучения, он тем самым нарушил логическую стройность всей классической физики. «Не слишком ли дорогой ценой достигнуто решение этой, в сущности, очень частной проблемы?» Для Макса Планка это было большим потрясением. Впоследствии, в докладе, который Планк произнес по случаю вручения ему Нобелевской премии, он вспоминал, что для него признание реальности квантов было равносильно «…нарушению непрерывности всех причинных связей».
Только значительно позже, в 1927 году, новая наука — квантовая механика — объяснила, что противоречия здесь нет. Но до этого времени еще далеко.
14 декабря 1900 года в зале заседаний Немецкого физического общества родилась новая наука — учение о квантах. Сухо и обстоятельно ординарный профессор физики Макс Карл Эрнст Людвиг Планк прочел перед небольшой аудиторией сугубо специальный доклад: «К теории закона распределения энергии в нормальном спектре».
В тот день мало было людей, которые поняли величие момента: плохая погода или логические противоречия теории, вероятно, занимали аудиторию больше. Признание пришло потом. И позже осмыслили значение постоянной Планка h для всего атомного мира. Она оказалась очень маленькой:
h = 6,62 · 10–27 эрг·сек,
но она открыла дверь в мир атомных явлений. И всегда, когда мы из мира привычного и классического хотим перейти в мир необычный и квантовый, мы должны пройти через эту узкую дверь.
Вокруг кванта
Яблоко Демокрита
Мы пока очень мало знаем об атомах, но даже этих знаний достаточно, чтобы решить задачу Демокрита: как долго придется последовательно делить яблоко, чтобы добраться до его «атома»?
Предположим, что у Демокрита в руке было большое яблоко — сантиметров десять в диаметре. Тогда объем его равен примерно V = 103 см3 и при каждом делении уменьшается вдвое, так что после n-го деления его объем Vn равен:
Vn = V/2n = 103/2n = 103/100,3·n = 103–0,3·n.
Согласно оценке Лошмидта объем атома равен примерно (10–8 см)3 = 10–24 см3. Деление закончится, когда объем Vn станет равным объему атома, то есть при условии:
103–0,3·n = 10–24.
Отсюда легко найти, что n = 90, то есть уже на 90 шагу Демокрит достиг бы своей цели. Не так уж много, не правда ли?
Если даже учесть, что он при этом размышлял и потому делил яблоко не торопясь, то и тогда ему хватило бы получаса.
Исаак Ньютон об атомах
«Мне кажется вероятным, что бог вначале создал материю в виде сплошных, массивных, твердых, непроницаемых, движущихся частиц таких размеров и форм и с такими другими свойствами и в таких пропорциях к пространству, которые наилучшим образом служат той цели, для которой он их создал, и что эти простейшие частицы, будучи твердыми, несравненно прочнее, чем любые другие тела, составленные из них; даже настолько прочны, что никогда не изнашиваются и не разбиваются на куски; никакие обычные силы не в состоянии разделить то, что бог создал сам в первый день творения…»
«Мне кажется очевидным, что эти частицы имеют не только свойство инерции вместе с такими пассивными законами движения, которые естественно следуют из этих сил, но что они движутся согласно определенным действующим принципам, подобным гравитации, и которые являются причиной возбуждения и сцепления тел. Эти принципы я рассматриваю не как оккультные качества, предположенные для того, чтобы вывести результаты, исходя из специфических форм вещей, но как общие законы природы, которым обязано само существование этих вещей; их достоверность очевидна нам через явления, хотя их причины пока что не открыты. Явны только качества, а их причины неизвестны».
Планк о кванте
В Шведской академии наук в Стокгольме Макс Планк при вручении ему Нобелевской премии 2 июня 1920 года произнес речь «Возникновение и постепенное развитие теории квантов». Приведем несколько выдержек из нее.
«Крушение всех попыток перебросить мост через возникшую пропасть вскоре уничтожило все сомнения: или квант действия был фиктивной величиной — тогда весь вывод закона излучения был принципиально иллюзорным и представлял просто лишенную содержания игру в формулы, или при выводе этого закона в основу была положена правильная физическая мысль — тогда квант действия должен был играть в физике фундаментальную роль, тогда появление его возвещало нечто совершенно новое, дотоле неслыханное, что, казалось, требовало преобразования самой основы нашего физического мышления, покоившегося со времен обоснования анализа бесконечно малых Ньютоном и Лейбницем на предположении о непрерывности всех причинных связей…»
«…То, что сегодня кажется нам непонятным, когда-нибудь будет казаться, с более высокой точки зрения, особенно простым и гармоничным. Но прежде чем эта цель будет достигнута, проблема кванта действия не перестанет побуждать и оплодотворять мысль исследователей, и чем большие трудности представятся в ее решении, тем важнее она окажется для расширения и углубления всего нашего физического знания».
Планк прекрасно сознавал значение своего открытия (он говорил сыну: «Сегодня я сделал открытие такое же важное, как Ньютон»), но никогда этого не афишировал. Вероятно, поэтому укоренилось заблуждение, что Планк, «очевидно, не знал, что он делает, когда делал это». Приведенные отрывки из нобелевской речи лишний раз опровергают это заблуждение.
Глава вторая
Лучи ♦ Атомы ♦ Электроны ♦ Атомы, электроны, лучи
В истории человечества нам интересны не имена государей и не даты их правления — хотя без этого история не существует вообще, а рождение, расцвет и упадок цивилизаций, эволюция и существо идей, которые столетиями направляют волю людей и определяют характер их взаимоотношений; в истории мы хотим понять причины обновления идей и обстоятельства их угасания.
Точно так же история физики — это не просто набор фактов, а связная картина возникновения и развития физических идей, без которых наука может показаться произвольным набором формул и понятий.
Истины плодотворны только тогда, когда между ними есть внутренняя связь, а связь эту можно проследить только в развитии.
Даже дикари на низшей ступени развития имеют свою историю. С утратой истории исчезнет связь времен, и люди перестанут быть людьми, точно так же, как отдельный человек, утратив память, необратимо деградирует.
Для физика история его науки — необходимый элемент образования, без которого он всегда останется ремесленником. Для всех остальных — это большей частью история человеческих судеб, которые подчас настолько же необычны, как и судьбы царей или полководцев.
Чтобы понять законченность и красоту понятий современной физики, необходимо проследить их истоки и путь развития. Только после этого они смогут стать вам близкими и понятными — точно так же, как близка вам родина, историю и культуру которой вы впитали с молоком матери.
Знаменитый математик Феликс Клейн говорил как-то, что самый быстрый и надежный путь овладеть любой наукой — пройти самому весь путь ее развития. Это не самый простой путь, но он самый интересный, и мы избрали именно его.
В дальнейшем нам особенно важно проследить эволюцию понятий: лучи, атомы, электроны, чтобы в конце пути почувствовать красоту их синтеза.
Лучи
Солнечный луч, если внимательно за ним проследить, может привести к порогу квантовой физики. Весьма вероятно, что вам этот переход не кажется пока убедительным. Но ощущение произвола, которое испытывает человек при первом знакомстве с теорией Планка, на самом деле обманчиво. Формула Планка не результат умозрения, она появилась лишь после длительного анализа точных опытов. Конечно, чтобы придумать ее, одного анализа мало: необходима еще и сила мысли, и взлет фантазии, и смелость перед лицом неожиданных следствий теории.
Ученые Релей, Джинс, Вин и до Планка предлагали различные формулы для описания спектра абсолютно черного тела. Но каждый раз экспериментаторы Отто Люммер (1860–1925) и Эрнст Принсгейм (1859–1917) после тщательного измерения этого спектра решительно отвергали их, как несовершенные. Только формула Планка удовлетворила их: она поразительно совпала с результатами их опытов, хотя и не становилась от этого более понятной.
Последуем примеру этих физиков и рассмотрим строение солнечного луча еще внимательнее, чем мы это делали до сих пор. В дальнейшем мы увидим, как много информации он с собой несет, и надо только научиться ее читать.
Если пропустить луч солнца через призму, то на экране позади нее возникает спектр — явление обычное, и за двести лет к нему привыкли. На первый взгляд между отдельными частями спектра нет резких границ: красный непрерывно переходит в оранжевый, оранжевый в желтый и т. д.
Так и думали до тех пор, пока в 1802 году английский врач и химик Уильям Хайд Волластон (1766–1828) не рассмотрел этот спектр более пристально. Он обнаружил при этом несколько резких темных линий, которые без видимого порядка пересекали спектр Солнца в разных местах. Он не придал им особого значения, полагая, что их появление зависит либо от качества призмы, либо от источника света, либо от других побочных причин. Да и сами линии он считал интересными только потому, что они отделяют друг от друга цветные полосы спектра. Впоследствии эти темные линии назвали фраунгоферовыми — по имени их настоящего исследователя, а не первооткрывателя.
Иосиф Фраунгофер (1787–1826) прожил недолго, но у него была удивительная судьба. В 11 лет, после смерти родителей, он пошел в ученье к шлифовальных дел мастеру. Работать приходилось так много, что на школу уже не оставалось времени, и потому до 14 лет он не умел ни читать, ни писать. Но однажды дом хозяина рухнул; и случилось так, что пока Фраунгофера извлекали из-под обломков, мимо проезжал наследный принц. Он пожалел юношу и вручил ему значительную сумму денег. Их оказалось достаточно, чтобы Иосиф смог купить себе шлифовальный станок и даже начать учиться.
То было время наполеоновских войн и больших перемен в Европе. А Фраунгофер между тем в заштатном городке Бенедиктбейрене учился, шлифовал оптические стекла и тщательно исследовал темные линии в спектре Солнца. Он насчитал их там 574, дал главным названия и указал их точное местоположение в спектре. Положение это было строго неизменным, в частности, всегда в одном и том же месте желтой части спектра появлялась резкая двойная линия, которую Фраунгофер назвал линией D.
И еще один важный факт установил Фраунгофер: в спектре пламени спиртовки на том же самом месте, где и темная линия D в спектре Солнца, всегда присутствует яркая двойная желтая линия. Значение этого факта оценили только много лет спустя.
В 1819 году Фраунгофер переехал в Мюнхен и стал там профессором, членом Академии наук и хранителем физического кабинета. Продолжая свои исследования темных линий в спектре Солнца, он убедился, что их причина не оптический обман, а сама природа солнечного света. Побуждаемый странной природой этих линий к дальнейшим наблюдениям, он открыл их затем в спектре Венеры и Сириуса.
Иосиф Фраунгофер умер и похоронен в Мюнхене в 1826 году. На его могиле надпись: «Approximavit sidera — Приблизил звезды». Но лучший памятник ему — его открытия.
Среди открытий Фраунгофера для нас особенно важно сейчас его наблюдение над двойной D-линией. Тогда, в 1814 году, когда он опубликовал свои исследования, на это наблюдение особого внимания не обратили. Однако труды его не пропали: прошло 43 года, и Вильям Сван (1828–1914) установил, что двойная желтая линия D в спектре пламени спиртовки возникает в присутствии металла натрия. (Его следы в составе поваренной соли почти всегда можно найти в различных веществах, и в спиртовке — тоже.) Как и многие до него, Сван не понял значения своего открытия и потому не сказал решающих слов: «Эта линия принадлежит металлу натрию».
К этой простой и важной мысли пришли только два года спустя (в 1859 году) два профессора: Густав Роберт Кирхгоф (1824–1887) и Роберт Вильгельм Бунзен (1811–1899). В Гейдельберге, в старой университетской лаборатории, они поставили несложный опыт. До них через призму пропускали либо только луч Солнца, либо только свет от спиртовки. Кирхгоф и Бунзен пропустили и то и другое сразу и обнаружили явление, о котором стоит рассказать подробно.
Если на призму падал только луч Солнца, то на шкале спектроскопа они видели спектр Солнца с темной линией D на своем обычном месте. Темная линия по-прежнему оставалась на месте, и в том случае, когда исследователи ставили на пути луча горящую спиртовку. Но когда на пути солнечного луча они ставили экран и освещали призму только светом спиртовки, то на месте темной линии D четко проявлялась яркая желтая линия D натрия. Кирхгоф и Бунзен убирали экран — линия D вновь становилась темной.
Потом они луч Солнца заменяли светом от раскаленного тела — результат был всегда тот же: на месте ярко-желтой линии возникала темная. То есть всегда пламя спиртовки поглощало те лучи, которые оно само испускало.
Чтобы понять, почему это событие взволновало двух профессоров, проследим за их рассуждениями.
Ярко-желтая линия D в спектре пламени спиртовки возникает в присутствии натрия.
В спектре Солнца на этом же месте находится темная линия неизвестной природы.
Спектр луча от любого раскаленного тела — сплошной, и в нем нет темных линий. Однако если пропустить такой луч через пламя спиртовки, то его спектр ничем не отличается от спектра Солнца — в нем также присутствует темная линия и на том же самом месте. Но природу этой темной линии мы уже почти знаем, во всяком случае, мы можем догадываться, что она принадлежит натрию.
Следовательно, в зависимости от условий наблюдения линия D натрия может быть либо ярко-желтой, либо темной на желтом фоне. Но в обоих случаях присутствие этой линии (все равно какой — желтой или темной!) означает, что в пламени спиртовки есть натрий.
А поскольку такая линия спектра пламени спиртовки в проходящем свете совпадает с темной линией D в спектре Солнца, то, значит, и на Солнце есть натрий. Причем он находится в газовом внешнем облаке, которое освещено изнутри раскаленным ядром Солнца.
Короткая заметка (всего две страницы), которую написал Кирхгоф в 1859 году, содержала сразу четыре открытия:
у каждого элемента есть свой линейчатый спектр, то есть строго определенный набор линий;
эти линии можно использовать для анализа состава веществ не только на Земле, но и на звездах;
Солнце состоит из горячего ядра и сравнительно холодной атмосферы раскаленных газов;
на Солнце есть натрий.
Первые три открытия были вскоре подтверждены, в том числе и гипотеза о строении Солнца: экспедиция, которую Французская академия наук в 1868 году во главе с астрономом Жансеном послала в Индию, обнаружила, что при полном солнечном затмении — в тот момент, когда его раскаленное ядро закрыто тенью Луны и светит только корона, — все темные линии в спектре Солнца вспыхивают ярким светом.
Вторую гипотезу сами Киргхоф и Бунзен уже в следующем году не только подтвердили, но и воспользовались ею для открытия двух новых элементов: рубидия и цезия.
В дальнейшем из этого скромного наблюдения над желтой двойной D-линией натрия родился спектральный анализ, с помощью которого мы теперь можем узнавать химический состав далеких галактик, измерять температуру и скорость вращения звезд и многое другое.
Все это действительно интересно, но сейчас нам важно понять главное: что дали открытия Кирхгофа и Бунзена для науки об атоме и какова их связь с нашими прежними знаниями о нем?
Мы знаем теперь два вида спектров: сплошной (или тепловой) и линейчатый.
Тепловой спектр содержит все длины волн, излучается он при нагревании твердых тел и не зависит от их природы.
Линейчатый спектр состоит из набора отдельных резких линий, возникает при нагревании газов и паров (когда малы взаимодействия между атомами), и — что особенно важно — этот набор линий неповторим для любого элемента. Более того, линейчатые спектры элементов не зависят от вида химических соединений, составленных из этих элементов. Следовательно, их причину надо искать в свойствах атомов.
То, что элементы однозначно и вполне определяются видом линейчатого спектра, вскоре признали все: но то, что этот же спектр характеризует отдельный атом, осознали не сразу, а лишь в 1874 году благодаря работам знаменитого английского астрофизика Нормана Локьера (1836–1920). А когда осознали, сразу же пришли к неизбежному выводу: поскольку линейчатый спектр возникает внутри отдельного атома, то атом должен иметь структуру, то есть иметь составные части!
Атомы
В 1865 году, когда появились работы Йозефа Лошмидта, об атомах знали немного: их представляли себе твердыми шариками размером примерно 10–8 см и весом от 10–24 до 10–22 г. Каждому такому «шарику» можно приписать «атомный вес» — число, которое показывает, во сколько раз он тяжелее атома водорода. Например, атомный вес кислорода равен 16, а гелия — 4. Отсюда просто заключить, что в 1 г водорода, в 4 г гелия или в 16 г кислорода (или, как принято говорить в химии, в одном грамм-атоме любого вещества) содержится одинаковое число атомов водорода, гелия, кислорода. Это число N = 6,02 · 1023 — число Авогадро — мы уже однажды приводили.
Представлений об атомах — твердых шариках — было достаточно для объяснения многочисленных фактов из химии, теории теплоты и строения материи. Однако уже к 1870 году вполне оформилась мысль, что атом состоит из еще более простых частиц, и физики принялись их искать. Прежде всего они стали исследовать электрические свойства атома.
Все вещества, как правило, электрически нейтральны. Однако при некоторых условиях они обнаруживают электрические свойства, например, если натирать стекло шерстью, янтарь — шелком и тому подобное. Особенно отчетливо они проявляются в явлениях электролиза.
Если в расплав какой-либо соли (скажем, поваренной — NaCl) опустить два электрода и подключить их к полюсам батареи, то в расплаве произойдут изменения: на катоде (электрод, который подключен к отрицательному полюсу батареи) начнет выделяться чистый металл натрий, на аноде — газ хлор. Это означает, что в расплаве атомы натрия заряжены положительно, а атомы хлора — отрицательно, и поэтому под действием электрического поля они двигаются в противоположных направлениях.
Майкл Фарадей (1791–1867) в 1834 году установил количественные законы этого явления. Оказалось, что если через растворы различных веществ, молекулы которых построены из одновалентных атомов, пропускать одно и то же количество электричества, равное 96 521 кулону, то на электродах всегда выделяется ровно по одному грамм-атому вещества. Например, из расплава поваренной соли выделится 23 г металла натрия и 37,5 г газа хлора.
Закон электролиза Фарадея легко понять, если предположить, что в расплаве NaCl с каждым атомом связан определенный заряд, причем для ионов Na+ и Cl– эти заряды равны и противоположны по знаку. (Название ион — «странник» — таким «заряженным» атомам дал Фарадей.) Заряд, который переносит один ион, равен e = 4,802 · 10–10 CGSE (электростатических единиц электричества).
Это значение очень мало, но мы уже немного привыкли к таким малым величинам. Более удивительно другое: заряда, меньшего, чем этот элементарный заряд e, обнаружить не удалось. С легкой руки Джонстона Стонея (1826–1911) в 1891 году это наименьшее количество заряда получило название «электрон».
Электроны
Первоначально с этим словом не связывали понятия о частице. Оно служило лишь для обозначения того наименьшего количества заряда, которое может переносить с собой ион любого атома. Однако подспудно мысль о том, что электрон — частица, всегда жила. Действительно, проследите мысленно процесс электролиза: вот ион натрия (Na+), двигаясь в растворе под действием электрического поля, подходит к катоду; на катоде избыток отрицательных зарядов, поэтому в момент, когда ион Na+ его касается, он забирает от катода один отрицательный заряд и, не меняя веса, выделяется в виде нейтрального атома натрия.
Попробуйте теперь вообразить сам момент перехода отрицательного заряда от катода к иону Na+: что добавляется к иону, когда он, не меняя веса, становится нейтральным?
Представить себе этот процесс довольно трудно, если не предполагать при этом, что элементарный заряд может существовать и вне атома. Эту трудность сознавали, конечно, все, но признать атомарное строение электричества было еще труднее, ибо при этом рушились удобные и привычные представления об электричестве как о некоем тонком флюиде, который без труда проникает во все тела.
В 1881 году на собрании Лондонского химического общества, посвященном чествованию памяти Майкла Фарадея, Герман Людвиг Фердинанд фон Гельмгольц (1821–1894) прочел доклад «Современное развитие взгляда Фарадея на электричество». В этом докладе Гельмгольц впервые отчетливо сформулировал мысль о «молекулярном строении электричества». Конечно, сама по себе эта мысль даже в то время не была новой.
Еще в 1749 году великий американец Бенджамен Франклин подозревал нечто похожее, но тогда его догадка ни на чем, в сущности, не была основана, а потому и не привела к новым следствиям. В 1871 году к мысли Франклина возвратился немецкий физик Вильгельм Эдуард Вебер (1804–1891), но сочувствия не встретил: в его время об электричестве знали уже так много, что на веру гипотез не принимали — знание предполагает ответственность. Нужны были экспериментальные доказательства идеи об электроне. Их стали искать в явлениях проводимости газов.
Представьте себе стеклянную трубку, наполненную каким-либо газом (например, неоном) и запаянную с обоих концов вместе с проволочками (обычно — платиновыми). Если мы обе эти проволочки присоединим к разным полюсам батареи: одну к отрицательному (катоду), а другую — к положительному (аноду), то по цепи пойдет ток. Совершенно так же, как и в случае с электролитом. Вероятно, именно эта аналогия с явлениями электролиза и побудила в свое время (в 1838 году) Майкла Фарадея построить прообраз такой трубки («электрическое яйцо» Фарадея). Как мы увидим позже, аналогия была чисто внешней, но и само по себе явление проводимости газов было настолько интересным, что многие исследователи посвятили жизнь изучению его свойств.
Примерно в середине прошлого века Юлиус Плюккер (1801–1868) (это имя знакомо теперь каждому математику) оставил свои занятия геометрией, которые не нашли признания среди современников, и увлекся опытной физикой. Когда вы следите за игрой световых реклам, вы обязаны этим зрелищем профессору математики в Берлине и Бонне. Именно Плюккер в 1858 году изобрел эти светящиеся трубки. (Обычно их называли Гейслеровыми, по имени знаменитого стеклодува Генриха Гейслера, который был техническим ассистентом Плюккера и научился особенно искусно их изготовлять; а еще полвека спустя их повсеместно называли трубками Крукса).
Прежде всего Плюккер установил, что проводимость газа зависит от его концентрации в трубке и возрастает, если часть газа из трубки откачать. При этом каждый газ начинает светиться своим характерным цветом, так что по цвету свечения можно определить состав газа в трубке. (К этому выводу Плюккер пришел даже раньше Кирхгофа и Бунзена, но не понял его значения.) Если увеличивать разрежение в трубке, то вблизи катода появляется темное пространство («катодное пятно»), которое при дальнейшем откачивании газа из трубки расширяется и наконец заполняет ее всю: трубка перестает светиться. Но это темное пространство живет, его пронизывают какие-то «лучи», хоть и невидимые для глаза (как невидима летящая пуля, пока не встретит препятствия на своем пути).
Ученик Плюккера Евгений Гольдштейн (1850–1931) в 1876 году дал им название: катодные лучи. Еще раньше, в 1869 году, другой его ученик, Иоганн Вильгельм Гитторф (1824–1914), обнаружил отклонение этих лучей в магнитном поле, и наконец в 1879 году Кромвель Вэрли (1828–1883) показал, что они заряжены отрицательно.
Поставьте себя на место этих исследователей: 70-е годы XIX столетия, у вас в руках набор интересных фактов, однако связи между ними не видно. С одной стороны, явление проводимости газов очень напоминает процессы электролиза, но, с другой стороны, происходят вещи совсем непонятные: например, проводимость растет с уменьшением концентрации газа в трубке. Кроме того, обнаружен только поток отрицательных «лучей» и не обнаружено положительных.
Нужна была руководящая идея.
Такая идея возникла после блестящих опытов, которые поставил Уильям Крукс — английский физик и химик. Это был интересный человек, наделенный к тому же редким даром — предвидеть фундаментальные открытия. Крукс нигде не служил и всецело был предан науке (что не помешало ему, однако, верить в спиритизм и в 1913 году стать президентом Королевского общества).
Прежде всего, он гораздо сильнее откачал воздух из трубки. При этом от катода отделилось еще одно, более темное пространство, которое также постепенно заполнило всю трубку, после чего анод вспыхнул зеленоватым светом. Тот день 1878 года, когда это произошло, можно считать днем рождения электроннолучевой трубки — основной части современного телевизора. Уже за одно это Круксу обеспечено признание потомков. Но для самого Крукса это было только началом — он стал тщательно изучать свойства излучения, которое он называл лучистой материей (этот термин ввел все тот же Фарадей еще в 1816 году). Крукс чувствовал, что столкнулся с совершенно новым явлением природы, и предлагал назвать его «четвертым состоянием вещества», которое «ни жидко, ни твердо, ни газообразно». Он писал:
«Изучая четвертое, лучистое состояние материи, мы, как мне кажется, имеем под руками и в сфере наших исследований те первичные атомы материи, из которых, как вполне основательно предполагают, состоят все тела природы. Мы видим, что лучистая материя по одним своим свойствам так же материальна, как вот этот стол, по другим — она скорее похожа на лучистую энергию. Мы действительно коснулись той пограничной области, где материя и энергия переходят друг в друга. Я думаю, что величайшие задачи будущего найдут свое разрешение именно в этой пограничной области; более того, здесь, как мне кажется, лежит граница всего реального мира».
Чтобы оценить смелость Крукса, надо вспомнить, что в то время весь мир разделяли на материю и эфир, причем две эти его части считали противоположными и несовместимыми: с материей отождествляли частицы, а с эфиром — среду, колебания которой мы воспринимаем как лучи света.
Таким образом, лучистая материя Крукса должна была совмещать в себе свойства несовместимые: луча и частицы. Через полстолетие все могли убедиться, насколько он был прав, но в то время (по словам Оливера Лоджа — современника и соотечественника Крукса) «…предположение Крукса имело судьбу тех проблесков мысли, которые иногда разрешаются авторам, но подвергаются насмешкам со стороны ортодоксальной науки их времени».
Независимо от смысла, который Крукс вкладывал в понятие «лучистая материя», он бесспорными опытами обнаружил у нее такие свойства: она распространяется прямолинейно; вызывает свечение тел и может их даже расплавить; отклоняется в электрическом и магнитном полях; проникает сквозь твердые тела, а в воздухе проходит путь 7 см, в то время как атомы — только 0,002 см.
Опираясь на эти факты, Уильям Крукс утверждал: катодные лучи, или лучистая материя, есть поток быстрых отрицательных частиц, величина которых значительно меньше размеров атомов.
Легко убедиться, что высказанная гипотеза проясняла все свойства катодных лучей. В частности, ею можно легко объяснить появление темного пространства у катода: его величина определялась просто средним расстоянием, которое пролетают электроны, не сталкиваясь с атомами газа. Очевидно, это расстояние растет по мере выкачивания газа из трубки. Но главное значение гипотезы в другом: именно она стала той руководящей идеей, которая позволила почувствовать себя устойчиво в море фактов, накопленных к тому времени.
Физики знали теперь, куда идти и что искать: необходимо было выделить «атом электричества» и определить его свойства: заряд, массу и размеры.
На это понадобилось почти 20 лет и усилия таких больших физиков, как Джозеф Джон Томсон (1856–1940), Джон Таунсенд (1868–1957), Вильгельм Вин (1864–1928), Джордж Фитцжеральд (1851–1901), Эмиль Вихерт (1861–1928), Жан Перрен (1870–1942), Роберт Эндрюс Милликен (1868–1953). У нас нет возможности рассказать сейчас об остроумии и тонкости опытов, которые придумали эти и многие другие ученые. Поэтому проследим просто, как гипотетический «атом электричества» обретал постепенно реальные свойства, пока не стал, наконец, основой физики.
Прежде всего Жан Перрен в 1895 году окончательно доказал: заряд катодных лучей отрицателен. В течение последующих двух лет выяснили: их скорость равна примерно одной десятой скорости света, то есть примерно в 10 000 раз больше скорости ружейной пули и скорости теплового движения атомов. Кроме того, эти и все остальные свойства лучей не зависят от состава газа в трубке. А это означало, что катодные частицы — непременная составная часть всех атомов.
И наконец, в 1897 году Дж. Дж. Томсону удалось определить заряд e и массу m отдельного «атома электричества».
Оказалось, что масса этих частиц (≈ 10–27 г) примерно в тысячу раз меньше массы атома водорода, а заряд (e ≈ 5 · 10–10 CGSE) почти точно равнялся тому заряду иона водорода, который был измерен при изучении электролиза.
Это было неожиданно. Посудите сами: явления электролиза и проводимости газов изучали разные науки, которые развивались независимо друг от друга, и в них на протяжении десятилетий сформировались свои понятия. И вдруг они оказались тесно связанными. «Такие факты в истории науки, — говорил ученик Планка нобелевский лауреат Макс Лауэ, — самое сильное доказательство ее истинности». Для физиков такие события всегда праздник, и мы еще посетим подобные перекрестки науки.
История электрона — хороший способ усвоить логику открытий нынешней физики: исходя из наблюдений, ученые выдвигают на их основе гипотезы, которые вновь проверяют опытом, и, наконец, этот процесс завершается теорией, то есть сжатым объяснением частных явлений на основе немногих общих принципов. Гипотеза об электроне возникла из наблюдений Фарадея, Плюккера и Крукса. Плодотворность ее была проверена и доказана в опытах Дж. Дж. Томсона и других физиков.
И наконец, Гендрик Антон Лоренц (1853–1928) настолько поверил в реальность электрона, что создал на основе этой гипотезы теорию, следствия из которой, вновь можно было проверить.
Процесс этот беспределен, но это единственный способ движения науки.
Возвратимся, однако, в 1897 год, когда после сорокалетних усилий получила права гражданства первая «элементарная частица» — электрон. Это было самое важное событие в физике со времени признания реальности атома. В тот год узнали, что существуют частицы значительно меньше атомов, что они входят в состав всех атомов; что не только материя, но и электричество имеет атомистическую структуру. Все это означало, что в природе реально существует материальный носитель наименьшего заряда.
Как и атом, электрон признали далеко не сразу. Еще в 1902 году Оливер Лодж писал: «…электрон — это чисто гипотетический заряд, изолированный от атома». И даже в 1920 году великий Рентген запрещал сотрудникам своего института произносить это слово.
Сейчас эти сомнения трудно понять.
Физики, сразу поверившие в реальность электронов, тщательно измеряли его характеристики: заряд e и массу m. Благодаря их трудам (особенно трудам Роберта Милликена, который с 1909 по 1940 год периодически возвращался к этой задаче) мы сейчас знаем эти числа с большой точностью:
m = 9,1083 · 10–28 г,
e = 4,80274 · 10–10 CGSE.
А размер? Каковы размеры электрона? Увы, нам это неизвестно до сих пор. Мы не знаем даже, имеет ли вообще этот вопрос четкий смысл. В самом деле, о свойствах электрона мы узнаéм, изучая его взаимодействия с другими частицами и полями. Но для понимания результатов всех этих опытов нам достаточно знать только массу и заряд электрона и совершенно ни к чему знать его размеры. Не исключено, что такого свойства у электронов и вправду нет. Ведь нельзя же указать толщину экватора, хотя длину его измерить можно. Или, быть может, величина электрона зависит от условий опыта? Такую возможность тоже нельзя отрицать заранее; ведь изменяет же комета свои размеры, приближаясь к Солнцу, хотя масса ее при этом остается постоянной. Все это не праздные вопросы, и мы к ним еще возвратимся.
Атомы, электроны, лучи
Мы только что повторили тот сложный участок пути, который прошли исследователи в конце прошлого столетия. Это было время, когда обилие новых явлений заслоняло простые связи между ними. Когда нужна была большая вера в гармонию природы, чтобы не потеряться в хаосе пестрых фактов и разноречивых гипотез.
Истинно великое открытие не только отвечает на старые вопросы, но и порождает новые. Открытие электрона вызвало воодушевление физиков. Однако вскоре на смену ему пришли новые заботы. Как электроны связаны в атоме? Сколько их там? Покоятся они или движутся? И как их движения связаны с излучением атомов?
Форма и характер вопросов менялись, но постепенно все они свелись к задаче: необходимо узнать число, размеры и расположение электронов в атоме, а также их влияние на процессы излучения.
Никто при этом не задумывался, имеют ли вообще такие вопросы смысл. В то время все молчаливо представляли себе электрон маленьким шариком диаметром 10–13 см, который «как-то» закреплен внутри атома.
Для начала хотели понять главное: почему атом излучает спектральные линии строго определенной длины волны и почему этих линий так много (у атома железа, например, только в видимой части спектра свыше 3000). Как всегда, если нет глубоких идей, мыслили аналогиями. Все хорошо помнили, что частота колебаний пружины с грузиком зависит от ее упругости, следовательно, рассуждала часть физиков, и в атоме электроны связаны «какими-то» пружинами различной упругости. Когда мы возбуждаем атом, электроны начинают колебаться и при этом излучают свет с частотой колебания пружинок. Отсюда, по мысли Локьера, сразу следовало, что число электронов в атоме равно числу линий в спектре элемента. Кроме того, атом с подобным устройством будет наиболее охотно поглощать именно те лучи, которые он сам испускает. Но ведь именно это и обнаружили Кирхгоф и Бунзен в своем знаменитом опыте с парами натрия!
Несмотря на успехи модели атома с упругосвязанным электроном, многие понимали ее логическое, или, точнее, эстетическое, несовершенство. А вскоре обнаружили и прямые противоречия с опытом. Дж. Дж. Томсон, изучая рассеяние рентгеновых лучей на атомах различных элементов, пришел к выводу, что число электронов в атоме сравнительно невелико и примерно равно половине атомного веса элемента. В 1904 году он предложил свою модель атома, развив гипотезу однофамильца Уильяма Томсона (лорда Кельвина): внутри положительного равномерно заряженного атома-шара диаметром 10–8 см плавают отрицательные электроны, квазиупруго с ним связанные. Число электронов равно заряду шара, так что в целом атом оказывается нейтральным, как это и должно быть.
В начале нашего века почти все физики приняли модель Томсона, и лишь немногие из них предлагали другие модели. Но, несмотря на частные разногласия, все чувствовали: в науке об атоме наступает новая эпоха.
Вокруг кванта
Уильям Крукс (1832–1919)
Родился У. Крукс в семье торговца на Риджен-стрит в Лондоне. Был он старшим из 16 детей от второго брака, и было еще 5 детей от первого. Как он сам говорил, в его семье вряд ли знали слово «наука», и первоначальное образование он получил у дяди, книжная лавка которого находилась рядом с магазином отца.
В 19 лет он оканчивает только что открытый Королевский химический колледж и работает ассистентом в том же колледже. Одновременно он посещает в Королевском институте лекции Фарадея, которые произвели на него незабываемое впечатление.
В 1861 году он открыл элемент таллий, а в 1869 году его избрали членом Королевского общества, где 30 ноября 1878 года он докладывал его членам о свойствах катодных лучей.
Ходит упорный слух, что он был близок к открытию рентгеновых лучей. Дело в том, что во время экспериментов с катодными лучами он постоянно обвинял компанию Ильфорда в том, что она поставляет ему засвеченные фотопластинки. (Как мы теперь понимаем, рентгеновы лучи, возникающие при столкновении электронов со стенками трубки, вполне могли засветить фотопластинки даже в закрытой коробке.) Слух не подтвержден, во всяком случае сам Крукс об этом нигде не упоминал публично.
Крукс был удивительно богатой натурой: изобретатель, издатель журнала «Химические новости» и чистый исследователь в одно и то же время. Человек он был приветливый, уравновешенный, преданный своей семье и осмотрительный с людьми посторонними.
«Это был исключительно независимый, оригинальный и мужественный ум, он смотрел на явления по-своему и не боялся высказывать мнения, в корне отличные от утверждений всех прежних ортодоксов», — говорил о нем впоследствии Дж. Дж. Томсон.
Кинетическая теория газов
Вместе с учеными XIX века мы стремимся сейчас проникнуть в глубь атома. Но наряду с этими попытками в том же XIX веке пробовали объяснить физические свойства тел, не входя в детали внутреннего строения атомов. Мысль, лежащая в основе этих попыток, предельно проста: атомы, из которых состоят все вещества в природе, не покоятся, а находятся в постоянном движении.
Оказалось, что подобное представление приводит к большому числу следствий, если сформулировать его на языке математики. А такие попытки, начиная с Ньютона, который хотел математически объяснить газовый закон Бойля — Мариотта, неоднократно предпринимались. Однако создателем кинетической теории материи следует считать Даниила Бернулли (1700–1782).
Он родился в семье выходцев из Голландии, в семье, которая дала миру более 120 выдающихся и знаменитых ученых, артистов, литераторов и государственных деятелей. Вопреки воле отца Даниил обучался математике у своего старшего брата Николая и затем закончил образование в Италии. В 1725 году вместе с Николаем он едет в Петербург, куда петровские реформы привлекли многих иностранцев. Спустя восемь месяцев Николай умирает. Даниил — к тому времени уже профессор математики — прожил в Петербурге еще семь долгих лет, до тех пор, пока смог переносить русский климат и образ жизни. Здесь он написал свою «Гидродинамику», которую напечатал через пять лет после возвращения, в 1738 году, в Базеле.
Примерно в то же время и в том же Петербурге сходные мысли развивал Михаил Васильевич Ломоносов.
Кинетическую теорию газов постигла странная судьба. «Гидродинамику» Бернулли не заметили и обнаружили ее только спустя 120 лет, в 1859 году. А работы Ломоносова, написанные в 1742–1747 годах, стали известны лишь в 1904 году.
В XIX веке произошло второе рождение кинетической теории газов, поначалу тоже неудачное. В 1821 году Джон Херэпет (1790–1868) — темпераментный и любящий споры школьный учитель из Бристоля — высказывает вновь кинетическую гипотезу, но ее опять оставляют без внимания. Четверть века спустя, в 1845 году, морской инструктор Ост-Индской компании в Бомбее Джон Джеймс Уотерстон (1811–1883) прислал в Лондон в Королевское общество обширный трактат по кинетической теории газов. Это сочинение не напечатали, поскольку рецензенты оценили его как «…нелепость, негодную даже для чтения перед Королевским обществом». Только в 1892 году лорд Рэлей отыскал рукопись Уотерстона в архивах и опубликовал ее.
Причину такого единодушного забвения этих трудов следует искать в общем умонастроении физиков того времени. Отчасти тому виной были тогдашние философские учения: в середине XIX века почти все философы отрицали существование атомов.
Тем не менее идеи Херэпета и Уотерстона не погибли: они решающим образом повлияли на работы Джеймса Прескотта Джоуля (1818–1889), который в 1851 году впервые оценил скорость молекул газа. Она оказалась неожиданно большой: например, для молекул водорода она равна примерно 1800 м в секунду — вдвое больше скорости артиллерийского снаряда.
В дальнейшем развитие кинетической теории материи пошло быстро: ее переоткрыли Крониг (1856) и Клаузиус (1857) и развили почти до современного состояния Максвелл (1860) и Больцман (1880). С тех пор это одна из основных наук о строении материи, с помощью которой объяснили теплоемкость и теплопроводность твердых тел, упругость и вязкость газов и многое другое.
Михаил Васильевич Ломоносов
По вполне понятным причинам особо следует отметить вклад в науку об атомах и их движении, сделанный Ломоносовым. В 1742 году в диссертации «О составляющих тела природы нечувствительных физических частичках, в которых находится достаточное основание частичных свойств» он писал:
«…§ 87. Аксиома. Сложные тела состоят из некоторого числа составных частей, на которые они распадаются…
§ 89. Теорема 10. Все тела состоят из нечувствительных физических частичек, заключающих в себе основание частичных качеств, которые при движении не могут разделиться на другие, меньшие…
§ 90. Изъяснение. Мы называем физическими монадами нечувствительные физические частички, не разделяющиеся на другие, меньшие, при движении. Мы не оспариваем возможность мысленно делить материю до бесконечности, но полагаем возможным, не опасаясь ошибки, обойтись без этого в физических делах. Также не заботимся мы и о рассеянной по материи пустоте (если она существует); с ней ведь не связано никакого понятия, кроме протяжения, поэтому она никаких свойств не имеет и ничего посему не может дать сущности и природе вещей, независимо от того, существует ли она, или нет.
§ 91. Теорема 11. Фигура физических монад неизменна…»
Причину тепла и холода Ломоносов видел «во взаимном движении нечувствительных физических частичек». В 1744 году он представил Академии наук диссертацию «Размышления о причине тепла и холода», представление о которой дают несколько выдержек из нее:
«§ 1. Весьма известно, что тепло возбуждается движением: руки от взаимного трения согреваются, дерево загорается, искры вылетают при ударе кремнем о сталь, железо накаливается при ковании его частыми, сильными ударами…
Из всего этого совершенно очевидно, что имеется достаточное основание теплоты в движении. А так как никакое движение без материи происходить не может, то необходимо, чтобы достаточное основание теплоты состояло в движении какой-либо материи…
§ 6. Внутреннее движение можно себе представить происходящим, трояко: 1) или нечувствительные частички тела постоянно меняют свое место; 2) или в одном месте постоянно вращаются; 3) или, наконец, в нечувствительном пространстве в нечувствительное время постоянно колеблются взад и вперед. Первое называем поступательным, второе — коловратным, третье — колебательным…
§ 13. Из этой нашей теории вытекают такие следствия: 1) наиболее приспособленными к нашему тепловому движению являются шарообразные корпускулы вещества… 2) как каждое движение в смысле количества может увеличиваться и уменьшаться, так же следует себе представить и тепловое движение… 3) частички теплых тел должны вращаться скорее, более холодных — медленнее».
В протоколах академии об этой работе сохранился отзыв, в котором сказано, что «адъюнкт Ломоносов слишком рано принялся за сочинение диссертаций». Низкая культура тогдашней академии и прогрессирующая в дальнейшем изоляция России привели к тому, что научные труды Ломоносова не оказали влияния на последующее развитие науки. Они были забыты, и в памяти потомков в течение полутора столетий он остался только поэтом. Лишь позже, к двухсотлетию со дня его рождения, постепенно извлекли из архивов научные труды Ломоносова и поняли величие этого воистину российского таланта.
Глава третья
Атомы ♦ Лучи ♦ Кванты ♦ Окончательная победа атомистики
Говорят, что половину знаний о внешнем мире человек приобретает в возрасте до пяти лет. В последующие десять лет он знает о мире почти все и свои дальнейшие познания о нем (за исключением специальных) пополняет очень медленно, быть может, потому, что к этому времени он уже успевает приобрести вредную взрослую привычку — узнавая что-либо новое, обязательно спрашивать: «А для чего это?»
При первом знакомстве с квантовой механикой такая взрослая привычка очень мешает, потому что на первых порах никогда не ясны ни суть атомных явлений, ни их относительная важность в общей картине, ни тем более их скрытый смысл.
В этой ситуации надо поступать подобно детям, которые учатся говорить. Вначале они слышат непонятные им звуки, затем бессмысленно перебирают и повторяют слова и, наконец, замечают, что между словами существуют логические связи. Постепенно они убеждаются, что сами по себе слова зачастую ничего не означают, но иногда обретают неожиданный смысл, если произнести их в определенном порядке.
Конечно, пройдет немалое время, пока они научатся улавливать самые тонкие оттенки мыслей и настроений за простыми сочетаниями обыденных слов. По существу, только тогда они и становятся взрослыми.
В этой главе мы узнаем много новых фактов об атомах, лучах и квантах. Быть может, выбор фактов и та уверенность, с которой мы будем их толковать, покажутся вначале не очень обоснованными, — как ребенку поступки взрослого человека. Но с этим ничего нельзя поделать. Узнавая впервые непривычную реальность атомной физики, все мы поневоле становимся похожими на детей, вступающих в новый для них мир. Без фактов нет науки. И чтобы наилучшим образом усвоить их, станем на время детьми, которые всегда больше знают, чем понимают.
Конец прошлого и начало нашего века часто называют героическим периодом физики. Это было время, когда каждый год приносил неожиданные открытия, фундаментальность которых очевидна даже сейчас, более полувека спустя. Одно из таких открытий связано все с той же трубкой Крукса. Ноября 2-го числа 1895 года в лаборатории университета в Вюрцбурге Вильгельм Конрад Рентген (1845–1923), изучая катодные лучи, обнаружил новое излучение, которое возникало в том месте анода, куда падал пучок электронов.
Свойства этого излучения были необычны, пугающе необычны: оно без труда пронизывало человеческое тело и даже проникало сквозь закрытые дверцы сейфов. Только в 1912 году немецкие физики Вальтер Фридрих (род. 1883) и Пауль Книппинг (1883–1935) по предложению Макса фон Лауэ (1879–1960) пропустили эти лучи через кристалл и обнаружили у них способность к интерференции и дифракции. А это означало, что X-лучи (как их вначале назвал Рентген) не поток частиц, а волны, только очень короткие: всего от 10–7 до 10–10 см.
Одного этого открытия было бы достаточно, чтобы нарушить привычный рабочий распорядок всех лабораторий мира. Но эпоха открытий только начиналась. Уже несколько месяцев спустя, в 1896 году, Антуан Анри Беккерель (1852–1908) открыл новый тип излучения, еще более странный. Это излучение возникало самопроизвольно в куске урановой руды и состояло из положительно заряженных частиц, которые Резерфорд назвал альфα-частицами (α-частицами). Они оказались вчетверо тяжелее атомов водорода, причем заряд их был равен двум зарядам электрона.
Некоторые вещества (например, ZnS — сернистый цинк) начинали светиться, если на них попадал пучок α-частиц. Это позволило все тому же Уильяму Круксу в 1903 году изобрести спинтарископ — прибор, который позволял видеть вспышки от единичных α-частиц, попадавших на экран из сернистого цинка.
Теперь эти два открытия хорошо известны, но мы о них все-таки напомнили, ибо без них история атома была бы неполной.
Атомы
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома. Например, Линдеман, ректор Мюнхенского университета, в 1905 году утверждал, что «…атом кислорода имеет форму кольца, а атом серы — форму лепешки». Но большинство физиков пришло к выводу, что прав Дж. Дж. Томсон: атом — это равномерно заряженный положительный шар диаметром примерно 10–8 см, внутри которого плавают отрицательные электроны (или корпёсли, как писали в русских изданиях начала века), размеры которых равны примерно 10–13 см. Сам Джи-Джи — как его называли ученики — относился к своей модели без энтузиазма.
А некоторые физики представляли себе атом совсем иначе. Одни об этом говорили вслух. Среди них были Джонстон Стоней, предполагавший еще в 1891 году, что «…электроны движутся вокруг атома, подобно спутникам планет», Жан Перрен, который в 1901 году пытался представить себе «нуклеарно-планетарную структуру атома»; японский физик Нагаока и сэр Оливер Лодж, утверждавшие в 1902 году, что «…пространства внутри атома чрезвычайно громадны по сравнению с величинами самих образующих его электрических ядрышек — иными словами, атом представляет своего рода сложную астрономическую систему, подобную кольцу Сатурна».
Другие, например Петр Николаевич Лебедев, доверяли подобные мысли только своему дневнику. В 1887 году ему казалось, что частота излучения атомов определяется частотой обращения электрона по орбите. А голос Николая Морозова был заперт в стенах Петропавловской крепости.
Но ни один сторонник идеи планетарного атома не мог объяснить главного: устойчивости системы, состоящей из положительной сердцевины и электронов, которые вокруг нее вращаются.
Действительно, на круговой орбите электрон движется ускоренно и, следовательно, по теории Максвелла — Лоренца, должен терять энергию на излучение. Зная размеры атома, легко оценить скорость движения электрона по орбите и величину центростремительного ускорения, оно равно примерно 1025 см/сек2. При таком ускорении излучение должно быть настолько интенсивным, что уже через 10–8 сек. электрон обязан упасть на положительный центр притяжения, и система «атом» прекратит свое существование.
Ничего похожего в природе не происходит: атом не только устойчив, но и восстанавливает свою структуру после разрушений, свидетельствуя в пользу модели Томсона. Однако в физике уже более двухсот лет принято правило: окончательный выбор между гипотезами вправе сделать только опыт. Такой опыт поставил в 1909 году Эрнст Резерфорд (1871–1937) со своими «мальчиками».
Представьте себе крупного и шумного человека, который принужден сидеть в темной комнате и, глядя в микроскоп, считать на экране спинтарископа вспышки (сцинтилляции) от α-частиц. Работа изнурительная: уже через две минуты глаза устают. Ему помогают опытный исследователь Ганс Гейгер (1882–1945) и двадцатилетний лаборант Эрнст Марсден (род. 1889). Их прибор несложен: ампула с радием-C, испускающим α-частицы, диафрагма, которая выделяет из них узкий пучок и направляет его на экран из сернистого цинка, и микроскоп, через который наблюдают сцинтилляции α-частиц на экране. Место появления очередной сцинтилляции предугадать нельзя — они возникают беспорядочно, но так, что в целом на экране получается довольно резкое изображение щели диафрагмы.
Однако если на пути α-частиц поставить металлическую фольгу, то вместо резкого изображения щели на экране возникает размытая полоса. Эта полоса лишь немного шире изображения щели, полученного в первом случае: α-частицы отклонялись от прямого пути в среднем всего на 2 градуса. Однако несложный расчет показал: чтобы объяснить даже такие небольшие отклонения, нужно допустить, что в атомах фольги могут возникать огромные электрические поля напряженностью свыше 200 тыс. в/см.
В положительном шаре атома Томсона таких напряженностей быть не может. Столкновения с электронами также не в счет: ведь по сравнению с ними α-частица, летящая со скоростью 20 км/сек, все равно что пушечное ядро рядом с горошиной. И все же пути α-частиц искривлялись. В поисках разгадки Марсден предложил проверить: а не могут ли α-частицы отражаться от фольги назад? С точки зрения модели Томсона, предложение совершенно бессмысленное: пушечное ядро не может отразиться от горошины. Результат был неожиданным, но вполне убедительным, хотя поверить в него было трудно: α-частицы отражались от фольги.
Прошло два года. За это время Гейгер и Марсден сосчитали более миллиона сцинтилляций и доказали, что отражается назад примерно одна α-частица из 8 тысяч.
Только теперь, 7 марта 1911 года, Манчестерское философское общество — то самое, президентом которого был когда-то Джон Дальтон, — услышало доклад Резерфорда «Рассеяние α- и β-лучей и строение атома». В тот день слушатели узнали, что атом подобен солнечной системе: он состоит из ядра и электронов, которые вращаются вокруг него на расстояниях ≈ 10–8 см. Размеры ядра очень малы — всего 10–13–10–12 см, но в нем заключена практически вся масса атома. Заряд ядра положителен и по величине равен примерно половине атомного веса элемента. Сравнение с солнечной системой не случайно: диаметр солнца (1,4 · 106 км) примерно во столько же раз меньше размеров солнечной системы (6 · 109 км), во сколько диаметры ядер (≈ 10–12 см) меньше размеров атома (≈ 10–8 см).
Мы настолько привыкли к новым понятиям, что, объясняя электронику, ссылаемся на телевизор, а рассказывая о механике, приводим в пример паровоз. Поэтому сейчас нам трудно понять тогдашнее недоумение людей, по силе ума подобных Резерфорду. Действительно, для нас сейчас все так прозрачно: просто α-частица отражается от ядер атомов. И к этой картине мы привыкаем с детства. Но чтобы нарисовать ее в первый раз, необходима была выдающаяся научная смелость, основанная на знании, добытом большим трудом. Прежде чем эта картина стала известна каждому, пришлось не только сосчитать свыше миллиона сцинтилляций: нужно было (как вспоминал в конце жизни Гейгер) «…преодолеть такие трудности, смысл которых мы сейчас даже понять не в состоянии»; нужно было сначала в течение десяти (!) лет доказывать, что α-частицы — не что иное, как атомы гелия, потерявшие два электрона. Доказательство оказалось непростым, и Шведская академия наук хорошо понимала это, когда в 1908 году присудила Резерфорду Нобелевскую премию за исследования по химии радиоактивных веществ, в результате распада которых образуются α-частицы. Обо всем этом постепенно забыли: результат был важнее и проще, чем путь, к нему приведший.
Сообщение Резерфорда физики приняли сдержанно. Сам он в течение двух лет также не очень сильно настаивал на своей модели, хотя и верил в безошибочность опытов, которые к ней привели. Причина была все та же: если верить электродинамике, такая система существовать не может, поскольку по ее законам вращающийся электрон неизбежно и очень быстро упадет на ядро. Приходилось выбирать: либо электродинамика, либо планетарный атом. Физики молча выбрали первое. Молча потому, что опыты Резерфорда нельзя было ни забыть, ни опровергнуть. Физика атома зашла в тупик. И чтобы выйти из него, нужен был Нильс Бор.
Лучи
Независимо от гипотез о строении атома ученые рано поняли, что знания о нем можно получить, изучая его линейчатый спектр (так музыкант по тону струны определяет ее длину, а по аккорду узнает инструмент). В физике всякое изучение в конечном итоге сводится к измерению. Поэтому прежде всего необходимо было научиться измерять длины волн как можно точнее, то есть еще пристальнее, чем Фраунгофер, исследовать структуру линейчатого спектра.
На призменном спектрографе Кирхгофа и Бунзена этого сделать уже было нельзя. Стеклянную призму в нем сменила дифракционная решетка, которую значительно усовершенствовал Генри Роулэнд (1848–1901) — представитель тогда еще молодой американской науки.
С помощью этого прибора в течение нескольких десятилетий трудами Карла Рунге (1856–1927), Фридриха Кайзера (1853–1940) и особенно лаборатории Фридриха Пашена (1865–1947) в Тюбингене были точно измерены десятки тысяч спектральных линий различных элементов и аккуратно записаны в длинные таблицы. (К 1913 году общее число работ по спектральному анализу перевалило за 50 тыс. В частности, оказалось, что знаменитая желтая линия D в спектре натрия состоит из двух очень близко расположенных линий: D1 = 5895,9236Å и D2 = 5889,9504Å. (1Å = 10–8 см, то есть примерно равен размеру атома.)
Но высшая задача любой науки не в том, чтобы накоплять факты, а в том, чтобы установить связи между явлениями и найти их причину. Всем было ясно, что в этих длинных таблицах заключена огромная информация о структуре атома. Но как ее оттуда извлечь? (Вероятно, такие же чувства испытывали египтологи до Шампольона, глядя на иероглифы.)
Первый шаг всегда труден и незаметен. Поэтому об Иоганне Якобе Бальмере (1825–1898), который впервые обнаружил какую-то систему в этом хаосе чисел, мы знаем очень мало. Известно, что родился он 1 мая 1825 года в маленьком городке Лаузене Базельского кантона, там же окончил среднюю школу, а затем изучал математику в университетах Карлсруэ, Берлина и Базеля. В 1869 году он стал доктором философии и приват-доцентом Базельского университета, но вскоре оставил профессорское кресло и предпочел преподавать физику в женской гимназии. Бальмеру было уже 60 лет, когда он вдруг заметил, что четыре спектральные линии в видимой части спектра водорода расположены не беспорядочно, а образуют серию, которую можно описать единой формулой:
λ = b · k2/(k2–n2),
где: n = 2; k = 3, 4, 5, 6; b = 3645,6Å.
Это простое соотношение заслуживает всяческого внимания. Дело в том, что оно точное, в чем каждый желающий может легко убедиться сам.
Взгляните на табличку, которую составил в 1885 году Бальмер:
В первом столбце выписаны длины волн упомянутых четырех спектральных линий, вычисленные по формуле Бальмера; во втором — длины волн, которые незадолго перед этим тщательно измерил шведский физик Ионас Андерс Ангстрем (1814–1874). Совпадение измеренных и вычисленных значений поразительное. Такие совпадения не могут быть случайными, и потому открытие Бальмера не затерялось в архивах, а привело к целой цепи новых исследований.
Иногда Бальмера изображают чудаковатым школьным учителем, который от нечего делать делил и умножал различные числа, пока случайно не набрел на простые связи между ними. Это неверно. Он был глубоко образованным человеком, писал статьи по разным вопросам проективной геометрии и постоянно возвращался к самым сложным проблемам теории познания. Например, в 1868 году он опубликовал работу, в которой пытался выяснить соотношение между научными исследованиями и системами мировой философии. Сам он с детских лет находился под влиянием пифагорейцев с их учением о гармонии и мистической роли целых чисел в природе. Как и древние, Бальмер был убежден, что тайну единства всех наблюдаемых явлений следует искать в различных комбинациях целых чисел. Поэтому, когда его внимание привлек набор четко ограниченных спектральных линий, он подошел к этому явлению природы с уже готовой меркой. Его ожидания оправдались: оказалось, что длины волн спектральных линий связаны между собой простыми рациональными соотношениями.
С открытия Бальмера начинается целая эпоха в науке об атоме. По существу, вся теория атома начинается с его формулы. Тогда еще этого не знали, но, вероятно, почувствовали. Уже в 1886 году Рунге заметил, что формула Бальмера становится прозрачнее, если в нее вместо длины волны λ поставить частоту ν = c/λ,
А в 1890 году шведский физик Иоганн Роберт Ридберг (1854–1919) предложил записывать формулу в том виде, который она сохранила до сих пор:
Здесь: c — скорость света, n и k — знакомые нам целые числа, а число R = 109 677,576 см–1 называется с тех пор «постоянной Ридберга» для атома водорода. Полагая в этой формуле n = 2, можно вычислить всю серию Бальмера, измеренную впоследствии вплоть до k = 31.
Тогда же возникла мысль записывать частоту ν в виде разности двух чисел Tn и Tk:
Пока что в такой записи не видно глубокого смысла, да и особых преимуществ тоже. Однако в 1908 году молодой, рано умерший швейцарский ученый Вальтер Ритц (1878–1909) объяснил преимущества такой формы записи. Продолжая работы Ридберга, он сформулировал так называемый комбинационный принцип: частоту ν произвольной линии в спектре любого атома можно представить как разность двух термов Tn и Tk:
νnk = Tn – Tk,
даже в том случае, когда отдельный терм Tn уже нельзя записать в таком простом виде, как для атома водорода.
На первый взгляд в этом нет никакого выигрыша: просто от набора частот мы перешли к набору термов. Однако это не так: попытайтесь прочесть книгу, в которой нет промежутков между словами, и вы сразу почувствуете разницу. Особенно если эта книга на неизвестном языке. Кроме того, чисел стало значительно меньше: чтобы определить частоты 50 линий водорода, которые были известны в начале века, достаточно знать десяток термов.
Неожиданно в хаосе чисел обнаружилась система. Беспорядочный набор линий распался на серии. В непонятной книге стали различать отдельные слова. В простейшем случае — в атоме водорода — удалось разглядеть даже буквы, из которых они составлены. Однако смысл слов и происхождение букв по-прежнему оставались неизвестными: иероглифы еще не заговорили, хотя и не казались теперь столь загадочными.
Стремление осмыслить структуру спектра и в самом деле напоминало попытку почти вслепую расшифровать незнакомый текст. Утомительная работа длилась больше четверти века, и отсутствие общей идеи отталкивало от нее многие глубокие умы. Необходимо было найти ключ к шифру.
Это сделал Нильс Бор в 1913 году.
Кванты
Излучение возникает внутри атома, однако, покинув его, существует независимо. Иногда оно состоит из волн одинаковой длины — такое излучение называют монохроматическим. Линейчатый спектр атома состоит из набора монохроматических лучей, и наборы эти различны для разных атомов.
До сих пор нас большей частью интересовала только одна характеристика волн — их частота ν. Однако лучи — сложное явление, и свойства их нельзя свести только к частоте излучения. Солнечный луч прозрачен, но вполне материален — он даже имеет вес: каждую минуту на квадратный сантиметр поверхности Земли падает 2 · 10–15 г света. На первый взгляд неощутимо мало, но это означает, что за год на нашу планету падает 80 тысяч тонн солнечных лучей. Эти тонны лучей осуществляют круговорот веществ в природе, так что в конечном итоге вся жизнь на Земле возможна только под Солнцем.
Действие излучения легче всего сопоставлять с морскими волнами, набегающими на берег: после работ Христиана Гюйгенса (1629–1695) и Огюстена Жана Френеля (1788–1827) такая аналогия стала бесспорной. Каждый год приносил новые этому доказательства в явлениях интерференции и дифракции света. В 1873 году Джемс Клерк Максвелл (1831–1879) теоретически предсказал, что свет, падая на поверхность тел, должен оказывать на них давление (также в полном согласии с нашей аналогией). Световое давление — очень тонкий эффект, но Петр Николаевич Лебедев (1866–1912) в 1899 году все-таки обнаружил его экспериментально. Казалось, теперь волновая природа света доказана настолько надежно, что всякие дальнейшие опыты для ее проверки не имеют смысла.
К счастью, опыты в физике ставят не только для проверки теорий. И в то время, когда Лебедев завершал свой знаменитый эксперимент, уже существовал другой, столь же тщательный, но более непонятный. В 1887 году Генрих Рудольф Герц (1857–1894) (тот самый, который доказал волновую природу электромагнитного излучения и тем самым справедливость всей электродинамики Максвелла) обнаружил явление, впоследствии названное фотоэффектом. Суть его в следующем.
Если свет ртутной лампы (теперь мы такие лампы называем кварцевыми) направить на металл натрий, то с поверхности его полетят электроны.
В конце века большая часть физиков уже ясно сознавала, что атом сложен, и потому само по себе это явление никого не удивило. Довольно быстро все согласились с тем, что электроны в опыте Герца вылетают из атомов натрия под действием излучения кварцевой лампы.
Странно и непонятно было другое — законы этого явления. Установлены они были Филиппом Ленардом (1862–1947) и Александром Григорьевичем Столетовым (1839–1896) на рубеже XX века. Эти ученые измеряли число выбитых электронов и их скорость в зависимости от интенсивности и частоты падающего излучения.
Мы уже знаем, что лучи, возникающие внутри атомов, различаются между собой не только длиной волны λ (или что то же, частотой ν), но также интенсивностью. Это ясно видно на спектрограммах: некоторые линии там значительно ярче других, например в желтом дублете натрия линия D2 вдвое ярче линии D1.
Наш предыдущий опыт и знания о волнах подсказывают нам, что действие волн тем заметнее, чем больше их амплитуда. Чтобы убедиться в этом, достаточно выйти на берег моря во время шторма. Значит, увеличивая амплитуду, мы тем самым увеличиваем интенсивность лучей. Интенсивность излучения можно увеличить и по-другому: увеличивая число излучающих атомов. Поэтому, если вместо одной ртутной лампы взять две, три, десять, то интенсивность излучения возрастет во столько же раз. Естественно ожидать, что и энергия выбитых электронов вырастет в такой же пропорции.
Но энергия электронов оставалась прежней, менялось лишь число их.
Такова первая несообразность, которая ожидала ученых в конце опытов. Зато энергия зависела от частоты падающего излучения, и притом сильно.
Кварцевая лампа излучает фиолетовые и ультрафиолетовые лучи. Оказалось, что если вместо них на поверхность натрия направить пучок красных лучей, то электроны не вылетят вообще.
— Если излучение — волновой процесс (а это строго доказано), такого не может быть, — утверждали одни.
— Но ведь это происходит! — возражали другие.
Если бы несколько прибрежных утесов неожиданно обрушились на ваших глазах, почти наверное вы бы стали искать внешние причины такой катастрофы. Конечно, волны моря постепенно размывают берег, и время от времени утесы рушатся, но все знают, как редко это бывает. Но если, обернувшись к морю, вы обнаружите там военный корабль, который ведет по берегу пальбу из орудий главного калибра, вы сразу догадаетесь, что причина внезапных разрушений не волны, а снаряды, хотя их энергия и меньше, чем общая энергия морских волн. Однако энергия волн равномерно распределена по всему побережью, и нужны века, чтобы мы увидели результаты их ежедневной работы. По сравнению с этой работой энергия снаряда ничтожна, зато она сосредоточена в малом объеме и выделяется мгновенно. Если к тому же снаряд достаточно велик — он разрушит утес. Последнее важно: действительно, все свойства снаряда, кроме размеров, присущи и пуле, однако сокрушить скалу ей не под силу.
Примерно так рассуждал Эйнштейн, когда предложил свое объяснение явления фотоэффекта. Он знал об открытии Планка, но для него, с его непредвзятой манерой мышления, гипотеза о квантах света не казалась столь ужасной, как самому Планку. Поэтому он был первый, кто не только поверил в нее, но и применил для объяснения новых опытов. Эйнштейн утверждал: свет не только испускается квантами, как того требовала гипотеза Планка, но и распространяется так же — квантами. Поэтому свет, падающий на поверхность металла, подобен не морским волнам, а артиллерийским снарядам. Причем каждый такой снаряд-квант может выбить из атома только один электрон.
Согласно Планку (вспомните первую главу), энергия снаряда-кванта равна hν. По мысли Эйнштейна, какая-то часть ее, назовем ее P, расходуется на то, чтобы вырвать электрон из атома, а остальная часть — на то, чтобы разогнать его до скорости и, то есть сообщить ему кинетическую энергию mv2/2. Оба эти утверждения можно коротко записать в виде простого уравнения:
Стоит принять эту гипотезу — и явление фотоэффекта проясняется. Действительно, пока размеры снарядов малы (красный свет), они не могут выбить электрон из атома (hν < P), как бы много мы их ни посылали. Если же мы начнем увеличивать их размеры (фиолетовый свет), то в конце концов их энергия станет достаточной для выбивания электронов (hν > P). Но по-прежнему энергия «снарядов-квантов» будет зависеть только от их величины (то есть от их частоты ν), а не их числа.
Шестнадцать лет спустя глубокую простоту уравнения Эйнштейна Шведская академия наук отметила Нобелевской премией. Но в 1905 году, когда уравнение было написано впервые, на него нападали все, даже Планк. Он любил Эйнштейна и потому, убеждая прусское министерство просвещения пригласить его на работу в Берлин, просил «…не слишком сильно ставить ему в упрек» гипотезу относительно явлений фотоэффекта.
Планка можно понять: только что вопреки общепринятым традициям и своему желанию он ввел в физику квант действия h. Лишь постепенно приходило к нему сознание неизбежности этого шага. Даже в 1909 году он признавался Эйнштейну: «Я еще плохо верю в реальность световых квант». Однако дело было сделано: «…Планк посадил в ухо физикам блоху», — говорил Эйнштейн двадцать лет спустя, и она не давала им покоя, хотя они и пытались ее не замечать. Во всяком случае, Планк постарался ввести квант действия так, чтобы не пострадала волновая оптика — здание чрезвычайной красоты, созданное в течение двух столетий. Поэтому согласно Планку свет только испускается квантами, но распространяется по-прежнему как волна; только в этом случае удавалось сохранить все результаты волновой оптики.
А Эйнштейн поступал так, как будто до него вообще не существовало физики или, по крайней мере, как человек, ничего не знающий об истинной природе света. Здесь сказалась замечательная особенность Эйнштейна: в совершенстве владея логикой, он больше доверял интуиции и фактам. Для него не было случайных фактов в физике. Поэтому в явлениях фотоэффекта он видел не досадное исключение из правил волновой оптики, а сигнал природы о существовании еще неизвестных, но глубоких законов.
Так уж случилось, что исторически сначала были изучены волновые свойства света. Только в явлениях фотоэффекта физики впервые столкнулись с его корпускулярными свойствами. У большинства из них инерция мышления была настолько велика, что они отказались этому верить. «Не может быть!» — повторяли они, подобно фермеру, увидевшему жирафа впервые в жизни.
Эйнштейн, конечно, знал историю оптики не хуже других. Но его независимый ум равнодушно относился к ее солидному авторитету. Все прежние заслуги оптики для него не имели значения, если они не могли объяснить единственный, но бесспорный опыт. Он глубоко, почти религиозно, верил в единство природы, и для него один такой опыт значил не меньше, чем вся история оптики. А его честность не позволила ему пройти мимо неугодного факта.
В науке по-настоящему опасны только неверные опыты: опытам принято верить. Но любую гипотезу — какой бы привлекательной она ни казалась — всегда тщательно проверяют. Даже если она окажется ложной, опыты, которые ее опровергли, часто приводят к результатам более ценным, чем сама гипотеза. Проверили и гипотезу Эйнштейна — она оказалась истинной.
В 1911 году Роберт Милликен, проверяя уравнение Эйнштейна, определил из него величину постоянной Планка h. Она совпала с тем значением, которое получил Планк из теории теплового излучения. А вскоре поставили опыт, идея которого в точности аналогична картине разрушения утесов на берегу моря. И снова оказался прав Эйнштейн, а не признанный авторитет волновой оптики.
Конечно, Эйнштейн не отрицал, что она все-таки существует. И не оспаривал опытов, которые доказывали волновую природу света. Просто он довел возникшее противоречие до логического конца и предоставил разрешать его следующему поколению физиков.
Несмотря на единодушные протесты, мысль о квантах света не погибла и восемь лет спустя дала могучие всходы. Это произошло в 1913 году, когда в лабораторию Резерфорда пришел застенчивый и неторопливый датчанин Нильс Бор.
Окончательная победа атомистики
20 мая 1904 года в Манчестере, где провел лучшие годы своей ученой деятельности Джон Дальтон, с торжественностью, к которой обязывают традиции англичан и значительность события, был отмечен столетний юбилей атомной теории материи.
Победа ее пришла не сразу: даже после работ Дальтона многие долгое время смотрели на атомистику просто как на «…любопытную гипотезу, допустимую с точки зрения нашей познавательной способности». Единодушие, с которым философы прошлого века отрицали существование атомов, пошатнуло веру в их реальность и у физиков. Например, философ и физик Эрнст Мах (1838–1916) прямо называл всех атомистов «общиной верующих». Его можно понять: человеку трудно вообразить себе нечто далее принципиально неделимое. И все же в начале века идея об атоме победила окончательно: разум оказался способным понять даже то, чего он не в состоянии представить. И случилось это гораздо раньше, чем через 300 лет, как предсказывал Людвиг Больцман (1844–1906), трагически погибший в своем одиночестве, не понятый современниками.
Но победа эта все-таки немного запоздала: после работ Томсона и Резерфорда понятие «атом» потеряло свой прежний смысл. Стало ясно, что атом — это не самая простая частица вещества, хотя его и нельзя расщепить средствами химии. «К сожалению, законы природы становятся вполне понятными только тогда, когда они уже не верны», — говорил Эйнштейн. Это не означает, конечно, что одновременно с этим законы теряют и все свое значение. В истории атома — независимо от дальнейших успехов науки — доказательство его реальности (даже в старом смысле ατομος — неделимый) навсегда останется одной из самых важных ее побед.
Окончательное утверждение атомистики также связано с именем Эйнштейна: в том же 1905 году независимо от польского физика Мариана Смолуховского (1872–1917) он дал математическое описание брауновского движения. Его теорию подтвердил экспериментально Жан Перрен, который в 1909 году предпринял систематические и тщательные исследования брауновского движения. И до Перрена многие физики были убеждены, что истинная причина этих движений — толчки молекул жидкости, которые сами невидимы даже в лучший микроскоп. Но удивительные по изяществу опыты Перрена не просто доказали справедливость этих утверждений — из них следовало нечто большее: непонятное движение частиц в жидкости есть точная модель истинного движения невидимых молекул, увеличенная в несколько тысяч раз. Поэтому, изучая брауновское движение частиц, мы тем самым получаем наглядную картину движений невидимых молекул. (Точно так же, как знание свойств радиоволн дает нам представление о волнах света и даже о рентгеновых лучах.)
После этих работ гипотезу об атомах признали все, даже знаменитый враг ее — Вильгельм Оствальд (1853–1932). А в 1909 году тот же Резерфорд, который доказал сложную структуру атома, вместе с Ройдсом дал и наиболее убедительное доказательство атомистической структуры вещества. Вот как это произошло.
Уже давно было замечено, что в минералах, содержащих радиоактивные вещества: торий, уран, радий, скапливается гелий. Измерили даже, что из 1 г радия в состоянии радиоактивного равновесия выделяется 0,46 мм3 гелия в день, то есть 5,32 · 10–9 см3/сек. После установления природы α-частиц ничего чудесного в этом факте не было. Но Резерфорд на этом не остановился: он сосчитал число α-частиц, которое вылетает в секунду из 1 г радия. Оно оказалось большим, но вполне определенным: 13,6 · 10–10 частиц/г·сек. Все эти α-частицы, захватив по два электрона, превращаются в атомы гелия и занимают объем 5,32 · 10–9 см3. Следовательно, в 1 куб. см содержится
L = 13,6 · 1010/5,3 · 10–9 = 2,56 · 1019 атомов
Но ведь это и есть то самое число Лошмидта, которое он вычислил на основании молекулярно-кинетической гипотезы! Действительно, один грамм-атом гелия (как и любого газа) занимает объем 22,4 л и содержит 6,02 · 1023 атомов, то есть в 1 см3 помещается атомов
L = 6,02 · 1023/22,4 · 103 = 2,69 · 1019
Совпадение убедительное.
Но человеку присуща необъяснимая потребность: прежде чем признать что-то окончательно, ему надо увидеть это что-то своими глазами. (Строго говоря, для этого нет никаких оснований: мы постоянно становимся жертвами оптических обманов). Эту любопытную потребность человеческого познания вполне удовлетворил в 1911 году Чарлз Томсон Рис Вильсон (1869–1959). После пятнадцати лет усилий он создал свою знаменитую камеру, которая позволяла проследить движение отдельных α-частиц по туманным следам, которые они оставляли.
Конечно, значение этого изобретения было не в том, что оно успокоило капризы человеческой психики, а в том, что в руках у физиков был теперь новый инструмент для исследования структуры атома.
Мы напомнили сейчас далеко не все опыты, которые в конечном итоге убедили всех: да, действительно, число N атомов в грамм-молекуле любого вещества хотя и очень велико, но конечно. Как и число людей на Земле, это число N не может быть дробным. Более того, число Авогадро N = 6,02497 · 1023 мы знаем сейчас значительно точнее, чем число жителей Земли.
«Если бы в результате какой-то мировой катастрофы все накопленные научные знания вдруг оказались бы уничтоженными и к грядущим поколениям живых существ перешла бы только одна фраза, то какое утверждение, составленное из наименьшего количества слов, принесло бы наибольшую информацию? Я считаю, что это атомная гипотеза (можете называть ее не гипотезой, а фактом — это ничего не меняет): Все тела состоят из атомов — маленьких телец, которые находятся в беспрерывном движении, притягиваются на небольшом расстоянии, но отталкиваются, если одно из них плотнее прижать к другому.
В одной этой фразе содержится невероятное количество информации о мире, стоит лишь приложить к ней немного воображения и чуть соображения».
Эти слова принадлежат Ричарду Фейнману, нашему современнику, Нобелевскому лауреату 1965 года по физике. И хотя они почти дословно повторяют Демокрита, понятия и образы, которые мы с этими словами связываем теперь, совсем другие: за 25 столетий об атоме узнали много нового.
Это было не просто — просты только результаты науки, и они не зависят от личности исследователя — в этом их ценность.
Вокруг кванта
Атомы и пустота
Даже люди, легко гнущие подковы, признают, что атомы твердые: в детстве им ведь тоже приходилось расшибать коленки об углы. Поэтому очень трудно представить себе атом таким же пустым, как пространство между Землей и Солнцем, и в то же время необычайно устойчивым.
Известно, например, что вода останется водой даже под давлением в 10 тыс. атмосфер. Это очень большое давление: так примерно будет давить слон, если его поставить на площадку в 1 кв. см. Легко подсчитать, что при таком давлении на каждый атом действует сила примерно 10–9 г, то есть в 100 миллионов миллионов (1014) раз превышающая его собственный вес (10–23 г). Это все равно как если бы на того же слона взгромоздить сотню Джомолунгм.
Все это удивительно, но не мешает атомам быть пустыми, поразительно пустыми: все ядра атомов, из которых построена Джомолунгма, можно упаковать в один мешок.
Дифракционная решетка
Неизвестно, как обернулась бы история атома, если бы физики не изобрели дифракционную решетку.
Ее использовал уже Фраунгофер; Ангстрем сделал ее главным инструментом своих исследований, и наконец Роулэнд придал ей почти современную форму. Принцип действия решетки основан на явлении дифракции, то есть на способности волн огибать препятствие, если оно сравнимо с их длиной. Волны различной длины огибают препятствие по-разному, что позволяет разделить их и точно измерить.
Благодаря этому прибору в спектроскопии достигнуты точности измерений, удивительные даже для физики. Уже в начале века удавалось разделить две линии в видимом спектре, если их длины волн отличались друг от друга хотя бы на 10–3Å (сейчас точность повышена до 10–4Å).
Чтобы наглядно представить себе точность подобных измерений, вообразите, что вы захотели измерить длину экватора с точностью до метра. Ясно, что в этой попытке нет нужды, да и особого смысла тоже, просто потому, что результат такого измерения будет зависеть от каждого муравейника на пути. Но в спектроскопии подобные усилия представляют не только спортивный интерес; и дальнейшая история атома убедительно это доказала — вопреки недоверию и насмешкам, которые эти усилия подчас сопровождали. Тому подтверждением — судьба эталона метра.
Знаменитый платино-иридиевый стержень с двумя рисками, отлитый по решению Конвента и хранящийся под стеклянным колпаком в Международном бюро мер и весов в Севре близ Парижа, оказался не равным в точности одной сорокамиллионной доле земного меридиана, как это вначале предполагали.
Французский академик Жак Бабине (1794–1872) был одним из первых, кто высказал сомнение в целесообразности такого выбора эталона длины и предложил принять за эталон длину волны какой-либо спектральной линии «…как величину, абсолютно неизменную и независимую даже от космических переворотов». Его предложение приняли только в 1958 году, когда был узаконен новый эталон метра: длина, на которой укладывается 1 650 763,73 длины волны оранжевой линии криптона Kr-86 в вакууме.
Что сделал Резерфорд?
В начале века мысли о планетарном строении атома не были такой редкостью, как это принято сейчас думать. Эти мысли открыто излагались даже на страницах учебников.
Для примера приведем несколько выдержек из III тома курса электричества, изданного в 1908 году профессором Парижского университета Г. Пелла:
«…атом не является неделимой частичкой материи. Испускание света, дающего спектральные линии, характерные для каждого рода атомов, указывает уже на разнородность атомов. Можно было бы предположить, что атом состоит из очень большого числа корпускул, которые притягиваются к какому-нибудь центру, как планеты притягиваются к Солнцу.
Для нейтральности атома необходимо, чтобы положительный электрический заряд, который, как мы предположили, находится в центре атома, был бы равен по абсолютной величине сумме отрицательных зарядов-корпускул, вращающихся вокруг него.
Словом, все световые, электрические, тепловые и механические явления можно объяснить, допустив существование двух различных материй: корпускулы, или отрицательного электрона, и положительного электрона, о котором нам почти ничего не известно. Центральный положительный заряд атома состоит из совокупности положительных электронов, число которых изменяется в зависимости от рода атома, но остается вполне определенным для каждого рода атомов…
Лишнее было бы доказывать красоту этой теории, которая дает возможность объяснить все известные до сих пор явления и позволяет связать столько явлений и законов, не имевших, казалось, ничего общего между собой».
После этой цитаты многие разочаруются: Резерфорд не придумал ничего нового. Это обычное и частое заблуждение происходит от непонимания различий между наукой и натурфилософией. В науке действует строгое правило: открыл тот, кто доказал. А доказать что бы то ни было в науке можно лишь с помощью опытов и чисел.
Все прежние высказывания опирались на чистое умозрение и потому звучали примерно так: атом, вероятно, может иметь такую-то структуру. Только Резерфорд имел моральное право сказать: «Так должно быть. Я могу доказать это с числами в руках. И каждый, кто захочет, может проверить их, если повторит мои опыты».
«Сказать, оно конечно, все можно, а ты поди демонстрируй», — любил повторять Менделеев. И эту разницу между расплывчатой идеей и научным доказательством всегда следует помнить в частых спорах о приоритете, которые время от времени вспыхивают в истории науки. В таких случаях разумно считать создателями теорий не тех, кто их впервые высказал, а тех, чьи работы — в силу глубоких причин или случайных обстоятельств — оказали решающее влияние на последующее развитие науки. В этом есть элемент чисто человеческой несправедливости. Но история не мыслит категориями морали: ее задача не успокоение обид, а установление истинной последовательности причин и следствий.
Световое давление
Гипотеза о световом давлении появилась уже во времена Кеплера, который выдвинул ее в 1619 году для объяснения происхождения и формы хвостов комет. О величине светового давления не было известно ничего и, как всегда в таких случаях, о нем рассказывали баснословные истории. Например, некто Гартзокер в 1696 году передавал рассказ путешественников, по словам которых «течение вод Дуная значительно медленнее утром, когда лучи Солнца противодействуют его движению, и ускоряется после полудня, когда лучи Солнца помогают его течению».
До конца прошлого века многочисленные попытки обнаружить световое давление экспериментально оканчивались полной неудачей. Причина этих неудач стала вполне ясной после теоретических работ Максвелла и успешных опытов Лебедева. Оказалось, что световое давление очень мало. Например, даже в ясный, безоблачный день давление солнечного луча на площадку в 1 кв. см не превышает 0,82 · 10–10 г. Для сравнения напомним, что маковое зерно весит в миллион раз больше.
Глава четвертая
До Бора ♦ Атом Бора ♦ После Бора ♦ Формальная модель атома
В свое время почти каждый из нас грезил пиратами и фрегатами. В пылких мечтах мы переживали бои и погони, тайны острова сокровищ и подвиги благородства. Мы видели почти наяву, как по голубому морю, слегка накренившись, фрегаты бесшумно уходят за горизонт, оставляя за кормою пенный след. Иногда, чтобы увеличить скорость парусника, пираты шли на отчаянный шаг: они выбрасывали за борт балласт и лишь благодаря этому благополучно уходили от погони. Зачастую это им сходило с рук, но время от времени они бывали жестоко наказаны: фрегат, лишенный балласта, становился неустойчивым, как яичная скорлупа под парусами, и первый же шквал опрокидывал его вверх дном.
Эта глава, пожалуй, самая трудная в книге. На первый взгляд она может показаться настолько сухой и неоправданно сложной, что некоторые читатели сочтут ее ненужным балластом. Но это тот самый балласт, который кладут на дно фрегата, балласт, без которого все паруса нашей фантазии не только бесполезны, но и опасны. Слишком часто в погоне за быстротой и легкостью мы пренебрегаем устойчивостью и глубиной. Однако такая беспечность не остается безнаказанной: в какой-то момент переполненная чаша знаний, лишенная опоры точных фактов, опрокидывается, и все приходится начинать сызнова.
В этой главе нет ничего такого, чего бы не смог понять вдумчивый и неторопливый читатель. Однако она требует некоторых навыков последовательного логического мышления. Как правило, эти минимальные усилия вознаграждаются впоследствии большей полнотой и «объемностью» приобретаемых познаний. Вполне вероятно, что при первом чтении глава вызовет больше вопросов, чем разрешит. Это не беда. Зато она хоть немного позволит заглянуть внутрь «физической кухни», которая обычно скрыта за парадными обедами и здравицами в честь квантовой механики. А главное — лишь после таких экскурсов в глубь новых знаний возникает психологическое ощущение их стройности и устойчивости.
До Бора
К тому времени, когда Нильс Бор появился в лаборатории Резерфорда в Манчестере, об атоме знали уже довольно много. Настолько много, что порой это мешало выделить из груды фактов главные.
На схеме (стр. 78–79) представлены только те из явлений, которые впоследствии оказались действительно основными для понимания структуры атома.
На основании этих фактов (которые наблюдать довольно легко) надо было угадать внутреннее устройство атома — объекта, который никто никогда не видел и не увидит. А у задач подобного типа есть общее название: проблема «черного ящика». Мы знаем характер воздействия на «черный ящик» — атом и результат этого воздействия, то есть знаем, что происходит и отчего. Но мы хотим знать больше: как все происходит, то есть механизм явлений, протекающих в черном ящике. Достигнуть этого значительно труднее, чем восстановить действие в зрительном зале по обрывкам музыки и речи.
Даже если мы знаем все внешние проявления внутренних свойств атома, необходимо еще их обобщение, синтез, необходима интуиция, которая через провалы в логических построениях безошибочно приводит к единственно верной картине явлений.
Из нашей далеко не полной схемы видна сложность задачи: необходимо с единой точки зрения (и непротиворечиво) объяснить все эти — очень разные — опыты. Нильс Бор нашел такое объяснение, причем оно оказалось удивительно простым и совершенным по форме.
Это случилось тогда, когда Бору вдруг стало ясно, что три физические идеи: атомы, лучи, электроны — связаны между собой понятием кванта. До сих пор эти идеи развивались независимо. Химия и кинетическая теория материи доказали существование атомов. Электромагнитная теория света Максвелла изучала свойства лучей. Электродинамика Максвелла — Лоренца пыталась осмыслить понятие «электрон».
Квант действия h, даже после работ Эйнштейна и Милликена, в Европе никто не принимал всерьез, хотя отдельные попытки использовать его были: в 1910 году Артур де Гааз попытался применить соотношение Планка E = hν для определения границ и периодов движения электронов в атоме Томсона; Джон Никльсон в 1912 году пытался использовать идею квантов для анализа спектров Солнца и туманностей, а Вальтер Нернст выдвинул гипотезу о квантовании вращений.
Скептическое отношение к идее квантов лучше всего выразил сам Планк в книге, которую он написал в 1912 году. «Когда подумаешь о полном экспериментальном подтверждении, которое получила электродинамика Максвелла в самых тонких явлениях интерференции, когда подумаешь о невероятных трудностях, которые повлек бы за собой отказ от нее для всей теории электрических и магнитных явлений, то испытываешь какое-то отвращение, когда сразу же разрушаешь эти основы. По этой причине во всем дальнейшем изложении мы оставим в стороне гипотезу квантов света, тем более что ее развитие находится еще в зачаточном состоянии».
Атом Бора
В 1912 году Нильс Бор уже работал в Манчестере у Резерфорда. Манчестер отделен от Европы Ла-Маншем, и, вероятно, поэтому в лаборатории Резерфорда к гипотезе квантов относились хотя и осторожно, но без континентального недоверия. Быть может, поэтому, когда Планк писал свою книгу, Нильс Бор уже был твердо убежден в том, что «…электронное строение атома Резерфорда управляется с помощью кванта действия». Но прошел еще год упорных размышлений, прежде чем он сформулировал свои знаменитые «постулаты Бора».
Как он должен был при этом рассуждать?
Когда Александр Македонский увидел перед собой узел Гордия, то просто разрубил его мечом — он был полководец и победитель. Бору пришлось труднее, но поступил он аналогично. Рассуждал он примерно так: по законам механики, чтобы электрон в планетарном атоме Резерфорда не упал на ядро, он должен вокруг него вращаться. Но по законам электродинамики он обязан при этом излучать энергию и в конце концов все равно упасть на ядро. Нужно запретить ему падать на ядро.
— Позвольте, — возражали ему, — как это — запретить? Между электроном и ядром действуют электрические силы?
— Да, — отвечал Бор.
— Они описываются уравнениями Максвелла?
— Да.
— И даже масса m и заряд e электрона определены из электрических измерений?
— Да.
— Значит, движение электрона в атоме также должно подчиняться электродинамике Максвелла?
— Нет!
Согласитесь, что такой способ ведения спора может рассердить даже очень спокойного человека. «Но ведь атом все-таки устойчив! — без конца повторял Бор в ответ на все возражения. — И мы не знаем более простой причины этой устойчивости, кроме той, что она есть».
В поисках разумного основания для этого несомненного факта Бор наткнулся на книгу Иоганна Штарку «Принципы атомной динамики» и там впервые увидел формулы Бальмера и Ридберга.
«Мне сразу все стало ясно, — вспоминает Бор. — И после многочисленных попыток использовать квантовые идеи в более строгой форме ранней весной 1913 года мне пришло в голову, что ключом к решению проблемы атомной устойчивости являются изумительно простые законы, определяющие оптический спектр элементов».
Теперь он мог сформулировать свои знаменитые постулаты:
1-й постулат — о стационарных состояниях. В атоме существуют орбиты, вращаясь по которым электрон не излучает.
2-й постулат — о квантовых скачках. Излучение происходит только при перескоке электрона с одной стационарной орбиты на другую. При этом частота излучения ν определяется гипотезой Эйнштейна о квантах света ΔE = hν, где ΔE — разность энергий уровней, между которыми происходит переход.
Чтобы понять эти постулаты несколько глубже, обратимся к очевидной аналогии между предполагаемым вращением электрона вокруг ядра и вращением спутника вокруг Земли. В свое время Ньютон открыл закон всемирного тяготения, размышляя над вопросом: «Почему Луна не падает на Землю?» Сейчас этот вопрос задают только в старых анекдотах, ибо все знают ответ: «Потому что она движется, причем со строго определенной скоростью, которая зависит от расстояния ее до Земли». Таким образом, чтобы спутник не упал на Землю и в то же время не улетел в космос, между радиусом его орбиты r и скоростью движения по ней v должна существовать определенная связь.
В атоме водорода при движении электрона с массой m и зарядом e вокруг ядра атома между скоростью электрона v на орбите и радиусом орбиты r существует аналогичная связь, которую можно записать в виде уравнения:
mv2/r = e2/r2.
Это уравнение верно всегда — независимо от того, излучает электрон или не излучает. Оно просто отражает известное равенство центростремительной и притягивающей сил.
Если электрон теряет энергию на излучение (по законам электродинамики), то он упадет на ядро, как спутник при торможении в атмосфере. Но если существуют особые — стационарные — орбиты, на которых он не подчиняется законам электродинамики и потому не излучает, то должны существовать также дополнительные условия, которые выделяют эти орбиты из набора всех возможных.
Как появляются эти условия, легче всего показать, продолжив нашу аналогию со спутником.
У кругового движения, кроме радиуса орбиты r и скорости v движения по ней, есть еще одна характеристика — момент количества движения l, или, коротко, орбитальный момент l. Он равен произведению массы m на скорость v и на радиус орбиты r, то есть l = mvr, и для спутника может принимать произвольные значения в зависимости от величины r и v.
Бор утверждал: электрон в атоме отличается от спутника тем, что его орбитальный момент l не может быть произвольным — он равен целому кратному от величины ħ = h/2π (это обозначение предложил один из создателей квантовой механики, Поль Дирак)
mvr = nħ.
Это и есть то дополнительное условие Бора, которое выделяет стационарные орбиты (единственно допустимые в атоме) из бесконечного числа мыслимых. А поскольку при таком выделении основную роль играет квант действия h, то и весь процесс назвали квантованием.
Из предыдущих двух условий Бор легко получил значения энергии En и радиусов rn стационарных орбит:
Стационарные орбиты (а следовательно, и уровни энергии) нумеруются целыми числами n или k, которые пробегают бесконечный ряд значений: 1, 2, 3… При переходе с уровня n на уровень k электрон излучает энергию ΔE = Ek–En, а частота излучения, которое при этом, возникает, определяется по формуле Эйнштейна:
Если мы наблюдаем излучение, которое возникает при переходах электрона со всевозможных уровней k на какой-то определенный уровень n, то мы увидим не просто набор спектральных линий, а серию. Например, если n = 2, а k = 3, 4, 5, 6… то мы увидим серию Бальмера. Отсюда сразу же следует знаменитая формула Бора для частоты излучения атома водорода:
Что из нее следует?
Прежде всего она очень напоминает формулу Ридберга для атома водорода, которую тот нашел эмпирически задолго до Бора и о которой мы подробно рассказали в предыдущей главе. Если формула Бора верна, то из нее можно вычислить постоянную Ридберга R.
R = me4/4πcħ3.
Вычислили. И действительно, ее значение совпало с тем, которое давно было известно из спектроскопических измерений.
Это был первый успех теории Бора, и он произвел впечатление чуда.
Но это еще не все. Из теории Бора следовало, что радиус атома водорода в основном (невозбужденном) состоянии (n = 1) равен
r1 = ħ2/me2 = 0,53 · 10–8 см = 0,53Å.
Это означает, что размеры атомов (≈ 10–8 см), вычисленные по его формуле, совпадали с предсказаниями кинетической теории материи.
И наконец, теория Бора объяснила: как свойства линейчатого спектра связаны с внутренним строением атома. Интуитивно эту связь чувствовали всегда. Но только Бору впервые удалось выразить ее математически. Оказалось, что искомую связь осуществляет постоянная Планка h.
Это было неожиданно. Действительно, квант действия h возник в теории теплового излучения и никаким очевидным образом не был связан ни с атомами, ни с лучами, которые эти атомы испускают. И тем не менее именно он позволил вычислить абсолютные размеры атома и предсказать частоту света, излучаемого им. Угадать эту связь Бору, как и многим до него, помогла глубокая вера в единство природы.
Постулаты Бора (как и всякие постулаты) нельзя обосновывать логически или вывести из более простых. Они остаются произвольными творениями человеческого разума до тех пор, пока опыт не подтвердит следствий, которые из них вытекают. Тогда на их основе развиваются теории, а наиболее удачные из теорий называют законами природы.
Мы ограничимся только этими тремя следствиями теории Бора — на самом деле их значительно больше, и все они демонстрируют непонятную силу непонятных постулатов.
Конечно, Бор пришел к ним несколько другим путем, чем мы с вами сейчас: когда человек впервые поднимается на незнакомую вершину, трудно ожидать, что он идет самым коротким путем. Только взойдя на пик, он видит, как можно было покорить его проще.
После Бора
Несмотря на необычность постулатов Бора, его теория нашла довольно быстрое признание и достаточно много талантливых и сильных последователей. Если бы потребовалось определить отношение к ней физиков в те годы, то, пожалуй, пришлось бы назвать чувство облегчения, чувство освобождения от того постоянного напряжения, в котором все они до сих пор находились, пытаясь удержать в памяти разрозненные факты и хоть как-то связать концы с концами. Теперь все атомные явления, естественно, группировались вокруг непонятной, но простой модели; часть из них блестяще ею объяснялась, а другая требовала дальнейшего развития модели.
В частности, теперь очень просто можно было объяснить опыт Кирхгофа и Бунзена с парами натрия.
Действительно, пока луч от раскаленного тела не прошел через пары натрия, атомы которого находятся в основном состоянии, он содержит все длины волн. Проходя через пары, луч переводит атом натрия из основного состояния в первое возбуждение. На это затрачивается энергия кванта E = hν, частота которого ν как раз и совпадает с частотой линии D натрия. Поэтому прошедший свет уже не содержит лучей с этой частотой, и на шкале спектрографа мы видим сплошной спектр, перерезанный в желтой части темной линией D.
В обратном процессе, когда атомы натрия переходят из возбужденного состояния в основное, они излучают свет с той же частотой ν, которую прежде поглотили, то есть ту же линию D, но теперь уже ярко-желтую.
Несмотря на все успехи теории Бора, физики вначале принимали ее скорее как удобную модель, но не очень верили в реальность такой энергетической лестницы в атоме. Это сомнение разрешили Джеймс Франк (1882–1964) и Густав Герц (род. 1887) (племянник знаменитого Генриха Герца) в том же 1913 году. Как и всякая ясная идея, теория Бора не только объясняла старые факты, но также подсказывала пути для своей проверки.
Арнольд фон Зоммерфельд (1868–1951) — замечательный физик и блестящий педагог — был одним из первых в Европе, кто сразу же не только поверил в постулаты Бора, но и развил их дальше, «…следуя, как когда-то Кеплер при изучении планетной системы, внутреннему чувству гармонии». Он рассуждал так: если атом подобен солнечной системе, то электрон в такой системе может вращаться не только по окружности, как в модели Бора, но и по эллипсам, причем ядро должно находиться в одном из фокусов этих эллипсов.
Эллипсы с одинаковой большой полуосью принадлежат одному и тому же значению главного квантового числа n, так как энергии электрона на таких орбитах равны между собой (Зоммерфельд знал доказательство, а нам придется поверить в это). Однако эллипсы различаются по степени сплющенности, которая зависит от орбитального момента. Вполне в духе идей Бора Зоммерфельд предположил, что при заданном n эллипсы могут быть сплющены не произвольным образом, а только так, чтобы орбитальное квантовое число l (которое их различает) принимало целые значения l = 0, 1, 2, …, n–1, то есть число допустимых эллипсов не превышает числа n — номер стационарного состояния.
Бор и Зоммерфельд показали даже нечто большее: если учесть теорию относительности Эйнштейна, то окажется, что энергия электрона различна на всех эллипсах, а потому уровни энергии в атоме необходимо нумеровать двумя квантовыми числами: n и l. По той же причине спектральные линии, возникающие при переходах электрона между уровнями с разными n, должны иметь тонкую структуру, то есть расщепляться на несколько компонент. По просьбе Зоммерфельда Фридрих Пашен проверил и подтвердил это следствие теории на примере линии гелия λ = 4686Å, которая соответствует переходу с уровня n = 4 на уровень n = 3 (с четвертого уровня на третий). Внимательно рассмотрев фотографию спектра гелия, он обнаружил, что линия в действительности состоит из тринадцати тесно расположенных линий.
Это было удивительное совпадение, и в то время (1916 году) его сравнивали с вычислениями Леверье и Адамса, которые предсказали планету Нептун.
Но даже два квантовых числа — n и l не объяснили всех особенностей спектров. Например, если поместить излучающий атом в магнитное поле, то спектральные линии расщепляются совсем по-другому.
Расщепление спектральных линий в магнитном поле пытался обнаружить Фарадей еще в 1862 году в своей, последней (уже неопубликованной.) работе. Однако магнит, который он для этой цели использовал, был слишком слаб, и лишь в 1896 году Питер Зееман наблюдал явление, которое в свое время тщетно искал Фарадей.
После работ Бора и Зоммерфельда явление расщепления спектральных линий в магнитном поле стали толковать следующим образом. Представьте, что перед вами электромотор. Даже не вникая в технические детали его устройства, вы со школьных лет знаете, что его ротор начнет вращаться, если через его обмотку пропустить электрический ток. Электрон, движущийся в атоме по замкнутой орбите, подобен витку тока в обмотке электромотора. И точно так же, как этот виток, орбита электрона в магнитном поле начнет поворачиваться. Однако в отличие от витка она не может занимать в атоме произвольные положения, поскольку этому препятствуют квантовые законы. Суть этих квантовых законов проще всего понять, взглянув на прилагаемый рисунок. На рисунке магнитное поле направлено снизу вверх, а орбита электрона изображена «с ребра», причем радиус орбиты численно равен значению орбитального момента l (на рисунке l = 3). Оказывается, законы квантования допускают только такие положения плоскости орбиты относительно магнитного поля H, при которых проекция диаметра орбиты на направление поля H равна целому числу. Это третье — магнитное квантовое число m, как легко видеть, принимает значения m = l, l–1, …, 1, 0, –1, …, –(l–1), –l, то есть всего (2l+1) значений.
Таким образом, в магнитном поле каждый уровень Enl с заданными значениями квантовых чисел n и l расщепится еще на (2l+1) подуровня Enlm, каждый из которых однозначно определяется заданием трех целых квантовых чисел: n, l, m. А это, мы знаем, приводит к дополнительному расщеплению спектральных линий.
Усложняясь, теория Бора постепенно теряла свое первоначальное изящество и наглядность. На ее место пришла формальная модель атома, от которой требовалось лишь одно: дать правильную систематику термов. Термин «квантование» постепенно потерял свой прежний смысл: им обозначали теперь формальный процесс сопоставления целых (квантовых) чисел n, l, и m каждому уровню энергии в атоме, а точнее, тому типу движения, в котором находится электрон. Квантовые числа n, l, и m определяют стационарные орбиты в изолированном атоме. Внешние поля (электрическое и магнитное) влияют на движение электрона в атоме (расщепление уровней энергии), а это сразу же сказывается на структуре светового сигнала, который испускает атом (расщепление спектральных линий).
Формальная модель атома
Популяризация (как и всякая наука) имеет свои границы. Как правило, они определяются тем, что с некоторого момента становится невозможным использовать понятия и образы повседневной жизни. Для того чтобы эту границу преодолеть, нужно перейти на язык формальных понятий науки (для начала хотя бы примитивный). При всех попытках уйти от этого шага неизбежно возникает неосознанное глухое недовольство, а самая суть науки остается скрытой. Наоборот, преодолев минимальные затруднения, вы можете почувствовать силу логических построений науки и оценить красоту их следствий. Как правило, возникающие технические затруднения ничуть не больше тех, с которыми сталкивается любой школьник при изучении химии: довольно быстро он убеждается, что проще (а главное — понятнее) написать формулу H2O, чем каждый раз говорить: «Молекула, которая состоит из двух атомов водорода и одного атома кислорода».
Нечто похожее на химические формулы принято и в теории спектров, где главное квантовое число n обозначают цифрами: 1, 2, 3, … а орбитальный момент l — буквами, причем ряду чисел 0, 1, 2, 3, … соответствует ряд букв s, p, d, f, …. Поэтому символ 3s, например, соответствует уровню энергии с квантовыми числами n = 3, l = 0, а символ 3p — уровню с n = 3, l = 1.
В невозбужденном атоме натрия излучающий электрон находится в состоянии 3s. А темная линия D возникает в том случае, если при возбуждении атома электрон переходит в состояние 3p. При обратном переходе 3p→3s он излучает энергию и возникает ярко-желтая линия D.
А что произойдет, если излучающий натрий поместить в магнитное поле? Вначале, следуя Зоммерфельду, предполагали, что при этом верхний уровень 3p должен расщепиться на 3 компоненты 2l + 1 = 2 · 1 + 1 = 3, а нижний останется без изменения. В итоге каждая из линий D1 и D2 должна расщепиться на 3 компоненты.
Опыт противоречит такому заключению. Из рисунка видно, что линия D1 расщепляется на 4 компоненты, а линия D2 — на 6. Это явление — частный случай так называемого аномального эффекта Зеемана. Чтобы понять его причину, необходимо немного возвратиться назад и уяснить себе вопрос, которого мы раньше сознательно избегали: почему даже в отсутствие магнитного поля D-линия натрия состоит из двух тесно расположенных компонент D1 и D2?
Мучительно размышляя над этим вопросом, ученик Зоммерфельда Вольфганг Паули (1900–1958) пришел в 1924 году к открытию спина электрона (от английского слова spin — веретено). Он рассуждал примерно так: обе линии D1 и D2 соответствуют одному и тому же переходу с уровня n = 3, l = 1 на уровень n = 3, l = 0. Но их все-таки две! Значит, существует не один, а два верхних уровня 3p и еще какое-то дополнительное квантовое число, которое их различает. Свойство, которому соответствует это четвертое квантовое число S, он назвал «неклассической двузначностью электрона» и предположил, что оно может принимать только два значения: +½ и –½. Паули считал, что наглядное представление этого свойства невозможно.
Но уже в следующем году Джордж Уленбек (род. 1900) и Сэмюэл Гаудсмит (род. 1902) нашли наглядную модель для объяснения этого свойства электрона, допустив, что он вращается вокруг своей оси. Такая модель прямо следовала из аналогии между атомом и солнечной системой: ведь Земля вращается не только по эллипсу вокруг Солнца, но еще и вокруг своей оси (эту аналогию отмечал и Комптон в 1921, а Крониг — в 1923 году, но Паули резко против нее восстал).
Уленбек и Гаудсмит предположили, что, кроме орбитального момента l, значения которого — целые числа и который возникает при движении по эллипсу, электрону присущ внутренний момент вращения, или спин S, равный по величине S = ½. Складываясь с орбитальным моментом l, этот внутренний момент S может его увеличить или уменьшить. В результате возникает полный момент j, равный либо j1 = l–½, либо j2 = l+½, в зависимости от взаимной ориентации векторов l и S. Если же l = 0, то полный момент и спин совпадают (j = S = ½).
Теперь все встало на свои места: уровень 3s в атоме натрия останется без изменения, так как соответствует моменту l = 0, но уровень 3p расщепится на два: 3p1/2 и 3p3/2, энергии которых немного различны.
В магнитном поле каждый из уровней с полным моментом j (как и в случае момента l) расщепляется еще на (2j + 1) компонент, которые различаются значением магнитного квантового числа m. Таким образом, каждый из уровней 3s1/2 и 3p1/2 расщепится еще на два подуровня, а уровень 3p3/2 — на четыре. В результате возникает та схема уровней и переходов между ними, которая изображена на рисунке (стр. 94) и которая полностью объясняет структуру линий.
Из рисунка видно, как усложнялась первоначальная модель Бора, в которой существовал только один уровень с n = 3. Когда приняли во внимание теорию относительности, он расщепился на два — 3p (n = 3, l = 1) и 3s (n = 3, l = 0). С учетом спина электрона уровень 3p расщепляется еще на два подуровня — 3p1/2(n = 3, l = 1, j = 1/2) и 3p3/2(n = 3, l = 1, j = 3/2). И наконец, в магнитном поле мы получим систему уровней, изображенную на нашем рисунке, которая приводит к картине спектральных линий, наблюдаемых на опыте.
Гипотеза о спине электрона — одна из самых глубоких в физике. Вполне осмыслить ее значение не удалось до сих пор. И Паули был, конечно, прав, предостерегая от прямолинейных попыток представлять электрон как вращающийся волчок.
Влияние спина на физические процессы в атоме и на его строение проявляется иногда самым неожиданным образом. Одна из таких особенностей спина составляет содержание знаменитого принципа запрета Паули: в атоме не может быть двух электронов, квантовые числа которых n, l, m, S одинаковы. В дальнейшем мы видим, что только этот принцип позволил найти рациональное объяснение периодической системы элементов Дмитрия Ивановича Менделеева.
Даже по стилю изложения вы, наверное, сейчас заметили, насколько формальная модель атома беднее образами по сравнению с моделью Бора, насколько труднее рассказать о ней привычными словами и представить наглядно. И тем не менее вы, вероятно, ощутили ее силу: на ее основе можно объяснить и предсказать самые тонкие особенности спектров. Устрашающее количество спектральных линий удалось привести в порядок. Теперь, чтобы однозначно определить любую линию в спектре атома, достаточно было задать восемь квантовых чисел: четыре для исходного уровня излучающего электрона (ni, li, mi, Si) и четыре для конечного (nk, lk, mk, Sk)
К 1925 году эта героическая работа была закончена. Иероглифы были расшифрованы, что позволило нарисовать первую и пока грубую картину внутреннего строения атома.
Конечно, расшифровать спектр какого-либо элемента — задача даже сегодня не особенно легкая, и вполне квалифицированно сделать это могут только специалисты. В конце концов научиться читать даже расшифрованные иероглифы не так уж просто, и к тому же не обязательно уметь это делать всем. Но поскольку ключ к шифру известен, то научиться с ним работать может любой.
И теперь уж никого не угнетают длинные таблицы спектральных линий, как не пугают зоологов миллионы видов растений и животных: после трудов Линнея, Ламарка и Дарвина все они подчинены строгой систематике.
Со спектральными линиями произошло то же самое, что и с настоящими египетскими иероглифами: пока их не прочли, они были интересны только египтологам, остальные интересовались ими лишь абстрактно. Но когда иероглифы и спектры расшифровали, одним удалось прочесть историю целого народа, другим — узнать устройство атома. А это уже интересно всем.
Несмотря на успехи формальной модели атома, она уже не удовлетворяла тому критерию логической простоты, которая производит впечатление очевидности (и которая так выгодно отличала модель Бора). Постепенно она стала настолько сложной, что вызвала недоверие к себе и некоторое чувство усталости, очень похожее на то, какое владело физиками до схемы Бора. К тому же все попытки распространить модель Бора на более сложные атомы кончались неудачей. В состоянии некой растерянности физики стали подвергать сомнению все: справедливость закона Кулона, применимость электродинамики и механики в атомных системах и даже закон сохранения энергии. Все примерно понимали, что кризис этот возник от столкновения эмпирических данных, принципов теории квантов и остатков классических представлений, отказаться от которых пока было нельзя, поскольку взамен их не было предложено ничего определенного.
При изучении квантовых явлений исследователи пользовались по-прежнему классическими понятиями. Но у атомных объектов не было свойств, которые бы этим понятиям соответствовали, и потому природе задавали, в сущности, незаконные вопросы. Или, точнее, вопросы на языке, которого она не понимала. Тогда начались поиски общего принципа, из которого бы логически следовали и формальная модель атома, и другие особенности атомных объектов. «Пусть вначале этот единый принцип будет непонятным, но пусть он будет один» — таково было общее желание.
В ответ на это стремление в том же 1925 году возникла квантовая механика — наука о движении электронов в атоме. Ее создало новое поколение физиков. По игре случая все они родились почти одновременно: Вернер Гейзенберг — в 1901, Поль Адриен Морис Дирак — в 1902, Вольфганг Паули — в 1900 году. Лишь немного старше их были Луи де Бройль и Эрвин Шредингер. Им выпало счастье записать образы и понятия атомной механики на языке формул. Как им это удалось — мы узнаем немного позже.
Нильс Хенрик Дэвид Бор (1885–1962)
По рисункам можно проследить эволюцию понятия «атом» от Демокрита до Бора. Это очень поучительная история, которая всегда вызывает не только чувство уважения к известным и безвестным ученым, но главным образом — чувство удивления, что такое познание вообще оказалось возможным, причем в такой совершенной и гармоничной форме.
Как и всякое истинно великое открытие, открытие Бора трудно сделать, но легко понять. Сила идей Бора в их недоказуемой простоте и доступности. В главной своей сути они понятны любому грамотному человеку. Бор дал образ, который позволял ориентироваться среди необычных понятий квантовой механики, образ, который стал символом нашего века. Если учесть к тому же, что при всей своей простоте образ этот верно отражает основные свойства атомов, то сразу станет ясна его исключительность.
Из ста физиков, взятых наугад, сегодня, пожалуй, только один или два читали знаменитые статьи Бора, напечатанные в 1913 году. Однако любой из них подробно объяснит идеи, которые в них изложены. А это означает, что сейчас идеи Бора уже не предмет науки, а необходимый элемент культуры — самое высшее, чего может достичь любая теория.
На склоне лет Нильс Бор приехал в нашу страну и посетил Грузию. В один из дней в долине Алазани он отдыхал с группой грузинских физиков. Неподалеку от них расположились крестьяне и по старинному обычаю во главе с тамадой пели песни и пили вино. Нильс Бор — человек не только великий, но и любознательный — подошел к ним и был принят с традиционным радушием. «Это знаменитый ученый Нильс Бор…» — начали объяснять физики. Но тамада жестом остановил их и, обращаясь к сотрапезникам, произнес тост: «Друзья! К нам в гости приехал самый большой ученый мира профессор Нильс Бор. Он создал современную атомную физику. Его труды изучают школьники всех стран. Он приехал к нам из Дании, пожелаем же ему и его спутникам долгих лет жизни, счастья, крепкого здоровья. Пожелаем его стране мира и благополучия». Речь тамады тихо переводили Бору, и когда он кончил говорить, с земли поднялся старик, взял обеими руками руку Бора и бережно ее поцеловал. Следом за ним поднялся другой горец, наполнил рог вином и, поклонившись Бору, осушил рог.
Нильс Бор всю жизнь провел среди парадоксов квантовой механики, но даже его поразила реальность происходящего: он заплакал от удивления и благодарности.
Вокруг кванта
Опытное доказательство постулатов Бора
Опыт Франка и Герца, по существу, очень похож на опыт Кирхгофа и Бунзена, только атомы натрия в нем они заменили атомами ртути, а вместо луча направили на них пучок электронов, энергию которых они могли менять. При этом Франк и Герц наблюдали интересное явление: пока энергия электронов была произвольной — число электронов, прошедших через атомы ртути, было равно числу электронов исходного пучка. Когда же энергия их достигала определенной величины (в опытах она равнялась 4,9 электрон-вольта, или 7,84 · 10–12 эрг), число электронов, прошедших ртуть, резко падало — они поглощались атомами ртути. Одновременно с этим в спектре паров ртути вспыхивала яркая фиолетовая линия с длиной волны λ = 2536Å, то есть с частотой ν = 1,18 · 1015 сек–1. Энергию кванта с такой частотой легко вычислить — она равна E = hν = 6,62 · 10–27 · 1,2 · 1015 = 7,82 · 10–12 эрг, то есть почти точно равна затраченной энергии электрона. Очевидно, это излучение возникает при обратном переходе атома ртути из возбужденного состояния в основное.
Легко видеть, что наблюдаемая картина — прямое опытное доказательство обоих постулатов Бора: в атоме реально существуют стационарные состояния, и поэтому он не способен поглощать произвольные порции энергии. Переходы электрона между уровнями в атоме возможны только скачками, а частота излучаемых квантов определяется разностью энергий уровней и вычисляется по формуле Эйнштейна ΔE = hν. Конечно, «легко видеть» это только сейчас, а в 1913 году даже сами Франк и Герц объяснили свой опыт совсем по-другому.
«Квантование» Солнечной системы
Мы много раз сравнивали атом с солнечной системой, хотя и не придавали глубокого смысла этой аналогии. Тем более неожиданно, что солнечная система, как и атом, тоже подчиняется некоему «правилу квантования». Это правило не имеет ничего общего с квантовой механикой, но тем не менее любопытно, что расстояния планет от Солнца (как и радиусы орбит в атоме) меняются не беспорядочно, а подчиняются довольно строгому закону.
Факт этот был известен Иоганну Кеплеру, и еще в молодости, много размышляя о «гармонии сфер», он пришел к выводу, что в промежутках между сферами, построенными на орбитах планет, можно вписать пять правильных многогранников.
Профессор Даниэль Тициус в 1772 году выпустил в Бонне книгу «Созерцание природы», в которой привел табличку расстояний от Солнца до планет в условных единицах (расстояние до ближайшей к Солнцу планеты Меркурий принято за 4).
Меркурий … 4 = 4;
Венера … 7 = 4 + 1 · 3;
Земля … 10 = 4 + 2 · 3;
Марс … 16 = 4 + 4 · 3;
Юпитер … 52 = 4 + 16 · 3;
Сатурн … 100 = 4 + 32 · 3.
Позднее прибавился
Уран … 196 = 4 + 64 · 3.
Впоследствии Боде уточнил закон Тициуса, приняв расстояние до Меркурия за 8 условных единиц и записав общую формулу для планетных расстояний в виде:
R = 8 + 3 · 2n,
где n = 0, 1, 2, 3, 4, 6, 7, 8.
Замечательно, что в приведенной схеме нет планеты с номером n = 5, которая должна была бы помещаться между Марсом и Юпитером. Но как раз в этом месте расположен пояс астероидов — малых планет. По мнению астрономов, это осколки некогда существовавшей большой планеты Фаэтон.
Закон Тициуса и Боде еще до конца не понят, хотя существует несколько его доказательств (одно из них принадлежит советскому ученому Отто Юльевичу Шмидту). По-видимому, полное объяснение закону будет найдено вместе с разгадкой происхождения нашей солнечной системы.
Глава пятая
Учения древних ♦ Первые попытки ♦ Элементы и атомы ♦ Таблица элементов ♦ Объяснение таблицы
Представьте, что вы решили изучить жизнь клетки. Вы ставите над нею всевозможные опыты: нагреваете, облучаете, разрушаете и тщательно рассматриваете в микроскоп. Однако все ваши знания о ней будут неполны, пока вы не вспомните, что клетка — это часть живого организма и только в нем проявляет всю полноту своих свойств.
Нечто похожее произошло и в науке об атоме. До сих пор мы намеренно пытались изолировать атом и отбирали только те опыты, которые могут прояснить свойства отдельного атома. Однако задолго до всех этих опытов, которые доказали сложную структуру атома, Дмитрий Иванович Менделеев (1834–1907) установил, что атомы различных элементов образуют единый организм — естественную систему элементов.
Через год после создания периодической системы элементов он писал:
«Легко предположить, но ныне пока еще нет возможности доказать, что атомы простых тел суть сложные вещества, образованные сложением некоторых еще меньших частей (ультиматов), что называемое нами неделимым (атом) — неделимо только обычными химическими силами… однако, несмотря на шаткость и произвольность такого предположения, к нему невольно склоняется ум при знакомстве с химией. Оттого такое учение повторяется в разных формах уже давно, и выставленная мной периодическая зависимость между свойствами и весом, по-видимому, подтверждает такое предчувствие, если можно так выразиться, столь свойственное химикам».
Надо сказать, что химиков никогда не могла удовлетворить мысль о независимом множестве качественно различных элементов. Поэтому они всегда стремились свести их качественное многообразие к простой и ясной идее: атомы различных элементов представляют собой различные скопления частиц одного и того же рода.
Такие попытки начались уже в древности и в дальнейшем развивались по двум различным путям.
Демокрит верил, что все вещества в природе построены из атомов, а свойства веществ зависят от различных сочетаний атомов.
Аристотель утверждал, что все сущее состоит из элементов, которые сами являются носителями определенных качеств.
Отголосок этого давнего спора дошел даже до наших дней: при слове «атом» у нас невольно возникает зрительный образ чего-то твердого и массивного; при словах «химический элемент» мы пытаемся представить себе некое чистое качество, безотносительно к его носителю. Быть может, поэтому учение о химических элементах вначале развивалось совершенно независимо от идеи об атомах. Впоследствии оба учения так переплелись, что их перестали различать, но, как мы только что убедились, до сих пор не удалось преодолеть психологический барьер между ними.
Пути науки неисповедимы, а истоки многочисленны. До сих пор мы подробно проследили «физические истоки» науки об атоме. Теперь пришло время отыскать ее «химические истоки».
Учения древних
Философы ионической школы, знаменитым представителем которой был Фалес Милетский (640–546 г. до н. э.), признавали только один элемент — воду, «на которой покоится Земля и которая дала начало всему, что есть». Впоследствии Эмпедокл (490–430 г. до н. э.) добавил к воде еще три элемента: землю, огонь и воздух. Наконец, Аристотель (384–322 г. до н. э.) к этим четырем элементам присоединил пятую сущность — quinta essentia, воспоминание о которой сохранилось до сих пор в слове «квинтэссенция».
Нечто похожее было создано и в индийской философии. Но в отличие от греков — материалистов, которые под элементами понимали вещества, воздействующие на наши органы чувств, в Индии элементы представляли себе как некие проявления всемогущего духовного начала. Этих проявлений-элементов в индийской философии было пять — по числу чувств, способных их воспринять: эфир — слух, ветер — осязание, огонь — зрение, вода — вкус и земля — обоняние. Философ Канадá, о котором мы упоминали в самом начале, добавил к ним еще четыре элемента: время, пространство, душу (атман) и манас (средство, с помощью которого душе передаются впечатления от чувств). Кроме того, он утверждал, что четыре элемента: земля, вода, огонь и воздух — состоят из атомов.
В средние века учение об элементах возродили алхимики, среди которых обычно отмечают египтянина Зосима, араба Гебера (Абу-Муза-Джабер-бен-Гайян-эк-Куфи) (X век) и Альберта Великого (XII век).
Под элементами алхимики (вслед за Аристотелем) понимали не вещества, а качества, или «принципы». Ртуть служила «принципом» металлического блеска, сера — горючести, соль — растворимости. Они были убеждены, что, смешав эти «принципы» в надлежащих пропорциях, можно получить любое вещество в природе.
Как правило, со словом «алхимия» связывают сказки о превращении ртути в золото, о получении эликсира жизни и прочие чудеса. Если порыться в архивах, то там можно найти, например, сочинение Гебера, в котором он всерьез обсуждает вопрос: «Почему, как всем известно, облако не дает дождя, когда женщина выходит из дома голой и обращается лицом к этому облаку?»
Но, кроме этих заведомых глупостей, алхимики изобрели спирт и уже одним этим оправдали свое существование. Основная же их заслуга состоит в том, что стихийное экспериментирование, которому предавались алхимики, привело постепенно к накоплению фактов, без которых наука химия никогда бы не возникла.
Первые попытки
В XVII веке алхимия вместе с натурфилософией уступила место химии и физике. В 1642 году появилось сочинение Иоахима Юнгиуса (1587–1657) «Диспуты о принципах материи», которое он вполне в духе века заканчивает словами:
«Какие принципы должны быть признаны первичными для однородных тел, может быть познано не путем догадок, а только на основании добросовестных, детальных и прилежных наблюдений».
В 1661 году вышла в свет знаменитая книга Роберта Бойля «Скептический химик», в которой он определил химические элементы как «некоторые примитивные, или простые, или совершенно несмешанные вещества».
По существу, это первое и почти современное определение элемента: элемент — это прежде всего вещество, а вовсе не «принцип», субстрат или идея. Оставалось пока неясным, как выделять элементы из природных веществ и по какому признаку можно отличить чистые элементы от их смеси или соединения. Например, сам Бойль полагал, что вода чуть ли не единственный чистый элемент, в то время как золото, медь, ртуть и серу относил к химическим соединениям и смесям.
Антуан Лоран Лавуазье (1743–1794) принял целиком учение Бойля об элементах, но он жил столетием позже, и ему этого было уже недостаточно: он хотел научиться выделять элементы из химических соединений. По-видимому, он был одним из первых, кто использовал весы не для приготовления порошков и смесей, а для целей исследования. Он исходил из предположения, которое сейчас кажется тривиальным, но в эпоху флогистона требовало немалой смелости:
Каждый элемент соединения весит меньше, чем все соединение в целом.
Последовательно применяя этот принцип, он составил первую таблицу, содержащую около 30 элементов. Взгляды Лавуазье настолько противоречили общепринятым в то время воззрениям, что рьяные последователи теории флогистона в Германии устроили публичное сожжение его портрета.
Лавуазье не закончил своих исследований: по обвинению в государственной измене 8 мая 1794 года после полудня на площади Революции в Париже ему отрубили голову, а тело погребли в общей могиле. Наутро после казни Лагранж говорил с горечью: «Чтобы снять эту голову, достаточно было мгновения, а чтобы создать другую, ей подобную, не хватит, быть может, и столетия».
Последующие сто лет были заполнены трудами химиков, которые постепенно дополняли таблицу Лавуазье. Среди них вызывает восхищение фигура «короля химиков» Иенса Якоба Берцелиуса (1779–1848), который за свою жизнь проанализировал свыше 2 тысяч веществ и открыл несколько новых элементов.
В это время было известно уже около 60 элементов — не так много, как думал Демокрит, но и не так мало, чтобы считать их все независимыми. Возникло подозрение, что совокупность элементов образует единую систему, и начались поиски этой системы.
По существу, такие поиски никогда не прекращались даже в то время, когда они были явно преждевременными. Например, Марне уже в 1786 году был уверен, «что все существующее в природе связано в один беспрерывный ряд» и что «…от мельчайшей пылинки солнечного луча до святейшего серафима можно воздвигнуть целую лестницу творений…». В 1815 году английский врач и химик Вильям Праут (1786–1850) развил идею Марне о родстве элементов и предложил простую гипотезу, по которой все элементы образовались при конденсации водорода.
Сейчас не время и не место подробно изучать все попытки найти систему элементов, которые в разное время предприняли Деберейнер (1817), Петтенкоффер (1850), Гладстон (1853), Олдинг (1857), Бегюэ де Шанкуртуа (1863), Ньюлендс (1865) и многие другие. Значительно важнее проследить идеи и побудительные причины, которые всеми ими двигали.
В основе любой науки лежит человеческая способность удивляться. А существование элементов всегда вызывало и будет вызывать удивление. В самом деле, разве не странно, что весь этот мир, наполненный красками, запахами, звуками и человеческими страстями, построен всего из нескольких десятков элементов. Причем, как правило, сами элементы невзрачны на вид и ничем не напоминают красочного мира, который из них построен.
Однако вслед за удивлением в сознании ученых возникает потребность упорядочить впечатления, которые их поразили. Это чисто человеческое качество заложено в каждом из нас очень глубоко: ребенок радуется, сложив из хаоса кубиков правильную фигуру, скульптор — вырубив из глыбы мрамора статую.
При всякой попытке что-либо упорядочить сразу же возникает вопрос: «А по какому признаку?» Если у вас в коробке навалены в беспорядке кубики с номерами, то упорядочить их очень просто: достаточно расставить их в порядке номеров. А теперь представьте, что вместо кубиков у вас в руках пробирки с химическими элементами. В пробирках вещества разного цвета и запаха, жидкие и твердые, тяжелые и легкие. Какое из этих качеств следует взять за основу классификации? Например, пробирки можно расставить на полке так, что их цвета образуют радугу. Это будет красиво, но для науки об элементах бесполезно: всякая классификация имеет смысл лишь в том случае, если она позволяет выявить глубокие свойства или особенности строения. (Такова, например, классификация животного мира.)
Чем вообще полезна классификация, кроме того, что она удовлетворяет наше инстинктивное стремление к простоте? Прежде всего — и это самое важное — без нее невозможна никакая наука. Мозг ученого — лишь небольшая часть природы, и он может надеяться познать всю природу только в том случае, если научится выделять в ней главные черты среди нагромождения деталей.
Как раз в этом и состоит суть классификации: среди многочисленных свойств предметов или явлений выбрать лишь одно или два свойства, но зато такие, чтобы они позволили выявить закономерность изменения всех остальных свойств.
У химических элементов очень много свойств, что вполне понятно: иначе нельзя было бы построить весь мир. Самое важное из них — способность элементов вступать в химические реакции. Казалось бы, именно это свойство элементов и нужно положить в основу их классификации. Однако это не так: нет способа точно измерить (и даже строго определить) реакционную способность элементов. А без этого любая классификация ненадежна. Чтобы не быть произвольной, она должна опираться на число, то есть элементы нужно классифицировать по тому их свойству, которое поддается точному измерению.
Но и здесь не все так просто: удельный вес элементов мы можем измерить очень точно, однако положить его в основу их систематики нельзя — хотя бы потому, что среди них есть и газы, и жидкости, и твердые тела.
Многочисленные неудачные попытки найти систему элементов помогли наконец понять, что среди различных свойств элементов, доступных непосредственному наблюдению, нет того единственного свойства, которое необходимо положить в основу их классификации. Искомое свойство — атомный вес элемента — лежит вне химии и целиком принадлежит физике. Тот момент, когда это впервые поняли, можно считать началом современного учения о химических элементах. Этот решающий шаг сделал Джон Дальтон.
Элементы и атомы
Среди ученых своего времени Джон Дальтон очень своеобразная фигура. В начале XIX века уже все уверовали в науку и поняли секрет ее могущества: она имеет дело с числами, а числа не обманут. Поэтому превыше всего в то время ценили искусство ставить точные опыты. Дальтон решительно этим качеством не обладал и потому при жизни подвергался нападкам маститых ученых.
«Его инструменты, сделанные в основном своими руками, не были приспособлены для получения аккуратных результатов, а его манера экспериментирования была небрежной, если не сказать неряшливой», — писал один из его биографов.
По складу ума это был типичный теоретик, как мы себе представляем сейчас эту профессию. Поэтому не следует слишком строго судить неточности измерений в его работах: на их основе он высказал светлые и плодотворные мысли, которые определили развитие химии на ближайшие сто лет. Суть его открытия состоит в том, что он указал экспериментальный путь проверки атомной гипотезы.
Дальтон определил элемент как вещество, состоящее из атомов одного вида. Атомы различных веществ различаются между собой по весу и при всех превращениях вещества остаются неизменными — происходит лишь их перегруппировка. «Мы с таким же успехом можем стараться прибавить новую планету в солнечную систему, как уничтожить или создать атом водорода», — писал Дальтон.
С Дальтона начинается современная история атома. Он впервые не только твердо поверил в атомную гипотезу, но стал искать вытекающие из нее и притом наблюдаемые следствия. Ход его рассуждений состоял примерно в следующем.
Допустим, что все элементы состоят из атомов. Тогда, скажем, в 16 г кислорода содержится N атомов кислорода. Теперь допустим, что мы сжигаем в этом кислороде водород. Легко измерить, что для сжигания 16 г кислорода надо затратить 2 г водорода, и в результате мы получим 18 г воды.
Первое предположение, которое приходит в голову стороннику атомной гипотезы, состоит в том, что каждый атом кислорода O соединяется с одним атомом водорода H и в результате образуется молекула воды HO. Именно так думал и Дальтон.
В дальнейшем Берцелиус доказал, что он немного не прав, а именно: с каждым атомом кислорода соединяются два атома водорода и поэтому формула воды принимает привычный для нас вид: H2O. Но здесь самое важное идея: с каждым атомом кислорода соединяется целое число атомов водорода. Поэтому если в 16 г кислорода содержится N атомов, то в 2 г водорода — 2N атомов. А это означает, что один атом кислорода в 16 раз тяжелее атома водорода.
Таким образом, появилась возможность сравнивать между собой вес атомов различных элементов. Появилось понятие — атомный вес — число, которое показывает, во сколько раз вес атома какого-либо элемента тяжелее атома водорода. По определению атомный вес водорода приняли равным единице, и, следовательно, атомный вес кислорода равен 16.
Чем может быть полезно это простое рассуждение? Прежде всего теперь можно измерить атомные веса всех других элементов, изучая их соединения с водородом и кислородом. Например, можно убедиться, что в тех же 16 г кислорода удается сжечь только 16 г серы и получить сернистый газ. Что отсюда следует? Можно, как всегда, предположить простейшее: с каждым атомом серы соединяется один атом кислорода по формуле S + O = SO, и сделать отсюда вывод, что атомный вес серы равен 16. Но если (как мы теперь знаем) горение происходит по формуле S + O2 = SO2, то атомный вес серы следует положить равным 32.
На этом примере мы видим, что сама по себе атомная гипотеза еще не дает способа предсказывать состав химических соединений, однако она не позволяет ошибаться больше чем в целое число раз. Например, мы заранее можем предсказать, что с 32 г серы (в которых содержится N атомов) может соединиться либо N, либо 2N и т. д. атомов водорода, то есть либо 1 г, либо 2 г, но ни в коем случае не 1,35 г водорода. Это утверждение как раз и составляет содержание знаменитого закона кратных отношений:
Весá элементов, входящих в соединение, относятся между собой как целое кратное их атомных весов.
К этим результатам Дальтон пришел в 1804–1805 годах, а в 1808 году вышла его знаменитая книга «Новая система химической философии», открывшая целую эпоху в науке. Его выводы тут же проверил английский врач и химик Уильям Волластон (тот самый, который впервые обнаружил темные линии в спектре Солнца) и убедился в их справедливости.
Нам сейчас трудно представить ту смутную эпоху, когда отвергали не только атомную гипотезу, но вообще сомневались в том, что химические соединения имеют постоянный состав. Известен знаменитый восьмилетний спор между Прустом и Бертолле, лишь в конце которого Пруст наконец доказал, что независимо от того, как и откуда получено соединение, оно всегда имеет один и тот же неизменный состав. И вода всегда остается водой H2O, упала ли она с неба, взята ли из реки или же получена сжиганием водорода в кислороде.
Оставалось сделать последнее: научиться определять атомные веса элементов. Для этого нужно было выбрать простейшие вещества. Прежде всего обратили внимание на газы. И тут сразу же, в 1809 году, бывший ассистент Бертолле французский ученый Джозеф Луи Гей-Люссак (1778–1850) (которого мы знаем по «газовому закону Гей-Люссака») сделал очень важное открытие: объемы двух газов, вступающих в реакцию, всегда относятся друг к другу как простые целые числа.
Не веса, а объемы!
Как мы скоро увидим, это очень важно. Например, чтобы получить воду, нужно в одном объеме кислорода сжечь ровно два объема водорода. Отсюда уже сам собой напрашивается вывод: в равных объемах газов содержится одинаковое количество атомов.
Именно к такому выводу пришел в 1811 году итальянский ученый Амедео Авогадро (1776–1856) (Лоренцо Романо Амедео Карло Авогадро ди Кварегна э ди Керрето), только сформулировал его точнее:
В равных объемах газов содержится одинаковое количество молекул. Как мы теперь знаем, молекулы большинства газов: водорода, кислорода, азота и т. д. — состоят из двух атомов H2, O2, N2. После этого уже ничего не стоит понять классический опыт по сжиганию водорода в кислороде. Известно, что при этом из 1 объема кислорода и 2 объемов водорода образуется 2 объема водяного пара. Коротко этот факт записывают уравнением:
2H2 + O2 = 2H2O.
В чем значение открытий Гей-Люссака и Авогадро и почему мы так подробно остановились на этих простых фактах?
Проследим еще раз цепочку рассуждений. В равных объемах газов содержится одинаковое число молекул. Известно, что 2 г водорода занимают объем 22,4 л; обозначим число молекул, которое содержится в этом объеме, через N. Те же самые N молекул кислорода занимают тот же объем 22,4 л, но весят они при этом не 2 г, а 32. Отсюда следует, что каждый атом кислорода в 16 раз тяжелее атома водорода; а это означает, что, измерив удельный вес какого-либо газа, мы сразу же определим его атомный вес.
Нигде до сих пор реальность атомной гипотезы не была видна так явно. Действительно, удельный вес — величина легко измеримая и привычная, поскольку она воздействует на наши органы чувств. Поразительно то, что таким простым способом можно измерить атомный вес — величину, не данную нам в ощущении непосредственно и тем не менее безусловно реальную.
Число молекул N, которые помещаются в 22,4 л любого газа, называют теперь числом Авогадро. Это одна из основных постоянных физики — подобно скорости света c или постоянной Планка h. Чтобы определить ее, достаточно знать абсолютный вес M одного атома водорода. И поскольку в 22,4 л содержится 2 г таких атомов, то число N = 2/M.
Впервые удалось оценить число N после вычислений Йозефа Лошмидта, который определил абсолютный вес и размеры атома водорода. Кстати, из его вычислений следовало, что расстояния между молекулами газа примерно в 10 раз превышают размеры самих молекул. Если знать этот результат заранее, то гипотеза Авогадро совершенно очевидна: средние расстояния между атомами газа не зависят от их размеров, которые от газа к газу меняются очень незначительно.
Гипотеза Авогадро была вскоре забыта, и лишь полстолетие спустя, в 1853 году, ей возвратил жизнь другой итальянский ученый, Станислао Каниццаро (1826–1910). Это было как нельзя более кстати, поскольку между химиками той поры не было согласия: почти каждый из них признавал только свою собственную таблицу атомных весов, органики не доверяли неорганикам, а созванный в 1860 году в Карлсруэ съезд самых знаменитых химиков ни к какому соглашению не пришел.
Немецкий химик Лотар Мейер (1830–1895), много сделавший для установления системы элементов, вспоминал, как, возвращаясь со съезда в Карлсруэ, он читал в вагоне поезда брошюру Каниццаро и как во время этого чтения у него «упала пелена с глаз».
Только теперь наконец были достаточно правильно определены атомные веса элементов, и можно было приступить к их классификации.
Таблица элементов
Казалось бы, чего проще — надо расположить все элементы в порядке возрастания атомных весов, и сразу же сама собой обнаружится периодичность их свойств. И часто дело изображают так, будто Менделеев, выписав все известные в то время элементы на оборотной стороне визитных карточек, долго раскладывал их как пасьянс, пока не забылся кратким дневным сном. Во время этого-то сна к нему и пришло решение проблемы. По-видимому, так оно и было, но при этом всегда следует помнить, что счастливому дню 1 марта 1869 года предшествовало много других дней и ночей — бессонных и бесплодных, когда проблема казалась безнадежной.
В чем состояла трудность задачи? Вспомните пример с беспорядочной кучей пронумерованных кубиков — расставить их по порядку не составляет труда. Но на химических элементах нет ярлыков с номерами — это просто вещества разного цвета, твердые, жидкие, газообразные. Мы знаем только, что каждому из них можно поставить в соответствие число — атомный вес. Именно это число приняли вначале за основу классификации. Можно, конечно, расположить все элементы в порядке возрастания атомных весов — многие именно так и поступали, — но это будет занятие, достойное ремесленника, а не мастера. Прежде всего, откуда известно, что мы знаем уже все элементы? А без этой уверенности какой смысл располагать их по возрастающим атомным весам?
Проблема в действительности напоминает известную детскую игру в кубики, на которых изображены части картины и нужно сложить их все вместе так, чтобы получилась вся картина целиком. Теперь представьте, что часть кубиков утеряна, а на части кубиков куски картины искажены. В этом случае целую картину все равно можно восстановить, хотя, конечно, и с большим трудом. Только при этом нужно стремиться представить себе именно картину всю целиком, а не надеяться, что она сама получится, если произвольно и бездумно переставлять кубики.
Дмитрий Иванович Менделеев владел как раз этим даром синтетического мышления. Он с самого начала представлял, себе элементы не как набор случайных веществ, а как части единой системы. И в поисках этой системы элементов он не ограничился только их физическим свойством — атомным весом (хотя и положил его в основу классификации), а держал в памяти и комбинировал все остальные их — химические — свойства.
Во времена Менделеева было известно 63 элемента. В таблице, которую он составил в 1869 году, только 36 из них подчинялись принципу возрастания атомных весов. Для 20 элементов этот принцип был нарушен, а для оставшихся 7 Менделеев исправил атомные веса на основании своей таблицы. Он настолько верил в найденную им систему, что предсказал на ее основе свойства еще не открытых элементов и оставил для них пустые места в таблице. Эти элементы и в самом деле были вскоре открыты: скандий, № 21, в 1875 году, галлий, № 31, в 1879 году, германий, № 32, в 1886 году, технеций, № 43 и рений, № 75, в 1925 году.
Если быть строгим, то приходится признать, что Менделеев открыл свою систему не на основании фактов, а вопреки им. Он как будто видел заранее всю таблицу и принимал во внимание лишь те факты, которые ей не противоречили. Как в загадочной картинке «Найди охотника!», Менделеев в беспорядочном нагромождении линий вдруг увидел четкие контуры правильной картины. А различив ее однажды, уже нельзя в дальнейшем ее не заметить — даже если очень стараться. (Это свойство человеческой психики каждому хорошо знакомо.) Здесь Менделеев обнаружил ту сторону своего ума, которая отличает гения от таланта: большую интуицию — редкий дар природы, позволяющий увидеть истину сквозь шелуху неверных фактов.
В периодической системе элементов Менделеева нашел наконец успокоение давний спор между представлениями Аристотеля и Демокрита о природе элементов. По горизонтали таблицы изменяется ненаблюдаемое свойство атома Демокрита — атомный вес (количество); по вертикали элементы естественно группируются в семейства с аналогичными химическими свойствами: валентность, способность вступать в реакции и т. д. Эти свойства наблюдаемы, воздействуют на наши органы чувств и сродни древним «качествам» Аристотеля.
Лагранж как-то сказал: «Счастлив Ньютон, ибо систему мира можно установить лишь однажды». Менделеев установил систему химического мира. Это тоже можно сделать только один раз. Поэтому его имя, как и имя Ньютона, никогда не будет забыто, пока существует наука.
Объяснение таблицы
При взгляде на таблицу Менделеева возникает (и всегда возникал) вопрос: «Что это — удобный способ запоминания элементов или фундаментальный закон природы?» Понимающему взгляду химика таблица говорит очень много, но сейчас мы не в состоянии обо всем этом рассказать. Мы попытаемся понять только главное: если это закон природы, то:
Что определяет порядок расположения элементов в таблице?
В чем причина их периодических свойств?
От чего зависит длина периодов?
Ответить на эти вопросы пытались в течение полувека — от Менделеева до Паули. Таблицу элементов многократно переписывали, разрезали и снова склеивали на плоскости и в пространстве всеми возможными и невозможными способами. Но, как всегда, причина явления лежала вне его самого: объяснить таблицу смогла только физика после создания теории атома.
Как мы видели, уже Менделеев знал, что атомный вес лишь приблизительно определяет положение элементов в таблице. И все же каким-то одному ему известным способом он сумел их расположить в таблице правильно. После уж не составляло труда пронумеровать их все подряд. Но имеет ли подобная нумерация глубокий смысл? Ведь с таким же успехом мы можем пронумеровать кубики из нашей детской игры-мозаики для того, чтобы можно было всегда и быстро восстановить всю картину. Это, конечно, удобно, однако глубокого смысла не имеет, поскольку номера кубиков никак не связаны с тем, что на этих кубиках изображено.
Существует ли глубокая внутренняя связь между химическими свойствами элемента и его порядковым номером в таблице? Или же это внешний и произвольный его признак, вроде порядкового номера дома на улице? Если бы это было действительно так, то с открытием каждого нового элемента пришлось бы менять их нумерацию, точно так же, как меняют нумерацию домов при дополнительной застройке улицы. Одним словом, порядковый номер элемента в таблице — это что: удобный способ найти его в этой таблице или же это его внутренняя характеристика, которая присуща ему независимо от всяких таблиц? История склоняется в пользу последнего предположения: за 100 лет существования таблицы нумерация элементов ни разу не изменилась.
Разгадку такой устойчивости таблицы удалось найти лишь после работ Резерфорда. В том же 1911 году, когда Резерфорд обнародовал свою планетарную модель атома, датчанин Ван дер Брок написал в немецкий журнал короткую заметку, в которой высказал предположение:
порядковый номер элемента в таблице Менделеева равен заряду ядра его атомов.
Два года спустя, изучая рентгеновские спектры различных элементов, эту гипотезу доказал один из лучших учеников Резерфорда — Генри Гвин Джеффрис Мозли (1887–1915). Работа Мозли стала главным событием в физике даже в те полные открытий годы. Ему не удалось ее завершить: в августе 1915 года он был убит наповал в Греции в окопах Галлипольского полуострова.
В чем суть и важность этих открытий?
Прежде всего из них следует, что элементы в таблице расставлены верно.
Кроме того, они доказывают, что все элементы уже открыты, за исключением тех, для которых в таблице оставлены пустые места.
Такая окончательность утверждений всегда обладает необъяснимой притягательной силой. Она становится особенно ценной, когда речь идет о системе мира. После работ Мозли система химических элементов была наконец установлена окончательно и оставалось только понять ее особенности.
Природа позаботилась о том, чтобы как можно дальше упрятать свои главные свойства от глаз естествоиспытателей: заряд ядра атома надежно укрыт шубой из электронов и недоступен измерению никакими химическими и большинством физических методов. Это свойство атомов нащупали только после того, как начали обстреливать их такими снарядами, как α-частицы. Вместе с тем именно это так глубоко запрятанное свойство определяет структуру атома и все наблюдаемые свойства элементов, состоящих из этих атомов. И если мы хотим по-настоящему узнать атом, то вначале должны докопаться до его ядра. (Как в сказке о Кащее Бессмертном: высоко на горе растет дуб, на дубу — сундук, в сундуке — заяц, в зайце — утка, в утке — яйцо, в яйце — игла, а в кончике той иглы — жизнь и смерть Кащея.)
В силу каких-то глубоких причин, которые мы пока не вполне знаем, заряд ядра атома примерно вдвое меньше, чем его атомный вес. Поэтому, располагая элементы в порядке возрастания их атомных весов, мы более или менее правильно выстроим их и в порядке возрастания зарядов ядер их атомов. Менделеев, конечно, не знал о существовании ядер, но он почувствовал, что у атомов есть еще какое-то свойство, более глубокое, чем атомный вес, и поэтому, располагая элементы в таблице, доверял больше интуиции, чем атомным весам. Он как бы заглянул под электронную оболочку атомов, пересчитал там положительные заряды в ядре и затем это число присвоил элементу, назвав его порядковым номером. Очевидно, порядковый номер — внутренняя характеристика элемента, и, конечно, она не зависит от нашего произвола, как, например, номер дома на улице. (Если продолжить нашу аналогию с детской игрой-мозаикой, то можно сказать, что все ее кубики в действительности оказались пронумерованными. Только номера эти были запрятаны внутри кубиков.)
Теперь наконец можно дать точное определение элемента.
Элемент — это вещество, состоящее из атомов с одинаковым зарядом ядра.
Нам осталось выяснить последнее: почему монотонное изменение заряда ядра атомов приводит к периодическим изменениям их химических свойств? Изменяются при этом не только химические, но и физические свойства: удельный вес, твердость и даже агрегатное состояние. Например, элементы с порядковыми номерами 2, 10, 18, 36 — это газы гелий, неон, аргон, криптон, получившие название благородных за свою неспособность вступать в обычные химические реакции. Но если заряд ядер этих атомов увеличить всего на единицу, то мы получим элементы 3, 11, 19, 37 — щелочные металлы литий, натрий, калий, рубидий, которые никак не похожи на соседние газы ни по физическим, ни по химическим свойствам. Например, натрий и калий так легко вступают в химические реакции, что их нельзя держать на открытом воздухе — они там самовоспламеняются.
Очевидно, причину периодического изменения свойств элементов следует искать не в ядре, а в окружающей его электронной оболочке. Первая мысль, при этом возникающая, состоит в том, что электроны вокруг ядра расположены не беспорядочно, а слоями-оболочками. Начало заполнения новой оболочки совпадает с началом нового периода, и как раз в этот момент скачком изменяются химические свойства элементов. После работ Бора подобная мысль казалась очень естественной, и он сам же ее впервые и высказал.
Однако приведенные наблюдения не подсказывают способа вычислить длину периода. На первый взгляд длина периодов в таблице меняется весьма прихотливо: в I периоде — два элемента, во II и III — восемь, в IV и V — восемнадцать, в VI — тридцать два. Но еще в 1906 году Иоганн Ридберг заметил, что ряд чисел 2, 8, 18, 32 подчиняется простой формуле: 2n2. Эту закономерность удалось объяснить Паули только в 1924 году, после открытия им принципа запрета.
Ход рассуждений Паули легко понять. В самом деле, движение электрона в атоме описывается четырьмя квантовыми числами, о которых мы подробно говорили в предыдущей главе и которые напомним теперь еще раз:
n — главное квантовое число, которое может принимать значения 1, 2, 3, …;
l — орбитальное квантовое число, которое при заданном n принимает значения 0, 1, 2, …, (n–1);
m — магнитное квантовое число; при заданных n и l оно пробегает ряд значений –l, –(l–1), …, –1, 0, 1, … (l–1), l, — всего 2l+1 значений;
S — спиновое квантовое число, принимающее значения +½ и –½.
Принцип запрета Паули гласит:
В атоме не может быть двух электронов с одинаковыми квантовыми числами.
Поэтому на оболочке с порядковым номером n может поместиться только ограниченное число электронов. Например, на первой оболочке умещаются только два электрона. В самом деле, если главное квантовое число n = 1, то для орбитального момента допустимо только одно значение l = 0, а следовательно, и магнитное квантовое число m = 0; спин электрона не зависит от других квантовых чисел и может принимать два значения S = ½ и S = –½. В соответствии с этим на первом квантовом уровне могут поместиться только два электрона с квантовыми числами: (n = 1; l = 0; m = 0; S = ½) и (n = 1; l = 0; m = 0; S = –½). Рассуждая точно так же, можно убедиться, что на второй оболочке умещается 8 электронов, на третьей — 18 и вообще на оболочке с главным квантовым числом n помещается 2n2 электронов. То есть число электронов на заполненных оболочках атомов равно длине периодов таблицы Менделеева.
Чтобы нагляднее уяснить себе причину появления этих чисел, представьте, что вам надлежит заселить жилой квартал, в котором n домов, пронумерованные числом l = 0, 1, 2, … (n – 1), причем в доме с номером l только (2l + 1) квартир. Если в каждую квартиру запрещено поселять больше двух жильцов, то во всем квартале поместится 2n2 человек и не более.
Каждый период в таблице Менделеева начинается щелочным металлом и заканчивается инертным газом. Химические свойства этих элементов резко различны. Теперь легко понять и причину их различия. Инертные газы — гелий, неон, аргон и т. д. — отличаются от всех остальных элементов тем, что у них оболочки полностью заполнены.
Атомы щелочных металлов: лития, натрия, калия и т. д., которые в таблице расположены следом за инертными газами, содержат по одному электрону в следующей, более высокой оболочке. Эти электроны связаны с ядром много слабее, чем остальные, и поэтому атомы щелочных металлов легко их теряют и становятся положительными однозарядными ионами:
Li+, Na+, К+ и т. д.
Наоборот, в атомах фтора, хлора, брома и т. д. недостает одного электрона, чтобы замкнуть их внешнюю оболочку до оболочки благородного газа. Поэтому-то галогены так охотно присоединяют электрон, образуя отрицательные ионы F–, Cl–, Br– и т. д. Когда атомы натрия и хлора встречаются, то натрий отдает свой внешний электрон хлору, в результате чего возникают ионы Na+ и Cl–. Ионы эти притягиваются, образуя молекулы NaCl; из которых состоит хорошо известная всем поваренная соль.
Попутно нам удалось выяснить смысл понятия валентности, которое так трудно определить химически: валентность элемента в соединении — это число электронов его атома, участвующих в образовании химической связи. Легко видеть, что валентность вместе с другими химическими свойствами должна повторяться периодически через 2, 8, 18, 32 элемента при начале заполнения каждой следующей оболочки.
В прошлом веке числа 2, 8, 18, 32 вызывали недоумение и получили название «магических». Объяснить их пытались по-разному, например, вспоминали, что октаэдр — самый прочный многогранник и что в буддийской философии есть учение о восьми путях добра. Но вряд ли кто предполагал, что для них существует такое простое и рациональное объяснение.
Если бы Дальтон, Лавуазье, Менделеев — все, кто в свое время посвятил жизнь и силы изучению системы химических элементов, попали хоть ненадолго в наше время, они бы, без сомнения, испытали совершенную радость чистого знания, которое наконец достигнуто в учении об элементах. Вместо случайного набора веществ, относительно которых даже не всегда было известно, элементы ли это или смеси, они увидели бы стройную иерархию атомов: от водорода до курчатовия.
Этой гармонией мы обязаны квантовой механике, к знакомству с которой теперь и перейдем.
Вокруг кванта
Атомы, ядра, изотопы
Вероятно, бог, создавая уже на пятый день творения «всех животных, и птиц, и рыб» целиком, не знал ничего об атомах или же не хотел вникать в такие детали. Но если бы он захотел заготовить вначале все атомы, то проще всего ему было бы пойти по пути, который предлагал в свое время Праут: построить их все из атома водорода.
Ясно, однако, что при сближении двух ядер водорода (протонов) они отталкиваются, поэтому природа изобрела еще один тип частиц — нейтроны, которые вместе с протонами уже могут образовать устойчивые ядра.
Заряд нейтрона равен нулю, а масса почти в точности равна массе протона. Если соединить вместе два протона и два нейтрона, то они образуют очень прочное ядро гелия (те самые α-частицы, которые использовал Резерфорд в своих опытах). Очевидно, что атом гелия в четыре раза тяжелее атома водорода и потому его атомный вес равен 4. Два электрона гелия занимают нижнюю оболочку с квантовыми числами n = 1; l = 0; m = 0; S = +½ и –½.
Если к ядру гелия добавить еще один протон и один нейтрон, то получится ядро лития с атомным весом 6. Третий электрон лития уже не помещается на первой оболочке и попадает на следующую, с квантовым числом n = 2. Данный факт как раз и соответствует тому, что с лития начинается новый период таблицы Менделеева. На оболочке с n = 2 помещается 2n2 = 8 электронов (2 электрона на орбите n = 2, l = 0 и 6 электронов на орбитах n = 2, l = 1, m = –1, 0, 1). Постепенно добавляя к ядру лития протоны и нейтроны, а к его оболочке — электроны, мы таким образом последовательно построим весь второй период — от лития до неона.
Здесь, однако, мы впервые столкнемся с новым явлением. В самом деле, мы точно знаем: для того чтобы получить ядро кислорода, нужно к ядру лития добавить 5 протонов, поскольку заряд ядра лития равен трем, а заряд кислорода — восьми. Но сколько при этом надо добавить нейтронов? Оказывается, что иногда 5, а иногда 7. В соответствии с этим атомный вес кислорода иногда равен 16, а иногда 18. Но что в таком случае мы понимаем под словом «кислород»? Тот кислород, которым мы дышим? Сейчас мы знаем, что это естественная смесь изотопов кислорода с атомными весами 16 и 18, которая однажды образовалась в природе и которую никакими химическими способами разделить нельзя, поскольку химические свойства элементов зависят не от их атомного веса, а лишь от заряда ядра их атомов и от особенностей строения их электронной оболочки. (Только теперь мы можем по-настоящему оценить глубину мысли Менделеева, который к понятию атомного веса относился уважительно, но с большой осторожностью и, располагая элементы в таблице, доверял больше своей интуиции, чем естественному порядку атомных весов.)
Термин изотопы ввел Фредерик Содди в 1912 году. Его буквальный перевод с греческого означает «занимающие одно и то же место» (в таблице Менделеева). Оказалось, что в природе существует по нескольку изотопов каждого элемента, иногда очень много; например, у водорода их три (водород, дейтерий и тритий), а у свинца — десять.
Больше всего изотопов у олова — двадцать шесть. А всего в природе насчитывается около полутора тысяч изотопов различных элементов.
После открытия изотопов стали различать «чистый элемент» и «смешанный».
«Чистый элемент» — это вещество, состоящее только из одного вида атомов: с одинаковым зарядом ядра и одинаковой массой. Чтобы обозначить такой элемент, пишут коротко, например: 8O16. Это означает: кислород с зарядом 8 и атомным весом 16. «Смешанный элемент», или — что то же — обычный химический элемент, — это естественная смесь «чистых элементов».
С открытием изотопов возникла новая проблема: а как измерять теперь атомные веса? То есть с весом какого элемента их надо теперь сравнивать? Оказалось, что сравнивать их с весом атома водорода уже неудобно, и с 1961 года во всем мире принята углеродная шкала, в которой за единицу атомного веса принята 1/12 веса изотопа углерода 6C12.
Благодаря работам Фрэнсиса Вильяма Астона (1877–1945) и многих других мы умеем теперь измерять атомные веса очень точно. Скажем, атомный вес водорода 1H1 в углеродной шкале равен 1,00782522.
«Чистый элемент» или «смешанный» — для химии все равно; она их не различает даже с помощью самых тонких методов анализа. Тем более недоступно это для человеческих несовершенных чувств. Но иногда это различие становится для всех видимым, а для многих — гибельным. Оставшиеся после атомной бомбардировки в живых жители Хиросимы и Нагасаки навсегда запомнят разницу между безобидными изотопами урана и изотопом 92U235, которым была начинена первая атомная бомба.
Атомы и люди
Случайно это или нет, но факт остается фактом: среди ученых, которые установили систему элементов, было много интересных людей.
Роберт Бойль (1627–1691). Это был незаурядный человек. Решающее влияние на него оказала философия Фрэнсиса Бэкона с его учением об опыте как основном мериле истины. Быть может, поэтому он установил один из первых количественных законов в физике, известный теперь как газовый закон. Бойля — Мариотта. Любопытно, что по стилю своей работы Бойль ближе к нам, чем к своей эпохе: он не писал статей, а диктовал их секретарю, он не делал сам опытов, а поручал их ассистенту (с которым ему, впрочем, повезло: это был знаменитый впоследствии Роберт Гук).
Бойль был четырнадцатым ребенком и седьмым сыном в богатой семье. С детских лет его мучили камни в почках, которые, быть может, отчасти определили его образ жизни. Бойль не был женат, был глубоко религиозен и, по свидетельству друзей, знавших его в течение сорока лет, никогда не произносил слова «бог» без благоговейной паузы. В течение 16 лет (1661–1677) он был председателем знаменитой Ост-Индской компании и на этом посту больше всего заботился о деятельности миссионеров в колониях. Примерно треть его ученых трудов посвящена теологии. Он самолично финансировал переводы библии на турецкий, арабский, малайский языки и даже на язык американских индейцев.
Но вместе с тем Бойль был одним из основателей Королевского общества и в числе первых его членов.
Это был высокий худой человек, в концу жизни бледный и изможденный. Несмотря на свою известность, он вел простую жизнь, был дисциплинирован, благороден и предельно учтив. Когда ему в 1680 году пожаловали звание пэра, он отказался от такой чести, поскольку его совесть не позволила ему принести необходимую в таких случаях присягу. Умер Бойль в постели за правкой корректуры своих «Очерков общей истории воздуха».
Джон Дальтон родился 5 сентября 1766 года в семье бедного ткача, в Камберленде, на севере Англии. Когда пришло время, его отправили в школу в селение неподалеку. В 12 лет, после того как учитель этой школы ушел в отставку, он сам открыл школу сначала в своем доме, а затем в местном доме собраний квакеров и преподавал там два года. Факт этот сам по себе необычайный, но комментариев и воспоминаний о нем не сохранилось.
Еще год он работал на ферме и в возрасте 15 лет уехал к старшему брату Джонатану. Вместе с ним они открыли школу и преподавали в ней 12 лет, пока в 1793 году Джона не пригласили в Манчестерский новый колледж, где он еще шесть лет преподает математику и физику. Здесь он вступает в Манчестерское литературное и философское общество и читает научные доклады. Первый его доклад был посвящен цветовому дефекту зрения, которым он сам страдал и который известен теперь под названием дальтонизма.
В Манчестере он прожил до конца своих дней и закончил их 27 июля 1844 года, разбитый параличом за семь лет до этого.
Дальтон происходил из семьи квакеров, одной из самых строгих протестантских сект. Быть может, именно это обстоятельство усугубило природные черты его характера. Он жил размеренной жизнью, его день никогда не менялся: соседи с точностью до минут узнавали время, когда он поутру выходил записывать показания термометра и барометра. Рабочий день Дальтона заканчивался в 9 часов вечера. После ужина он молча сидел в кругу семьи, курил трубку, лишь изредка вставляя краткие замечания.
Каждый четверг после обеда он шел не на работу, а на лужайку для игры в шары, примыкавшую к таверне «Собака и куропатка». Здесь он неожиданно утрачивал свои трезвые и размеренные манеры, к удивлению зрителей, возбужденно размахивал руками и бросал шары с неожиданным энтузиазмом. Несколько умеренных пари, всегда точно рассчитанных, чай и неизменная трубка заканчивали этот день. Домой он возвращался к началу вечерних метеорологических наблюдений. В воскресенье, одетый в квакерские бриджи до колен, серые чулки и башмаки с пряжками, он дважды посещал публичное богослужение, хотя по вопросам веры никогда не высказывался.
Он почти ничего не читал и часто хвастал, что «может унести всю свою библиотеку на спине и что даже из этих книг он не прочел и половины». «Как у всех самоучек, в нем было меньше развито желание знать то, что сделали другие, чем твердая уверенность в правильности найденного им самим», — писал о нем один из биографов.
На современников его человеческие качества действовали удручающе. Брат Хэмфри Дэви вспоминал впоследствии: «Его вид и манеры были отталкивающими… голос у него был резкий и сварливый, а походка жесткая и неуклюжая».
Примерно так же воспринимали его члены Манчестерского философского общества, которые тем не менее за научные заслуги избрали Дальтона в 1817 году своим президентом. К концу жизни он признан повсюду: в 1822 году его избирают членом Королевского общества, а в 1830 году — одним из восьми иностранных членов Парижской академии вместо умершего за год до этого Хэмфри Дэви.
Как всегда в таких случаях, последующие поколения полностью равнодушны к личным недостаткам ученого. Они помнят только лучшее в нем — его идеи. Наверное, в этом и состоит одна из причин человеческого прогресса.
Атониус Ван дер Брок (1870–1926) был по профессии юристом, а наукой занимался в свободное от работы время. Уже само по себе в XX веке это было редкостью, но и во всем остальном Ван дер Брок был личностью примечательной. Он глубоко интересовался наукой, но не любил научных собраний и дискуссий; его философия жизни сделала его вегетарианцем, а его наряд и особенно сандалии, которые он носил, явно относились к другой эпохе.
Когда Резерфорду рассказали о гипотезе Ван дер Брока, он с раздражением заметил, что «…только любитель может позволить себе высказывать забавы ради много догадок сразу без достаточных на то оснований». Следы этой неприязни сохранились надолго, и еще много лет спустя Резерфорд настойчиво выражал недовольство, когда Бор в своих работах по теории атома ссылался на Ван дер Брока.
2-я часть Идеи
Глава шестая
Теория Бора глазами современников ♦ Явление, образ, понятие, формула ♦ Атомная механика Гейзенберга
Через несколько лет космонавты возвратятся с Марса. Они привезут с собой тонны кинопленки и образцов. Но не в этом будет главная ценность их полета — все это могут доставить и рóботы. Космонавты привезут с собой впечатления. Об этих впечатлениях им будет очень трудно рассказать. Прежде всего потому, что в земном языке нет слов, которые бы точно соответствовали всему тому, что их поразило.
Но с этой трудностью они сообща справятся уже во время долгого обратного пути: перебирая недавние впечатления, они будут вынуждены придумать для них новые слова или непривычные сочетания слов — иначе они просто не смогут между собой договориться.
Настоящие трудности начнутся потом, по возвращении на Землю, когда они захотят рассказать о своих впечатлениях всем остальным. Ведь все те, кто не летал вместе с ними, будут понимать их слова по-старому, по-земному. Пройдет немалое время, прежде чем слушатели овладеют новыми словами и станут вкладывать в них тот же смысл, что и сами космонавты.
Так происходит всегда: в науке и в искусстве, в технике и политике. Значение слов определяется традицией и привычкой, но их истинный смысл выясняется только в контексте. Узнавая новые явления, человек называет их старыми словами, но вкладывает в них другой смысл — смысл, который нельзя понять, если не знать происхождения новых понятий и их связей с прежними.
Это стремление хоть как-то отделить нужное значение слов от привычного приводит к появлению жаргона в науке, который вызывает понятное недовольство редакторов. Дилетанты от науки впадают в другую крайность: они воспринимают все ее утверждения буквально, не зная той сложной системы условностей, которыми окружено любое утверждение науки. Сплошь и рядом из-за этого возникают недоразумения — смешные для физиков, огорчительные для самих дилетантов.
В конце прошлого — начале нашего века физики открыли новый мир — мир атома. Их ошеломило богатство новых явлений, форм и закономерностей. Они наскоро придумали им названия, но не вполне понимали, какой смысл в них надо вкладывать. В поисках однозначности многие из них вообще перестали доверять словам и верили только уравнениям. То было «смутное время» в физике, хотя именно тогда были добыты основные факты, которыми до сих пор жива наука об атоме. Пока что мы стремились узнать как можно больше таких фактов. Теперь попытаемся найти слова, чтобы правильно об этих фактах рассказать.
Рассказ о квантовой механике мы начали с определения: квантовая механика — это наука о строении и свойствах атомных объектов и явлений. Сразу же оказалось, что мы не в состоянии определить понятие «атом». Вполне однозначно мы не можем определить его и сейчас, хотя знаем о нем гораздо больше, чем вначале. В первой части мы подробно проследили, как под влиянием опытов умозрительные образы сменялись более сложной, менее наглядной, но зато и более реальной картиной атома.
В начале века уже никто не верил в атомы — твердые шарики, и от первоначальных представлений Демокрита сохранилась только одна идея: в природе существует предел делимости материи, после которого она переходит в новое качество.
Ученые постепенно доказали, что атом действительно существует, но совсем не похож на атом Демокрита. Узнали, что он состоит из ядра и электронов. Выяснили, что он может испускать лучи. Установили, что это излучение связано с движением электронов в атоме. Необходимо было найти законы этого движения. И тогда изобрели квантовую механику.
Начал создавать ее Нильс Бор: он первый отчетливо понял, что постоянная Планка h не забавная гипотеза, помогающая объяснить спектр абсолютно черного тела, а физическая реальность, которую необходимо учитывать при объяснении всех атомных явлений. На основе этой идеи он сформулировал свои знаменитые постулаты — о стационарном состоянии и квантовом скачке. Постулаты Бора противоречили всей прежней физике, однако внесли неожиданный порядок в первозданный хаос новых опытных фактов.
Но наука ничего не принимает на веру — даже если это постулаты Бора. Надо было либо отбросить их, либо устранить их противоречия. Как удалось решить эту задачу и построить последовательную теорию атомных явлений — об этом и будет рассказано дальше.
Теория Бора глазами современников
В 1949 году Альберт Эйнштейн так вспоминал об эпохе создания квантовой механики.
«Все мои попытки приспособить теоретические основы физики к новым результатам потерпели полную неудачу. Это было так, точно из-под ног ушла земля и нигде не видно было твердой почвы, на которой можно было бы строить. Мне всегда казалось чудом, что этой колеблющейся и полной противоречий основы оказалось достаточно, чтобы позволить Бору — человеку с гениальной интуицией и тонким чутьем — найти главнейшие законы спектральных линий и электронных оболочек атомов, включая их значение для химии. Это мне кажется чудом и теперь. Это наивысшая музыкальность в области мысли».
Издали всегда много легче и надежнее оценивать значение открытий. Современникам гораздо труднее: они еще слишком мало знают, чтобы отличить достоинства теории от ее недостатков. Современники Бора, несмотря на все успехи его теории, были глубоко не удовлетворены.
То, что они писали и говорили в то время, для нас непривычно и поучительно.
«Если это правильно, то это означает конец физики как науки» (А. Эйнштейн, 1913).
«Атом существует вечно, мы это, бесспорно, знаем. Но понимаем ли мы это? Нет, не понимаем. Наше непонимание мы прикрываем непонятными же квантовыми условиями. Процесс лучеиспускания — это акт возрождения разрушенного атома. Механизм его нам непонятен. Свое непонимание мы вновь прикрываем непонятным квантовым условием, второй гипотезой Бора… Весь этот метод Бора основан на квантовании — совершенно слепом, мало логическом процессе мысли, на формальной, если можно так выразиться, интуиции» (Д. С. Рождественский, 1919).
«Теория квантов подобна другим победам в науке: месяцами вы улыбаетесь им, а затем годами плачете» (Г. Крамерс, 1920).
«Законы квантования в своей теперешней формулировке носят до некоторой степени теологический характер, для натуралиста совершенно неприемлемый, так что многие ученые по справедливости возмущаются этими Bauern-Regeln (крестьянскими законами)» (П. Эпштейн, 1922).
«Мы неизмеримо далеки от такого описания атомного механизма, которое позволило бы проследить, например, все движения электрона в атоме или понять роль стационарных состояний…
…Теорию квантов можно сравнить с лекарством, излечивающим болезнь, но убивающим больного» (Г. Крамерс, X. Гольст, 1923).
«Физика теперь снова зашла в тупик, во всяком случае для меня она слишком трудна, и я предпочел бы быть комиком в кино или кем-нибудь вроде этого и не слышать ничего о физике!» (В. Паули, 21 мая 1925 г.).
Даже у самого Бора тогдашнее положение теории вызывало «чувство грусти и безнадежности».
Это единодушное недовольство трудно понять тем, кто совсем незнаком со структурой и методами нынешней физики. Чтобы осознать причину подобного недовольства, необходимо хотя бы в общих чертах представить себе внутреннюю логику естественных наук. Занятие это непривычное и, пожалуй, непростое, однако для понимания квантовой механики абсолютно необходимое.
В учебнике квантовой механики человека неискушенного прежде всего поражает обилие формул и уравнений. Довольно скоро он убеждается, однако, что это необходимая, но не самая трудная часть науки об атоме. Гораздо сложнее понять, что скрывается за формулами или, как принято говорить в физике, «понять физический смысл формул». Трудности эти не следует преувеличивать, но, поскольку они все-таки реально существуют, помнить о них полезно. Их суть в том, что многие слова, привычные нам с детства, в квантовой механике мы вынуждены использовать в необычном смысле.
Явление, образ, понятие, формула
Всякое познание природы начинается с ощущений: ребенок трогает рукой деревянную лошадь, слушает голос матери, сосет соску — словом, с первых же дней жизни он попадает в мир явлений, которые рождают у него свои образы. Для этих явлений и образов у него нет пока даже названий — лишь постепенно он начинает узнавать слова, им соответствующие, и обучается понимать, какие образы скрываются за словами других людей. Довольно скоро он догадывается, что одни и те же слова рождают у разных людей различные образы, и, наконец, выясняет, что есть слова (или группы слов), которые не связаны непосредственно с образами, хотя и появились благодаря им. Это понятия.
Понятия обобщают коллективный опыт, они намеренно лишены деталей, присущих конкретным образам, и потому пригодны для общения разных людей между собой.
Развиваясь, ребенок начинает мыслить понятиями, он вдруг понимает, что «деревянная лошадь» — только одна из «игрушек», а «вода» — это не обязательно морская вода, вода из реки или из-под крана, — это просто вода. Способность к абстракции — первый признак взрослого человека и непременное условие всякой науки. Иначе она превратилась бы в беспорядочный набор фактов.
Однако и понятия не вполне однозначны — хотя бы потому, что рождают у разных людей различные образы. Даже в повседневной жизни подобное может привести к недоразумениям. В науке это еще опаснее: ведь ее результаты претендуют на объективный смысл и не должны зависеть от капризов воображения или мнений отдельных людей. Поэтому в науке каждому понятию сопоставлен набор символов и чисел и заданы строго определенные правила действий над ними. Этим достигается та однозначность науки, которая позволяет общаться между собой ученым разных стран и поколений.
Связь:
явление→образ→понятие→формула —
можно изобразить схематически и пояснить на примере возникновения понятия волна.
Люди наблюдали различные явления: волны на море и круги от брошенного камня в пруду, распространение света и колебания струны. У них при этом возникали вполне конкретные образы. Постепенно им стало ясно, что этим разным явлениям присуще нечто общее: все они связаны с некоторым периодическим процессом, характерные признаки которого — явления интерференции и дифракции (о них мы подробно говорили раньше). Так возникло новое понятие волна. А чтобы сделать его вполне однозначным, с ним связали четыре характеристики: амплитуду А, скорость распространения v, длину волны λ и частоту ν.
Точно так же понятие частица не предполагает, что у вас при этом возникает конкретный образ бильярдного шара, дроби или пылинки. Физику вполне достаточно знать, что частица — это некий объект, внутренним строением которого он не интересуется, но у которого есть масса m, скорость v, импульс p = mv и траектория движения, которую физик может проследить.
Траектория — еще одно новое понятие, которое необходимо использовать, определяя понятие «движение частицы». На первый взгляд процесс этот беспределен: чтобы определить понятие, нужно использовать другое понятие, которое вновь необходимо определять, и т. д. Однако это не так. В физике существует несколько первичных понятий, которые можно определить без ссылок на другие, а именно — задав точные рецепты измерения величин, которые этим понятиям соответствуют. Таковы понятия: время t, координата x, заряд e и т. д.
Траектория движения частицы задана, если в каждый момент времени t мы можем указать положение частицы — ее координаты x — в пространстве. Нужно только либо измерить координаты x в моменты времени t, либо вычислить их. Первую задачу решает экспериментальная физика, вторую — теоретическая. Однако вторую задачу можно решить лишь в том случае, если известны физические законы, по которым частица движется.
Что есть физический закон? Это постоянная связь явлений и величин, записанная с помощью математических символов в виде уравнений. Для каждой группы явлений существуют свои законы движения: в механике — одни законы (уравнения Ньютона), в электродинамике — другие (уравнения Максвелла). А все вместе взятое в совокупности: понятия, физические законы, формулы, их выражающие, и следствия из них — принято называть точной наукой.
Каждая законченная наука должна быть логически непротиворечива. Это означает, в частности, что каждое понятие в рамках этой науки можно употреблять только в одном строго определенном смысле. Добиться этого трудно, но необходимо, поскольку ученые, как и все люди, общаются между собой не формулами, а с помощью слов. Формулы нужны им лишь для однозначной записи результатов исследований.
Примером логически завершенной науки долгое время служила механика, которую за ее совершенство назвали классической. Механика — это наука о движении тел. Ее законам подчиняются почти все видимые движения в природе — будь то порхание мотылька или полет планет. Классическое совершенство механики долгое время гипнотизировало ученых, и они пытались объяснить с ее помощью не только механические, но и все другие движения в природе.
«Все единодушно признают, что задачей физики является подведение всех явлений природы под простые законы механики», — писал Генрих Герц даже в 1894 году, на пороге революции в физике.
Движение — одно из самых сложных понятий физики. С ним воображению вольно связывать любые образы — от шелеста листьев до бегущего носорога. Однако даже самые фантастические картины движения, доступные нашему воображению, содержат нечто общее: перемещение одних объектов относительно других с течением времени. После введения понятия траектории понятие движения становится более определенным — вероятно, потому, что при этом оно вновь приобретает черты наглядности. Только теперь эта наглядность особого сорта: возникающий образ никак не похож на мотылька или носорога. И все же наглядность, связанная с понятием траектории, опасна. Действительно, частое повторение словосочетания «траектория движения» приводит к тому, что оба понятия просто перестают различать, хотя совпадают они только для одного вида движений — механических. Но поскольку условия развития и воспитания человека таковы, что ему трудно вообразить иное движение, кроме механического, то и все другие виды движения он пытается осмыслить также с помощью понятия траектории. Это ему, естественно, не удается, например, при попытке осмыслить электрические движения. Можно, конечно, представить себе высоковольтную линию передачи или междугородный телефон и вообразить, что провода и есть «траектории» электрических сигналов, однако реального смысла такие образы не имеют; волны электрических сигналов не жидкость, текущая по проводам.
Определить понятие движения в квантовой механике еще сложнее. Более того: именно тот день, когда это понятие удалось определить непротиворечиво, можно считать днем рождения современной квантовой механики.
Атомная механика Гейзенберга
Когда прошел восторг первых успехов теории Бора, все вдруг трезво осознали простую истину: схема Бора противоречива. От такого факта некуда было укрыться, и им объясняется тогдашний пессимизм Эйнштейна, равно как и отчаяние Паули.
Физики вновь и вновь убеждались, что электрон при движении в атоме не подчиняется законам электродинамики: он не падает на ядро и даже не излучает, если атом не возбужден. Все это было настолько необычно, что не укладывалось в голове: электрон, который «произошел» от электродинамики, вдруг вышел из-под контроля ее законов. При любой попытке найти логический выход из подобного порочного круга ученые всегда приходили к выводу: атом Бора существовать не может.
Однако природе нет дела до наших логических построений: атомы вопреки всякой логике устойчивы и, насколько мы знаем, существуют вечно. А если законы электродинамики не могут обеспечить устойчивость атома, тем хуже для них, значит, движение электрона в атоме подчиняется каким-то другим законам.
Впоследствии оказалось, что постулаты Бора — это удачная догадка о тогда еще неизвестных, но фундаментальных законах, которые чуть позже назовут законами квантовой механики.
Квантовая механика — это наука о движении электронов в атоме. Она первоначально так и называлась: атомная механика. А Вернер Карл Гейзенберг — первый из тех, кому выпало счастье эту науку создавать.
Весной 1925 года по приглашению Бора Гейзенберг приехал в Копенгаген из Мюнхена, где только что закончил университет под руководством Зоммерфельда. В Дании он сразу же попал в обстановку научных споров, в среду людей, для которых физика стала главным делом жизни. Полгода прошли в работе и бесконечных дискуссиях все о том же: почему электрон — объект электродинамики — не подчиняется ее законам в атоме и в чем причина удивительной силы нелогичных постулатов Бора? Наконец, что означает в этом случае само понятие «движение»?
Наступило лето. В июне заболевший Гейзенберг уехал отдохнуть на остров Гельголанд в Балтийском море. Отдохнуть ему не удалось — там он вдруг понял неожиданную истину: нельзя представлять себе движение электрона в атоме как движение маленького шарика по траектории. Нельзя, потому что электрон не шарик, а нечто более сложное, и проследить движение этого «нечто» столь же просто, как движение бильярдного шара, нельзя. И если эта догадка верна, то, пытаясь проследить траекторию электрона в атоме, мы задаем природе незаконные вопросы вроде тех, которые задавали в древности: «На чем держится Земля?», «Где у нее край?» А немного позднее: «Где у нее верх и низ?»
Гейзенберг утверждал: уравнения, с помощью которых мы хотим описать движение в атоме, не должны содержать никаких величин, кроме тех, которые можно измерить на опыте. А из опытов следовало, что атом устойчив, состоит из ядра и электронов и может испускать лучи, если его вывести из состояния равновесия. Эти лучи имеют строго определенную длину волны и, если верить Бору, возникают при перескоке электрона с одной стационарной орбиты на другую. При этом схема Бора ничего не говорила о том, что происходит с электроном в момент скачка, так сказать «в полете» между двумя стационарными состояниями. А все, и Гейзенберг в том числе, по привычке добивались ответа именно на этот вопрос. Но в какой-то момент ему стало ясно: электрон не бывает «между» стационарными состояниями, такого свойства у него просто нет!
А что есть? Есть нечто, чему он не знал пока даже названия, но был убежден: оно должно зависеть только от того, куда перешел электрон и откуда.
До сих пор, исходя из уравнений электродинамики, все пытались найти гипотетическую траекторию электрона в атоме, которая непрерывно зависит от времени и которую можно задать рядом чисел x1, x2, x3, …, отмечающих положение электрона в моменты времени t1, t2, t3, … Гейзенберг утверждал: такой траектории в атоме нет, а вместо непрерывной кривой X(t) есть набор дискретных чисел Хnk, значения которых зависят от номеров n и k начального и конечного состояний электрона.
Это важное и довольно сложное утверждение можно пояснить простой аналогией. Представьте, что перед вами шахматная доска, по которой ползет муха. При желании можно очень подробно проследить ее путь, если в каждый момент времени t отмечать ее положение x. По этим измерениям вы затем легко сможете начертить кривую X(t), то есть траекторию движения мухи. Если у вас нет такого желания, то вы можете ограничиться только указанием квадратов, которые посетила муха на своем пути. Это тоже даст некую информацию о ее перемещении, но легко сообразить, что с точки зрения классической механики такое описание будет неполным.
Теперь представьте, что вы за той же доской играете в шахматы и решили, например, сделать традиционный ход e2—e4. В этом случае результат вашего хода совершенно не зависит от того, по какому пути вы передвинули пешку. Это и понятно: правила шахматной игры не зависят от законов механики, а потому и не нуждаются в понятии траектории.
Гейзенберг сообразил, что «правила атомной игры» тоже не требуют знания траектории. В соответствии с этим он представил состояние атома в виде бесконечной шахматной доски, в каждом квадрате которой написаны числа Хnk. Естественно, что значения этих чисел зависят от положения квадрата на «атомной доске», то есть от номера n строки (начальное состояние) и номера столбца k (конечное состояние), на пересечении которых стоит число Хnk.
Никого не удивляет тот факт, что запись шахматной партии позволяет повторить ее даже много лет спустя. Конечно, при этом мы не узнаем, как долго она длилась в действительности, что переживали при этом шахматисты и как именно двигали они пешки и фигуры. Но это и неважно, коль скоро нам интересна только игра сама по себе.
Точно так же, если нам известны числа Хnk — эта своеобразная запись «атомной игры», — мы знаем об атоме все необходимое, чтобы предсказать его наблюдаемые свойства: спектр атома, интенсивность его спектральных линий, число и скорость электронов, выбитых из атома ультрафиолетовыми лучами, а также многое другое.
Числа Хnk нельзя назвать координатами электрона в атоме. Они заменяют их, или, как стали говорить позже, представляют их. Но что означают эти слова — на первых порах не понимал и сам Гейзенберг.
Действительно, вместо таблицы чисел {Хnk} с таким же успехом можно нарисовать все, что угодно, скажем цветок, и сказать, что именно он представляет движение электрона в атоме. Однако тут же с помощью Макса Борна (1882–1970) и Паскуаля Иордана удалось понять, что таблица чисел {Хnk} не просто таблица, а матрица.
Что означает это слово? Математика имеет дело с величинами и символами, и каждый символ в ней подчиняется своим правилам действия. Например, простые числа можно складывать и вычитать, умножать и делить, и результат этих действий не зависит от того, в каком порядке мы эти действия производим:
5 + 3 = 3 + 5 и 5 · 3 = 3 · 5.
Но в математике есть и более сложные объекты: отрицательные и комплексные числа, матрицы и т. д. Матрицы — это таблицы величин типа {Хnk} для которых существуют свои строго определенные операции сложения и умножения.
В частности, результат перемножения двух матриц зависит от порядка, в котором они перемножаются, и
{Хnk} · {Pnk} ≠ {Pnk} · {Xnk}.
Это правило может показаться странным и подозрительным, но никакого произвола в себе не содержит. По существу, именно это правило отличает матрицы от других величин. Менять его по своей прихоти мы не вправе — в математике тоже есть свои незыблемые законы. Законы эти, независимые от физики и всех других наук, закрепляют на языке символов все мыслимые логические связи в природе. Причем заранее неизвестно, реализуются ли все эти связи в действительности.
Конечно, математики о матрицах знали задолго до Гейзенберга и умели с ними работать. Однако для всех было полной неожиданностью, что эти странные объекты с непривычными свойствами соответствуют чему-то реальному в мире атомных явлений. Заслуга Гейзенберга и Борна в том и состоит, что они преодолели психологический барьер, нашли соответствие между свойствами матриц и особенностями движения электронов в атоме и тем самым основали новую, атомную, квантовую, матричную механику.
Атомную — потому, что она описывает движение электронов в атоме.
Квантовую — ибо главную роль в этом описании играет понятие кванта действия h.
Матричную — поскольку математический аппарат, необходимый для этого, — матрицы.
В новой механике каждой характеристике электрона: координате x, импульсу p, энергии E — сопоставлялись соответствующие матрицы: {Хnk}, {Pnk} и {Enk} — и уже для них (а не для чисел) записывали уравнения движения, известные из классической механики. А затем надо было только проследить, чтобы все действия над величинами {Хnk}, {Pnk}, {Enk} не нарушали правил математики.
Гейзенберг установил даже нечто большее: он выяснил, что квантовомеханические матрицы координаты {Хnk} и импульса {Pnk} — это не вообще матрицы, а только те из них, которые подчиняются коммутационному (или перестановочному) соотношению:
{Хnk} · {Pnk} – {Pnk} · {Xnk} = iħ,
где i = √-1, а ħ = h/2π.
В новой механике это перестановочное соотношение играло точно такую же роль, как условие квантования Бора в старой механике. И точно так же, как условия Бора выделяли стационарные орбиты из набора всех возможных, коммутационное соотношение Гейзенберга выбирает из множества всех матриц только квантовомеханические.
Не случайно, что в обоих случаях — и в условиях квантования Бора, и в уравнениях Гейзенберга — необходимо присутствует постоянная Планка h. Как мы увидим в дальнейшем, постоянная Планка непременно входит во все уравнения квантовой механики, и по этому признаку их можно безошибочно отличить от всех других уравнений.
Новые уравнения, которые нашел Гейзенберг, были непохожи ни на уравнения механики, ни на уравнения электродинамики и потому никак не могли их нарушить. С точки зрения этих уравнений состояние атома полностью задано, если известны все числа Хnk или Pnk, то есть известны матрицы {Хnk} или {Pnk}. Причем структура этих матриц такова, что в невозбужденном состоянии атом не излучает.
Обратите внимание: в наших рассуждениях нигде не использовано понятие «движение электрона в атоме». Теперь оно просто не нужно. Согласно Гейзенбергу движение — это не перемещение электрона-шарика по какой-либо траектории вокруг ядра.
Движение — это изменение состояния системы во времени, которое описывается матрицами {Хnk} и {Pnk}.
Вместе с вопросами о характере движения электрона в атоме сам собой отпал и вопрос об устойчивости атома. С новой точки зрения в невозбужденном атоме электрон покоится, а потому и не должен излучать.
Теория Гейзенберга была внутренне непротиворечива, чего схеме Бора так недоставало. Вместе с тем она приводила к таким же результатам, что и правила квантования Бора. Кроме того, с ее помощью удалось наконец показать, что гипотеза Планка о квантах излучения E = hν — это простое и естественное следствие новой механики.
Можно и дальше пытаться без формул излагать следствия механики Гейзенберга. Однако это будет так же неестественно, как попытка пересказать словами музыку.
Чтобы постигнуть глубины квантовой механики, необходимо штудировать математику, учиться работать с матрицами — одним словом, надо овладевать ремеслом физика.
В матрицах нет ничего мистического или непостижимого: изучить их значительно проще, чем усвоить, скажем, латынь. Но, пожалуй, не стоит этого делать в автобусе. Этому, как и музыке, надо учиться специально. Иначе неприятный осадок полузнания отравит даже то удовольствие, которое доступно каждому: без формул и вычислений почувствовать красоту образов и законченность понятий любой глубокой науки.
Появление матричной механики Гейзенберга физики встретили с огромным облегчением: «Механика Гейзенберга снова вернула мне радость жизни и надежду. Хотя она и не дает решения загадки, но я верю, что теперь снова можно продвигаться вперед», — писал Паули 9 октября 1925 года.
Свою веру он вскоре сам же и оправдал. Применив новую механику к атому водорода, он получил те же формулы, что и Нильс Бор на основе своих постулатов. Конечно, при этом возникли новые трудности, однако это уже были трудности роста, а не безнадежность тупика.
Вокруг кванта
Фундамент физики
Основные понятия физики: длина, время, масса, заряд и т. д. — нельзя определить однозначно с помощью слов по двум причинам: во-первых, эти понятия первичны и ни к чему другому более простому не сводятся; во-вторых, физика — наука количественная и потому понятиям сразу же необходимо соотнести числа. Существует только один способ сделать такие понятия однозначными: задать точный рецепт измерения величин, которые им соответствуют.
Мы уже определяли понятие «длина»: 1 м — это такая длина, на которой укладывается 1 650 763,73 волны оранжевой линии спектра Kr-86 в вакууме (изотоп криптона с массовым числом 86). Принятая за эталон, спектральная линия соответствует переходу электрона в атоме криптона между его уровнями 5d и 2p. Один метр приближенно равен 1/40000000 части парижского меридиана, принятой первоначально, в 1799 году, за эталон длины.
Единица массы в 1 кг определяется как масса платино-иридиевого цилиндра специальной формы (его высота 39 мм равна диаметру основания), который изготовлен в 1789 году. Эта масса приближенно совпадает с массой одного литра дистиллированной воды при 4 градусах Цельсия.
Чтобы определить единицу времени, надо использовать какой-нибудь стабильный циклический процесс, например вращение Земли вокруг Солнца. 1 секунда — это 1/31 556 925,9747 часть тропического года, который равен промежутку времени между двумя одинаковыми положениями Земли относительно звезд. Однако продолжительность тропического года медленно меняется (на 0,5 сек. в столетие) из-за прецессии земной оси и других возмущений, поэтому в эталоне принята продолжительность 1900 года, а точнее — года, который начался в 12 часов дня 31 декабря 1899 года.
С течением времени убедились, однако, что единицу времени — так же, как и единицу длины — лучше всего определять на основе спектроскопических измерений, поскольку до сих пор это самая точная область физики. В 1967 году XIII Генеральная конференция по мерам и весам дала новое определение секунды, согласно которому 1 сек. — это продолжительность 9 192 631 770 периодов излучения, соответствующего переходу электрона между двумя сверхтонкими уровнями основного состояния изотопа цезия с массовым числом 133 (Cs-133).
Переход к атомным стандартам длины и времени был неизбежен не только потому, что спектроскопия — самый точный отдел физики. Дело в том, что атомные стандарты необычайно стабильны: они не зависят ни от температуры, ни от давления, ни даже от космических катастроф, чего нельзя сказать о первоначально принятых эталонах. (Например, «стандартный метр» хранят под стеклянным колпаком, при постоянной температуре и с прочими предосторожностями.) Еще хуже обстоят дела с секундой. В самом деле, если через солнечную систему неожиданно пролетит какое-то небесное тело, то период обращения Земли вокруг Солнца необратимо изменится, а вместе с ним изменится и продолжительность секунды. Ничто подобное не грозит атомным стандартам: они устойчивы и неизменны, как сам атом, на свойствах которого они основаны.
Три величины — метр (м), килограмм (кг), секунда (сек.) — образуют часть системы единиц СИ и достаточны для описания всех механических движений. Электромагнитная теория требует измерения еще двух фундаментальных величин: заряда e и скорости света c. А чтобы описать атомные явления, необходимо знать также величину постоянной Планка h.
Для точного определения фундаментальных физических констант в 1875 году создано Международное бюро мер и весов, которое раз в шесть лет собирает генеральные конференции мер и весов. На этих съездах тщательно оговариваются все подробности условий, в которых происходят измерения: температура, давление, высота над уровнем моря и т. д. Столь же скрупулезно перечисляются все детали приборов для измерения эталонных величин.
Отметим важную особенность таких измерений: только в редких случаях удается определить одну величину независимо от других. Для измерения остальных величин необходимо использовать законы физики. Скажем, если скорость v частицы постоянна, можно определить ее, измерив расстояние Δx, которое частица пройдет за время Δt:
v = Δx/Δt.
Это простой пример того, что все фундаментальные константы в некотором смысле взаимосвязаны. Существует целый специальный и довольно сложный раздел физики, задача которого непротиворечиво определить весь набор этих констант, учитывая одновременно все данные об их измерениях.
Но самый трудный вопрос — это вопрос о границах применимости понятий, определенных таким способом.
Легко сообразить, что единицы измерения — метр, килограмм, секунда — выбраны так, что человеку легко их представить, поскольку они соизмеримы с размерами самого человека. Действительно, 1 м — это рост пятилетнего ребенка, 1 кг весит буханка хлеба, 1 сек. — это один удар сердца. Сохраняют ли эти понятия свой прежний смысл при переходе к очень большим и очень малым расстояниям, массам и промежуткам времени?
Общего ответа на этот вопрос пока не существует. Однако у нас был случай убедиться, что к электрону понятие размера уже неприменимо. В теории атома (где понятие «движение» пришлось заменить новым) прежние понятия «длина», «масса», «время» все еще сохраняют свою силу. Это означает, что, по крайней мере, расстояния 10–10 м, массы 10–27 кг и промежутки времени 10–17 сек. все еще можно понимать в их обычном смысле.
Аналогичная проблема возникает и в астрономии при попытке осмыслить огромные расстояния до галактик и их массы. Пожалуй, здесь она даже труднее, чем в теории элементарных частиц. Действительно, никто не может с легким сердцем утверждать, что он вполне понимает слова «один миллиард световых лет». Формально все предельно просто: это расстояние, которое проходит луч света за 109 лет, то есть расстояние в 109 · 3,15 · 107 сек · 3 · 108 м/сек = 1025 м. Но как понять или хотя бы почувствовать, что в действительности скрывается за этим символом? Для сравнения напомним, что расстояние от Земли до Солнца 1,5 · 1011 м луч света проходит «всего» за 8 минут; до ближайшей звезды — α Центавра — за 4,35 года, а до центра нашей Галактики — за 30 000 лет.
История первого метра
В 1788 и 1789 годах многие города Франции обратились к правительству с просьбой о введении единой системы мер, чтобы покончить со злоупотреблениями на этой основе. Талейран (в то время еще епископ Отенский) внес этот вопрос в Национальное собрание. Была создана комиссия французской академии в составе Борда, Лагранжа, Лапласа, Монжа и Кондорсе. Она рекомендовала принять за единицу длины какую-либо часть земного экватора или меридиана, как это давно предлагал инженер-географ Бонн. 30 марта 1791 года Национальное собрание постановило принять в качестве метра одну сорокамиллионную долю земного меридиана. Вскоре после этого Мешен в Испании и Деламбр во Франции приступили к измерению дуги меридиана между Дюнкерком и Барселоной. Время было тревожное — шла Великая французская революция, лишь недавно казнили короля. В землях санкюлотов, где пришлось работать Деламбру, многие колокольни были разрушены, приходилось строить пирамиды из досок и обтягивать их белой холстиной. Но тут взбунтовались окрестные крестьяне: белый цвет — символ королевской власти. Пришлось обшивать полотно по краям голубыми и красными полосами.
В набожной Испании, где работал Мешен, колоколен было сколько угодно, но туда просто не пускали, обвиняя ученых в кощунстве. К тому же все вокруг были напуганы чумой и потому запрещали Мешену свободно переезжать с места на место, заставляли все его бумаги смачивать уксусом и создавали массу других мелких помех. Разбитый и больной, Мешен хотел просить отставки, но, не дождавшись ее, умер.
Его работу продолжили члены Парижской академии Араго и Био, которым повезло больше: им помогало правительство, протекции крупных епископов и даже один знаменитый главарь разбойников. По окончании работ Био уехал во Францию как раз незадолго до вторжения французских войск в Испанию. Араго тотчас схватили: конечно же, это он расставлял знаки на вершинах, чтобы потом привести по ним французскую армию. В плену Араго читал испанские журналы, в которых сообщалось, что он казнен и принял смерть мужественно, как подобает христианину.
Вскоре, однако, Араго бежит в Алжир и там садится на корабль, идущий в Марсель. Но по дороге корабль захватывают испанские корсары, и снова Араго гоняют по испанским тюрьмам вместе со всяким сбродом. На его счастье, некий африканский властитель на том же корабле посылал подарок Наполеону — двух африканских тигров. Властитель пригрозил войной Испании, корабль был выдан, пленники отпущены и на том же корабле отправились в Марсель. Но корабль сбился с пути и попал в Бужи. Отсюда Араго вернулся опять в Алжир, со многими приключениями прошел пешком Кабилию, его вновь схватили, опять грозили тюрьмой, но, наконец, разрешили вернуться во Францию. Удивительнее всего, что после всех этих нескончаемых приключений записи, зашитые в белье, и даже инструменты остались целыми и невредимыми.
На основании измерений Мешена и Деламбра искусный механик Ленуар изготовил хорошо известный теперь всем эталон метра, и законом от 25 июня 1800 года новая единица длины была введена во всеобщее употребление. «Из всех хороших предприятий, которые у нас останутся в памяти о Французской революции, это то, за которое мы всего менее заплатили…» — писал позднее Деламбр в своем отчете 1806 года.
Глава седьмая
Луи де Бройль ♦ Волны материи ♦ Оптико-механическая аналогия ♦ Волновая механика Шредингера
В свои 23 года венгерский офицер Янош Бояи открыл неевклидову геометрию и был счастлив этим до тех пор, пока не узнал, что где-то на границе Азии и Европы Николай Иванович Лобачевский опубликовал ту же геометрию несколькими годами ранее. И тогда его жизнь стала походить на кошмар: повсюду ему чудились шпионы и соглядатаи, он стал резок и подозрителен, обвинял всех, даже своего отца, всю жизнь посвятившего той же проблеме. Наверное, Фаркаш Бояи не был так гениален, но он был человечнее и мудрее сына. Умирая, он говорил ему: «Не отчаивайся: когда приходит весна, все фиалки расцветают сразу».
В науке об атоме такая весна наступила в 1925 году. Всего за три года появилась, расцвела и даже дала первые плоды новая наука — квантовая механика. С тех пор в ней изменилось очень немногое: так внезапно среди океана возникает вулканический остров и затем уже не меняется столетиями. Конечно, все это — и остров в океане, и весна — неожиданны лишь для тех, кто не следил за подземными толчками и равнодушно проходил мимо набухших почек. В первой части мы стремились почувствовать именно эти глухие толчки, разглядеть то незаметное движение соков, с которых и началась весна квантовой механики.
По-настоящему она пришла тогда, когда Вернер Гейзенберг, взломав лед предрассудков, под коим были погребены застывшие основы физики, дал новую жизнь понятию о движении и создал новую, матричную механику. Это была первая последовательная теория атома, которая объясняла его устойчивость и которую так долго искали. Но (вполне по законам весны!) всего четыре месяца спустя Эрвин Шредингер создал еще одну механику — волновую, которая столь же хорошо объясняла строение атома, но была совсем не похожа на матричную механику.
Впоследствии мы узнаем, что и матричная, и волновая механики просто разные формы записи единой квантовой механики — науки о строении атомов. Но прежде мы должны понять, в чем суть волновой механики, и усвоить те простые идеи, из которых она выросла.
Луи де Бройль
Гейзенберг родился в 1901 году. Когда он заканчивал гимназию, его родина Германия воевала со всем миром: с Россией — родиной Менделеева, с Англией — родиной Резерфорда. Она воевала и с Францией, где в 1892 году родился принц Луи Виктор де Бройль — потомок королей и будущий нобелевский лауреат. В то время он не занимался физикой — он воевал — и лишь после войны стал работать в лаборатории своего старшего брата Мориса де Бройля. Брат изучал рентгеновские спектры элементов, и поэтому в его лаборатории хорошо знали работы Бора.
Как и многих в то время, Луи де Бройля занимал все тот же вопрос: «Почему атомы устойчивы? И почему на стационарных орбитах электрон не излучает?»
Первый постулат Бора выделял эти орбиты из набора всех мыслимых орбит квантовым условием, которое связывает радиус орбиты r, скорость v и массу m электрона с целым числом квантов действия h:
mvr = n · h/2π.
Де Бройль хотел найти разумные основания для этого условия, то есть стремился объяснить его с помощью других, более привычных понятий. (Или, как теперь принято говорить, пытался понять его физический смысл.)
Когда ищут объяснение непонятным фактам, как правило, прибегают к аналогиям. Точно так же поступил и де Бройль в поисках выхода из тупика противоречивых представлений об атоме. Он догадался, что трудности эти сродни тем, которые возникли при попытках понять противоречивые свойства света.
Со светом дело запуталось окончательно в 1923 году, когда Артур Комптон поставил свой знаменитый опыт и доказал, что рассеяние рентгеновых лучей на электронах нисколько не похоже на рассеяние морских волн, зато в точности напоминает столкновение двух бильярдных шаров, один из которых — электрон с массой m, а другой — световой квант с энергией E = hν. После опыта Комптона уже нельзя было сомневаться в том, что в природе реально существуют световые кванты, а их энергия E = hν однозначно связана с длиной световой волны — λ = c/ν которой эти кванты соответствуют. В 1926 году по предложению Дж. Льюиса их стали называть фотонами.
Ни де Бройль, ни его современники не могли объяснить, что означают слова: «Световые кванты соответствуют световой волне». Однако у них не было оснований подвергать сомнению эксперименты, из которых следовало, что в одних условиях световой луч ведет себя как волна с длиной λ и частотой ν = c/λ, а в других — как поток частиц — фотонов — с энергией E = hν и импульсом p = hν/c.
Года через три-четыре все поймут, что это явление — лишь частный случай корпускулярно-волнового дуализма в природе, но в то время де Бройлю пришлось находить верную дорогу ощупью.
Волны материи
Де Бройль верил в единство природы, верил искренне и глубоко — как все великие ученые до него. Поэтому он не мог допустить, что луч света — нечто особенное и ни на что другое в природе не похожее. Де Бройль предположил: не только луч света, но и все тела в природе должны обладать и волновыми, и корпускулярными свойствами одновременно. Поэтому, кроме световых волн и частиц материи, в природе должны реально существовать и кванты света, и волны материи.
Такое простое и сильное утверждение нелегко высказать: для этого нужны смелость и вера. Еще труднее его понять — на это способен лишь непредвзятый ум, привычный к абстрактному мышлению. И это очень трудно представить — природа, доступная восприятию наших пяти чувств, не создала зримых образов, которые могли бы помочь нам в этих усилиях. В самом деле, при слове, «частица» вам может прийти на память все, что угодно, — песчинка, бильярдный шар, летящий камень, но вы никогда не вспомните морские волны или колеблющуюся струну. Для нормального человека это настолько противоречивые образы, что объединить их в один кажется противоестественным.
Всякий рассказ о рождении новой физической теории заведомо неточен даже в устах ее создателя: такой рассказ, как правило, использует понятия, которых в момент создания теории не было. У ныне живущих физиков понятие «волна материи» вызывает в сознании некий сложный образ, который ни с чем привычным в окружающем нас мире сравнить нельзя. Образ этот складывается постепенно, при работе с формулами квантовой механики, при решении атомных задач, и рассказать о нем словами довольно трудно. Понятно, что использовать такой сложный и совершенный образ в 1922 году де Бройль не мог, и потому в его тогдашних рассуждениях мы встречаем некий заменитель: образ волны, которая возникает при колебаниях струны.
Хорошо известно, что при ударе по натянутой струне она начинает звучать, и звук этот зависит от длины струны. Механизм возникновения звука также хорошо известен: колебания струны передаются воздуху, и мы воспринимаем уже колебания воздуха, а не колебания струны, которые их породили. Однако между ними существует строгая связь. Например, если мы слышим ноту ля из первой октавы, то в этот момент струна колеблется с частотой ν = 440 герц, то есть 440 колебаний в секунду. А поскольку скорость звука в воздухе равна v = 334 м/сек, то длина этих звуковых волн равна
λ = v/ν = 76 см.
При колебаниях струны мы слышим основной тон — такое колебание, когда вся струна колеблется как целое. Однако при ее возбуждении возникают и дополнительные колебания — обертоны. Картина колебаний усложняется, на струне появляются «узлы», то есть такие точки, которые остаются неподвижными в процессе колебания. Но всегда строго соблюдается одно условие: на длине струны умещается целое число полуволн λ/2. Для основного тона на длине струны укладывается ровно половина волны λ/2. Для первого обертона — две половины волны, между которыми расположен неподвижный «узел», и так далее.
Все это де Бройль вспомнил, представив себе колеблющуюся струну. Дальнейшее — сравнительно просто.
Свернем наши струны в кольцо и представим себе, что это орбиты электрона в атоме. Теперь заменим движение электрона по ним колебаниями волн, которые «соответствуют электрону», — де Бройль был убежден, что это разумно. Легко видеть, что при сворачивании струн в кольцо на них появляется дополнительный узел, то есть основной тон растянутой струны превращается в первый обертон кольцевой струны. А это, в свою очередь, означает, что на кольцевой струне может уместиться самое меньшее целая волна λ, а не половина волны λ/2 (как прежде на плоской струне). Таким образом, движение электрона будет устойчивым тогда — и только тогда! — когда на длине орбиты укладывается целое число n «волн электрона» λ. Отсюда следует простое условие:
2πr = nλ.
Де Бройль сравнил это условие с первым постулатом Бора:
и нашел отсюда «длину волны электрона»:
λ = h/mv.
Вот и все. Это действительно просто. Но это так же просто, как формула Планка E = hν, как постулаты Бора, как закон всемирного тяготения Ньютона, — это гениально просто. Такие открытия просты, ибо требуют самых простых понятий. Но в истории развития человеческого духа их считанное число, ибо они меняют самые основы нашего мышления. И никогда нельзя до конца понять, как они были совершены. Это всегда чудо, объяснить которое не под силу даже самим создателям. Они могут лишь строго и просто повторить вслед за Ньютоном: «Я все время об этом думал».
Де Бройлю было 30 лет, когда он нашел свою формулу. Но искать ее он начал за одиннадцать лет до этого — с тех самых пор, как его брат Морис приехал из Брюсселя, где был секретарем первого Сольвеевского конгресса. Того самого конгресса 1911 года, на котором Планк рассказал о развитии «гипотезы квант». Значительность открытий, живые впечатления старшего брата от общения с великими физиками настолько поразили воображение младшего, что он не смог забыть их даже на войне. Постоянное напряжение мысли разрешилось наконец в 1922 году гипотезой о волнах материи. Теперь де Бройль смог дать новое определение понятию «стационарная орбита»: это такая орбита, на которой укладывается целое число «волн электрона» λ.
Если это действительно так, то проблемы устойчивости атома не существует, ибо в стационарном состоянии электрон подобен струне, колеблющейся в вакууме без трения. Такие колебания не затухают, а потому без внешнего воздействия электрон останется в стационарном состоянии навсегда.
Самое трудное — высказать гипотезу. Это всегда процесс нелогический. Но как только гипотеза высказана, строгие законы логики позволяют извлечь из нее все следствия. Главное из них очевидно: если «волны материи» существуют, то их можно обнаружить и измерить. Их действительно обнаружили и доказали их реальность с той степенью достоверности, какая вообще доступна в физике. Однако случилось это четыре года спустя; и об этом мы расскажем потом.
Свои формулы де Бройль написал в 1923 году — за два года до работ Гейзенберга и Шредингера. Их простота и прозрачность основной идеи очень напоминали постулаты Бора. И точно так же, как постулаты Бора, идеи де Бройля еще не были теорией атома — для этого их необходимо было записать на языке уравнений. Когда Вернер Гейзенберг создал матричную механику, он тем самым превратил идеи Бора в точные формулы и строгие уравнения.
Идеи де Бройля стали началом волновой механики, которую создал Эрвин Шредингер.
Оптико-механическая аналогия
Сейчас мы должны усвоить несколько новых фактов. Пусть вначале они покажутся не очень простыми — все равно понять их необходимо, если мы не хотим без конца повторять гладкие, обкатанные фразы о «таинственной стране микромира», которые лишь засоряют ум, поскольку на поверку ничего реального не означают.
Говорим ли мы об атомах или о квантах — мы вновь и вновь обращаемся к свойствам светового луча. Это не случайно. По существу, в нем заключена почти вся нынешняя физика. Сейчас мы еще раз — и более пристально — взглянем на его свойства. Для этого нам нужно возвратиться к Исааку Ньютону и вспомнить смысл его спора с Христианом Гюйгенсом о природе светового луча.
Всегда, во все времена все знали, что луч света в пустоте распространяется прямолинейно; это знание человек приобретает в детстве без всякой науки и физических приборов — после того, как несколько раз ушибется об угол стола. Впоследствии это знание помогает ему избегать многих других опасностей, и постепенно он убеждается в его истинности. Чтобы сделать явление распространения луча более наглядным, в учебниках обычно соединяют источник света и глаз наблюдателя прямой линией, то есть рисуют воображаемую траекторию светового луча.
И по смыслу, и по возникающим образам траектория светового луча ничем не отличается от траектории движения частицы. На этом основании во времена Ньютона луч света представляли себе как поток очень маленьких частиц. Конечно, путь этих «световых частиц» (как и путь обычных частиц) может искривляться, допустим, при переходе из воздуха в воду, но понятие траектории и в этом случае сохраняется. В повседневной жизни это понятие очень полезно и не приводит к недоразумениям: оно помогает избегать автомобилей на улицах, определять положение звезд на небе и конструировать фотоаппараты.
С развитием экспериментальной физики люди раздвинули узкие границы повседневного опыта и обнаружили новые свойства светового луча: оказывается, он нацело теряет свои привычные свойства, если огибает «очень маленькое препятствие». Физика — наука количественная, и в ней такое неопределенное утверждение не имеет смысла. Маленькое — по сравнению с чем?
Христиан Гюйгенс представлял себе распространение света как колебания некоего «светового эфира». Образ, при этом возникающий в сознании, напоминает круги от брошенного в пруд камня либо же бесконечные ряды морских волн. В правомерности этих образов перестали сомневаться вовсе после трудов Максвелла и Герца, которые доказали, что свет — это просто частный случай электромагнитных колебаний.
Вспомним (мы об этом говорили в первой главе): у всякого колебания есть характеристика — длина волны. Теперь наше утверждение приобретает строгий смысл: «Луч света теряет свои привычные свойства, если размеры препятствия сравнимы с длиной его волны». В этом случае луч света уже не распространяется прямолинейно — происходит явление дифракции. Кроме того, отдельные волны луча начинают взаимодействовать между собой — усиливать и гасить друг друга, или, как принято говорить в физике, начинают интерферировать. Оба явления — дифракция и интерференция — в конечном итоге дают на экране дифракционную картину, которую с точки зрения Ньютона понять довольно трудно. Волновая же теория света объясняет ее вполне естественно, и это определило ее победу.
Со временем к свойствам света настолько привыкли, что они превратились в некий эталон для всех вообще волновых процессов. Теперь, если в каком-либо процессе замечали вдруг явления интерференции и дифракции, то уже не сомневались в его волновой природе. Потому, собственно, все сразу и признали гипотезу де Бройля о волнах материи, увидев первые снимки дифракции электронов.
Взгляните на три почти одинаковые фотографии на странице 164: слева — дифракция видимого света, справа — дифракция электронов, внизу — волны на воде. Глядя на них, не поверить в волновую природу электрона очень трудно. Для нынешнего поколения физиков это уже не вопрос веры, а факт точного знания и даже средство для технических приложений.
В стройной теории волновой оптики оставалась одна неувязка: луч света мы воспринимаем все-таки как луч, а не как волну. Как объяснить такой факт с точки зрения волновой оптики? Задачу решил Огюстен Жан Френель, и его объяснение можно найти теперь в любом учебнике физики.
Оказывается, при интерференции все волны от источника света гасят друг друга, кроме тех, которые находятся внутри узкого канала толщиной в половину длины волны света. (Для видимого света толщина канала λ/2 ≈ 3 · 10–5 см.) Если мы пренебрежем толщиной «светового канала», то получим ту самую траекторию светового луча, к которой все мы привыкли в обычной жизни.
Известен даже способ ее построения: сначала нужно провести линии через все гребни волн — как говорят в физике, отметить фронт волны. А затем от источника света провести линию, которая перпендикулярна к фронту волны. Это и будет траектория светового луча. Если вблизи препятствия фронт волны искажается, то одновременно с этим искривляется и траектория луча — луч света огибает препятствие, происходит дифракция.
В 1834 году Уильям Роуан Гамильтон (1805–1865), знаменитый профессор астрономии в Дублинском университете, занимался непонятной для современников задачей. Он хотел доказать, что формальная аналогия между траекторией движения частицы и траекторией светового луча имеет строгий математический смысл.
Мы уже знаем: в физике понятию закона движения соответствуют формулы — уравнения движения. Для волн и частиц они совершенно различны: решая одни, мы вычисляем траекторию частицы, решая другие, находим форму и скорость фронта волны. Но мы также знаем, что в оптике можно нарисовать траекторию светового луча, зная движение фронта его волны.
Гамильтон доказал, что в механике можно сделать нечто противоположное: заменить траекторию частицы движением фронта некоторой волны. Или более точно: уравнения движения механики можно записать в таком виде, что они полностью совпадут с уравнениями геометрической оптики, которые описывают распространение луча света без учета его волновых свойств. Тем самым Гамильтон доказал оптико-механическую аналогию: движение частицы по траектории можно представить как распространение луча света без учета его волновых свойств.
Волновая механика Шредингера
Эрвин Шредингер (1887–1961) в 1911 году окончил Венский университет, где были еще живы традиции Доплера, Физо, Больцмана и весь дух классических времен физики: основательность при изучении явлений и неторопливый к ним интерес. В 1925 году это был уже немолодой профессор Цюрихского университета, сохранивший, однако, юношеское стремление понять самое главное в тогдашней физике: «Как устроен атом? И как в нем движутся электроны?»
В конце 1925 года в одной из статей Эйнштейна Шредингер прочел несколько слов похвалы в адрес де Бройля и его гипотезы. Этих немногих сведений ему оказалось достаточно, чтобы поверить в гипотезу де Бройля о волнах материи и развить ее до логического конца (что всегда трудно, и не только в науке).
Ход его рассуждений легко понять, по крайней мере, теперь, почти полвека спустя. Прежде всего он вспомнил оптико-механическую аналогию Гамильтона. Он знал, что она доказана лишь в пределе геометрической оптики — тогда, когда можно пренебречь волновыми свойствами света. Шредингер пошел дальше и предположил: оптико-механическая аналогия остается справедливой также и в случае волновой оптики. Это означает, что всегда любое движение частиц подобно явлению распространения волн.
Как и всякое глубокое открытие, гипотеза Шредингера ниоткуда логически не следовала.
Но, как всякое открытие, логические следствия она имела.
Прежде всего, если Шредингер прав, то движение частиц должно обнаруживать волновые свойства в тех областях пространства, размеры которых сравнимы с длиной волны этих частиц. В большой степени это относится и к движению электрона в атоме: сравнив формулы де Бройля (λ = h/mv) и Бора (mvr = h/2π), легко усмотреть, что диаметр атома d = λ/π примерно в три раза меньше, чем длина волны электрона λ. Но эта длина — единственная, которую мы вспоминаем, когда говорим о размерах электрона в атоме. Теперь становится очевидным, что представить его в атоме частицей невозможно, ибо тогда придется допустить, что атом построен из таких частиц, которые больше его самого. Отсюда сразу, и немного неожиданно, следует уже известный нам из предыдущей главы постулат Гейзенберга: не существует понятия траектории электрона в атоме.
Действительно, не может нечто большее двигаться внутри чего-то меньшего, и притом еще по какой-то траектории. Но тогда не существует и проблемы устойчивости атома, так как электродинамика запрещает электрону двигаться в атоме лишь по траектории и не отвечает за явления, которые происходят при других типах движений. Все это означает, что в атоме электроны существуют не в виде частиц, а в виде некоторых волн, смысл которых мы поймем немного позже. А пока ясно только одно: какова бы ни была природа этих электронных волн, их движение должно подчиняться волновому уравнению. Шредингер нашел это уравнение. Вот оно:
Для тех, кто видит его впервые, оно абсолютно непонятно и может возбудить лишь любопытство или чувство инстинктивного протеста, причем последнее без серьезных оснований.
В самом деле, представленный на этой странице рисунок столь же непонятен, как и уравнение Шредингера, однако мы принимаем его без внутреннего сопротивления. Мы совсем успокоимся, узнав, что это просто герб города Парижа, в котором мы никогда не были и, быть может, никогда не побываем. Только самые дотошные станут допытываться, почему он выглядит именно так, а не иначе. Как и в уравнении Шредингера, в этом гербе каждая черта и каждый символ исполнены смысла. Вверху — королевские лилии, которые появились в геральдических знаках Франции уже в конце V века — после победы Хлодвига над гуннами у берегов реки Ли. (По преданию, воины Хлодвига, возвращаясь домой, украсили свои шлемы и щиты цветами белых лилий «ли-ли», по-русски «белый-белый»). Внизу герба — корабль, похожий очертаниями на Ситэ — остров посреди Сены, где в древности обитало племя паризиев, по имени которых назван Париж. А форма герба напоминает парус — в память об основном занятии древних обитателей Парижа. Как видите, понять герб несложно, однако только жителям города он по-настоящему близок.
Подойдем к уравнению Шредингера точно так же. Примем его вначале просто как символ квантовой механики, как некий герб квантовой страны, по которой мы теперь путешествуем, и постараемся понять, почему он именно таков. Некоторые штрихи в этом гербе нам уже понятны: m — это масса электрона, ħ — постоянная Планка h, деленная на 2π, E — полная энергия электрона в атоме, U(x) — его потенциальная энергия, x — расстояние от ядра до электрона. Несколько сложнее понять символ второй производной d2/dx2, но с этим пока ничего нельзя поделать, вначале придется просто запомнить, что это символ дифференциального исчисления, из-за которого уравнение Шредингера не простое, а дифференциальное.
Самое сложное — понять, что собой представляет ψ-функция (читается: пси-функция). Это действительно не просто, и вначале даже сам Шредингер истолковал неправильно ее смысл. Мы также поймем его несколько позднее, а сейчас важно усвоить следующее: несмотря на свою необычность, пси-функция все же как-то представляет движение электрона в атоме. По-другому, чем матрицы Гейзенберга {Xnk} и {Pnk}, но все-таки представляет, и притом хорошо. Настолько хорошо, что с ее помощью многие задачи квантовой механики можно решать значительно проще и быстрее, чем с помощью матриц Гейзенберга.
Физики довольно быстро оценили преимущества волновой механики: ее универсальность, изящество и простоту, и с тех пор почти забросили механику матричную.
Однако победа далась не сразу.
Вокруг кванта
Опыт Комптона
Представьте себе, что вы стоите перед зеркалом в зеленом свитере и вдруг замечаете, что ваше изображение одето в красный свитер. Прежде всего вы, вероятно, протрете глаза, а если это не поможет, пойдете к врачу. Потому что «так не бывает». В самом деле, зеленые лучи — что волны, длина которых λ = 5500Å. Встретив на пути препятствие — зеркало, они отражаются, но при этом никак не могут изменить свою длину и стать, например, красными (λ = 7500Å). А Комптон наблюдал именно это явление. Направив на мишень пучок рентгеновых лучей с длиной волны λ, он обнаружил, что длина волны рассеянных лучей λ′ больше длины волны падающих, то есть рассеянные лучи действительно «краснее» первоначальных!
Чудо это можно понять, если вспомнить гипотезу Эйнштейна о квантах света, которую он предложил для объяснения явлений фотоэффекта. Действительно, в этом случае вместо рентгеновых волн с длиной λ и частотой ν = c/λ нужно представлять себе поток частиц — квантов с энергией E = hν. Сталкиваясь с электронами атомов мишени, они выбивают их оттуда (затратив энергию P), разгоняют до скорости v (дополнительно затратив энергию mv2/2), а сами рассеиваются с меньшей энергией E′ = hν′. Очевидно, что
Если атом полностью поглотит квант света (E′ = 0), то мы увидим обычное явление фотоэффекта, а уравнение Комптона превратится в уравнение Эйнштейна:
Оба эти опыта можно провести в камере Вильсона, проследить путь каждого выбитого электрона и тем самым наглядно представить процесс столкновения светового кванта с электроном.
Но в таком случае что нам мешает увидеть себя в красном свитере? Оказывается, все те же квантовые законы, которые запрещают электрону поглощать произвольные порции энергии. Электрон на стационарной орбите в атоме может поглотить только такой квант, который либо перебросит его из одного стационарного состояния в другое, либо выбросит его из атома (вспомните опыт Франка и Герца). Энергия «зеленых квантов» (длина их волны (λ = 5,5 · 10–5 см = 5500Å) равна
А этого слишком мало, чтобы вырвать электрон из атома (нужно впятеро больше, P ≈ 10 эв). Поэтому они упруго (без потери энергии) отразятся от атомов зеркала и при этом нисколько не «покраснеют».
Совсем другую картину являют собой рентгеновы лучи (λ ≈ 1Å). Их энергия примерно в 5–10 тысяч раз больше, и потому явления, которые с ними происходят, иные. Например, они вовсе не отражаются от зеркала, а свободно через него проходят, срывая по пути электроны с его атомов.
Конечно, даже простой процесс отражения зеленого света от зеркала несколько сложнее, чем мы это сейчас представили. Но существует еще одна — главная — трудность: в нашей стройной картине, где вместо волн света сплошь одни только кванты света, нет места опытам Фридриха, Книппинга и Лауэ, которые открыли дифракцию рентгеновых лучей и тем самым доказали их волновую природу.
Как примирить эти несовместимые представления: лучи-волны и лучи-кванты?
В следующей главе мы увидим, что квантовая механика справилась и с этой задачей.
Электрон: частица или волна?
Мы не думаем об этом каждый день, точно так же, как и об устройстве телефона. Мы просто пользуемся приборами, в которых электрон «работает», — телевизором, рентгеновским аппаратом, электронным микроскопом. Но если задуматься, как устроены эти аппараты, то вопрос о природе электрона сразу потеряет свой академический характер.
В телевизионной трубке изображение получают с помощью электронов, которые разгоняются напряжением V ≈ 10 000 в. При этом они приобретают скорость v ≈ 5 · 109 см/сек — всего в шесть раз меньше скорости света. Длину их волны легко вычислить по формуле де Бройля: λ = h/mv, она равна λ ≈ 0,1Å, то есть в 10 раз меньше размеров атома. И поскольку в телевизоре электроны распространяются прямолинейно, мы их воспринимаем как поток частиц.
В электронном микроскопе тот же электрон работает как волна: пучок электронов разгоняют напряжением в 100 000 вольт до скорости 1010 см/сек, что соответствует длине волны в 0,05Å. Кроме того, этот пучок проходит через систему магнитных линз, точно так же, как в обычном микроскопе луч света проходит через линзы оптические. В волновой оптике хорошо известно, что из-за явлений дифракции даже в лучший микроскоп нельзя разглядеть предмет, если его размеры меньше, чем половина длины волны света, которым он освещен. Длина волны видимого света равна 5000Å, поэтому в обычный микроскоп можно различать лишь предметы, размеры которых превышают 2500Å. Размеры бактерий превышают 10–4 см = 10 000Å, поэтому их легко наблюдать в обычный микроскоп. Но уже вирусы в такой микроскоп различить нельзя: их размеры меньше 1000Å (например, диаметр вируса гриппа всего 800Å).
Теоретически электронный микроскоп позволяет разглядеть объекты размером до 0,02Å, то есть в 50 раз меньше атома. Означает ли это, что мы можем таким способом рассмотреть отдельный атом? Нет, конечно. Энергия связи электрона в атоме (P) равна примерно 10 электрон-вольтам (энергия, которую приобретает электрон, пройдя разность потенциалов 10 в). А в электронном микроскопе электроны приобретают энергию около 100 тыс. электрон-вольт. Такие «лучи» сразу же, при первом столкновении с атомом, разрушат его. (В самом деле, легко сообразить, что если мы захотим получить на стене тень от пылинки, стреляя по ней из ружья, то ничего хорошего из такой затеи не выйдет.) Реально в электронный микроскоп удалось пока рассмотреть объекты размером 5–10Å, то есть в 5–10 раз больше атома.
Дифракция электронов
Как и многие открытия в физике, дифракция электронов была обнаружена во многом «случайно», хотя, как любил повторять Пастер, «случай говорит только подготовленному уму».
В 1922 году по заказу американской фирмы «Белл-телефон» Клинтон Джозеф Дэвиссон (1881–1958) и его сотрудник Кенсмен изучали отражение электронных пучков от поверхности металлов и вдруг заметили какие-то аномалии. В 1925 году, после работ де Бройля, ученик Макса Борна Вальтер Эльзассер предположил, что эти аномалии объясняются электронными волнами. Дэвиссон прочел эту заметку, но не придал ей значения. В 1926 году он приехал в Европу и показывал свои графики Максу Борну и Джеймсу Франку в Геттингене, а также Дугласу Хартри в Оксфорде. Все они единодушно признали в них волны де Бройля. В пути через океан Дэвиссон изучал работы Шредингера и вскоре по приезде в Америку вместе с Лестером Альбертом Джермером (род. 1896) подтвердил гипотезу де Бройля опытом.
Дж. П. Томсон подошел к проблеме с другого конца. Он с самого начала относился к гипотезе де Бройля с большим сочувствием и вскоре после посещения Англии Дэвиссоном стал обдумывать способы доказать ее на опыте. В Англии после работ Крукса и Дж. Дж. Томсона опыты с катодными лучами стали непременным и привычным элементом образования. Быть может, поэтому Дж. П. Томсон прежде всего задумался, а нельзя ли приспособить их для новых опытов. Почти сразу же отыскалась подходящая готовая установка в Абердине, с которой работал студент Александр Рейд. Уже через два месяца они получили на этой установке прекрасные фотографии дифракции электронов, которые в точности напоминали дифракцию рентгеновых лучей. Это было естественно, поскольку в их опытах электроны ускорялись потенциалом в 150 в (обычное напряжение городской сети). Длина волны таких электронов равна примерно Å = 10–8 см, то есть сравнима с длиной волны рентгеновых лучей и с размерами атомов.
Небольшая справка: Джордж Паджет Томсон — сын знаменитого Джи-Джи — Джозефа Джона Томсона, который в конце века установил, что электрон — это частица. По иронии судьбы тридцать лет спустя сын доказал, что электрон — это волна. И оба они правы, оба удостоены Нобелевской премии за свои открытия.
Загадочная буква ψ
Греческую букву ψ («пси») для обозначения волновой функции Шредингер выбрал более или менее случайно. Но для многих она стала неким символом непонятности квантовой механики. Чтобы лишить ее мистического ореола, предлагаем читателям проследить предполагаемую эволюцию буквы «буки» древнерусского письма «глаголицы» и ее связь с более древними знаками и символами.
Глава восьмая
Корпускулярно-волновой дуализм ♦ Соотношение неопределенностей Гейзенберга ♦ Принцип дополнительности
В начале 20-х годов Макс Борн и Джеймс Франк — физики и Давид Гильберт — математик организовали в Геттингене «семинар по материи». Его посещали и признанные в то время ученые, и знаменитая впоследствии молодежь. Почти каждый семинар Гильберт начинал вопросом: «Итак, господа, подобно вам, я хотел бы, чтобы мне сказали точно: что такое атом?»
Сейчас мы знаем об атоме больше, чем все участники семинара тех лет, однако ответить Гильберту мы еще не готовы. Дело в том, что до сих пор мы узнали довольно много фактов, но нам пока недостает понятий, чтобы эти факты правильно объяснить.
Благодаря Нильсу Бору даже сейчас, много лет спустя, при слове «атом» мы непроизвольно представляем себе маленькую планетную систему из ядра и электронов. Только потом усилием воли мы заставляем себя вспомнить, что ему присущи также и волновые свойства. Сейчас, как и прежде, обе идеи — «электрон-волна» и «электрон-частица» — существуют в нашем сознании независимо, и невольно мы пытаемся от одной из них избавиться. «Электрон или волна»? — к этому вопросу в 20-х годах физики возвращались постоянно, стремясь, как и все люди, к определенности.
К началу 1926 года в атомной физике сложилось любопытное положение: порознь и независимо возникли сразу две квантовые механики, исходные посылки которых резко различались. Гейзенберг вслед за Бором был убежден, что электрон — частица, и свои матричные уравнения написал в этом убеждении. А Шредингер смог вывести свое дифференциальное уравнение, только поверив вместе с де Бройлем в волновые свойства электрона.
Гейзенберг требовал, чтобы в уравнения входили только те величины, которые можно непосредственно измерить на опыте: частоты спектральных линий и их интенсивности. На этом основании он исключил из теории понятие «траектория электронов в атоме», как величину, в принципе не наблюдаемую. Шредингер тоже не использовал понятия траектории, однако записал свое уравнение для ψ-функции, которая также измерена быть не может и смысл которой даже ему самому оставался пока неясным.
Опыт — последний судья во всех спорах — вначале решительно стоял на стороне матричной механики. В самом деле, Фарадей обнаружил неделимость электрического заряда, и дальнейшие опыты Крукса и Томсона строго это доказали. Таким свойством может обладать только частица. Опыты Милликена и фотографии следов электрона в камере Вильсона устранили последние в этом сомнения.
Однако представления об электроне-частице резко противоречили факту удивительной стабильности атома. Мы много раз подчеркивали, что планетарный атом неустойчив. Именно для того, чтобы объяснить устойчивость атома и в то же время сохранить представление об электроне-частице, Бор и придумал свои постулаты.
Де Бройль и Шредингер пошли другим путем и показали, что устойчивость атома наиболее естественно объясняется, если допустить, что электрон — волна, а не частица. Эту гипотезу вскоре подтвердили прямыми опытами Дэвиссон, Джермер и Дж. П. Томсон, обнаружив у электрона способность к дифракции.
Опытам принято верить. Но как поверить сразу двум опытам, исключающим друг друга? Возникшая ситуация в истории физики примеров не имела и была настолько необычна, что вначале никто не подозревал о единстве двух механик, а потому все стремились доказать истинность одной из них и ложность другой. Между сторонниками обеих теорий шли ожесточенные споры: одни отстаивали право первородства матричной механики, другие предпочитали математическую простоту волновой механики. Конец этим спорам положил все тот же Шредингер в начале 1927 года, доказав, что обе механики математически эквивалентны. Для каждого физика это означало, что они эквивалентны также и физически, то есть что перед ним одна и та же механика — механика атома, но записанная в разных формах. Это означало также, что верны исходные предпосылки обеих механик: представления матричной механики об электроне-частице и представления волновой механики об электроне-волне.
Корпускулярно-волновой дуализм
Чем больше ученые узнавали об атоме, тем менее категоричными становились вопросы, которые они задавали природе. Во времена Планка и Эйнштейна хотели знать: «Луч света — это что: волна или поток частиц-квантов?» После работ де Бройля по-прежнему пытались выяснить: «Электрон — что это: волна или частица?» Лишь постепенно и с большим трудом оформилась простая мысль: «А почему или? Почему эти свойства — свойства волны и частицы — должны исключать друг друга?» По трезвом размышлении оказалось, что логических оснований для альтернативы «или — или» нет. А единственная причина, по которой от нее не отказывались, — все та же инерция мышления: мы всегда пытаемся осмыслить новые факты с помощью старых понятий и образов.
Существует еще одна трудность — психологическая: в повседневной жизни мы привыкли, что предметы тем проще, чем они меньше. Например, из 33 матрешек самая маленькая — самая простая, бильярдный шар значительно проще шара земного, а целое всегда состоит из более простых частей. Когда, сидя у моря, Демокрит делил яблоко, он мог представлять себе атом как угодно, но вряд ли ему приходило в голову, что он устроен сложнее, чем все яблоко. Это и в самом деле не так. Но бывает, что одни и те же свойства очевидны у малых предметов и совсем незаметны у предметов больших. Точно так же при дроблении вещества (которое мы по традиции мыслим себе построенным из частиц) у него не появляется новых, волновых, свойств — они проявляются. Свойства эти у него были всегда — просто мы их не замечали.
С явлениями подобного типа мы сталкиваемся значительно чаще, чем сознаем это. Бильярдный шар и шар земной все равно шары, и этим похожи. Однако сколько людей пострадало за эту истину, прежде чем Земля для всех стала шаром. А кривизна бильярдного шара была очевидна даже отцам инквизиции. Все дело в соотношении явления и наблюдателя. Земля, точно так же, как и каждый ее электрон, обладает свойствами волны. Однако если попытаться описать ее движение с помощью уравнения Шредингера, то при массе Земли 5 · 1027 г и скорости, с которой она движется вокруг Солнца — 3 · 106 см/сек, придется приписать этой «частице» волну де Бройля длиной в 4 · 10–61 см — число настолько малое, что даже неизвестно, как понимать такую волну.
Однако мы не можем только на этом основании утверждать, что Земля не обладает волновыми свойствами. Ведь с помощью циркуля и линейки мы не можем измерить ее кривизну, однако Земля все-таки круглая.
Число подобных примеров легко умножить, и каждый из них по-своему помогает понять конечный итог размышлений о проблеме «волна — частица».
Вопроса «волна или частица» не существует; атомный объект — это «и волна и частица» одновременно. Более того, все тела в природе обладают одновременно и волновыми и корпускулярными свойствами, и свойства эти лишь различные проявления единого корпускулярно-волнового дуализма.
К этой мысли пришли еще в 1924 году Бор, Крамерс и Слэтер. В совместной работе они с определенностью заявили, что волновой характер распространения света, с одной стороны, и его поглощение и испускание квантами — с другой являются теми экспериментальными фактами, которые следует положить в основу любой атомной теории и для которых не следует искать каких-либо объяснений.
Непривычное единство свойств «волна — частица» отражено в формулах Планка (E = hν) и де Бройля (λ = h/mv). Энергия E и масса m — характеристики частицы; частота ν и длина волны λ — признаки волнового процесса. А единственная причина, по которой мы не замечаем этого дуализма в повседневной жизни, — малость постоянной Планка h = 6,62 · 10–27 эрг·сек. Даже если это случайное обстоятельство, с ним надо считаться.
Если бы мы жили в мире, где постоянная Планка сравнима с его привычными масштабами, наши представления об этом мире резко отличались бы от нынешних. Например, нам было бы трудно представить себе дома с резкими очертаниями или стоящий спокойно паровоз. Более того, в этом мире вообще не может быть железнодорожных расписаний: в нем нельзя проложить рельсы-траектории, а можно лишь отметить станции отправления и назначения поездов. Конечно, это мир гипотетический, поскольку величину постоянной Планка мы не в состоянии менять по своему произволу — она всегда неизменна и очень мала. Но атомы тоже так малы, что постоянная Планка сравнима с их масштабами. «Для них» этот необычный мир реально существует, и его непривычную логику нам предстоит теперь понять — точно так же, как Гулливеру пришлось привыкать к нравам лилипутов.
Соотношение неопределенностей Гейзенберга
Предположим, что мы настолько прониклись идеей неделимости свойств «волна — частица», что захотели записать свое достижение на точном языке формул. Эти формулы должны установить соотношение между числами, которые соответствуют понятиям «волна» и «частица». В классической механике эти понятия строго разделены и относятся к совершенно различным явлениям природы. В квантовой механике корпускулярно-волновой дуализм вынуждает нас использовать оба понятия одновременно и применять их к одному и тому же объекту. Этот необходимый шаг не дается даром — мы за него должны платить, и, как оказалось, платить дорого.
Вполне ясно это стало в 1927 году, когда Вернер Гейзенберг догадался, что хотя к атомному объекту одинаково хорошо применимы оба понятия: и «частица» и «волна», однако определить их строго можно только порознь.
В физике слова «определить понятие» означают: «Указать способ измерения величины, которая этому понятию соответствует».
Гейзенберг утверждал: нельзя одновременно, и при этом точно, измерить координату x и импульс p атомного объекта. С учетом формулы де Бройля λ = h/p это означает: нельзя одновременно и в то же время точно определить положение x атомного объекта и длину его волны λ. Следовательно, понятия «волна» и «частица» при одновременном их использовании в атомной физике имеют ограниченный смысл. Более того, Гейзенберг нашел численную меру такого ограничения. Он доказал, что если мы знаем положение x и импульс p атомной частицы с погрешностями δx и δp, то мы не можем уточнять эти значения бесконечно, а лишь до тех пор, пока выполняется неравенство — соотношение неопределенностей:
δx · δp ≥ ½h.
Этот предел мал, но он существует, и это фундаментально.
Соотношение неопределенностей — строгий закон природы, который никак не связан с несовершенством наших приборов. Оно утверждает: нельзя — принципиально нельзя — определить одновременно и координату и импульс частицы точнее, чем это допускает приведенное неравенство.
Нельзя — точно так же, как нельзя превысить скорость света или достичь абсолютного нуля температур. Нельзя — как нельзя поднять самого себя за волосы или вернуть вчерашний день. И ссылки на всемогущество науки здесь неуместны: сила ее не в том, чтобы нарушать законы природы, а в том, что она способна их открыть, понять и использовать.
Нам кажется это немного странным — мы привыкли к всесилию науки и утверждение «невозможно» исключили из ее лексикона. Замечательно, однако, что высший триумф любой науки достигается именно в моменты установления таких запретов с участием слова «невозможно». Когда сказали: «Невозможно построить вечный двигатель», возникла термодинамика. Как только догадались, что «нельзя превысить скорость света», родилась теория относительности. И лишь после того, как поняли, что различные свойства атомных объектов нельзя измерять одновременно с произвольной точностью, окончательно сформировалась квантовая механика.
При первом знакомстве с соотношением неопределенностей возникает инстинктивное сопротивление: «Этого не может быть!» Гейзенберг объяснил его причину, отбросив еще одну идеализацию классической физики — понятие наблюдения. Он доказал, что в атомной механике его нужно пересмотреть, точно так же, как и понятие движения.
Подавляющую часть своих знаний о мире человек приобретает с помощью зрения. Эта особенность восприятия человека определила всю его систему познания: почти у каждого слово «наблюдение» вызывает в сознании образ внимательно глядящего человека. Когда вы смотрите на собеседника, то абсолютно уверены, что от вашего взгляда ни один волос не упадет с его головы, даже если вы смотрите пристально и у вас «тяжелый взгляд». В сущности, именно на этой уверенности основано понятие наблюдения в классической механике. Классическая механика выросла из астрономии, и поскольку никто не сомневался, что, наблюдая звезду, мы никак на нее не воздействуем, то это молчаливо приняли и для всех других наблюдений.
Понятия «явление», «измерение» и «наблюдение» тесно связаны между собой, хотя и не совпадают. Древние наблюдали явления — в этом состоял их метод изучения природы. Из наблюдений они извлекали затем следствия с помощью чистого умозрения. По-видимому, с тех пор укоренилась уверенность: явление существует независимо от наблюдения.
Мы много раз подчеркивали главное отличие нынешней физики от античной: она заменила умозрение опытом. Теперешняя физика не отрицает, что явления в природе существуют независимо от наблюдения (и конечно, от нашего сознания). Но она утверждает: объектом наблюдения эти явления становятся лишь тогда, когда мы укажем точный способ измерения их свойств. В физике понятия «измерение» и «наблюдение» неразделимы.
Всякое измерение есть взаимодействие прибора и объекта, который мы изучаем. А всякое взаимодействие нарушает первоначальное состояние и прибора и объекта, так что в результате измерения мы получаем о явлении сведения, искаженные вмешательством прибора. Классическая физика предполагала, что все подобные искажения можно учесть и по результатам измерений установить «истинное» состояние объекта, независимое от измерений. Гейзенберг показал, что такое предположение есть заблуждение: в атомной физике «явление» и «наблюдение» неотделимы друг от друга. По существу, «наблюдение» тоже явление, и далеко не самое простое.
Как и многое в квантовой механике, такое утверждение непривычно и вызывает бессознательный протест. И все же попытаемся его понять или хотя бы почувствовать.
Ежедневный опыт убеждает нас: чем меньше объект, который мы исследуем, тем легче нарушить его состояние. Ничего меньше атомных объектов — атома, электрона — мы в природе не знаем. Определить их свойства усилием воли мы не можем. В конце концов мы вынуждены измерять свойства атомных объектов с помощью самих объектов. В таких условиях прибор неотличим от объекта.
Но почему нельзя добиться, чтобы в процессе измерения один атомный объект лишь незначительно влиял на другой?
Дело в том, что оба они — и прибор и объект — находятся в одном и том же квантовом мире и поэтому их взаимодействие подчиняется квантовым законам. А главная особенность квантовых явлений — их дискретность. В квантовом мире ничего не бывает чуть-чуть — взаимодействия там происходят только квантом: или все, или ничего. Мы не можем как угодно слабо воздействовать на квантовую систему — до определенного момента она этого воздействия вообще не почувствует. Но коль скоро величина воздействия выросла настолько, что система готова его воспринять, это приводит, как правило, к переходу прежней системы в новое (тоже квантовое) состояние, а часто даже и к ее гибели.
Процесс наблюдения в квантовой механике напоминает скорее вкус, чем зрение. «Для того чтобы узнать свойства пудинга, его необходимо съесть» — любили повторять создатели квантовой механики. И подобно тому как, съев однажды пудинг, мы не в состоянии еще раз проверить свое впечатление о его достоинствах, точно так же мы не можем беспредельно уточнять наши сведения о квантовой системе: ее разрушит, как правило, уже первое измерение. Гейзенберг не только понял впервые этот суровый факт, но и сумел записать его на языке формул.
Соотношение неопределенностей, каким бы непонятным оно ни казалось, есть простое следствие корпускулярно-волнового дуализма атомных объектов. Вместе с тем это соотношение — ключ к пониманию всей квантовой механики, ибо в нем сконцентрировались главные ее особенности. После этого открытия Гейзенберга пришлось пересмотреть не только атомную физику, но и всю теорию познания.
Такой шаг оказался под силу опять-таки лишь Нильсу Бору, который счастливо сочетал в себе могучий интеллект ученого и философский склад души истинного мыслителя. В свое время он создал систему образов квантовой, механики, теперь, четырнадцать лет спустя, он тщательно отрабатывал систему ее понятий.
После Бора стало ясно, что и соотношение неопределенностей, и корпускулярно-волновой дуализм лишь частные проявления более общего принципа — принципа дополнительности.
Принцип дополнительности
Принцип, который Бор назвал дополнительностью, — одна из самых глубоких философских и естественнонаучных идей нашего времени, с которой можно сравнить лишь такие идеи, как принцип относительности или представление о физическом поле. Его общность не позволяет свести его к какому-либо одному утверждению — им надо овладевать постепенно, на конкретных примерах. Проще всего (так поступил в свое время и Бор) начать с анализа процесса измерения импульса p и координаты x атомного объекта.
Нильс Бор заметил очень простую вещь: координату и импульс атомной частицы нельзя измерить не только одновременно, но вообще с помощью одного и того же прибора. В самом деле, чтобы измерить импульс p атомной частицы и при этом не очень сильно его изменить, необходим чрезвычайно легкий подвижный «прибор». Но именно из-за его подвижности положение его весьма неопределенно. Для измерения координаты x мы должны поэтому взять другой — очень массивный «прибор», который не шелохнулся бы при попадании в него частицы. Но как бы ни изменялся в этом случае ее импульс, мы этого даже не заметим.
Когда мы говорим в микрофон, то звуковые волны нашего голоса преобразуются там в колебания мембраны. Чем легче и подвижнее мембрана, тем точнее она следует за колебаниями воздуха. Но тем труднее определить ее положение в каждый момент времени. Эта простейшая экспериментальная установка является иллюстрацией к соотношению неопределенностей Гейзенберга: нельзя в одном и том же опыте определить обе характеристики атомного объекта — координату x и импульс p. Необходимы два измерения и два принципиально разных прибора, свойства которых дополнительны друг другу.
Дополнительность — вот то слово и тот поворот мысли, которые стали доступны всем благодаря Бору. До него все были убеждены, что несовместимость двух типов приборов непременно влечет за собой противоречивость их свойств. Бор отрицал такую прямолинейность суждений и разъяснял: да, свойства их действительно несовместимы, но для полного описания атомного объекта оба они равно необходимы и поэтому не противоречат, а дополняют друг друга.
Это простое рассуждение о дополнительности свойств двух несовместимых приборов хорошо объясняет смысл принципа дополнительности, но никоим образом его не исчерпывает. В самом деле, приборы нам нужны не сами по себе, а лишь для измерения свойств атомных объектов. Координата x и импульс p — это те понятия, которые соответствуют двум свойствам, измеряемым с помощью двух приборов. В знакомой нам цепочке познания
явление→образ→понятие→формула
принцип дополнительности сказывается прежде всего на системе понятий квантовой механики и на логике ее умозаключений.
Дело в том, что среди строгих положений формальной логики существует «правило исключенного третьего», которое гласит: из двух противоположных высказываний одно истинно, другое — ложно, а третьего быть не может. В классической физике не было случая усомниться в этом правиле, поскольку там понятия «волна» и «частица» действительно противоположны и несовместимы по существу. Оказалось, однако, что в атомной физике оба они одинаково хорошо применимы для описания свойств одних и тех же объектов, причем для полного описания необходимо использовать их одновременно.
Люди, воспитанные на традициях классической физики, восприняли эти требования как некое насилие над здравым смыслом и поговаривали даже о нарушении законов логики в атомной физике. Бор объяснил, что дело здесь вовсе не в законах логики, а в той беспечности, с которой иногда без всяких оговорок используют классические понятия для объяснения атомных явлений. А такие оговорки необходимы, и соотношение неопределенностей Гейзенберга δx · δp ≥ ½h точная запись этого требования на строгом языке формул.
Причина несовместимости дополнительных понятий в нашем сознании глубока, но объяснима. Дело в том, что познать атомный объект непосредственно — с помощью наших пяти чувств — мы не можем. Вместо них мы используем точные и сложные приборы, которые изобретены сравнительно недавно. Для объяснения результатов опытов нам нужны слова и понятия, а они появлялись задолго до квантовой механики и никоим образом к ней не приспособлены. Однако мы вынуждены ими пользоваться — у нас нет другого выхода: язык и все основные понятия мы усваиваем с молоком матери и, во всяком случае, задолго до того, как узнаем о существовании физики.
Принцип дополнительности Бора — удавшаяся попытка примирить недостатки устоявшейся системы понятий с прогрессом наших знаний о мире. Этот принцип расширил возможности нашего мышления, объяснив, что в атомной физике меняются не только понятия, но и сама постановка вопросов о сущности физических явлений.
Но значение принципа дополнительности выходит далеко за пределы квантовой механики, где он возник первоначально. Лишь позже — при попытках распространить его на другие области науки — выяснилось его истинное значение для всей системы человеческих знаний. Можно спорить о правомерности такого шага, но нельзя отрицать его плодотворность во всех случаях, даже далеких от физики.
Сам Бор любил приводить пример из биологии, связанный с жизнью клетки, роль которой вполне подобна значению атома в физике. Если атом — последний представитель вещества, который еще сохраняет его свойства, то клетка — это самая малая часть любого организма, которая все еще представляет жизнь в ее сложности и неповторимости. Изучить жизнь клетки — значит узнать все элементарные процессы, которые в ней происходят, и при этом понять, как их взаимодействие приводит к совершенно особому состоянию материи — к жизни.
При попытке выполнить эту программу оказывается, что одновременное сочетание такого анализа и синтеза неосуществимо. В самом деле, чтобы проникнуть в детали механизмов клетки, мы рассматриваем ее в микроскоп — сначала обычный, затем электронный, — нагреваем клетку, пропускаем через нее электрический ток, облучаем, разлагаем на составные части… Но чем пристальнее мы станем изучать жизнь клетки, тем сильнее мы будем вмешиваться в ее функции и в ход естественных процессов, в ней протекающих. В конце концов, мы ее разрушим и поэтому ничего не узнаем о ней как о целостном живом организме.
И все же ответ на вопрос «Что такое жизнь?» требует анализа и синтеза одновременно. Процессы эти несовместимы, но не противоречивы, а лишь дополнительны — в смысле Бора. И необходимость учитывать их одновременно — лишь одна из причин, по которой до сих пор не существует полного ответа на вопрос о сущности жизни.
Как и в живом организме, в атоме важна целостность его свойств «волна — частица». Конечная делимость материи породила не только конечную делимость атомных явлений — она привела также к пределу делимости понятий, с помощью которых мы эти явления описываем.
Часто говорят, что правильно поставленный вопрос — уже половина ответа. Это не просто красивые слова.
Правильно поставленный вопрос — это вопрос о тех свойствах явления, которые у него действительно есть. Поэтому такой вопрос уже содержит в себе все понятия, которые необходимо использовать в ответе. На идеально поставленный вопрос можно ответить коротко: «да» или «нет». Бор показал, что вопрос «Волна или частица?» в применении к атомному объекту неправильно поставлен. Таких раздельных свойств у атома нет, и потому вопрос не допускает однозначного ответа «да» или «нет». Точно так же, как нет ответа у вопроса: «Что больше: метр или килограмм?», и у всяких иных вопросов подобного типа.
Два дополнительных свойства атомной реальности нельзя разделить, не разрушив при этом полноту и единство явления природы, которое мы называем атомом. В мифологии такие случаи хорошо известны: нельзя разрезать на две части кентавра, сохранив при этом в живых и коня и человека.
Атомный объект — это и не частица, и не волна и даже ни то, ни другое одновременно. Атомный объект — это нечто третье, не равное простой сумме свойств волны и частицы. Это атомное «нечто» недоступно восприятию наших пяти чувств, и тем не менее оно, безусловно, реально. У нас нет образов и органов чувств, чтобы вполне представить себе свойства этой реальности. Однако сила нашего интеллекта, опираясь на опыт, позволяет познать ее и без этого. В конце концов (надо признать правоту Борна), «…теперь атомный физик далеко ушел от идиллических представлений старомодного натуралиста, который надеялся проникнуть в тайны природы, подстерегая бабочек на лугу».
Когда Гейзенберг отбросил идеализацию классической физики — понятие «состояние физической системы, независимое от наблюдения», — он тем самым предвосхитил одно из следствий принципа дополнительности, поскольку понятия «состояние» и «наблюдение» — дополнительные в смысле Бора. Взятые в отдельности, они неполны и поэтому могут быть определены только совместно, друг через друга. Говоря строго, эти понятия вообще не существуют порознь: мы всегда наблюдаем не вообще нечто, а непременно какое-то состояние. И наоборот: всякое «состояние» — это вещь в себе до тех пор, пока мы не найдем способ его «наблюдения».
Взятые по отдельности понятия: волна, частица, состояние системы, наблюдение системы — это некие абстракции, не имеющие отношения к атомному миру, но необходимые для его понимания. Простые, классические картины дополнительны в том смысле, что для полного описания природы необходимо гармоничное слияние этих двух крайностей, но в рамках привычной логики они могут сосуществовать без противоречий лишь в том случае, если область их применимости взаимно ограничена.
Много размышляя над этими и другими похожими проблемами, Бор пришел к выводу, что это не исключение, а общее правило: всякое истинно глубокое явление природы не может быть определено однозначно с помощью слов нашего языка и требует для своего определения по крайней мере двух взаимоисключающих дополнительных понятий. Это означает, что при условии сохранения нашего языка и привычной логики мышление в форме дополнительности ставит пределы точной формулировке понятий, соответствующих истинно глубоким явлениям природы. Такие определения либо однозначны, но тогда неполны, либо полны, но тогда неоднозначны, поскольку включают в себя дополнительные понятия, несовместимые в рамках обычной логики. К таким понятиям относятся понятия «жизнь», «атомный объект», «физическая система» и даже само понятие «познание природы».
С давних пор известно, что наука — это лишь один из способов изучить окружающий мир. Другой, дополнительный, способ воплощен в искусстве. Само совместное существование искусства и науки — хорошая иллюстрация принципа дополнительности. Можно полностью уйти в науку или всецело жить искусством — оба эти подхода к жизни одинаково правомерны, хотя взятые по отдельности и неполны. Стержень науки — логика и опыт. Основа искусства — интуиция и прозрение. Но искусство балета требует математической точности, а «…вдохновение в геометрии столь же необходимо, как и в поэзии» Они не противоречат, а дополняют друг друга: истинная наука сродни искусству — точно так же, как настоящее искусство всегда включает в себя элементы науки. В высших своих проявлениях они неразличимы и неразделимы, как свойства «волна — частица» в атоме. Они отражают разные, дополнительные стороны человеческого опыта и лишь взятые вместе дают нам полное представление о мире. Неизвестно, к сожалению, только «соотношение неопределенностей» для сопряженной пары понятий «наука — искусство», а потому и степень ущерба, который мы терпим при одностороннем восприятии жизни.
Конечно, приведенная аналогия, как и всякая аналогия, и неполна и нестрога. Она лишь помогает нам почувствовать единство и противоречивость всей системы человеческих знаний.
Вокруг кванта
Дуализм и неопределенность
В волновой оптике давно знали, что ни в какой микроскоп нельзя разглядеть частицу, если ее размеры меньше, чем половина длины волны света, которым она освещена. В этом не видели ничего странного: волны света существуют сами по себе, частица — сама по себе. Но когда выяснилось, что частице тоже можно приписать длину волны, тогда это утверждение волновой оптики превратилось в соотношение неопределенностей: не может частица сама себя локализовать точнее, чем на половине длины своей же волны.
В пору становления квантовой механики даже хорошие физики с горечью шутили, что теперь им приходится по понедельникам, средам и пятницам представлять электрон частицей, а в остальные дни — волной.
Такой способ мышления приводил к множеству парадоксов, от которых мы будем избавлены, если сразу же заставим себя не разделять в электроне свойства «волна — частица». Только после этого соотношение неопределенностей Гейзенберга перестанет быть чем-то странным и превратится в простое следствие корпускулярно-волнового дуализма.
Чтобы убедиться в этом, поставим мысленный эксперимент по измерению импульса p летящей частицы с массой m. Как известно, p = mv — поэтому нам достаточно измерить скорость v. Для этого нужно отметить ее положения x1 и x2 в моменты времени t1 и t2 и затем вычислить скорость по формуле:
Как всегда при измерении, мы на частицу воздействуем и тем самым меняем ее скорость. Поэтому, если нам захочется измерить скорость v как можно точнее, мы должны выбирать точки x1 и x2 как можно ближе — перейти к пределу Δx→0. В классической физике так и поступают.
Но в квантовой механике мы не можем выбрать точки x1 и x2 как угодно близко, и все время должны помнить, что летящая частица — это не точка, а некоторый волновой процесс, и нельзя представлять ее меньшей, чем половина длины волны этого процесса. Поэтому погрешность δx определения каждой из координат x1 и x2 всегда будет больше или, в крайнем случае, равна λ/2.
По той же причине расстояние Δx = x2 – x1 между двумя последовательными измерениями нет смысла брать меньшим λ/2. Наиболее точное значение скорости v получается при значении Δx = λ/2, тогда оно будет равно v = Δx/Δt = λ/2Δt. Понятно, что даже это значение содержит неустранимую погрешность δv, которая зависит от точности δx определения координат x1 и x2 и равна
δv = δx/Δt ≥ λ/2Δt.
Сравнивая две последние формулы для v и δv, приходим к неожиданному, но строгому результату: δv ≥ v. То есть погрешность определения импульса всегда больше или, по крайней мере, равна его наиболее точно измеренному значению: δp ≥ p.
Абсолютная величина погрешности δp определяется длиной волны λ. В самом деле, формулу де Бройля λ = h/p можно обратить: p = h/λ. И поскольку δp ≥ p, то δp ≥ h/λ. Величина обеих погрешностей
δx ≥ λ/2 и δp ≥ h/λ
зависит от длины волны частицы λ. Чем медленнее движется частица, тем больше длина ее волны (λ = h/mv) и тем меньше погрешность δp. Но как раз для такой частицы очень велика неопределенность координаты δx. Меняя скорость частицы, мы можем уменьшить либо δx, либо δp, но никогда не сможем уменьшить их произведение: δx · δp ≥ ½h.
Опыты и мысли Перрена
Из нашего анализа следует еще один неожиданный вывод, который, впрочем, нам уже известен: у атомных объектов нет траектории, поскольку при вычислении скорости частицы v = dx/dt нельзя перейти к пределу Δx→0, Δt→0 и вычислить производную
Это теоретические соображения. На опыте с этим обстоятельством впервые столкнулся Жан Перрен, изучая брауновское движение. Он писал по этому поводу:
«Зигзаги траектории так многочисленны и пробегаются с такой скоростью, что невозможно уследить за ними… Средняя кажущаяся скорость частицы в течение определенного промежутка времени претерпевает громадные изменения по величине и направлению и не стремится вовсе ни к какому пределу при уменьшении этого промежутка. В этом легко убедиться, если отмечать положение зернышка на экране через каждую минуту, затем через каждые 5 сек. и, наконец, фотографировать их через промежутки в 1/20 сек. … Ни в одной точке траектории нельзя получить касательной определенного направления. Трудно в этом случае удержаться от мысли о функциях без производной, в которых напрасно видят лишь математический курьез. В действительности природа внушает представление о них наравне с идеей о функциях, имеющих производную».
Пятнадцать лет спустя догадку Перрена подтвердил создатель кибернетики Норберт Винер, построив теорию брауновского движения на основе «непрерывных функций без производных».
Конечно, брауновское движение — это еще не квантовая механика, но все же это хорошая иллюстрация некоторых ее особенностей.
Поэт и принцип дополнительности
Сам по себе принцип дополнительности, взятый вне физики, изобретение древнее. По существу, он довольно известная категория диалектической логики и в разных видах неоднократно высказывался различными философами во все времена. Аристотель говорил, например, что «гармония — это смешение и сочетание противоположностей», а триады Гегеля можно с успехом приспособить для анализа понятий квантовой механики.
В этой связи любопытно вспомнить, как принцип дополнительности переоткрыли для себя поэты. В 1901 году Валерий Брюсов написал статью под названием «Истины», в которой мы читаем буквально следующее:
«Каково бы ни было наше миросозерцание, есть основы, которые, безусловно, обязательны для мысли… Начиная мыслить, я должен… верить, что мне, вообще человеку, возможно мыслью постичь истину. Может быть, и вероятно, есть другие пути постижения мира: мечты, предчувствия, откровения, но если почему-либо я выбрал логическое мышление, я обязан ему довериться. Иначе всякое рассуждение станет ненужным…»
«Для мышления нужна множественность, независимо от того, будет ли она дроблением я или предстанет как что-то внешнее. Мысль, и общее — жизнь, возникает из сопоставления, по меньшей мере, двух начал. Единое начало есть небытие, единство истины есть безмыслие. Не было бы пространства, не будь правого и левого; не было бы нравственности, не будь добра и зла…»
«В истине ценно лишь то, в чем можно сомневаться. „Солнце есть“ — в этом нельзя сомневаться… Это истина, но в ней нет самостоятельной ценности. Она никому не нужна. За нее никто не пойдет на костер. Даже, говоря яснее, это не истина, а определение. „Солнце есть“ — только особое выражение вместо: такой-то предмет я называю Солнцем».
«Истина получает ценность, лишь когда становится частью возможного миросозерцания. Но в то же время она становится оспоримой, по крайней мере, является возможным спорить о ней… Мало того, ценная истина непременно имеет право на противоположную, соответствующую ей истину; иначе сказать — суждение, прямо противоположное истине, в свою очередь, истинно…»
Знаменательно, что многие из этих утверждений почти дословно предвосхищают формулировки Бора. Не все знают, что и Бор пришел к своему принципу дополнительности не «от физики», а «от философии». Идея дополнительности созрела в нем еще в юношеские годы под влиянием философов Дании. В дальнейшем она крепла и уточнялась, пока не нашла наконец достойного применения в атомной физике.
Тот же Валерий Брюсов двадцать лет спустя, в 1922 году, еще до создания квантовой механики, написал стихотворение
Мир электрона
Быть может, эти электроны — Миры, где пять материков: Искусства, знанья, войны, троны И память сорока веков! Еще, быть может, каждый атом — Вселенная, где сто планет, Там все, что здесь в объеме сжатом, Но также то, чего здесь нет. Их меры малы, но все та же Их бесконечность, как и здесь, Там скорбь и страсть, как здесь, и даже Там та же мировая спесь. Их мудрецы, свой мир бескрайний Поставив центром бытия, Спешат проникнуть в искры тайны И умствуют, как ныне я…Глава девятая
Уравнение Шредингера ♦ Форму чего изображает ψ-функция ♦ Атом ♦ Квантовая истина
«Может быть, естествоиспытателя, покидающего область непосредственных чувственных восприятий с целью открытия более общих взаимосвязей, можно сравнить с альпинистом, который хочет подняться на вершину самой высокой горы для того, чтобы обозреть лежащую перед ним местность во всем ее многообразии. Альпинисту тоже необходимо покинуть плодородные населенные долины. По мере того как он поднимается, перед ним все шире и шире раскрывается окрестность, но вместе с тем все реже он видит вокруг себя признаки жизни. Наконец, он попадает в ослепительно яркую область льда и снега, где уже нет никакой жизни и дышать становится почти невозможно. Только пройдя эту область, он может достигнуть вершины. Но когда он взойдет на вершину, наступит момент, что вся расстилающаяся перед ним местность станет ему видна совершенно отчетливо, и, может быть, тогда область жизни не будет слишком далека от него… В предшествующие эпохи эти безжизненные области воспринимались только как суровые пустыни, вторжение в которые казалось кощунством по отношению к каким-то высшим силам, жестоко каравшим всех тех, кто осмеливался приблизиться к ним».
Эти слова Гейзенберга хорошо поясняют тот качественный скачок, который произошел в сознании людей, когда они перешли от наблюдения явлений, непосредственно воздействующих на их органы чувств, к изучению атомных явлений. Этот перелом произошел в начале века, и он настолько важен, что мы еще раз поясним его на конкретном примере.
Представьте, что перед вами звучит натянутая струна. Вы слышите звук, видите вибрирующую струну, можете прикоснуться к ней рукой, и на основании этих данных в сознании у вас формируется образ физического явления, происходящего перед вами. Понятие «волновой процесс» возникает позднее, при наблюдении других, похожих явлений. Чтобы сделать это понятие однозначным, его закрепляют формулой, уравнением, позволяющим заранее предсказать весь процесс колебания струны. Это предсказание мы можем проверить, запечатлев, например, колебания струны на кинопленке…
Мы сознательно еще раз проследили цепочку:
явление→образ→понятие→формула→опыт,
которая лежит в основе всего физического знания. Последнее звено в этой цепи — опыт проверяет, насколько правильно мы представляем себе явление в целом на основе частичных знаний о нем.
Но эта простая схема не поможет нам ответить на вопрос «Что такое атом?» просто потому, что явление «атом» не воздействует на наши органы чувств, и они не могут дать нам никакого, даже приблизительного, «образа атома». Поэтому вначале понятие «атом» возникло чисто умозрительно, без ссылок на органы чувств и в течение двадцати веков оставалось не более чем любопытной гипотезой, которая ничем не лучше других гипотез о строении материи.
Настоящая история атома началась с приходом науки, когда люди стали полагаться не только на свои органы чувств, но научились также доверять показаниям приборов. С помощью приборов они наблюдали, как ведут себя тела при растворении, при пропускании через раствор электрического тока, при нагревании, при освещении и при многих других воздействиях. Ученые не просто наблюдали эти явления, но изучали их, то есть измеряли температуру тел, длину волны излучаемого ими света и многое другое, о чем мы уже знаем. Результаты своих измерений они записывали в виде чисел. Вот эти-то числа и заменили физикам те непосредственные ощущения, которые доставляли им ранее органы чувств. Числа — вот единственное, чему они стали доверять, когда стали изучать явления, недоступные непосредственному восприятию. Имея в руках числа, они стали находить между ними связи и записывать эти связи в виде формул.
Но люди общаются не с помощью формул, а с помощью слов, и, чтобы рассказать о новых связях в природе, они придумывают понятия, которые соответствуют формулам. Иногда эти понятия очень необычны, но люди к ним быстро привыкают, учатся правильно пользоваться ими и даже создают для себя какие-то образы, которые они связывают с новыми понятиями.
Цепочка познания переворачивается:
В истории атома эту цепочку можно легко проследить: Фраунгофер, Кирхгоф и Бунзен обнаружили, что каждый атом испускает строго определенный набор спектральных линий (явление) и каждой спектральной линии соответствует число — длина волны λ (опыт). Бальмер, Рилберг и Ритц нашли между этими числами простые связи (формула), а Бор показал, что их формулы следуют из единого принципа, который назвали квантованием (понятие). Наконец на основе этих опытов, формул и понятий возник образ — атом Бора.
Но опыты продолжались, они приносили новые числа и факты, которые уже не вмещались в рамки прежних формул, понятий и образов. И тогда возникла квантовая механика — единый принцип, из которого следовали все прежние эмпирические формулы и удачные догадки.
До сих пор мы довольно много узнали об опытах атомной физики и о понятиях, которые необходимо использовать, чтобы эти опыты объяснить. Но мы хотим большего: на этом новом, более высоком уровне знаний мы хотим создать образ атома. Для этого нам нужно, хотя бы бегло, коснуться формул квантовой механики. Это необходимо — в конце концов красота логических построений в науке много важнее, чем эффекты неожиданных ассоциаций.
Уравнение Шредингера
Предыдущие рассказы о квантовой механике почти убедили нас в том, что электрон в атоме не имеет определенного положения или хотя бы какой-нибудь орбиты, по которой он движется. Взамен этого мы пока что усвоили довольно туманную идею о том, что при движении в атоме электрон «расплывается».
Эту неопределенную идею Шредингеру удалось выразить весьма точно на однозначном языке формул. Уравнение Шредингера, как и всякий глубокий закон природы, нельзя вывести строго из более простых. Его можно только угадать. Шредингер так и сделал, и впоследствии признавался, что сам не вполне понимает, как это ему удалось. Но после того как уравнение угадано, надо еще научиться им пользоваться: надо знать, что означают все символы в уравнении и какие явления в атоме они отображают.
Уравнение Шредингера
мы уже приводили однажды и объясняли смысл входящих в него символов: ħ — постоянная Планка h, деленная на 2π; m — масса электрона, E — полная энергия электрона в атоме, a U(x) — его потенциальная энергия, которая показывает, с какой силой притягивался бы электрон к ядру, если бы он был частицей и находился от него на расстоянии x. Но нам по-прежнему неясен смысл волновой функции пси (ψ). Чтобы понять его, обратимся снова к аналогии с колеблющейся струной.
Ее уравнение
очень похоже на уравнение Шредингера. Несколько решений уравнения струны, функции U = Uk(x), изображено на рисунке. Это обычные, знакомые всем синусоиды, и смысл их очевиден: они изображают форму струны в какой-то момент времени, то есть моментальную фотографию процесса ее колебания. Форма колебаний струны зависит от числа узлов k — точек, остающихся неподвижными в процессе колебания. Поэтому существует бесконечно много решений U = Uk(x), которые различаются между собой числом узлов k.
Теперь взгляните на рисунок, где рядом с синусоидами струны Uk(x) изображены решения ψ = ψn(x) уравнения Шредингера для атома водорода. Они очень похожи. И если даже никаких реальных колебаний, подобных движениям струны, в атоме не происходит, то аналогия не становится от этого менее полезной.
Отмеченная аналогия позволяет пронумеровать решения ψn целым числом n точно так же, как решения Uk(x) нумеруются целым числом k. Более того, оказалось, что целое число n — это и есть то самое непонятное квантовое число, которым Бор нумеровал орбиты электрона в атоме. Теперь оно потеряло свой мистический оттенок: n — не что иное, как число узлов волновой функции, увеличенное на единицу (n = k + 1).
Первый постулат Бора неким «усилием воли» предписывал электронам двигаться только по тем орбитам в атоме, которые удовлетворяют квантовому условию:
Это был плодотворный, но неестественный для физики принцип, и потому он вызвал у современников сложную смесь восхищения и недовольства. Требование Шредингера значительно естественнее: как бы хитро ни двигался электрон в атоме, он должен все-таки находиться внутри атома. Поэтому ψ-функция, которая это движение «представляет», независимо от своей природы должна быть сосредоточена вблизи ядра. Это единственное граничное условие позволило вывести из уравнения Шредингера все: условия квантования Бора, энергию электрона на стационарных орбитах, смысл квантовых чисел.
В свое время эти следствия теории Шредингера покорили многих своей простотой. В уравнение Шредингера поверили и стали выяснять последнее: что представляет собой сама функция ψ.
И если функция Uk(x) изображает форму колеблющейся струны, то что изображает ψ?
Форму чего изображает ψ-функция
Это один из самых сложных вопросов квантовой механики, на который даже сам Шредингер вначале ответил неправильно. Но его ответ так удобен и так близок к истине, что мы им на первых порах воспользуемся. Вот он.
Электрон в атоме не существует как частица. Он расплывается там в некое облако. Форма и плотность этого облака определяется волновой функцией ψ(x), причем на расстоянии x от ядра плотность ρ(x) электронного облака равна квадрату этой функции:
ρn(x) = |ψn(x)|2.
Чтобы пояснить эту мысль, вспомним тот самый арбуз, с которого мы когда-то начали рассказ о квантовой механике, и попытаемся на рисунке изобразить его плотность ρ(x) в зависимости от расстояния x до центра арбуза. Очевидно, что функция ρ(x) для арбуза везде примерно постоянна, она лишь несколько возрастает к краям из-за косточек и кожуры и, наконец, резко обрывается на границе арбуза. Взглянув на наш рисунок, человек, даже ни разу не видавший арбуза, может схематически представить себе, как устроен арбуз внутри. Правда, при этом он не будет иметь ни малейшего представления о его вкусе, цвете и аромате, а также о тысяче мелких признаков, которые отличают один арбуз от другого.
Пытаясь проникнуть внутрь атома, все мы оказываемся в положении человека, который никогда в жизни арбуза не видел, но хочет представить его себе по функции ρ(x). Для атома функцию ρ(x) вычисляют из уравнения Шредингера и затем с ее помощью рисуют распределение электронного облака в атоме. Эти картины заменяют нам тот зрительный образ атома, к которому все мы бессознательно стремимся.
На страницах 208 и 209 представлены объемные изображения атома водорода, построенные по функциям ρn(x), которые вычислены из уравнения Шредингера. Это и есть тот новый образ атома, к которому мы так долго шли и к которому теперь надо привыкать. В дальнейшем построенный образ изменится лишь немного — точнее, даже не сам он, а наше отношение к нему.
Теперь все самое сложное позади, и мы можем не торопясь подвести итоги. Прежде всего — и теперь уже на новом уровне — мы вновь обратимся к вопросу: «Что такое атом?»
Атом
Вспомните модель Томсона: большой положительный шар, и в нем плавают маленькие отрицательные электроны.
В действительности все оказалось наоборот: в центре атома расположено очень маленькое положительное ядро, окруженное отрицательным облаком электрона. Форма этого облака непроизвольна — она определяется строгими законами квантовой механики. Конечно, это не шарик с резкими границами, но в целом невозбужденный атом водорода очень похож на шар (его Демокрит угадал правильно).
Однако форма возбужденных атомов уже отличается от сферической и тем больше, чем сильнее возбужден атом.
Возбуждая атом, мы затрачиваем энергию как раз на перестройку его электронного облака. Каждой форме облака соответствует своя вполне определенная энергия. Поэтому, чтобы перевести атом из одной формы в другую, мы должны затратить строго отмеренное количество энергии — квант hν, как того и требовал второй постулат Бора.
До сих пор мы сознательно говорили только об атоме водорода. По существу, это единственный атом, который физик знает сейчас во всех деталях и может представить себе его правдоподобный образ. Теперь это более или менее очевидно всем. Но в первые годы после создания квантовой механики энтузиазм победителей был так велик, что они начисто забыли о прародительнице атома — химии. «С точки зрения физика, химии не существует, — заявляли самые увлеченные из них. — Дайте нам заряд ядра, и мы оденем его шубой из электронов так, что этот построенный нами атом нельзя будет отличить от настоящего».
Начали строить — и оказалось, что без химии обойтись не удается. Споткнулись уже на литии: вместо того чтобы расположить два электрона на первой оболочке, а третий — на второй, поместили все три его электрона на одну оболочку. Но в годы подъема такие частные затруднения быстро преодолеваются.
Выход нашли почти тотчас же, как только обратились к периодической системе элементов Менделеева, которая и прежде не раз выручала и физиков и химиков. В самом деле, если химические свойства веществ зависят от электронов, которые окружают ядро, то периодичность химических свойств элементов прямо указывает на то, что электроны в атомах расположены не как попало, а группами — оболочками. Вполне логично было предположить, что число электронов в каждой из оболочек совпадает с длиной периодов таблицы Менделеева. Вольфганг Паули так и сделал.
Лишь после этого удалось создать образ не только атома водорода, но и более сложных атомов. В целом форма электронного облака в тяжелых атомах не очень сильно отличается от наших рисунков. Но рассчитать ее точно удалось лишь после работ английского ученого Дугласа Хартри и советского физика Владимира Александровича Фока. Это очень сложная задача, которая не всегда по плечу даже современным вычислительным машинам, а тем более нам сейчас.
Говоря о форме тел, мы, как правило, предполагаем, что у них есть также и размеры. Однако это не всегда верно: у бильярдного шара есть и форма и размеры, но о размерах облака говорить уже трудно, хотя форма его обычно не вызывает сомнений.
Самое неожиданное следствие новой модели атома состоит в том, что атом не имеет определенных геометрических размеров. Иными словами, границу атома можно отметить лишь условно — точно так же, как и очертания облака. Мы вынуждены принять это следствие новой модели атома, чтобы объяснить наблюдаемые свойства тел, например разнообразие геометрических форм кристаллов. Нас не должно это особенно удивлять — ведь и дома построены из кирпичей, но нам не кажется странным, что кирпичи — это не дом в миниатюре, а просто кирпичи. У тел, окружающих нас, есть цвет, запах, есть размеры, но атомы, из которых построены эти тела, не обладают ни одним из этих качеств. У них осталось только одно неизменное свойство — масса. А неизменной формы нет. Неизменны лишь законы квантовой механики, которые управляют этой формой.
Но почему атом, у которого даже нет размеров, так устойчив? Нас не должно удивлять и это: в конце концов Земля тоже не стоит на трех китах, однако уже миллионы лет, повиснув в пустоте, сохраняет свою орбиту неизменной. Секрет ее устойчивости — в движении и в неизменности динамических законов, которые этим движением управляют. В этом же причина устойчивости атомов, хотя законы, управляющие движением электронов, совсем не похожи на законы небесной механики.
(Справедливости ради следует заметить, что квантовая устойчивость значительно надежнее, чем динамическая устойчивость классической механики: разрушенный атом восстанавливает свою структуру, но орбита Земли уже никогда не станет прежней, если однажды ее нарушит внезапное вмешательство инородного космического тела.)
Атомы различных элементов разнятся между собой массой и зарядом ядра. Но по какому признаку различить два атома одного и того же элемента? Для арбузов такой вопрос неактуален: никто никогда не видел двух совершенно одинаковых арбузов. Отличить один кирпич от другого уже много сложнее, и только в том случае, если кирпичи битые, задача немного упрощается.
С атомами дело обстоит точно так же. Если их массы и заряды ядер равны, то различаться атомы могут только формой электронного облака — других свойств у них просто нет; два атома можно различить лишь в том случае, если один из них возбужден. Все невозбужденные атомы одного и того же элемента неразличимы между собой, как кирпичи из одной формы. Роль такой формы для атомов играют динамические законы квантовой механики, неизменные и одинаковые для всех атомов.
Портреты атома на рисунке отражают наш нынешний уровень знаний о нем. Это и есть тот современный образ атома, который заменил собой модели Демокрита, Томсона и Бора. Конечно, и теперешние «портреты» не следует понимать слишком буквально: это отнюдь не «фотографии атомов», подобные фотографиям колеблющейся струны. Ни простыми, ни сложными приборами мы не можем прямо измерить распределение электронной плотности внутри атома, потому что это неизбежно разрушит его (даже арбуз, чтобы проверить его качества, необходимо предварительно разрезать). И все же у нас есть много оснований верить найденной картине: с ее помощью мы можем последовательно объяснить все опыты, которые привели нас к нынешнему образу атома.
Теперь нас не должно удивлять, что α-частицы в опытах Резерфорда беспрепятственно пролетали сквозь миллиарды атомов, как через пустоту. Ведь, пронизывая кометные хвосты, Земля тоже никогда не отклоняется от своей орбиты. Понятен должен быть нам и механизм появления спектральных линий: просто атом скачком изменяет форму распределения электронного облака, излучая квант энергии. Мы должны теперь понять и расщепление частоты спектральных линий в электрическом поле (эффект Штарка) и в магнитном поле (эффект Зеемана): электронное облако заряжено, и его различные формы под воздействием полей немного изменяются, а вместе с ними изменяется и энергия кванта, которую необходимо затратить, чтобы перевести облако из одной формы в другую, и частота ν спектральной линии, которая этому кванту соответствует. Эти простые качественные рассуждения можно подтвердить строгими расчетами и доказать, что они совпадают с экспериментальными фактами.
Но сейчас нам важнее понять другое: а почему мы уверены, что созданный нами образ атома соответствует истине?
Квантовая истина
Прежде всего, о какой истине пойдет речь? И что понимают под истиной в квантовой механике? Если бы речь шла об арбузе, все было бы просто. Например, мы бы сразу сказали, что знания одного только распределения плотности нам недостаточно — это еще далеко не вся истина об арбузе. Лишь когда мы увидим, потрогаем, съедим его, наконец, мы сможем сказать, что он собой на самом деле представляет. Но даже такое, по мнению большинства людей, полное знание для ученых весьма предварительно. Они начнут рассматривать арбуз под микроскопом и скажут, что он состоит из клеток. Немного позже они заявят, что клетки построены из молекул, потом — что молекулы из атомов… Круг замкнулся. Чтобы узнать до конца арбуз, мы снова должны ответить на вопрос: «Что такое атом?»
В действительности, дело обстоит не так плохо: понятие «арбуз» сформировалось за много веков до появления всякой науки и не очень зависит от прошлых и будущих ее достижений, поскольку опирается только на наши ощущения. Это понятие может измениться лишь в том случае, если вдруг у всех людей одновременно появится еще одно — шестое чувство. Полагая это нереальным, мы с легким сердцем и говорим, что знаем об арбузе всю истину, если подвергли его испытанию своих пяти чувств. (Вспомните, как вы сами покупаете арбуз: сначала выбираете издали один из них, потом берете его в руки, иногда подносите к уху, чтобы услышать легкий треск и, наконец, надрезав его, пробуете на вкус.)
Можно ли с такой же меркой подходить к понятию «атом»? Ведь число опытов, на основе которых мы строим образ и понятие «атом», безгранично и в принципе каждый из них добавляет к нашим знаниям нечто новое. Мы не можем остановиться на этом пути и сказать: «Хватит с нас опытов, мы уже построили для себя образ атома, и дальнейшие опыты могут его только испортить». Наоборот, мы радуемся каждому новому опыту и особенно тем из них, которые не укладываются в рамки нами же придуманных образов. Именно такие опыты помогли нам отказаться от атомов — твердых шариков и построить нашу более совершенную модель. Почему же мы теперь уверены, что нынешний образ атома соответствует истине?
Надо признаться, что физики в этом вовсе не уверены. Зато они честно и спокойно могут сказать: «За последние сто лет не сделано ни одного опыта, который противоречил бы созданной нами картине. Поэтому лучше говорить не об ее истинности, а об ее плодотворности — о том, насколько она помогает нам объяснить и предсказывать особенности атомных явлений».
И здесь выясняется поразительная вещь: нам не так уж необходимо знать, «как выглядит атом на самом деле». Нам достаточно изучить уравнения квантовой механики и правила обращения с ними. После этого мы можем предсказать все: как изменится цвет тела при нагревании, какие спектральные линии оно при этом испустит и как изменится длина их волны, если поместить тело в электрическое или магнитное поле. Мы можем предсказать форму кристаллов, их теплоемкость и проводимость. Мы можем, наконец, построить атомную электростанцию и атомный ледокол, и они будут исправно работать. И все это без малейших ссылок на «истинную» форму атома.
На этом основании многие (с легкой руки Гейзенберга) предлагают обходиться в квантовой механике вообще без наглядных образов. Целесообразность такой крайности можно оспаривать, но отрицать ее возможность безоговорочно нельзя. На вопрос «Что такое атом?» сторонники крайних мер отвечают лаконично: «Атом есть система дифференциальных уравнений». К сожалению, в этой шутке много правды. По сравнению с целым арбузом «атом арбуза» очень беден свойствами. Однако свойства эти противоречивы, и слить их воедино без насилий над логикой и здравым смыслом можно пока только в уравнениях квантовой механики.
Квантовая механика — это математическая схема, которая позволяет вычислять физически измеримые характеристики атомных явлений: уровни энергии атомов, интенсивность и частоту спектральных линий, их расщепление в электрическом и магнитном полях и еще многое другое.
Если бы задача физики заключалась только в этом, то построение механики атома можно было бы считать законченным. Однако физика призвана дать нам нечто большее — рациональную картину мира. Выполнить столь обширную программу с одними формулами и числами нельзя — необходимо найти образы и сформулировать понятия, им соответствующие. Особенно интересно это для всех нефизиков, которые не знают и не понимают формул квантовой механики. Для них язык образов и понятий — единственный способ проникнуть в глубь атома. Со времен Демокрита мы продвинулись на этом пути довольно далеко и сейчас нарисовали для себя более или менее удовлетворительную картину атома. Однако до совершенства ей не хватает еще нескольких штрихов.
В самом деле, мы знаем теперь, что дуализм «волна — частица» — главное свойство всех атомных явлений. Но ведь сам по себе электрон все-таки частица? А мы сейчас ударились в другую крайность и утверждаем, что электрон в атоме — это некое заряженное облако. Для понимания большинства опытов такая картина удобна, однако с ее помощью нельзя понять, например, явление фотоэффекта. Действительно, никто никогда не видел, чтобы из атома вылетал кусок электронного облака — всегда вылетает единый и неделимый электрон. Как же происходит мгновенное собирание атомных облаков разной формы всегда в одну и ту же неделимую частицу?
Чтобы ответить на эти вопросы, нам придется ввести новое понятие — вероятность. Оно настолько фундаментально, что без него современной квантовой механики не существует вообще. Теперь мы им и займемся.
Вокруг кванта
Жизнь…
Роджер Иозеф Боскович (1711–1787) сейчас известен только узкому кругу специалистов, но в начале прошлого века он был знаменит, а его теория атома оказала влияние даже на мировоззрение таких людей, как Фарадей и Максвелл.
Боскович родился и провел детские годы в Югославии, в Дубровнике (в то время — Рагуса). Он был восьмым ребенком из девяти и самым младшим из шести сыновей в семье крупных торговцев. То было время, когда любая деятельность людей получала смысл и признание лишь в том случае, если она была освящена церковью или связана с нею. Уже с 8 лет Боскович учился в местном иезуитском колледже, а в 14 лет отправился на родину матери, в Рим, и после двух лет искуса был принят в Collegium Romanum. Там он отличился в математике, физике и астрономии и в 1736 году опубликовал первую научную работу о солнечном экваторе и периоде вращения Солнца. В 29 лет он стал преподавателем, а в 33 года — священником и членом общества Иисуса. В продолжение 14 лет он преподает физику и математику, изучает аберрацию света и форму Земли, создает карту Ватикана.
Боскович был не только ученый, но и поэт. (В 1779 году он посвятил поэму Людовику XVI, в которой предсказывал ему царствование без солнечных затмений.) Яркие качества его богатой натуры в сочетании с блестящим интеллектом открыли ему доступ в высшие духовные, академические и дипломатические круги Европы.
В 1757 году он едет в Вену в составе посольства и там за одиннадцать месяцев пишет книгу «Теория натуральной философии», которую он обдумывал в течение двенадцати лет. После возвращения из Вены он отправился в четырехлетнее путешествие в Париж, Лондон, Константинополь, затем читал лекции, работал в обсерватории в Милане, снискал ненависть коллег независимостью взглядов и в 1772 году оказался в Венеции без средств к жизни. Друзья выхлопотали ему место в Париже, где он прожил десять лет и лишь в 1783 году возвратился в Италию издавать свои труды. В конце 1786 года он почувствовал признаки умственного расстройства, которое перешло в патологическую меланхолию. После попытки к самоубийству он сошел с ума и 13 февраля 1787 года избавился наконец от всех сложностей своей жизни.
…И атом Босковича
Из тех немногих, кто в XVIII веке верил в атомы, Боскович — единственный, кто не верил в атомы — твердые шарики. Поэтому его воззрения ближе к нам, чем все атомные теории XIX века.
Свое недоверие к несжимаемым атомам-шарикам Боскович обосновывал тем, что с помощью таких атомов нельзя объяснить кристаллическую структуру тел и их упругость, плавление твердых веществ, испарение жидкостей, а тем более химические реакции между веществами, построенными из таких круглых, твердых и непроницаемых шаров.
Боскович представлял себе атом, как центр сил, которые меняются в зависимости от расстояния до этого центра. Близко к центру силы отталкивающие, что соответствует отталкиванию атомов при тесном сближении или при их столкновении. При удалении от центра отталкивающая сила сначала уменьшается, затем обращается в нуль и, наконец, становится притягивающей — как раз в этот момент, говорил Боскович, образуются все жидкие и твердые тела. Но если мы еще удалимся от центра сил, то силы вновь станут отталкивающими — в этот момент жидкие тела испаряются. И совсем далеко от атома силы всегда притягивающие, как того и требует закон всемирного тяготения Ньютона.
Таким образом, каждый атом Босковича «простирается вплоть до границ солнечной системы», а поскольку центры сил нельзя ни уничтожить, ни создать, то его атомы вечны, так же как и атомы Демокрита.
Атом Босковича значительно ближе к современному атому, чем атом Демокрита. Например, как и современный атом, он не имеет определенных геометрических размеров. Зато с его помощью можно понять разнообразие форм кристаллов и всевозможные химические превращения, в которых эти атомы участвуют.
Взгляните на рисунок, взятый из книги Босковича. Он изображает закон изменения сил, как его представлял себе он сам. Конечно, атом Босковича — это умозрительная схема, которая не опирается ни на опыт, ни на математику, а лишь на здравый смысл и внимательные наблюдения над природой. Сам Боскович писал: «Существуют, однако, определенные вещи, связанные с законом сил, относительно которых все мы невежды. Они касаются находящихся между ними дуг и других вещей того же рода. Все это, однако, далеко превосходит человеческое разумение, и только Он один, кто создал вселенную, имел перед своими глазами целое».
На рисунке рядом нарисован закон изменения сил, действующих между двумя атомами водорода. Можно только удивляться, насколько он похож на картинку Босковича. Но этот закон вычислен из уравнений квантовой механики без всякого произвола и ссылок на божественное провидение. С помощью этого закона сил мы можем предсказать спектр молекулы водорода, вычислить заранее энергию, которую необходимо затратить, чтобы оторвать один атом водорода от другого, мы можем предвидеть, что произойдет, если смешать водород, например, с хлором, и что изменится, если облучать эту смесь ультрафиолетовыми лучами.
Квантовая механика позволяет вычислить закон изменения сил между двумя произвольными атомами. В принципе она в состоянии рассчитать форму кристаллов. Она даже может предсказать, цвет химических соединений. Конечно, все это доступно только тем, кто владеет довольно сложной математикой атомной физики. Однако понять многие особенности строения и свойства веществ может каждый, кто хоть немного знаком с ее образами.
Глава десятая
Игра в «орел-решку» ♦ Стрельба в тире ♦ Дифракция электронов ♦ Волны вероятности ♦ Из чего состоит электронная волна? ♦ Атом ♦ Вероятность и спектры атомов ♦ Причинность и случайность, вероятность и достоверность
Представьте себе, что где-то в поезде между Новосибирском и Красноярском вы познакомились с хорошим человеком. Теперь вообразите, что год спустя вы случайно встречаете его в Москве у кинотеатра «Россия». Как бы вы ни были рады встрече, прежде всего вы удивитесь, потому что знаете по опыту, насколько такое событие маловероятно.
Мы постоянно употребляем слова «вероятно», «вероятнее всего», «по всей вероятности», «невероятно», не отдавая себе отчета, насколько строго определены понятия, им соответствующие. В науке такое положение недопустимо, поэтому там понятие «вероятность» имеет смысл лишь в том случае, если мы можем ее вычислить.
Это не всегда возможно. Например, нельзя предсказать вероятность случайной встречи с вашим случайным знакомым в 6 часов вечера 23 октября 1975 года на Главпочтамте города Липецка, хотя заведомо ясно, что эта вероятность не равна нулю. Но поступки людей не случайны, и применять к ним теорию вероятностей нельзя. Поэтому во всех учебниках с завидным постоянством объясняют законы случая на примере бросания монеты.
Игра в «орел-решку»
Прежде всего заметим: если событие имеет несколько исходов, то полная вероятность произойти хоть какому-то из них равна единице. Поэтому слова «событие произойдет с вероятностью единица» означают, что оно произойдет наверняка.
Отсюда ясно также, что вероятность какого-то одного исхода всегда меньше единицы. В примере с монетой случайное событие — бросание монеты — имеет только два исхода: она может упасть либо гербом вверх, либо гербом вниз. (Мы исключаем неправдоподобно редкие случаи, когда монета при падении останется стоять на ребре.) Если монета сделана без хитростей, то логично предположить, что оба исхода бросания равновероятны. Отсюда сразу же следует, что вероятность выпадания, скажем, герба равна ½.
Столь же легко вычислить вероятность выпадания, скажем, 3 очков при бросании игральной кости: очевидно, она равна 1/6.
Число аналогичных примеров каждый легко умножит сам, но все они очень похожи.
Во-первых, каждое последующее событие (бросание монеты) не зависит от предыдущего.
Во-вторых, они строго случайны, то есть мы не знаем (или не можем учесть) всех причин, которые приводят к тому или иному исходу события.
Последнее особенно важно. В самом деле, монета не атом, и ее движение подчиняется хорошо известным законам классической механики. Используя их, мы бы могли заранее предвидеть все детали движения монеты и предсказать, как она упадет: гербом вверх или вниз. Нам под силу даже нарисовать ее траекторию движения. Конечно, это очень трудно: нужно принять во внимание сопротивление воздуха, форму монеты, упругость пола, на который она упадет, и еще много других важных мелочей. И — самое главное — необходимо точно задать начальное положение и импульс монеты.
Однако учесть все мыслимые факторы, влияющие на исход событий, не всегда возможно. Например, в случае с монетой мы никогда не знаем достаточно точно ее начального положения и скорости. А всякое, даже очень небольшое, их нарушение может изменить результат бросания на противоположный. И тогда уже нельзя быть уверенным, что при этом бросании монета упадет гербом вверх. Можно только сказать: вероятность выпадания герба при любом бросании равна ½.
Простые примеры, которые мы привели, не объясняют пока, почему так важно понятие вероятности в квантовой механике. Но прежде чем объяснить это, познакомимся хотя бы бегло с основными законами теории вероятностей. Законы случая (несмотря на странное сочетание двух этих слов) такие же строгие, как и всякие другие законы математики. Однако они имеют некоторые непривычные особенности и вполне определенную область применимости.
Например, хотя мы и знаем, что вероятность выпадания герба при бросании монеты равна ½, однако предсказать исход одного отдельно взятого бросания мы не в состоянии. Тем не менее мы легко можем проверить, что при большом числе бросаний герб выпадет примерно в половине случаев, и закон этот выполняется тем точнее, чем больше испытаний мы проведем. В этом и состоит главная особенность закона случайных событий: понятие вероятности применимо к отдельному событию, и мы можем вычислить заранее число, которое этому понятию соответствует. Однако измерить это число можно только при многократном повторении однотипных событий.
Очень важно, чтобы события были однотипными, то есть полностью неразличимыми, поскольку только тогда измеренное число — вероятность — можно использовать для оценки каждого отдельного события.
Непривычные особенности законов случая имеют естественное объяснение. В самом деле, бросание монеты — очень непростой процесс. Мы не хотим или не умеем изучать его во всей сложности. Поэтому мы намеренно закрываем глаза на всю его сложность, отказываемся следить за траекторией монеты и хотим знать только конечный результат испытания. Такое пренебрежение к деталям процесса не проходит даром — теперь мы можем достоверно предсказать только усредненный результат многочисленных однотипных испытаний, а для каждого отдельного события мы в состоянии указать лишь вероятный его исход.
Широко бытует заблуждение, что вероятностное описание движения менее полно, чем строго причинное, классическое, с его понятием траектории. С точки зрения классической механики это действительно так. Однако если мы откажемся от части ее жестких требований (например, от знания начальных координат и импульсов), тогда классическое описание бесполезно. На смену ему приходит вероятностное, и в новых условиях оно будет исчерпывающим, поскольку сообщает нам все сведения о системе, которые мы вообще можем узнать о ней с помощью опыта.
Стрельба в тире
При игре в «орел-решку» мы намеренно не хотим знать начального положения и скорости монеты и целиком полагаемся на волю случая. Несколько другие желания одолевают нас в тире: там мы всегда стремимся попасть в центр мишени. Но, несмотря на это стремление (довольно сильное), мы никогда заранее не знаем, в какое место мишени попадет каждая из пуль. Попадания группируются в довольно правильный овал, который принято называть «эллипсом рассеяния». От чего он зависит?
Очевидно, чтобы все пули, вылетающие из винтовки, попадали всегда в одну и ту же точку мишени, необходимо, чтобы в момент вылета все они имели одни и те же начальные координаты x и скорости v (или импульсы p). А это возможно лишь в том случае, если вы целитесь безошибочно и, кроме того, заряд пороха во всех патронах всегда в точности одинаков.
Ни то, ни другое обычно недостижимо. Поэтому распределение отверстий от пуль на мишени всегда подчиняется законам случая, и можно говорить лишь о вероятности попадания в «десятку» или «девятку» мишени, но никогда нельзя быть уверенным в этом заранее.
Как и при игре в «орел-решку», эту вероятность можно измерить. Допустим, мы произвели 100 выстрелов и 40 раз попали в «десятку», 30 раз — в «девятку», 15 — в «восьмерку» и так далее — до нуля. Тогда вероятности попадания в «десятку», «девятку», «восьмерку» и т. д. соответственно равны:
W(10) = 40/100 = 0,4; W(9) = 0,3; W(8) = 0,15 и т. д.
Можно даже построить диаграмму, которая как бы показывает внутреннюю структуру эллипса рассеяния.
Если мы возьмем теперь такую же мишень и вновь 100 раз по ней выстрелим, то расположение отверстий на ней будет совсем другим, чем на первой мишени. Но число попаданий в «десятку», «девятку» и т. д. останется примерно тем же самым, а следовательно, и диаграмма эллипса рассеяния также останется без изменения.
Конечно, для разных стрелков диаграммы различны: для опытного стрелка они уже, для неопытного — шире. Но для каждого отдельного стрелка она остается неизменной, так что опытный тренер по одному виду мишени может установить, кому из его учеников она принадлежит.
Из приведенных простых примеров следует, что «законы случая» — это не пустая игра слов. Конечно, каждая отдельно взятая пуля попадет в случайную точку мишени, которую нельзя предсказать заранее. Однако при большом числе выстрелов попадания образуют настолько закономерную картину, что мы воспринимаем ее как достоверную и совершенно забываем о вероятности, лежащей в ее основе.
Дифракция электронов
Простой пример со стрельбой напоминает опыты квантовой механики значительно больше, чем это может показаться на первый взгляд. Чтобы убедиться в этом, заменим ружье «электронной пушкой», мишень — фотопластинкой, а между ними поместим тонкую металлическую фольгу.
«Электронная пушка» не шутка, а научный термин, который обозначает устройство для получения пучка электронов примерно такое же, как в телевизионной трубке (или трубке Крукса). Из этого пучка с помощью диафрагм и фокусирующих линз мы можем выделить очень узкий электронный луч, в котором все электроны движутся с одинаковой скоростью.
Теперь направим этот луч через металлическую фольгу на фотопластинку и затем проявим ее. Какое изображение мы на ней увидим? Точку? Эллипс рассеяния, как при стрельбе в тире? Или что-нибудь еще? Ответ нам давно известен: на фотопластинке мы увидим дифракционные кольца, подобные тем, которые изображены на предыдущей странице. Мы можем теперь объяснить даже причину их появления.
В самом деле, мы много раз повторяли, что электрон — это не только частица, но также и волна. И если до сих пор мы еще не привыкли к этому факту, то, во-всяком случае, должны были его запомнить. Поэтому сама по себе дифракция электронов не должна нас теперь удивлять: явление дифракции возникает всегда, если через вещество проходит волна. Вопрос не в этом. Волна чего проходит вместе с электроном через фольгу?
По морю гуляют морские волны — они состоят из воды. Космос пронизывают электромагнитные волны — они представляют собой колебания электрического и магнитного полей. Из чего состоит волна электрона, если сам он неделим и не имеет внутренней структуры?
Прежде чем ответить на эти вопросы, поставим опыт с пучком электронов немного по-другому. Станем выпускать электроны по одному (как пули из винтовки) и каждый раз менять фотопластинку за фольгой. После проявления всех фотопластинок мы обнаружим на каждой из них точку — след от упавшего электрона. (Уже один этот факт, если бы не было других доказательств, легко убеждает нас в том, что электрон — все-таки частица.) На первый взгляд черные точки на пластинках расположены совершенно беспорядочно, и, конечно, ни одна из точек ничем не напоминает дифракционную картину. Но если мы сложим все пластинки в одну стопку и посмотрим ее на просвет, то с удивлением обнаружим все те же дифракционные кольца. Стало быть, черные следы от электронов расположены на пластинках не так уж беспорядочно, как может показаться вначале.
Этот простой опыт настолько прост, что может даже обидеть некоторых читателей своей тривиальностью. Однако в свое время именно он убедил последних противников квантовой механики. Конечно, вовсе не обязательно для каждого электрона брать отдельную пластинку, вполне достаточно одной пластинки-мишени, только по-прежнему надо пускать электроны-пули поодиночке. Как и прежде, мы не можем заранее предсказать, в какую точку пластинки попадет каждый следующий электрон. Это случайное событие. Однако если мы выпустим достаточно много электронов, то получим закономерную дифракционную картину.
С такими явлениями мы уже сталкивались при игре в «орел-решку», при бросании кости, при стрельбе в тире. Отмеченная аналогия приводит к естественному предположению: процесс рассеяния электронов подчиняется законам теории вероятностей. При дальнейшем размышлении и после знакомства с идеями Макса Борна эта догадка сменяется уверенностью.
Волны вероятности
Макс Борн (1882–1970) преподавал физику в признанном центре немецкой науки — в Геттингене. Он пристально следил за развитием теории атома и был одним из первых, кто придал квантовым идеям Гейзенберга строгую математическую форму. В начале 1927 года он заинтересовался опытами по дифракции электронов.
Само по себе это явление после работ де Бройля уже не казалось удивительным. Любой физик, взглянув на дифракционную картину, мог бы теперь объяснить ее появление с помощью гипотезы о «волнах материи». Более того, по формуле де Бройля λ = h/mv он мог вычислить длину этих «волн материи» и на опыте убедиться в правильности своих вычислений. Однако по-прежнему никто не мог объяснить, что он разумеет под словами «волны материи». Пульсацию электрона-шарика? Колебания какого-то эфира? Или вибрацию чего-либо еще более гипотетического? То есть насколько материальны сами «волны материи».
Летом 1927 года Макс Борн предположил: «волны материи» — это просто «волны вероятности», которые описывают вероятное поведение отдельного электрона, например вероятность его попадания в определенную точку фотопластинки.
Всякая новая и глубокая идея не имеет логических оснований, хотя нестрогие аналогии, которые к ней привели, можно проследить почти всегда. Поэтому вместо того чтобы доказывать правоту Борна (это невозможно), попытаемся почувствовать естественность его гипотезы. Обратимся снова к игре в «орел-решку» и вспомним причины, которые вынудили нас тогда применить теорию вероятностей. Их три:
полная независимость отдельных бросаний монеты;
полная неразличимость отдельных бросаний;
случайность исхода каждого отдельного бросания, которая проистекает от полного незнания начальных условий каждого опыта, то есть от неопределенности начальной координаты и импульса монеты.
Все эти три условия выполняются в атомных явлениях и, в частности, в опытах по рассеянию электронов. В самом деле:
электроны ведь все-таки частицы, и потому каждый из них рассеивается независимо от других;
кроме того, электроны так бедны свойствами (заряд, масса, спин — и все), что в квантовой механике они неразличимы, а вместе с тем неразличимы и отдельные акты рассеяния;
и наконец, начальные значения координат и импульсов электронов нельзя определить даже в принципе — это запрещено соотношением неопределенностей Гейзенберга δx · δp ≥ ½h.
В таких условиях бессмысленно искать траекторию каждого электрона. Вместо этого мы должны научиться вычислять вероятность ρ(x) попадания электронов в определенное место x фотопластинки (или, как принято говорить в физике, вычислять функцию распределения ρ(x)).
При игре в «орел-решку» это очень просто: даже без вычислений ясно, что вероятность выпадания «орла» равна ½. В квантовой механике дело немного осложняется. Чтобы найти функцию ρ(x), описывающую распределение электронов на фотопластинке, необходимо решить уравнение Шредингера.
Макс Борн утверждал: вероятность ρ(х) найти электрон в точке x равна квадрату волновой функции ψ(x):
ρ(x) = |ψ(x)|2.
Утверждение Борна легко проверить. В самом деле, разделим дифракционную картину на концентрические круги и пронумеруем их, как мишень в тире. Затем сосчитаем число Nk электронов, попавших в каждое кольцо с радиусом xk, и поделим эти числа на общее число электронов N, попавших на пластинку. Тогда, как и в случае стрелковой мишени, мы получим набор чисел ρ(xk) = Nk/N, которые равны вероятности обнаружить электрон на расстоянии xk от центра мишени. Теперь не трудно нарисовать распределение электронов по пластинке и проследить, как меняется их число при удалении от центра дифракционной картины.
График функции ρ(x) выглядит сложнее, чем диаграмма эллипса рассеяния при стрельбе в тире. Но если вид эллипса нам не под силу предсказать, то функцию ρ(x) мы можем вычислить заранее. Ее вид однозначно определяется законами квантовой механики: несмотря на свою необычность, они все-таки существуют, чего нельзя сказать с уверенностью о законах поведения человека, от которого зависит эллипс рассеяния.
Из чего состоит электронная волна?
Когда мы стоим на берегу моря, то у нас не возникает сомнений, что на берег набегают волны, а не что-либо другое. И нас не удивляет тот достоверный факт, что все волны состоят из огромного числа частиц — молекул.
Волны вероятности — такая же реальность, как и морские волны. И нас не должно смущать то обстоятельство, что волны эти построены из большого числа отдельных, независимых и случайных событий.
Морской воде присущи и свойства волны, и свойства частиц одновременно. Это нам кажется естественным. И если мы удивлены, обнаружив такие же свойства у вероятности, то наше недоумение, по крайней мере, нелогично.
Когда дует ветер, то в море из беспорядочного скопления отдельных молекул возникают правильные ряды волн. Точно так же, когда мы рассеиваем пучок электронов, то отдельные случайные события — пути электронов — закономерно группируются в единую волну вероятности.
Чтобы убедиться в реальности морских волн, не обязательно попадать в кораблекрушение, но хотя бы поглядеть на море желательно. Чтобы обнаружить волны вероятности, нужны сложные приборы и специальные опыты. Конечно, эти опыты сложнее, чем простой взгляд с прибрежного утеса к горизонту, но ведь нельзя же только на этом основании отрицать само существование вероятностных волн.
Полистав толстые учебники гидродинамики, можно убедиться, что пути молекул, из которых состоит морская волна, ничем не напоминают волновых движений: молекулы движутся по кругам и эллипсам, вверх и вниз и вовсе не участвуют в поступательном движении волны. Они составляют волну, но не следуют за ее движением. Форму этой волны определяют законы гидродинамики.
Точно так же движение отдельных электронов в атоме вовсе не похоже на те колебания, которым мы уподобили его раньше. Но в целом ненаблюдаемые пути электронов принадлежат единому наблюдаемому ансамблю — волне вероятности. Форму этой волны диктуют законы квантовой механики.
Аналогии такого рода можно продолжать и дальше, но сейчас важнее уяснить другое. Как теперь надо понимать слова «электрон — это волна»? Ведь если это не материальная волна, а волна вероятности, то ее даже нельзя обнаружить в опытах с отдельным электроном.
Иногда волновой характер квантовомеханических явлений трактуют как результат некоего мистического взаимодействия большого числа частиц между собой. Это объяснение мотивируют как раз тем, что волновые закономерности атомных явлений вообще нельзя обнаружить, если проводить опыты с отдельно взятой атомной частицей. Ошибка таких рассуждений объясняется элементарным непониманием природы вероятностных законов: вычислить волновую функцию ψ(x) и распределение вероятностей ρ(x) можно для отдельной частицы, но измерить распределение ρ(x) можно только при многократном повторении однотипных испытаний с одинаковыми частицами.
И все же вероятность — это характеристика отдельного события. А потому каждому электрону присущи волновые свойства, хотя мы обнаружить их можем только в пучке электронов. (Точно так же при игре в «орел-решку» вероятность ½ выпадения «орла» — это свойство каждого события, но измерить эту вероятность можно лишь при большом числе испытаний.)
Без понятия вероятности современную квантовую механику представить очень трудно. Пожалуй, это главное, чем она отличается от механики классической. Конечно, и классическая физика постоянно использует теорию вероятностей. Например, в кинетической теории газов. Однако там еще можно успокаивать себя в надежде обойтись без теории вероятностей, если удастся научиться решать одновременно очень много уравнений движения молекул газа. Квантовая механика не оставляет такой надежды, ее уравнения принципиально позволяют вычислять только вероятности событий. Тем не менее для атомных явлений это описание будет настолько же полным, насколько исчерпывающе описание классического движения с помощью понятия траектории.
Все предыдущие примеры и рассуждения помогают нам понять, что представляет собой электрон вне атома и почему эта частица наделена также свойствами волны. Как же эти свойства — волны и частицы — можно совместить без логических противоречий внутри атома?
Атом
Если вы заметили, мы нигде не пытались определить форму атома непосредственно на опыте. Мы ее вычислили из волнового уравнения Шредингера. Мы в нее поверили, поскольку то же самое уравнение позволяет правильно предсказать самые тонкие особенности наблюдаемых спектров атомов. Сейчас эта форма атомов общепризнана, и в предыдущей главе мы даже нарисовали несколько таких форм.
Однако если понимать приведенные рисунки атома буквально, то приходится представлять себе электрон как некое заряженное облако, форма которого зависит от степени возбуждения атома. По многим причинам такая картина неудовлетворительна.
Прежде всего электрон — все-таки частица, и убедиться в этом очень просто, наблюдая, например, его следы в камере Вильсона. Кроме того, мы теперь достаточно хорошо знаем, что никаких реальных колебаний и материальных волн в атоме нет. Реальны только волны вероятности. Как это новое знание изменит наши прежние представления об атоме?
Поставим мысленный опыт по определению формы атома водорода. Возьмем, как и прежде, «электронную пушку», но теперь будем обстреливать из нее не фольгу, а отдельно взятый атом водорода. Что мы при этом должны увидеть?
Большинство электронов «прошьет» атом водорода, как снаряд рыхлое облако, не свернув с пути. Но, наконец, один из них, столкнувшись с электроном атома, вырвет его оттуда и при этом сам изменит направление своего движения. Теперь позади атома мы увидим не один, а два электрона: один — из «пушки», другой — из атома. Допустим, что мы так точно измерили их пути, что можем восстановить точку их встречи в атоме. Можем ли мы на этом основании утверждать, что электрон в атоме водорода находился именно в этой точке?
Нет, не можем. Мы не в состоянии даже проверить свое допущение, поскольку атома водорода больше не существует — наше измерение его разрушило.
Этой беде, однако, легко помочь: все атомы водорода неразличимы, и, чтобы повторить опыт, можно взять любой из них. Повторный опыт нас разочарует: мы обнаружим электрон в атоме совсем не там, где ожидали найти его на основании первого измерения.
Третье, пятое, десятое измерения только укрепят нашу уверенность в том, что электрон в атоме не имеет определенного положения: каждый раз мы будем его находить в новом месте. Но если мы возьмем очень много атомов, проведем очень много измерений и при этом всякий раз будем отмечать точкой место электрона в атоме, найденное в каждом отдельном опыте, то в конце концов мы с удивлением обнаружим, что точки эти расположены не беспорядочно, а группируются в уже знакомые нам фигуры, которые мы раньше вычислили из уравнения Шредингера.
Из опытов по дифракции электронов мы уже знаем, как объяснить этот факт. В самом деле, тогда мы не знали, в какое место фотопластинки попадет электрон, теперь мы не знаем, в каком месте атома мы его найдем. Как и прежде, сейчас мы можем указать только вероятность обнаружения электрона в каком-то определенном месте атома.
В одной точке атома эта вероятность больше, в другой — меньше, но в целом распределение вероятностей образует закономерный силуэт, который мы и принимаем за форму атома.
Ничего другого нам не остается. Можно, конечно, возразить, что это не отдельный атом, а некий обобщенный образ многих атомов. Но это будет слабый аргумент: ведь все атомы в одном и том же квантовом состоянии неразличимы между собой. Поэтому точечные картинки, полученные в опыте по рассеянию электронов на многих, но одинаковых атомах, определяют одновременно форму и обобщенного атома, и одного отдельно взятого атома.
Здесь, как и всегда, где работают законы случая, необходимо учитывать их особенности. Для каждого отдельного атома функция ρ(x) указывает лишь распределение вероятностей найти электрон в точке x атома. Именно в этом смысле можно говорить о «вероятной форме отдельного атома». Но картина эта достоверна, поскольку она совершенно однозначна для любой совокупности одинаковых атомов.
Наша теперешняя картина атома бесконечно далека от представлений Демокрита. В сущности, от его представлений почти ничего не осталось.
Но плодотворные заблуждения всегда лучше, чем бесплодная непогрешимость. Не будь их, Колумб никогда бы не открыл Америку.
Сейчас мы достигли предела, который вообще доступен тем, кто пытается проникнуть в глубь атома без формул и уравнений. Тем не менее образ, который мы для себя сформировали, верен во всех деталях. Не пользуясь «математической кухней» квантовой механики, мы не сможем предсказать ни одного атомного явления, однако объяснить кое-что мы теперь в состоянии, если будем использовать новый образ атома грамотно и помнить о его происхождении.
Вероятность и спектры атомов
Не только форма атома, но и все процессы в нем подчиняются законам теории вероятностей. Имея дело с отдельным атомом, никогда нельзя сказать наверняка, где находится его электрон, куда он попадет в следующий момент и что произойдет при этом с самим атомом.
Однако уравнения квантовой механики всегда позволяют вычислить вероятности всех этих процессов. Вероятностные предсказания можно потом проверить и убедиться, что они достоверны, если провести достаточно много одинаковых испытаний. Даже такие люди, как Резерфорд, далеко не сразу поняли эту особенность атомных процессов.
Он был первым читателем тогда еще рукописной статьи Бора о строении атомов. Ознакомившись с ней, Резерфорд с присущей ему прямотой и резкостью спросил Бора: «А откуда электрон, сидящий на n-й орбите, знает, куда ему надо прыгнуть: на k-ю или на j-ю орбиту?» Тогда, в 1913 году, Бор ничего не смог ответить Резерфорду. И лишь теперь, после работы трех поколений физиков, вопрос прояснился до такой степени, что даже мы в состоянии в нем разобраться.
Электрон вовсе ничего «не знает» заранее — он лишь подчиняется законам квантовой механики. Согласно этим законам для электрона в любом квантовом состоянии (например, в состоянии с квантовым числом n) всегда существует строго определенная вероятность перейти в любое другое состояние (например, в состояние k). Как всегда, вероятность Wnk перехода n→k — это число, значение которого зависит от выбора пары квантовых состояний n и k. И если мы переберем всевозможные комбинации номеров n и k, то получим квадратную таблицу чисел Wnk. Мы уже знаем, что такая таблица называется матрицей. И матрица эта представляет внутреннее состояние атома.
Только теперь мы можем оценить интуицию Гейзенберга, который, ничего не зная о законах вероятности, управляющих квантовыми процессами в атоме, все-таки правильно почувствовал их особенности и ввел свои матрицы. {Xnk} и {Pnk}. Как выяснилось немного позже, через эти матрицы матрица вероятности Wnk выражается довольно просто. А матрицы Гейзенберга, в свою очередь, легко вычислить, решив уравнение Шредингера.
Рассуждения, которые мы только что проследили, несмотря на свою простоту, весьма плодотворны. Например, с их помощью довольно легко можно объяснить, почему в желтом дублете D-линии натрия — линия D2 в два раза интенсивнее, чем линия D1.
Более того, последовательно используя уравнения квантовой механики, можно выяснить и более тонкие особенности строения этих линий, например законы изменения интенсивности внутри их самих. Но все эти радости доступны только специалистам.
Причинность и случайность, вероятность и достоверность
Вероятностная интерпретация квантовой механики очень многим пришлась не по душе и вызвала многочисленные попытки возврата к прежней, классической схеме описания. Это стремление во что бы то ни стало использовать старые знания в новых условиях по-человечески понятно, но ничем не оправдано. Оно напоминает желание отставного солдата осмыслить все многообразие жизни с позиций строевого устава. Безусловно, его возмутит беспорядок на танцплощадке, и довольно трудно будет объяснить ему, что там действуют несколько иные законы, чем на армейском плацу.
Еще не так давно недобросовестные интерпретаторы квантовой механики с подозрительным рвением пытались отменить ее только на том основании, что она не укладывалась в рамки ими же придуманных схем. Они возмущались «свободой воли», которая якобы дарована электрону, шельмовали соотношение неопределенностей и всерьез доказывали, что квантовая механика — бесполезная наука, коль скоро она толкует не о реальных событиях, а об их вероятностях. Те, кто внимательно проследил предыдущие рассуждения, понимают всю вздорность подобных обвинений. Но даже те, кто относится уважительно к теории атома, не всегда четко сознают, как понимать причинность атомных явлений, если каждое из них — случайно; и насколько достоверны ее предсказания, если все они основаны на понятии вероятности.
Житейское понятие причинности: «Всякое явление имеет свою причину» — не требует объяснений, но для науки бесполезно. Причинность в науке требует строгого закона, с помощью которого можно проследить последовательность событий во времени. На языке формул этот закон принимает вид дифференциального уравнения, которое называют уравнением движения. В классической механике такие уравнения — уравнения движения Ньютона — позволяют предсказать траекторию движения частицы.
Именно такая бегло очерченная нами схема объяснения и предсказания явлений природы всегда составляла идеал причинного описания в классической физике. Она не оставляет места для сомнений и кривотолков, и, чтобы подчеркнуть это ее качество в дальнейшем, причинность классической физики назвали детерминизмом.
Такой причинности в атомной физике нет. Но там есть своя — квантовомеханическая причинность и свой закон — уравнение Шредингера. Он даже более могуществен, чем уравнения Ньютона, так как улавливает и выделяет закономерности в хаосе случайных атомных событий. Подобно калейдоскопу, который в случайном сочетании стеклышек позволяет разглядеть фигуры, имеющие смысл и красоту.
Сочетания слов «статистическая причинность», «вероятностная закономерность» с непривычки режут слух своей несовместимостью. («Масляное масло» — плохо, но все же разумно, однако «немасленое масло» — это уж слишком.) Они и в самом деле несовместимы. Но в атомной физике мы вынуждены использовать их одновременно для того, чтобы во всей полноте объяснить особенности квантовых явлений. В действительности никакого логического парадокса здесь нет: понятия «случайность» и «закономерность» — дополнительные понятия. В согласии с принципом дополнительности Бора оба они одновременно и равно необходимы, чтобы определить новое понятие «квантовомеханическая причинность», которая есть нечто большее, чем простая сумма понятий «закономерность» и «случайность». Точно так же, как «атомный объект» всегда нечто более сложное, чем бесхитростная сумма свойств «волны» и «частицы».
При всей логической красоте таких построений привыкнуть к ним и признать их естественными все-таки довольно трудно. Как всегда, в квантовой физике эти логические трудности объясняются особенностями нашего языка и нашего воспитания. Понятия «закономерность» и «случайность», «достоверность» и «вероятность» возникли задолго до квантовой механики, и смысл, который в них обычно вкладывают, не зависит от желания квантовых физиков. По существу, проблема вероятности — это всегда проблема наблюдения: что произойдет, если мы проделаем то-то и то-то.
В классической физике два одинаковых испытания при одинаковых начальных условиях всегда должны приводить к одному и тому же конечному результату. В этом суть классической причинности, или детерминизма. Своеобразие квантовомеханической причинности состоит в том, что даже при неизменных условиях она может указать лишь вероятность отдельного испытания, но зато совершенно достоверно предсказывает общую картину при большом числе тех же самых испытаний.
Можно без конца жонглировать парадоксами «закономерная случайность», «достоверная вероятность», однако это ничего не прибавит к нашим знаниям об атоме. Суть не в этом. Просто нужно понять хотя бы однажды, что вероятностное описание атома — это не результат усреднения пока неизвестных нам атомных моделей (как это было в случае с бросанием монеты). Здесь мы дошли до предела возможностей нынешней науки: пока остается в силе соотношение неопределенностей Гейзенберга, мы принципиально не можем уточнять наши сведения об атомных системах. По существу, нам это и не нужно: все тела в природе состоят из огромного числа атомов, а свойства таких систем квантовая механика предсказывает однозначно и без всякого произвола.
Понятие о вероятности завершило логическую схему квантовой механики. Только с его помощью удалось логически непротиворечиво осуществить высший синтез дополнительных пар понятий: волна — частица, непрерывность — дискретность, причинность — случайность, явление — наблюдение. Лишь после этого удалось наконец установить, что все эти понятия образуют неделимую систему и каждое из них зависит от контекста других. А форма ответов квантовой механики на наши вопросы зависит от того, какую сторону атомного явления мы хотим изучить пристальнее.
Изучая природу, мы всегда — сознательно или бессознательно — расчленяем ее на две части: система + наблюдатель. Разделение это неоднозначно и зависит от того, какое явление мы изучаем и что мы хотим о нем узнать.
Если под явлением мы понимаем движение отдельной частицы, то это событие дискретно, случайно и большей частью ненаблюдаемо. Но если явлением мы называем результат наблюдения за движением многочисленных одинаковых атомных объектов, то это событие непрерывно, закономерно и описывается волновой функцией.
Квантовая механика изучает только такие события. Для них она дает достоверные и однозначные предсказания, которые до сих пор ни разу не были опровергнуты опытом.
Вокруг кванта
Люди, события, кванты
Результаты науки не зависят от психологии или желаний отдельных людей, и в этой объективности — ее сила и ценность. И все же наука — дело человеческое, и оттого ее история — это не только развитие физических понятий и математических методов, но также история человеческих судеб. Рядом с открытиями любая подробность жизни ученых выглядит значительной: мы всегда стремимся понять, как та или иная мелочь, из которых складывается повседневная жизнь великих людей, повлияла на дела, которые их обессмертили.
История создания квантовой механики сохранила для нас несколько живых воспоминаний, которые помогают представить ту обстановку напряжения и подъема, в которой люди разных национальностей, возрастов и темпераментов всего за три года построили современное здание квантовой механики.
Быть может, все началось с того, что в конце мая 1925 года Вернер Гейзенберг заболел сенной лихорадкой и по совету своего тогдашнего руководителя Макса Борна уехал отдыхать на остров Гельголанд в Балтийском море. Там у него было время проделать подробные вычисления, без которых не удавалось разрешить давно мучившую его идею. Уже 5 июня, по возвращении из отпуска, он написал о своих вычислениях Кронигу, а 24 июня — подробное письмо Паули, в котором содержалось начало будущей матричной механики. Правда, математическая культура Гейзенберга уступала глубине его физических идей: он не знал даже, что величины, которые он тогда ввел, в математике уже давно известны под названием матриц. Поэтому сформулировать теорию Гейзенберга математически строго удалось лишь с помощью Макса Борна и совсем молодого тогда Паскуаля Иордана. Уже в июле они завершили в Геттингене построение матричной механики.
Независимо от них в Кембридже ту же задачу решил Поль Дирак, который летом 1925 года на семинаре у Петра Леонидовича Капицы слушал доклад Гейзенберга, посетившего Англию вскоре после выздоровления.
С помощью этой новой математики осенью того же года Вольфганг Паули нашел уровни энергии атома водорода и доказал, что они совпадают с уровнями атома Бора.
В то же лето Гаудсмит и Уленбек предложили гипотезу о спине электрона, Луи де Бройль окончательно разработал идею о волнах материи, а Эльзассер и Эйнштейн посоветовали объяснить с помощью этих теорий эксперименты Дэвиссона и Кенсмена по отражению электронных пучков от поверхности металлов.
Волновая механика родилась год спустя, весной 1926 года. Ее встретили недоверчиво, поскольку в ней явно отсутствовали квантовые скачки — то, к чему лишь недавно и с большим трудом привыкли и что считалось главной особенностью атомных явлений.
В июне 1926 года Гейзенберг приехал в Мюнхен навестить родителей и «…пришел в совершенное отчаяние», услышав на одном из семинаров доклад Эрвина Шредингера и его интерпретацию квантовой механики.
Споры о волновой механике продолжались часами и днями и достигли предельной остроты в сентябре 1926 года, когда Шредингер приехал по приглашению Бора в Копенгаген.
Шредингер настолько устал от дискуссий, что даже заболел и несколько дней провел в доме Бора, который в течение всей болезни гостя почти не отходил от его постели.
Время от времени, характерным жестом подняв палец, Нильс Бор повторял:
— Но, Шредингер, вы все-таки должны согласиться…
Однажды почти в отчаянии Шредингер воскликнул:
— Если мы собираемся сохранить эти проклятые квантовые скачки, то я вообще сожалею, что имел дело с атомной теорией!
— Зато остальные весьма признательны вам за это, — ответил ему Бор.
С течением времени точки зрения сторонников матричной и волновой механик сближались. Сам Шредингер доказал их математическую эквивалентность, а Макс Борн летом 1926 года догадался, какой физический смысл следует приписать ψ-функции Шредингера.
Опыты по дифракции электронов, ставшие известными осенью 1926 года, сильно укрепили веру в теории де Бройля и Шредингера. Постепенно физики поняли, что дуализм «волна-частица» — это экспериментальный факт, который следует принять без обсуждений и положить его в основу всех теоретических построений.
Теперь ученые старались понять, к каким следствиям приводит этот факт и какие ограничения он накладывает на представления об атомных процессах. При этом они сталкивались с десятками парадоксов, понять смысл которых зачастую не удавалось.
В ту осень 1926 года Гейзенберг жил в мансарде физического института в Копенгагене. По вечерам к нему наверх поднимался Бор, и начинались дискуссии, которые часто затягивались за полночь. «Иногда они заканчивались полным отчаянием из-за непонятности квантовой теории уже в квартире Бора за стаканом портвейна, — вспоминал Гейзенберг. — Однажды после одной такой дискуссии я, глубоко обеспокоенный, спустился в расположенный за институтом Фэллед-парк, чтобы прогуляться на свежем воздухе и немного успокоиться перед сном. Во время этой прогулки под усеянным звездами ночным небом у меня мелькнула мысль, не следует ли постулировать, что природа допускает существование только таких экспериментальных ситуаций, в которых… нельзя одновременно определить место и скорость частицы».
В этой мысли — зародыш будущего соотношения неопределенностей.
Быть может, чтобы снять напряжение этих дней, в конце февраля 1927 года Нильс Бор уехал в Норвегию отдохнуть и походить на лыжах. Оставшись один, Гейзенберг продолжал напряженно думать. В частности, его очень занимал давний вопрос товарища по учебе, сына известного физика Друде: «Почему нельзя наблюдать орбиту электрона в атоме при помощи лучей с очень короткой длиной волны, например гамма-лучей?»
Обсуждение этого эксперимента довольно быстро привело его к соотношению неопределенностей, и уже 23 февраля он написал об этом Паули письмо на 14 страницах.
Через несколько дней возвратился из отпуска Бор с готовой идеей дополнительности, которую он окончательно продумал в Норвегии.
Еще через несколько недель напряженных дискуссий с участием Оскара Клейна все пришли к выводу, что соотношение неопределенностей — это частный случай принципа дополнительности, для которого возможна количественная запись на языке формул.
В последующие месяцы интерпретация математического формализма квантовой механики дополнялась и уточнялась и окончательно утвердилась в Брюсселе на Сольвеевском конгрессе осенью 1927 года. На этот конгресс собрались Планк, Эйнштейн, Лоренц, Бор, де Бройль, Борн, Шредингер, а из молодых — Гейзенберг, Паули, Дирак, Крамерс. Это была самая суровая проверка всех положений квантовой механики. Она ее с честью выдержала и с тех пор почти не претерпела никаких изменений.
В те годы в Копенгагене, в институте Бора, была создана не только наука об атоме — там выросла интернациональная семья молодых физиков. Среди них были Гейзенберг, Паули, Крамерс, Гамов, Ландау, Гаудсмит и многие другие. Беспримерное в истории науки содружество ученых отличали бескомпромиссное стремление к истине, искреннее восхищение перед величием задач, которые им предстояло решить, и неистребимое чувство юмора, которое так гармонировало с общим духом интеллектуального благородства. «Есть вещи настолько серьезные, что о них можно говорить лишь шутя», — любил повторять Нильс Бор, который стал их учителем и духовным отцом.
Через много лет политические бури разбросают их по всему миру: Гейзенберг станет главой немецкого «уранового проекта»; Нильс Бор, спасаясь от нацистов, окажется в американском центре атомных исследований в Лос-Аламосе, а Гаудсмита назначат руководителем миссии «Алсос», которая будет призвана выяснить, что успел сделать Гейзенберг для постройки немецкой атомной бомбы.
Сейчас этих людей осталось совсем немного, и вместе с ними из жизни уходит целая эпоха в физике, которую можно сравнить лишь с эпохами Галилея и Ньютона.
Глава одиннадцатая
Что такое квантовая механика? ♦ Что такое атом? ♦ Физическая реальность
Нильс Бор, объясняя на примерах свой принцип дополнительности, любил вспоминать известную шутку Бернарда Шоу: «Хороший специалист — это тот, кто знает много о немногом. Хороший журналист — тот, кто знает понемногу о многом. В пределе: самый хороший специалист знает все ни о чем; наилучший журналист знает ничего обо всем».
Козьма Прутков принципа дополнительности не знал и объяснялся проще: «Специалист подобен флюсу — полнота его односторонняя». И наоборот: «Нельзя объять необъятное».
Эти шутки приобрели особый смысл в наше время, когда на человека ежедневно обрушивается поток информации: книги, радио, телевизор, журналы… (В книгохранилищах мира 60 миллионов книг, и каждую минуту выходит в свет еще одна.) Люди неподготовленные, внезапно попадая в этот поток знаний, отчаиваются вообще что-либо в нем понять и предпочитают плыть по течению, не зная ничего ни о чем. Люди недалекие пытаются обмануть себя и других, черпая из этого потока лишь верхушки знаний, которые стали теперь так доступны и к тому же красиво упакованы.
Но большая часть людей стремится все же выделить из потока информации лишь те знания, которые абсолютно необходимы им или же доставляют необъяснимую радость, — конечно, каждый по-своему и в меру сил, отпущенных ему природой. Процесс этот строго индивидуален, во многом стихиен и не поддается безукоризненному логическому анализу. Нельзя в колыбель новорожденного положить рецепт с точным указанием: когда, в каком порядке и какие книги необходимо прочесть ему в течение жизни.
Однако некоторые правила все-таки существуют, точно так же как известны способы продления жизни, хотя рецепта бессмертия не было и нет. Невозможно знать все. Хорошо знать много. Но хотя бы что-то одно необходимо знать досконально. Только такое знание сообщает человеку уверенность, способность самостоятельно мыслить и создавать новые ценности.
Еще не найдено «соотношение неопределенностей» для процесса познания, которое укажет равновесие между «количеством» и «качеством» необходимых человеку знаний и строго определит границы возможного при выборе предмета и способа его изучения. Но одно бесспорно: верхоглядство не приносит ни пользы, ни удовольствия. Все мы так или иначе поражены логической красотой и могуществом науки, однако салонные разговоры о ней носят печать какой-то особой пустоты, если за ними не стоит знание точных фактов и четких понятий.
В продолжение всего рассказа о квантовой механике мы стремились использовать только такие факты и только такие понятия. Конечно, даже усвоив их, вы не сможете сконструировать лазер или рассчитать атомный котел. Но ведь и в музыкальный лекторий вы ходите не затем, чтобы научиться играть на скрипке.
Мы подошли к концу нашего рассказа. Можем ли мы теперь осмысленно ответить на два основных вопроса, которые задали в самом начале?
Что такое квантовая механика?
Что такое атом?
Оказывается, ответ на эти вопросы существует, хотя и выглядит несколько своеобразно.
Наш рассказ о квантовой механике мы начали с определения: «Квантовая механика — это наука о строении и свойствах атомных объектов и явлений». Мы его тут же оставили, поскольку бесполезность его очевидна до тех пор, пока не определено само понятие «атомный объект». Мы обратились к анализу опытов, в которых проявляются свойства атома, и к анализу формул, которые позволяют предсказать результаты этих опытов.
Постепенно выяснилась поразительная вещь: все формулы, которые описывают свойства атомных объектов, непременно содержат постоянную Планка h. И теперь, если физик видит уравнение, в которое входит квант действия h, он безошибочно заключает, что перед ним уравнение квантовой механики.
На этом основании квантовую механику можно было бы определить как систему уравнений, в которых обязательно присутствует постоянная Планка h. Однако такое определение может лишь успокоить наше стремление к однозначности и формальной строгости, но ничего не может дать по существу — определение науки должно указывать на предмет ее изучения, а не только на метод, которым эта цель достигается.
После наших многочисленных попыток ответить на вопросы о сущности атома мы могли бы сказать просто: «Атом — это все то, что мы теперь о нем знаем». Но, конечно, это опять не определение, а благовидный предлог его избежать.
Какими словами коротко и без разночтений можно определить понятие «атом»?
Мы неоднократно убеждались, что все многообразие и сложность этого понятия не в состоянии вместить какое-нибудь одно слово нашей речи. Тогда мы обратились к уравнениям квантовой механики и с помощью формул, минуя слова и строгие определения, построили для себя образ атома. При этом мы сознательно следовали методу современной физики.
В чем суть этого метода? Прежде всего он запрещает говорить о явлениях самих по себе, независимо от способа их наблюдения. Понятия «явление» и «наблюдение» существуют независимо только в нашем сознании, да и то с ограниченной точностью. Для физика оба эти понятия — две стороны одной и той же физической реальности, которую он изучает и в объективное существование которой, безусловно, верит.
Понятия «явление» и «наблюдение» — дополнительные в смысле Бора. Они несовместимы: наблюдение разрушает первозданное явление. Но они равно необходимы: без наблюдения мы вообще ничего не узнаем о явлении. Их сложное единство и взаимодействие не позволяют нам постигнуть суть явления самого по себе, но они помогают нам раскрыть связи между явлениями.
Эти связи мы можем запирать с помощью формул и рассказать о них словами. Однако слова эти повисают в воздухе, если рядом с ними не написаны формулы. А формулы мертвы до тех пор, пока мы не нашли способа объяснить, что они на самом деле означают. Для полного объяснения «явления — наблюдения» необходимо гармоничное сочетание понятий и формул. Лишь после этого можно создать для себя удовлетворительный образ физического явления.
На этом этапе цепочка познания новой физики
еще раз видоизменяется, усложняется и приобретает вид:
В продолжение всех попыток определить понятие «атом» мы бессознательно стремились к этой схеме. Нынешние физики начинают свое обучение с формул. Наверное, это разумно: при изучении любого иностранного языка лучше сразу учиться говорить, а не выяснять каждый раз, почему то или иное слово пишется так, а не иначе.
Вслед за формулами физики усваивают слова, которые необходимо произносить и без которых вообще невозможно общение между людьми. Однако формулы не имеют точных словесных эквивалентов. Поэтому обучение современной физике состоит в том, чтобы излагать непривычные вещи привычными словами, но каждый раз немного с новой точки зрения. Тем самым добиваются погружения новых понятий из сферы логической и сознательной в сферу интуитивную и подсознательную — условие, необходимое для всякого творчества.
Такой способ обучения физиков неуловимо деформирует систему их образов, понятий и даже систему ассоциаций. Как всякого человека, хорошо владеющего языком, физиков коробят безукоризненно правильные словесные конструкции большинства научно-популярных книг: в них они безошибочно различают еле уловимый чужеродный акцент. Невозможно передать смысл иностранной фразы, не разрушив при этом ее первоначальную структуру. Язык, на котором общаются между собой физики, зачастую только по названию и отдельным словам русский, английский или еще какой-то. В действительности это особый язык, словарь и грамматические конструкции которого приводят в отчаяние литературных редакторов. Но при всякой попытке «причесать» корявую физическую фразу по нормам литературного языка она что-то теряет — как иностранные стихи даже в хорошем переводе.
Непричесанная физическая правда состоит в том, что:
атомный объект — это физическая реальность, свойства которой можно описать с помощью уравнений квантовой механики;
квантовая механика — это система формул, понятий и образов, которая позволяет представить, объяснить и предсказать наблюдаемые свойства атомных объектов.
Два приведенных определения, поставленные рядом, выглядят как насмешка над здравым смыслом. Однако они совершенно естественны в рамках принципа дополнительности. Дело в том, что понятия «атомный объект» и «квантовая механика» — дополнительные в смысле Бора. Точно так же, как понятия: «координата» и «импульс», «волна» и «частица», «явление» и «наблюдение», «вероятность» и «достоверность», «причинность» и «случайность». Они не могут заменить одно другое, и любое из них нельзя определить полностью без учета другого, дополнительного ему. К этому необходимо привыкнуть, с этим необходимо сжиться — такова судьба всех действительно глубоких понятий.
Нильс Бор до конца жизни не уставал это повторять. Он предложил даже способ отличить глубокое утверждение от тривиального: нужно построить противоположное утверждение, и если окажется, что оно абсурдно, то первоначальное — тривиально. И приводил примеры. Утверждение «бог существует» — глубóко, поскольку противоположное ему «бога нет» — столь же глубóко. А утверждение «все люди смертны» — тривиально, так как противоположное ему «все люди бессмертны» — абсурдно.
Умение мыслить в соответствии с принципом дополнительности Бора необходимо в себе развивать, как и любую другую способность, данную нам от природы лишь в зародыше. Для этого недостаточно усвоить формальные правила построения понятий. Нужно еще представлять себе, откуда они возникли. Поэтому-то мы так долго и тщательно знакомились с опытами, из которых впоследствии выкристаллизовалось понятие «атомный объект». Само по себе, в отрыве от этих опытов, оно ничего не значит; оно лишь закрепляет на языке формальной логики тот интуитивный образ, который постепенно формировался в нашем сознании во многом помимо нашей воли.
Наше теперешнее определение квантовой механики почти дословно совпадает с тем, которое мы привели в самом начале книги. И если теперь оно звучит для вас совсем по-другому — значит все остальное вы прочли не напрасно.
Рассказ о квантовой механике на этом можно было бы закончить, если бы не одно важное обстоятельство. Дело в том, что, когда мы сказали: «Атом — это физическая реальность…», мы невольно коснулись обширной пограничной области между физикой и философией.
Понятие «физическая реальность» — последнее понятие, к которому неизбежно приходят при любой попытке объяснить что-либо в физике. И в силу своей универсальности оно настолько обширно и всеобъемлюще, что определить его только средствами физики оказывается невозможным. Для этого необходимо привлечь философию с ее понятием объективной реальности.
Как известно, объективная реальность — это все то, что есть и было — независимо от нашего сознания. (Впрочем, и наше сознание, и наши ощущения — тоже объективная реальность.) Однако для науки такое определение недостаточно конкретно, поскольку оно ни к чему не обязывает, кроме веры в объективную сущность познаваемого мира. А в это все ученые верят — иначе они бы не отдавали всю свою жизнь познанию этой самой реальности. Мнения расходятся лишь о природе физической реальности, ее истинности и однозначности. Большая часть физиков признает, что
Физическая реальность — эта та часть объективной реальности, которую мы познаем с помощью опыта и нашего сознания, то есть все те факты и числа, которые мы получаем с помощью приборов, а также все то, что мы об этом думаем.
Мнения — очень зыбкая вещь. Почему же мы уверены, что картина физической реальности, добытая таким путем, истинна? Или более мягко (ведь никто не знает, «что такое истина») — почему мы убеждены, что эта картина единственно возможна?
Физическая реальность
Уточнение понятий — занятие сложное и не всегда безобидное. В свое время Сократ поплатился жизнью за настойчивые попытки уяснить смысл основных морально-этических понятий: добро и зло, истина и заблуждение, справедливость и закон… Сократ жил в античной Греции времен ее наивысшего расцвета. Как истинный мудрец, он проводил свои дни на солнечных площадях Афин и испытывал сограждан вопросами вроде следующего:
«Скажи мне, многоученый Гиппий, что есть прекрасное?» Ученый собеседник с энтузиазмом брался за объяснения, но очень скоро убеждался, что не может выйти за круг примеров: он толковал более или менее понятно, что такое прекрасная женщина, прекрасный горшок с кашей или прекрасная лошадь, но объяснить, что есть прекрасное само по себе, ему каждый раз оказывалось не под силу.
Трагизм этой типичной мыслительной ситуации понимали во все времена. Понимали и смирялись.
«Истина лежит за пределами сознания и потому не может быть выражена словами», — говорили в Древней Индии. «О чем нельзя сказать словами, о том следует молчать», — пишут современные философы.
В своем стремлении ответить на вопрос «Что такое атом?» мы неизбежно приходим к тем же трудностям. Как и древние философы, мы затрудняемся преодолеть их с помощью слов. Но нам легче: с развитием науки появились формулы, которые позволяют многие из трудностей обойти.
На частных примерах мы постепенно убедились, что атом — это не спектральные линии, которые он испускает, и не многообразие кристаллов, которые из атомов построены, не тепло раскаленного железа и не электроны, которые из атомов вылетают. Подобно собеседникам Сократа, мы теперь вынуждены признать, что атом — это нечто неопределимое само по себе, некая общая причина атомных явлений, которую нельзя познать независимо от них.
Зайдите в любую физическую лабораторию и попытайтесь с порога определить, какое явление природы в ней изучают. Вы увидите перед собой нагромождение приборов и путаницу проводов, за которыми нельзя разглядеть не то что явление, но даже физиков, которые призваны его изучать. В этой обстановке такие, например, слова: «Мы изучаем здесь расщепление спектральных линий в магнитном поле» — могут вызвать лишь вежливое внимание, но отнюдь не доверие.
Даже когда вам в руки дадут фотопластинку и вы увидите на ней узкие черные линии, у вас не возникнет никаких ассоциаций с атомами, из недр которых (как станут убеждать вас физики) испущены те самые лучи, которые впоследствии были преобразованы спектроскопом и оставили на фотопластинке резкие следы.
Для человека, непричастного к физике, все эти объяснения выглядят очень неубедительно. Ему более или менее понятно, как по стуку мотора механик определяет его неисправность, или как врач по жалобам больного может поставить правильный диагноз. Потому что он знает: всегда можно разобрать мотор — детали его при этом не изменятся; и, на худой конец, можно произвести вскрытие, чтобы убедиться в правильности диагноза. В обоих случаях известны все части, из которых устроено целое. Даже если вы не часовщик, то, разобрав часы, вы сможете понять, как они работают и почему видимое движение их стрелок не похоже на невидимое обычно движение их пружин и колесиков.
С атомами все много сложнее. Мы наблюдаем внешние проявления их свойств: спектры, цвет тел, их теплоемкость и кристаллическую структуру, но мы не можем после этого открыть «крышку часов» и посмотреть, как атом устроен «на самом деле». На основе совокупности фактов, понятий и формул мы создали для себя некоторый образ атома. Но поскольку не существует никакого независимого способа проверить этот образ, то возникает естественный вопрос: а нельзя ли придумать другой образ атома, который, однако, приводил бы к тем же самым наблюдаемым следствиям?
Вопрос этот не праздный, им занимались почти все великие физики. Житейский скептический ум формулирует его несколько иначе: «Все, что вы придумали, — неправда, на самом деле все не так!»
Такое возражение трудно опровергнуть, потому что понятие «на самом деле» на самом деле не определено. В общежитейском смысле «на самом деле» существует лишь то, что мы можем проверить с помощью наших пяти чувств, либо же то, в чем мы можем убедиться с помощью продолжения наших чувств — приборов.
Даже с последним утверждением согласились далеко не сразу: современники Галилея упрекали его в том, что его открытия солнечных пятен и спутников Юпитера на самом деле не открытия, а ошибки зрительной трубы, которой он пользовался.
Предположим, что мы ушли вперед со времен Галилея и верим в истинность показаний приборов. Тогда остается еще свобода для толкования этих показаний. Вопрос «на самом деле» теперь означает: «Насколько однозначно толкование опытов относительно явлений, недоступных непосредственному чувственному восприятию?»
Здравый смысл человека, непричастного к науке, должен признать, что такое толкование неоднозначно. После беглого посещения физической лаборатории это априорное убеждение может только укрепиться. И лишь физики знают, что факты и понятия их науки допускают свободу толкований только в процессе их открытия и становления. Но коль скоро они включены в общую систему физических знаний и согласованы с ними — изменить их почти невозможно, если не переходить при этом границы их применимости.
При углублении и уточнении системы научных знаний мы вынуждены все дальше и дальше отходить от непосредственных чувственных восприятий и от понятий, которые возникли на их основе. Такой процесс абстракции необратим, но не следует огорчаться по этому поводу, коль скоро наш разум способен понять даже то, чего мы не в состоянии представить.
Абстрактность научных понятий — такая же необходимость, как изобретение буквенного письма взамен древних рисунков и иероглифов. Ни одна буква в слове «носорог» не напоминает его самого, и тем не менее все слово безошибочно вызывает в памяти нужный образ. Всем очевидно, что нынешняя культура немыслима без книгопечатания. Но далеко не каждому ясно, что без дальнейшей абстракции научных понятий развитие науки невозможно. Житейский здравый смысл должен с этим фактом смириться и не требовать ему объяснений. Абстрактная наука, как и музыка, требует не оправдания, а глубокого понимания: только с ее помощью можно познать непривычную атомную реальность, хотя реальность эта совсем другого рода, чем весомые и зримые камни или деревья.
Но даже эту «абстрактную реальность» человек всегда пытается представить наглядно, то есть свести ее к небольшому числу проверенных образов. Такое стремление заложено в человеке очень глубоко, и поэтому у физиков постепенно развилась своя, причудливая система образов, которая почти наверное ничему реальному в природе не соответствует, о которой нельзя рассказать словами, но которая тем не менее помогает им отыскивать связи между явлениями в моменты наивысшего напряжения мысли.
Те цепочки познания, которые мы рисовали — от явления через понятия и формулы к образам, — не более чем схемы, дающие довольно слабое представление о сложных процессах, происходящих в сознании ученого, когда в беспорядочном наборе фактов он пытается увидеть простые связи, определить их словами и найти им место в общей картине природы.
Отдельное слово еще не образует языка — необходим набор слов и правил грамматики, по которым они сочетаются. Точно так же отдельный научный факт, каким бы важным он ни казался, еще ничего не означает сам по себе, если неизвестно его место в общей системе знаний, и лишь вместе со своим толкованием он получает смысл и значение.
Вспомните историю D-линии натрия. Ее наблюдал уже Фраунгофер. Но разве мог он подозревать, что держит в руках ключ ко всей квантовой механике? Он видел, что линия эта расщепляется на две компоненты. Но разве знал он, что это влияние спина электрона? Понятия «электрон», «квантовая механика», «спин» во времена Фраунгофера еще не были изобретены. А без них D-линия натрия просто любопытный факт, не ведущий ни к каким глубоким следствиям. Лишь после опытов Крукса, Резерфорда, Томсона и после создания системы понятий и формул, которую назвали квантовой механикой, стало ясно, что D-линия натрия — это один из тех фактов, которые меняют самые основы нашего мышления.
Гармонию явлений атомного мира мы можем оценить лишь благодаря теории: всякое описание только экспериментальной установки будет безнадежно скучным и неинтересным. Лишь теория сделала картину атома не только логически удовлетворительной, но и эстетически приемлемой. И не зря (хотя, быть может, этимологически и не очень правильно) такие моменты проникновения в сущность вещей называют иногда Θεορια — видение бога.
То, что понятия возникают на основе новых фактов, очевидно всем. Однако не все отдают себе отчет в том, насколько смысл новых фактов зависит от понятий, которые используются для их толкования. С развитием и углублением научных знаний это взаимное влияние фактов и понятий постепенно усиливается, и цепочка познания деформируется еще раз:
В наше время это взаимодействие стало настолько сильным, что подчас бывает трудно отделить факты от их толкования. Результат такого взаимодействия часто называют информационным взрывом — настолько быстро бесконтрольное взаимовлияние новых фактов и понятий ведет к реальным практическим последствиям.
Сложное переплетение фактов, понятий, формул и образов науки очень трудно, да, пожалуй, и невозможно распутать. При всех попытках подобного рода мы неизбежно придем к сакраментальному вопросу: «Что возникло раньше: яйцо или курица?»
Иммануил Кант пытался разомкнуть этот логический круг: понятия зависят от результатов опыта, истолкование опытов — от системы понятий. Он полагал, что несколько таких понятий даны человеку «от бога», он с ними рождается, а все дальнейшие истины он сможет найти, комбинируя первичные понятия, если, конечно, при этом не будет делать логических ошибок. Приняв это допущение, он построил стройную и законченную философию познания. Развитие физики очень скоро показало, однако, что многие «априорные истины» Канта — такие, как пространство, время и другие, — в действительности имеют эмпирическое и самое что ни на есть земное происхождение — конечно, переосмысленное и лишенное конкретных особенностей тех образов на основе которых они возникли.
Никто никогда не узнает тот первый научный факт и то первое научное понятие, с которых началась эволюция нынешней науки. Поэтому все чаще вместо «объяснения природы» естествоиспытатели говорят об «описании природы».
«Мы теперь лучше, чем прежнее естествознание, сознаем, что не существует такого надежного исходного пункта, от которого бы шли пути во все области нашего познания, но что все познание в известной мере вынуждено парить над бездонной пропастью. Нам приходится всегда начинать где-то с середины и, обсуждая действительность, употреблять понятия, которые лишь постепенно приобретают определенный смысл благодаря их применению…» Эти слова Гейзенберга близки и понятны каждому физику. И в жизни каждого из них бывают минуты, когда они удивляются, что в таких условиях познание природы все-таки возможно. «Единственная загадка мира — его познаваемость», — часто повторял Эйнштейн.
Физическая реальность — очень глубокое понятие и, как все глубокие понятия нашего языка, не имеет однозначного смысла. Это понятие первично, и его нельзя достаточно строго определить логически через более простые. Его необходимо принять, предварительно вложив в него тот смысл, который диктует нам вся наша прежняя жизнь и приобретенные в ней знания. Очевидно, смысл этот меняется с развитием науки точно так же, как и смысл понятия «атом».
Наши предки верили, что пять чувств дают им правильную картину реальности, поскольку с их помощью им удавалось избегать реальных опасностей и выжить. На этом этапе развития сознание лишь группировало и анализировало данные чувств.
Пришли другие времена — и сознание само стало творить реальность: оно рисовало подробные картины ада и рая и стремилось отчетливо представить себе триединую сущность бога.
Потом наступило время очистительного сомнения: нельзя безоговорочно доверять данным чувств (мы не ощущаем движения Земли, но ведь она вертится!), но и выводы сознания также необходимо проверять опытом (звезды, в которых прежде видели и души усопших, и светильники ангелов, оказались просто далекими солнцами).
С приходом науки понятие реальности изменилось неузнаваемо, и реальность человека XX века так же далека от реальности греков, как современный атом от атома Демокрита.
Решающие штрихи в новой картине физической реальности дорисовала квантовая механика. Пожалуй, это главная причина, которая будит желание людей понять: «Что такое квантовая механика?» Но не единственная. Она даже глубже, чем естественный профессиональный интерес. При изучении квантовой механики человек приобретает не только специальные навыки, позволяющие ему рассчитать лазер или атомный котел. Знакомство с квантовой механикой — это некоторый эмоциональный процесс, который заставляет заново пережить всю ее историю. Как всякий нелогический процесс, он строго индивидуален и оставляет неистребимые следы в сознании человека. Это абстрактное знание, приобретенное однажды, необратимо влияет на всю последующую жизнь человека — на его отношение к физике, к другим наукам и даже на его моральные критерии. Вероятно, так же изменяет человека изучение музыки.
Конечно, нельзя стать музыкантом, посещая концерты даже ежедневно. Для этого вначале необходимо долго и упорно играть гаммы. При знакомстве с любой наукой всегда наступает момент, когда человек должен выбирать: останется ли он любителем в ней или же станет профессионалом? В первом случае ему достаточно усвоить понятия и образы науки и — если сможет — почувствовать их красоту. Во втором случае он обязан учиться ремеслу: изучать взаимную связь понятий и способы их выражения на языке математики. Если он не сделает этого — ему будет недоступна радость мастера и музыканта.
Прочитав эту книгу, вы узнали только первые ноты квантовой механики и, быть может, научились брать несколько звучных аккордов. Конечно, только музыкант вполне оценит глубину музыкального замысла, и только физик способен испытывать эстетическое удовлетворение от красоты формул. Те из вас, кто посвятит себя науке, быть может, поймут это со временем. Однако, если, не вникая в «законы гармонии» квантовой механики, вы все же почувствовали красоту ее «мелодии», задача нашего рассказа выполнена.
Вокруг кванта
Квантовый Олимп
Шведский ученый и промышленник Альфред Нобель, разбогатевший на изобретении пироксилина, завещал Шведской академии наук большую сумму денег, с тем чтобы каждый год прибыли с этого капитала шли на премии ученым за выдающиеся достижения в науке и искусстве.
Первая Нобелевская премия была присуждена в 1901 году Рентгену, и с тех пор звание лауреата Нобелевской премии стало высшим признанием научных заслуг. Замечательно, что почти каждый год в течение тридцати лет Нобелевская премия присуждалась за открытия в атомной физике. Такое признание довольно узкой области физики не случайно — она действительно изменила наше мировоззрение.
Среди лауреатов Нобелевской премии — имена всех великих физиков, которые построили современное здание квантовой механики, и, перечитывая их список, мы еще раз мысленно повторяем ее богатую историю.
1901 год.
Вильгельм Конрад Рентген (1845–1923) — «В знак признания выдающегося вклада, который он внес открытием замечательных лучей, названных впоследствии его именем».
1902 год.
Хенрик Антон Лоренц (1853–1928), Питер Зееман (1865–1943) — «…за исследования влияния магнетизма на явления излучения».
1903 год.
Антуан Анри Беккерель (1852–1908) — «…за открытие спонтанной радиоактивности».
1904 год.
Сэр Уильям Рамсей (1852–1916) — «…за открытие инертных газообразных элементов в воздухе и определение их места в периодической системе».
1905 год.
Филипп Эдуард Антон фон Ленард (1862–1947) — «…за исследование катодных лучей».
1906 год.
Джозеф Джон Томсон (1856–1940) — «в знак признания большого значения его теоретических и экспериментальных исследований электрической проводимости газов».
1908 год.
Эрнест Резерфорд (1871–1937) — «…за его исследования по разложению элементов и химии радиоактивных веществ».
1911 год.
Мария Склодовская-Кюри (1867–1934) — «…за открытие элементов радия и полония, выделение радия и изучение природы и соединений этого замечательного элемента».
Вильгельм Вин (1864–1928) — «…за открытие законов излучения теплоты».
1914 год.
Макс фон Лауэ (1879–1960) — «…за открытие дифракции рентгеновых лучей в кристаллах».
1918 год.
Макс Карл Эрнст Людвиг Планк (1858–1947) — «…за открытие кванта энергии».
1919 год.
Иоганн Штарк (1874–1957) — «..за открытие Доплер-эффекта в каналовых лучах и расщепления спектральных линий в электрических полях».
1921 год.
Альберт Эйнштейн (1879–1955) — «…за его вклад в теоретическую физику и особенно за открытие закона фотоэлектрического эффекта».
Фредерик Содди (1877–1956) — «…за его вклад в наши знания о химии радиоактивных веществ и его исследования происхождения и природы изотопов».
1922 год.
Нильс Хенрик Дэвид Бор (1885–1962) — «…за его исследования структуры атомов и их излучения».
Фрэнсис Уильям Астон (1877–1945) — «…за его открытие изотопов большого числа нерадиоактивных элементов (главным образом с помощью его масс-спектрографа) и за его доказательство правила целочисленности».
1923 год.
Роберт Эндрюс Милликен (1868–1953) — «…за работы по изучению элементарного заряда электричества и фотоэлектрического эффекта».
1925 год.
Джеймс Франк (1882–1964), Густав Людвиг Герц (род. 1887) — «…за открытие законов, управляющих столкновением электронов с атомами».
1927 год.
Артур Холли Комптон (1892–1962) — «за исследование эффекта, названного его именем».
Чарльз Томсон Рис Вильсон (1869–1959) — «…за его метод делать видимыми пути заряженных частиц при конденсации пара».
1929 год.
Принц Луи-Виктор де Бройль (род. 1892) — «…за открытие волновой природы электронов».
1932 год.
Вернер Карл Гейзенберг (род. 1901) — «…за создание квантовой механики и, в частности, за ее приложение к открытию аллотропических форм водорода».
1933 год.
Эрвин Шредингер (1887–1961), Поль Адриен Морис Дирак (род. 1902) — «…за открытие новой плодотворной формы атомной теории».
1934 год.
Гарольд Клейтон Юри (род. 1893) — «…за его открытие тяжелого водорода».
1935 год.
Жан-Фредерик Жолио (1900–1958), Ирэн Жолио-Кюри (1897–1956) — «…за синтезы новых радиоактивных элементов».
1937 год.
Клинтон Джозеф Дэвиссон (1881–1958), Джордж Паджет Томсон (род. 1892) — «…за их экспериментальные открытия дифракции электронов в кристаллах».
1945 год.
Вольфганг Паули (1900–1958) — «…за открытие принципа запрета, называемого также принципом Паули».
1951 год.
Эдвин Маттисон Мак-Миллан (род. 1907), Гленн Теодор Сиборг (род. 1912) — «…за их открытия в химии трансурановых элементов».
1954 год.
Макс Борн (1882–1970) — «…за фундаментальные исследования в квантовой механике, в особенности за его статистическую интерпретацию волновой функции».
Лайнус Карл Полинг (род. 1901) — «…за его исследования природы химической связи и их приложения к объяснению структуры сложных веществ».
1955 год.
Виллис Евгений Лэмб (род. 1913) — «…за открытия, связанные с тонкой структурой водородного спектра».
Поликарп Куш (род. 1911) — «…за точное определение магнитного момента электрона».
1958 год.
Игорь Евгеньевич Тамм (1895–1971), Павел Александрович Черенков (род. 1904), Илья Михайлович Франк (род. 1908) — «за открытие и объяснение эффекта Вавилова — Черенкова».
1964 год.
Николай Геннадиевич Басов (род. 1922), Александр Михайлович Прохоров (род. 1916 г.), Чарльд Таунс (род. 1915 г.) — «за исследования по квантовой радиофизике, приведшие к созданию квантовых генераторов и усилителей электромагнитного излучения — мазеров и лазеров».
Глава двенадцатая
Мистер Томпкинс в стране чудес
Хороший юмор всегда основан на точных и глубоких фактах. Но, намеренно вырванные из гармоничного контекста, эти факты кажутся несуразными — как мраморная Венера в милицейской фуражке.
Юмор подобен вершине айсберга: его сила непонятна тем, кто не знает о его подводной части, которая, как известно, в девять раз больше видимой. Поэтому так трудно понять блеск и парадоксы юмористических преданий чужого народа, не изучив предварительно его язык, историю и культуру.
И поэтому только теперь, когда мы немного знакомы с языком и историей квантовой механики, мы можем по достоинству оценить уникальный юмористический рассказ Георгия Гамова о приключениях мистера Томпкинса.
Как и всякая талантливая шутка, эти веселые заметки позволяют взглянуть на явления с непривычной стороны и открыть между ними неожиданные связи.
Мистер Томпкинс в стране чудес
(Отрывки из книги)
Квантовая бильярдная
Вторая лекция, на которую попал мистер Томпкинс, была посвящена квантовой теории. Она оказалась еще непонятнее, чем первая. Большую часть времени профессор пытался убедить слушателей, что такие обычные понятия, как положение тела и его скорость, не так уж просты и что говорить о траектории движущегося тела — значит проявлять полное невежество в современной физике. Только однажды ушей мистера Томпкинса достигло хорошо знакомое слово «неопределенность». По словам профессора, о точном положении и скорости тела никогда нельзя говорить с полной уверенностью. «Любое движение можно представить себе только размазанным», — продолжал профессор, пытаясь изобразить это яснее на пальцах. В конце концов он написал на доске большую греческую букву
ψ,
от которой зависит эта размазанность. Но смысл всего этого оставался для большинства слушателей таким же непонятным, как если бы он вообще говорил по-гречески.
Пытаясь в последний раз объяснить суть дела, профессор сказал, что людям, склонным к математике, будет проще все это понять, если ввести «бесконечные некоммутабельные матрицы». Он даже не поленился нарисовать одну из матриц, которая выглядела примерно так:
x11 x12 x13 x14 …
x21 x22 x23 x24 …
x31 x32 x33 x34 …
……………………………………
Это, однако, окончательно добило мистера Томпкинса, хотя его сосед, тощий очкастый студент, взволнованно пробормотал: «Теперь я понял, почему положение и скорость не могут быть определены одновременно!»
По пути домой мистер Томпкинс чувствовал себя так, как будто вырвался из сумасшедшего дома. «Неопределенность и размазанная скорость, — вспоминал он. — Хорошо, что об этих штуках не слыхивала полиция. А то они могли бы оштрафовать кого угодно за превышение „в некоторой степени“ предельной, дозволенной скорости…»
Наконец он добрался до дома и улегся в постель. «Да, определенно в постель, а не просто „в некоторой степени“, и не на матрице, а на матраце…» — думал он, засыпая.
Неожиданно он очутился в большой комнате, в центре которой несколько человек, сняв пиджаки, играли на бильярде. Он подошел к столу и начал следить за игрой. Но игра была какая-то странная! Один из игроков положил шар на стол и толкнул его кием. Мистер Томпкинс проводил шар взглядом и, к своему большому удивлению, заметил, что шар начал «расплываться». Это было единственное выражение, которое пришло ему на ум, когда он попытался определить странное поведение шара. Катясь по зеленому сукну, шар все больше и больше размывался и терял четкие очертания. Казалось, по столу катится не один, а много шаров, частично переходящих друг в друга. Мистеру Томпкинсу и раньше нередко случалось наблюдать подобные явления, но сегодня он не брал в рот ни капли виски и не мог понять, что происходит. «Ну что ж, — подумал он, — посмотрим, как эта размазня попадет в другой шар».
Игрок, очевидно, был хороший: катившийся шар ударился прямо в лоб другому. Раздался стук, и оба шара разлетелись по всем направлениям. Да, это было очень странно: на столе было уже не два слегка размазанных шара, а бесчисленное множество шаров, очень смутных и размазанных, которые катились в разные стороны в пределах 180 градусов от направления первоначального удара. Все это напоминало скорее какую-то волну, разбегавшуюся от точки столкновения шаров. Правда, как заметил мистер Томпкинс наибольший поток шаров был направлен все-таки в сторону первоначального удара.
— Вы наблюдаете здесь квантовомеханическое явление, — послышался знакомый голос, и мистер Томпкинс увидел рядом с собой профессора.
— А! Матрицы! — саркастически произнес мистер Томпкинс.
— Или скорее неопределенность движения, — поправил его профессор. — Хозяин бильярдной собрал здесь несколько предметов, которые, если можно так сказать, страдают «квантовой слоновой болезнью». Все природные тела подчиняются квантовым законам, но только так называемая квантовая постоянная, определяющая все эти явления, очень-очень мала — ее численная величина имеет двадцать семь нулей после запятой. А для этих шаров постоянная гораздо больше — около единицы, и вы легко можете увидеть такие явления, которые наука обнаружила лишь с помощью весьма чувствительных и тонких методов наблюдения.
Тут профессор на мгновение задумался.
— Я не хочу лезть не в свое дело, — продолжал он, — но хотел бы я знать, где он достал такие шары. Строго говоря, они не могут существовать в нашем мире, потому что для всех тел нашего мира квантовая постоянная имеет одно и то же небольшое значение.
— А может, это импортные шары, из какого-нибудь другого мира? — предположил мистер Томпкинс.
Но профессор этим не удовлетворился и остался полон подозрений.
— Вы заметили, как размазываются шары? — спросил он. — Это значит, что их положение на столе не вполне определенно. В лучшем случае, вы можете сказать, что шар «в основном тут», но «отчасти и в других местах».
— Это очень странно, — пробормотал мистер Томпкинс.
— Наоборот, — возразил профессор, — это совершенно естественно в том смысле, что это постоянно происходит с любым материальным телом. Только из-за ничтожной величины квантовой постоянной и неточности обычных методов наблюдения люди этой неопределенности не замечают и приходят к ошибочному заключению, будто и положение и скорость — величины всегда определенные. На самом же деле до некоторой степени неопределенны и положение и скорость, и чем точнее определена одна из этих величин, тем более размазана другая. А квантовая постоянная просто устанавливает соотношение между этими обеими неопределенностями. Смотрите, сейчас я точно ограничу положение шара, заключив его внутри треугольника.
Как только шар очутился внутри деревянного треугольника, вся охватываемая им площадь заполнилась блеском слоновой кости.
— Видите! — сказал профессор. — Я определил положение шара с точностью до размеров треугольника, то есть до нескольких сантиметров. Это привело к значительной неопределенности скорости, и шар теперь быстро движется в пределах этой площади.
— И его нельзя остановить? — спросил мистер Томпкинс.
— Нет, это физически невозможно. Любое тело в замкнутом пространстве обладает некоторым движением. Мы, физики, называем его нулевым движением. Так, например, движутся электроны в атоме.
Пока мистер Томпкинс смотрел, как шар мечется в треугольнике наподобие тигра в клетке, случилось нечто еще более странное. Шар попросту «просочился» сквозь стенку треугольника и в следующий момент уже катился по столу.
Самое странное заключалось в том, что он не перепрыгнул через деревянную стенку, а прошел сквозь нее, не отрываясь от стола.
— Ну вот, — сказал мистер Томпкинс, — ваше нулевое движение сбежало. И это тоже по вашим правилам?
— Конечно, — ответил профессор. — Больше того, это одно из самых любопытных следствий квантовой теории. Невозможно удержать тело в замкнутом пространстве, если только оно обладает энергией, достаточной для движения после преодоления стенки. Рано или поздно любой предмет должен «просочиться» и сбежать.
— Ну, больше я в зоопарк не ходок, — решительно сказал мистер Томпкинс, живо представив себе львов и тигров, «просачивающихся» сквозь свои решетки.
Потом ему пришло в голову, что «просочиться» на манер средневекового привидения может и его автомобиль, надежно запертый в гараже.
— А сколько времени должно пройти, — спросил он, — чтобы автомобиль, сделанный не из этой штуковины, а из обыкновенной стали, «просочился» сквозь стену, скажем, кирпичного гаража? Мне очень хотелось бы это увидеть.
Быстро проделав в уме какие-то вычисления, профессор тут же ответил:
— Для этого нужно 1 000 000 000… 000 000 лет.
Даже мистер Томпкинс, привычный к крупным цифрам банковских операций, потерял счет нулям в числе, которое назвал профессор. Во всяком случае, срок был так велик, что беспокоиться за судьбу автомобиля не приходилось.
— Ну хорошо, допустим, что я всему этому верю. Но как можно наблюдать все эти штуки, если нет под рукой таких вот шаров?
— Разумное возражение, — сказал профессор. — Конечно, квантовые явления нельзя наблюдать на больших телах, с которыми мы обычно имеем дело. Но квантовые законы становятся более заметными в применении к очень маленьким телам, например атомам или электронам. Для этих частиц квантовые эффекты так сильны, что обычная механика к ним просто неприменима. Столкновение двух атомов выглядит точь-в-точь так, как удар шара об шар, который вы только что видели, а движение электрона внутри атома очень напоминает движение того шара, который я положил внутрь треугольника.
— И часто атомы сбегают из гаража? — спросил мистер Томпкинс.
— Да, частенько. Вы, конечно, слышали о радиоактивных веществах, атомы которых самопроизвольно расщепляются, испуская очень быстрые частицы. Такой атом, или, вернее, его центральная часть — ядро, вполне аналогичен гаражу, где стоят автомобили, то есть другие частицы. И они убегают, просачиваясь сквозь стенки ядра, иногда они и секунды не задерживаются внутри. Одним словом, в ядрах квантовые явления — самое обычное дело.
Мистер Томпкинс чувствовал большую усталость после всех этих разговоров и рассеянно глядел по сторонам. Его внимание привлекли большие старинные часы в углу комнаты. Длинный старомодный маятник медленно качался.
— Я вижу, вас заинтересовали эти часы, — сказал профессор. — Это тоже не совсем обычный механизм. Но сейчас он уже устарел. Эти часы показывают, что люди думали раньше о квантовых явлениях. Их маятник устроен так, что его амплитуду можно изменять только на конечные величины — ступенчато. Теперь, однако, все часовщики предпочитают патентованные размазывающиеся маятники.
Мистер Томпкинс, глубоко обеспокоенный, внимательно поглядел на старинные часы с написанной на них непонятной формулой. Понемногу маятник стал размазываться, и скоро его туманные контуры заполнили всю комнату. Постепенно окружающие предметы стали размазываться, фигура профессора становилась все более смутной, уступая место знакомым очертаниям спальни мистера Томпкинса. Он начал просыпаться…
Охота в квантовых джунглях
…Однажды серым ноябрьским утром мистер Томпкинс дремал в постели. Вдруг он почувствовал, что в комнате кто-то есть. Оглянувшись, он увидел, что в кресле сидит его знакомый профессор и изучает какую-то карту, разложив ее на коленях.
— Так вы едете с нами? — спросил профессор, подняв голову.
— Куда? — не понял мистер Томпкинс. Он думал в это время о том, как профессор мог попасть к нему в комнату.
— Посмотреть слонов и всех остальных зверей квантовых джунглей! Недавно хозяин бильярдной, где мы с вами были, раскрыл мне тайну того места, откуда он получает слоновую кость для своих шаров. Видите этот район, который я обвел красным карандашом? Здесь как будто все подчиняется квантовым законам при очень большой квантовой постоянной. Туземцы думают, что там живут злые духи, и я боюсь, что мы не сможем найти себе проводников. Но если вы собираетесь ехать, поторопитесь. Корабль уходит через час, а нам еще нужно заехать за сэром Ричардом.
— А кто это такой? — спросил мистер Томпкинс.
— Разве вы о нем не слыхали? — удивился профессор. — Это знаменитый охотник на тигров. Он решил ехать с нами, когда я пообещал ему очень своеобразную охоту.
Они приехали в порт как раз вовремя. На корабль уже грузили длинные ящики с ружьями сэра Ричарда и специальными пулями из свинца, который профессор выписал из свинцовых рудников, неподалеку от квантовых джунглей. Пока мистер Томпкинс устраивался в каюте, корабль отошел от пристани.
В дороге время прошло незаметно. Скоро они сошли на берег в прелестном восточном городе — ближайшем к таинственной квантовой стране.
— Теперь, — сказал профессор, — нам нужно купить слона для путешествия в глубь страны. Не думаю, чтобы кто-нибудь из туземцев согласился ехать с нами, так что погонять слона придется самим. Этому надо научиться вам, мистер Томпкинс. Я буду занят научными наблюдениями, а сэр Ричард — оружием.
Томпкинсу стало немного не по себе, когда он увидел на базаре огромных слонов, одним из которых ему предстояло управлять. Сэр Ричард, хорошо разбиравшийся в слонах, выбрал одного побольше и спросил хозяина, сколько он стоит.
— Храп ханвек о хобот хам. Хагори хо, харахам о Хохохохи, — ответил туземец, сверкая белыми зубами.
— Он просит дорого, — перевел сэр Ричард, — но говорит, что это слон из квантовых джунглей и поэтому он стоит дороже. Берем?
— Конечно, — сказал профессор. — Слоны, которые иногда забредают из квантовых джунглей, гораздо лучше всех других. А для нас это особенно кстати — он будет себя чувствовать там как дома.
Мистер Томпкинс внимательно оглядел слона со всех сторон. Это был прекрасный, крупный экземпляра но по своему поведению ничем не отличался от слонов, которых он видел в зоопарке. Мистер Томпкинс повернулся к профессору.
— Вы говорите, что это квантовый слон, но с виду он самый обычный и ведет себя совсем не так, как те бильярдные шары из клыков его сородичей. Почему же он не размазывается во всех направлениях?
— Вы очень туго соображаете, — ответил профессор. — Он не размазывается благодаря своей большой массе: я же говорил, что вся неопределенность положения и скорости зависит от массы — чем больше масса, тем меньше неопределенность. Квантовая постоянная здесь, в джунглях, хотя и велика, но не настолько, чтобы сказаться на поведении такого крупного животного. Неопределенность положения квантового слона можно заметить, если очень внимательно вглядеться в его очертания. Посмотрите — поверхность шкуры как будто чуть зыблется. На животных поменьше квантовые эффекты, вероятно, будут сказываться заметнее.
— Хорошо, что мы едем не на лошадях, — заметил мистер Томпкинс. — Иначе никогда нельзя было бы точно сказать, где находится ваша лошадь — под вами или в соседней долине.
Профессор и сэр Ричард забрались в корзины, укрепленные на спине слона, а мистер Томпкинс, в своей новой роли погонщика, — на шею животного, и они двинулись. Дорога до квантовых джунглей должна была занять около часа, и мистер Томпкинс решил еще порасспросить профессора о квантовых явлениях.
— А скажите, пожалуйста, — спросил мистер Томпкинс, — почему так странно ведут себя тела с маленькой массой и каков вообще смысл этой вашей квантовой постоянной, о которой вы все время толкуете?
— О, это нетрудно понять, — ответил профессор. — Странное поведение предметов, которые вы видите в квантовом мире, объясняется просто тем, что вы на них смотрите.
— Что они, стесняются?
— Дело не в том… — холодно поправил профессор. — Наблюдая какое-нибудь движение, вы неизбежно его нарушаете. Ведь если вы что-то узнали о движении тела, это значит, что движущееся тело оказало какое-то действие на ваши органы чувств или на приборы, которые вы используете. А так как действие равно противодействию, то отсюда следует, что ваш прибор тоже подействовал на тело — так сказать, «испортил» его движение и сделал его скорость и положение неопределенным.
— Ну да, — сказал мистер Томпкинс, — если бы я ткнул пальцем в тот бильярдный шар, я, конечно, повлиял бы на его движение. Но я просто на него смотрел. Разве это тоже влияет?
— Конечно. В темноте вы шара не увидите, а если зажжете свет, то отраженные от шара лучи, благодаря которым он становится виден, влияют на шар — мы называем это световым давлением — и искажают его движение.
— А если я возьму очень точный и чувствительный прибор, разве я не могу добиться того, чтобы его влияние на движение тела было совсем незаметно?
— Вот так раньше и думали в классической физике, — отвечал профессор, — пока не был открыт квант действия. Тогда стало ясно, что воздействие на любой предмет не может быть меньше определенного предела, который и называется квантовой постоянной и обозначается символом h. В обычном мире квант действия очень мал и имеет значение только для таких легких частиц, как электроны, которые из-за своей крохотной массы чувствительны даже к таким ничтожным воздействиям. А в квантовых джунглях, к которым мы сейчас приближаемся, квант действия очень велик. Это грубый мир, в нем нет места нежностям. Если вы попробуете здесь погладить котенка, то он или ничего не почувствует, или вы сломаете ему шею первым же квантом вашей ласки.
— Очень мило, — заметил мистер Томпкинс задумчиво. — А когда никто не смотрит, я полагаю, тела ведут себя как следует, то есть так, как мы привыкли думать?
— Когда никто не смотрит, — отрезал профессор, — никто не может знать, как они себя ведут, и поэтому ваш вопрос не имеет никакого физического смысла.
— Ну, ну, — воскликнул мистер Томпкинс, — это уже больше похоже на философию!
— Если вам так больше нравится, можете называть это философией, — обиделся профессор, — но на самом деле это фундаментальный принцип современной физики — никогда не говорить о вещах, которых не знаешь. Все современные физические теории основаны на этом принципе, тогда как философы обычно пренебрегают им. Например, знаменитый немецкий философ Кант потратил довольно много времени, размышляя о свойствах «вещей в себе». Физик же признает только те свойства явлений, которые хотя бы в принципе доступны наблюдению. Все современные физики сходятся в этом. Вещи ненаблюдаемые хороши только для праздного ума — их можно навыдумывать сколько угодно, но нет способа проверить их существование или хотя бы использовать. Я бы сказал…
В этот момент раздался ужасный рев, и слон так рванулся, что мистер Томпкинс чуть не упал. Огромная стая тигров напала на слона одновременно со всех сторон. Сэр Ричард схватил ружье и выстрелил, целясь точно между глаз в ближайшего к нему тигра. В следующий момент мистер Томпкинс услышал крепкое охотничье ругательство: пуля прошла насквозь, не причинив тигру никакого вреда.
— Стреляйте еще! — крикнул профессор. — Стреляйте во все стороны, не старайтесь точно целиться. Здесь только один тигр, но он размазан вокруг нашего слона. Наша единственная надежда — гамильтониан!
Профессор тоже схватил ружье, и звуки выстрелов смешались с ревом квантового тигра. Мистеру Томпкинсу показалось, что прошла целая вечность, прежде чем все кончилось. Одна из пуль попала в цель, и, к его большому удивлению, тигр, вдруг оставшийся один, отлетел далеко в сторону, описав дугу в воздухе, и упал мертвым где-то за пальмами.
— А кто такой Гамильтониан? — спросил Томпкинс, когда все успокоились. — Какой-нибудь знаменитый охотник?
— Извините, — ответил профессор, — как вы недогадливы! В пылу битвы я начал пользоваться научным языком. Гамильтониан — это математическое выражение, описывающее квантовое взаимодействие между двумя телами. Я просто хотел сказать, что нужно выпустить как можно больше квантовых пуль — этим мы увеличиваем вероятность взаимодействия между пулей и тигром. Видите ли, в квантовом мире нельзя точно прицелиться и наверняка попасть. Из-за размазывания пули и цели всегда существует лишь вероятность попадания, которая никогда не равна единице. Мы выстрелили раз тридцать, пока попали в тигра, зато пуля ударила его так сильно, что зашвырнула за пальмы. Все это происходит и в нашем мире, но в гораздо меньших масштабах: заметить это можно лишь на таких мелких частицах, как электроны.
Вы, наверное, слышали, что каждый атом состоит из сравнительно тяжелого ядра и большого числа электронов, которые вокруг него вращаются. Вначале думали, что движение электронов вокруг ядер во многом подобно движению планет вокруг Солнца. Более глубокий анализ показал, однако, что для такой крохотной системы обычные представления о движении слишком грубы. Внутри атома важную роль играют взаимодействия того же порядка величины, что и элементарный квант действия, а в этом случае вся картина сильно размазывается. Движение электрона вокруг ядра во многих отношениях подобно движению нашего квантового тигра, окружившего слона со всех сторон.
— А можно выстрелить по электрону, как мы стреляли в тигра? — спросил мистер Томпкинс.
— О да, конечно, например освещая атом лучом света. И все происходит так же, как с нашим тигром: много квантов света может пройти сквозь место, занимаемое электроном, никак на него не повлияв, пока в конце концов один из них не вступит во взаимодействие с электроном и не выбросит его из атома. На квантовую систему нельзя повлиять чуть-чуть: она или вообще остается нетронутой, или сильно изменяется.
— Как тот котенок, которого в квантовом мире нельзя погладить, — заключил мистер Томпкинс.
— Смотрите — газели! Сколько их! — воскликнул сэр Ричард, поднимая ружье.
Действительно, из бамбуковой рощи показалось стадо газелей.
«Наверное, они дрессированные, — подумал мистер Томпкинс. — Они бегут шеренгой, как солдаты на параде. Может быть, это тоже какой-то квантовый эффект?»
Сэр Ричард приготовился стрелять, но профессор остановил его.
— Не тратьте патронов, — сказал он. — Очень мало шансов попасть в животное, когда оно представляет собой дифракционную картину.
— Что значит «животное»? — воскликнул сэр Ричард. — Там их по крайней мере десятки!
— Нет, нет! Там только одна маленькая газель, которая чего-то испугалась и бежит через бамбуковую рощу. Понимаете, «размазанные» тела обладают таким же свойством, как и обычный свет: проходя через правильный ряд отверстий (например, промежутков между стволами бамбука), они подвергаются дифракции, о которой вы, быть может, слышали в школе. Поэтому мы и говорим о волновых свойствах материи.
Но ни сэр Ричард, ни мистер Томпкинс никак не могли взять в толк, что бы могло означать таинственное слово «дифракция», и разговор заглох сам собой.
По дороге через квантовые джунгли путешественники встретили множество других интересных животных — например, квантовых комаров, положение которых в воздухе вообще почти невозможно было определить из-за их крохотной массы, и очень занятных квантовых обезьян. Потом вдали показалось нечто очень похожее на туземную деревню…
— Я не знал, что здесь живут люди, — удивился профессор. — Судя по шуму, у них там что-то вроде фестиваля. Прислушайтесь к этому непрерывному звону.
Туземцы плясали вокруг большого костра, но различить отдельные фигуры было очень трудно. Из толпы то и дело поднимались коричневые руки, размахивавшие колокольчиками всех размеров. По мере того как путешественники приближались, все вокруг, в том числе хижины и деревья, все больше размазывалось, а звон колокольчиков становился совершенно невыносимым. Мистер Томпкинс протянул руку, схватился за что-то и отшвырнул в сторону. Будильник разбил стакан, стоявший на тумбочке, и струя холодной воды заставила мистера Томпкинса очнуться. Он вскочил и стал поспешно одеваться. Через полчаса он должен был быть в банке.
3-я часть Размышления
Глава тринадцатая
Возникновение научного метода ♦ Сущность и развитие научного метода ♦ Истинность и полнота научной картины мира ♦ Наука и человечество ♦ Границы научного метода ♦ Наука и искусство ♦ Будущее науки
Недавно один физик в пылу спора заявил: «В принципе, даже для описания такой сложной системы, как человек, достаточно знать закон Кулона и уравнения квантовой механики».
Такие утверждения в науке не новость. Чтобы поднять Землю, Архимеду было достаточно рычага, а Лаплас брался предсказать будущее мира, если ему дадут начальные координаты и импульсы всех частиц во вселенной. И хотя такая вера в законченность и всемогущество науки всегда привлекательна, полезно все-таки помнить предостережение Роджера Бэкона, которое сегодня так же верно, как и семьсот лет назад: «Если бы человек жил в смертной юдоли даже тысячи веков, он и тогда бы не достиг совершенства в знании; он не понимает теперь природы мухи, а некоторые самонадеянные доктора думают, что развитие философии закончено!»
Роджер Бэкон (1214–1292) — францисканский монах, учился и преподавал в Оксфорде — в одном из первых университетов мира, который был основан незадолго до его рождения.
«Существуют четыре величайших препятствия к постижению истины, — писал он. — Они мешают всем и каждому мудрому человеку и едва позволяют достичь подлинной мудрости. А именно: пример жалкого и недостойного авторитета, постоянство привычки, мнение несведущей толпы и прикрытие собственного невежества показной мудростью».
Учение Роджера Бэкона пришлось не по душе отцам церкви, и они на 17 лет заточили его в тюрьму.
Это была эпоха крестовых походов, время расцвета религиозных вероучений и слияния их с философией и христианской мистикой. Основой образования стала теология, жития святых — морально-этическими образцами, а значение церкви выросло настолько, что папы оспаривали у королей права на светскую власть. Казалось, ничто не предвещало крушения всей системы средневековых ценностей, и тем не менее религиозная вера вскоре уступила место научному знанию, а мистическое прозрение — рациональному опыту.
Мы являемся свидетелями расцвета новой системы ценностей, которая ничего не принимает на веру и в основе которой лежит наука. Могущество науки поражает даже искушенный ум: она расщепила атомное ядро, достигла Луны, открыла законы наследственности…
Но в обстановке всеобщего восхищения не всегда понимают, в чем суть научного метода, причины его могущества и тем более не представляют его границ. Еще не осознана наука о науке, и неизвестно, существует ли она вообще. Но, даже не зная законов развития науки, всегда интересно проследить ее истоки и характерные особенности. Это поможет нам лучше понять место и роль квантовой механики в общей системе человеческих знаний.
Возникновение научного метода
Мы утратили знания древнейших времен, до нас дошли только их осколки. Но они бессистемны, чужды нам по духу и кажутся наивными. У истоков нынешней науки стоят древние греки. Они наши предшественники не только по времени, но — что самое главное — по духу. Греки изобрели доказательство. Ни в Египте, ни в Месопотамии, ни в Китае такая идея не возникла, быть может, потому, что все эти государства были основаны на тирании и безусловном подчинении авторитетам. В таких условиях даже сама мысль о возможности разумных доказательств кажется крамольной.
В Афинах впервые за всю мировую историю возникла республика. Не надо ее особенно идеализировать — она расцвела на труде рабов. Тем не менее в Древней Греции сложились условия, при которых стал возможен свободный обмен мнениями, и это привело к небывалому расцвету наук. Появились зачатки научного метода, с помощью которого греки попытались построить цельную картину мира.
В средние века потребность рационального познания природы совершенно угасла рядом с попытками осмыслить место человека в мире в рамках различных религиозных вероучений. В продолжение почти десяти веков религия давала исчерпывающие ответы на все вопросы бытия. Эти ответы не подлежали не только критике, но даже обсуждению, и разум находился в безусловном подчинении у веры.
Сочинения Эвклида были переведены на латинский язык и стали известны в Европе в XII веке. Однако в то время их воспринимали просто как совокупность остроумных правил, которые надлежало заучить наизусть — настолько они были чужды духу средневековой Европы, привыкшей верить, а не искать корней истины. Но объем знаний стремительно рос и их уже не удавалось согласовать с направлением средневековых умов.
Конец средневековья обычно связывают с открытием Америки в 1492 году. Некоторые указывают даже более точную дату: 13 декабря 1250 года — день, когда в замке Флорентино близ Лючеры умер король Фридрих II Гогенштауфен (Барбаросса). Конечно, не следует относиться к этим датам всерьез, но несколько таких дат, взятых вместе, создают несомненное ощущение достоверности перелома, который произошел в сознании людей на рубеже XIII и XIV веков. В истории этот период назвали Возрождением.
Подчиняясь внутренним законам развития и без видимых на то причин, Европа всего за два века возродила зачатки древних знаний, которые до этого более десяти веков находились в небрежении и которые впоследствии получили название научных.
В период Возрождения в умах людей произошел поворот от стремления осознать свое место в мире к попыткам понять его рациональное устройство без ссылок на чудеса и божественное откровение. Вначале переворот носил аристократический характер, но изобретение книгопечатания распространило его на все слои населения.
Суть перелома — освобождение от давления авторитетов и переход от средневековой веры к знанию нового времени. Церковь всячески противилась новым веяниям, она строго судила философов, которые признавали, что есть вещи истинные с точки зрения философии, но ложные с точки зрения веры, «как будто в противовес истине, заключенной в священном писании, может находиться истина в книгах язычников».
Если отвлечься от политических страстей того времени, в которое жил Галилей, становится ясно, что судили его не только за сочувствие системе Коперника. Такие же мысли столетием раньше отстаивал кардинал Николай Кузанский (1401–1464) и остался безнаказанным. Но в то время как ученый кардинал утверждал ее, ссылаясь на авторитеты, как то и подобает верующему, Галилей ту же мысль доказывал, как того требует наука, то есть предлагал проверить каждому, опираясь лишь на опыт и здравый смысл. Именно этого не могли простить ему служители церкви.
Но рухнувшую плотину веры починить уже было нельзя, и освобожденный дух стал искать новые пути для своего развития.
После долгого заточения под гнетом авторитетов бросились в другую крайность: начался период всеобщего сомнения. Сомневались во всем: в том, что чувства дают правильное представление о мире, и в том, что сознание способно уберечься от заблуждений мнений и чувств, сомневались даже в реальности своего собственного существования.
То было время, когда утратили опору в вере, но еще не обрели уверенности в разуме. Более того, казалось, что несовершенство ума отодвинуло надежды когда-либо достигнуть истины на дороге познания. Лишь постепенно разум набирал силу и шаг за шагом создал метод, который мог уберечь его от собственных ошибок.
Принципы научного знания и метод, позволяющий их осуществить, начали искать задолго до возникновения современной науки. Уже в XIII веке Роджер Бэкон в своем трактате «Opus tertium» писал:
«Существует естественный и несовершенный опыт, который не сознает своего могущества и не отдает себе отчета в своих приемах: им пользуются ремесленники, а не ученые… Выше всех умозрительных знаний и искусств стоит умение производить опыты, и эта наука есть царица наук…
Философы должны знать, что их наука бессильна, если они не применяют к ней могущественную математику… Невозможно отличить софизм от доказательства, не проверив заключение путем опыта и применения».
В 1440 году Николай Кузанский написал книгу «Об ученом невежестве», в которой настаивал, что все познания о природе необходимо записывать в цифрах, а все опыты над нею производить с весами в руках.
Утверждение новых взглядов происходило медленно. Например, хотя арабские цифры уже в X веке вошли во всеобщее употребление, но даже в XVI веке повсеместно вычисления производили не на бумаге, а с помощью особых жетонов, которые были, еще менее совершенны, чем наши конторские счеты.
Настоящую историю научного метода принято начинать с Галилея и Ньютона. Согласно той же традиции Галилео Галилей (1564–1642) считается родоначальником экспериментальной физики, а Исаак Ньютон (1643–1727) — основателем теоретической физики. Конечно, в их время не было такого разделения единой науки физики на две части, не было даже самой физики — она в то время называлась натуральной философией. Но такое разделение имеет глубокий смысл: оно помогает понять особенности научного метода и, по существу, эквивалентно делению науки на опыт и математику, которое сформулировал Роджер Бэкон.
Сущность и развитие научного метода
Мы настолько привыкли отождествлять понятия «знание» и «наука», что не мыслим себе иного знания, кроме научного. В чем его сущность и особенности?
Сущность научного метода можно объяснить довольно просто: этот метод позволяет добыть такие знания о явлениях, которые можно проверить, сохранить и передать другому.
Отсюда сразу следует, что наука изучает не вообще всякие явления, а только те из них, которые повторяются. Ее главная задача — отыскать законы, согласно которым эти явления протекают. В разное время наука достигала этой цели по-разному.
Древние греки внимательно наблюдали явления и затем с помощью умозрения пытались проникнуть в гармонию природы силой интеллекта, опираясь только на данные чувств, накопленные в памяти.
В период Возрождения стало очевидно, что поставленная цель не может быть достигнута только с помощью пяти чувств — необходимо изобрести приборы, которые есть не что иное, как продолжение и углубление наших органов чувств. При этом сразу же возникло два вопроса: насколько можно доверять показаниям приборов и как сохранить информацию, полученную с их помощью.
Вторая задача была вскоре решена изобретением книгопечатания и последовательным применением математики в естественных науках. Значительно труднее оказалось разрешить первый вопрос — о достоверности знаний, полученных с помощью приборов. По существу, он не решен окончательно до сих пор, и вся история научного метода — это история постоянного углубления и видоизменения этого вопроса.
Довольно скоро поняли, что показаниям приборов, как правило, можно доверять, то есть они отражают что-то реальное в природе, существующее независимо от приборов. (В конце концов убедились, например, в том, что пятна на Солнце — это пятна именно на Солнце, а не дефекты зрительной трубы, с помощью которой они были открыты.) В этот период расцвета экспериментальной физики были накоплены все те знания, на основе которых в конце прошлого века произошел мощный скачок техники.
Однако объем знаний стремительно рос и в начале нашего века привел к кризису в физике. Суть его заключалась в том, что в какой-то момент люди перестали понимать, как соотносить числа, полученные с помощью приборов, к реальным явлениям в природе. Именно в этот момент решающее значение приобрела теоретическая физика.
Причин кризиса было две. С одной стороны, приборы слишком далеко ушли от непосредственных ощущений человека, и поэтому интуиция, руководствуясь их данными, не давала никакой простой картины изучаемых явлений. Тем самым были исчерпаны возможности наглядной интерпретации данных опыта.
С другой стороны, не существовало логической схемы, которая помогла бы упорядочить научные факты и без ссылок на интуицию, привести к таким наблюдаемым следствиям, против которых не мог бы возразить даже здравый смысл.
Кризис преодолели на втором пути: по-прежнему доверяя показаниям приборов, изобрели новые понятия и новые логические схемы, которые научили по-новому относиться к этим показаниям. Решающую роль в такой ломке устоявшихся понятий сыграла квантовая механика. Она не только дала нам власть над совершенно новым миром атомных явлений, но и убедила в том, что показания приборов — это не простая фотография явлений природы: они не относятся к ней непосредственно, а лишь отражают и закрепляют числами наши представления о ней.
С течением времени эти знания совершенствуются и позволяют нам правильно предсказывать все более тонкие явления природы. Факт сам по себе удивительный, и мы его, вероятно, никогда не поймем, но коль скоро он стал известен — мы его используем.
С этим согласны теперь почти все физики. Однако, как и все люди, они хотят понять больше: насколько полна картина мира, нарисованная физикой? Вопрос этот не физический, а скорее философский. Он возникал во все времена, но впервые четко был сформулирован в диалогах Платона.
Платон уподобил ученых узникам, прикованным в пещере спиной ко входу так, что они не видят света, а только тени, движущиеся на противоположной стене. Он признавал, что даже в этих условиях, внимательно наблюдая движение теней, можно научиться предугадывать поведение тех тел, чьи тени видны на стене пещеры. Но знание, приобретенное таким способом, бесконечно далеко от того полного знания, которое приобретает освобожденный узник, выйдя из пещеры.
Платону нечего возразить. Окружающий мир и в самом деле богаче того, который мы в состоянии себе представить только на основе данных физики. Слепой от рождения может в совершенстве изучить оптику, но при этом он не будет иметь ни малейшего представления о том, что такое свет и, тем более, как выглядит богатство весенних красок. Когда мы вступаем в мир атомных явлений, все мы становимся похожими на слепых от рождения. Мы начисто лишены «атомного зрения» и вынуждены двигаться в непривычном мире только ощупью.
Число подобных аналогий можно легко умножить, и каждая из них учит физиков быть скромнее. В XIX веке природу мечтали объяснить; в XX — стремятся лишь описать. Теперь мы понимаем, что вопросы о полноте физических знаний и о сущности явлений лежат вне физики и не могут быть разрешены ее средствами. Физика изучает только законы, по которым эти явления происходят. И в этом смысле она в точности следует «теории теней».
Но даже такое ограниченное знание о природе, насколько оно истинно?
Истинность и полнота научной картины мира
Вопрос этот не может быть разрешен логически: мы верим в науку, поскольку она позволяет нам правильно предсказывать явления природы и не зависит от произвола познающей личности. Мы можем сомневаться в структуре ее образов — они зависят от способа общения. Но мы теперь с достоверностью знаем, что все земные и небесные тела построены из одних и тех же элементов и примерно в тех же пропорциях. Мы уверены даже, что законы природы одинаковы во всей вселенной, и, следовательно, атом натрия всегда излучает одну и ту же D-линию, находится ли он на Земле или на Сириусе. Теперь это признают почти все, и никто не сомневается в истинности этих знаний. Сомнения возникают тогда, когда мы на основании твердо установленных, но частных фактов пытаемся создать общую и непротиворечивую картину мира, согласную со всей совокупностью данных опыта и общей природой человеческого сознания. Наиболее часто возникает вопрос: насколько однозначна форма физических законов?
Категорического ответа на этот вопрос не существует. Те, кто знаком с историей науки, знают, что в некоторые периоды ее развития действительно бок о бок существовали две теории, каждая из которых считала себя истинной, и обе одинаково хорошо объясняли известные в то время явления. Однако та же история рассказывает, что с течением времени новые опыты выбирали из двух теорий только одну, либо же на новом этапе обе они сливались воедино на основе новых, более высоких принципов, как это случилось с корпускулярной и волновой теорией света.
Факты и понятия науки могут показаться случайными хотя бы потому, что установлены в случайное время случайными людьми и часто при случайных обстоятельствах. Но, взятые вместе, они образуют единую закономерную систему, в которой число связей настолько велико, что в ней нельзя заменить ни одного звена, не затронув при этом всех остальных. Под давлением новых фактов система эта непрерывно изменяется и уточняется, но никогда не теряет цельности и своеобразной законченности. Взятая в целом, система научных понятий — продукт длительной эволюции: в течение многих лет старые звенья в ней заменялись новыми, более совершенными, а совсем новые понятия всегда возникали с учетом и на основе прежних. Одним словом, наука — это не застывшая мертвая схема, а живой развивающийся организм. И хотя все понятия науки — произвольные творения человеческого разума, тем не менее они случайны настолько же, насколько случайна сама разумная жизнь в природе.
В одном из фантастических рассказов Рея Брэдбери герой на машине времени отправился в далекое прошлое и во время короткого визита туда нечаянно раздавил там маленькую бабочку. Когда он вернулся обратно, то не узнал мира, который оставил уезжая: оказалось, что его невольное и на первый взгляд незначительное вторжение в ход биологической эволюции полностью изменило все ее конечные результаты.
Очевидно, пример этот не более чем эффектная крайность, извинительная для фантаста. Нет слов, все в природе взаимосвязано. Однако не такой жестокой причинностью, граничащей с детерминизмом, а более изобретательно и гибко — на манер статистической причинности квантовой механики. Тем не менее пример этот лишний раз предостерегает от любого вторжения в природу, ибо никто не может предугадать отдаленных последствий подобных действий.
Эволюция системы научных понятий — такой же бесконтрольный, но закономерный процесс, как и эволюция животного мира. Можно представить себе его другим в частностях, можно удивляться его странным прихотям, но нельзя вообразить его целиком иным. Мы не знаем, как возникли первое понятие и первый организм и что было бы, если бы они были другими. Но мы знаем, что каждый новый шаг эволюции зависел от всех предыдущих. Поэтому мы можем легко вообразить себе лошадь с лапами тигра или атом в виде бублика, но представить себе иными весь животный мир и всю систему научных понятий нам не под силу: и процесс биологической эволюции, и процесс формирования научных знаний подчиняется своим внутренним законам, изменить которые мы не можем и познать которые пока не удалось.
Мы рождаемся в мире сформировавшихся видов и установившихся понятий. Мы можем вывести новую породу лошадей или заменить одно понятие другим, которое больше соответствует научной истине. Однако вопрос об истинности или ложности всей системы человеческих знаний лежит вне сферы сознания и не может быть разрешен его силами. Более того, вопрос этот лишен смысла. Наука создана человеком и для человека, и вся система ее понятий придумана так, что она соответствует природе человеческого сознания. Конечная же цель понятий — предсказывать и объяснять явления, воздействующие на наши органы чувств или на их продолжение — приборы.
Почти наверное где-то во вселенной существуют разумные существа с иными органами чувств и другой структурой сознания, чем у нас. Быть может, их система понятий в корне отлична от нашей. Но даже если мы будем в состоянии понять ее настолько, чтобы сравнить с собственной системой, мы не сможем заключить из этого сравнения, что она ложна. Наоборот, она всегда истинна, если дает своим органам чувств правильные предсказания. Наши научные знания о мире — это реальные тени реальных явлений природы. Тени, которые они отбрасывают, освещенные светом нашего сознания. И точно так же, как один и тот же предмет отбрасывает различные тени в зависимости от угла, под которым он освещен, — точно так же система научных знаний, созданная разумной жизнью другой планеты, может отличаться от нашей. Быть может, когда-нибудь, не очень скоро, мы сможем сравнить между собой эти «сознательные тени» и, как узник Платона, вырвавшийся из пещеры, восстановить по ним истину во всей полноте и блеске. Точно так же, как по нескольким плоским чертежным проекциям детали опытный мастер может изготовить ее целиком. Но пока этого не случилось, мы должны углублять нашу теперешнюю науку: при всем своем несовершенстве это пока единственный способ проникнуть в глубь наблюдаемых явлений.
Мир объективен и существует независимо от нашего сознания. Ему нет никакого дела до того, как мы, часть этого мира, представляем себе внутренние механизмы его внешних проявлений. Это важно только для нас самих. Весь вопрос в другом: как далеко мы сможем продвинуться на этом пути. И до каких пор мы сможем уточнять наши представления о причинах наблюдаемых явлений. Вместо вопроса о физической реальности мы должны решить вопрос о границах научного метода. Вопрос, который после изобретения квантовой механики стал особенно актуален.
Наука и человечество
Принято считать, что наука (в нынешнем понимании этого слова) существует не более 300–400 лет. За такой ничтожный срок она полностью изменила образ жизни цивилизованных народов, их отношение к миру, способ мышления и даже моральные категории.
Главная черта новой философии жизни — ощущение непрерывных движений в мире и, как результат этого ощущения, стремление узнать и понять окружающий мир, чтобы должным образом ответить на его изменения. Современный человек скептически относится к раз навсегда установленным принципам, он не верит в окончательность любого знания и каждую минуту жизни находится в состоянии поиска оптимальных решений. Ненасытная жажда знаний, пробудившаяся впервые в эпоху Возрождения, не угасла до сих пор. Научный метод преобразовал мир, в котором мы живем: он населил его машинами, и мы к ним относимся часто как к живым существам; он впервые накормил людей и защитил их от болезней, а это привело к небывалому росту человечества в целом и даже к росту отдельного человека.
На основе успехов научного метода возникла и укрепилась новая вера — вера в науку, которая иногда напоминает средневековую веру в божественное откровение. Поворот в умах, вызванный наукой, можно сравнить только с великими религиозными переворотами: буддизмом, христианством, исламом. Наука и формально и по существу пришла на смену религии: от нее ждут ответов на все вопросы жизни, ее приговоры считают непогрешимыми, среди ее служителей ищут образцы для подражания, а число ее адептов растет быстрее, чем армия буддийских монахов на Востоке в старые времена. Но в отличие от прежних религий, которые подчиняли одних людей другим, наука дает власть человеку над природой.
Страны Запада, воспринявшие эту новую религию, далеко обогнали прежде цветущие страны Востока. Все это оказалось возможным благодаря простому открытию: суть многих явлений природы можно записать в виде чисел и уравнений, устанавливающих связи между числами. Как и всякий последовательный метод, научный метод имеет свои издержки, область действия и границы применимости.
Сидеть на берегу моря и смотреть, как Солнце совершает по небу свой круг, не считалось в древности занятием, недостойным мужа. С тех пор многое изменилось. Индуктивные науки пришли на смену чистому умозрению и принялись «проверять алгеброй гармонию». Наука стала на прочное основание опыта, но утратила черты спокойной мудрости и неторопливого созерцания. На это можно сетовать, но изменить уже нельзя.
В пору ее становления наукой занимались на свой страх и риск преданные ей одиночки. Долгое время ее результаты не считали обязательными для всех: даже в середине прошлого века Фарадей ратовал за признание науки элементом всеобщего образования. В наше время наука стала массовой, а научная работа — самым обычным и часто прозаическим занятием. Из инструмента познания наука стала материальной силой, но вместе с этим она прикоснулась к человеческим страстям совсем не того высокого склада, каким она обязана своим возникновением.
Все это верно, все это так, но в век науки немыслимо отказаться от ее результатов только из моральных соображений: в стремлении к чистоте не следует преступать границ стерильности. Главное — чтобы музыканты хорошо играли, а пьют они при этом или нет — это уж как повезет. Наука пока что исправно несет свою службу: строит машины, кормит человечество, снабжает его энергией, защищает от болезней. Конечно, это не снимает моральной ответственности с ученых за их — иногда смертоносные — открытия.
Как известно, в процессе биологической эволюции всегда возникают мутации, часть из которых быстро закрепляется и вытесняет менее приспособленные. Но другая их часть консервируется впрок и проявляется лишь тогда, когда изменившиеся внешние условия грозят уничтожить биологический вид. Именно эти скрытые до поры мутации спасли в свое время от гибели и человеческий род. Но эволюция не прекратилась — она лишь изменила свои формы: на протяжении тысячелетий тело человека осталось почти без изменений, зато его сознание изменилось неузнаваемо и необратимо. В этих условиях наука служит источником новых идей, которые, быть может, спасут человечество в грядущих катастрофах.
Научный метод — это соглашение между людьми, достаточно плодотворное, чтобы стать всеобщим. На основе этого соглашения вырос и развивается своего рода коллективный разум — если и не бессмертный, то сравнительно долговечный. Как долго он проживет и где границы научного метода — пока неясно, однако то, что они существуют, несомненно.
Границы научного метода
Человека всегда занимали «вечные вопросы»: о жизни и смерти, о добре и зле, о боге и вечности, о конечной цели бытия и нашем месте во вселенной. Религия не смогла ответить на эти вопросы, она лишь на время успокоила стремление их разрешить и дала краткое утешение в забвении человеческих сложностей и проблем земного бытия.
Наука тоже не приспособлена для ответов на вопросы о смысле жизни — у нее более скромные задачи. В ослеплении успехами точных наук об этом часто забывают и упускают из виду ту простую возможность, что будущим поколениям людей наш рационализм и вера в науку будут столь же смешны и непонятны, как для нас обряды египетских жрецов: безгранично лишь само познание, а не его исторические формы.
Наука в состоянии познать только те явления, свойства которых можно оценить числом. Работу гипнотизера нельзя описать математическими формулами, и тем не менее результаты ее несомненны и воспроизводимы. Достижения индийских йогов — экспериментальный факт, многократно проверенный. Однако эти феномены не могут стать объектами точной науки, поскольку они не поддаются количественному описанию с помощью чисел и формул. Точно так же явления телепатии не станут достоверными до тех пор, пока не подтвердятся научными опытами. Наше время признает только и только такие доказательства; точно так же, как в средние века принимали во внимание лишь доказательства со ссылками на авторитеты.
Не стоит огорчаться по этому поводу: ведь это означает просто, что мир богаче и сложнее, чем его образ, даваемый наукой. Улыбка ничего не стоит, но, к счастью, ее нечем заменить. Это всегда полезно помнить, чтобы не погрязнуть в ученом невежестве. И те из ученых, кто пытается представить себе мир в виде бесконечных таблиц чисел и отрицает реальность многих явлений природы только на том основании, что они необъяснимы средствами науки, — эти ученые не очень отличаются от попов, которые при виде паровоза закрывали глаза, топали ногой и приговаривали: «Сгинь, сатана!» Для таких ученых гений и убийца неразличимы, ибо можно строго научно доказать, что они состоят из совершенно одинаковых молекул.
На фоне такого рода рассуждений квантовая механика, о которой мы так много теперь узнали, должна показаться совсем простой наукой. В самом деле, об атоме водорода мы знаем так много, что можем предсказать все его наблюдаемые свойства. Значительно труднее, но все-таки можно рассчитать свойства молекулы водорода. Но уже свойства молекул белка мы предсказать не в состоянии. Белков не так уж много, однако из них построен каждый человек во всей его неповторимости.
Одним словом, наука — это полезно и даже необходимо, но нельзя обращать нужду в добродетель и подчинять ей все только на том основании, что, без нее обойтись пока нельзя.
Наука и искусство
Нигде так отчетливо не видна ограниченность науки, как при попытках ее методами понять секрет искусства. Наука «все знает» о рояле: число, качество и длину струн, породу дерева, состав клея и мельчайшие особенности строения. И тем не менее она не в состоянии объяснить, что происходит с этим полированным ящиком, когда к нему подходит большой артист. Быть может, это и не нужно: человеку, который плачет над книгой, по большей части все равно, какими средствами добился этого автор. Конечно, он может прочесть затем критический труд вдвое толще книги, его поразившей, но все это напоминает препарирование трупов в анатомичке: специалистам оно необходимо, а большинству дилетантов неприятно. Искусство всегда охраняло непосредственную истину чувственных восприятий от настойчивых вторжений науки. Его всегда ценили именно за способность «напоминать нам о гармониях, недоступных для систематического анализа».
Каждый при желании может понять, как устроен атомный котел, даже не увидев его. Но никакими силами нельзя объяснить человеку, что такое обаяние, если он сам ни разу не испытал на себе его воздействия.
Причина могущества науки — в ее всеобщности: ее законы свободны от произвола отдельных людей, она отражает лишь коллективный их опыт, независимый от возраста, национальности и настроения. Секрет искусства — в его неповторимости: сила его воздействия зависит от всего прошлого опыта человека, от богатства его ассоциаций, от неуловимых переходов настроения, от случайного взгляда, слова или прикосновения — от всего того, что составляет силу индивидуальности, красоту преходящего и власть неповторимого.
Высшее достижение ученого — если результаты его работы подтвердятся, то есть кто-то другой повторит их в дальнейшем. В искусстве повторение равносильно смерти, и настоящий артист умирает на сцене каждый раз по-новому.
Известны случаи, когда люди сочиняли симфонии без знания музыкальной грамоты. Симфонии могли быть непривычными, но имели право на существование, коль скоро хоть кому-то нравились. В науке такое положение немыслимо: в ней существует критерий истины, и слово «нравится» исключено из ее лексикона.
Истины в науке доказываются, а явления — объясняются. В искусстве они истолковываются: ему чужды логические рассуждения — оно заменяет строгие доказательства непосредственной убедительностью образов.
Как правило, наука всегда может объяснить, почему хороша эта формула или плоха та теория. Искусство позволяет лишь почувствовать очарование музыки и блеск сонета — и никогда ничего не объясняет до конца.
Наука началась тогда, когда в хаосе случайных фактов научились выделять простые закономерности. Но лишь там, где при сложении простых и понятных вещей возникает внезапно ощущение чуда, — только там и начинается искусство.
Наука основательна и нетороплива: она годами решает свои задачи, многие из которых часто переходят из поколения в поколение. Она может позволить себе эту роскошь: в науке изобретен однозначный способ записи и хранения добытых фактов. В искусстве интуитивно точный мир образов живет мгновение. («Герои одного мгновения» — так иногда называют великих актеров). Однако оно будит в сердцах людей отзвук, который не угасает годами, а иногда круто меняет всю их дальнейшую жизнь. «Мгновение, остановись, ты прекрасно!» — это желание Фауста может выполнить только магия искусства. Благодаря ему даже через много лет память человека может с пугающей ясностью восстановить невыразимые словами оттенки давних мыслей и настроений.
Несмотря на кажущуюся хрупкость и неоднозначность образов искусства, оно долговечнее и древнее науки. Эпос о Гильгамеше и поэмы Гомера волнуют нас до сих пор потому, что они о чем-то главном в человеке, что не изменилось в нем на протяжении тысячелетий. Наука же едва успевает закреплять те новые возможности мышления, которые открыты совсем недавно. Читать физические книги прошлого века сейчас почти невозможно — настолько они устарели и настолько изменился с тех пор весь стиль научного мышления. Значение научных трудов определяется не их долговечностью, а их плодотворностью: если в свое время они помогли развитию науки — с них довольно.
Можно и дальше искать и находить бесчисленные оттенки различий между искусством и наукой — предмет этот неисчерпаем. Однако польза такого занятия сомнительна: на поверку они различаются между собой не по существу, а лишь по методам познания окружающего мира и человеческой природы. В Древней Греции их не различали и называли одним словом: τεχνη — что означало «умелость», «опытность», «изощренность» (отсюда же — «техника»).
Уже давно поэты мечтают не просто о поэзии, а о «поэзии мысли». Ученые, со своей стороны, берутся объяснить желающим «поэзию в науке». И те и другие вышли, наконец, из своих укрытий, чтобы разрушить искусственные границы кланов и забыть давние споры о древности рода. Нет смысла спорить, какая рука важнее: левая или правая, хотя развиваются и работают они по-разному.
Актер понимает, что ему не достигнуть вершин мастерства, если он предварительно не овладеет наукой дикции, мимики и жеста. И лишь потом (если он талантлив!) он сможет из этих простых и понятных элементов неведомым ему самому способом создать нечто неповторимое и удивительное.
Точно так же ученый, даже овладевший ремеслом физика, еще не физик, если он доверяет только формулам и логике.
Все глубокие истины науки парадоксальны при своем рождении, и нельзя достигнуть их, опираясь лишь на логику и опыт.
Одним словом, настоящее искусство невозможно без самой строгой науки. Точно так же метод открытия глубоких научных истин лежит вне науки и целиком принадлежит сфере искусства. Но при этом всегда существуют границы научного анализа искусства и предел, который не позволяет постигнуть науку единым порывом вдохновения.
Существует очевидная дополнительность методов науки и искусства в процессе познания окружающего мира. Рабочий, повседневный метод науки — это анализ фактов и выяснение их причин, стремление «…найти вечный закон в чудесных превращениях случая», попытки «…отыскать неподвижный полюс в бесконечной веренице явлений». В искусстве преобладает бессознательный синтез, который в тех же «превращениях случая» находит единственные и неповторимые, а из той же «бесконечной вереницы явлений» безошибочно выбирает лишь те, которые позволяют почувствовать гармонию целого.
Лишь недавно отгремели никчемные споры о «физиках» и «лириках», непонятную запальчивость которых можно объяснить только недостаточной подготовкой спорящих. Процесс творчества (но не ремесла!) одинаков и в физике и в поэзии. У поэта вначале возникает неясное ощущение ритма, движения стиха, и лишь потом он находит (уже сознательно) подходящие формы и слова для его выражения. У физика сначала возникает смутная общая картина явления, о которой он часто даже не может рассказать словами. Лишь впоследствии он подвергает логическому анализу этот аморфный, умозрительный, но все-таки в какой-то мере цельный и синтетический образ, расчленяет его на понятия, закрепляет на языке формул и, наконец, проверяет опытом.
У разных ученых цепочка «образ — понятие — формула» устроена по-разному и различается по силе, быстроте и прочности… На эту цепочку влияет все: путь развития ученого, его прежние догадки и заблуждения, накопленные знания, чувство языка и даже его темперамент. У некоторых эта цепочка урезается. Например, существует много ученых, которых образы посещают весьма редко. Но те из них, которые владеют всей цепью взаимосвязей, на некотором этапе приобретают способность эстетической оценки конечных результатов науки. Для них понятия: красивая формула, изящные вычисления, остроумная гипотеза — звучат естественно и полны смысла. И для них искусство не только первоначальный толчок в науке, но одновременно и результат в высших ее проявлениях. Это не означает, конечно, что вместо знака интеграла они пишут скрипичный ключ, и только в плохих романах ученые-герои, слушая музыку, помнят, что в основе октавы лежат логарифмы.
Мир человеческих восприятий бесконечно разнообразен, но хаотичен и окрашен личными переживаниями. Человек стремится упорядочить свои впечатления и согласовать их с впечатлениями других. Для этого он изобрел науку и создал искусство. Именно это стремление стало общей побудительной причиной их возникновения. Их объединяет чувство удивления, которое они после себя оставляют: как возникла эта формула, эта поэма, эта теория и эта музыка. («Начало знания — удивление», — говорили в древности.)
Природа творчества едина во всех искусствах и науках. Она определяется интуитивной способностью группировать факты и впечатления окружающего мира таким образом, чтобы удовлетворить нашу эмоциональную потребность в чувстве гармонии, которое человек испытывает, выделив из хаоса внешних впечатлений что-то простое и законченное: статую из мрамора, поэму из слов, формулу из чисел. Это эмоциональное удовлетворение одновременно и первый критерий истинности созданного, которая, конечно, в дальнейшем проверяется: в науке — опытом, в искусстве — временем.
Будущее науки
Когда думают о будущем науки, как правило, представляют себе мир машин, кнопок, прозрачных куполов — одним словом, представляют себе мир вещей, которыми повелевает человек в чистом комбинезоне. Тем самым впадают в ту же ошибку, которую допускает большинство людей после беглого знакомства с квантовой механикой. Как правило, их поражают в ней конкретные, «грубые и зримые» факты: атомная бомба, атомный ледокол, атомная электростанция. Лишь очень немногие догадываются, что все эти достижения — довольно простые следствия квантовой механики. И удивляться надо не им, а изумительно простой и гармоничной системе научных идей атомной физики, благодаря которым стали возможны и ледокол, и электростанция, и, к сожалению, бомба.
Никто не может говорить о будущем науки без риска впасть в наивность или преувеличение. Можно легко доказать ограниченность научного метода в той области, где он неприменим, но нельзя предсказать его возможностей.
Несомненно, что научный способ мышления лишь одна из способностей человеческого сознания, которая, однако, до сих пор себя не исчерпала. Вполне вероятно, что в дальнейшем человек откроет в себе новые возможности познания окружающего мира и на этой основе лучше поймет свое место в нем. Но это новое, более совершенное знание почти наверное будет включать в себя как составную часть все главные достижения науки.
Можно только гадать, каким будет это новое знание: человек всегда может больше, чем умеет. Быть может, со временем в человеке с новой силой разовьется способность синтетического познания, которая отличала античных мудрецов и которая сейчас почти угасла на фоне успехов научного анализа. Быть может, в дальнейшем интуиция из инструмента научного предвидения станет орудием научного доказательства. В этом нет ничего невероятного: ведь мы же доверяем глазу сортировщика алмазов, а он отличается от обычного только длительной тренировкой. Быть может, точно так же со временем научатся воспитывать интуицию и добьются ее воспроизводимости у разных людей. Если это действительно удастся, то сами собой отпадут вопросы о неоднозначности научных понятий и вообще весь громоздкий аппарат логики. Последствия такой революции в мышлении предсказать невозможно.
В гипотезах о будущем науки недостатка нет: существует их полный спектр — от безудержного энтузиазма до самого мрачного пессимизма. Одни предрекают скорую гибель всей нашей цивилизации от неумелого пользования ею же вызванными силами. Другие верят, что человечество будет жить даже тогда, когда угаснет наше Солнце.
Но как бы ни развивалось человечество — если оно останется живо, — оно всегда с удивлением будет обращаться мыслью в наш бурный и стремительный век науки точно так же, как мы теперь вспоминаем эпоху Возрождения и времена античных мудрецов.
Заключение
В юности меня всегда поражал такой факт: каким образом чтение хороших книг — процесс нематериальный — неузнаваемо меняет весь облик человека: его речь, улыбку, выражение лица и глаз, даже походку и жесты. Лишь постепенно я понял, что это одна из главных и до сих пор нерешенных загадок человеческого сознания.
Когда дикие кочевники клеймили табуны раскаленным железом, они не знали, что спектр его излучения подчиняется формуле Планка. Купая лошадей в реке, они не представляли себе молекул воды в виде уголка в 109 градусов 30 минут. И, выходя из реки, не задумывались над тем, что загаром своих тел они обязаны фотонам.
Сейчас, тысячелетия спустя, в природе все осталось по-прежнему: Солнце каждый день всходит на востоке, вода в реках замерзает при нуле градусов Цельсия, а раскаленный металл остывает по вечным законам термодинамики.
Только теперь мы обо всем этом знаем. Быть может, наше знание не сделало нас счастливее (ибо сказано: «Во многой мудрости много печали»), но знание это необратимо, оно элемент культуры, которая единственно отличает нас от первобытных пастухов и от благ и бремени которой почти невозможно теперь отрешиться. Совокупность знаний, которую мы называем культурой, настолько изменила образ жизни и систему ценностей цивилизованных народов, что многие даже склонны относить их к другому биологическому виду, чем те дикие прародители, от которых все мы произошли.
Сейчас вся эта огромная масса знаний грозит раздавить человечество, вызвавшее ее к жизни. Часто можно услышать сентенции о том, что наука зашла в тупик, что она развивается быстрее, чем ее можно понять, что она погрязла в мелочах и растеряла свои великие идеалы. И слишком многие повторяют эффектные слова Эллиота: «Мы забыли мудрость ради знания, мы утратили знания в потоке информации».
Подобные рассуждения очень импонируют людям усталым или разочарованным. Но вопреки этой безнадежности, хотя и очень редко, вдруг вспыхивает искра таланта, освещая в хаосе фактов и мнений что-то очень простое и главное. Тогда все забывают свои сетования, споры по мелочам и молча разделяют восхищение перед новой истиной: как всякая совершенная красота она редка, удивительна и обезоруживает своей недоказуемой силой.
Я хотел бы, чтобы все, кто дочитал эту книгу до конца, разделили со мной ту радость и то удивление, которые я сам когда-то испытал, узнавая впервые необычный мир квантовой механики.
Оглавление
От автора … 2
1-я часть. Факты
Глава первая … 5
Глава вторая … 28
Глава третья … 50
Глава четвертая … 75
Глава пятая … 101
2-я часть Идеи
Глава шестая … 131
Глава седьмая … 153
Глава восьмая … 174
Глава девятая … 196
Глава десятая … 217
Глава одиннадцатая … 243
Глава двенадцатая … 263
3-я часть Размышления
Глава тринадцатая … 279
Заключение … 302
Леонид Иванович Пономарев
Биографию Л. Пономарева можно изложить тремя словами: школа, университет, работа.
В лаборатории теоретической физики Объединенного института ядерных исследований в городе Дубна он выполнил ряд важных работ, стал кандидатом наук и одним из ведущих исследователей института.
В свободное время Л. Пономарев путешествует по стране и пробует силы в нелегком жанре популяризаций науки. «По ту сторону кванта» — первая его книга, в которой он попытался проследить историю рождения и развития идей квантовой физики.



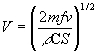

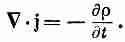
Комментарии к книге «По ту сторону кванта», Леонид Иванович Пономарёв
Всего 0 комментариев