Атомы и электроны
Новое издание первой части популярной книги известного советского физика и популяризатора науки М. П. Бронштейна, выходившей в 1935 г. В ней рассказывается о развитии науки, о том, как впервые измерили массы атомов и их размеры, какие работы и опыты привели к открытию электронов и выяснению строения атомов. Книга относится к числу лучших образцов научно-популярных изданий прошлого.
Рассчитана на школьников, преподавателей, студентов.
Матвей Петрович Бронштейн
Библиотечка Квант
Выпуск 1
Москва «Наука» Главная Редакция
Физико-Математической Литературы 1980
Предисловие редколлегии
Этой книгой Академия наук СССР начинает издание новой серии научно-популярных книг. Предназначены эти книги главным образом для школьников - учеников старших классов. Но мы надеемся, что большинство книг будут интересны и многим другим читателям - учителям, студентам, всем тем, кто интересуется естественными науками, их успехами и историей.
Серия создана по инициативе редколлегии популярного в нашей стране журнала «Квант» и ставит перед собой те же цели, что и этот журнал. Главные из них - формирование у читателя марксистско-ленинского мировоззрения, коммунистических черт личности, пробуждение интереса к активным занятиям физикой, математикой, астрономией и оказание помощи в этих занятиях.
Для того чтобы эти цели были достигнуты, читателю нужно не просто читать книги, но и работать над ними - решать задачи, доказывать теоремы, ставить описанные опыты.
Мы надеемся, что эта серия поможет нашей молодежи в овладении знаниями, необходимыми теперь в любой сфере их будущей деятельности.
Мы ждем от читателей предложений, замечаний и советов, какие книги следует издать, на какие темы. Все эти предложения будут приняты с благодарностью.
Редколлегия серии
Предисловие редактора
Книга, предлагаемая вниманию читателей, впервые увидела свет в 1935 г. Она предназначалась для школьников старших классов, а ее автор был примерно в два раза их старше: Матвею Петровичу Бронштейну в то время не было еще 30 лет. Он работал в Ленинграде, в теоретическом отделе прославленного Физико-технического института, который справедливо называют колыбелью советской физики. Исследования Бронштейна охватывали целый ряд областей теоретической физики - астрофизику, физику полупроводников и атомных ядер.
Сейчас вошло в моду слово «хобби» - увлечение, часто не имеющее ничего общего с основной профессией человека. Одним из самых сильных увлечений М. П. Бронштейна была популяризация физики. К 1936 г. вышли четыре его книги для юношества. Одна из них особенно полюбилась читателям и сделала имя автора известным далеко за пределами того сравнительно небольшого в 30-е годы круга физиков, в котором Матвея Петровича и без того хорошо знали.
Эта книжка - «Солнечное вещество» - о необыкновенной истории открытия благородного газа гелия - была переиздана в 1959 г. В предисловии к ней Л. Д. Ландау, товарищ Бронштейна по Ленинградскому университету и Физико-техническому институту, писал: «Книга «Солнечное вещество», принадлежащая перу безвременно погибшего талантливого физика Матвея Петровича Бронштейна,- незаурядное явление в мировой популярной литературе. Она написана с такой простотой и увлекательностью, что читать ее, пожалуй, равно интересно любому читателю - от школьника до физика-профессионала. Раз начав, трудно остановиться и н дочитать до конца». Л. Д. Ландау убедился в этом на собственном опыте, подготавливая книгу к переизданию. В это время он был ведущим в нашей стране физиком-теоретиком, «профессионалом» самого высокого класса, академиком, Героем Социалистического Труда; в 1962 г. его работы по исследованию жидкого гелия Шведская Академия наук удостоит Нобелевской премии по физике.
Книга М. П. Бронштейна «Атомы, электроны, ядра» отличается теми же высокими достоинствами и блеском, что и «Солнечное вещество». Матвей Петрович сравнивает в ней ученых с искусными сыщиками, умеющими по самым незначительным и незаметным следам раскрывать картину физического явления, задавать Природе такие вопросы, чтобы ответы на них восстанавливали всю цепь событий, приводящих к результату, зафиксированному в искусном эксперименте. Эта книга читается как талантливо, прекрасным языком написанный детективный роман. Только действующие лица этого романа, за которыми следят внимательные и проницательные ученые, не преступники, а атомы, электроны, ядра.
Есть два рода хороших книг. От одних через много лет сохраняется общее благоприятное впечатление, другие же запоминаются даже в деталях. Быть может, это индивидуальная особенность памяти, но, так или иначе, книгу Матвея Петровича, впервые прочитанную более 30 лет тому назад, я сразу же запомнил во всех подробностях. Еще одно наблюдение: книги, понравившиеся в детстве, могут произвести совершенно иное впечатление при повторном чтении, уже в зрелые годы. Многие из опасения утраты таких впечатлений воздерживаются от перечитывания когда-то любимых авторов и книг - вне зависимости от того, относятся ли эти книги к жанру художественной или научно-популярной литературы. В последнем случае, пожалуй, такие опасения особенно основательны. Ведь за годы, прошедшие от юности до «взрослости», быстро развивающаяся наука может настолько далеко уйти вперед, что упрощенными оказываются сами теории и концепции, а не только популярная их трактовка, как бы хорошо она ни была выполнена.
Книги М. П. Бронштейна блестяще выдерживают испытание временем. Через тридцать с лишним лет после первого знакомства с «Атомами, электронами, ядрами» я с не меньшим удовольствием прочел эту книгу, хотя и по-другому оценивая те или иные ее разделы и абзацы. Причина здесь, помимо очевидного таланта Матвея Петровича, которого - вслед за С. И. Вавиловым, Я. И. Перельманом, А. Е. Ферсманом - следует считать одним из пионеров советской научно-популярной литературы, еще и в том, что из прогресса науки совсем не следует необходимость отказа от всех ее предшествующих завоеваний. Развитие исследований в области микромира может служить тому хорошим подтверждением. Открытия Рентгена, Беккереля, супругов Пьера и Марии Кюри, Резерфорда по-прежнему составляют фундамент ядерной физики, являясь первой и замечательной главой ее истории.
Необычайно углубились наши сведения об элементарных частицах, из которых построена материя, были открыты - с тех пор, как книга Бронштейна увидела первое издание - десятки новых удивительных частиц, обнаружено явление цепного распада урана, синтезированы заурановые элементы периодической системы Менделеева, нашли техническое применение силы, заключенные в ядрах атомов. Но все это не поколебало значения всколыхнувших воображение современников открытий, сделанных в последние годы прошлого и первые десятилетия нашего века, о которых и рассказано в книге Бронштейна. В настоящем выпуске «Библиотечки «Квант» публикуется ее первая часть; вторая часть, содержащая увлекательный рассказ о ядрах и их штурме, будет издана позднее.
Теперь - небольшая биографическая справка о Матвее Петровиче Бронштейне. Он родился в 1906 г. в Виннице в семье врача. Его детство пришлось на годы первой мировой войны, революции и гражданской войны - он практически не учился в средней школе и прошел ее программу самостоятельно. Работая на заводе в Киеве, молодой человек заинтересовался физикой; первые его шаги на этом поприще направлял известный советский физик Петр Саввич Тартаковский. Девятнадцатилетним юношей, студентом электромеханического техникума, Бронштейн опубликовал свою первую работу, посвященную спектру рентгеновского излучения. Она была напечатана в известном в те годы немецком физическом журнале. Именно на его страницах - и примерно в то же время - были опубликованы знаменитые работы Гейзенберга и Борна, с которых началась современная квантовая механика. В нем постоянно печатались в 20-е годы советские физики; иногда их статьи занимали около трети объема журнала: экспериментальная и теоретическая физика страны Советов выходила на международную арену.
Творческая активность Бронштейна была удивительной: три статьи оп опубликовал в 1925 г., еще три - в следующем. Двадцатилетним студентом первого курса физико-математического факультета Ленинградского государственного университета оп был, таким образом, автором шести статей по квантовой физике!
Блестяще закончив университет, Бронштейн в 1930 г. поступил в теоретический отдел Физико-технического института.
В ноябре 1935 г. - в год выхода книги «Атомы, электроны, ядра» - Матвей Петрович Бронштейн защитил докторскую диссертацию на тему о квантовании гравитационного поля. Одним из оппонентов Бронштейна был член-корреспондент АН СССР И. Е. Тамм, впоследствии - академик, Герой Социалистического Труда, лауреат Нобелевской премии по физике. В своем отзыве о работе диссертанта он писал: «В диссертации М. П. Бронштейна впервые, и притом совершенно последовательным и исчерпывающим образом, произведено квантование поля тяготения - путем соответствующего изменения и обобщения методов квантовой электродинамики». Матвей Петрович ввел понятие о квантах гравитационного поля _ гравитонах, аналогичных квантам электромагнитного поля - фотонам. Подобно тому, как квантовая электродинамика рассматривает электромагнитное взаимодействие как результат обмена фотонами, так и тяготение, по Бронштейну, есть результат обмена гравитонами между тяготеющими массами: гравитоны испускаются одним телом и поглощаются другим.
К этим работам Бронштейна в наши дни вновь обращаются в связи с успехами современной астрофизики. Во всем мире идут настойчивые поиски гравитационных волн и разрабатываются утонченные методы их регистрации. Внешним показателем значительности вклада Матвея Петровича в развитие этой области теории тяготения может служить то обстоятельство, что его статья, содержавшая изложение основных результатов докторской диссертации, опубликованная в 1936 г., включена в сборник основополагающих работ по теории тяготения, изданный в 1979 г. в нашей стране в связи со 100-летним юбилеем со дня рождения Альберта Эйнштейна.
Время прихода М. П. Бронштейна в ФТИ совпало с развитием в институте исследований по атомному ядру и физике полупроводников. В работах обоих этих направлений Матвей Петрович принимал деятельное участие. Он был одним из руководителей и, пожалуй, самым активным участником ядерного семинара ФТИ.
Бронштейн пользовался большим авторитетом не только у своих коллег: его талант оценил Нильс Бор во время своего первого визита в нашу страну в мае 1934 г. Ранняя смерть (1938 г.) трагически оборвала его работу в области теоретической физики как раз тогда, когда от него можно было ожидать особенно больших свершений: это было время «бури и натиска»- в ядерной физике и физике полупроводников, это была заря современной астрофизики.
Прекрасный физик, Матвей Петрович был человеком блистательных гуманитарных способностей и удивительной памяти. Ему никогда и ничего не надо было перечитывать: прочитав, он запоминал навсегда. Корней Иванович Чуковский в шутку говорил, что, если бы погибла цивилизация, Матвей Петрович мог бы заново написать всю энциклопедию - от первого и до последнего тома.
Бронштейн читал в подлиннике «Дон-Кихота» и физические статьи на японском языке, переводил с латинского на русский стихи замечательного поэта Древнего Рима - Катулла и украинских поэтов. Прекрасно знал и любил русскую поэзию и выделял из поэтов нашего века Александра Блока.
Бронштейн был великолепным педагогом. Его лекции в Ленинградском университете оставили глубокий след у тех студентов, которым посчастливилось его слышать.
Бронштейн был человеком смелым, независимым, острым на язык. Но его товарищи, которым иногда приходилось бывать объектами таких шуток, не обижались на них, потому что знали: за колючестью Матвея Петровича стоит душевность, чуткость, доброта.
Особенной любовью Бронштейна пользовались дети - и отвечали ему взаимностью. Он умел с ними разговаривать как с равными - заинтересованно и уважительно. Недаром же его книги | нашли дорогу к сердцам школьников! Новое издание книги Бронштейна будут сейчас читать внуки и внучки тех, кому она предназначалась почти полвека тому назад. Будем надеяться, что это чтение окажется для них столь же увлекательным, как в свое время для их дедушек и бабушек, а для очень многих - определит будущие занятия и профессию, поможет понять и полюбить ту науку, бескорыстному служению которой была посвящена короткая и яркая жизнь Матвея Петровича.
Предоставим же слово ему самому.
В. Френкель
Глава первая. Загадка радиоактивности
В этой книжке вы найдете рассказы о проницательных сыщиках, разгадывающих самые головоломные загадки, самые непонятные тайны на свете. Нo только не думайте, что эта книжка будет похожа на другие книжки о сыщиках - на книжки об отважном Нате Пинкертоне или о хладнокровном Шерлоке Холмсе, о которых вы с таким увлечением читали в детстве. Сыщики, которых вы встретите здесь, очень мало напоминают обычных героев детективных книжек. Они не служат в полиции, не преследуют по пятам знаменитых преступников, не носят револьвера в кармане и полицейского значка под отворотом пиджака. Возможно, что они даже удивились бы, если бы узнали, что их называют сыщиками. Они - ученые люди, по целым дням сидящие в лабораториях, склоняясь над своими приборами, фотографическими снимками, листами с вычислениями. Да и тайны им приходится раскрывать не такие, как Шерлоку Холмсу или Нату Пинкертону. В этой книжке не будет ни загадочных пятен крови на измятой траве, говорящих о нераскрытом убийстве, не будет таинственных подземелий, адских машин, поддельных банковских чеков. Тайны, с которыми имеют дело герои нашей книжки, совсем не такие: это тайны невидимых маленьких частиц, из которых построено все на свете: вода, воздух, лед, железо, дерево, да и мы сами,- это тайны электричества, тайны лучей света, тайны далеких мерцающих звезд. Многие из этих тайн еще и до сих пор не разгаданы; другие разгаданы уже давно, третьи - совсем недавно. Для того чтобы разгадать эти тайны, нашим сыщикам понадобилось еще больше проницательности, остроумия, упрямства, настойчивости и мужества, чем понадобилось бы самому Шерлоку Холмсу для того, чтобы раскрыть самое загадочное преступление на свете.
Как и всякая другая книжка о сыщиках, наша книжка начинается с головоломной загадки, которую нашим сыщикам предстояло разгадать. Дело было зимой, в самом начале 1896 года. Эта зима была одной из самых замечательных зим в истории: в течение этой зимы немецкий профессор Рентген сделал поразительное открытие, навеки обессмертившее его имя,- открытие лучей, которые теперь всем известны под названием рентгеновских. Сейчас уже все привыкли к этим лучам, которые свободно проходят через дерево, через человеческое тело, через тонкие металлические листики,- все мы много слышали о рентгеновских лучах и давно перестали им удивляться,- но представьте себе, как удивились люди, слышавшие об этом открытии в первый раз!
Среди людей, которых восхитило и поразило до глубины души великое открытие Рентгена, был и тот, с приключений которого начинается наша книжка. Он был профессором химии в Париже. Звали его Анри Беккерель.
20 января 1896 года - день, когда начинается история, которую мы хотим рассказать,- Анри Беккерель отправился, по своему обыкновению, на собрание Парижской Академии наук. Собрание должно было быть очень интересное: все знали, что один из академиков - знаменитый математик Пуанкаре - получил от самого Рентгена подробное письмо о только что открытых лучах. К письму Рентген приложил фотографические снимки: это были первые фотографии, сделанные не обыкновенными видимыми лучами света, а рентгеновскими лучами. В повестке, которая была заранее разослана всем парижским ученым, было напечатано, что на этом собрании Пуанкаре прочитает вслух полученное им письмо и покажет фотографии. Задолго до начала заседания огромный зал Парижской Академии наук был переполнен. Сюда пришли не только профессора, но и студенты многочисленных высших школ города Парижа, пришли с неизменными своими блокнотами и маленькими фотографическими; аппаратами корреспонденты всех газет, чтобы в тот же день поместить в вечерних выпусках сенсационные отче ты о заседании Академии и о письме знаменитого Рентгена, пришла и просто любопытствующая публика -«публика с улицы», как ее презрительно называли студенты и профессора. Когда в наступившей тишине Пуанкаре начал громко читать по-немецки получении им письмо, все присутствующие приложили к уху ладони чтобы получше расслышать (а особенно внимательны вид был у тех, которые ни слова не понимали по-немецки но ни за что не хотели в этом признаться). Но вот чтение окончилось и среди известных парижских ученых, сидевших в первых рядах кресел, началось публичное обсуждение письма Рентгена. В этом обсуждении принял участие и Беккерель. Его очень заинтересовал вопрос о том, из какого именно места рентгеновской трубки выходят открытые Рентгеном лучи. А нужно сказать, что эта трубка была не такая, как те усовершенствованные рентгеновские трубки, которые употребляются теперь. В теперешних трубках то место, из которого во всё стороны расходятся рентгеновские лучи,- это массивный кусок тугоплавкого металла. А в первой трубке, которую построил Рентген, лучи расходились от одного местечка на стекле трубки. Когда трубка работала, на ее стеклянной стенке появлялось маленькое светящееся пятнышко. Оно светилось холодным зеленовато-желтым светом, и как раз от него во все стороны расходились рентгеновские лучи. Сами рентгеновские лучи невидимы глазу, но зелено-желтое свечение на стекле трубки, конечно, видимо, и, значит, одно и то же местечко на стекле трубки испускает и видимые глазу лучи зеленовато-желтого света, и невидимые рентгеновские лучи. Вот это-то холодное зелено-желтое свечение на стеклянной стенке трубки, о котором говорил в своем письме Рентген, страшно поразило Беккереля - он даже прервал чтение Пуанкаре и попросил его снова перечесть поразившее его место письма. И Беккерелю пришла в голову неожиданная мысль: а что, если свечение стекла рентгеновской трубки как раз и есть настоящая причина испускания рентгеновских лучей? Эта мысль взволновала Беккереля. Холодное зеленовато-желтое свечение, испускаемое стеклянной стенкой трубки, о котором говорилось в письме Рентгена, напомнило Беккерелю другой, хорошо ему знакомый свет - свет, испускаемый «флюоресцирующими» веществами. Флюоресцирующие вещества - вот что было любимой научной специальностью Анри Беккереля, постоянным предметом его мыслей, разговоров и даже ночных снов, что же это за такие вещества, изучению которых Беккерель посвятил несколько десятков лет своей жизни?
Флюоресцирующие вещества - это такие, которые в темноте не светятся, но стоит только поставить их на яркий солнечный свет, как они начинают светиться. Существует, например, такой минерал флюорит (его еще иначе называет плавиковым шпатом); сам по себе он не светится, но, как только на него попадут яркие солнечные лучи, он тотчас же начинает испускать синевато-фиолетовый свет. Флюорит - это одно из самых известных флюоресцирующих веществ; даже самое слово «флюоресцировать» происходит от слова «флюорит»: оно, собственно говоря, означает «вести себя как флюорит». Многие другие вещества тоже сильно флюоресцируют: например, раствор сернокислого хинина, выставленный на солнце, светится голубыми лучами, раствор хлорофилла - красными. Флюоресцирует даже и обыкновенный керосин, хотя довольно слабо: если бутылку с керосином поставить на солнце, то она начинает испускать слабенькое синее сияние.
Обо всех этих веществах вспомнил Анри Беккерель, как только услышал о зеленовато-желтом свете, похожем на свет флюоресцирующих веществ (так и писал Рентген в своем письме), которым сопровождается испускание рентгеновских лучей. «Как знать,- подумал Беккерель,- может быть, флюоресценция и рентгеновские лучи всегда неразлучны; может быть, не только стекло рентгеновской трубки, флюоресцируя, испускает рентгеновские лучи, но и плавиковый шпат, и сернокислый хинин, и хлорофилл, и даже самый обыкновенный керосин, который торговцы развозят в своих тележках по парижским улицам и продают домашним хозяйкам,- может быть, даже и этот керосин испускает рентгеновские лучи в то время, как флюоресцирует на солнечном свету». Вот какая мысль запала в голову Беккереля, и он в волнении ушел домой, решив поскорее приступить к опытам, чтобы проверить свою догадку.
Несколько дней размышлял Беккерель о том, какой бы сделать опыт, чтобы узнать, действительно ли флюоресцирующие вещества испускают и рентгеновские лучи в то самое время, пока они светятся. В конце концов Беккерель придумал вот что: он возьмет фотографическую пластинку, завернет ее в черную бумагу для того, чтобы ни один солнечный луч не мог упасть на эту пластинку, положит сверху кусок какого-нибудь флюоресцирующего вещества, а затем выставит все это на солнце. Если верно, что флюоресцирующее вещество, освещенное солнцем, не только светится видимым светом, но и испускает невидимые глазу рентгеновские лучи, то эти лучи пройдут через черную бумагу и отпечатаются на фотографической пластинке. Если же рентгеновских лучей нет, то ничего на пластинке не отпечатается - ведь от всех видимых лучей она прекрасно защищена обверткой из черной бумаги. Надо сказать, что за много лет своей работы над флюоресцирующими веществами Анри Беккерель собрал огромнейшую коллекцию этих веществ: нигде в мире, ни в одном музее не было такой. Долго стоял Беккерель перед своим шкафом с флюоресцирующими веществами, желая выбрать такое, которое флюоресцировало бы посильнее. «Вероятно,- думал Беккерель,- чем сильнее вещество флюоресцирует, тем больше оно испускает рентгеновских лучей, а значит, мне будет тем легче и удобнее их обнаружить». Наконец, после долгих колебаний, он остановился на веществе, которое он когда-то - лет за пятнадцать перед этим - сам приготовил в своей химической лаборатории. Это вещество называлось «двойная сернокислая соль урана и калия». У Беккереля было несколько лепешек этого вещества с таким длинным названием. Все они прекрасно флюоресцировали: стоило только им попасть на солнце, как они начинали испускать яркое зеленое сияние. Беккерель положил лепешку с двойной сернокислой солью урана и калия на фотопластинку, завернутую в черную бумагу, и выставил все это на солнце. Через несколько часов он проявил и отфиксировал пластинку. К его радости, оказалось, что на пластинке действительно отпечаталось изображение лепешки. Выходило, что он был прав: флюоресцирующие вещества действительно испускают рентгеновские лучи.
Беккерель был очень доволен собой: ведь столько лет никто (да и он сам) не замечал, что флюоресцирующие вещества испускают рентгеновские лучи, и вот теперь ему впервые посчастливилось это заметить. Но все-таки он не торопился напечатать в журнале Академии наук сообщение о своем открытии. Как часто бывает, что самое несомненное, казалось бы, открытие потом оказывается просто ошибкой! Поэтому Беккерель решил повторить свой опыт еще раз, и еще раз, пока, наконец, он не убедится, что все это действительно так и что никакой ошибки быть не может. Он взял несколько еще нетронутых фотопластинок, завернул их в черную бумагу и стал их выставлять на солнце, положив на каждую из них кусочек флюоресцирующего вещества. Такие опыты он делал довольно долго - несколько недель, как вдруг случилось странное происшествие, которое показало Беккерелю, что дело не так просто, как ему казалось раньше. Произошло вот что: пока Беккерель трудился в своей лаборатории, придумывая все новые и новые опыты для изучения тех рентгеновских лучей, которые испускает флюоресцирующая, лепешка двойной сернокислой соли урана и калия, наступили пасмурные дни. Напрасно Беккерель выносил на балкон свои фотографические пластинки с лепешками сернокислой соли,- солнце было закрыто тучами, и лепешки упорно не хотели флюоресцировать. Пришлось Беккерелю прекратить свои опыты, запереть все свои пластинки и лепешки в ящик стола и ждать солнечных дней.
1 марта 1896 года Беккерель (от скуки или от нечего делать) вздумал проявить одну из таких фотопластинок, положенных им в ящик письменного стола. Эту фотопластинку он пробовал за несколько дней перед этим - 26 февраля - выставить на солнце вместе с лепешкой сернокислой соли; пластинка была, как всегда, завернута в черную бумагу, а между ней и лепешкой он еще положил маленький медный крестик для того, чтобы узнать, смогут ли рентгеновские лучи, испускаемые лепешкой, пройти не только через черную бумагу, но и через слой меди. Солнце показывалось из-за туч очень редко, а потому Беккерель очень скоро убрал свою пластинку в ящик вместе с лежащим на ней крестиком и лепешкой.
Когда через несколько дней, 1 марта, Беккерель вздумал проявить эту пластинку, он ожидал, что изображение лепешки, которое отпечатается на пластинке, будет очень слабенькое: ведь солнце появлялось на короткое время," и лепешка флюоресцировала очень недолго. Но когда пластинка была проявлена и Беккерель на нее взглянул, он едва от удивления не выронил ее из рук: на пластинке отпечаталось резкое темное изображение лепешки - такое резкое, какое никогда не получалось в прежних опытах Беккереля, в которых лепешка ярко флюоресцировала в течение нескольких часов. А на фоне темного изображения лепешки выделялось светлое изображение креста: лучи, испускаемые лепешкой, не смогли пройти сквозь медь креста, как прошли через черную бумагу, и поэтому под крестом пластинка осталась такой, какой была,- незачерненной.
Удивление Беккереля было безгранично. Ведь, лежа в темном ящике стола, лепешка не могла флюоресцировать, как она флюоресцирует на солнечном свету, а между тем изображение па фотопластинке получилось резкое и отчетливое, как будто бы невидимые лучи, проходящие через черную бумагу, действовали на пластинку очень долго. Выходило, что лепешка продолжала и в темноте посылать свои невидимые глазу лучи, действующие на фотографическую пластинку. Зачем же было тогда выставлять лепешку на солнце, когда даже в темноте она испускает те же самые лучи? Лепешка двойной сернокислой соли урана и калия - и на солнце, когда она ярко флюоресцирует, .и в темноте, когда она не светится вовсе,- одинаково испускает какие-то невидимые глазу лучи, похожие на лучи Рентгена. Вот какой неожиданный для себя вывод должен был сделать Анри Беккерель в этот пасмурный день 1 марта 1896 года. Его первоначальная догадка о том, что флюоресценция неразлучно связана с испусканием рентгеновских лучей, все-таки в конце концов оказалась неверной. Ио вместе с тем Беккерель увидел, что двойная сернокислая соль урана и калия обладает каким-то загадочным свойством, о котором до тех пор никто не подозревал.
И вот Беккерель принимается за новую работу: он должен исследовать открытое им свойство двойной сернокислой соли урана и калия, найти, с чем это свойство связано, какие особенности двойной сернокислой соли урана и калия делают ее способной испускать невидимые глазу лучи. И Беккерель роется в своей коллекции флюоресцирующих веществ, берет оттуда одно вещество за другим и делает с каждым таким веществом опыт: не испускает ли и оно такие же лучи, какие испускает двойная сернокислая соль урана и калия? Несколько недель напряженной работы, и Беккерель приходит к следующему заключению: из всех флюоресцирующих веществ, взятых им для опыта, только те испускают невидимые глазу лучи, в состав которых входит уран (уран - это металл, который вместе с другим металлом - калием - входит в состав двойной сернокислой соли урана и калия). Флюоресцирующие вещества, в которых нет урана, не испускают никаких невидимых глазу лучей,- держать ли их па солнце или в темном шкафу,- а те флюоресцирующие вещества, в которых содержится уран, всегда испускают невидимые лучи, заставляющие -фотографическую пластинку чернеть,- даже если она завернута в плотную бумагу. И они испускают эти невидимые лучи и днем и ночью, совершенно независимо от того, освещены ли они и светятся ли они или нет.
Оставалось сделать еще последний шаг - взять какое-нибудь вещество, которое содержит в себе уран, но никогда не флюоресцирует, и посмотреть, будет ли оно испускать невидимые лучи. Уран - довольно редкий и дорогой металл, но все же в лаборатории Беккереля нашлась щепотка чистого урана в виде .порошка, и еще несколько кусочков урана ему на время дали знакомые химики. Сам уран никогда не флюоресцирует, сколько бы его ни освещали- солнечные лучи. Но когда Беккерель положил кусочек урана на фотографическую пластинку, завернутую в черную бумагу, то пластинка, проявленная через несколько часов, почернела от действия невидимых лучей, которые испускал уран. Значит, эти таинственные лучи, которые открыл Беккерель и которые так похожи на лучи, открытые Рентгеном, не имеют ровно ничего общего с флюоресценцией. Сам металл уран обладает чудесным свойством испускать эти лучи; он испускает их и когда находится в чистом виде, и когда соединен с какими-нибудь другими веществами (например, в двойной сернокислой соли урана и калия, где уран соединен с калием, серой и кислородом). Уран испускает эти лучи совершенно независимо от того, освещает ли его в это время солнце или нет. Испускание лучей зависит только от количества самого урана - чем больше урана, тем больше и лучей - и ни от чего другого не зависит. Когда Беккерель, слушая чтение письма Рентгена, вообразил, что испускание рентгеновских лучей связано о флюоресценцией, то в этой мысли не было ничего верного. И если бы он взял для своего опыта не флюоресцирующую сернокислую соль, содержащую в себе уран, а плавиковый шпат или раствор хлорофилла, то из его опытов решительно ничего не вышло бы. Но по счастливой случайности Беккерель выбрал из всей своей огромной коллекции именно сернокислую соль урана и калия, и это помогло ему открыть удивительное свойство урана: способность без всякой видимой причины испускать лучи, похожие на лучи Рентгена.
Отличаются ли лучи, открытые Беккерелем, чем-нибудь существенным от лучей Рентгена - этого и сам Беккерель в первое время не мог решить. Лучи Беккереля, как и лучи Рентгена, невидимы глазу, проходят через, бумагу, дерево, тонкие слои металла, чернят фотографическую пластинку. Очень скоро Беккерель открыл еще одно замечательное свойство лучей, испускаемых ураном (и каждым веществом, содержащим в себе уран),- способность действовать на заряженный электрометр. Электрометр - это такой прибор, в котором свисают рядом два тоненьких золотых листочка.
Рис. 1. Фотография алюминиевой медали в лучах урана, снятая Беккерелем. Экспозиция - две недели.
Стоит только хоть немножко зарядить электрометр электричеством, как листочки сейчас же начнут отталкиваться друг от друга и немедленно разойдутся врозь на некоторый угол. В таком положении они и останутся, пока с них не стечет электрический заряд. Обыкновенно электрический заряд стекает очень медленно, и проходит много часов или даже много дней перед тем, как листочки снова сойдутся. Но Беккерель сделал следующий опыт: он положил в коробку электрометра, под самые листочки, свою лепешку урановой соли, и листочки стали спадать заметно быстрее, а через полтора часа и вовсе сошлись. Сделав несколько опытов, Беккерель увидел, что испускаемые ураном лучи делают воздух способным проводить электричество; поэтому с листочков электрометра заряд утекает через воздух, и листочки спадают.
Когда Беккерель напечатал подробное описание своих опытов, все физики и химики во всем мире всполошились. Лучи Беккереля произвели такую же сенсацию, какую за несколько месяцев перед тем произвели лучи Рентгена. Во всех физических лабораториях только и было разговоров, что о таинственных лучах Беккереля. Огромное впечатление произвели эти разговоры о лучах Беккереля на одну молодую польку, жившую в Париже,- Марию
Склодовскую-Кюри. Склодовская-Кюри, которая в то время еще была начинающим и никому не известным физиком, решила расследовать, один ли только уран испускает лучи Беккереля или же есть и еще какие-нибудь другие вещества, испускающие такие же самые лучи. Для того чтобы узнать, испускает ли какое-нибудь вещество лучи Беккереля или нет, не нужно брать фотографическую пластинку, подумала Мария Кюри: с фотографической пластинкой много возни, и работа подвигается очень медленно. Проще всего взять электрометр, как это делал и Беккерель: если по мере приближения к исследуемому веществу листочки заряженного электрометра будут спадать, значит, это вещество испускает лучи Беккереля, а если нет, то, значит, никаких лучей Беккереля оно не испускает. Вооружившись своим электрометром, Мария Кюри исследовала множество разных веществ - всевозможные минералы, горные породы, газы, растворы - вообще все, что ей удалось достать. И только в апреле 1898 года она, наконец, наткнулась на одно вещество, которое испускало лучи Беккереля, как и уран. Этим веществом оказался металл торий - довольно редкий металл, который еще в 1829 году был открыт знаменитым шведским химиком Берцелиусом. Не только чистый торий испускал лучи Беккереля, но и все соединения тория с другими веществами. Как и в случае урана, здесь выполнялось такое же правило: чем больше тория, тем сильнее лучи; ни от чего другого испускание лучей Беккереля не зависело. Когда Мария Кюри увидела, что уран не единственное чистое вещество, испускающее лучи Беккереля, но что таким же свойством обладает и торий, она сочла нужным придумать для этого свойства особое название - она назвала его радиоактивностью (от латинского слова «радиус» - луч; радиоактивность - способность испускать лучи). Уран и торий - это радиоактивные вещества,- так назвала их Мария Кюри,- и все их соединения с другими веществами тоже радиоактивны[ 1 ].
Продолжая свою работу с радиоактивными веществами, Мария Кюри в том же 1898 году сделала неожиданное открытие, которое поставило ее на короткое время в тупик. У нее было несколько образцов урановой смоляной обманки - руды, из которой добывается чистый металл уран. Эти образцы руды были выкопаны из земли в рудниках около чешского городка Иоахимсталь. Когда Мария Кюри начала исследовать электрометром эти куски руды, то обнаружилась непонятная вещь: если взять два препарата, содержащие в себе одинаковое количество урана,- но только один в виде химически чистого урана, а другой в виде куска руды из Иоахимсталя - и поднести и к тому, и к другому одинаково заряженный электрометр, то оказывается, что в присутствии иоахимстальской руды листочки электрометра спадают в несколько раз быстрее, чем в присутствии химически чистого урана. Значит, иоахимстальская руда испускает гораздо больше лучей Беккереля, чем препарат, содержащий такое же количество химически чистого урана. Это казалось очень странным, потому что количество лучей Беккереля, испускаемых тем или иным препаратом урана, должно было бы, казалось, зависеть только от количества урана и ни от чего больше. Когда Мария Кюри получила в своей лаборатории этот странный результат, она рассказала о нем своему мужу, известному французскому физику Пьеру Кюри. Пьер и Мария Кюри стали вместе думать о том, какая могла бы быть причина того, что иоахимстальская урановая руда в несколько раз более радиоактивна, чем химически чистый уран и его соединения. Подумав, они сообразили, что, вероятно, в иоахимстальской руде есть, кроме урана, еще какое-то другое радиоактивное вещество, испускающее лучи Беккереля; присутствие этого другого вещества, которого нет в химических препаратах урана,- это и есть причина большей радиоактивности чешской руды по сравнению с чистым ураном.
Что же это за вещество, подмешанное к иоахимстальской руде и дающее столько лучей Беккереля? Ясно, прежде всего, что этого вещества там очень мало, иначе его давно заметили бы инженеры-химики, изучавшие химический состав урановой руды. А раз его там так мало и, несмотря на это, оно дает так много лучей Беккереля, значит, это должно быть какое-то еще неведомое химикам вещество, во много раз более радиоактивное, чем уран или торий. В иоахимстальской урановой руде спрятано неизвестное новое вещество, отличающееся огромной способностью испускать лучи Беккереля.
Пьер Кюри
Вот к какому заключению пришли Пьер и Мария Кюри, и сразу же перед ними встала заманчивая задача - извлечь из иоахимстальской руды это таинственное новое вещество, которого там так мало, что обыкновенными химическими способами никому не удалось его там обнаружить: ведь только электрометр, указавший на повышенную (по сравнению с чистым ураном) радиоактивность иоахимстальской руды, заставил это неизвестное радиоактивное вещество выдать свое присутствие.
С этого момента (с апреля 1898 года) Пьер и Мария Кюри решаются посвятить себя этой задаче - извлечению нового радиоактивного вещества из иоахимстальской руды.
Мария Кюри (Склодовская)
Пьер Кюри приостановил все другие работы, которые он вел в своей лаборатории, и присоединился к работе Марии Кюри. Первым делом нужно было получить для обработки большое количество материала, содержащего в себе это неизвестное вещество. Сама урановая руда очень дорога, и поэтому Пьер и Мария Кюри отказались от мысли получить ее в чистом виде. Но урановая руда дорога только потому, что в ней есть уран, а ведь Пьеру и Марии Кюри сам уран был не нужен, и поэтому они охотно согласились получить не уран, а то, что остается от урановой руды после того, как из нее уже извлечен уран: этот остаток и должен был, по мнению Кюри, содержать в себе таинственное новое вещество. В Иоахимстале, на заводах, где перерабатывают добытую в рудниках урановую смоляную руду, делают так: руду сперва растирают в порошок, затем размешивают с содой и тщательно промывают горячей водой, к которой подмешано немного серной кислоты. При этом соли растворяются в воде, и их затем уже добывают оттуда. Но при такой промывке порошка горячей водой не все растворяется в воде: осадок, в котором уже нет никакого урана, остается, и его просто выбрасывают (или, лучше сказать, выбрасывали в те времена, потому что теперь, после того, как Пьер и Мария Кюри научили химиков добывать из этого осадка новые радиоактивные вещества, он ценится еще больше, чем чистый уран, а тогда он считался просто никому не нужным отбросом). Вот этот-то осадок Пьер и Мария Кюри и захотели исследовать; по их мнению, в нем должно было содержаться неизвестное вещество, которому иоахимстальская руда обязана своей повышенной радиоактивностью. Добыть это вещество из осадка было очень заманчиво: если даже ничтожная примесь этого вещества дает так много лучей Беккереля, то сколько же лучей даст само вещество, если удастся его добыть в достаточно большом количестве! Ясно, что для этого понадобится переработать в лаборатории много пудов осадка, остающегося после удаления урана из смоляной руды. Все это должно было потребовать от Пьера и Марии Кюри огромной работы, но их это не устрашило. У них не было денег, но, к счастью, удалось убедить известного миллионера барона Ротшильда пожертвовать несколько тысяч франков на устройство новой лаборатории; кроме того, австрийское правительство (Чехия тогда принадлежала Австрии, и иоахимстальские рудники были собственностью правительства) согласилось подарить настойчивым французским физикам целых два вагона отбросов, остающихся от урановой руды после добычи из нее урана. Все это было привезено в Париж и свалено в лаборатории, которую устроили себе супруги Кюри. Сама «лаборатория» - правду сказать - имела не очень внушительный вид: это был большой сарай на улице Ломон, неудобный и сырой, в котором было лишь самое необходимое; приборов было очень мало, вентиляции почти никакой, так что многие химические реакции, при которых выделяются вредные газы, приходилось производить на дворе. Но сколько чудесных часов провели в том сарае Пьер и Мария Кюри, увлеченные поисками нового радиоактивного вещества!
Трудная задача предстояла Пьеру и Марии Кюри - потруднее, чем отыскать иголку в стоге сена. Здесь не дастся пересказать все те сложные и хитроумные химические способы, которые они придумывали и применяли разделению исследуемого материала на составные части. К каждой такой составной части они подносили заряженный электрометр, чтобы узнать, испускает ли он лучи Беккереля или нет. Если нет, то они ее выбрасывали, а если да, то ее предстояло снова разделить на составные части, снова исследовать их при помощи электрометра, и так далее, и так далее, пока, наконец, таинственное вещество, за которым они так охотились, не будет выделено в чистом виде.
Очень скоро Пьер и Мария Кюри установили, что неизвестных радиоактивных веществ в исследуемом ими материале не одно, а два. Одно из них по своим химическим свойствам должно было быть похоже на висмут, потому что во всех химических реакциях, куда шел висмут, туда шло и это вещество, присутствие которого было заметно по действию его лучей Беккереля на заряженный электрометр. Другое же вещество по своим химическим свойствам напоминало металл барий, потому что оно повсюду следовало за барием. Уже 18 июля 1898 года Пьер и Мария Кюри могли добыть из иоахимстальской руды химический препарат с заметной примесью первого из этих двух веществ (похожего на висмут). Этому веществу ни дали название «полоний» (в честь Полыни - родины Марии Кюри). Полученный ими препарат полония был во много раз активнее, чем самый чистый уран. А через несколько месяцев, 26 декабря 1898 года, они послали в Академию новое сообщение: они добыли из той же руды ругой препарат, в котором содержалось второе неизвестное вещество (похожее на барий). Препарат испускал лучи Беккереля в 900 раз сильнее, чем такое же количество чистого урана. Значит, в этом препарате должно было быть какое-то вещество, в огромное число раз более радиоактивное, чем уран. Добыть это вещество по возможности в большом количестве в чистом (или по крайне мере в сильно сконцентрированном) виде - вот что тало целью жизни Пьера и Марии Кюри. Для достижения этой цели они отказались от всего на свете, просиживали в лаборатории дни и ночи за кропотливыми химическими анализами, стараясь найти способ отделить неизвестное вещество от бария, за которым оно следовало по пятам во всех химических превращениях. Нужно был как-нибудь окрестить это неизвестное вещество, за которым они охотились, и они назвали его радием, т. е. «лучистым веществом», в честь тех мощных потоков лучей Беккереля, которые это вещество будет испускать, когда удастся сконцентрировать его в заметном количестве.
В 1902 году, через четыре года после начала работы Пьер и Мария Кюри получили первые несколько дециграммов чистого хлористого радия, т. е. соединения радия с хлором (на каждый грамм хлористого радия приходится 0,76 г радия и 0,24 г хлора). Несколько маленьких белых кристалликов в форме острых иголочек - вот что получили Пьер и Мария Кюри после четырех лет работы, вот что они добыли из огромной груды переработанного ими иоахимстальского осадка. Но этот хлористый радий был в миллион раз радиоактивнее, чем такое же количество чистого урана, и этим Пьер и Мария Кюри были вознаграждены за огромную проделанную ими работу.
Заметим, что обыкновенно, когда добывают радий, ограничиваются тем, что получают его не в абсолютно чистом виде, а в виде его соединения с хлором или бромом. Впрочем, Мария Кюри в 1910 году получила радий и в чистом виде, пропуская через расплавленный хлористый радий сильный электрический ток: это тот же самый, известный всем еще из школьных учебников, способ электролиза, которым можно разложить на хлор и натрий расплавленный или растворенный в воде хлористый натрий (поваренную соль). Выделенный в чистом виде радий оказался, как и следовало ожидать, блестящим белым металлом, похожим на барий или кальций, с которыми у него есть химическое сходство. Пьер Кюри не дожил до того дня, когда радий был выделен в совершенно чистом виде: нелепый случай лишил его жизни - 19 апреля 1906 года он погиб под колесами телеги на улице Дофин в Париже.
В урановой смоляной руде радия очень мало: необходимо переработать много тонн руды, чтобы получить всего лишь один грамм радия. Но чудесные радиоактивные свойства радия, испускающего в миллион раз больше лучей Беккереля, чем чистый уран, оправдывают всю ту грандиозную работу, которую пришлось проделать супругам Кюри для извлечения радия из руды. В течение четырех лет, протекших от начала работы до получения первых кристалликов хлористого радия, каждый год получались все более и более концентрированные порции радиевых препаратов, и каждый год приносил новые неожиданные открытия. Уже в самом начале работы, когда Пьер и Мария Кюри получили препарат радия, в 900 раз превосходящий своей активностью уран (в декабре 1898 года), было замечено, что лучи Беккереля, как и лучи Рентгена, не только чернят фотографическую пластинку и ускоряют спадание листочков заряженного электрометра, но и заставляют ярко светиться в темноте экран, покрытый слоем платиноцианистого бария или какого-нибудь другого флюоресцирующего вещества. Это свойство лучей Беккереля впоследствии даже получило некоторое практическое применение: сернистый цинк, к которому подмешано самое крохотное количество радиоактивного вещества, светится в темноте под влиянием лучей Беккереля, испускаемых частицами этого вещества, а поэтому таким сернистым цинком с примесью радиоактивного вещества иногда рисуют цифры на циферблате часов и обмазывают стрелки, чтобы можно было ночью взглянуть на часы, не зажигая спички. Во время первой мировой войны таким сернистым цинком обмазывали ружейные прицелы (чтобы ночью можно было прицеливаться в темноте), стрелки и буквы на магнитной буссоли и т. п.; это даже вызывало резкое повышение спроса и вздорожание радиоактивных веществ (о ценах радиоактивных веществ будет дальше рассказано подробнее).
Фотографическое действие лучей Беккереля тоже становилось все интенсивнее и заметнее по мере того, как Пьер и Мария Кюри приготовляли препараты, все более и более богатые радием. Вскоре после начала работы были получены препараты столь активные, что уже не требовалось длительных экспозиций (по нескольку часов), чтобы получилось заметное почернение фотографической пластинки от действия лучей Беккереля: стоило только поднести препарат, содержащий радий, На несколько секунд к завернутой в бумагу фотографической пластинке, как пластинка заметно темнела. В прекрасной книжке «Радий и его разгадка», которую написал английский химик Фредерик Содди - один из Первых исследователей радиоактивности (о его работах будет подробно рассказано дальше),- описывается следующий опыт: берется стеклянная трубочка, в которую помещен препарат, содержащий в себе немножко радия и этой трубочкой медленно водят, выписывая какое-нибудь слово, как карандашом, по фотографической пластинке, завернутой в черную бумагу, защищающую ее а всех видимых лучей света. После того, как пластинка проявлена, на ней оказывается написанным это слово
Рис. 2. Надпись, сделанная Содди на фотографической пластинке стеклянной трубочкой с препаратом радия
Вот как быстро лучи Беккереля зачернили те места пластинки, к которым была поднесена трубочка с препаратом радия! (См. рис. 2.)
В самых первых опытах над препаратами радия было замечено, что вещество, содержащее радий, всегда немножко теплее, чем все окружающие предметы. Пьер Кюри решил воспользоваться этим для того, чтобы измерить энергию лучей Беккереля, испускаемых радием В самом деле, эти лучи Беккереля, которые чернят фотографическую пластинку, делают воздух проводников электричества, заставляют флюоресцирующие экран светиться,- должны же эти лучи Беккереля иметь какую-то энергию для того, чтобы делать все это! Пьер Кюри взял калориметр - прибор, в котором по количеству растаявшего в нем льда определяется, сколько выделилось в приборе тепла,- и поместил туда препарат pадия. Калориметр был взят такой, что все лучи Беккереля которые испускал препарат, не могли выходить из прибора, все они, как говорят, «поглощались» в массе льда в толстых стенках калориметра. Взвесив растаявший лед и зная, сколько требуется тепла для того, чтобы расплавить это количество льда, Пьер Кюри сумел измерить количество теплоты, выделяемое препаратом радия. Оказалось, что каждый грамм радия в течение часа выделяет из себя 140 калорий энергии (калория - это та энергия, которая нужна, чтобы поднять температуру одного грамма воды на один градус Цельсия). Энергия, отдаваемая радием, уходит с лучами Беккереля, но если эти лучи задержать, поглотить их, как было сделано в опыте Пьера Кюри с калориметром, то та же самая энергия выделяется в виде теплоты. 140 калорий в час! Эта энергия, выделяемая граммом радия, не очень велика: целых 50 часов должно пройти для того, чтобы грамм радия отдал столько же энергии, сколько отдает, сгорая, один грамм угля. Но зато грамм угля, сгорев, превратившись в углекислый газ, уже перестает отдавать энергию дальше, а грамм радия, отдав, хотя и очень медленно - в течение 50 часов - то же самое количество калорий, остается, по-видимому, таким же, каким он был, и продолжает испускать энергию тем же самым темпом.
Вот эта-то способность радия испускать, хотя и очень медленно, большие и казавшиеся совершенно неограниченными количества энергии должна была больше всего заинтересовать физиков: она и дала возможность говорить о загадке радия, о загадке радиоактивности, мучительной загадке, заставлявшей физиков 1900 года ломать себе голову над таинственными свойствами радия и его лучей. Что является причиной радиоактивных явлений? Что заставляет радиоактивные вещества испускать лучи Беккереля? Какова, природа этих лучей, так похожих (на первый взгляд) на лучи Рентгена? Откуда радиоактивные вещества берут энергию, которую они затем отдают внешнему миру в форме энергии своих таинственных лучей? И действительно ли эта энергия неисчерпаема? Действительно ли кусочек радия представляет собой нечто вроде «перпетуум-мобиле» - вечного двигателя, о котором так страстно мечтали когда-то изобретатели,- Двигателя, который все время может отдавать миру энергию, хотя в нем самом ничего не сгорает, не травится, не портится, не изменяется? Или, может быть, радий совсем не является исключением в мире, где все подчинено закону сохранения энергии, и, может быть, запасы энергии, содержащиеся в радии, хотя и велики, но совсем не неисчерпаемы, и если через 50 часов в грамме радия еще не заметно никакого иссякания, увядания, упадка, то через много недель или даже только через много лет уменьшение запасов энергии в радии должно стать заметным? Вот какие вопросы волновали физиков, изучавших радий, вот какие вопросы составляют содержание загадки радиоактивности, о которой говорит название этой главы нашей книжки.
В дальнейших главах мы узнаем, как была разгадана загадка радия и к каким огромным по своему значения последствиям привела разгадка этой загадки, позволившая физикам необыкновенно глубоко заглянуть в самые сокровенные тайны окружающего нас мира. Но, перед тем как приступить к рассказу о разгадке тайны радия нужно будет хотя бы вкратце рассказать о том, в каком состоянии находилась физика того времени, когда загадка радия была поставлена и привлекала к себе всеобщее внимание; нужно будет рассказать о том, что физики знали вообще об устройстве вещества, когда им пришлось заняться более узким и специальным вопросом об устройстве радиоактивного вещества. Этому мы посвятим две следующие главы (гл. II - Атомы гл. III - Электроны и рентгеновские лучи). В этих главах мы расскажем все то, что уже могли знать физики, которым предстояло разгадывать загадку радиоактивности,- все, что физики знали об устройстве вещества до 1902 года (год, когда Пьер и Мария Кюри выделил хлористый радий) и в течение нескольких следующих лет. Но еще перед тем, как погрузиться в эти трудные и важные главы, мы расскажем еще об одном удивительном свойстве радия - свойстве, которое привлекло к нему внимание не только физиков, но и самой широкой публики и вызвало к жизни великое множество практически важных последствий.
3 апреля 1901 года Анри Беккерель зашел в лабораторию Пьера Кюри и попросил у него разрешения взять на время препарат радия (Анри Беккерель собирался этот день прочитать студентам лекцию о радиоактивности, и препарат радия ему нужен был для того, чтобы показать слушателям несколько опытов). Пьер Кюри дал ему стеклянную трубочку, в которой было немного (меньше 1 г) добытого из иоахимстальской руды вещества с большой примесью радия. Трубочка была завернута в бумагу и положена в картонную коробку. Эту коробку- Беккерель небрежно засунул в жилетный карман, и она пролежала в кармане около шести часов. Лучи Беккереля, испускавшиеся этим препаратом, были так сильны, что когда Беккерель в пальто вошел в темную комнату, в которой был экран с платиноцианистым барием, и подошел к экрану, экран начал очень сильно светиться: лучи свободно проходили сквозь пальто, и даже когда экран подносили к спине Беккереля прямо напротив жилетного кармана, где была трубочка с препаратом радия, экран слегка светился под действием лучей, прошедших насквозь через грудную клетку Анри Беккереля.
Через 10 дней, 13 апреля, Беккерель обнаружил у себя на груди, как раз на том месте, где был жилетный карман, маленькое красное пятнышко. Боли не было никакой. Потом пятнышко начало расти, сделалось более темным, а через несколько дней оно приняло такую же форму и такие размеры, как стеклянная трубочка, в которой был радий. Еще через несколько дней Беккерель почувствовал сильную боль. Кожа растрескалась, образовалась язва, и Беккерель в ужасе обратился к врачу. Врач принялся лечить эту язву, как лечат обыкновенный ожог, и приблизительно через месяц язва закрылась и зарубцевалась. Но еще через два года после этого происшествия на груди Беккереля был виден отчетливый белый шрам в том месте, где раньше была эта ранка.
Когда Пьер Кюри узнал о происшествии с Беккерелем, он принялся нарочно делать вот какие опыты: .один раз он привязал к своей руке препарат радия на десять часов. Через некоторое время у Кюри, как прежде у Беккереля, появилась краснота, началось воспаление, а через несколько дней открылась ранка. Она очень сильно болела и прошла только после четырех месяцев лечения; на коже, как и у Беккереля, остался глубокий белый шрам. Другой раз Пьер Кюри попробовал поносить в кармане крупинку радия полчаса; через 16 дней на коже образовался ожог, затем вскочил волдырь, который прошел только через две недели.
Обо всем этом Пьер Кюри рассказал парижскому доктору Данло, работавшему в госпитале Сен-Луи. Доктор Данло сразу сообразил, что если радий так сильно действует на человеческую кожу, то это должно оказаться очень важным для медицины. Ведь все врачи очень хорошо знают, что действие лекарств сильно зависит от дозы: если какое-нибудь лекарство благотворно действует на больного, когда его применяют в маленькой дозе, то в большой дозе оно может оказаться сильным ядом, способным отправить на тот свет и здорового. Не окажутся ли лучи радия, которые так вредны в большой дозе, хорошим лекарством для кожи, если их применять в маленькой дозе? Доктор Данло очень осторожно попробовал действовать слабенькими порциями лучей радия сначала на животных, потом на людей. Оказалось, что в маленьких дозах лучи радия хорошо излечивают экзему, лишаи, волчанку и всякие другие болезни кожи.
Опытами доктора Данло заинтересовались многие врачи и биологи, и с тех пор медицинские действия лучей радия были очень хорошо изучены в клиниках и в биологических лабораториях. Врачи скоро заметили, что сильные лучи радия, разрушая клетки и ткани человеческого тела, не на все клетки и не на все ткани действуют одинаково: те клетки, которые обладают способностью очень быстро размножаться, гораздо сильнее страдают от разрушительного действия лучей радия, чем медленно размножающиеся клетки. Это открытие оказалось очень важным, и вот почему: существует такая болезнь - рак; это очень мучительная болезнь, от которой погибает множество людей и которая прежде считалась совершенно неизлечимой. У больного раком образуется на коже или во внутренних органах, например в гортани, в желудке, раковая опухоль, очень быстро разрастающаяся и заражающая весь организм больного теми частицами, которые она рассылает во все органы его тела. Клетки, из которых состоит раковая опухоль, размножаются очень быстро: гораздо быстрее, чем те клетки, из которых состоят здоровые ткани. А так как лучи радия тем сильнее разрушают ткань, чем быстрее размножаются ее клетки, то вывод ясен: необходимо воздействовать на раковую опухоль, оставив окружающие здоровые ткани почти невредимыми. Такой способ лечения рака врачи стали применять уже через несколько лет после открытия радия, и этот способ давал прекрасные результаты. Лечение производится так: препарат радия помещают в золотой футляр и прикладывают к раковой опухоли. Если только болезнь не слишком запущена. т. е. если микроскопические кусочки опухоли еще не успели разнестись (по кровеносным и лимфатическим сосудам) по всему телу больного, то лечение обыкновенное очень хорошо удается. Плохо оно удается только в тех случаях, когда раковая опухоль растет очень глубоко внутри тела, например в желудке. Опухоль на коже
уничтожается при достаточно энергичном лечении очень быстро - недели в две.
Когда врачи стали лечить лучами радия разные болезни, то на радий сейчас же появился спрос. Все крупные больницы обязательно захотели иметь у себя хотя бы крупинку этого вещества для того, чтобы излечивать кожные болезни. Но радий доставать было очень трудно, немецкий физик Гизель вскоре после того, как Пьер и Мария Кюри открыли радий, достал из Иоахимсталя небольшое количество тех же остатков от переработки урановой смоляной руды, которыми пользовались супруги Кюри, и начал добывать из них радий, применяя ; же самые способы. После этого он очень великодушно разослал весь добытый им радий всем физикам, которые занимались изучением лучей Беккереля и пробовали раздать тайну радиоактивности. Австрийское правительство очень скоро сообразило, что отбросы от переработки урановой смоляной руды теперь будут цениться дороже самого урана, и просто-напросто запретило вывозить эти отбросы за границу. Это подняло цены на радий до таких пределов, что даже те физики, которые больше всего сделали для открытия и добычи радия (Пьер и Мария Кюри, Гизель), потеряли всякую возможность его покупать. Когда через несколько лет после открытия радия английским физикам понадобилось крохотное количество радия для научной работы, они вынуждены были использовать очень сложную протекцию: обратились к принцу Уэльскому (наследнику английского престола), он воспользовался своими знакомствами и связями во дворе австрийского императора, чтобы получить разрешение вывезти из Австрии некоторое количество остатков от переработки урановой смоляной руды.
В 1912 году Парижский университет совместно с знаменитым медицинским институтом Пастера организовал в Париже так называемый Институт радия. Этот институт открылся на улице, которая была названа именем Пьера Кюри, а мадам Кюри получила должность директора этого института, которую она сохранила до самой своей смерти (в 1934 году). В этом институте производятся важные физические исследования, относящиеся к свойствам радиоактивных веществ и их лучей, но, кроме то, еще и производится лечение больных. В 1918 году Мария Кюри подарила клинике своего института грамм радия, извлеченный ею и ее мужем из иоахимстальской руды и представлявший ее личную собственность. В то время, когда был сделан этот подарок, грамм радия стоил сто тысяч долларов (полтора миллиона франков). Практические применения радия в медицине вызвал необходимость добывать заводским путем значительное количества радия. В 1914 году правительство Соединенных Штатов организовало завод для добычи радия так называемых карнотитовых руд, которые встречают в разных местах Соединенных Штатов и содержат в себе уран и радий. В 1921 году в местечке Кантага (бельгийские владения в Центральной Африке[ 2 ]) были открыты богатые залежи урановой смоляной руды. Оказалось, что в этой руде есть довольно значительная примесь радия. Поэтому в 1923 году в местечке Оолен, вблизи бельгийского города Антверпен, был построен радиевый завод, куда привозили урановую смоляную руду добытую в Катанге, и извлекали из нее радий. В течение месяца на этом заводе добывали четыре грамма радия. Способ добычи, в основном, такой же, как тот, который применяли Пьер и Мария Кюри в своих первых лабораториях на улице Ломон и на улице Кювье. Этот способ очень сложен; для интересующихся мы приводим цитату из «Курса общей химии» проф. Б. Н. Меншуткши (4-е издание, Ленинград, 1933):
«Переработка урановой смолки в Оолен ведется так: действием серной и азотной кислот извлекают из руды соединения урана, затем после удаления кремнезема обрабатывают соляною кислотою и (после прибавления необходимого количества солей бария) полученные сернокислые соли бария и радия отфильтровывают и под давлением нагревают с раствором соды для перевода сернокислых солей бария и радия в углекислые; их растворяют в чистой соляной кислоте и снова осаждаю; раствором угленатриевой соли. Полученные чистые углекислые соли действием чистой же соляной кислоты переводят в хлористые барий и радий, готовят почти насыщенный при 100° С раствор последних и охлаждают его; при дробной кристаллизации сперва осаждаете труднее растворимый хлористый радий, потом уже хлористый барий. Поэтому отдельно собирают первые порции кристаллов и последующие. С маточным рассолом и этими кристаллами повторяют много раз такую перекристаллизацию, пока не получится хлористый барий со значительным содержанием хлористого радия. Тогда раствор их осаждают углекислой солью аммония, полученный осадок промывают, растворяют в бромоводородной кислоте и получают еще более различающиеся растворимостью в воде бромистые барий и радий. Их снова подвергают дробной перекристаллизации вплоть до получения чистого бромистого радия, который запаивают в стеклянные трубочки, помещенные в толстые свинцовые футляры, и сохраняют в отдаленном от жилья помещении».
Глава вторая. Атомы
Физические явления, происходящие в окружающем нас мире, представляют бесконечную цепь загадок. Вода, охлаждаясь, превращается в твердый, бесцветный лед, нагреваясь же, становится невидимым водяным паром. Если ее слегка подкислить серной кислотой и пропускать через нее электрический ток, она постепенно превращается в два газа - водород и кислород. Стоит только смешать эти газы и поджечь их искрой, как они со взрывом снова превращаются в воду. Блестящее железо в сыром воздухе превращается в ржавчину. Горящий уголь становится углекислым газом. Подлинно, «природа находит удовольствие во всевозможных превращениях», как когда-то сказал знаменитый английский ученый Исаак Ньютон. И все эти превращения ставят перед нами все тот же вопрос: в чем заключается интимная, внутренняя сторона всех этих явлений, которые мы воспринимаем как холод, как тепло, как пламя, как взрыв и т. д.? Каков закулисный механизм всех этих театральных эффектов, которые мы все время наблюдаем и которые изучает физика и химия? С давних пор люди стремились получить ответ на этот вопрос. И еще перед тем, как наука доросла до того, чтобы суметь ответить на этот вопрос правильно, нетерпеливые философы пытались ответить на него, заменив строгое исследование простой догадкой.
В глубокой древности, больше чем 2000 лет тому назад (в 5-м столетии до начала нашего летосчисления), греческие философы Демокрит Абдерский и Левкипп высказали замечательную догадку, которой впоследствии было суждено сыграть огромную роль в истории научного понимания мира. Демокрит и Левкипп утверждали, что все вещи в мире состоят из ничтожно малых, невидимых глазу по причине своей малости, частиц. Эти частицы уже не могут быть разрезаны на дальнейшие части, они являются последними и самыми основными частицами всего существующего на свете; поэтому они получили название «атомов» (по-гречески «атомос» значит неделимое - то, что не может быть разрезано или разорвано). Но в том рое атомов, которым является каждое тело окружающего нас мира, мы не видим отдельных атомов, подобно тому как в рое пчел мы издали не видим отдельных пчел: все пчелы сливаются для нас в одну сплошную тучу. Все явления, происходящие на свете, заключаются лишь в том, что атомы движутся в пространстве, образуют друг с другом разные комбинации, затем эти комбинации распадаются, возникают новые и т. д. Мы можем видеть пламя, ощущать холод, тепло, слышать звук и т. д., но все это лишь внешняя видимость вещей, воспринимаемая нашими несовершенными органами чувств, а на самом деле (с той самой внутренней, закулисной стороны, о которой мы говорили раньше) происходит одно только движение атомов, их перемещение в пространстве, разрушение и возникновение все новых и новых построек из того же самого вечного материала - атомов.
В этом и заключалось учение Левкиппа и Демокрита. Хотя оно было основано на простой догадке и не было подкреплено серьезными доказательствами, тем не менее оно получило широкое распространение уже в глубокой древности. Учение о том, что все тела природы состоят из атомов разной величины и разной формы, было особенно развито Эпикуром (300 лет до начала нашего летосчисления) и Лукрецием (в I веке до начала нашего летосчисления). Не только греко-римская цивилизация создала это учение, но и индийская: современник Лукреция индийский философ Канада учил, что тела состоят из атомов, отличающихся друг от друга различными свойствами. Мельчайшая пылинка солнечного луча,- так учил Канада,- состоит из шести атомов, из которых каждые два «волей бога или еще чем-нибудь» соединены в двойные атомы. Четыре пылинки солнечного луча образуют следующую по сложности частицу,- с восхитительной наглостью продолжает Канада (как будто он мог обо всем этом хоть что-нибудь знать!). Так, смешанная с фантастическими и грубо ошибочными рассуждениями, создавалась атомистическая теория - одна из наиболее глубоких и важных теорий строения вещества.
В средние века атомистическая теория имела сравнительно мало сторонников. Но в XVII веке, когда наука стала огромными шагами идти вперед, когда появилась научная механика и начала появляться научная химия, атомистическая теория снова стала распространяться среди физиков и философов. Вот что говорит об атомах Исаак Ньютон (приводим в точном переводе этот отрывок, чрезвычайно характерный для науки XVII столетия): «Мне представляется, что бог с самого начала сотворил вещество в виде твердых, весомых, непроницаемых, подвижных частиц и что этим частицам он придал такие размеры, такую форму и такие другие свойства и создал их в таких относительных количествах, как ему нужно было для той цели, для которой он их сотворил. Эти первичные частицы абсолютно тверды: они неизмеримо более тверды, чем те тела, которые из них состоят,- настолько тверды, что они никогда не изнашиваются и не разбиваются вдребезги, так как нет такой силы, которая могла бы разделить на части то, что сам бог создал неразделимым и целым в первый день творения. Именно потому, что сами частицы остаются целыми и неизменными, они могут образовать тела, обладающие той же самой природой и тем же строением во веки веков; ведь если бы частицы изнашивались или разбивались на части, то зависящая от них природа вещей изменилась бы. Вода и земля, составленные из старых изношенных частиц и осколков, отличались бы по строению и свойствам от воды и земли, построенных из еще целых частиц в начале творения. Поэтому, для того чтобы природа могла быть долговечной, все изменения тел природы могут заключаться лишь в перемене расположения, в образовании новых комбинаций и в движении этих вечных частиц. Бог мог создать частицы вещества, обладающие разными размерами и разной формой, поместить их на разных расстояниях друг от друга, наделить их, быть может, разными плотностями и разными действующими силами. Во всем этом я, по крайней мере, не вижу никаких внутренних противоречий. Итак, по-видимому, все тела были построены из вышеупомянутых твердых непроницаемых частиц, которые были в первый день творения размещены в пространстве по указанию божественного разума».
В 1661 году англичанин Роберт Бойль опубликовал книгу под заглавием «Скептический химик». В этой книге он дал необыкновенно ясный анализ атомистической теории с точки зрения химии. Атомы, как учил Роберт Бойль, бывают различных сортов; все тела, построенные из атомов одного и того же сорта, являются «простыми телами» (теперь говорят - химическими элементами). Атомы могут, соединяясь друг с другом, образовывать более сложные частицы. Если какое-нибудь тело состоит из одинаковых частиц, каждая из которых есть комбинация нескольких атомов разного сорта, то такое тело, по Бойлю, является «совершенной смесью» (теперь принято говорить - химическим соединением). Всякая «совершенная смесь» может быть разложена на «простые тела», из которых она состоит. Однако скудные химические познания XVII века не дали Бойлю возможности установить, какие из окружающих нас тел являются «совершенными смесями», а какие - «простыми телами». Он даже склонен был допустить, что единственным известным «простым телом» является вода, а что все другие вещества - в том числе железо, медь, золото, серебро, свинец, ртуть - это «совершенные, смеси». В этом Бойль заблуждался, и больше столетия понадобилось для того, чтобы выяснить, какие тела являются сложными, т. е. «смесями», а какие - простыми.
В 1808 году в Лондоне вышел первый том книги «Новая система химической философии», написанной Джоном Дальтоном, учителем в Манчестере. В этой книге Дальтон, по существу, повторяет взгляды Бойля, но какая огромная разница между книгами Бойля и Дальтона! Не будем забывать, что между выходом этих двух книг прошло 147 лет и что в течение этих лет в химии появился Лавуазье. Уже было известно, что водород, кислород, азот, углерод, сера, фосфор, натрий и калий (открыты Дэви в 1807 году), кальций, стронций, барий и магний (открыты тем же Дэви в 1808 году), железо, цинк, медь, свинец, серебро, платина, золото и ртуть являются простыми телами, а вода, аммиак, углекислый газ и многие другие - сложными. В химии уже употреблялись весы, и целый ряд количественных анализов сложных веществ уже был произведен. Поэтому Джон Дальтон и мог поставить перед собой смелую задачу: определить относительные массы всевозможных атомов.
Водород - простое тело, рассуждал Дальтон, значит, водород состоит из атомов одного и того же сорта - атомов водорода. Обозначим атом водорода значком . Кислород - тоже простое тело; значит, кислород состоит из атомов кислорода. Введем для них значок . Вода - это химическое соединение («совершенная смесь», как сказал бы Роберт Бойль); значит, она состоит из каких-то частиц, каждая из которых представляет комбинацию определенного числа водородных атомов с определенным числом кислородных атомов. Такую частицу, состоящую из нескольких сцепленных друг" с другом атомов, Джон Дальтон называл «сложным - атомом»; в химии теперь предпочитают употреблять слово «молекула», которым и мы будем все время пользоваться. Итак, вода или водяной пар состоит из молекул воды. Каждая молекула воды/ как решил Дальтон, руководствуясь при этом «принципом простоты», состоит из двух атомов - атома водорода и атома кислорода. Молекула воды, по Дальтону, имеет вот какой вид:
Отсюда легко заключить, во сколько раз атом кислорода тяжелее, чем атом водорода. Каждый фунт[ 3 ] воды - как гласили химические анализы, произведенные самим Дальтоном и другими современными ему химиками,- состоит из 1/8 фунта водорода и из 7/8 фунта кислорода. А так как все молекулы воды совершенно одинаковы, то, значит, и в каждой молекуле воды 1/8 часть ее массы - это масса атома водорода, а остальные 7/8 ее массы - это масса атома кислорода. Отсюда следует, что атом кислорода весит в 7 раз больше атома водорода. Если взять массу атома водорода за единицу, то масса атома кислорода будет равна семи.
Таким же образом Дальтон определил и во сколько раз масса атома азота, который он обозначил значком , больше массы атома водорода Для этого он воспользовался химическим анализом газа аммиака, который является химическим соединением азота и водорода. Руководствуясь тем же самым принципом простоты, Дальтон предположил, что молекула аммиака состоит из одного атома водорода и одного атома азота, т. е. имеет вид .
Анализы аммиака показали, что каждый фунт аммиака состоит из 1/6 фунта водорода и 5/6 фунта азота. Применяя такое же самое рассуждение, как раньше, легко заключить, что атом азота должен быть в пять раз тяжелее, чем атом водорода. Если по-прежнему считать массу атома водорода равной единице, то масса атома азота окажется, по Дальтону, равной пяти.
Большим испытанием для атомистической теории оказался случай углерода. Углерод образует с кислородом не одно, а целых два различных соединения: в одном из них (окись углерода) на заданное количество углерода приходится сравнительно мало кислорода, а в другом (углекислый газ) - гораздо больше.
Поэтому молекулу окиси углерода Дальтон предложил рисовать в виде , где значок обозначает атом углерода, а молекулу углекислого газа, в которой кислорода больше, он предложил рисовать так: . Иными словами, по Дальтону, молекула углекислого газа состоит из трех атомов (двух кислородных и одного углеродного), а молекула окиси углерода - из двух атомов - кислородного и углеродного. Химический анализ углекислого газа показал, что фунт углекислого газа состоит из 5/19 фунта углерода и 14/19 фунта кислорода. Так как такое же самое соотношение должно быть и для массы каждой отдельной молекулы углекислого газа, то, значит, масса атома углерода равна 5/14 частям массы двух атомов кислорода, т. е. она равна 5/7 массы одного кислородного атома. Сохраняя ту же условную единицу (масса атома водорода равна единице массы) и зная, что в этих отношениях масса атома кислорода равна 7, мы найдём, что масса атома углерода должна быть равна 5.
До сих пор мы еще нигде не имели повода проверить правильность этих взглядов, сделав из них какой-нибудь вывод, который можно было бы уже затем сравнить с опытом. Но теперь такая возможность представляется: если верно то, что мы говорили о массах атомов углерода и кислорода, то в окиси углерода, молекула которой имеет вид , отношение массы кислорода к массе углерода должно быть 7 : 5. Так и оказалось: опыт показал, что из 7 фунтов кислорода и 5 фунтов углерода получается 12 фунтов окиси углерода. Таким образом, взгляды Дальтона получили блестящее количественное подтверждение. Следует, впрочем, сказать, что химические анализы Дальтона были довольно неточны и цифры количественного состава химических соединений, которые были здесь приведены, несколько отличаются от правильных. Тем не менее Дальтон, несмотря на грубость своих анализов, был совершенно убежден в правильности атомистической гипотезы.
Таблица химических символов и атомных масс по Дальтону; (1808 г.)
Один биограф Дальтона говорит о нем так: «Дальтон был атомист до мозга костей. Он был глубоко убежден в правильности взглядов Ньютона. Для него его атомы - «твердые, непроницаемые, подвижные» - были такой же реальностью, как если бы он видел их собственными глазами и трогал руками. В своем воображении он видел в воздухе атомы кислорода, азота и водяного пара. Он рисовал их на бумаге».
Приведем из книги Дальтона значки, обозначающие атомы разных химических элементов, и их атомные массы (см. таблицу; за единицу массы по-прежнему принята масса атома водорода).
Таковы те первичные частицы, те атомы, те «кирпичи мироздания», из которых, по Дальтону, состоят все тела на свете.
Комбинация из нескольких атомов образует молекулу («сложный атом», как говорил Дальтон); сложные тела состоят из одинаковых молекул - такие тела являются химическими соединениями, например вола или аммиак, и их состав в процентах может быть легко вычислен, если знать состав молекулы (например, в случае воды в , в случае углекислого газа) и относительные массы атомов, входящих в молекулу; или же сложные тела состоят из разных молекул - такие тела являются не химическими соединениями, а смесями, например, воздух представляет смесь молекул кислорода с молекулами азота и с небольшим количеством молекул воды и углекислого газа.
Химические реакции, по Дальтону, заключаются в том, что атомы вступают друг с другом в разные комбинации, образуя «сложные атомы» (молекулы), затем эти молекулы распадаются, образуются новые молекулы и т. д., подобно тому, как танцоры, переходя от одного танца к другому, образуют новые комбинации. Но сами атомы при этом остаются неизменными и вечными: меняется только их распределение. «Каждая частица воды,- говорит Дальтон в своей «Химической философии»,- в точности похожа па любую другую частицу воды; каждая частица водорода в точности похожа на любую другую частицу водорода и т. д. Химическое разложение и химическое соединение означают лишь то, что атомы удаляются друг от друга или же снова сцепляются вместе. Но химик не способен уничтожить материю или создать ее вновь. Пытаться создать или уничтожить хотя бы один атом водорода так же безнадежно, как пытаться прибавить еще одну планету к Солнечной системе или уничтожить какую-нибудь из существующих планет. Все, что мы можем сделать,- это разъединить атомы, соединившиеся или сцепившиеся друг с другом, или же соединить те атомы, которые сейчас находятся на большом расстоянии друг от друга».
«Химическая философия», изложенная в этих строках Дальтона, действительно стала философией целого ряда поколений химиков и физиков. Невозможность создания хотя бы одного нового атома данного химического элемента, невозможность превращения одних атомов в другие - все это было необходимым выводом из всего огромного опытного материала, на котором основывалась научная химия. Когда-то, в средние века, химики - тогда они назывались алхимиками - поставили своей целью искусственное приготовление золота; но это невозможно, как следует из «химической философии» Джона Дальтона, потому что ведь золото - это химический элемент, и, значит, невозможно ни создать, ни разрушить хотя бы один-единственный атом ; можно лишь извлечь золото из какого-нибудь химического соединения, в котором оно уже находится, но невозможно создать новое золото из свинца или ртути. И в самом деле, разве из всех стараний алхимиков хоть что-нибудь вышло? Получить золото из свинца или ртути им так и не удалось. И «химическая философия» Дальтона раз и навсегда ставила крест над попытками алхимиков: эти попытки были обречены на неудачу, потому что атомы вечны и неразрушимы.
В этом пункте Дальтон не совсем сходился с Бойлем, который в 1661 году писал, что хотя атомы остаются неизменными при всех химических явлениях, но тем не менее когда-нибудь будет найден некий «сильный и тонкий агент», с помощью которого удастся разбить атомы на более мелкие части и превратить одни атомы в другие. Эта мысль Бойля казалась Дальтону чистой фантазией: ни один химический факт не указывал на то, что атомы возможно разбивать на части и превращать друг в друга. Впрочем, в 1816 году неожиданно нашелся один сторонник этой мысли Роберта Бойля, пытавшийся подтвердить ее фактами. Это был лондонский вольнопрактикующий врач Уильям Праут, который напечатал в журнале «Философские анналы» («Annals of Philosophy») статью, где обращал особенное внимание на тот факт, что все атомные массы, которые определил Дальтон и которые приведены в его «Химической философии», выражаются целыми числами. .Это - очень замечательный факт, говорил Праут, ведь если бы атомы всех химических элементов были первичными, основными частицами, подлинными «кирпичами мироздания», неразложимыми на частя и нисколько не связанными друг с другом, то какая могла бы быть причина того, что атом азота ровно в пять раз превосходит по массе атом водорода, а атом кислорода - ровно в семь раз? Праут предложил совсем другом взгляд на атомы, нисколько не противоречащий химическим опытам, но вместе с тем объясняющий и тот замечательный факт, что все атомные массы (измеренные в предположении, что масса атома водорода принята за единицу) оказались целыми числами. Мнение Праута вот какое: атом азота, который, по Дальтону, ровно в пять раз превосходит по массе атом водорода,- это и есть пять атомов водорода, очень тесно сцепленных друг с другом; атом кислорода - это семь атомов водорода, тесно сцепленных друг с другом; атом ртути - это 167 тесно прижавшихся друг к другу водородных атомов и т. д. Выходит, что все на свете состоит в конечном счете из водорода. А чем же объяснить, что все-таки в химических опытах никак не удается, например, разложить кислород на водород? Очень просто, отвечает Праут, все дело в том, что когда семь атомов водорода сцепляются, чтобы образовать атом кислорода, то они сцепляются гораздо теснее, чем тогда, когда, например, атом водорода и атом кислорода сцепляются, чтобы образовать молекулу воды. Поэтому-то в химических опытах и удается разложить молекулу воды на атом водорода и атом кислорода, но никак не удается разложить атом кислорода на семь атомов водорода, т. е. удается разложить воду на водород и кислород, но не удается превратить кислород в водород. Атомы всех веществ, кроме водорода, по мнению Праута,- это такие же молекулы, но только гораздо более прочные и тесно сцепившиеся, а поэтому, действуя обыкновенными химическими способами, не удается их разложить. Но что произойдет, если когда-нибудь будет найден «сильный и тонкий агент», о котором мечтал Роберт Бойль? Ведь с его помощью возможно будет превращать элементы друг в друга и даже, если угодно, осуществить идеал алхимии - получение золота: например (см. таблицу Дальтона), разбить атом на один атом и двадцать семь атомов , т. е. разложить ртуть на золото и водород.
Статья Праута была очень убедительна,- многие поверили в то, что водород есть действительно «первичное вещество», из которого состоит все на свете. Одна только была беда - те химические анализы, основываясь на которых Дальтон вычислил свои атомные массы, были очень уж неточны: Дальтон был, правду сказать, плохой экспериментатор. Если провести анализы тщательнее и вычислить атомные массы точнее, то окажутся ли они по-прежнему целыми числами?
За грандиозную работу точного определения атомных масс и точного анализа состава химических соединений взялся знаменитый шведский химик Пенс Якоб Берцелиус. Берцелиусу, больше чем кому-нибудь другому, химия обязана тем, что она стала точной наукой. Берцелиус был убежденнейшим сторонником атомистической теории Дальтона, которую он называл «одним из величайших успехов химии». Но в других отношениях он многого не мог простить Дальтону. «Следует упрекнуть Дальтона в том,- писал Берцелиус,- что он чересчур доверял своей собственной гипотезе и мало подвергал ее экспериментальной проверке. Можно подумать, что даже в тех немногочисленных химических анализах, которые производил Дальтон, он руководствовался желанием получить определенный результат, а ведь такого способа действий всегда нужно остерегаться, особенно если цель опытов - получить решающее доказательство в пользу или против какого-нибудь предвзятого теоретического мнения». И Берцелиус вооружился самой точной химической аппаратурой, какую только он мог достать или построить, и принялся за свои анализы. В течение своей жизни Берцелиус проанализировал больше двух тысяч различных химических соединений, и результаты его анализов отличаются от самых точных теперешних результатов не больше чем на 1-2% (попутно Берцелиус открыл и несколько химических элементов, до него неизвестных: селен, кремний, циркон[ 4 ], торий, тантал). Вычисляя атомные массы, Берцелиус никогда не определял состав молекулы анализируемого вещества наугад, как это делал Дальтон, предположивший «для простоты», что молекула воды имеет состав , а молекула аммиака - состав (т. е. что каждая из этих молекул состоит из двух атомов). Берцелиус стремился определить состав молекулы так, чтобы удовлетворительно объяснить возможно большее число химических фактов. Таким образом Берцелиус обнаружил, например, что молекула воды состоит не из двух атомов, а из трех - одного кислородного и двух водородных, что молекула аммиака состоит из четырех атомов - одного азотного и трех водородных, и т. д. Все это привело к тому, что хотя работы Берцелиуса и дали блестящее подтверждение основных идей Дальтона, но полученные Дальтоном конкретные цифры - атомные массы - оказались сплошь неверны. Берцелиус опубликовал свои атомные массы два раза. Один раз в 1818 году он выпустил таблицу атомных масс, основанную на химических анализах, которые представляли рекорд возможной тогда в химии точности (но, все же в атомных массах, выведенных из этих анализов, еще было очень много ошибок вследствие неверных формул состава молекул). В 1826 году Берцелиус опубликовал новую таблицу, в которой он побил свои собственные рекорды точности. Атомные массы, которые были помещены в этой таблице, в громадном большинстве случаев очень близки к тем, которые приняты в химии и теперь.
Небольшую путаницу, которая еще оставалась у Берцелиуса, устранил в 1860 году итальянский химик Станислав Канниццаро; собравшийся 3 сентября 1860 года в Карлсруэ Международный конгресс химиков принял систему относительных атомных масс, предложенную Канниццаро, и этот момент принято считать началом современной химии.
Мы приведем таблицу химических элементов и их атомных масс, принятую в настоящее время[ 5 ]. Заметим только, что теперь в качестве единицы атомной массы уже больше не принимают массу атома водорода, как предлагал в свое время Дальтон.
Сейчас атомная единица массы (а.е.м.) выбрана так, чтобы масса атома самого распространенного изотопа углерода была в точности равна 12 а.е.м. Масса атома водорода оказалась при этом чуть больше 1 а.е.м.
В таблицах обычно указывают относительную атомную массу химического элемента - отношение массы атома элемента к атомной единице массы. Эта система единиц принята и в той таблице, которую мы приводим. Что касается указанных там же значков (символов) химических элементов, то они уже нисколько не похожи на кружки Дальтона. Берцелиус предложил - и это было принято огромным большинством химиков, а потом и всеми без исключения - применять в качестве значка химического элемента начальную букву или две буквы его латинского названия (например, водород обозначать буквой Н от латинского Hydrogenium, азот - буквой N от латинского Nitrogenium, железо - значком Fe от Ferrum, медь - Cu - от Cuprum, углерод - С от Carbo и т. д.). Когда нужно обозначить молекулу, то, если в ней есть несколько атомов одного и того же химического элемента, обозначение этого атома не повторяется, как это делал Дальтон, изображавший, молекулу углекислого газа в виде , а просто внизу приписывается цифра, указывающая число атомов; например, та же молекула углекислого газа, состав которой Дальтон случайно угадал правильно, пишется в виде СO2 (С - углерод, О - кислород), молекула воды записывается Н2O, молекула аммиака - NH3 и т. д. Упрямый Дальтон до конца жизни (он умер в 1844 году) не хотел принять обозначений Берцелиуса (как из того же упрямства он не хотел принять и его точных атомных масс, предпочитая свои, неточные). Ворча, он говорил, что легче изучить древнееврейский язык, чем понять что-нибудь в химических формулах Берцелиуса. Но мы можем наглядно убедиться в удобстве обозначений Берцелиуса на примере молекулы тростникового сахара, которая по системе Берцелиуса записывается формулой С12Н22О11 (12 атомов углерода, 22 атома водорода, 11 атомов кислорода); по Дальтону же пришлось бы нарисовать сорок пять кружков, двенадцать из них зачернить, а в двадцати двух поставить в середине точку. Обозначения Берцелиуса позволяют также легко записать в виде формулы и то, что происходит при химической реакции: это записывают обыкновенно в виде равенства, где слева стоит все, что было до реакции, а справа - все, что стало после реакции. Например, горение водорода в кислороде, дающее в результате воду, пишется в виде уравнения
2H2+O2=2H2O
(две молекулы водорода и одна молекула кислорода дают две молекулы воды; заметим по поводу этой формулы, что обыкновенный водород состоит из молекул, содержащих каждая по два водородных атома, и подобным же образом кислород состоит из молекул, каждая из которых составлена из двух атомов кислорода). Горение черного пороха может быть представлено формулой
2KNO3 + S + ЗС = K2S + N2 + ЗСО2
(две молекулы калийной селитры, атом серы, три атома углерода, соединяясь, дают молекулу сернистого калия, молекулу азота и три молекулы углекислого газа).
Еще удобнее было бы (хотя, впрочем, это мало принято у химиков) вместо знака = писать стрелку , отчетливее указывающую направление химического превращения; обе реакции, которые в виде примера были только что написаны, при этом приняли бы вид
2Н2 + O2 2Н2O, 2KNO3 + S + ЗС K2S + N2 + 3CO2.
После всех этих предварительных разговоров и объяснений приводим таблицу ныне известных химических элементов и их атомных масс.
Не преувеличивая, можно сказать, что эта небольшая таблица, помещающаяся на одной-двух страницах, представляет концентрированный результат упорнейшего труда многих поколений химиков, со времен Берцелиуса и до наших дней. (Порядок, в котором в этой таблице расположены элементы, выбран не случайно: элементы расположены в порядке растущей атомной массы.)
Спросим себя, что же стало с гипотезой Праута, которая была основана на том, что атомные массы элементов - точные целые числа? Осталось ли что-нибудь от этой гипотезы? Увы, не только весьма точные современные числа не подтверждают мнения Праута о целочисленности атомных масс, но даже и первые измерения Берцелиуса показали, что не все атомные массы являются целыми числами.
Таблица химических элементов, их символов и атомных масс[ 6 ]
N п/п Название и символ Атомная масса N п/п Название и символ Атомная масса 1 Водород Н 1,008 37 Рубидий Rb 85,468 2 Гелий Не 4,003 38 Стронций Sr 87,62 3 Литий Li 6,941 39 Иттрий Y 88,906 4 Бериллий Be 9,012 40 Цирконий Zr 91,22 5 Бор В 10,811 41 Ниобий Nb 92,906 6 Углерод С 12,011 42 Молибден Мо 95,94 7 Азот N 14,007 43 Технеций Тс 98,906 8 Кислород О 15,9994 44 Рутений Ru 101,07 9 Фтор F 18,998 45 Родий Rh 102,905 10 Неон Ne 20,179 46 Палладий Pd 106,4 11 Натрий Na 22,990 47 Серебро Ag 107,868 12 Магний Mg 24,305 48 Кадмий Cd 112,40 13 Алюминий А1 26,981 49 Индий In 114,82 14 Кремний Si 28,086 50 Олово Sn 118,69 15 Фосфор Р 30,974 51 Сурьма Sb 121,75 16 Сера S 32,06 52 Теллур Те 127.60 17 Хлор С1 35,453 53 Йод I 126,905 18 Аргон Аr 39,948 54 Ксенон Хе 131,30 19 Калий К 39,098 55 Цезий Cs 132,905 20 Кальций Са 40,08 56 Барий Ва 137,33 21 Скандий Sc 44,956 57 Лантан La 138,906 22 Титан Ti 47,90 58 Церий Се 140,12 23 Ванадий V 50,941 59 Празеодим Рг 140,908 24 Хром Сг 51,996 60 Неодим Nd 144,24 25 Марганец Мп 54,938 61 Прометий Рт 146 26 Железо Fe 55,847 62 Самарий Sm 150,4 27 Кобальт Со 58,933 63 Европий Еu 151,96 28 Никель Ni 58,70 64 Гадолиний Gd 157,25 29 Медь Сu 63,546 65 Тербий Тb 158,925 30 Цинк Zn 65,38 66 Диспрозий Dy 162,50 31 Галлий Ga 69,72 67 Гольмий Но 164,930 32 Германий Ge 72,59 68 Эрбий Еr 167,26 33 Мышьяк As 74,922 69 Туллий Тm 168,934 34 Селен Se 78,96 70 Иттербий Yb 173,04 35 Бром Вr 79,904 71 Лютеций Lu 174,97 36 Криптон Кr 83,80 72 Гафний Hf 178,49Таблица (продолжение)
N° п/п Название и символ Атомная масса N п/п Название и символ Атомная масса 73 Тантал Та 180,948 89 Актиний Ас 227 74 Вольфрам W 183,85 90 Торий Th 232,038 75 Рений Re 186,2 91 Протактиний Ра 231,036 76 Осмий Os 190,2 92 Уран U 238,029 77 Иридий Ir 192,2 93 Нептуний Np 237,048 78 Платина Pt 195,09 94 Плутоний Рu 244 79 Золото Аu 196,967 95 Америций Am 243 80 Ртуть Нg 200,59 96 Кюрий Cm 247 81 Таллий Т1 204,37 97 Берклий Вк 247 82 Свинец Рb 207,19 98 Калифорний Cf 251 83 Висмут Bi 208,981 99 Эйнштейний Es 254 84 Полоний Ро 209 100 Фермий Fm 257 85 Астат At 210 101 Менделевий Md 258 86 Радон Rn 222 102 Нобелий No 255 87 Франций Fr 223 103 Лоурснсий Lo 256 88 Радий Ra 226,025 104 Курчатовий Кu 260Примером может служить хлор, атомная масса которого равна 35,453 (в таблице Берцелиуса, составленной в 1826 году, атомная масса хлора 35,4). Поэтому гипотеза Праута в том виде, в каком он ее сформулировал, безусловно долита быть отброшена.
Заметим все же, просматривая нашу таблицу, что очень многие атомные массы, особенно в начале таблицы, весьма близки к целым числам, иногда в точности им равны, например, у фтора и углерода, а иногда отличаются от них меньше чем на 0,01, например, у водорода, гелия, азота, натрия и т. д. Это странное обстоятельство заставляет как будто отнестись с некоторым вниманием к гипотезе Праута[ 7 ], так как трудно себе представить, чтобы это могло быть результатом чистого случая, но тем не менее такие атомные массы, как у магния или хлора, не говоря уже о многочисленных элементах с большими атомными массами, все-таки принуждают отбросить предположение о том, что все атомы состоят из атомов водорода.
Поэтому в XIX столетии совершенно укрепилось и распространилось представление о том, что все тела в мире состоят из этих нескольких десятков сортов атомов, которые являются совершенно независимыми друг от друга основными элементами мироздания. Атомы вечны и неразрушимы и не могут превращаться друг в друга. «Даже когда Солнечная система распадется и на ее развалинах возникнут другие миры, атомы, из которых она состоит, останутся целыми и неизношенными»,- так сказал в 1873 году в одной речи знаменитый английский физик Джемс Клерк Максвелл, основатель современной теории электрического и магнитного полей. Из этой цитаты видно, как нераздельно властвовали в физике идеи Дальтона даже через несколько десятилетий после появления его «Химической философии».
И все же, несмотря на все это, среди физиков и химиков продолжало жить смутное убеждение в том, что между атомами различных химических элементов имеются какие-то связи, что эти атомы образуют какую-то естественную систему. Удивительно, что эта мысль была отчетливо сформулирована еще задолго до того, как стало известно, какие именно химические элементы существуют в природе. В 1786 году немец Н.Г.Марне напечатал книгу, озаглавленную «О числе элементов». В этой книге, мистической и странной, он выражает свое глубокое убеждение в том, что «от мельчайшей пылинки солнечного пуча до святейшего серафима можно воздвигнуть целую лестницу творений» и что атомы химических элементов тоже являются ступенями этой лестницы. Марне продолжает: «Подобно тому, как каждый отдельный тон созвучен тому же тону октавой выше или ниже вследствие связи между числом колебаний струн, так же и определенные химические элементы («основные вещества», как называет их Марне) могут по тем же причинам стоять в самом близком родстве друг с другом, несмотря на то, что в их естественной последовательности между ними находятся многие вещества: с этими веществами они так же не могут соединиться, как два тона не могут приятно звучать вместе, несмотря на свою близость, если они находятся в отношении секунды».
Эта идея Марне не могла привести ни к каким последствиям, пока химические элементы не были в достаточной мере выделены и изучены. Но после того, как Канниццаро опубликовал (в 1858 году) свою таблицу атомных масс, стремление к естественной классификации химических элементов должно было принести свои плоды.
В 1863 году англичанин Дж. А. Ньюлендс, воспользовавшись атомными массами Канниццаро, нашел, что если . расположить элементы в порядке возрастания их атомных масс, то такой список элементов естественно разлагается на октавы, т. е. на строчки по семь элементов в каждой, где каждый элемент обладает большим сходством с одинаковым по номеру элементом предыдущей и последующей октав. Приведем первые три октавы Ньюлендса:
Н, Li, Be, В, С, N, О;
F, Na, Mg, Al, Si, Р, S;
С1, К, Са, Сг, Ti, Mn, Fe.
Аналогия проявляется в том, что все элементы, стоящие на втором месте в своей октаве (литий, натрий, калий), являются так называемыми щелочными металлами, образующими соединения по одному и тому же типу, например дающими соли LiCl, NaCl, КСl; элементы, стоящие на третьем месте в октаве (бериллий, магний, кальций), являются так называемыми щелочноземельными металлами, дающими тоже похожие друг на друга, но уже иного типа соединения, например соли ВеС12, MgCl2, СаС12.Фтор весьма похож по своей химической природе на стоящий под ним хлор, азот обнаруживает некоторые аналогии с фосфором, кислород - с серой и т. д. Заметим, впрочем, что все получается так хорошо и убедительно лишь в первых октавах Ньюлендса: в дальнейших октавах было гораздо больше путаницы, и в некоторых случаях для ее устранения Ньюлендс позволил себе отступить от принятого им плана и располагать элементы не совсем в порядке возрастания атомной массы. Так или иначе, эта предложенная Ньюлендсом классификация, являвшаяся конкретным воплощением старой идеи Марне, не имела никакого успеха среди химиков. Когда Ньюлендс попробовал "рассказать о своей классификации химических элементов съезду английских естествоиспытателей, его почти не хотели слушать, и председатель химической секции съезда насмешливо спросил Ньюлендса,- а не пробовал ли он располагать химические элементы в порядке алфавита и не получалось ли и при этом каких-нибудь закономерностей.
Через несколько лет после этой попытки Ньюлендса она была повторена двумя другими учеными, работавшими над вопросом естественной классификации элементов совершенно независимо друг от друга. Одним из них был Юлиус Лотар Мейер, профессор университета в Бреслау (ныне Вроцлав в ПНР), другим - Дмитрий Иванович Менделеев, профессор университета в С.-Петербурге. И Мейер, и Менделеев сообразили, что могут существовать и элементы, еще не открытые химиками, а поэтому, если этого требует классификация, можно оставлять в таблице пропуски, соответствующие еще не открытым элементам.
Периодическая таблица элементов, опубликованная в 1869 г. Д. И. Менделеевым.
Кроме того, они сочли схему Ньюлендса с ее одинаковыми строчками чрезмерно узкой и допустили, что строчки (периоды) могут становиться длиннее к концу таблицы. Мы приводим «периодическую таблицу элементов», которую опубликовал Д. И. Менделеев в 1869 году в немецком журнале «Zeitschrift fur Chemie» (таблица приводится в несколько измененном виде, но так, что все идеи Менделеева, содержащиеся в его статье, переданы правильно).
В этой таблице курсивом даны те элементы, которые были поставлены Менделеевым неправильно вследствие познания их атомных масс или по другим причинам (в 1870 году Менделеев исправил большую часть этих ошибок). Уже в четвертой строке таблицы классификация потребовала оставления пустых мест. На этих пустых местах должны находиться какие-то еще не открытые элементы, а именно должен быть один элемент между кальцием п эрбием (впрочем, эрбий здесь поставлен по ошибке, и уже в 1870 году Менделеев правильно поставил вместо эрбия титан) и два элемента между цинком и, мышьяком. Этим элементам Менделеев дал следующие названия: элементу, который должен стоять после кальция, он дал имя экабор, а двум элементам, которые должны идти за цинком,- имена экаалюминий и экакремний (экабор, как видно из таблицы, должен быть аналогичен бору, а экаалюминий и экакремний - алюминию и кремнию). Менделеев был настолько убежден в своей классификации, что имел смелость заранее описать свойства этих трех элементов, прежде чем их откроют. Чтобы предсказать свойства, например, экакремния, он сообразил, что экакремний по своим свойствам должен быть чем-то средним между цинком и мышьяком (но заметно ближе к мышьяку) и что, с другой стороны, он должен иметь много сходства с кремнием и с элементом под ним, т. е. с оловом, будучи чем-то средним между кремнием и оловом. (Все это читатель легко поймет, пользуясь приведенной таблицей.)
И что же? Предсказания Менделеева блестящим образом сбылись. Летом 1875 года французский химик Лекок де Буабодран, исследуя найденный в Пиренейских горах кусок руды (цинковой обманки), обнаружил в этой руде новый химический элемент, который но своим свойствам был совершенно таким же, как предсказанный Менделеевым экаалюминий. Найденному им элементу Лекок де Буабодран дал название галлий (от латинского слова Галлия, что значит Франция). В 1879 году шведские химики Нильсон и Клеве нашли в одном редком норвежском минерале эвксените предсказанный Менделеевым экабор и назвали его скандием (по-латыни Скандия значит Швеция), И наконец, в 1885 году немецкий химик К. Винклер, исследуя только что открытый в фрейбургских рудниках в Саксонии минерал аргиродит, нашел в нем предсказанный Менделеевым экакремний. Продолжая тот же ряд патриотических названий, Винклер назвал экакремний германием.
Чтобы убедиться, насколько точны были предсказания Менделеева, сравним свойства экакремния и германия:
Свойства экакремния (обозначался Es), предсказанные Менделеевым в 1871 г.
Экакремний - серый металл, плавится с трудом, атомная маска - 72.
Плотность экакремния должна быть 5,5 г/см3.
Окись экакремпия должна иметь формулу EsO2 и плотность 4,7 г/см3. Под действием водорода из нее должен выделяться экакремний.
Хлористый экакремний EsCU должен иметь плотность 1,9 г/см3 и кипеть при 90° С.
Фтористый экакремний EsF4 не летуч.
Сернистый экакремний EsS2 должен растворяться в сернистом аммоппи.
Экакремний этил Es(C2H5)4 должен иметь плотность 0,96 г/см3 и кипеть при 160° С.
Свойства германия (обозначается Ge), изученные К. Винклером в 1886 г.
Германий - серый, трудно возгоняющийся металл, атомная масса - 72,6.
Плотность германия 5,409 г/см3.
Плотность окиси германия GeO2 4,703 г/см3. Под действием водорода из нее выделяется германий.
Хлористый германий GeCl4 имеет плотность 1,887 г/см3 и кипит при 86° С.
Фтористый германий GeF4-3Н2O- твердое белое вещество.
Сернистый германий GeS2 растворяется в сернистом аммонии.
Германий этил Ge (С2Н5)4 имеет плотность 0,991 г/см3 и кипит при 160° С.
Пожалуй, можно сказать, что Менделеев предвидел в этом элементе все, кроме его названия.
После такой блестящей победы никто уже не мог сомневаться в том, что «периодический закон» Менделеева действительно выражает какое-то весьма глубокое свойство химических элементов и что атомы химических элементов могут быть расположены в какой-то «системе родства». Но что означает это, родство химических элементов, эти связи между разными атомами, не имеющими, казалось бы, ничего общего друг с другом,- этого в те времена еще никто - в том числе и сам Менделеев - не сумел бы сказать.
Периодический закон Менделеева, как выразился один историк химии, «среди многочисленных зданий научных теорий, воздвигнутых в XIX веке, был похож на обелиск, покрытый непонятными письменами; расшифровать эти письмена - вот великая задача, которую девятнадцатый век оставил в наследство двадцатому».
Приведем еще периодическую таблицу элементов в том виде, который она имела в тридцатых годах. Заметим, что предсказания свойств новых элементов на основании периодического закона неоднократно делались и впоследствии; так, например, У. Рамзай, после открытия (им и Дж. У. Рэлеем) аргона и гелия, предсказал существование неона, криптона, ксенона, которые он потом и открыл вместе с Траверсом в 1898 году.
Нет ничего невозможного в том, что в природе существуют и элементы, обладающие большей атомной массой, чем уран.
Периодическая таблица элементов Менделеева (первая половина 30-х гг. XX века).
Эти элементы, если они существуют, должны были бы в нашей таблице попасть на места, идущие после урана. Но до сих пор эти элементы еще не были обнаружены в природе [ 8 ]).
Таково, в общих чертах, учение об атомах химических элементов, созданное Дальтоном и определившее все дальнейшее развитие химии в XIX столетии. Но если гипотеза об атомах и молекулах оказалась такой важной и такой полезной для химии, то какую роль она сыграла в физике, занимающейся гораздо более широкой областью явлений природы, чем химия? Следует заметить, что в физике гипотеза атомов существовала и играла очень большую роль задолго до той поры, когда Дальтон сделал учение об атомах и молекулах необходимым для того, чтобы хоть что-нибудь понимать в химических явлениях. Ведь мы уже говорили о том, как и к теории атомов относился такой гениальный и авторитетный физик, как Исаак Ньютон. Представление об атомах служило физикам для того, чтобы составить ясное понятие о целом ряде физических явлений. Мы нагреваем тело - это тело расширяется. С точки зрения атомной гипотезы это значит, что атомы несколько отошли друг от друга - пустые промежутки между ними увеличились. Как можно было бы наглядно представить себе такое простое явление, как расширение тел при нагревании, если считать вещество не состоящим из атомов, а непрерывный и сплошным? Все газы обладают гораздо меньшей плотностью, чем жидкости и твердые тела,- это значит, что атомы (или молекулы) газов находятся на очень больших расстояниях друг от друга; поэтому-то так легко сжать газ, т. е. уменьшить пустые промежутки между его атомами или молекулами. Сжать сколько-нибудь заметно жидкость или твердое тело очень трудно, а уменьшить посредством сжатия объем жидкого или твердого тела в несколько раз вовсе невозможно. Что это значит? Это значит, что в жидких и твердых телах между атомами почти нет пустых промежутков; атомы почти соприкасаются друг с другом, как дробинки в мешочке с дробью, если его хорошенько встряхнуть.
Всякий газ давит изнутри на поверхность стенок того сосуда, в котором этот газ заключен. Как это понять? Очень просто: стоит только предположить, что атомы (или молекулы) газа не находятся в покое, а, напротив, все время очень быстро движутся. Если это так, то они должны все время наталкиваться на стенки сосуда и отскакивать от них, как отскакивают бильярдные шары от борта бильярда; стенки сосуда, в котором заперт газ, должны все время испытывать изнутри целый град толчков, целую бомбардировку со стороны молекул газа. Если увеличить объем сосуда, отодвинув в нем крышку или поршень, или если открыть перед молекулами газа дверь, ведущую в соседнее пустое пространство, то быстро движущиеся молекулы сейчас же начнут проникать в предоставленный им новый объем, пока весь сосуд не заполнится газом равномерно и целиком. Вот почему всякий газ всегда стремится расшириться и заполнить весь предоставленный ему объем. Легко понять, что будет, если сжать газ, находящийся в каком-нибудь сосуде с поршнем: молекулы газа, занимавшие раньше большой объем, теперь вынуждены будут сконцентрироваться в меньшем объеме, а поэтому на каждый квадратный сантиметр поверхности стенки будет приходиться в течение секунды больше ударов молекул, т. е. молекулярная бомбардировка на каждый квадратный сантиметр стенки возрастает. Давление газа, запертого в сосуде, увеличивается при уменьшении объема этого сосуда. Если нагреть газ, запертый в сосуде, не изменяя его объема, то давление газа, как показывают опыты, возрастает. Так как число атомов и молекул осталось тем же самым, то для того, чтобы понять, почему молекулярная бомбардировка увеличилась, необходимо допустить, что при повышении температуры молекулы и атомы начинают двигаться быстрее: вследствие увеличившейся скорости их движения возрастет и число ударов в секунду о стенку (ведь при возросшей скорости каждая молекула успевает в течение секунды большее число раз слетать от одной стенки сосуда до другой и обратно) и, кроме того, возрастет и сила каждого отдельного удара. Это допущение о том, что при повышении температуры скорость движения атомов и молекул растет, должно относиться не только к газам, но и к жидкостям, и к твердым телам: без этого невозможно понять, каким образом при нагревании происходит испарение.
В самом деле, как должны мы наглядно представлять себе твердые тела и жидкости? Жидкости очень подвижны и текучи; это значит, что атомы и молекулы жидкостей, все время тесно соприкасаясь друг с другом, вместе с тем легко и быстро скользят, перемещаясь по всему объему жидкости (иногда бывает, что молекула какой-нибудь жидкости так же легко и просто может перемещаться среди молекул другой жидкости; вот почему так быстро происходит, например, перемешивание воды и спирта, если спирт налит поверх воды в какой-нибудь сосуд).
Твердые тела, наоборот, имеют некоторую упругость, т. е. стремятся все время сохранить свою форму; поэтому приходится заключить, что атомы твердых тел всегда находятся в каких-то определенных положениях равновесия и могут только совершать около этих положений более или менее быстрые колебания. Быстрота движений, совершаемых молекулами и атомами жидких и твердых тел, должна, как и в газах, возрастать при увеличении температуры. Этим объясняется испарение при нагревании, так как более быстро движущиеся молекулы жидкости могут преодолеть притяжение со стороны окружающих молекул той же жидкости и выскочить из жидкости наружу. Пар, насыщающий пространство над поверхностью данной жидкости,- это и есть тот газ, который состоит из таких «сбежавших из жидкости» молекул. Из жидкости выскакивают, правда, все новые и новые молекулы, по молекулы пара, падающие на жидкость, проникают туда вновь, и поэтому в конце концов устанавливается равновесие между жидкостью и ее паром, когда в каждую секунду столько же молекул выскакивают из жидкости («испаряется»), сколько их падает в жидкость обратно.
Из всего сказанного видно, какие простые и ясные представления вносит гипотеза атомов и молекул в физику. Основным в этой атомно-молекулярной картине газов, жидкостей и твердых тел является представление о том, что с возрастанием температуры растет и скорость движения атомов. Это представление сыграло очень большую роль в истории атомистического учения.
До XIX столетия среди физиков господствовало мнение, что теплота есть какое-то невесомое вещество - «теплород»,-которое может соединяться с обычными веществами. Нагретое тело, согласно этой точке зрения,- это такое, в котором много теплорода; при охлаждении тела теплород и з него уходит. Это широко распространенное представление о вещественности тепла было опровергнуто, как только физики стали изучать связь между теплотой и движением. Наличие этой связи очевидно: при трении, которым сопровождается движение, возникает тепло,- этим издавна пользовались для добывания огня народы, стоящие на низких ступенях культуры,- с другой же стороны, теплота, выделяющаяся при сжигании угля в топке парового котла, является основной причиной возникающего в паровой машине движения поршня в цилиндре, махового колеса, шатуна и т. д.
В 1798 году некий Бенджамин Томпсон, американец, авантюрист, прежде сражавшийся на стороне Англии во время войны за независимость Соединенных Штатов, а затем поступивший на службу к баварскому королю, от которого, он получил титул графа Румфорда, наблюдал в мюнхенском арсенале сверление пушечных жерл. Сверление сопровождалось выделением очень большого количества тепла. Когда Румфорд погружал просверливаемую металлическую болванку вместе с работающим в ней сверлом в воду, то вода через два с половиной часа начинала кипеть. Пораженный этим огромным выделением тепла, Румфорд подробно исследовал все условия, при которых тепло возникает. Оказалось, что если просверлить в болванке жерло острым сверлом, а затем заменить его тупым сверлом, которое уже не может отделять от металла стружки, но все же поворачивается с большим трением, то дальнейшее вращение сверла позволяет извлечь из болванки любое количество тепла - стоит только вращать сверло достаточно долго. Это было несовместимо с представлением о вещественности тепла: если бы теплота была веществом («теплородом»), то из данной болванки нельзя было бы извлечь больше тепла, чем в ней в действительности содержалось. Поэтому Румфорд решил, что теплота не вещество, а движение. Теплота - это движение невидимых глазу атомов, из которых состоит любое вещество. Нагреть какое-нибудь тело - это значит привести его атомы в более быстрое движение, чем то, в котором они находились раньше. Охладить тело - значит замедлить движение атомов. Так возникла механическая теория тепла (термодинамика), получившая свое окончательное обоснование уже только в последней четверти XIX века - в работах Людвига Больцмана и Уилларда Гиббса, которые доказали, что все законы тепловых явлений могут быть выведены теоретически, если применять теоремы механики к движению невидимых глазу атомов. Это был такой же триумф атомистической теории, как и тот, который ей доставили работы Дальтона в химии: не только химические, но и физические явления легко объяснялись с помощью предположения, что все тела состоят из мельчайших, невидимых глазу атомов.
И все же атомистической теории в это время (к концу XIX столетия) еще не хватало многого. Представление об атомах все еще не было достаточно конкретным. Пусть мы знаем, что существуют такие-то и такие-то атомы - атомы кислорода, железа, фосфора, серы и т. д.,- но много ли мы знаем о самих этих атомах? Мы можем только сравнивать их друг с другом, можем говорить, что масса атома кислорода в 16 раз больше массы атома водорода, а масса атома серы в два раза превышает массу атома кислорода, но о каждом из этих атомов в отдельности мы ничего не можем сказать. Мы не можем сказать, какова масса атома водорода и каковы его размеры; мы знаем, что капелька воды состоит из молекул Н2O, но не можем сказать, из скольких молекул, и т. д. И постепенно у многих начинало складываться впечатление, что этого мы так-таки никогда и не узнаем и что ничего, кроме отношений химических элементов друг к другу, в природе нет, а те атомы - атомы водорода, кислорода, азота, которые Дальтон так ясно представлял себе и рисовал на бумаге в виде кружочков,- те атомы являются чистейшей фантазией - мы никогда не сумеем их взвесить, измерить и понять их настоящие свойства. Жесточайшим нападкам подвергалась атомистическая теория со стороны многих философов. Артур Шопенгауэр утверждал в своем сочинении «Мир как воля и представление», что химические атомы Берцелиуса являются лишь формой выражения тех относительных количеств, в которых вещества вступают друг с другом в химические соединения; поэтому следует считать атомы, по существу, лишь арифметическими понятиями, лишь «расчетными единицами» (Rechenpfennige). В другом сочинении - «О философии естествознания» - он бранит химиков, называя их «невежественными аптекарями, занимающими профессорские кафедры», и говорит, что они «с таким детским самомнением и с такой уверенностью толкуют об эфире и его колебаниях, об атомах и о прочих глупостях, как если бы они все это видели и трогали руками». В конце XIX столетия возникла целая школа физиков и философов, которая осуждала все попытки атомистической теории проникнуть во внутренний механизм явлений: эти философы признавали достойным изучения только непосредственное ощущение предметов внешнего мира и отвергали всякие стремления объяснять их наблюдаемые свойства (их цвет, твердость, температуру и т. п.) при помощи атомов, которые настолько малы, что наши органы чувств не могут их наблюдать непосредственно. (Уничтожающую критику учений этой философской школы можно найти в книге В. И. Ленина «Материализм и эмпириокритицизм».) Выдающиеся представители этой школы (Мах, Дюгем, Оствальд) выставляли против теории атомов те же самые возражения, какие в свое время выставил Шопенгауэр. Все они единодушно сходились в том, что «атомистической теории следовало бы уже давно истлеть в пыли библиотек», как выразился Вильгельм Оствальд в своих лекциях по философии природы, которые он читал в Лейпцигском университете летом 1901 года.
Но сторонников атомистической теории не смущали злые нападки философов. Они упорно стремились найти убедительные доказательства реальности атомов. Увидеть атом, взвесить его, измерить его размеры - вот что стало заветной мечтой атомистов. Но как это сделать, если атомы настолько малы, что ускользают не только от наших невооруженных органов чувств, но и от самых усовершенствованных микроскопов! Жигмонди и Зидентопф построили и усовершенствовали так называемый «ультрамикроскоп», позволяющий обнаружить в коллоидном растворе золота золотые частички, масса которых чуть ли не в миллиард раз меньше грамма. Но в том же растворе присутствуют и более мелкие частички золота - значит, атом золота весит еще меньше. Каким же образом можно взвесить атом? Не следует ли отказаться от этой задачи, признать ее принципиально неразрешимой? Если мы признаем эту задачу принципиально неразрешимой, т. е. если мы признаем атомы принципиально ненаблюдаемыми, то тогда Оствальд и компания окажутся нравы, потому что принципиально ненаблюдаемое не может служить объектом изучения в физике и должно считаться лишь результатом неправильного образования понятий. Вот почему атомисты не хотели примириться с таким решением вопроса и не захотели утверждать, что «атомы существуют, но их наблюдать, взвесить и измерить никогда не удастся». Если бы они это утверждали, то это означало бы капитуляцию перед философами, считавшими, что книги по атомистической теории должны сгнить в пыли библиотек.
И в конце концов атом действительно удалось взвесить. Этому помогло одно странное явление, которое было открыто еще в первой половине XIX века и на которое физики в свое время не обратили должного внимания. Это явление называется броуновским движением.
В 1828 году знаменитый английский ботаник Роберт Броун проделал одно в высшей степени интересное наблюдение. Испытывая только что присланный ему новый усовершенствованный микроскоп с ахроматическим объективом, Роберт Броун вздумал рассмотреть с помощью этого микроскопа ничтожную каплю жидкости, содержащейся в крохотных зернышках пыльцы растений. В такой жидкости всегда имеется большое количество микроскопических твердых частиц. Как удивлен был Броун, когда увидел, что эти частицы не остаются на месте, а движутся, движутся непрерывно, точно исполняя какой-то фантастический танец! Когда в поле зрения микроскопа было видно много таких частиц, то получалось такое же впечатление, как от тучи каких-то мельчайших мошек. Твердые частицы микроскопических размеров, находящиеся в жидкости, движутся, как если бы они были живыми, и, действительно, у наблюдателя остается именно такое впечатление. Но уже Роберт Броун, который первым наблюдал это хаотическое движение микроскопических частиц, получившее свое название от его имени, пришел к другому заключению: частицы движутся не потому, что они живые. Частицы мертвого вещества, обладающие такими же размерами, тоже должны совершать аналогичное движение, если только они окружены со всех сторон жидкостью. Так утверждал Броун, и это было полностью подтверждено многочисленными последующими наблюдениями.
Можно было бы думать, что броуновское движение микроскопических частиц вызывается какими-то потоками в самой жидкости, связанными с разностью давления в различных точках жидкости. Каждому приходилось наблюдать движение пылинок в воздухе, освещенном падающими сбоку солнечными лучами. Это движение действительно связано с токами воздуха, но броуновское движение имеет совершенно другой характер. В самом деле, если внимательно наблюдать за движением пылинок в солнечном луче, то легко заметить, что соседние пылинки, попавшие в небольшую струю воздуха, движутся в одну и ту же сторону. А если наблюдать за броуновским движением микроскопических частиц, то оказывается, что между направлением движения соседних частиц нет решительно ничего общего: частицы движутся совершенно независимо друг от друга, даже если им случится подойти друг к другу на самое крохотное расстояние, равное диаметру отдельной частички. Значит, совсем не от токов жидкости происходит это непостижимое и фантастическое движение микророскопических твердых частичек.
Во второй половине XIX века броуновское движение подробно исследовал французский физик Гуи. Он проделал целый ряд опытов, которые убедили его в том, что причина броуновского движения скрыта в самой жидкости. Не от внутренних токов жидкости, вызванных ничтожными разностями температур, и не от внешних толчков и сотрясений происходит броуновское движение. Гуи пробовал сравнивать броуновское движение в лаборатории, расположенной на шумной улице, по которой проезжают тяжелые экипажи, с тем же броуновским движением, наблюдаемым ночью в глухом подвале, в деревне,- разницы не получалось никакой. Толчки от экипажей заметны, но они сказываются не на хаотическом движении броуновских частиц, а на движении всей капельки жидкости в целом: двигаясь как целое, капелька увлекает за собой все частицы в одном и том же направлении, н это движение очень легко отличить от накладывающегося на него хаотического движения броуновских частиц, происходящего по всем возможным направлениям. Гуи убедительно доказал, что броуновское движение, как уже предполагал и сам Броун, нисколько не связано с тем, что жидкость, в которой оно наблюдается, взята из живого существа - из растений: искусственно приготовленные жидкости с взвешенными в них микроскопическими частицами, в которых нет ничего живого, тоже обнаруживают броуновское движение.
В 1881 году польский физик Бодашевский показал, что броуновское движение происходит и в газах, а не только в жидкостях. Для того чтобы наблюдать броуновское движение, он рассматривал при боковом освещении микроскопические частички, образующие табачный дым. Крохотные частички угля, из которых состоит дым, плясали во все стороны совершенно таким же образом, как плясали твердые частички, наблюдавшиеся Робертом Броуном в жидкости.
Настоящую причину броуновского движения угадал в 70-х годах прошлого столетия бельгиец Карбонель. Его объяснение, гениальное по своей простоте, состоит в следующем: микроскопические частицы движутся потому, что они испытывают толчки со стороны невидимых молекул и атомов окружающей их жидкости. Рассматривая движение броуновских частичек, мы получаем некоторое представление о том, как движутся невидимые молекулы жидкости,- совершенно таким же образом, как мы узнаем о волнении на море, когда, стоя далеко от берега, видим качание лодки, швыряемой волнами во все стороны. Броуновское движение является поэтому мостом, соединяющим невидимый мир атомов и молекул с миром, доступным восприятию при помощи наших органов чувств.
Почему броуновское движение можно наблюдать только в том случае, когда частички очень малы? Очень просто, отвечает на этот вопрос Карбонель: если поверхность частицы велика, то количество толчков, получаемых ею справа, всегда окажется приблизительно равным количеству толчков, получаемых ею же слева, и ничтожное различие в количестве толчков будет совершенно недостаточно для того, чтобы сдвинуть с места большую и тяжелую частицу. Если же частица имеет ничтожный вес и ничтожные размеры, то в хаосе молекулярных движений жидкости- всегда может случиться, что с одной стороны частицы будет в данный момент случайно больше толчков, чем с другой, а поэтому легкоподвижная частица двинется в ту сторону, куда ее толкнут молекулы. Через какой-то очень короткий промежуток времени избыток молекулярных толчков будет сдвигать броуновскую частицу уже по другому направлению, еще через какой-то короткий промежуток времени - по третьему и т. д., и т. д. Вот почему броуновская частица и совершает свое движение, напоминающее пляску дикарей.
Если это, предложенное Карбонелем, объяснение правильно, то чем частицы легче и мельче, тем броуновское движение должно быть интенсивнее. Так и есть в действительности - уже Броун сумел это заметить. Кроме того, ведь мы знаем, что движение молекул жидкости происходит тем быстрее, чем выше температура, и, в самом деле, Гуи нашел из своих опытов, что при повышении температуры броуновское движение делается все интенсивнее и интенсивнее. Когда Жигмонди изобрел свой ультрамикроскоп и смог наблюдать ничтожнейшие частицы золота в коллоидном растворе (диаметр частиц меньше миллионной доли сантиметра), то броуновское движение этих частиц оказалось таким быстрым, что получилось какое-то сплошное мелькание: частицы двигались с такой скоростью, что их иногда удавалось видеть только в точках поворота их пути, где скорость несколько уменьшалась. Жигмонди описывает первое впечатление так: «Это какое-то непрерывное прыганье, скакание, столкновения и раздевания, так что трудно разобраться в этой путанице».
Шведский физик Сведберг, изучавший после Жигмонди броуновское движение частиц в коллоидном растворе золота, придумал для устранения этого мелькания следующий способ: он открывал поле зрения ультрамикроскопа с помощью моментального фотографического затвора, регулируя продолжительность того времени, в течение которого затвор открыт. Уменьшая этот промежуток времени, можно добиться того, что мелькание исчезает, а при дальнейшем его уменьшении частицы начнут казаться неподвижными, как летящая птица на моментальном фотографическом снимке. Чем быстрее броуновское движение, тем более коротким должен быть тот промежуток времени, в течение которого затвор открыт. И Сведберг нашел из своих опытов - в полном согласии с теми теоретическими выводами, о которых мы говорили,- что при повышении температуры коллоидного раствора приходится открывать фотографический затвор на все более и более короткое время для того, чтобы мелькание прекратилось.
Мы переходим теперь к рассказу о классических работах, которые сделал французский физик Жан Перрен (1908 г.). В этих работах было окончательно проверено и установлено, что броуновское движение в жидкостях вызвано движением молекул, и тем самым дано решающее доказательство действительного существования молекул и атомов.
Перрен брал кусочки резиновой смолы «гуммигута» (желтая краска) и растирал их рукой в воде, как растирают кусочек мыла. Гуммигут постепенно растворялся в воде, пока она не становилась ярко-желтого цвета. После этого Перрен брал немножко такой жидкости под микроскоп. Под микроскопом оказывалось, что гуммигут на самом деле совсем не растворился в воде, а распался на множество шаровидных мелких зернышек, которые разбрелись по всему объему воды. Зернышки эти очень различны по размерам. А Перрену хотелось иметь такую жидкость, в которой были бы совершенно одинаковые по размерам частицы гуммигута. Для этого он воспользовался «центрифугой» (центробежной машиной), такой же, какой пользуются на крупных молочных фермах для отделения сливок от молока или же в медицинских лабораториях -для удаления кровяных шариков из крови, после чего остается однородная жидкость - кровяная сыворотка. Центрифуга Перрена делала 2500 оборотов в минуту, и возникающая при этом центробежная сила выбрасывала из жидкости зернышки гуммигута- Перпендикулярно к оси центрифуги были расположены стеклянные пробирки, в которых содержалась эмульсия гуммигута (так называется вода со взвешенными в ней частичками гуммигута). Центробежная сила, возникавшая при вращении центрифуги, была настолько велика, что на расстоянии 15 см от оси она превосходила силу тяжести в тысячу раз. Эта центробежная сила стремилась прижать частицы гуммигута ко дну пробирки, расположенному подальше от оси: частицы «выпадают» из эмульсии на дно пробирки под влиянием центробежной силы совершенно таким же образом, как грязь и муть выпадают из речной воды под влиянием силы тяжести,- разница лишь в том, что в опытах Перрена частицы выпадали не вниз, а вбок, в ту сторону, в которую действовала центробежная сила.
Первыми выпадали тяжелые частицы, а вслед за ними и легкие. Это давало возможность отделить частицы друг от друга по массе (а значит, и по размерам, потому что все частицы сделаны из одного и того же материала, и поэтому, чем больше их масса, тем больше и размеры). Разумеется, разделение происходило не сразу, а постепенно: задумав получить однородную эмульсию с частицами какого-то совершенно определенного размера, Перрен сперва получил эмульсию, в которой частиц такого размера было больше, чем частиц других размеров, затем эту эмульсию он снова подвергал центрифугированию и выделял из нее часть, в которой процент частиц заданных размеров был еще больше, и т. д., и т. д., пока, наконец, не получилась порция эмульсии, в которой были зернышки только нужных размеров. Это очень кропотливая и тяжелая работа: приходится работать целый месяц для того, чтобы из одного килограмма гуммигута получить несколько десятых или даже сотых долей грамма круглых зерен нужной величины. Перрен сумел получить несколько порций эмульсии с диаметром зерен в 0,50, 0,46, 0,37, 0,21 и 0,14 микрона[ 9 ] (микрон - это тысячная доля миллиметра) .
С помощью таких эмульсий Жан Перрен произвел множество замечательных опытов, о которых мы здесь и расскажем. Он поместил каплю эмульсии с определенным диаметром зерен в плоскую ванночку (кюветку) с глубиной 0,1 мм. Кюветка была вслед за тем покрыта тонким покровным стеклышком, края которого были залиты парафином: таким образом капля оказалась размазанной в сосуде, в котором она герметически заперта, так что никакое испарение уже невозможно.
Перрен сперва поставил свою кюветку на бок и стал смотреть на нее в микроскоп. В поле зрения микроскопа оказалась тонкая вертикальная водяная стенка, внутри которой распределились зернышки гуммигута.
Рис. 3. Распределение зернышек гуммигута по высоте: а) рисунок воспроизводит фотографию, полученную Перреном в его лаборатории;
Рис. 3. Распределение зернышек гуммигута по высоте: б) рисунок составлен из пяти наложенных друг на друга фотографических снимков.
Распределение зернышек сперва было однородным (это произошло, как потом выяснилось, вследствие неизбежного встряхивания препарата при его установке под микроскоп), но потом, с течением времени, распределение изменилось и в конце концов стало таким: очень много зернышек внизу, а по мере продвижения вверх их становится все меньше и меньше. Число зернышек в одном кубическом микроне уменьшается с увеличением высоты, и притом по некоторому вполне определенному закону.
Этот закон уменьшения плотности эмульсии с высотой Перрен захотел исследовать. Для этого он положил кюветку на донышко и стал смотреть на нее сверху в микроскоп, имевший очень маленькую глубину поля зрения: в .микроскоп было видно все, что происходит в тонком слое глубиной в один микрон. Передвигая микроскоп вверх и вниз, можно было смещать этот слой то выше, то ниже. Перрен стал работать так: поставил микроскоп на какой-то высоте и начал считать, сколько зернышек виднеется в поле зрения па этой высоте, затем передвинул микроскоп на новую высоту и снова сосчитал число зернышек и т. д. Заметим, что при этом числом зернышек считается среднее из нескольких наблюдений, потому что зернышки движутся совершенно хаотически и, следовательно, их число в поле зрения микроскопа бывает то больше, то меньше, в зависимости от случая. Поэтому на одной и той же высоте Перрен производил подсчет зернышек много раз и затем уже определял среднее значение, характерное для каждой такой высоты.
Казалось бы, можно было производить под микроскопом моментальные фотографические снимки, а затем уже на досуге спокойно сосчитать, сколько имеется зернышек в поле зрения на данной высоте. Но моментальные фотографические снимки в этих условиях плохо получаются, потому что не удается осветить зернышки достаточно ярко (Перрену удавалось получать моментальные снимки в случае частиц с диаметром больше чем 0,5 микрона, для меньших же частиц фотографии получались чересчур не отчетливые.) Поэтому Перрену пришлось сильно сузить поле зрения микроскопа, помещая между микроскопом и препаратом кружочек фольги, проколотый иголкой: в микроскоп было видно только то, что происходило на площади, равной отверстию, сделанному иголкой. Препарат освещался очень короткое время - для этого на пути лучей, освещавших препарат, ставился фотографический затвор,- и каждый раз в поле зрения было видно сравнительно небольшое число зернышек: не больше пяти. Для этого-то и должен был Перрен сузить поле зрения микроскопа: если бы каждый раз в поле зрения получалось много частиц, то наблюдатель никак не успевал бы их сосчитать. Сосчитать же зернышки, если их число не превышает пяти, легко. Зато приходилось компенсировать это уменьшение поля зрения тем, что в одном таком поле зрения делалось очень много отсчетов, и затем уже из полученных результатов вычислялось среднее арифметическое.
Приведем результаты одного из опытов Перрена. Глубина кюветки была, как мы уже говорили, 100 микрон (т. е. 0,1 мм). Отсчеты производились на высотах 5, 35, 65 и 95 микрон над уровнем донышка кюветки. Оказалось, что среднее число частиц на высоте 35 микрон составляет половину того, которое было на высоте 5 микрон; число частиц на высоте 65 микрон было равно половине числа частиц на высоте 35 микрон, а число частиц на высоте 95 микрон равнялось половине числа частиц на высоте 65 микрон. Иными словами, при подъеме вверх на каждые 30 микрон число частиц в данном объеме (соответствовавшем глубине и ширине выбранного поля зрения) уменьшалось вдвое. Поэтому математический закон убывания плотности (числа зерен в данном объеме) с высотой может быть выражен так: если высоты образуют арифметическую прогрессию, то числа зерен образуют геометрическую прогрессию.
Такой закон убывания плотности зерен с высотой должен был сильно поразить и заинтересовать Перрена: ведь по такому же самому закону спадает плотность при подъеме в нашей атмосфере. Блэз Паскаль, знаменитый французский ученый, живший в XVII столетии и впервые применивший к изучению атмосферы барометр, изобретенный итальянцем Торричелли, обнаружил закон, по которому спадает с увеличением высоты плотность атмосферного воздуха. Этот закон, получивший название барометрической формулы, гласит то же самое: плотность каждого из газов, составляющих атмосферу, убывает вместе с увеличением высоты в геометрической прогрессии. Так, например, при подъеме на 5 км количество кислорода, находящегося в кубическом сантиметре, уменьшается вдвое; при подъеме на следующие 5 км оно уменьшается еще вдвое и т. д., и т. д. Это - тот же самый закон, по которому уменьшается с высотой число зернышек гуммигута в кубическом сантиметре эмульсии, но только здесь иные масштабы - вместо 30 микрон здесь мы имеем 5 км. Отчего же получаются другие масштабы? Достаточно посмотреть, что будет, если вместо кислорода исследовать какой-нибудь другой газ атмосферы, например углекислый газ или азот. Для того чтобы количество углекислого газа на кубический сантиметр уменьшилось вдвое, нужно подняться не на высоту 5 км, а всего только на высоту 3,6 км, т. е. на высоту, в 1,37 раза меньшую. Но во столько же раз (в 1,37 раза) масса молекулы углекислого газа (СО2) больше массы молекулы кислорода (O2). Совершенно такое же соотношение получается, если сравнивать кислород не с углекислым газом, а, например, с азотом или с аргоном. Высота, на которую нужно подняться, чтобы плотность уменьшилась вдвое, обратно пропорциональна массе молекулы данного газа. Например, масса молекулы гелия (состоящая только из одного атома Не) в 8 раз меньше массы молекулы кислорода. Поэтому, для того чтобы количество гелия в одном кубическом сантиметре уменьшилось вдвое, нужно подняться не на 5 км, как в случае кислорода, а на 40 км (т. е. в 8 раз выше).
Слой гуммигутовой эмульсии в 100 микрон - это, в сущности, такая же атмосфера, но только состоящая не из молекул кислорода или азота, а из зернышек гуммигута, которые уже достаточно велики, чтобы их можно было видеть в микроскоп. Вследствие большой массы этих зернышек (по сравнению с молекулами газа) уменьшение плотности с высотой происходит быстрее, чем в обыкновенной атмосфере, окружающей нашу Землю, а именно (в случае гуммигутовых зернышек с диаметром 0,21 микрона) плотность уменьшается вдвое при подъеме на 30 микрон. «Эмульсия,- говорит Перрен,- это атмосфера в миниатюре, тяготеющая к Земле. В масштабе такой атмосферы Альпы представлялись бы несколькими микронами, а отдельные холмы стали бы равны молекулам». Для нас всего важнее, что молекулы этой миниатюрной «атмосферы» - зернышки гуммигута - могут быть взвешены, а это позволяет вычислить и массы молекул обыкновенного газа. Так Перрен сумел сделать то, что казалось совершенно невозможным,- взвесить молекулы и атомы.
Проделаем этот нехитрый расчет. Высота, на которой плотность кислорода уменьшается вдвое,- 5 км. Высота, на .которой плотность гуммигута уменьшается вдвое,- 30 микрон. 5 км в 165 миллионов раз больше, чем 30 микрон. Значит, масса гуммигутового зернышка с диаметром в 0,21 микрона превышает массу кислородной молекулы в 165 миллионов раз.
Сколько же весит такой гуммигутовый шарик? Это нетрудно рассчитать, если измерить предварительно, сколько весит кубический сантиметр гуммигута. При этом расчете не следует забывать, что в опытах Перрена зернышки гуммигута находились в воде, а значит, по закону Архимеда, каждый кубический сантиметр гуммигута терял в весе ровно столько, сколько весит кубический сантиметр воды, т. е. 1 грамм. Значит, каждый кубический сантиметр гуммигута в воде весил на один грамм меньше, чем в воздухе. В результате всех расчетов (которые мы пропускаем) получается, что масса зернышка (с поправкой на закон Архимеда) равна 0, 000 000 000 000 01 г.
И это зернышко в 165 миллионов раз превосходит по массе молекулу кислорода. Значит, молекула кислорода весит 0,000 000 000 000 000 000 000 05 г.
А так как масса молекулы кислорода в 32 раза больше массы атома водорода, то масса атома водорода - этого самого легкого из всех атомов – равна 0,000 000 000 000 000 000 000 0016 г.
В грамме водорода содержится, следовательно, 600 000 000 000 000 000 000 000 атомов.
Эти цифры, найденные Перреном, позволили связать употребительную единицу атомной массы - массу атома водорода - с граммом. Масса атома водорода, выраженная в граммах, получается настолько малой, что ее никак невозможно себе представить,- тем не менее ее удалось определить. Атом был взвешен. Важнейшая задача атомной физики была разрешена.
Немыслимо все время писать в виде десятичных дробей все эти ничтожно малые цифры. Поэтому физики придумали иной, более короткий способ их написания. Вместо того, чтобы писать 0,1, пишут 10-1, вместо того, чтобы писать 0,01, пишут 10-2, вместо 0,001 пишут 10-3, вместо 0,0001 пишут 10-4 и т. д., и т. д. Поэтому можно сказать, что масса атома водорода[ 10 ] в граммах есть произведение числа 1,6 на число 10-24, или, короче, масса атома водорода = 1,6-10-24 г.
Таким образом, вместо 100 пишут 102, вместо 1000 пишут 103, вместо 10000 пишут 104 и вообще вместо единицы c n нулями пишут 10n. Поэтому число атомов водорода в одном грамме = 6 *1023.
Вот какой результат получил Перрен, изучая распределение зернышек в гуммигутовой эмульсии в зависимости от высоты. Но всего любопытнее то обстоятельство, что точно такой же результат был выведен с помощью тех же гуммигутовых шариков, но совершенно иным путем, о котором мы также скажем несколько слов.
Броуновское движение в гуммигутовой эмульсии совершается необыкновенно быстро. Нет никакой возможности проследить за движением отдельного гуммигутового зернышка. Поэтому Перрен и не пытался этого делать, а поступил следующим образом: он отмечал на чертеже положение гуммигутового зернышка через определенные промежутки времени, например через каждые 30 секунд, и полученные точки соединял прямыми линиями (хотя на самом деле гуммигутовое зернышко за это время двигалось не по прямой линии, а также по причудливой ломаной кривой). Полученные рисунки дают возможность судить о беспорядочности и хаотичности броуновского движения вообще. Но Перрен снимал эти рисунки не только для того, чтобы получить наглядную иллюстрацию к броуновскому движению. Его интересовала количественная сторона дела. Знаменитый Альберт Эйнштейн, бывший тогда еще молодым человеком, написал (в 1905-1906 годах) замечательные работы, в которых он математически вывел формулу, определяющую для заданного промежутка времени среднее смещение гуммигутового зернышка относительно его первоначального положения в жидкости. Мы не станем здесь приводить эту формулу; заметим только, что в эту формулу входит величина, равная числу атомов водорода в одном грамме. Поэтому, сопоставляя формулу Эйнштейна с рисунками Перрена, определяющими перемещение частицы за каждые 30 секунд, можно вычислить эту величину. Так и сделал Перрен, и у него получилось, что число атомов водорода в одном грамме равно 6*1023, т. е. получилось такое же число, как и раньше.
Совпадение между двумя числами, которые были получены совершенно различными способами, является лучшим доказательством правильности всех сделанных предположений. Значит, молекулы и атомы действительно существуют, а не только являются удобной для химиков выдумкой. Такое заключение были вынуждены сделать даже те, кто долго и упорно не хотел признавать существования атомов. И даже Оствальд в конце концов должен был в предисловии к своему курсу химии написать следующие слова:
«Теперь я убежден, что в последнее время мы получили опытное доказательство прерывного, или зернистого, строения материи - доказательство, которого тщетно искала атомистическая гипотеза в продолжение сотен и тысяч лет. Совпадение броуновского движения с требованиями этой гипотезы дает право самому осторожному ученому говорить об опытном доказательстве атомистической теории вещества. Атомистическая гипотеза сделалась, таким образом, научной, прочно обоснованной теорией».
Вековой спор между сторонниками и противниками существования атомов закончился, таким образом, победой сторонников атомной теории. И в настоящее время мы можем с уверенностью утверждать, что все вещи на свете - и вода, и камни, и растения, и животные, и воздух, и железо, и т. д., и т. д., и т. д.- все это состоит из мельчайших, невидимых глазу атомов.
Глава третья. Электроны и рентгеновские лучи
В конце XVIII века знаменитый американец Бенджамин Франклин, прославившийся не только своим участием в борьбе британских колоний в Америке за независимость, но и своими- электрическими опытами и в особенности изобретением громоотвода, предложил теорию электричества, согласно которой электрические явления вызываются присутствием особого электрического «флюида», находящегося во всех телах природы. Если в каком-нибудь теле электрический «флюид» (электрическая «жидкость») находится в количестве, превышающем некоторую норму, то такое тело кажется нам заряженным электричеством одного знака, а если количество электрической «жидкости» меньше нормы, то это тело заряжено электричеством другого знака. О самой электрической «жидкости» или электрической «материи» Франклин говорил: «Электрическая материя состоит из частичек, которые должны быть чрезвычайно мелкими, так как они могут проникать в обыкновенную, даже самую плотную материю так легко и свободно, что не встречают при этом заметного сопротивления». Если внимательно прочесть эти слова Франклина, то в них можно увидеть следующие утверждения: 1) существует особая электрическая «материя» или электрический «флюид»; 2) электрический «флюид» состоит из атомов; 3) атомы электрического флюида мелки и ничтожно малы даже по сравнению с такими мелкими частицами, как атомы обыкновенного вещества, потому что они очень легко и без особенного сопротивления проникают внутрь жидких и твердых тел, в которых атомы плотно упакованы и соприкасаются друг с другом; тем не менее атомы электрического флюида легко шныряют в промежутках между атомами обыкновенных тел (стоит только вспомнить о том, как легко электрический заряд перемещается по металлической проволоке).
Эти идеи Франклина имели чисто умозрительный характер,- это была гениальная догадка, не имевшая в то время никаких серьезных опытных обоснований. Но в 1833 году гениальный английский ученый-самоучка Михаил Фарадей открыл замечательный факт, который можно считать подтверждением теории Франклина. Этот факт заключается в следующем. Фарадей изучал явление электролиза, которое было известно уже давно (с последней четверти XVII века) и которое состоит в том, что прохождение электрического тока через некоторые жидкие тела (расплавленные или растворенные в воде соли, щелочи, кислоты) приводит к разложению этих тел (электролитов) на их составные химические части. Фарадей измерил электрический заряд, проходящий через электролит в течение всего того времени, пока из электролита выделяется определенное количество водорода, или калия, или серебра, или меди и т. п. Обнаружилась замечательная вещь: для того чтобы из любого электролита выделился грамм водорода, необходимо пропустить через него 96 500 кулонов электрического заряда (кулон - единица для измерения электрического заряда, которой всегда пользуются электротехники). Иными словами, 1 г водорода всегда переносит с собой через электролит одно и то же количество электричества, а именно 96 500 кулонов. Такое же самое количество электричества, как показали точные измерения Фарадея, переносят с собою и 23 г натрия, и 35,45 г хлора, и 39,1 г калия, и 107,87 г серебра. Если мы заглянем в список химических элементов, который был помещен в предыдущей главе, то мы увидим, что эти числа - 1, 23, 35,45, 39,1, 107,87 - являются нечем иным, как атомными массами водорода, натрия, хлора, калия, серебра. Легко сообразить, что в 107,87 г серебра должно содержаться столько атомов серебра, сколько атомов водорода имеется в 1 г. водорода, сколько атомов калия есть в 39,1 г калия и т. д., и т. д. Значит, все эти вещества (водород, калий, натрий и др.) переносят через электролит одно и то же количество электричества на одинаковом числе атомов, откуда сразу же вытекает, что один атом водорода переносит с собою через электролит такой же электрический заряд, какой переносит с собой и атом хлора, и атом серебра, и атом калия. Чему же этот заряд равен? Ясно, что он равняется частному от деления всего заряда 96 500 кулонов, который переносится одним граммом водорода, на число атомов в грамме водорода. Попробуем записать это в виде математического уравнения (эта книжка написана так, что для ее чтения не нужно знать никакой сложной математики; поэтому пусть читатель, незнакомый с математикой, не пугается: от него требуется только, чтобы он умел применять четыре правила арифметики и десятичные дроби и знал, что величины иногда обозначаются буквами). Итак, обозначим заряд, который переносится через раствор электролита одним атомом водорода, буквой е (такой же заряд переносится и атомом калия, или натрия, или серебра). Этот заряд получается от деления 96 500 кулонов на число атомов в одном грамме водорода. Поэтому, если обозначить число атомов в одном грамме водорода буквой N, то выйдет, что Ne (т. е. произведение заряда е на число N) равно 96 500 кулонам. Это, по существу, и есть та формула, которую мы хотели написать, но только ее обыкновенно пишут в несколько измененном виде, а именно вот как: вместо того чтобы измерять электрический заряд кулонами, как это делают электротехники, физики обыкновенно выбирают другую единицу измерения, которая в три миллиарда раз меньше кулона. Такая единица называется абсолютной единицей. Ясно, что заряд 96 500 кулонов равен 96 500 X 3 000 000 000 абсолютных единиц. Если произвести перемножение, а затем применить обычный способ сокращенной записи длинных чисел, которым мы уже пользовались в предыдущей главе, то выйдет, что это произведение равно 2,895 * 10й. Поэтому, измеряя заряд е, переносимый одним граммом водорода, не в кулонах, а в абсолютных единицах, мы получим
Ne = 2,895-1014 абс. ед.
Мы говорим, что 1 г водорода, и 23,0 г натрия, и 35,45 г хлора, и 39,1 г калия, и 107,87 г серебра переносят через электролит один и тот же электрический заряд, а именно 96 500 кулонов, и мы обращаем внимание на то обстоятельство, что числа 1, 23,0, 35,45, 39,1, 107,87 являются как раз атомными массами этих веществ, что можно видеть из таблицы, которая приведена в предыдущей главе. Все это - результаты измерений Фарадея. Но не со всеми веществами у Фарадея получилось то же самое. Когда он стал измерять количество электричества, которое нужно пропустить через электролит, чтобы выделить из него 24,31 г магния, или 40,08 г кальция, или 65,38 г цинка (эти числа суть атомные массы упомянутых веществ, в чем всякий может убедиться, взглянув на нашу таблицу), то оказалось, что оно одно и то же и для 24,31 г магния, и для 40,08 г кальция, и для 65,38 г цинка, но только оно совсем не равно 96 500 кулонам, как мы могли бы ожидать. Измерения Фарадея показали, что оно равно 193 000 кулонов, т. е. вдвое больше, чем 96 500 кулонов. Сообразим, что все это значит. Ведь в 24,31 г магния или в 65,38 г цинка содержится столько же атомов, сколько в одном грамме водорода. Но эти атомы переносят с собою не такое количество электрического заряда, какое переносит с собой один грамм водорода, а ровно вдвое больше. Значит, и каждый атом магния, или цинка, или кальция переносит с собой не такой электрический заряд, а ровно вдвое "больше, т. е. не е, а 2е. Итак, из измерений Фарадея вытекает следующее:
Каждый атом водорода, или натрия, или калия, или серебра и т. д. переносит с собой через электролит количество электричества, равное е.
Каждый атом магния, или калия, или цинка и т. д. переносит с собой через электролит количество электричества, равное 2е.
Аналогичные измерения Фарадей проделал и для целого ряда других химических элементов, и при этом всегда оказывалось, что один атом любого химического элемента при прохождении через электролит несет с собой электрический заряд, который может быть равен или е, или 2е, или 3е, или 4е и т. д., но никогда не может быть равен дробному числу е, например заряду е, умноженному на целое число с половинкой. Заметим, что сам Фарадей, формулируя открытый им количественный закон электролиза, ничего не упоминал об отдельных атомах, а только говорил, что если взять число граммов водорода, или калия, или натрия и т. д., равное их атомной массе, то это число граммов рассматриваемого химического элемента переносит с собой через электролит всегда один и тот же заряд, а именно 96 500 кулонов; а если сделать то же самое с кальцием или с магнием, то получится не 96 500 кулонов, а ровно вдвое больше, и т. д., и т. д.
Все это очень легко перевести на язык атомов, как это мы и сделали выше, но впервые это сделал не Фарадей, а ирландский физик Джонстон Стоней в 1874 году, через сорок лет после Фарадея. Еще более ясную форму придал этим соображениям знаменитый немецкий физик Герман фон Гельмгольц, который в 1881 году прочитал в Лондоне, в Королевском институте, лекцию, посвященную памяти Фарадея. В этой лекции он очень отчетливо выразил ту мысль, что существует некоторая «порция» электрического заряда, равная е, и что атом вещества, проходящий через электролит, может нести на себе или одну такую порцию, или две, или три такие порции, но никак не дробное число и не целое число с дробью. Заряд е - элементарная порция электрического заряда или «элементарный электрический заряд», как обыкновенно говорят» является чем-то вроде атома электричества: ведь для понятия атома всего характернее, что он не делится на части, а встречается - по крайней мере в какой-то определенной области явлений - только в целом виде, так что можно отделить от вещества один атом, или два, или три, или четыре и т. д., но не дробную часть атома и не целое число с дробью. Вот каким образом возродилась старая мысль Франклина об «атомах электрического флюида». В своей лекции, посвященной памяти Фарадея, Гельмгольц говорил: «Самым поразительным следствием закона Фарадея является, быть может, следующее: если мы примем гипотезу, что обыкновенные вещества состоят из атомов, то мы не сможем избежать и того заключения, что электричество, как положительное, так и отрицательное, тоже состоит из определенных элементарных порций, которые ведут себя как атомы электричества».
Чему равна величина заряда такого «атома электричества»? На этот вопрос Гельмгольц не сумел бы ответить. Он сказал бы только, что элементарный электрический заряд е связан с числом N (числом атомов в одном грамме водорода) уравнением
N*e=2,895-1014 абс. ед.
и что если ему скажут, чему равен множитель N, то только тогда он сумеет сказать, чему равно е. В предыдущей главе мы видели, что изучение броуновского движения, произведенное Перреном, дает ответ на вопрос о том, чему равно N: мы видели, что N=6*1023. Но в 1881 году, когда Гельмгольц написал это уравнение, число N известно не было; о нем можно было только догадываться. Заметим, что связь N и е двусторонняя: если нам скажут, чему равно N, то мы вычислим из нашего уравнения в, но ведь совершенно таким же образом, если мы сумеем каким-нибудь образом узнать и измерить е, то из нашего уравнения мы вычислим, чему равно N, т. е. число атомов в грамме водорода,- иными словами, чему равна масса атома водорода. В конце этой главы мы увидим, каким образом действительно удалось показать на опыте, что электричество состоит из неделимых порций, и измерить величину такой порции. Это дало возможность вычислить с помощью нашего уравнения массу атома водорода, и в результате получилось такое же число, какое совершенно другим способом уже получил Перрен.
Из рассуждений Гельмгольца и Стонея как будто вытекало, что электрический заряд действительно состоит из каких-то «атомов электричества», как предположил чуть ли не за сто лет до этого Бенджамин Франклин. Но все-таки это заключение еще не было достаточно убедительным. Необходимо было выделить «атомы электричества» в чистом виде, освободив их от обыкновенных атомов вещества; необходимо было найти физическое явление, в котором «атомы электричества» принимали бы такое непосредственное участие, чтобы стало возможным открыть их и изучить их свойства. Это удалось ученым, изучавшим прохождение электрического тока через разреженные газы.
В стеклянный сосуд, из которого выкачан почти весь воздух (так что остающийся там воздух производит давление не больше тысячных долей миллиметра ртутного столба), впаяны две металлические пластинки, соединенные с полюсами источника постоянного тока. Будем называть пластинку, соединенную с отрицательным полюсом, катодом, а с положительным - анодом. В 1859 году немецкий физик Плюккер открыл, что если При таком сильном разрежении пропускать электрический разряд между катодом и анодом, то с поверхности катода выходят особые лучи, заставляющие светиться те части стеклянных стенок сосуда, на которые они падают. Таинственные лучи, открытые в 1859 году Плюккером, служили после него предметом исследования ряда ученых, в особенности Гитторфа, Гольдштейна (давшего им название катодных лучей) и других.
В 1874 году гениальный английский ученый Крукс прочел в Шеффильде доклад под заглавием «Лучистая материя, или четвертое состояние вещества», в котором высказал смелую гипотезу о том, что катодные лучи представляют поток материальных частиц, движущихся с колоссальной скоростью и заряженных отрицательным электричеством. Эти частицы, по мнению Крукса, входят в состав каждого химического атома. Таким образом, они представляют «осколки» атома, который, следовательно, не может уже считаться «неделимым» в обычном узком смысле этого слова.
Рис. 4. Искривление катодных лучей в магнитном поле.
Высказав эту гипотезу, Крукс тем самым посягнул на считавшееся тогда несокрушимой основой химии мнение о том, что атомы абсолютно неделимы и являются последними и неразрушимыми единицами, из которых построены все тела природы.
Неудивительно, что смелая мысль Крукса сначала не встретила особой поддержки. Даже такие выдающиеся ученые, как Генрих Герц (открывший электромагнитные волны), нападали на Крукса, утверждая, что катодные лучи представляют не поток материальных заряженных частиц, а особого рода волны, распространяющиеся в эфире; многие считали Крукса сумасшедшим. Однако Крукс оказался прав, и постепенно весь ученый мир под давлением неопровержимых фактов вынужден был принять мнение Крукса. То, что катодные лучи представляют быстро движущиеся заряженные частицы, доказывается следующими опытами.
Если к стеклянному сосуду, в котором распространяются катодные лучи (такие сосуды называются разрядными или круксовыми трубками), приблизить магнит, то катодные лучи определенным образом искривляются. Это было бы совершенно необъяснимо, если бы эти лучи представляли собой волны, но становится совершенно понятным, если мы только допустим, что катодные лучи - быстро движущиеся заряженные частицы. Движущийся электрический заряд есть не что иное, как ток, а магнитное поле, как известно, действуя на ток, заставляет его отклоняться (проводник с электрическим током отклоняет магнитную стрелку и, наоборот, сам стремится повернуться в магнитном поле). Направление,, по которому происходит искривление пучка катодных лучей, указывает на то, что они заряжены отрицательным электричеством.
Если круксову трубку поместить не в магнитное, а в электрическое поле, то катодные лучи также искривляются, при этом таким образом, что они стремятся приблизиться к положительно заряженному телу и, наоборот, удалиться от тела, отрицательно заряженного. Это тоже указывает на то, что катодные лучи заряжены отрицательно.
Катодные лучи, как мы уже говорили, вызывают яркую флюоресценцию (зеленого цвета) в тех местах стеклянной стенки разрядной трубки, куда они падают. Если же на пути лучей поставить какое-нибудь препятствие, например металлический крест, то это препятствие отбрасывает от себя резкую тень: на фоне яркой зеленой флюоресценции стекла видно резкое темное изображение препятствия, например изображение креста. Катодные лучи ведут себя в точности так, как если бы это был поток материальных снарядов, выбрасываемых из катода трубки; при продолжительном обстреле какого-нибудь тела катодными лучами оно заметно нагревается. В некоторых опытах удавалось добела раскалить катодными лучами кусок платины, и это показывало, что микроскопические снаряды, которыми мы бомбардируем этот кусок платины (частицы или «атомы» катодных лучей), несут на себе большую энергию, движутся с огромной скоростью. Катодные лучи вызывают свечение не только стекла, но и многих других веществ. Пользуясь таким свечением, особенно удобно производить опыты с отклонением катодных лучей в магнитном поле: если на пути лучей поставить листок слюды с прорезанной в нем щелью так, чтобы лучи могли пройти только через эту щель, а за слюдой поставить кусок вещества, способного флюоресцировать под действием катодных лучей (все это нужно сперва поместить в разрядную трубку и только затем откачать из нее воздух и запаять ее), то на флюоресцирующем веществе вспыхнет яркая полоска - точное геометрическое изображение щели. Помещая разрядную трубку в поле какого-нибудь электромагнита, мы можем заставить это светящееся изображение щели передвинуться направо или налево, в зависимости от направления магнитного поля. Именно из таких опытов физики и узнали, что «лучистое вещество» (как говорил Крукс), из потоков которого состоят катодные лучи, заряжено отрицательным электричеством.
Если на пути катодных лучей поставить какое-нибудь подвижное тело (например, очень легкую вертушку), то катодные лучи, падая на это тело, приведут его в движение. Это тоже указывает на их материальную природу.
Когда Гельмгольц и Стоней нашли, что электричество состоит из «порций», или «атомов», то естественно было заключить, что движущиеся в катодных лучах частицы и представляют собой атомы отрицательного электричества. В 1891 году Стоней предложил называть их электронами. Итак, катодные лучи - это поток отрицательно заряженных электронов. Катодные лучи - это и есть «электрический флюид» Франклина, выделенный из обыкновенного вещества и полученный в чистом виде, в котором его удобно изучать.
Наиболее замечательные исследования катодных лучей произвел английский физик сэр Дж. Дж. Томсон. Томсон исходил вот из какой идеи: если поместить разрядную трубку с катодными лучами в электрическое или в магнитное поле, то лучи, как мы знаем, искривляются. Это объясняется тем, что электроны, из которых состоят катодные лучи, испытывают в электрическом и в магнитном поле ускорение. От чего зависит величина этого ускорения? Если заряженная частица находится в заданном электрическом поле, то ее ускорение будет тем больше, чем больше ее заряд, и тем меньше, чем меньше ее масса. Говоря математически, ускорение, испытываемое заряженной частицей в электрическом поле, прямо пропорционально ее заряду е и обратно пропорционально ее массе m,- иными словами, оно пропорционально дроби e/m. (Нужно обратить особое внимание на то обстоятельство, что движение частицы в поле зависит только от отношения e/m, а не от числителя е и знаменателя m в отдельности: если бы мы, например, увеличили в десять раз заряд частицы, то все действующие на нее силы увеличились бы в десять раз. Но если при этом мы во столько же раз увеличим и ее массу, то действие силы останется тем же, хотя сила увеличилась в десять раз.) Если же частица находится не в электрическом, а в магнитном поле, то испытываемое ею ускорение зависит не только от отношения e/m, но и от ее скорости. Поэтому Томсон придумал следующее. Он заставил горизонтальный пучок катодных лучей перпендикулярно падать на расположенную вертикальную фотографическую пластинку. Затем он включил электрическое поле такого направления, чтобы оно могло отклонять след падения катодных лучей на фотопластинке вправо или влево, а также включил и магнитное поле, направленное так, чтобы оно могло смещать этот след вверх или вниз. Смещение следа на фотопластинке в направлении вправо и влево и смещение того же следа в вертикальном направлении зависело от e/m и от скорости электронов катодных лучей. Измерив горизонтальное и вертикальное смещение следа падения электронов на фотографическую пластинку, Томсон смог написать два уравнения с двумя неизвестными, а именно с неизвестной дробью e/m и неизвестной скоростью. Эти два уравнения с двумя неизвестными Томсон решил. Что же оказалось? Оказалось, что скорость электронов катодных лучей бывает в разных случаях разная: она зависит от того, какая разность потенциалов приложена между катодом и анодом трубки. Например, если эта разность 1000 вольт, то скорость электронов будет около 18 000 км/с, если 250 вольт, то скорость будет 9000 км/с и т. д.
Это - невообразимо огромные скорости, если сравнить их с обычными скоростями окружающих нас тел - скоростью поезда, скоростью артиллерийского снаряда,- но они не выглядят такими же внушительными с точки зрения физика, который привык встречаться в своих расчетах и с гораздо большей скоростью - со скоростью света, которая равна 300 000 км/с (это - та самая скорость, с которой распространяются лучи света; расстояние от Солнца до Земли - 150 миллионов километров - лучи света] пробегают за 500 секунд). Поэтому физики не очень удивились, когда Томсон опубликовал свой результат измерения скорости катодных лучей: все сочли эту скорость сравнительно скромной по величине. Гораздо интереснее было то, что Томсон сообщил о найденном в его опытах значении величины e/m. Из его измерений вытекало, что величина e/m получается (в отличие от скорости) всегда и всюду одинаковой. Во всех опытах с катодными лучами она неизменно оказывалась равной e/m = 5,307.1017 абс. ед.,
если е выражено в абсолютных единицах, а m (масса электрона) - в граммах. Это было хорошим подтверждением догадки Крукса о том, что катодные лучи - поток каких-то совершенно одинаковых частиц.
Из этого значения e/m Томсон сейчас же вывел совершенно поразительное следствие. Вспомним, что из фарадеевских законов электролиза мы получили N*e = 2,895*1014 абс. ед.
Но что такое N? Это - число атомов водорода в одном грамме водорода. Значит, масса атома водорода должна составить N-ю часть грамма. Если мы обозначим массу атома водорода буквой М, то окажется, что M=l/N. Поэтому умножить какое-нибудь число на N - это все равно что разделить его на М, и наоборот. Выходит, что формулу N*e=2,895-1014 абс. ед. можно еще написать в виде e/M = 2,895-1014 абс. ед.
Таким образом, число 2,895-10" есть отношение элементарного электрического заряда (т. е. заряда электрона), выраженного в абсолютных единицах, к массе атома водорода, выраженной в граммах. А число 5,307-10" есть отношение того же самого заряда электрона к массе уже не атома водорода, а самого электрона. Число 5,307*1017, как нетрудно сосчитать, примерно в 1840 раз больше числа 2,895*1014. Что это значит? У двух дробей e/m и e/М числители одинаковы, а между тем первая дробь в 1840 раз больше второй. Значит, знаменатель первой дроби в 1840 раз меньше знаменателя второй дроби. Иными словами, электрон в 1840 раз легче атома водорода, т. е. чуть ли не в две тысячи раз легче самого легкого из атомов. Итак, атом водорода не есть самая легкая частица в мире, как мы думали до сих пор: электрон гораздо легче его.
Для того чтобы понять всю огромную важность этого результата, полученного впервые Дж. Дж. Томсопом, вспомним следующее: в явлениях электролиза мы имеем дело с атомами, заряженными положительным и отрицательным электричеством, причем заряд каждого атома может равняться по величине одному, или двум, или трем и т. д. зарядам электрона. Электрон играет роль того «атома электрической жидкости», о котором говорил старик Франклин. Легко понять, каким образом атом вещества может иметь один, или два, или три отрицательных элементарных заряда: для того чтобы зарядить атом таким отрицательным зарядом, стоит только приклеить к нему один, или два, или три и т. д. электрона. Но как зарядить атом одним, или двумя, или тремя положительными зарядами? Для этого необходимо отнять у атома отрицательный заряд: ведь отнять отрицательный заряд - это все равно что прибавить положительный. Значит, нужно отнять у атома один, или два, или три и т. д. электрона. Выходит, что атом водорода, переносящий на себе в электролите один положительный элементарный заряд,- это есть атом водорода, у которого отнят электрон. Атом цинка, несущий два положительных элементарных заряда,- это атом цинка, у которого отняты два электрона, и т. д., и т. д. Но для того, чтобы можно было отнять у атома электроны, необходимо - так, по крайней мере, говорит здравый смысл,- чтобы они у него были.
Таким образом, мы приходим к взгляду на атом как на какую-то сложную систему, в состав которой входят электроны. У атомов можно оторвать один или несколько электронов - при этом образуется положительно заряженный «ион» (отрыв электронов от атома принято называть ионизацией, в. заряженный атом, который при этом образуется,- ионом; это греческое название, которое значит «передвигающийся», так как заряженный атом получает способность передвигаться в электрическом поле, чем и объясняется, например, передвижение атомов при электролизе). Если к атому добавить один или несколько электронов, получается отрицательно заряженный ион.
Все эти представления очень сильно отличаются от тех, которые были у Дальтона: ведь Дальтон считал, что атом является абсолютно неделимым на части, а теперь оказывается, что от атома сравнительно легко откалываются электроны. В сущности говоря, весьма забавно, что физические открытия в конце XIX и в начале XX века, те самые открытия, которые наконец-то дали физике убедительные доказательства реального существования атомов, вместе с тем поставили крест на старинной идее неделимости атомов: физики столкнулись с явлениями, в которых принимают участие осколки атомов - электроны. Атомы существуют, но совсем не обладают свойством неделимости. По этому поводу следует сказать, что уже Франклин, говоря об атомах электрического «флюида», тоже предполагал, что их можно извлекать из обыкновенных атомов вещества и прибавлять к обыкновенным атомам. Различие заключается в том, что «атомы электрической жидкости» у Франклина считались невесомыми, а на самом деле оказалось, что они обладают массой, хотя и очень небольшой (в 1840 раз меньшей, чем масса самого легкого атома). Поэтому, строго говоря, если мы от какого-нибудь атома отрываем один или несколько электронов, то масса его уменьшается; если же заряжаем его отрицательно, т. е. придаем один или несколько электронов, то его масса увеличивается. Однако не следует забывать, что масса электрона во много раз меньше массы даже самого легкого атома: если электрон и не оказался невесомым, как думал о нем Франклин, то все же мы можем его считать «почти невесомым». Вот почему, когда от атома оторван один или несколько электронов, мы не будем называть этот атом расколотым на части: было бы смешно употреблять это выражение, когда отколотые от атома_ куски в несколько тысяч раз легче, чем то, что осталось,- ведь мы же не говорим, что человек разрезан на части, когда ему обрили голову или остригли ногти, и именно потому, что масса отрезанных волос или ногтей во много раз меньше массы человека. Может ли существовать такой «тонкий и сильный агент» - как говорил в XVII столетии Роберт Бойль,- с помощью которого удалось бы действительно раздробить атом на части, т. е. оторвать от него осколок, не обладающий столь ничтожной массой, как электрон,- об этом мы узнаем дальше в этой книжке.
Итак, электроны, из которых состоят катодные лучи, являются вместе с тем обычной составной частью любого атома. Такое заключение сделал Томсон в полном согласии с гениальной гипотезой Крукса, и развитие физики в конце XIX и в начале XX столетия приносило все новые и новые подтверждения этого взгляда. Уже давно было известно, что все вещества обладают, в той или иной степени, магнитными свойствами, и еще в первой половине XIX столетия французский математик и физик Ампер объяснил магнитные свойства вещества тем, что атомы и молекулы окружены особыми электрическими токами. Теперь, после открытия электрона, эти «молекулярные токи» Ампера приняли гораздо более определенный и конкретный характер: для того чтобы объяснить существование этих токов, было достаточно предположить, что электроны, находящиеся внутри атомов, движутся;
движение электронов - это и есть текущий внутри атомов замкнутый электрический ток.
Известно было также, что ускоренное, переменное движение электрических зарядов должно вызывать в пространстве электромагнитные волны; в зависимости от длины волны эти электромагнитные волны воспринимаются нами то как радиоволны (когда длина волны составляет несколько метров или даже километров), то как волны видимого света (когда длина волны - равна десятитысячным долям миллиметра), то как волны ультрафиолетового света (длина волны еще меньше). После открытия электронов стало ясно, каким образом атом может испускать свет: он испускает свет вследствие того, что в нем электроны совершают неравномерное и переменное движение.
Этот естественный и правдоподобный вывод из открытия электронов, сделанный физиками, получил очень сильное подтверждение, когда голландский физик Зееман открыл, что стоит только поместить светящееся вещество в сильное магнитное поле, как сейчас же испускаемые им спектральные линии делаются двойными или тройными. В 90-х годах прошлого века другой голландский физик Лоренц очень остроумно математически показал, что так и должно быть в действительности, если спектральные линии испускается вследствие наличия заряженных частичек внутри атома. Мало того, Лоренц доказал, что из данных измерений, относящихся к открытому Зееманом явлению, можно вычислить e/m - отношение заряда к массе - для тех заряженных частиц, движение которых внутри атома приводит к испусканию спектральных линий. В результате подсчета получилось совершенно такое же e/m, как у Дж. Дж. Томсона в его опытах над отклонением катодных лучей в магнитном и в электрическом полях. После этого физики окончательно поверили в то, что те же самые электроны, которые в разрядной трубке мчатся с большими скоростями от металлического катода,- те же самые электроны существуют и внутри атомов водорода, железа, серы, золота и всех вообще химических элементов на свете.
Открытие электронов также помогло физикам понять,,, что происходит в металле, когда по нему проходит электрический ток; способность металлов проводить электрический ток без какого бы то ни было заметного переноса массы и без химического изменения в самом металле получила соответственное объяснение, заключающееся в следующем: в атомах металла существует некоторое количество электронов, которые сравнительно легко отрываются от своих атомов, переходя от своего атома к соседнему и т. д. Такие электроны, легко отрывающиеся от атомов металла, получили название электронов проводимости. Они переходят от одного атома к другому, сравнительно легко передвигаясь по всему объему металла. Передвижение таких электронов в металле под влиянием электрического поля - это и есть электрический ток. Мы могли бы сравнить электроны проводимости в металле с воздухом, находящимся в порах какого-либо пористого вещества (например, губки): если сделать так, чтобы с одной стороны губки давление воздуха было больше, чем с другой, то воздух начнет продавливаться или просачиваться через губку, причем отдельные, частицы воздуха будут описывать весьма извилистые пути, сталкиваясь друг с другом и, в общем, следуя очертаниям пор внутри губки. Поток электронов через металл должен быть похож на такой ток воздуха через пористое вещество, так как скорости отдельных электронов могут быть направлены в какую угодно сторону и только в среднем должно получаться просачивание «электронного газа» через металл.
В этой картине электрического тока, проходящего через металл, наиболее существенным является представление о том, что передвигаются отрицательно заряженные частицы (электроны), а положительно заряженные (остатки атомов, от которых оторваны эти электроны) стоят на месте. Именно так возникает представление об электронном газе, частицы которого (т. е. электроны) шныряют с разнообразными скоростями в промежутках между атомами металла и, время от времени сталкиваясь с этими атомами, отскакивают от них, как мячики. Если приложить к металлу извне электрическое поле, то все частицы электронного газа получат добавочную скорость в определенном направлении и весь электронный газ будет (более или менее быстро, в зависимости от силы поля) просачиваться в этом направлении, встречая сопротивление со стороны атомов металла. Атомы заставляют электроны отскакивать от них и тем самым приводят к тому, что скорость просачивания электронного газа не растет беспредельно, но достигает некоторой конечной величины. Совершенно понятно также, почему металл нагревается при прохождении электрического тока: сталкиваясь с атомами металла, электроны всячески раскачивают эти атомы, отдавая им ту энергию движения, которую они сами приобрели в электрическом поле; атомы начинают быстрее колебаться около своих положений равновесия, а мы воспринимаем это как увеличение температуры металла.
Пожалуй, наиболее непосредственным подтверждением правильности этой картины является замечательный опыт американских физиков Стюарта и Толмена, проделанный в 1916 году. Остроумная идея, которая пришла им в голову, заключается в следующем: металлическая катушка, не соединенная ни с каким источником электрического тока, приводится в очень быстрое вращение, а затем ее внезапно и очень резко останавливают. Если в металле действительно существуют «свободные» электроны, т. е. электроны, легко перемещающиеся в промежутках между атомами и шныряющие от одного атома к другому, то после внезапной остановки катушки они будут в течение некоторого (очень короткого) времени двигаться по инерции, в то время как атомы катушки уже успели остановиться,- таким же точно образом, как люди, стоящие в трамвае, невольно делают шаг вперед, когда вагоновожатый слишком резко тормозит вагон. Это значит, что в первые мгновения после остановки катушки по ней будет бежать кратковременный ток: направление этого тока легко предсказать заранее, исходя из того, что отрицательно заряженные электроны будут продолжать бежать вперед но направлению первоначального вращения катушки. Стюарт и Толмен измерили такой ток электронов и даже сумели вычислить на основании своих измерений отношение e/m для тех частиц, передвижение которых в металле создает электрический ток. Это отношение оказалось таким же самым, какое получил Томсон для электронов, входящих в состав катодных Лучей в разрядных трубках. Этим был подтверждён тот взгляд, согласно которому электроны катодных лучей ничем не отличаются от электронов, переносящих электрический ток в металле.
Но и задолго до этого опыта Стюарта и Толмена не было недостатка в доказательствах того, что внутри металла имеются обыкновенные электроны. Одним из таких доказательств был так называемый «фотоэффект». Это явление, впервые открытое Генрихом Герцем (знаменитым изобретателем радиотелеграфа) и подробно исследованное многими другими физиками, заключается в том, что при освещении ультрафиолетовым (а в некоторых случаях и видимым) светом металлы становятся положительно заряженными. Внимательное изучение этого явления показало, что металл потому становится положительно заряженным, что с его поверхности светом вырываются отрицательно заряженные частицы. Дж. Дж. Томсон измерил отношение e/m для этих частиц по такому же способу, какой он применял раньше к катодным лучам, и получил такое же самое значение, как для электронов катодных лучей. Отсюда ясно, что частицы, вырывающиеся из металла при освещении ультрафиолетовым светом,- это есть те же электроны.
Другое, еще более эффективное доказательство существования электронов внутри металла заключается в явлении «термоэлектронной эмиссии», которое открыл Томас Алва Эдисон, изобретатель фонографа[ 11 ] и электрической лампочки. Особенно подробно исследовал это явление (уже в первом десятилетии этого века) английский физик О. У. Ричардсон. Оно заключается в следующем: если сильно нагреть какой-либо металл, то из его поверхности начинают самопроизвольно выскакивать наружу отрицательно заряженные частицы. Определение e/m для этих частиц по способу Томсона показало, что это электроны. Число таких электронов, выскакивающих из металла наружу, очень быстро увеличивается с возрастанием температуры металла. Объясняется это явление вот как: среди электронов, находящихся в металле, попадаются и такие, которые имеют достаточно большую скорость для того, чтобы, подойдя изнутри к поверхности металла, пробить эту поверхность и выскочить наружу. Для того чтобы проскочить через поверхность металла, электроны должны затратить работу; это видно из того, что если бы такая работа была не нужна, то все электроны, пришедшие к поверхности, могли бы выскочить наружу,- в действительности же это под силу только электронам, у которых достаточно большой запас энергии движения, В этом смысле электроны, сидящие в металле, похожи на пойманных рыбок, мечущихся во все стороны в ведре с водой; только тем рыбкам, которые движутся достаточно быстро, удается выпрыгнуть наружу, прочие же не смогут подпрыгнуть так высоко, чтобы перемахнуть через край ведра. В случае электронов, находящихся в металле, число тех, которые движутся достаточно быстро для того, чтобы суметь выскочить из металла наружу, очень быстро увеличивается при возрастании температуры; при обычных температурах оно настолько мало, что никакого «термоэлектронного испускания» не происходит, но стоит только раскалить металл, как число выскакивающих из него электронов станет очень большим й «термоэлектронный ток» станет вполне доступен измерению. В некотором смысле это явление очень похоже на испарение жидкости: при повышении температуры число молекул, движущихся настолько быстро, что они смогут преодолеть притяжение остальных молекул и выскочить из жидкости в ее пар, становится все больше и больше, а поэтому нагретая жидкость испаряется быстрее, чем холодная. Явление «термоэлектронного испускания» может поэтому быть названо «испарением электронов». В настоящее время это явление имеет огромное множество технических применений (особенно в радиотехнике - стоит только вспомнить об электронных лампах), и с ним хорошо знаком каждый радиолюбитель.
* * *
Все вышеизложенное не оставляет никакого сомнения в правильности гениальной догадки Крукса о том, что электроны катодных лучей являются составной частью всех химических атомов. Но исследование катодных лучей привело не только к открытию электронов - этих предсказанных Франклином «атомов электрического флюида»,- оно привело также и к другому весьма важному открытию, оказавшему огромное влияние на все дальнейшее развитие физики. Речь идет об открытии рентгеновских лучей.
В 90-х годах прошлого столетия очень многие физики изучали замечательные свойства катодных лучей. При этом делались интересные открытия. Так, например, немецкий физик Ленард открыл способ изучать катодные лучи вне разрядной трубки. Для этого он проделал в стеклянной стенке трубки «окошечко» для катодных лучей, т. е. отверстие, закрытое металлическим листиком, очень тоненьким, но все же способным выдерживать атмосферное давление. Через это окошечко он выпустил из трубки катодные лучи наружу и сумел их изучать в воздухе. Заметим, что воздух оказывается не очень «прозрачным» для катодных лучей: пробежав в воздухе несколько сантиметров, электроны останавливаются,- очевидно, вследствие столкновений с атомами газов, из которых состоит воздух.
Еще более -замечательное открытие суждено было сделать другому немецкому физику - мюнхенскому профессору Вильгельму Конраду Рентгену.
В ноябре 1895 года он совершенно случайно обнаружил, что, когда разрядная трубка, в которой от катода бегут катодные лучи, помещена в картонный футляр, экран, покрытый флюоресцирующим веществом, начинает ярко светиться при приближении к этой трубке. Отсюда Рентген заключил, что разрядная трубка испускает особые лучи, невидимые глазу, но свободно проходящие через футляр. Падая на экран, покрытый платиносинеродистым барием, они заставляют его светиться. В первое мгновение Рентген был готов думать, что эти лучи света суть лучи Ленарда, т. е. вырвавшиеся наружу катодные лучи, но он должен был сейчас же отбросить это предположение, потому что лучи Ленарда очень плохо проходили даже через воздух - нескольких сантиметров воздуха было вполне достаточно для того, чтобы их задержать и поглотить,- а эти лучи, наоборот, обладали совершенно удивительной проникающей способностью: они свободно проходили через две сложенные вместе колоды карт, через еловую доску, через человеческую руку и т. д. Исследовав ближе это замечательное явление, Рентген обнаружил, что лучи испускаются той частью стеклянной стенки разрядной трубки, куда падают электроны катодных лучей. Под влиянием ударов со стороны падающих электронов стекло стенки начинает испускать (наряду со своим видимым зеленовато-желтым свечением, о котором мы уже упоминали в первой главе) также и особые, невидимые лучи, которые распространяются во все стороны и обладают удивительной способностью проникать на сравнительно большую глубину в тела, непрозрачные для видимого света. Такие лучи Рентген назвал «лучами икс», но это название, впрочем, не привилось, и в настоящее время на русском и на немецком языке открытые Рентгеном лучи называются попросту рентгеновскими лучами (англичане и французы продолжают называть их «лучами икс»).
Очень скоро Рентген обнаружил, что источником новых лучей может служить не только стекло разрядной трубки, но и всякое другое твердое тело, на которое падают достаточно быстрые электроны. Так как интенсивные и быстрые катодные лучи сильно разогревают всякое тело, на которое они падают, то лучше всего взять толстую металлическую пластинку из тугоплавкого металла, например вольфрама, и направить пучок катодных лучей на нее. Так возникла обычная форма «рентгеновской трубки», где против катода действительно располагается такая металлическая пластинка (антикатод), которая и служит источником рентгеновских лучей. (Заметим, что такой металлический антикатод вовсе не флюоресцирует, так что упомянутая в первой главе гипотеза Беккереля о том, что испускание рентгеновских лучей связано с флюоресценцией, не имеет под собой никакой почвы.) На антикатод может быть нанесен слой какого-либо иного вещества. Это важно потому, что, как мы увидим дальше, рентгеновские лучи, испускаемые различными веществами, различны по своим свойствам.
Наиболее замечательные особенности рентгеновских лучей (если не считать их удивительной проникающей способности) заключаются в следующем. Они не .отклоняются ни в электрическом, ни в магнитном полях, откуда следует, что, в отличие от катодных лучей, они не несут на себе никакого электрического заряда. Падая на способный флюоресцировать экран, они заставляют его светиться. Фотографическую пластинку они чернят Совершенно таким же образом, как это делают и видимые лучи света. Проходя через воздух, они делают воздух проводником электричества, так что заряженный электрометр, находящийся в таком воздухе, быстро разряжается (его заряд утекает через воздух) и его листочки спадают. (Таким же свойством, как мы знаем, обладают лучи Беккереля.) Каков может быть физический смысл этого замечательного свойства рентгеновских Лучей? Для того чтобы воздух стал проводником электричества, необходимо, чтобы в нем появились какие-то носители электрического заряда, способные передвигаться в электрическом поле. Отсюда следует, что рентгеновские лучи, проходя через воздух или через какой-нибудь другой газ, ионизуют этот газ, т. е. превращают часть его молекул в ионы, отрывая от них электроны. После этого в газе появляются положительные ионы наряду с оторвавшимися отрицательными электронами. Любое заряженное тело, находящееся в таком ионизованном воздухе, начнет разряжаться, потому что оно оттолкнет от себя те заряженные частицы, которые имеют заряд такого же знака, как и это тело, и притянет к себе частицы, заряженные электричеством противоположного знака; притянувшись к нему, эти частицы нейтрализуют (уравновесят, уничтожат) его заряд. Ясно, что чем интенсивнее рентгеновские лучи, тем сильнее вызванная ими ионизация воздуха и, следовательно, тем быстрее разряжаются в этом воздухе наэлектризованные тела.
Долгое время физики спорили о том, что же представляют собой эти таинственные лучи Рентгена. В конце концов они пришли к заключению, что рентгеновские лучи - это электромагнитные волны такого же рода, как лучи видимого света, с той лишь разницей, что они обладают во много раз меньшей длиной волны.
Наиболее полное подтверждение эта догадка получила в замечательном явлении, которое было открыто в 1912 году. История этого открытия такова. Мюнхенские физики, группировавшиеся вокруг Рентгена, имели обыкновение собираться в свободное время в одном кафе, где между ними происходили оживленные научные споры. Однажды, во время такого спора, один из этих физиков - Лауэ - высказал следующую мысль: «Всем известно,- сказал Лауэ,- что обыкновенные лучи видимого света обладают тем свойством, что если взять дифракционную решетку (стеклянную пластинку, на которой очень густо нанесены параллельные и равноотстоящие друг от друга царапины), то свет, отражаясь от такой «решетки», будет не по всем направлениям одинаково ярок: в одних направлениях световые волны будут усиливать друг друга, а в других направлениях они будут друг другу мешать, так что в результате там никакого света не будет. Если рентгеновские лучи похожи на видимый свет, но только имеют гораздо меньшую длину волны, то и для них следовало бы приготовить такую же дифракционную решетку, которая дала бы возможность хорошенько изучить их свойства, измерить их длину волны и т. д. Но только такая дифракционная решетка должна быть покрыта царапинами гораздо более густо, чем обыкновенная решетка для видимых лучей,- во столько раз гуще, во сколько раз длина волны рентгеновских лучей меньше, чем видимых лучей.
Рис. 5. Рентгенограмма Лауэ.
Боюсь, что никакой мастер не возьмется приготовить такую решетку. Но, к счастью, такие дифракционные решетки для рентгеновских лучей уже существуют в природе, и их можно сразу получить в готовом виде. Я имею в виду кристаллы. Их блестящие грани, их правильные геометрические очертания - все это наводит на мысль о том, что в них атомы расположены правильными рядами, совсем как штрихи в дифракционной решетке».
Когда присутствующее выслушали эту речь Лауэ, они решили произвести на другой же день опыт - посмотреть, что делается с рентгеновскими лучами после прохождения их через кристалл поваренной соли или какое-нибудь другое кристаллическое вещество. За такой опыт взялся молодой физик П. Книппинг.
На другой же день он приступил к работе, но, к несчастью, он расположил фотографическую пластинку не так, как следовало, и после нескольких часов экспозиции он ничего на ней не получил (ему хотелось заставить рентгеновские лучи отразиться от кристалла и свернуть под прямым углом, но этого они на самом деле не делают). Тогда другой физик - В. Фридрих,- работавший в соседней комнате, пришел к Книппингу на помощь и поставил пластинку так, чтобы рентгеновские лучи могли падать на нее, пройдя через кристалл насквозь. Результат получился удивительный: вокруг центрального пятна, которое на фотопластинке сделали лучи, прошедшие кристалл насквозь, расположились в правильном порядке черные пятнышки. Пятнышки эти были следами от рентгеновских лучей, отразившихся от внутренних граней кристалла, т. е. от параллельных рядов его атомов. Картина, получившаяся на фотографической пластинке, служила блестящим подтверждением как той мысли, что рентгеновские лучи имеют длину волны, во много раз меньшую, чем видимые лучи, так и той мысли, что в кристаллах атомы располагаются идеальными правильными рядами, образуя, как говорят, «кристаллическую решетку». Поэтому можно считать, что такие фотографические снимки («рентгенограммы Лауэ») заодно являются убедительным доказательством -также и того факта, что атомы действительно существуют, а не являются измышлением «невежественных аптекарей», как говорил Шопенгауэр.
Рис. 6. Расположение атомов в кристалле поваренной соли.
Явление, открытое Лауэ, Фридрихом и Книппингом, позволяет убить сразу двух зайцев: 1) исследовать внутреннюю структуру кристаллов, т. е. определить весь строй кристаллической решетки, в которой располагаются атомы, твердого тела; 2) измерить длину волны рентгеновских лучей. Над обеими задачами работали многие физики, и в настоящее время мы знаем расположение атомов в ряде кристаллов так же хорошо, как если бы мы видели эти атомы собственными глазами. Измерение же длины волны рентгеновских лучей достигло
совершенно исключительной точности. Ограничимся немногими примерами. На рис. 6 представлено пространственное расположение атомов в кристалле поваренной соли. Темные и белые шарики изображают атомы натрия и атомы хлора. И те и другие атомы образуют кубическую решетку; обе решетки как бы вдвинуты друг в друга. При этом отмеченная на рисунке длина равна 2,814 * 10-8 см. Ни один атом натрия не связан с каким-нибудь одним атомом хлора в молекулу, изолированную от всех остальных частиц; поэтому уместно сказать, что весь кристалл поваренной соли представляет одну гигантскую молекулу. Такие же сведения были добыты и о громадном количестве других кристаллических тел. Заметим также, что многие тела, которые до тех пор считались аморфными (не кристаллическими), оказались «микрокристаллическими»: их кристаллы слишком малы, чтобы быть обнаруженными каким-нибудь иным путем, и только рентгеновские лучи дают возможность их исследовать.
Приведем также несколько числовых данных, относящихся к длине волны рентгеновских лучей. Методы рентгеновской спектроскопии позволяют измерять длину волны лучей примерно в промежутке от 0,1 А до 15 А. (Значком А обозначается единица длины - ангстрем. Один ангстрем равен 10-6 см.) Точность, с которой можно измерить длину волны характеристических рентгеновских лучей (см. ниже), совершенно потрясает: после работ шведского ученого Зигбана она достигла одной стотысячной доли ангстрема, т. е. 10-13 см.
Рис. 7, Рентгеновский спектрограф.
Длина волны рентгеновских лучей раз в тысячу меньше, чем длина волны лучей видимых: так, например, кальций имеет в видимом спектре линию с длиной волны 3933,83 А,
а длина волны его наиболее жесткой характеристической рентгеновской линии (см. ниже) равна 3,36169 А. Из этих чисел видно, насколько широк тот спектр частот электромагнитных колебаний, с которым приходится иметь дело физику: начиная с волн длиною в несколько километров, улавливаемых радиоприемником, он простирается до рентгеновских лучей с длиной волны в несколько стомиллионных долей сантиметра. В дальнейшем мы увидим, что существуют волны еще более короткие.
За блестящим открытием Лауэ последовали работы английских физиков У. Г. Брэгга и У. Л. Брэгга (отца и сына), которые придумали способ фотографировать спектры рентгеновских лучей. Построенный ими рентгеновский спектрограф (рис. 7) имеет следующее устройство. Лучи рентгеновской трубки, выделенные в узкий пучок, падают на кристалл и затем, отражаясь от него, на фотографическую пленку. Кристалл может вращаться, причем с поворотом его меняется, конечно, и угол, под которым рентгеновские лучи падают на грань, параллельную оси вращения кристалла. Поэтому при поворачивании кристалла процессу отражения подвергаются все новые и новые волны, в результате чего па фотографической пленке разворачивается спектр рентгеновских лучей. Исследование по методу Брэггов Спектра рентгеновских лучей, получаемых от обыкновенной рентгеновской трубки, показывает, что кроме непрерывного фона, т.е. лучей с самыми разнообразными и непрерывно меняющимися длинами волн, в спектре присутствуют еще отдельные резкие линии, выделяющиеся на этом непрерывном фоне. Положение этих линий зависит от того вещества, из которого состоит поверхность антикатода; совокупность этих линий называется характеристическим спектром того химического элемента, которому принадлежат эти «характеристические» рентгеновские линии.
В 1914 году молодой английский физик X. Дж. Мозли (в следующем году убитый на войне в Галлиполи) исследовал характеристические рентгеновские линии ряда химических элементов и обнаружил замечательный факт, который заключается в следующем: если расположить химические элементы в том порядке, в каком они располагаются в периодической таблице Менделеева, и затем рассмотреть их характеристические рентгеновские спектры, то все спектры будут очень похожи друг на друга, и только длина волны спектральных рентгеновских линий будет становиться все меньше и меньше, когда мы будем переходить от одного химического элемента к следующему, затем еще к следующему и т. д. Это убывание длины волны при переходе от элемента к элементу происходит совершенно планомерно, по определенному закону, а поэтому, если в списке элементов есть какой-нибудь пропуск (какой-нибудь химический элемент еще не открыт), то это сразу обнаруживается из рассмотрения рентгеновских спектров: при переходе от какого-нибудь элемента к другому элементу, который следует за ним не непосредственно, а с пропуском одного или двух промежуточных элементов, получается чересчур большой скачок в длине волны рентгеновских спектральных линий. По величине скачка можно судить о том, сколько элементов пропущено. На этом открытии Мозли и основано наше знание периодической системы: именно благодаря этому открытию мы уверены, например, в том, что между неодимом и самарием есть один промежуточный элемент, а не два, и т. д. Вот почему мы с уверенностью приписываем самому тяжелому элементу - урану - 92-й, а не какой-нибудь другой номер.
История об электроне и рентгеновских лучах будет неполной, если мы не расскажем, как американский физик Роберт Эндрус Милликен, пользуясь ионизующим действием рентгеновских лучей, сумел измерить заряд электрона совершенно непосредственным способом, как если бы речь шла об измерении заряда какого-нибудь наэлектризованного бузинового шарика.
Способ Милликена заключался в следующем. В пространство между двумя пластинами 1 и 2 конденсатора (рис. 8) с помощью особого пульверизатора вбрызгивались мельчайшие капельки масла. Манипулируя заслонкой 3, можно было на короткое время подвергать воздух между пластинами конденсатора действию лучей рентгеновской трубки 4.
Рис. 8. Схема опыта Р. Милликена.
Как только рентгеновские лучи начинали освещать пространство между пластинами, воздух в этом пространстве ионизовался, и легко могло случиться, что одна из масляных капелек соединится с каким-либо ионом, становясь, таким образом, заряженной. Если пластины конденсатора не заряжены электричеством, то на такую масляную капельку будет действовать только сила тяжести и капелька будет медленно падать (медленно потому, что для тел таких маленьких размеров сопротивление воздуха их движению играет очень большую роль). Освещая пространство между пластинами вольтовой дугой 5, лучи которой собираются в нужную точку выпуклым стеклом 6, Милликен мог следить в микроскоп за падением масляной капельки. Как только пластины конденсатора заряжались, в движении капельки происходило изменение: если, например, она была заряжена отрицательно, а конденсатор заряжался так, что верхняя пластина получала положительный заряд, то капля начинала притягиваться к верхней пластине и отталкиваться от нижней; поэтому падение капли замедлялось или даже заменялось поднятием. Массу капли, конечно, нельзя было определить простым взвешиванием, но ее можно было вычислить, измерив скорость, с которой капля падает в отсутствие электрического поля. Это делается на основании законов гидромеханики, позволяющих рассчитать сопротивление воздуха движению шарообразных капелек различных размеров. Зная скорость, с которой капля падает в отсутствие поля (когда ее заряд не играет роли), и скорость, с которой та же заряженная капля падает в заданном и известном электрическом поле, Милликен мог вычислить, чему равен заряд капли. Оказалось, что в разных случаях заряды капелек бывали различны, но всегда они представляли целое кратное величины 4,77*10-10 абс. ед., т. е. равнялись или просто этой величине, или удвоенной, или утроенной и т. д., но никогда не равнялись этой величине, умноженной на какое-либо дробное число. Отсюда Милликен заключил, что величина е=4,77*10-10 абс. ед. представляет наименьшее возможное в природе количество электричества, т. е. «порцию», или «атом», электричества. Эта величина, следовательно, и есть заряд электрона. Точность опытов Милликена такова, что невероятно ожидать ошибки большей, чем тысячная доля измеряемой величины. Таким образом, величина е найдена, и это позволяет определить значения и других постоянных.
Ведь мы знаем, что заряд электрона е связан с числом атомов в грамме водорода (N) и с массой атома водорода (М) соотношением Nе =e/M = 2,895-1014 абс. ед., а с массой электрона (m) соотношением e/m = 5,307.1017 абс. ед.
Так как теперь е известно, то из этих уравнений можно легко вычислить m, М и N.
Вычисление дает N = 6,062*1023, что находится в полном согласии с тем результатом, который получил Перрен, изучая броуновское движение. Масса водородного атома оказывается равной М = 1,662-10-24 г, а масса электрона m = 9,01*10-28 г.
О том, как мала масса электрона, выраженная в граммах, можно судить из следующего сопоставления: отношение массы электрона к одному грамму почти в два раза меньше, чем отношение грамма к массе всего земного шара. Если великого удивления, заслуживает то искусство, с которым физики и астрономы сумели взвесить земной шар и небесные светила, то еще большее удивление должны возбуждать те физические опыты, из которых можно с такой уверенностью (вероятная ошибка не больше одной десятой процента) заключать о массе ничтожного электрона - самой мелкой единицы, входящей в состав материальных тел.
Всего поразительнее во всем этом то обстоятельство, что заключения о заряде и о массе электрона сделаны не на основании каких-либо очень специальных и натянутых гипотез,- напротив, эти заключения можно считать весьма прямыми и непосредственными следствиями наблюдаемых явлений: ведь наблюдения Милликена относились к отдельным электронам (заряд капли во многих опытах равнялся величине е или удвоенной, утроенной и т. д.). Эти опыты являются убедительнейшим доказательством реальности электронов и атомов. Всего убедительнее в этом доказательстве полное совпадение, которое существует между результатами опытов Милликена и результатами опытов Перрена: ведь те и другие опыты основаны на совершенно разных идеях и на первый взгляд -ничего не имеют общего друг с другом. Числам, полученным из этих опытов, приходится верить,- по той же самой причине, по которой на суде верят двум свидетелям, если они, не имея никакой возможности предварительно сговориться друг с другом, оба утверждают одно и то же[ 12 ] .
Глава четвертая. Разгадка радиоактивности
Мы знаем теперь, что все вещи состоят из атомов и что атом не является чем-то абсолютно неделимым; наоборот, атом - это какая-то сложная система, от которой могут отделяться крохотные части - отрицательно заряженные электроны. Таков, в общих чертах, был тот запас знаний, которым обладали физики на рубеже XIX и XX столетий. И, опираясь на этот, в сущности очень скудный, запас знаний о веществе, физики должны были разгадать головоломную загадку, которая отпугнула бы от себя самого самонадеянного сыщика на свете,- загадку радиоактивности.
Мы возвращаемся к нашей детективной истории.
Самое поразительное, самое чудесное в радии - это его неутомимость. Днем и ночью, зимой и летом, без устали, без передышки радий посылает в пространство свои невидимые лучи. Каждый час грамм радия испускает столько тепла, сколько нужно, чтобы растопить примерно полтора грамма льда. Много ли это? Это не очень много: грамм угля, сгорая, испускает тепла почти в пятьдесят раз больше, но зато он ведь сгорает и перестает быть углем, а грамм радия, испуская тепло в течение часа, в течение суток, в течение года, остается совершенно таким же, каким был раньше,- его способность испускать лучи Беккереля и вместе с ними энергию остается прежней, и он, как и раньше, готов безостановочно испускать энергию в течение новых и новых лет. Вот это-то и есть самое неслыханное, самое беспримерное из всего, что физикам когда-либо приходилось слышать и видеть. Когда топится печка, в ней сгорают дрова, и, если не подбрасывать дров, печка погаснет. Когда идут часы, в них все время раскручивается пружина или опускается гиря, и, если их не заводить, они остановятся. Во всей природе только радий оказывается каким-то странным исключением: ничего в нем не тратится, ничего не сгорает, никогда он не стареет, он вечно молод. Он похож на волшебный кошелек в старой сказке: сколько раз ни вынимать из такого кошелька золотую монету, в нем всегда остается еще одна.
Другой не менее странный факт, относящийся к радию,- это его полная независимость от внешних влияний, полное равнодушие к ним. С тех пор как радий впервые был получен в лаборатории, физики неоднократно пробовали повлиять на его радиоактивность, применяя самые разнообразные способы, но ни сильный жар, ни сильный холод, ни самые высокие давления, какие только можно осуществить средствами современной техники,- ничего не оказывало влияния на радиоактивность: лучи, испускаемые радием, не становились ни сильнее, ни слабее. Для того чтобы охарактеризовать то огромное впечатление, которое произвели на физиков оба эти свойства радия - его неутомимость и его равнодушие ко всем внешним воздействиям,- достаточно процитировать слова, сказанные одним из первых исследователей радиоактивности (Содди): «В крошечном кусочке радия нет ничего, что напоминало бы громадные масштабы н размеры Вселенной, а между тем он выделяет энергию в такой пропорции, в какой ее не выделяет ни Солнце, ни одна из звезд. Предположим, например, что наше Солнце вместо тех веществ, из которых оно состоит теперь и которые, как нам известно из спектрального анализа, входят и в состав Земли, состояло бы из чистого радия. Если допустить, что каждая частица такого Солнца выделяет энергию в той же пропорции, что и равная ей по массе частица радия, то нетрудно будет учесть количество выделяемой им энергии. Короче говоря, количество света и теплоты, выделяемых таким Солнцем, было бы в миллион раз больше, чем теперь»[ 13 ].
Еще и по другой причине наша мысль почти бессознательно обращается от радия к высшим явлениям Вселенной: ведь только в отношении этих явлений мы окалываемся в положении зрителей, бессильных влиять на них и управлять ими. Все могущественные ресурсы современной лаборатории - крайние пределы тепла и холода, а также давления, сильные химические реактивы, действие сильных взрывчатых веществ, наиболее сильные электрические поля - не влияют на радиоактивность радия и на количество выделяемой им энергии ни в малейшей степени. Радий черпает свои запасы энергии из неизвестного до сих пор источника и подчиняется неоткрытым пока законам. Есть что-то сверхъестественное в его отделенности от окружающей среды и в его безразличии к ней. Он как будто принадлежит другим мирам, за пределами нашего, питается тем же неугасимым огнем и движется тем же не поддающимся контролю механизмом, который поддерживает свет великих солнц в мировом пространстве в течение безграничных периодов времени.
Непрерывное излучение крупинки радиоактивного вещества, которую мы держим в руке, напоминает многие из странных тайн, давно позабытых.
В лабораториях всего мира физики жадно набросились на иpучение радиоактивности. Можно. смело сказать, что в это время (в 1900 году или около того) не было ни одного физика на свете, который бы не ломал голову над этой трудной загадкой: что же такое, в конце концов, эта радиоактивность? Каков ее внутренний механизм, внутренний смысл? Отчего она происходит? И каждый физик, по мере сил, пробовал догадаться о том, каково решение этой загадки. Одни говорили: если радий все время испускает свои лучи и они не становятся от этого слабее, то, значит, он эти лучи, это тепло, эту энергию все время откуда-то снова получает. Например, возможно, что во всем пространстве распространяются какие-то лучи, которые свободно проходят через все тела и даже через всю толщу земного шара. Не только мы не видим этих лучей, но их даже не замечает фотографическая пластинка, и только радий имеет особенную способность поглощать эти лучи и затем их испускать вновь, но уже в измененном виде -в виде лучей Беккереля. Выходит, что если сравнить радий с часами, то эти часы на самом деле все время «заводятся», заводятся таинственными лучами, которые поглощаются радием и затем перерабатываются им в лучи Беккереля.
Другие говорили: никаких таких лучей, которыми «заводится» радий, не существует. В радии все время что-то тратится, но только очень медленно, и потому мы этого никак не замечаем. Если бы взять грамм радия и очень долго ждать, десятки лет (а если понадобится, то и сотни), то в конце концов можно будет заметить, что лучи радия стали слабее, чем раньше.
Рис. 9. Трубка, наполненная виллемитом, для опытов с эманацией радия.
Все это были довольно-таки праздные разговоры, потому что вначале ни та, ни другая сторона ничем не могла доказать свою правоту. Поэтому оставалось только одно: наблюдать и делать опыты, пока наконец загадка радия не будет разгадана.
В 1900 году многие физики, работая в своих лабораториях, сделали удивительное открытие: они обнаружили, что воздух вокруг вещества, в котором есть хотя немножко радия, тоже становится радиоактивным. Впервые это заметили Пьер и Мария Кюри, но не они разгадали настоящий смысл этого открытия. Это сделали два молодых англичанина, которые в то время жили в Канаде, в городе Монреале. Имена этих молодых физиков - Эрнест Резерфорд и Фредерик Содди.
Они сделали такой опыт: взяли стеклянную трубочку и положили туда несколько кусочков виллемита. Виллемит - это ничем не примечательный с виду камешек, зеленовато-серый, похожий на те гладкие камешки, которые обыкновенно валяются на берегу моря. Но у виллемита есть замечательное свойство: если его освещать лучами радия, то он начинает светиться холодным ярким зеленым, светом. Резерфорд и Содди впустили в свою трубочку с виллемитом воздух, который довольно долгое время находился в соседстве с веществом, содержащим немножко радия. После этого трубочку закрыли с обеих сторон (для этого в ней были с двух сторон устроены краны) и отнесли в темную комнату.
Рис.10. Трубка, изображенная на рис. 9, сфотографирована в темной комнате благодаря флюоресценции виллемита.
И вот, хотя радия поблизости не было, виллемит стал так ярко светиться, что при этом свете можно было даже посмотреть на часы и прочитать заголовок газеты. Выходит, что воздух в трубочке с виллемитом заставляет виллемит светиться точь-в-точь так же, как он светился под лучами радия. Как только краны открыли и выдули из трубок этот воздух, виллемит светиться перестал.
Как же объяснить, что воздух, побывавший в соседстве с радием, сам становится радиоактивным? Резерфорду пришла в голову очень простая и очень смелая мысль: он предположил, что из радия все время выходит какой-то газ, но не простой газ, а радиоактивный, испускающий лучи Беккереля. Газ этот, попадая в воздух, смешивается с ним. Значит, лучи Беккереля испускает не сам воздух, побывавший в соседстве с радием, а новый газ, попавший в воздух из радия.
Этому новому газу Резерфорд дал название «эманация радия» (это название значит «то, что выходит из радия»).
Эманация радия в этих опытах Резерфорда и Содди поступала в воздух в самых крохотных количествах, но все же ее можно было заметить по яркому свечению виллемита. Содди сделал такой опыт: он сфотографировал стеклянную трубку с эманацией и с виллемитом в темной комнате: виллемит сам испускает тот свет, который позволил его фотографировать. Эта фотография помещена на с. 107. Но в книжке, которую написал Содди, говорится, что фотография не дает никакого представления о красоте виллемита, светящегося в эманации радия.
Рис. 11. Прибор Резерфорда и Содди для демонстрации сжижения эманации радия.
В своих воспоминаниях Содди говорит, что это одна из самых красивых вещей на свете и что, смотря на свечение виллемита и размышляя о его причинах, он ощущал такие чувства, которые может по-настоящему передать только поэт.
Долгое время физики не хотели верить, что эманация радия есть действительно газ - такой же, как воздух или как углекислый газ, но только радиоактивный. Например, Пьер и Мария Кюри утверждали, что эманация совсем не простой газ, а что-то среднее между обыкновенным веществом и лучами света. Но Резерфорд и Содди проделали много опытов, чтобы доказать, что эманация есть газ.
Всякий газ можно превратить в жидкость, если только достаточно сильно его охладить. И вот Резерфорд и Содди достали такую холодильную машину, в которой воздух можно сделать жидким. Такая машина теперь имеется в каждой хорошей физической лаборатории: в ней можно осуществить мороз в 192° С ниже нуля. При таком холоде воздух делается жидким.
Резерфорд и Содди взяли несколько литров жидкого воздуха и сделали следующий опыт. У них был большой пустой стеклянный шар, покрытый изнутри очень легким налетом сернистого цинка. Если бы в этот шар попала эманация радия, то сернистый цинк стал бы светиться под действием лучей Беккереля. Резерфорд и Содди стали вдувать в этот шар тот воздух с примесью эманации, который у них был заперт в стеклянной трубке с виллемитом. Они вдували эту эманацию через длинную трубку, часть которой находилась в сосуде с жидким воздухом. Поэтому в этой части трубки температура была очень низка и эманация никак не могла проскочить через эту часть трубки: она замерзала в ней, превращаясь в жидкость, застревала там, не доходя до стеклянного шара. Всего этого Резерфорд и Содди не могли видеть, потому что не очень-то разберешь, что творится внутри стеклянного колена трубки, засунутого в сосуд с жидким воздухом; да если бы они и могли туда заглянуть, то все равно не смогли бы заметить этих микроскопических капелек жидкой эманации. Но им было совершенно ясно, что дело происходит именно так. Почему им это было ясно? Потому, что, когда стеклянное колено трубки лежало в жидком воздухе, эманация не попадала в шар, и шар не светился. Но стоило только вынуть колено из жидкого воздуха, как эманация, нагревшись, через несколько минут снова испарялась, и ее легко можно было продуть в шар. Достаточно было один раз нажать рукой на резиновую грушу для продувания эманации, чтобы эманация попала в шар, который сейчас же начинал светиться, как фонарь, мягким белым приятным светом. При свете этого фонаря Содди мог смотреть на часы.
Что вытекает из всех таких опытов? Из них вытекает, что радий беспрерывно выделяет из себя какое-то другое радиоактивное вещество - эманацию радия. Эманация получается в ничтожных количествах: нужно иметь очень много радия, чтобы собрать эманацию хотя бы с булавочную головку. Но так как эманация очень сильно радиоактивна, то самую крохотную примесь эманации к воздуху легко заметить по лучам Беккереля, которые она испускает.
И вот Резерфорд и Содди захотели узнать: так же ли эманация неутомима, как радий? Так же ли она продолжает день за днем, год за годом испускать лучи без всякого заметного ослабления?
Резерфорд и Содди напустили эманацию в трубочку с виллемитом, закрыли оба крана, чтобы она не ушла, и оставили трубочку в темной комнате. Каждый вечер они приходили туда смотреть, как светится виллемит. Оказалось, что свечение виллемита с каждым вечером становилось все слабее и слабее. Через четыре дня оно было вдвое слабее, чем раньше, к концу месяца оно почти совсем прекратилось.
Значит, эманация радия со временем теряет свои радиоактивные свойства.
Это очень важно. Важно потому, что если радиоактивное вещество - эманация радия - теряет свои радиоактивные свойства со временем, то, вероятно, то же самое можно сказать и обо всех других радиоактивных веществах. Трудно себе представить, чтобы радий был исключением даже среди радиоактивных веществ. А так как обыкновенное физическое наблюдение не позволяет обнаружить уменьшения радиоактивности радия и урана даже в течение нескольких лет, то остается предположить, что заметное уменьшение их радиоактивности происходит не в течение нескольких дней, как у эманации радия, а в течение огромных промежутков времени, во много раз превышающих самую длинную человеческую жизнь.
Таким образом, Резерфорд и Содди установили два факта: 1) из радия беспрерывно выделяется радиоактивный газ - эманация радия; 2) радиоактивные свойства эманации уменьшаются с течением времени, и это позволяет высказать гипотезу, что радиоактивные свойства всех других радиоактивных элементов тоже со временем убывают, хотя это убывание в некоторых случаях может происходить крайне медленно и поэтому почти незаметно.
Каким же образом происходит возникновение эманации и отчего могут уменьшаться радиоактивные свойства радиоактивных элементов?
Для того чтобы получить ответ на этот вопрос, физики обратились к изучению лучей Беккереля, испускаемых радиоактивными элементами.
Что представляют собой эти лучи, которые как будто бы ничем не отличаются от лучей Рентгена?
В 1899 году Пьер и Мария Кюри- попробовали пропустить пучок лучей Беккереля через пространство, в котором было магнитное поле. Это они сделали для того, чтобы узнать, являются ли лучи Беккереля чем-то вроде лучей Рентгена (электромагнитными колебаниями, такими же, как лучи видимого света, но только с гораздо меньшей длиной волны) или же они скорее напоминают катодные лучи, т. е. представляют собой поток очень быстро движущихся, заряженных электричеством частичек.
Результат опыта был совсем неожиданным: в магнитном поле лучи Беккереля расщеплялись на две части! Одна из них изогнулась в магнитном поле - совершенно таким же образом, как искривляются катодные лучи, и при этом в ту же сторону, только величина искривления была в несколько раз меньше. Что отсюда следует? Отсюда следует, что эта часть лучей Беккереля несет на себе, как и катодные лучи, отрицательный электрический заряд. Поэтому можно было исследовать эти лучи совершенно тем же самым способом, каким Томсон исследовал катодные лучи, т. е. можно было определить для них отношение e/m и их скорость, наблюдая отклонение лучей в магнитном и в электрическом полях. Эту работу проделал немецкий физик Кауфман. Он нашел, что отношение e/m у этих лучей Беккереля такое же, как у электронов катодных лучей. Значит, эта (отклонившаяся в магнитном поле) часть лучей Беккереля есть не что иное, как поток электронов, вырывающихся, по-видимому, из атомов радиоактивных веществ. Что касается скоростей этих электронов, то они, как нашел Кауфман, были очень разнообразны, но в среднем они были гораздо больше, чем у электронов катодных лучей. Поэтому и отклонение в магнитном поле было у них не такое большое, как у катодных лучей: действительно, чем быстрее движется заряженная частица, тем труднее магнитному полю сбить ее, отклонить ее от первоначального пути.
Наиболее быстрые из электронов, выбрасываемых радиоактивными веществами, оказались движущимися почти со скоростью света (300000 км/с).
Итак, часть лучей Беккереля - это просто поток очень быстрых электронов.
Но кроме этой части была еще и другая часть. Она не отклонялась в магнитном поле и распространялась без всякого изменения направления.
Таков был результат опытов Кюри.
Но в 1903 году Резерфорд доказал, что та часть лучей Беккереля, которую Пьер и Мария Кюри не сумели отклонить в магнитном поле, тоже сложна и состоит из разных частей.
Рис. 12. Лучи, испускаемые радиоактивными веществами.
Для этого Резерфорд взял очень сильное магнитное поле, гораздо более сильное, чем то, которое было в распоряжении Кюри. В этом сильном магнитном поле та часть лучей Беккереля, которая в опытах Кюри не хотела искривляться, расщепилась на две части: одна из них изогнулась в магнитном поле, но не в ту сторону, в которую изгибается поток электронов, а в противоположную. Значит, это был поток заряженных частиц, но не электронов, а частиц, заряженных положительным электричеством. Другая же часть лучей по-прежнему продолжала распространяться прямолинейно, не обращая никакого внимания на магнитное поле.
Из этих опытов следует, что лучи Беккереля, испускаемые радием и другими радиоактивными веществами, не однородны, а состоят из трех видов лучей (рис. 12). Всем этим трем видам лучей физики дали названия, а именно обозначали их тремя первыми буквами греческого алфавита: альфа, бета и гамма (альфа, бета и гамма - это названия букв: ведь и у нас когда-то русские буквы имели названия, например, а, б и в назывались аз, буки, веди).
Альфа-лучами стали называться лучи, состоящие из потока положительно заряженных частиц,- те самые лучи, которые Резерфорду удалось отклонить магнитным полем от их" первоначального направления (в 1903 году).
Бета-лучами стали называться лучи, состоящие из потока очень быстрых отрицательных электронов, которые были отклонены магнитным полем еще в опытах Кюри (в 1899 году).
Наконец, гамма-лучами стали называться лучи, которые упорно не хотели изменять своего направления даже и в очень сильном магнитном поле.
Какие существуют еще различия между этими тремя сортами лучей, смесь которых образует лучи Беккереля?
Альфа-лучи гораздо труднее изогнуть в магнитном поле, чем бета-лучи (именно поэтому в первоначальных опытах Кюри удалось загнуть бета-лучи в сторону в таком магнитном поле, которое было еще совершенно недостаточным для того, чтобы заставить альфа-лучи изменить свое направление). Гамма же лучи не изгибаются
ни в магнитном, пи в электрическом поле вовсе, точь-в-точь как лучи Рентгена.
Альфа-лучи легко задерживаются и поглощаются даже сравнительно очень топкими слоями вещества. Например, достаточно завернуть радий в обыкновенную писчую бумагу или закрыть его листком слюды или алюминия толщиной в 0,05 мм, чтобы альфа-лучи почти полностью поглотились. А бета- и гамма-лучи проходят через такие листки совершенно свободно. Вообще можно считать, что проникающая способность бета-лучей примерно в 100 раз больше проникающей способности альфа-лучей, а проникающая способность гамма-лучей в десять или в сто раз превосходит проникающую способность бета-лучей. Слой в 5 мм алюминия или в 1 мм свинца достаточен, чтобы задержать большую часть бета-лучей, а гамма-лучи проходят через этот слой еще довольно свободно.
Из-за того, что альфа-лучи так легко поглощаются, возникает вот какое любопытное обстоятельство: если взять какой-нибудь препарат радия и придать ему форму шарика, то он будет испускать сравнительно немного альфа-лучей, потому что большая часть альфа-лучей, испускаемая внутренними слоями этого шарика, успеет поглотиться внутри шарика еще раньше, чем доберется до его поверхности. Поэтому наружу выйдет лишь очень малая доля всех испускаемых альфа-лучей. Но если взять тот же самый препарат и размазать его в виде очень тоненького слоя по какой-нибудь тарелочке или пластинке, то альфа-лучей будет очень много и их действие будет гораздо сильнее, чем действие бета- и гамма-лучей того же самого препарата. С помощью такого препарата можно обнаружить удивительные действия альфа-лучей.
Так, например, легко показать на опыте, что альфа-лучи гораздо сильнее ионизуют воздух, чем бета- и гамма-лучи. Содди доказал это следующим опытом. Он размазал 1 мг бромистого радия по поверхности платиновой тарелочки (около шести квадратных сантиметров). Затем он взял наэлектризованную шелковую кисточку. Эта кисточка служила как бы электрометром: когда клеточка наэлектризована, все ее нити отталкиваются друг от друга и расходятся в виде конуса, а как только кисточка разрядится, нити снова спадут и будут свисать вертикально. Когда Содди поднес свою наэлектризованную кисточку к размазанному но тарелочке бромистому радию, покрытому сверху листком почтовой бумаги, кисточка оставалась наэлектризованной и ее нити не хотели спадать. Но как только Содди передвинул листок бумаги и приоткрыл небольшую часть поверхности, смазанной бромистым радием, кисточка немедленно разрядилась и ее шелковые нити сейчас же повисли. Значит, бета- и гамма-лучи, испускаемые одним миллиграммом бромистого радия и проходящие сквозь листок бумаги, не действуют на заряженную кисточку, а альфа-лучи действуют очень сильно. Когда Содди поднес такую же заряженную шелковую кисточку к 30 мг бромистого радия, закрытого листком слюды для поглощения альфа-лучей, то кисточка сложилась, но все же не так быстро, как от действия альфа-лучей, испускаемых лишь одним миллиграммом бромистого радия. Выходит, что альфа-лучи одного миллиграмма бромистого радия ионизуют сильнее, чем бета- и гамма-лучи, и поглощаются так сильно, что их энергия очень быстро расходуется на ионизацию тех веществ, через которые они проходят.
Поглощение альфа-лучей в воздухе и в других веществах тщательно изучил У. Г. Брэгг (тот самый, который впоследствии вместе со своим сыном У. Л. Брэггом построил спектроскоп для рентгеновских лучей). Брэгг нашел, что альфа-лучи каждого радиоактивного вещества проходят в каждой данной среде путь совершенно определенной длины, после чего сразу останавливаются. Поэтому нужно говорить о совершенно определенной «длине пробега» данных альфа-лучей в данном веществе. Это понятно: положительная частица альфа-лучей, проходя, например, через воздух, все время ионизует молекулы воздуха, отрывая от них электроны. На ионизацию каждой молекулы она затрачивает определенное количество энергии. Поэтому после каждой ионизации энергия частицы уменьшается на какую-то величину. Наконец, когда весь ее запас энергии будет таким образом исчерпан, она остановится.
В одном из своих опытов Брэгт взял стеклянный шар радиусом 7,5 см и расположил в его центре пластинку с размазанным на ней препаратом радия. Стенки шара были изнутри вымазаны сернистым цинком - это вещество, которое обладает способностью флюоресцировать белым светом, когда на него падают альфа-лучи. Но самые быстрые альфа-лучи, испускаемые препаратом, проходят в воздухе при обыкновенном давлении только 7,1 см. Поэтому они останавливаются, не дойдя от центра шара до вымазанных сернистым цинком стенок, и никакого свечения нет. Но стоит только начать выкачивать из шара воздух - при первом же ходе поршня насоса стенки шара начинают светиться. Это значит, что, становясь более разреженным, воздух начинает лучше пропускать альфа-лучи, и их длина пробега, таким образом, увеличивается и достигает величины 7,5 см. Поэтому они успевают добежать до сернистого цинка и заставить его светиться. При дальнейшем откачивании воздуха свечение сернистого цинка становится все ярче и ярче; это показывает, что альфа-лучи, которые успевают добежать до сернистого цинка, растрачивают на ионизацию воздуха все меньшую и меньшую часть своей энергии.
Что же такое представляют собой эти положительно заряженные частицы, из которых состоят альфа-лучи? Ответ на этот вопрос дал Резерфорд. Он начал с того, что нашел отношение e/m для этих частиц совершенно таким же образом, как это было сделано для электронов катодных лучей и бета-лучей, т. е. измеряя отклонение лучей электрическим и магнитным полями. Результат получился следующий: для альфа-лучей e/m = 1,444*1014 абс. ед.
Однако из предыдущей главы мы знаем, что для водородного иона, заряженного одним положительным элементарным зарядом, можно написать: e/M = 2,895*1014 абс. ед.
Мы видим, что у альфа-частицы (так мы будем называть положительно заряженные частицы, поток которых выбрасывается радием в виде альфа-лучей) отношение заряда к массе вдвое меньше, чем у водородного иона[ 14 ]. Так как заряд электрона или, что то же самое, равный ему по величине (хотя и обратный по знаку) заряд водородного иона в электролите есть «атом электрического флюида» и не может делиться на части, то заряд альфа частицы может быть или такой же самый, как у водо-1 родного иона (и тогда ее масса должна быть в два раза больше), или он может равняться удвоенному заряду во-1 дородного иона (тогда масса альфа-частицы должна быт! уже не в два, а в четыре раза больше массы водородного иона), или он равняется утроенному заряду водородного иона (тогда масса будет в шесть раз больше массы водородного иона) и т. д. Так как масса водородного! иона практически не отличается от массы водородного] атома, то получаются следующие возможности: или альфа-частица в два раза тяжелее водородного атома и несет на себе один положительный элементарный заряда или альфа-частица в четыре раза тяжелее водородного! атома (т. е. имеет массу атома гелия) и несет на себе! два положительных элементарных заряда; и т. д.
Какая бы из этих возможностей ни была верна, все! равно альфа-частица должна быть сравнительно тяжелой] частицей, т. е. иметь массу, близкую уже не к массе электрона, а к массе атомов. Масса альфа-частицы должна превосходить массу электрона по крайней мере в несколько тысяч раз, и, хотя скорость альфа-частиц, по измерениям Резерфорда, гораздо меньше, чем скорость электронов бета-лучей (по крайней мере в несколько раз), все равно альфа-частица должна обладать гораздо большей энергией движения, чем менее тяжелый электрон, вылетающий из тех же радиоактивных веществ. Альфа-лучи могут быть названы снарядами тяжелой артиллерии радиоактивных веществ; бета-лучи по сравнению с ними - это беглый огонь пулемета.
Поэтому к двум фактам, открытым Резерфордом и Содди и указанным на с.110, необходимо прибавить еще и третий необычайной важности факт.
Атомы радия и других радиоактивных веществ испускают весьма быстрые электроны, а также и альфа-частицы, по крайней мере в два раза (а может быть, и больше) превосходящие по массе атом водорода.
Когда Резерфорд и Содди собрали и сопоставили эти три факта, то они, как настоящие герои детективной истории, решили, что теперь уже пора выставить гипотезу, которая дала бы объяснение загадочных явлений радиоактивности. Гипотеза, которую они придумали и опубликовали (в 1903 году), заключается в следующем.
Атомы радиоактивных веществ взрываются, распадаются на части. Лучи Беккереля, которые испускаются радиоактивными веществами,- это осколки, отлетающие от атома при таком взрыве. Неверно, что все атомы бессмертны, что они живут вечно, не изменяются, не стареют, не разрушаются. Все это предрассудок, как и то, что атомы не могут быть разделены на части. Предрассудок о неделимости атома был уничтожен благодаря открытию электрона, которое показало, что атом - сложная система, состоящая из более мелких частиц. Таким же образом исследование радиоактивности должно уничтожить предрассудок о бессмертии атомов. Атом радиоактивного вещества живет некоторое время, а затем умирает, взрываясь на части и разбрызгивая во все стороны свои осколки. Но не у всех радиоактивных атомов одинаковая «смертность»: атомы эманации радия вымирают очень быстро, так что через несколько дней от первоначального количества эманации радия остается только небольшая часть, а атомы самого радия или урана вымирают гораздо медленнее, так что даже через несколько лет практически мы не можем еще заметить никакого уменьшения их количества. Но все же и они умирают и дают об этом знать своими лучами Беккереля. Эманация радия, постепенно возникающая из радия, состоит из атомов эманации радия. Так как в лучах Беккереля, испускаемых радием, никаких тяжелых частиц, кроме альфа-частиц, не обнаружено, то самое естественное предположение, которое можно сделать, заключается в том, что атом радия распадается на атом эманации радия и альфа-частицу, что можно записать так:
атом радия атом эманации + альфа-частица.
При таком распаде летят еще и мелкие брызги в виде электронов и гамма-лучей (что касается гамма-лучей, то они ничем не отличаются от очень жестких, т. е. очень пропинающих, лучей Рентгена). Выходит, что после смерти атома радия образовался атом другого вещества - эманации радия - и альфа-частица, которая, вероятно, тоже является атомом какого-то вещества. В радиоактивных явлениях мы имеем дело с превращением одних химических элементов в другие, с рождением и смертью атомов, т. е. как раз со всем тем, что считал невозможным Дальтон и все химики XIX столетия, но к чему стремились средневековые «делатели золота». Правда, средневековые алхимики стремились превращать одни химические элементы в другие по собственному желанию.
стремились управлять этим превращением, а радий, как мы видели, остается совершенно равнодушным ко всем попыткам физиков как-то повлиять па интенсивность испускаемых им лучей Беккереля и замедлить или ускорить его распад. Но, как знать, может быть, когда-нибудь и удастся добыть тот «тонкий и сильный агент», о котором мечтал Роберт Бойль, и научиться управлять с его помощью радиоактивными явлениями, замедляя и ускоряя их по произволу, вызывая распад атомов там, где он не хочет происходить сам собою, и прекращая его там, где он происходит.
Но не для того нам пригодится этот «тонкий и сильный агент», чтобы добывать золото,- этот хотя и полезный, но все же не очень важный химический элемент. Есть вещи поважнее золота, и их мы найдем в недрах атомов. Радий - это склад энергии. Его запас энергии не безграничен, потому что, с точки зрения гипотезы Резерфорда и Содди, в радии, как и в горящем топливе, что-то тратится, и это что-то есть он сам: атомы радия уничтожаются, превращаясь в другие атомы. Но все-таки этот запас энергии очень велик (когда Резерфорд и Содди впервые выставили свою гипотезу, его нельзя было даже приблизительно учесть). Грамм радия - это резервуар энергии, резервуар, из которого она вытекает медленно и неохотно. Удастся ли когда-нибудь открыть кран пошире - так, чтобы она вытекала быстрей? А может быть, и другие атомы тоже радиоактивны, по только отдают свои лучи так медленно и так мало, что мы не в состоянии этого заметить? И есть ли какие-нибудь способы заставить эти атомы распадаться на части быстрее, чем они распадаются сами? Какими могущественными стали бы люди, если бы им удалось взнуздать и подчинить себе эти таинственные силы, клокочущие в недрах атомов! «Люди, которые могли бы это сделать,- писал Содди,- не особенно нуждались бы в том, чтобы в поте лица своего добывать хлеб свой. Они могли бы переделать пустыни, растопить обледенелые полюсы, сделать весь мир веселым райским садом». И какими жалкими показались бы им те запасы энергии - сила воды и ветра, химическая энергия безумно растрачиваемых нами угля и нефти,- которыми располагает современное человечество. Подчинив себе радиоактивность, люди совершили бы такой же огромный скачок вперед, какой они совершили когда-то, когда первобытный человек, подчинив себе огонь, сделался повелителем и господином остальных животных.
Такова была гипотеза Резерфорда и Содди. Такова была предложенная ими разгадка радиоактивности. Она открывала перед физикой широчайшие перспективы. Она в корне меняла все физические представления, относящиеся к атомам и к их судьбе. Она была смела, необычна. Но была ли она правильна?
Предстояло проделать огромную работу, проверить во всех деталях эту «гипотезу превращения элементов», как называли ее Резерфорд и Содди, объяснить все темные, неясные пункты. И прежде всего, конечно, нужно было проверить, действительно ли атом радия превращается в атом эманации радия и в альфа-частицу.
Для этого следовало собрать как можно больше дополнительных сведений. В частности, нужно было, наконец, узнать, что же такое эта альфа-частица? Имеет ли она элементарный заряд и массу, равную удвоенной массе атома водорода, или же два элементарных заряда и массу, равную учетверенной массе атома водорода, или же три элементарных заряда и массу, равную ушестеренной массе атома водорода, и т. д.?
Резерфорд и Содди рассуждали так: альфа-частица должна быть каким-то атомом, обыкновенным атомом какого-то химического элемента, хотя и положительно заряженным, т. е. потерявшим один, или два, или три и т. д. электрона. Но такого химического элемента, у которого атом имел бы вдвое большую массу, чем атом водорода, по-видимому, не существует. Поэтому первую из перечисленных возможностей приходится отбросить. Но существует атом, который по массе в четыре раза больше атома водорода,- это атом газа гелия, открытого в 1896 году сэром Уильямом Рамзаем. Поэтому весьма вероятно, что альфа-частица - это и есть атом гелия, заряженный двумя положительными элементарными зарядами, т. е. потерявший два электрона. Конечно, такое рассуждение нельзя считать очень убедительным потому, что легко могло бы оказаться, например, и что альфа-частица есть атом кислорода, потерявший восемь электронов (это тоже дало бы правильное значение для отношения e/m, так как знаменатель был бы в 16 раз большем, чем у водородного иона, а числитель - в 8 раз).
Но Резерфорд и Содди считали наиболее вероятным, что альфа-частица есть атом гелия, от которого отколото два электрона. Они основывались на одном факте, который был хорошо известен химикам и геологам, хотя никто до Резерфорда и Содди не мог понять его причины, а именно па том, что гелий встречается в ген минералах, в которых присутствуют радиоактивные вещества торий или уран. Так, например, цейлонский минерал торианит, названный так потому, что он включает значительное количество тория, содержит в себе также и гелий, который можно извлечь из торианита, если его хорошенько накалить на огне. Химики и геологи хорошо знали, что там, где есть уран или торий, там неизменно оказывается и гелий, но причины этого явления они не понимали. Ясно было только то, что эта причина не могла быть чисто химической: гелий не вступает ни в какие химические соединения с другими веществами, а потому нет никаких разумных оснований думать, что гелий приходит извне в минералы, содержащие уран или торий, и остается там.
С точки зрения Резерфорда и Содди, причина должна быть как раз обратная: гелий возникает внутри минералов, содержащих уран или торий, и возникает потому, что он является одним из продуктов радиоактивного распада: альфа-частицы, испускаемые радиоактивными элементами, постепенно накапливаются внутри минералов, в которых вкраплены радиоактивные вещества, и тот гелий, который химики находят в этих минералах, как раз и состоит из таких альфа-частиц. Гелий этот состоит из обломков давно распавшихся более тяжелых атомов: он представляет последнее звено в той медленной эволюции вещества, которая происходит в земной коре.
Вероятно, не только гелий, находимый в минералах, но и тот гелий, который в огромных количествах поднимается из трещин земной коры в некоторых местах Соединенных Штатов и уже в течение многих лет (со времени первой мировой войны) больше не рассеивается в атмосфере, а используется для наполнения дирижаблей,- даже и этот гелий, вероятно, тоже образовался в результате каких-то радиоактивных процессов в глубоких недрах земного шара.
Эволюция вещества, связанная с радиоактивностью, должна совершаться очень медленно и постепенно: радий, который всегда находят в урановых рудах, безусловно является одним из потомков урана; далее атомы радия, испуская альфа-частицы, превращаются в атомы
эманации; эта последняя испытывает какие-то дальнейшие превращения, так как ведь и она испускает альфа-частицы, и т. д., и т. д. Как далеко идет это превращение, когда оно прекращается и какие окончательные продукты, кроме гелия, получаются в результате всего этого последовательного ступенчатого распада - на эти вопросы Резерфорд и Содди тогда (в 1903 году) еще не могли дать окончательного ответа.
Рис. 13. Спектроскопическая трубочка, в которой Содди и Рамзай обнаружили появление гелия из эманации радия.
Содди переселился из Монреаля в Англию и стал работать вместе с Рамзаем. Они взяли некоторое количество воздуха, к которому была примешана эманация радия, и поместили его в спектроскопическую трубочку. Это - длинная стеклянная трубочка; у концов она шире, а в середине она совсем узка. С того и с другого конца в нее впаяны платиновые проволочки: через эти проволочки можно пропускать электрический ток по газу, запертому в трубочке. Когда через такую спектроскопическую трубочку пропускают ток, то в узком ее месте газ начинает ярко светиться и с помощью спектроскопа можно рассмотреть его спектр.
Рамзай и Содди запаяли трубочку, а затем несколько" дней подряд ходили смотреть на спектр эманации. И вот оказалось, что с каждым днем спектральные линии эманации становятся все слабее и слабее. А вместо них загораются другие линии, которых раньше не было,- спектральные линии гелия. С волнением рассматривал Рамзай этот хорошо ему известный спектр. Чем слабее становился спектр эманации радия, тем ярче и ярче разгорался спектр гелия. Гелий рождался на глазах у Рамзая и Содди.
Впоследствии (в 1909 году) Резерфорд сделал (вместе с одним из своих помощников - Ройдсом) другой опыт, еще более убедительно доказавший, что альфа-частица - это атом гелия. Резерфорд и Ройдс заперли эманацию радия в стеклянную трубочку с такими тонкими стенками, что испускаемые эманацией альфа-частицы совершенно свободно проходили сквозь эти стенки. Эту тонкостенную трубку они поместили в стеклянный сосуд, который был вверху соединен со спектроскопической трубочкой. Из сосуда был откачан воздух. После этого они подождали два дня, в течение которых некоторое количество альфа-частиц успело выскочить из тонкостенной трубочки и скопиться в сосуде. Тогда они, наполнив сосуд ртутью, заставили все, что там было, подняться наверх в спектроскопическую трубочку и сжаться там. Через трубочку был пропущен ток, и в поле зрения спектроскопа явственно загоралась желтая спектральная линия гелия. А через шесть дней можно было видеть и другие, менее яркие линии гелиевого спектра. Значит, альфа-частицы, прошедшие через тонкие стенки трубочки, в которой была заперта эманация, и собранные затем в спектроскопической трубочке, действительно оказались самым обыкновенным гелием. Поэтому гипотетическую формулу распада радия следует писать в следующем виде:
атом радия атом эманации + атом гелия.
Еще одна, последняя, окончательная проверка была необходима: нужно было проверить, действительно ли масса атома эманации радия, сложенная с массой атома гелия, даст массу атома радия. Атомная масса радия была известна: ее с большой точностью определил химик Хенигшмидт, и она оказалась равной 225,97. Атомная масса гелия равна 4,00. Поэтому, если только гипотеза Резерфорда и Содди правильна, то атомная масса эманации радия должна быть приблизительно равна 222.
Предстоял решающий эксперимент. Атомная масса эманации радия была неизвестна, но теория утверждала, что она должна равняться 222. Если опыт подтвердит это предсказание, то взгляды Резерфорда и Содди приобретут необыкновенную убедительность и силу. Если предсказание окажется неверным, то их теорию нужно будет отбросить и искать какую-то совершенно другую.
За производство эксперимента взялся сэр Уильям Рамзай. Необыкновенная трудность стоявшей перед ним задачи, неслыханная в истории химии, заключалась в том, что количество эманации, бывшее в его распоряжении, было совершенно ничтожным - не больше булавочной головки. Даже и это крохотное количество эманации должно было считаться очень большим: в громадном большинстве радиоактивных опытов физики имеют в своем распоряжении еще более ничтожные количества этого газа, который, вероятно, поэтому никогда и не был бы открыт, если бы не лучи Беккереля, которые он испускает и которые позволяют заметить его присутствие.
Но Рамзай должен был проделать со своей булавочной головкой эманации все, что химики делали с другими газами, атомную массу которых они хотели найти. Прежде всего нужно было определить химические свойства эманации радия. Это была сравнительно легкая часть задачи; даже если бы у Рамзая было эманации еще меньше,- так мало, .что ее можно было бы обнаружить лишь по действию испускаемых ею лучей Беккереля,- он все равно сумел бы определить ее химическую природу, пробуя соединить ее с различными веществами: то вещество, к которому перешла бы радиоактивность эманации, тем самым обнаружило бы свою способность вступать с эманацией в химическое соединение. Но из опытов Рамзая вытекало, что эманация радия ускользает от любого химического поглотителя и что, следовательно, она не соединяется ни с чем. Иными словами, эманация радия принадлежит к группе «благородных газов», к которой относятся, кроме нее, гелий, неон, аргон, криптон, ксенон. [Заметим, что, с тех пор как этот факт был установлен, эманация радия получила новое название - радон - для того, очевидно, чтобы рифмовать с неоном, аргоном, криптоном и ксеноном. В нашей таблице химических элементов (см. с. 49) эманация радия тоже фигурирует под этим именем, и отныне мы ее будем называть именно так].
Из того, что радон принадлежит к группе благородных газов, отказывающихся соединяться и между собою, и с какими угодно другими веществами, следует, что на него можно распространить все те законы, которые оказались справедливыми для остальных благородных гаэов. В частности, можно утверждать (все это было хорошо проверено на остальных благородных газах), что молекула радона состоит только из одного атома радона и что его атомная масса может быть вычислена из его плотности (атомные массы всех благородных газов пропорциональны их плотности). Поэтому перед Рамзаем встала задача - взвесить крохотное, почти незаметное количество радона, бывшее в его распоряжении, чтобы определить его плотность, а значит, и атомную массу.
Эту трудную задачу Рамзай и его помощник Уайтлоу-Грей разрешили следующим образом. Они построили специальные «микровесы», чувствительность которых превосходила все, что когда-либо было известно в истории измерительного искусства. Крохотное количество эманации радия было введено в пустой и очень легкий кварцевый шарик, который был подвешен к одному концу легчайшего кварцевого же коромысла весов. К другому концу был подвешен кварцевый противовес, приблизительно уравновешивавший кварцевый шарик с радоном. Для того чтобы точно уравновесить весы, Рамзай и Уайтлоу-Грей пользовались не добавочными разновесками или чем-нибудь в этом роде; а поставили микровесы под стеклянный колпак и стали менять с помощью насоса давление воздуха под этим колпаком. По закону Архимеда всякое тело, погруженное в газ, теряет в своем весе столько, сколько весит газ, занимающий такой же объем. А так как кварцевый шарик с радоном имел больший объем, чем кварцевый противовес, то он больше терял в весе, чем противовес, и это становилось тем ощутимее, чем плотнее был газ под колпаком. Поэтому Рамзай и его помощник могли управлять своими весами, не прибегая к помощи разновесок: хотят они, чтобы противовес опустился, а шарик с радоном поднялся,- для этого нужно только еще подкачать насосом под колпак воздух; а чтобы шарик с радоном опустился, а противовес пошел вверх, следует насосом немножко откачать воздух из-под колпака. С помощью этих остроумных «весов без разновесок» Рамзай и Уайтлоу-Грей сумели довольно точно взвесить свой шарик с радоном, а значит, и вычислить атомную массу радона. Когда измерения и вычисления были закончены, то в результате получилось, что атомная масса радона почти точно равна 222, т. е. тому самому числу, которое предсказали Резерфорд и Содди.
Резерфорд и Содди торжествовали победу. Теперь уже никто не мог отрицать, что их разгадка радиоактивности правильна и что атом радпя действительно распадается на атом радона и атом гелия. Начиналась новая эпоха в истории физики и химии. Наряду с обыкновенными химическими реакциями, которые изображаются формулами, где справа и слева стоят те же самые атомы, но только в разных комбинациях, теперь физики и химики должны
были рассматривать и такую реакцию: Ra Rn + Не.
В какой ужас пришел бы старый Берцелиус, если бы ему показали такую химическую формулу!
Из всего того, о чем говорилось на предыдущих страницах, читатель может заключить, что гипотеза Резерфорда и Содди о радиоактивном распаде атома радия на атомы радона и гелия несомненно верна. Не может быть неверной гипотеза, которая подвергалась такому суровому испытанию и так блестяще его выдержала. Но Резерфорд счел нужным подвергнуть ее еще и другому испытанию: он захотел определить непосредственно на опыте, чему равен заряд отдельной альфа-частицы. Ведь из догадки Резерфорда и Содди о сущности радиоактивности вытекает, что заряд альфа-частицы должен равняться двойному элементарному заряду: это обязательно должно быть верным, если альфа-частица есть заряженный атом гелия и если отношение e/m для нее, как показывает опыт, в два раза меньше такого же отношения, вычисленного для водородного иона. Но как это проверить? Альфа-частица - это атом гелия или, лучше сказать, ион гелия. Не слишком ли самонадеянны физики, вознамерившиеся поймать один-единственный атом гелия и измерить его электрический заряд? Не значит ли это - попытаться войти в мир бесконечно малого, в мир невидимого, в мир ускользающего от наших органов чувств?
И все же эта смелая попытка удалась. Физики действительно смогли увидеть невидимое. Первый, кому это удалось, был сэр Уильям Крукс. Для того чтобы совершить это чудо, он совсем не строил грандиозных и сложных приборов, при виде которых всякий неученый человек начинает чувствовать себя нехорошо,- он соорудил совсем крохотный и пустяковый приборчик стоимостью рубля в полтора. И с помощью этого приборчика он смог увидеть отдельные атомы.
Прибор Крукса - так называемый спинтарископ - имеет следующее устройство. Он состоит из небольшой трубки, напоминающей по виду и по размерам трубку от маленького театрального бинокля. Один конец трубки закрыт экраном, который покрыт (с внутренней стороны) сернистым цинком. С другого конца в трубку вставлено увеличительное стекло, с помощью которого можно рассматривать этот покрытый сернистым цинком экран. Внутри трубки укреплена иголка, конец которой расположен на оси трубки между увеличительным стеклом и экраном. На этом конце иголки имеется ничтожное количество радия, причем - и в этом состоит наиболее эффектная особенность прибора Крукса - чем меньше радия, тем лучше.
Рис. 14. Спинтарископ Крукса: а) схематический чертеж (А - иголочка, В - флюоресцирующий слой, С - лупа); б) внешппй вид спинтарископа.
Для того чтобы насадить на конец иголки нужное количество радия, поступают так: этим концом иголки слегка дотрагиваются до внутренней стенки пробирки, в которой когда-то был препарат радия. Вот и все. Неудивительно, что прибор Крукса так дешево стоит, хотя в нем имеется радий - самое дорогое вещество в мире.
Прибор готов. Как же увидеть с помощью этого прибора отдельные атомы? Для этого нужно с ним пойти в темную комнату и подождать некоторое время, пока глаза отдохнут и хорошенько привыкнут к темноте. Потом нужно посмотреть в увеличительное стекло прибора.
Странное зрелище тогда предстанет перед нашими глазами. На поверхности экрана вспыхивают и гаснут маленькие неяркие звездочки. Они загораются то тут, то там, и весь экран так и кишит ими. Его поверхность была бы похожа на звездное небо, видимое в телескоп, если бы вся картина не менялась так быстро, как в калейдоскопе. Разорванные вспышки, усеивающие экран, гаснут так же внезапно, как появляются, и все, что мы видим, производит впечатление беспрестанной бомбардировки экрана микроскопическими зажигательными снарядиками, вызывающими вспышку в той точке экрана, в которую они попадают. И это впечатление совершенно правильно - то, что мы видим, это и есть бомбардировка, ведь на кончике иглы находится крохотный, почти невесомый и совершенно невидимый кусочек радия, из которого все время вырывается поток микроскопических снарядов - альфа-частиц. Если бы радия было больше, то весь экран светился бы равномерно и ярко: отдельные вспышки сливались бы в одно сплошное свечение экрана. Но так как радия очень мало, то вспышки видны раздельно: мы видим кратковременный светящийся след, который оставляет на поверхности экрана отдельная альфа-частица, один атом гелия, перелетевший от кончика иглы к экрану с огромной скоростью в несколько десятков тысяч километров в секунду, чтобы рассказать о смерти одного атома радия. Всяким наблюдателем, впервые смотрящим в спинтарископ и понимающим, в чем состоит смысл открывающегося перед ним зрелища, поневоле овладевает странное и жуткое чувство, похожее на то, которое овладевает нами, когда мы смотрим в телескоп на особенно богатые звездами участки Млечного Пути. И в том, и в другом случае мы видим перед собой бездну,- в одном случае бездну бесконечно малого, в другом - бездну бесконечно большого,- и, глядя в обе эти бездны, одинаково далекие от нас и одинаково безразличные к нам, мы начинаем понимать смысл странных слов Паскаля о том, что «человек подвешен между двумя бесконечностями».
Гениальное изобретение Крукса, сделанное им в том же 1903 году, в котором Резерфорд и Содди впервые выдвинули свою гипотезу о превращении химических элементов, знаменует, как и эта гипотеза, начало совершенно новой эпохи в физике. Не странно ли, что атомы стали видимой, ощутимой реальностью как раз в то время, когда было уничтожено представление о неразрушимости и непревращаемости атомов? Физики так долго и так тщетно стремились доказать, что атомы действительно существуют, и вот наконец эта цель достигнута: спинтарископ Крукса позволяет видеть действия отдельных атомов - заряженных атомов гелия. Но в то же самоё время, когда таким образом реальность атомов доказана совершенно неоспоримо, становится ясным, что атомы совсем не те вечные, бессмертные, неразрушимые частицы, какими их представлял себе Джон Дальтон: атомы рождаются, живут и умирают, с атомами происходят чудесные превращения, ослепительные взрывы, они разлетаются на части, и возникающие при этом осколки - это новые атомы. Похоже на то, что средневековые алхимики, стремившиеся превращать одни химические элементы в другие и так осмеянные за это впоследствии, в конце концов оказались правы. Но не будем преувеличивать их правоту. Вспомним, как все ухищрения лабораторной техники оказались бессильными повлиять на быстроту распада радия, вспомним, какими равнодушными, неприступными и забронированными от всех внешних воздействий оказались атомы этого чудесного вещества.
Все это показывает, что радиоактивность принадлежит совершенно особому миру явлений, с которым физики никогда не встречались раньше,- иными словами, что в радиоактивных явлениях действуют совершенно огромные, чудовищные силы, несравнимые со всем, что было известно физике прежде, и, значит, такие же огромные чудовищные силы требуются для того, чтобы управлять радиоактивными явлениями и изменять их естественное течение. Значит, Джон Дальтон был в каком-то смысле прав, хотя правота его и не была абсолютной, а относилась только к некоторому ограниченному кругу явлений: в пределах этого круга явлений атомы действительно неразрушимы и бессмертны, и требуется далеко перейти за пределы этого круга и привести в действие силы совершенно иного порядка («тонкий и сильный агент» Роберта Бойля) для того, чтобы вызвать превращение одних химических элементов в другие. В обыкновенных явлениях, изучаемых в химической лаборатории, атомы действительно никогда не превращаются друг в друга, и ошибка средневековых алхимиков и заключалась в том, что они пытались вызвать это превращение, не располагая «тонким и сильным агентом», а пользуясь лишь обыкновенными силами, которые развиваются при химических реакциях. В тех случаях, когда они утверждали, что им действительно удалось получить золото из других металлов, все это объяснялось или сознательным надувательством, или экспериментальной ошибкой (например, золото извлекалось из какого-либо химического соединения, содержащего золото, путем замещения золота другим металлом, а неискушенному экспериментатору казалось, что он превращает этот металл в золото).
Как только изобретенный Круксом спинтарископ стал известен остальным физикам, возникла задача счета альфа-частиц. В спинтарископе Крукса такой счет невозможен, потому что иголка находится слишком близко от экрана (несколько миллиметров) и в каждый момент на экран сыплется целый дождь альфа-частиц, так что сосчитать их нет никакой возможности. Но если поставить препарат с известным количеством радия достаточно далеко от экрана (но так, чтобы между препаратом и экраном был не воздух, поглощающий альфа-частицы, а безвоздушное пространство), то можно будет сосчитать количество вспышек, загорающихся на каждом квадратном сантиметре поверхности экрана в среднем в течение секунды. Отсюда уже будет легко сосчитать, сколько альфа-частиц испускает препарат по всем направлениям, т. е, узнать в конце концов, сколько альфа-частиц испускает каждый грамм радия в секунду. Знать это число важно по двум причинам: во-первых, если мы затем каким-нибудь способом измерим заряд, уносимый всеми альфа-частицами, которые вылетают в секунду из грамма радия, то мы можем, разделив его на число этих частиц, узнать заряд отдельной альфа-частицы; во-вторых, зная число альфа-частиц, испускаемых в секунду граммом радия или урана, мы тем самым знаем, сколько атомов радия или урана распадается в секунду из общего числа этих атомов в одном грамме,- иными словами, мы сумеем вычислить быстроту распада радия и урана.
В 1908 году немецкий физик Э. Регенер действительно осуществил такой подсчет числа вспышек. Но этот метод счета альфа-частиц не очень надежен, так как он сильно зависит от состояния глаз наблюдателя: глаза очень быстро утомляются, и поэтому подсчет альфа-частиц по наблюдению вспышек на экране из сернистого цинка требует .миллиона предосторожностей. Физики стремились заменить метод вспышек каким-нибудь другим, более объективным (не так сильно зависящим от наблюдателя) и потому более надежным методом. Таких методов было придумано целых три -один замечательнее другого. Эти три объективных метода обнаружения отдельных альфа-частиц мы по порядку опишем и только после этого перейдем к тем результатам, которые были с помощью этих методов получены.
Наиболее простым по идее способом является фотографический. Ведь альфа-частица вызывает заметное действие не только тогда, когда она падает на флюоресцирующий экран, но и тогда, когда она падает на фотографическую пластинку.
Рис. 15. Треки ос-частиц: а) наблюдается две группы альфа-частиц, излучаемых торием, с пробегами (в воздухе) в 8,6 и 4,8 см; фото Чедвика; б) альфа-лучи от точечного источника полония; фото Ирэн Жолио-Кюри.
В 1910 году японец Киносита внимательно изучил действие отдельных альфа-частиц на фотографическую пластинку и нашел, что каждая альфа-частица вызывает заметное почернение того зернышка светочувствительного слоя, на которое она упала. После того, как пластинка проявлена, можно сосчитать под микроскопом количество почерневших зернышек, и это даст число альфа-частиц, упавших на пластинку. Можно поступить и так: дотронуться до какого-нибудь места светочувствительного слоя острием иголки, которым мы предварительно коснулись радиоактивного препарата. Сейчас же некоторое ничтожное и совершенно невидимое количество радиоактивных атомов перейдет на фотографическую пластинку. Эти атомы станут испускать во все стороны альфа-частицы. Некоторые из альфа-частиц полетят в самой плоскости пластинки, пронизывая одно зерно светочувствительного слоя за другим. Если через некоторое время проявить пластинку, то на ней будут явственно видны следы промчавшихся альфа-частиц в виде лучей, расходящихся во все стороны от того места, до которого мы дотронулись иголкой.
Фотографический метод не очень удобен на практике и потому не получил большого распространения. Гораздо удобнее оказался другой метод - электрический, который был изобретен в 1908 году Резерфордом и его помощником Гейгером.
Идея этого способа заключается в следующем. Мы знаем, что каждая альфа-частица, влетевшая в какой-нибудь сосуд с газом, производит в этом газе ионизацию, отрывая электроны от молекул газа, с которыми она сталкивается, и превращая эти молекулы в ионы. При таком столкновении, как нетрудно сообразить, возникает сразу пара заряженных частиц - одна частица заряжена положительно, а другая отрицательно - пара ионов, как принято говорить. Число ионов, образуемых каждой альфа-частицей, очень велико. Мы знаем, например, что альфа-частица, летящая со скоростью 19 220 км/с[ 15 ], производит в воздухе двести тысяч пар ионов на каждом сантиметре своего пути. Но, как ни велико число этих ионов, оно все-таки слишком мало для того, чтобы их можно было непосредственно обнаружить. Необходимы необыкновенно чувствительные приборы, чтобы удалось измерить электрический ток, образуемый несколькими сотнями тысяч движущихся элементарных электрических зарядов. В 1908 году таких чувствительных измерительных приборов вовсе не было. Лишь в 1928 году немецкому физику Гофману удалось построить такой прибор, и то он настолько капризен и чувствителен к малейшим влияниям (дохнешь на него - и он уже расстроился), что работать с ним весьма затруднительно. Резерфорд и Гейгер и не стали стремиться к тому, чтобы непосредственно обнаружить ионы, образуемые отдельной альфа-частицей. Они сообразили, что можно усилить ионизующее действие альфа-частицы, если в том сосуде с газом, через который она пролетает, будет сильное электрическое поле: в этом электрическом поле каждый ион, образовавшийся в результате действия альфа-частицы, получит большую скорость и, сталкиваясь с другими молекулами газа, сам в свою очередь произведет множество новых ионов; эти последние тоже разгоняются в сильном поле, и каждый из них снова образует много других ионов и т. д., и т. д.
Ионизация будет расти как лавина, и поэтому ее легко будет обнаружить даже и не слишком чувствительными приборами.
Счетчик альфа-частиц, сконструированный Резерфордом и Гейгером в 1908 году, был устроен так. По оси длинного латунного цилиндра (25 см длины, 1,77 см в диаметре) проходит проволока. Эта проволока изолирована от цилиндра, потому что она входит в цилиндр и выходит из него через специальные эбонитовые изоляторы. Из цилиндра слегка откачивается воздух (опыт показал, что ионизационная лавина лучше всего образуется в воздухе, когда давление равно нескольким сантиметрам ртутного столба). Посредством батареи аккумуляторов, один полюс которой заземлен, а другой соединяется со стенками латунного цилиндра, создается сильное электрическое поле между стенками цилиндра и проволокой. Проволока соединена с чувствительным прибором, измеряющим ток. В одном из эбонитовых изоляторов сделано маленькое отверстие для впуска альфа-частиц, прикрытое тончайшим слюдяным листком. Как только альфа-частица влетает внутрь цилиндра и ионизует в нем воздух, каждый из образовавшихся ионов сейчас же разгоняется сильным электрическим полем, существующим между проволокой и стенками цилиндра, и начинает производить новые ионы. Лавина растет и развивается, как было описано выше. В результате этого от стенок цилиндра к проволоке идет заметный электрический ток, попадающий в чувствительный электрометр, с которым соединена проволока. Нить электрометра вздрагивает каждый раз, когда в него попадает ток, и все ее движения записываются на кинопленке, движущейся перед электрометром. Такое устройство позволило Резерфорду и Гейгеру отмечать прохождение отдельных альфа-частиц через прибор даже и тогда, когда число альфа-частиц достигало тысячи в минуту.
Впоследствии Гейгер, уже независимо от Резерфорда, разработал и усовершенствовал этот счетчик. «Счетчик Гейгера - Мюллера», представляющий дальнейшее усовершенствование описанного здесь счетчика Резерфорда и Гейгера, является одним из наиболее замечательных и чувствительных приборов современной физики. Но мы не будем описывать его устройство подробно, потому что его основная идея такая же, как у счетчика Резерфорда и Гейгера. Заметим только, что счетчик Гейгера - Мюллера очень чувствителен не только к влетающим в него альфа-частицам, но и к быстрым электронам, и к другим частицам.
Рассмотрим теперь и третий, наиболее замечательный способ «видеть атомы» - способ конденсации водяных паров, придуманный английским физиком Ч. Т. Р. Вильсоном. Этот способ замечателен тем, что он позволяет не только обнаруживать отдельные быстро движущиеся заряженные атомы и электроны, но и видеть и изучать те пути, по которым эти частицы движутся. Основная идея состоит в следующем.
Если в воздухе находятся пары воды или какой-нибудь другой жидкости (например, пары спирта), то они сейчас же превратятся в жидкость, если только достаточно сильно их охладить. Очень простой способ охлаждения заключается в том, чтобы очень быстро увеличить объем сосуда, в котором находятся эти пары. Можно сделать, например, так: устроить камеру в виде трубы, по которой ходит поршень. Если быстро выдвинуть этот поршень, то воздух с водяным паром, находящийся в камере, сразу расширится а его температура сейчас же упадет. При этом водяной пар превратится в мельчайшие водяные капельки, рассеянные по камере в виде тумана.
Изучая образование этого тумана, Вильсон обнаружил замечательный факт. Он нашел, что туман образуется не всегда. Если пространство в камере совершенно чисто и не содержит даже микроскопических пылинок, то, несмотря на сильное охлаждение камеры при выдвигании поршня, туман не образуется. Водяной пар остается паром, остается, как физики говорят, в переохлажденном состоянии. Но если в камере есть микроскопическая пыль, то пар превращается в жидкость, и притом тем охотнее, чем этой пыли больше. Изучив это явление ближе, Вильсон пришел к заключению, что каждая микроскопическая пылинка является тем центром, вокруг которого происходит конденсация (сгущение, превращение в жидкость) водяного пара. Вокруг каждой микроскопической пылинки образуется капелька воды. Но не только пылинки, плавающие в воздухе, могут служить такими центрами конденсации. Если в воздухе некоторое количество молекул ионизовано, т. е. если в нем есть некоторое число электронов и заряженных электричеством молекул (ионов), то конденсация пара происходит совершенно так же, как если бы там была микроскопическая пыль. Выходит, что не только крохотные твердые пылинки могут служить центрами конденсации, но и ионы (электроны и заряженные молекулы). Водяной пар может оседать на эти ионы, обволакивая их капельками воды. Если в каком-нибудь пространстве содержится переохлажденный водяной пар, который хотел бы сгуститься в жидкость, но не может вследствие отсутствия подходящих центров конденсации, то стоит только образовать в этом пространстве достаточно большое количество ионов (например, рентгеновскими лучами), как пар сейчас же оседает на этих ионах и возникает туман. По-видимому, образование тумана и дождевых капель в нашей атмосфере тоже связано с наличием в воздухе пыли и ионов.
В 30-е годы были проделаны многочисленные опыты, цель которых была - ускорить образование дождевых капель путем разбрасывания с самолета заряженного песка или заряженной пыли. Хотя эти опыты и не дали ценных для сельского хозяйства результатов (такой «искусственный дождь» над большой территорией потребовал бы слишком больших затрат), тем не менее действительно оказалось, что вокруг заряженных пылинок образуются дождевые капли. Этот механизм возникновения капелек дождя и мельчайших капелек тумана, исследованный Вильсоном еще в 1893 году, помог ему в 1911 году построить прибор, позволяющий «видеть атомы».
Идея Вильсона очень проста. Альфа-частица (или другая заряженная быстро движущаяся частица) влетает в камеру, в которой находится воздух с водяным паром. На пути этой частицы образуется большое количество ионов. Если очень быстро увеличить объем камеры (например, выдвигая поршень), то водяной пар охладится и сразу же осядет на ионах, которые густо усеивают путь прошедшей заряженной частицы. Вокруг каждого иона образуется крошечная капелька, но так как ионов очень много, то капельки сольются в целое ожерелье капелек, в длинную струйку воды. Эту струйку можно будет просто увидеть глазом, и можно будет, если мы только захотим, сфотографировать. Мы увидим «туманный след», который точно воспроизводит тот путь, по которому только что прошла заряженная частица. Мы увидим путь отдельной альфа-частицы или путь отдельного электрона! В спинтарископе Крукса мы видим гораздо меньше: там каждая альфа-частица отмечала вспышкой на экране только одну точку своего пути - точку пересечения пути с экраном,- а здесь мы увидим весь ее путь в целом.
Рис. 16. Схематическое изображение камеры Вильсона.
Мы сможем увидеть своими глазами, как пути быстрых альфа-частиц искривляются в сильном магнитном поле, мы сможем увидеть, как альфа-частица меняет направление своего движения, столкнувшись с каким-нибудь атомом, мы сможем увидеть все то, о чем атомная физика раньше говорила, не имея никакой возможности непосредственно проверить правильность своих слов. Поистине камеру Вильсона можно назвать одним из самых чудесных физических приборов, изобретенных в XX столетии.
Заимствуем из книги Резерфорда, Чедвика и Эллиса «Лучи радиоактивных веществ», вышедшей в Кембридже в 1930 году, подробное описание камеры Вильсона:
«Конструкция камеры, с которой работал Вильсон, видна на приложенном рисунке. Закрытая толстым стеклом цилиндрическая камера А, диаметром в 16,5 см и высотой в 3,4 см, представляет собой пространство, в котором получаются пути частиц. Расширение достигается поворотом вентиля В, который соединяет пространство под „полом" камеры с сосудом С, из которого предварительно удален воздух насосами (через стеклянную трубку, указанную на рисунке). При открывании вентиля „пол" камеры внезапно опускается до упора на резиновую подкладку. Деревянные цилиндры D служат только для того, чтобы объем воздуха, перемещающегося при расширении, был меньше. Вентиль В управляется с помощью маятника, который одновременно вызывает разряд мощной конденсаторной батареи через трубку с ртутным паром, где получается яркая вспышка, освещающая пространство внутри камеры настолько интенсивно, что получившиеся пути запечатлеваются на пластинке фотоаппарата[ 16 ], наведенного на внутренность камеры через стекло, которым она покрыта сверху.
Рис. 17. Схематическое изображение камеры Вильсона - Шимизу.
Камера все время наполнена насыщенным паром воды, так как ее крышка и дно покрыты тонким слоем влажного желатина. Между „потолком" и „полом" камеры при надобности может быть включено электрическое поле (с помощью батареи), служащее для того, чтобы убрать ионы, образовавшиеся в камере, и очистить ее для следующего опыта. При точной регулировке промежутка времени между расширением и вспышкой (фотографированием) эта камера позволяет получить очень резкие и ясные стереоскопические фотографии».
При изучении некоторых явлений необходимо иметь фотографии путей огромного множества альфа-частиц, иногда - до одного миллиона. В этом случае необходим прибор автоматического типа, который позволял бы производить много расширений камеры через очень короткие промежутки времени. Для этой цели Шимизу разработал простую конструкцию камеры, позволяющую последовательно производить большое количество снимков. Устройство камеры Шимизу изображено на рисунке. Точно пригнанный к цилиндру поршень качается в камере взад и вперед под действием мотора. Хотя расширение камеры этой конструкции происходит не так внезапно, как камеры конструкции Вильсона, все же в ней получаются прекрасные фотографии, если только позаботиться о том, чтобы альфа-частицы впускались в камеру лишь непосредственно перед тем, как поршень займет свое крайнее положение (максимальный объем камеры). Если применять электрическое ноле для очистки камеры от ионов, то она в состоянии работать, расширяясь каждые несколько секунд. Шимизу разработал метод одновременной съемки на движущейся пленке по двум взаимно перпендикулярным направлениям, что позволяет определить расположение путей частиц в пространстве.
Фотографии, заснятые с помощью камеры Вильсона, приведены на рис. 15, а, б. На основании этих фотографий обыкновенно говорят, что удалось заснять летящие альфа-частицы. Это выражение не вполне точно, так как фотографировались собственно не сами альфа-частицы и даже не образованные ими ионы, а водяные капельки, осевшие на этих ионах при внезапном увеличении объема переохлажденных водяных паров. Но по этим водяным капелькам, густо расположенным на приблизительно прямой линии, можно заключить, что здесь только что пронеслась альфа-частица, подобно тому как вид потоптанных полей и дымящихся развалин свидетельствует о том, что через страну прошли полчища великого завоевателя.
Итак, мы познакомились с четырьмя способами «видеть невидимое», с четырьмя способами наблюдать действия отдельных альфа-частиц: способ вспышек, способ фотографический, способ ионизационной камеры Резерфорда и Гейгера, способ Вильсона[ 17 ].
Рассмотрим же те экспериментальные данные подсчета альфа-частиц, которые были получены в результате применения этих способов.
В 1908 году Резерфорд и Гейгер, применяя свой электрический счетчик, сумели сосчитать число альфа-частиц, испускаемых каждым граммом радия в секунду. Эта задача не так легка, как можно было бы подумать, потому что в препарате радия всегда кроме радия присутствуют еще атомы других химических элементов, образовавшихся в результате распада атомов радия (мы знаем, что атом радия, испуская альфа-частицу, превращается в атом радона, но ведь атом радона в свою очередь испускает альфа-частицу, значит, распад продолжается и дальше, и в результате получаются другие атомы, которые тоже, быть может, испускают альфа-частицы и т. д.). Поэтому среди альфа-частиц, испускаемых препаратом радия, не все испускает сам радий, а некоторые (как правило, даже большая часть) испускаются продуктами распада радия. Поэтому Резерфорд и Гейгер должны были разобраться в этой путанице и суметь отделить альфа-частицы, испускаемые самим радием, от альфа-частиц, испускаемых его продуктами распада. Здесь мы не будем вдаваться в описание того, как им удалось это сделать,- достаточно сказать, что им это удалось. Полное количество альфа-частиц, испускаемых одним граммом чистого радия в секунду, оказалось равным 3,7 *1010.
Тридцать семь миллиардов атомов радия из всего количества атомов, составляющих один грамм радия, умирают в течение каждой секунды. Таков был важный результат, полученный Резерфордом и Гейгером.
Не медля ни одного дня, Резерфорд и Гейгер приступили к следующей части своей задачи - к определению заряда альфа-частицы. Они взяли стеклянный сосуд, из которого хорошенько выкачали воздух. Препарат радия, испускавший определенное и уже известное количество альфа-частиц, был помещен на стеклянное блюдечко, находившееся внутри этого сосуда. Напротив блюдечка была расположена металлическая пластинка, соединенная с очень чувствительным электрометром, с помощью которого было возможно измерять падающий на пластинку электрический ток. Нужно было не забывать еще об одной необходимой предосторожности: препарат радия испускает кроме альфа-лучей еще и бета-лучи, которые в этом опыте совершенно не нужны. Поэтому весь сосуд был поставлен между полюсами электромагнита, магнитное поле которого сдувало прочь бета-лучи, испускавшиеся препаратом, так что ни один электрон бета-лучей не мог долететь до металлической пластинки, соединенной с электрометром. Альфа-лучи не так сильно искривляются в магнитном поле. Поэтому они долетали до пластинки,, и полный заряд всех альфа-частиц мог быть измерен.
Эти опыты Резерфорда и Гейгера показали, что полный заряд альфа-частиц, испускаемых в секунду одним граммом чистого радия, составляет 33,2 абс. ед. Так как число этих альфа-частиц равно 37 миллиардам, то заряд альфа-частиц получится, если разделить 33,2 на 37 миллиардов. Отсюда следует, что заряд каждой альфа-частицы равен 9*10-10 абс. ед. Это число действительно приблизительно в два раза больше, чем элементарный электрический заряд. (Конечно, то, что оно не точно, а лишь приблизительно в два раза больше, чем элементарный электрический заряд, объясняется только тем, что в таком трудном измерении всегда неизбежны некоторые ошибки, а совсем не тем, что заряд альфа-частицы действительно чем-то отличается от удвоенного заряда водородного иона.) Таким образом, можно было считать непосредственно доказанным, что каждая альфа-частица несет на себе двойной элементарный заряд, и, следовательно, так как величина e/m в ее случае была уже хорошо известна, что масса альфа-частицы в четыре раза больше массы атома водорода. Это и утверждали Резерфорд и Содди еще в 1903 году, когда они впервые высказали свою гипотезу о превращении элементов. Гипотеза Резерфорда и Содди выдержала еще одно испытание.
В 1909 году Э. Регенер повторил опыты Резерфорда и Гейгера, измеряя таким же способом заряд, переносимый альфа-частицами. Различие заключалось лишь в том, что он в то же время и подсчитывал число альфа-частиц, но не с помощью счетчика Резерфорда - Гейгера, а регистрируя вспышки. Экраном, на котором возникали вспышки при падении- альфа-частиц, служил небольшой алмаз. В результате этой работы у Регенера получалось еще более точное, чем у Резерфорда и Гейгера, значение заряда альфа-частицы, а именно: 9.58*10-10 абс. ед.
Если разделить это число на 2, то получится 4,79*10-10 абс. ед.
Это число очень близко к тому, которое получил Милликен, когда он измерял (см. предыдущую главу) элементарный электрический заряд.
Рассмотрим еще одно важное следствие, вытекающее из опытов Резерфорда и Гейгера. Мы знаем, что масса каждого атома водорода составляет 1,662*10-24 г, а так как атомная масса радия 226, то, значит, масса каждого атома радия равна 3,76*10-22 г. В грамме радия, следовательно, имеется 2,66 *1021 атомов.
Из этих атомов каждую секунду распадается 3,7*1010 атомоd, т. е. доля, равная дроби
(3,7*1010)/(2,66*1021) = 1,4.*10-11.
Это значит, что любое наличное количество атомов радия уменьшается в течение каждой секунды примерно на полторы миллиардные доли процента. Всякий, кто умеет вычислять с помощью таблицы логарифмов, очень легко сосчитает, сколько же нужно секунд, чтобы имеющееся количество атомов радия сократилось, например, вдвое. Необходимое для этого число секунд равно[ 18 ]
{(2,66*1021)/( 3,7*1010)}*Ln2=5*1010 c
А так как год составляет 3,16*107 с, то, чтобы узнать, через сколько лет данное количество атомов радия уменьшится ровно вдвое, нужно разделить 5*1010 на 3,16 * 107. Ответ гласит: через 1600 лет.
Этот необыкновенно важный результат, полученный таким простым способом, сразу объясняет, почему физики, открывшие радий, сочли его неиссякаемым источником энергии, каким-то «вечным двигателем», никогда не устающим отдавать все новые и новые запасы энергии. В действительности радий устает, энергия его иссякает, но только все это происходит очень медленно. Радон (эманация радия) распадается наполовину в течение четырех дней (точнее говоря, за 3,85 дня), и поэтому уменьшение его радиоактивности было сразу замечено. Но радий распадается наполовину в течение 1600 лет, значит, в течение самой долгой человеческой жизни данный препарат радия останется почти таким же, каким он был. Но все же радий не вечен. Если бы вавилонский царь Хаммураби, царствовавший семь тысяч лет тому назад, положил в свою сокровищницу один грамм радия, то в наше время, даже если бы сокровищница не была разграблена, в ней осталось бы радия не больше чем несколько десятков миллиграммов.
Не бесконечен, хотя и очень велик, тот запас энергии, который радий растрачивает, превращаясь в радон. Измерения показали, что один грамм радия испускает в час 140 калорий тепла. Это количество тепла испускается, однако же, не одним лишь чистым радием, но также и теми радиоактивными продуктами распада радия, которые всегда присутствуют в радиевом препарате и тоже испускают лучи Беккереля, нагревая все окружающие предметы. Немецкий физик Гесс (в 1912 году) попробовал измерить теплоту, испускаемую препаратом чистого радия, из которого были удалены все продукты распада. Оказалось, что один грамм чистого радия дает всего лишь 25 калорий в час, т. е. 6,9*10-8 калорий в секунду. А мы знаем, что за секунду распадается часть радия, равная 1,4*10-11. Значит, когда распадется весь грамм радия, то выделенная им энергия (при превращении в радон) будет равна
(6,9*10-8)/( 1,4*10-11)=2,05*109 Дж.
Четыреста девяносто миллионов калорий - вот сколько энергии отдает грамм радия, превращаясь в радон! И это еще не вся заключенная в нем энергия: ведь и радон распадается дальше, отдавая энергию еще и еще (в дальнейшем мы увидим, сколько энергии выделяется во всей длинной цепи радиоактивных превращений, в которой превращение радия в радон является лишь одним из звеньев). Для того чтобы понять, как велика эта энергия, заметим, что при горении грамма водорода (а это одна из самых энергичных химических реакций) выделяется 34 000 калорий тепла, т. е. приблизительно в 10 тысяч раз меньше, чем при превращении грамма радия в грамм радона. Еще эффективнее получится сравнение, если энергию пересчитать на атомы. Энергия, выделяющаяся при превращении одного атома радия:
Ra Rn + He,
оказывается (как показывает простенький расчет) в полтора миллиона раз больше, чем энергия, освобождающаяся при образовании одной молекулы воды из водорода и кислорода. Все это показывает, что радиоактивные явления - действительно нечто совершенно несравнимое по масштабу с обычными явлениями химии.
Еще более интересные цифры получаются для продолжительности жизни[ 19 ] урана. Количество альфа-частиц, испускаемых ураном, было сосчитано таким же способом, как и количество частиц, испускаемых радием. Отсюда можно было вычислить и продолжительность жизни урана. Оказалось, что данное количество урана должно распасться наполовину в течение четырех с половиной миллиардов лет. Это - огромная цифра даже по сравнению с продолжительностью жизни радия. Четыре с половиной миллиарда лет! Трудно даже представить себе такой огромный промежуток времени. Отсюда следует, что радиоактивность куска урановой руды не могла бы заметно уменьшиться не только за краткий срок человеческой жизни, но даже и за промежуток времени, сравнимый со всей историей человечества. Радиоактивность урана почти бессмертна. В этом смысле, как совершенно справедливо замечает Содди, уран, в сущности говоря, гораздо чудеснее и замечательнее, чем радий: из всех известных нам вещей на земле кусок урановой руды больше всего напоминает «вечный двигатель» - заветную мечту изобретателей. Беда в том, что этот «вечный» или, лучше сказать, «почти вечный» двигатель имеет такую маленькую мощность.
Тот факт, что уран не является «вечным двигателем» на самом деле и что с ним, как с радием, происходит изменение, хотя гораздо более медленное, может быть доказан посредством прямого опыта: из урана постепенно, хотя и весьма медленно, выделяется гелий. Это обнаружил на опыте Содди. Мы приводим из его книжки «Радий и строение атома» рисунок, изображающий прибор, который он использовал, и описание этого прибора. Это описание может служить хорошей иллюстрацией к словам того же Содди о том, что современная физика уже не может утверждать, что «ее величайшие открытия делаются при помощи очень простых приборов, сооруженных из проволоки и сургуча», как с гордостью утверждала старинная наука. Радиоактивные измерения требуют сложных приборов и тончайшей экспериментальной техники. Но дадим слово самому Содди: «На фотоснимке представлен прибор, использовавшийся в моей лаборатории. Это семь совершенно одинаковых аппаратов, стоящих рядом, но. независимых и не сообщающихся друг с другом.
Рис. 18. Прибор Содди для доказательства возникновения гелия из урана.
Каждый аппарат состоит из большой колбы, вмещающей значительное количество исследуемого материала в виде раствора. Колбы снабжены кранами с ртутным затвором особой формы, который, совершенно изолируя на определенный срок содержимое колб от окружающей атмосферы, в то же время может быть открыт в любой момент путем отсасывания книзу столба ртути к барометрических трубках, так что накопившиеся в колбе газы могут быть без всякого впуска воздуха извлечены для испытания на гелий. Присутствие воздуха крайне вредно. Пузырек воздуха величиной с булавочную головку, остававшийся во всем объеме большой колбы или в растворе или же проникавший в колбу в период накопления газа, обычно совершенно губил опыт. Большинство приспособлений имеет целью предварительное тщательное удаление воздуха из приборов до начала опытов. Методы испытания на гелий также совершенно новы. Они основаны на открытом мной свойстве металла кальция поглощать, при нагревании в безвоздушном пространстве до очень высокой температуры, все следы газов, за исключением газов типа гелия и аргона. Таким образом, ничтожное количество полученного гелия (обычно не более одной тысячной доли кубического миллиметра) является совершенно свободным от следов водяного пара и других газов. Наконец, его переводят при помощи ртути в самую маленькую спектроскопическую трубочку, какая только может существовать, и рассматривают его спектр. Как показали многочисленные специальные опыты, желтая спектральная линия гелия может быть замечена при наличии одной миллионной части кубического сантиметра гелия (или, что то те самое, одной пятимиллиардной доли грамма). Это, конечно, наименьшее количество какого бы то ни было химического элемента, которое может быть обнаружено спектроскопом.
Повторяя опыт много раз, можно для каждого сосуда определить продолжительность периода накопления гелия до того момента, когда его можно заметить в выделяющихся газах, и таким образом установить его количество. Я неоднократно получал таким способом гелий из солей урана и, как оказывалось, именно в таком количестве, какое может быть заранее вычислено из теории распада. На каждую тысячу тонн урана получается около двух миллиграммов гелия в год».
Что же получается в результате этого медленного радиоактивного превращения урана? Выше мы уже говорили о том, что радий должен быть одним из продуктов распада урана (хотя и не обязательно непосредственным продуктом). Это заключение мы основывали на том, что радий встречается всегда в рудах, которые содержат уран. Покажем теперь, что, зная продолжительность жизни урана и радия, можно подвергнуть это заключение еще и некоторому количественному испытанию. Для того чтобы понять, в чем заключается это испытание, вдумаемся в следующее рассуждение.
Продолжительность жизни радия составляет всего лишь 1600 лет - огромный срок по сравнению с продолжительностью человеческой жизни, но все же совершенно ничтожный по сравнению с продолжительностью существования земного шара. Ясно, что имеющееся на Земле количество радия должно все время восстанавливаться из какого-то источника: иначе оно давным-давно пришло бы к концу задолго до того, как на Земле появилось поколение физиков, которое оказалось способным открыть радий и изучить его свойства. Отсюда мы заключаем, что радий беспрерывно возникает вновь из какого-то другого радиоактивного элемента, являющегося его предком. Предположим, что таким предком, т. е. не обязательно отцом, а, может быть, прадедом или прапрадедом, является, как это весьма вероятно, уран.
Как должны мы представлять себе процесс рождения и смерти радия?
Если мы возьмем некоторое количество урана и предоставим этот уран самому себе, то атомы урана будут постепенно распадаться, превращаясь в атомы какого-то другого химического элемента; эти последние будут распадаться в свою очередь, превращаясь снова во что-то другое, и т. д., и т. д., пока, наконец, в качестве одной из ступеней этого последовательного процесса, не появятся атомы радия, превращающиеся затем в атомы радона, и т. д. Из всего этого следует, что если данное количество урана, например килограмм, предоставлено самому себе, то через некоторое время в нем должно оказаться какое-то количество радия. Это количество радия сперва равнялось пулю, затем оно начало расти, по, спрашивается, будет ли оно расти все время? Ясно, что все время расти оно не будет и что должна быть какая-то граница этого роста. Эта граница определяется, разумеется, не только тем, что из первоначально взятого килограмма урана не может получиться сколько угодно большого количества радия (если бы радий был конечным продуктом превращения и не подвергался дальнейшему превращению, то из килограмма урана не могло бы получиться больше чем 225,97/238,14 килограмма радия, так как атомная масса радия составляет именно такую дробь от атомной массы урана).
Граница роста радия установится еще раньше, потому что атомы радия распадаются, а не являются конечным продуктом. Количество радия перестает расти в тот самый момент, когда число атомов радия, распадающихся в секунду, станет равно числу атомов радия, возникающих в секунду из радиоактивного элемента, являющегося непосредственным предшественником («отцом») радия. Когда этот момент наступит, то в дальнейшем количество радия уже расти не будет. Оно начнет уменьшаться, хотя и необычайно медленно, следуя за постепенным уменьшением запасов самого урана - родоначальника всей этой династии превращающихся друг в друга радиоактивных элементов. Но так как уран распадается настолько медленно, что по сравнению с радием его можно считать почти бессмертным, то мы пренебрежем этим медленным уменьшением количества радия и убудем считать количество радия практически постоянным. Наступило «радиоактивное равновесие»: число уничтожающихся в секунду атомов радия равно числу рождающихся в секунду атомов того же радия.
Такое радиоактивное равновесие наступило не только для радия, но и для всех промежуточных элементов (между радием и ураном). Мы пока не знаем, каковы эти элементы и даже сколько их; обозначим их попросту номерами (1, 2, 3,..., n). Наступившее для этих элементов (из которых 1-й является «сыном» урана, а n-й - «отцом» радия) радиоактивное равновесие означает следующее: число ежесекундно распадающихся атомов урана или, что то же, число ежесекундно возникающих атомов элемента 1 равно числу ежесекундно распадающихся атомов того же элемента 1, так как он находится в радиоактивном равновесии. Но ведь это число есть не что иное, как число ежесекундно возникающих атомов элемента 2, и оно, в силу радиоактивного равновесия элемента 2, равно числу ежесекундно распадающихся атомов элемента 2, т. е., что то же, числу ежесекундно возникающих атомов элемента 3. Таким образом, мы получаем длинную цепь равенств: одно число равно другому, другое - третьему и т. д.
В самом конце цепи стоит число ежесекундно распадающихся атомов элемента n или, что то же, число возникающих атомов радия, которое, в силу радиоактивного равновесия радия, равно числу распадающихся ежесекундно атомов радия. Но всякому известно, что если мы имеем цепь равенств, где а = b =c ... = у = z, то мы всегда можем, если хотим, зачеркнуть все промежуточные члены и написать просто a=z.
То те происходит и здесь: в начале цепи стоит число ежесекундно распадающихся атомов урана, в конце цепи - число ежесекундно распадающихся атомов радия. Поэтому мы можем утверждать, что, когда наступит равновесие, число ежесекундно распадающихся атомов урана будет попросту равно числу ежесекундно распадающихся атомов радия. Замечательный результат! Ведь мы вывели его с математической строгостью, совершенно ничего не зная о том, сколько есть промежуточных радиоактивных элементов между ураном и радием и каковы их свойства. А из этого результата сейчас же вытекает другой, еще более замечательный. Ведь мы знаем, что из заданного количества атомов радия ежесекундно распадается доля, равная дроби 1,4*10-11. А из заданного количества атомов урана ежесекундно распадается доля, равная дроби 5 *10-18. Поэтому, когда наступило радиоактивное равновесие, то наличное количество атомов радия, умноженное на 1,4*10-11, должно равняться наличному количеству атомов урана, умноженному на 5*10-13 . Иными словами, число атомов радия должно равняться числу атомов урана, умноженному на 3,5*10-7. Таким образом, мы получаем чисто теоретически, из теории радиоактивного распада Резерфорда и Содди, следующий результат:
Во всякой урановой руде, которая находилась в недрах земли так долго, что в ней успело уже наступить радиоактивное равновесие, число атомов радия должно быть в три миллиона раз меньше числа атомов урана. Так как атомная масса радия лишь ненамного меньше атомной массы урана, то, иными словами, в каждой такой руде грамм радия должен приходиться на три тонны (3*106 г) Урана.
Этот теоретический вывод был проверен Резерфордом и Болтвудом. Они исследовали химический состав очень большого количества урановых руд и обнаружили, что, за очень немногими исключениями, содержание радия в руде всегда строго пропорционально содержанию в ней урана. И отношение между количеством урана и количеством радия оказалось такое же, какого требовала теория: по измерениям Резерфорда и Болтвуда, один грамм радия приходится в среднем на 3,2 тонны чистого урана! (Небольшое расхождение между этим числом и числом, выведенным теоретически, объясняется, конечно, большими трудностями измерения.) Теория радиоактивного распада отпраздновала еще одну победу.
Наконец, еще одно важное заключение вытекает из вычисленной продолжительности жизни урана. Рассмотрим обыкновенный кусок урановой смоляной руды, количество урана в которой составляет 50% веса всей руды.
Спросим себя: как долго мог этот кусок руды пролежать в Земле? Даже если бы он первоначально состоял из одного лишь чистого урана, он не мог бы лежать в Земле больше четырех с половиной или пяти миллиардов лет, потому что в этом случае больше половины его перестало бы быть ураном и превратилось бы в другие химические элементы. Отсюда следует, что возраст куска урановой руды, в которой содержание урана достигает 50%, не может быть больше пяти миллиардов лет.
Это простое и ясное заключение указывает на то, какие неожиданные применения может иметь наука о радиоактивности. Радиоактивные явления дают нам как бы своеобразные часы, с помощью которых мы можем измерять продолжительность протекших огромных геологических эпох.
Вопрос о времени всегда был одним из наиболее болезненных вопросов геологии. Наблюдая различные пласты земной коры, геолог более или менее уверенно говорит о той последовательности, в которой различные геологические эпохи сменяли друг друга, но он большей частью становится в тупик, когда ему предлагают определить продолжительность этих эпох. Иногда он пытается делать примерные оценки сроков, исходя из того, что он приблизительно представляет себе, с какой скоростью могли бы откладываться те или иные наносы, но эти оценки всегда бывают очень гадательны. Отложения, выпадающие из воды каких-нибудь рек и т. п., нарастают с различной скоростью, в зависимости от быстроты течения, рельефа дна и других обстоятельств, и не всегда геолог, пытающийся восстановить прошлую историю Земли, имеет достаточные познания в том, как эти обстоятельства складывались в том или ином случае. Но радиоактивность не обладает всеми этими недостатками: уменьшение количества урана в урановой смоляной руде, лежащей в недрах Земли, должно происходить с абсолютной точностью, «по часам», с величайшим безразличием ко всем внешним явлениям. И геологи поняли, что, если они хотят получить безошибочно точные сведения о продолжительности залегания в земной коре тех или иных минералов, если они хотят установить хронологию тех жутко отдаленных от нас времен, когда еще не существовало человечества, а может быть, не было и самой жизни,- они должны обратиться к помощи радиоактивных элементов - самых безошибочных часов на свете.
Геологи уже давно с любопытством рассматривали маленькие окрашенные кружки, которые встречаются в некоторых сортах слюды - в биотите, кордиерите и мусковите. Происхождение этих кружков оставалось совершенно непонятным, и лишь в 1907 году английский геолог Джоли указал, наконец, на истинную причину, появления этих окрашенных кружков («плеохроическртх ореолов», как их называли геологи). Джоли обратил внимание на то, что альфа-лучи радиоактивных элементов обладают способностью затемнять или окрашивать многие прозрачные тела.
Рис. 19. Радиоактивные венчики: а) в слюде; б) в полевом шпате.
Уильям Крукс пробовал воздействовать в течение нескольких недель альфа-лучами радия на большой бесцветный алмаз. К концу опыта алмаз принял густую зеленую окраску. Стекло и слюда темнели после того, как в течение продолжительного времени подвергались воздействию тех же самых лучей.
Не вызываются ли и плеохроические ореолы действием альфа-лучей? Такая мысль пришла в голову Джоли, и он измерил под микроскопом радиусы этих ореолов с целью узнать, нет ли какой-нибудь связи между ними и длиной пробега альфа-лучей в слюде. Среди альфа-частиц, испускаемых препаратами радия (большая часть которых принадлежит, как мы уже знаем, не самому радию, а дальнейшим продуктам его распада) т наибольшей скоростью и, следовательно, наибольшим пробегом обладает некоторая определенная группа альфа-частиц; выяснилось, что их пробег в слюде равен 0,03 мм.
Когда Джоли измерил радиусы плеодроических ореолов, то оказалось, что в большинстве случаев эти радиусы составляют как раз 0,03 мм! Поэтому Джоли высказал следующее предположение: причиной плеохроических ореолов (или венчиков, как их называют еще) являются маленькие крупинки радиоактивного вещества, вкрапленные в слюду как раз в центре ореола. Эти крупинки, которые в некоторых случаях действительно удавалось обнаружить в микроскоп, испускают во все стороны свои альфа-частицы. Альфа-частицы пробегают некоторое расстояние внутри однородной слюды и останавливаются, застревая на расстоянии, равном длине пробега этих частиц, от центра ореола. Получается шар, центр которого совпадает с вкрапленным кусочком радиоактивного вещества. При срезе можно наблюдать то самое круглое сечение, которое и было замечено геологами. Джоли указал на то, что в некоторых случаях попадаются хорошо развитые ореолы, имеющие сложную структуру. Это объясняется тем, что различные радиоактивные элементы испускают альфа-лучи с различной длиной пробега. В результате получаются концентрические кольца, радиусы которых соответствуют различным длинам пробега.
Вид плеохроического ореола, как указал Джоли, может быть различным в зависимости от возраста минерала. Самые молодые минералы, в которых из урана, находившегося в радиоактивном включении, еще не успело образоваться достаточно большое число атомов, являющихся потомками радия, обладают плеохроическими ореолами с радиусом только 0,013 мм. Более древние минералы обнаруживают и внешнее кольцо с радиусом 0,03 мм, и промежуточные кольца. Внимательно изучая эти еле видимые окрашенные венчики в слюде, Джоли определял с довольно большой уверенностью возраст минерала, пролежавшего в земной коре много столетий. Сравнивая густоту окраски венчика с густотой окраски, вызванной искусственно в слюде, подвергаемой действию известного числа альфа-частиц, Джоли установил, что некоторые образцы слюды имеют возраст в сотни миллионов лет. Количество урана, находившееся в радиоактивном включении в одном исследованном Джоли образце, равнялось 5*10-10 г. Это невообразимо маленькое количество урана испускает всего одну альфа-частицу каждые десять часов. И все же этого оказалось достаточно для того, чтобы за сотни миллионов лет образовать нежный плеохроический венчик, способный рассказать внимательному геологу историю длинных геологических эпох.
Немецкий ученый Мюгге систематически исследовал множество различных минералов, ища в них плеохроические венчики. Он нашел, что голубой плавиковый шпат из Вольсендорфа обнаруживает плеохроические венчики в большем количестве и более разнообразные, нежели какой бы то ни быЛо другой минерал. Концентрические слои видны еще отчетливее, чем в слюде. И радиусу каждого такого слоя соответствует (по длине пробега в плавиковом шпате) одна из групп альфа-частиц, испускаемых ураном и его радиоактивными потомками.
В наши дни уже невозможно сомневаться в том, что плеохроические ореолы действительно имеют радиоактивное происхождение, как это предположил Джоли. Внимательное изучение окраски драгоценных камней, вероятно, тоже покажет, что и она обязана своим происхождением действию лучей радиоактивных веществ,- быть может, ничтожно малого их количества, но действующего в течение огромнейших промежутков времени. Таким образом, основываясь на мелких, но безошибочных признаках, геологи умеют восстановить длинную историю земной коры и с уверенностью оценить продолжительность геологических эпох.
Объяснение плеохроических венчиков, которое дал Джоли, можно сравнить с открытиями Шамполиона и Гротефенда, расшифровавших непонятные письмена давно исчезнувших народов. И подобно тому, как историки вслед за тем сумели шаг за шагом восстановить судьбу этих народов, точно так же и геологи, пользуясь открытием Джоли, читают историю минералов, написанную еле заметными пятнышками окраски, еле заметными плеохроическими венчиками.
Примечания
1
Заметим, что радиоактивность тория и его соединений одновременно с Марией Кюри или даже немножко раньше открыл немецкий физик Шмидт. Но дальнейшие работы Шмидта оказались менее замечательными, чем дальнейшие работы Марии Кюри, а поэтому мы здесь ограничимся рассказом об открытиях, сделанных Марией Кюри.
(обратно)2
Катанга - в настоящее время провинция Шаба в Заире (Прим. ред.)
(обратно)3
Фунт - единица массы старой русской системы мер, 1 фунт=409,5 г.
(обратно)4
Церий. (Прим. ред.)
(обратно)5
См, примечание на следующую таблицу (Примеч. ред.)
(обратно)6
Значения атомных масс, данные М. П. Бронштейном, за последующие годы были уточнены и приведены в соответствие с попы си данными. В примечании к таблице М. П. Бронштейн указывал, что в скобках в ней приведены названия тех элементов, открытие которых «еще сомнительно». Это элементы: 85, который, назывался тогда алабамий и 87 - Виргинии; их атомные массы не были известны (ныне это астат и франций соответственно). Подверглись изменению и названия 43-го (мазурий), 61-го (иллиний) и 71-го (Кассиопей) элементов. Наконец, таблица пополнилась трансурановыми элементами, о которых в предположительных тонах говорит М. П. Бронштейн на стр. 56. (Прим. ред.)
(обратно)7
Отступления от целочисленности связаны с существованием изотопов одного и того же химического элемента таблицы Менделеева, различающихся атомными массами. Открытие изотопов подтвердило правильность гипотезы Праута, (Прим. ред.)
(обратно)8
Ряд таких «трансурановых» элементов был получен искусственно. (Прим. ред.)
(обратно)9
Здесь и далее оставлено старое название «микрон» вместо современного «микрометр». (Прим. ред.)
(обратно)10
Здесь и в дальнейшем М. П. Бронштейн оперирует со значениями некоторых физических величин: заряда электрона е, удельного заряда электрона (отношения заряда к массе) e/m, постоянной Авогадро N и т. д. Приведем уточненные значения этих величин, полученные к нашему времени в результате возросшей точности измерений:
заряд электрона e=4,80325*10-10 ед. СГС,
масса электрона m=9,10956*10-28 г,
удельный заряд электрона e/m=5,27276*1017 ед. СГС/г,
масса атома водорода M= 1,67352*10-24 г,
отношение массы протона к массе электрона М/m=1836,11,
число Авогадро W=6,02217-1023 моль-1. (Прим. ред.)
(обратно)11
Фонограф - изобретенный в 1877 году Эдисоном аппарат, записывающий и воспроизводящий всевозможные звуки. (Прим. ред.)
(обратно)12
Аналогичные опыты (независимо от Милликена) были проведены академиком А. Ф. Иоффе. (Прим. ред.)
(обратно)13
Как ни странно звучит это утверждение, тем не менее оно совершенно справедливо. Попробуем проверить его. По измерениям астрономов, наше Солнце испускает каждую секунду 9*1025 калорий энергии (калория - это то количество энергии, которое тратится на нагревание одного грамма воды на один градус Цельсия). Каждый грамм радия испускает энергию в количестве около 0,04 калорий в секунду. Известно, что масса Солнца 2*1033 г. Значит, если бы оно состояло из чистого радия, то испускало бы около 0,04*2*1033=8*1031 калорий в секунду. Это почти в миллион раз больше той энергии, которую оно испускает в действительности.
(обратно)14
Числа не вполне сходятся, но это ведь может быть результатом некоторой неточности в измерениях.
(обратно)15
С такой скоростью летят альфа-частицы, испускаемые так называемым радием С, одним из продуктов распада радона (см. ниже).
(обратно)16
Или двух фотоаппаратов, если нужно получить стереоскопические снимки.
(обратно)17
За прошедшее с 1935 г. время камера Вильсона была существенно модифицирована; появились и новые типы камер, позволяющие фиксировать траектории заряженных частиц: пузырьковая (1952 г.) и искровая (1957 г.) камеры. (Прим. ред.)
(обратно)18
Ln - натуральный логарифм. Он равен десятичному логарифму, деленному на 0,4343. (Тот, кто не умеет вычислять с логарифмами, может при чтении пропустить все промежуточные выкладки и просто принять результат на веру.).
(обратно)19
Под «продолжительностью жизни» радиоактивного элемента мы всегда понимаем тот промежуток времени, в течение которого наличное количество атомов этого элемента должно уменьшиться вдвое.
(обратно)

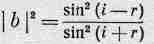

Комментарии к книге «Атомы и электроны», Матвей Петрович Бронштейн
Всего 0 комментариев