Борис Казаков Превращение элементов
Посрамление идеи, или хула алхимикам (Вместо предисловия)
В царствование Людовика XIII некий Дюбуа заявил, что ему известен секрет получения философского камня, и он знает теперь, как добывать золото искусственным путём. Слух об этом достиг ушей кардинала Ришелье, фактического правителя государства. По этой причине Дюбуа однажды оказался в королевском дворце, где его заставили показать своё умение. Ловкий пройдоха взял у стража мушкетную пулю, что-то там над ней поколдовал, после чего она и впрямь стала… золотой. Первое, что пришло в голову изумлённому королю, — так это сделать Дюбуа казначеем: уж он постарается, и королевская казна никогда не будет пуста. Ришелье рассудил иначе: если он овладеет секретом Дюбуа, то его могущество ещё больше возрастёт, а если нет — нетрудно догадаться, к кому оно перекочует. Дюбуа поначалу было заупрямился, так ведь с упрямцами и разговор особый, и язык особый — пытки. Каждое добытое таким надежным способом признание тут же проверялось, золота, разумеется, ни разу не получили. И кончил Дюбуа жизнь на виселице как чародей — с чародеями тогда не церемонились.
Пожалуй, чаще других жертвами обмана становились правители небольших средневековых государств и княжеств Центральной Европы. Среди них император Рудольф II, курфюрст Август Саксонский, курфюрст Бранденбургский… Нюренбергский бургграф Иоанн сам занимался алхимическими опытами в надежде получить вожделенный металл.
А судьба незадачливых алхимиков, искавших для своих занятий богатых покровителей, была, как правило, печальной. Герцог Вюртембергский, потратив безрезультатно на алхимика Генадера 60 тыс. ливров, повесил его на позолоченной будто бы виселице. Также поступил со своим алхимиком маркграф Байретский, да ещё приказал прибить к виселице дощечку с надписью: «Когда-то я умел делать ртуть более постоянной, а теперь меня самого сделали более постоянным». В 1709 г. угодил на виселицу неаполитанец Каэтано, называвший себя графом Руджиеро.
Впрочем, не все герцоги и курфюрсты были так доверчивы, хотя, конечно, не меньше других жаждали злата. Иной правитель не спешил раскошеливаться в ответ на жаркие уверения алхимика, будто он сумеет озолотить своего благодетеля, а прежде напрямик спрашивал: скажи лучше, умеешь ли ты делать фальшивую монету?
Когда алхимик и поэт Аугурелли преподнёс папе Льву X поэму, в которой изложил известные, дескать, ему способы добывания алхимическим путём золота, то в награду получил пустой мешок — весьма необходимый, по мнению папы, предмет для того, кто владеет таким великим искусством…
Разложение феодализма было особенно благодатной почвой для «творчества» великосветских мошенников вроде самозванного графа Сен-Жермена, искусного иллюзиониста, уверявшего, что ему от роду… 360 лет. Ещё большей популярностью пользовался другой самозванный граф — Калиостро. Его принимали чуть ли не при всех королевских дворах Европы, «превращение» железных гвоздей в золотые, ртути в серебро было для него изящным трюком, а для светской публики — поражающим воображение чудом.
Бесплодные попытки алхимиков превратить неблагородные металлы в золото и серебро, откровенное мошенничество разного рода авантюристов и шарлатанов привели в конце концов к тому, что это занятие уже в средние века воспринималось искусством, основанным на обмане. «Пусть не останется здесь мною позабыт обман мошенника, алхимией прикрыт», — писал Себастьян Бранд в своём знаменитом сатирическом сочинении «Корабль дураков». Французский учёный Николя Лемери в 1675 г. отозвался об алхимии так: «Алхимия — это искусство без искусства, которое вначале лжёт, в середине работает и кончает нищетой». А Бернар Пернотт, один из тех несчастных, кто искренне поверил в идею и, потратив на неё состояние, стал нищим, с мрачным остроумием советовал: «Тот, кто желает кому-нибудь гибели, но не может осмелиться открыто напасть на своего врага, должен побудить его заняться изготовлением золота».
Отголоски прежнего недоверия и презрения к алхимии дошли и до наших дней. Этим словом пользуются, как правило, когда хотят что-либо осудить как не имеющее к науке никакого отношения.
Вниз и вверх по ступеням веков
Между тем всё не так просто. «Алхимики, — считает современный итальянский историк науки М.Джуа, — в поисках философского камня заложили фундамент для создания химии… Те исследователи, которых мы представляем себе запертыми в лабораториях, полных реторт и перегонных кубов, были бессознательно настоящими тружениками на ниве знаний».
Почти также отзывался об алхимиках великий Д.И.Менделеев. «Поверхностное знакомство с алхимиками, — писал он, — часто влечёт за собой невыгодное о них мнение, в сущности весьма неосновательное… Только благодаря запасу сведений, собранных алхимиками, можно было начать действительные научные изучения химических явлений».
Одна из самых безоговорочно положительных оценок алхимии принадлежит знаменитому химику XIX в. Юстусу Либиху. По его мнению, «алхимия никогда не была чем-либо другим, как химией…»
И возраст у алхимии почтенный — более 1000 лет. Обычно верхним пределом алхимии считают XVI–XVII вв., потому что именно в это время она под влиянием возвышения городов, развития торговли, ремёсел и промыслов начала уступать место практической, прикладной химии, связанной прежде всего с горным и металлургическим производством. В XVII в. были изобретены телескоп и микроскоп, благодаря которым люди, можно сказать, стали глядеть на окружающий мир иными глазами. XVII в. — это и век, когда на почве повышенного интереса к естествознанию возникают такие научные организации, как академии. В 1603 г. в Риме появилась «Accademia dei Lincei» — в дословном переводе «Академия рысей». Её члены должны были изучать природу с зоркостью, присущей этому зверю. К слову сказать, в числе членов академии был Галилей. В 1657 г. кардинал Медичи учредил флорентийскую «Академию опыта». В 1660 г. оформилось Лондонское Королевское общество.
Рубеж, отделяющий химию от алхимии, прослеживается, казалось бы, довольно чётко. Но также чётко проглядывает и его условность: последующее становление химии ещё долго шло в борьбе с алхимическими представлениями, в их преодолении. Ярых приверженцев алхимии было немало и позже. Даже в середине XIX в. существовали герметические общества (от имени бога Гермеса), члены которых были убеждены в достижении заветной цели.
Считается, что европейская алхимия как что-то более или менее определённое, со своей системой идей, догм, набором приёмов, рецептов, со своим характерным языком символов, аллегорий, магических формул и т. д. начала формироваться в IV в. н. э.
Среди алхимиков были настоящие и честные врачи, трудолюбивые ремесленники, учёные монахи и просто учёные. Арабы Джабир ибн Гайян (Гебер) и Аль-Рази (Разес), испанцы Раймунд Лулл и Арнальдо да Виллонова, немцы Альбрехт фон Больштедт (Альберт Великий) и некто Василий Валентин, англичанин Роджер Бэкон… Это IX–XVI вв. А вот ещё несколько ярких звёзд: Теофраст Парацельс — XVI в.; Иоганн Рудольф Глаубер, Ван-Гельмонт, Готфрид Лейбниц — XVII в. Даже сам сэр Исаак Ньютон, завершивший кладку величественного здания классической механики, которая претендовала на полное объяснение мира и потому, казалось, не оставляла места для алхимических спекуляций, — даже сэр Исаак Ньютон верил в возможность превращения металлов на алхимической основе. Правда, без пресловутого философского камня, а с помощью некоего универсального растворителя. «Золото, — писал он, — состоит из взаимопритягнвающихся частиц, сумму их назовём первым соединением, а сумму этих сумм — вторым и т. д. Ртуть и царская водка могут проходить через поры между частицами последнего соединения, но не через иные. Если бы растворитель мог проходить через другие соединения, иначе, если бы можно было разделить частицы золота первого и второго соединений, то золото сделалось бы жидким и текучим. Если бы золото могло бродить, то оно могло бы быть превращено в какое-нибудь другое тело».
Было бы, по-видимому, более справедливо назвать алхимию сложным, противоречивым явлением, в котором искренняя вера сочеталась с обманом, бескорыстие научного поиска — с жаждой наживы. Но нас интересует не сама алхимия, а идея, которую она безуспешно пыталась осуществить.
Истоки идеи теряются в седой мгле веков. Вера в то, что один металл может стать другим, складывалась постепенно по мере накопления практических наблюдений над превращением веществ в процессе изготовления предметов труда и быта. Случайно найденное или замеченное потом либо бесследно терялось, либо закреплялось в опыте поколений. Имея дело с разного рода предметами, вовлечёнными в сферу производственных интересов, люди, естественно, не могли не думать о природе и сущности процессов, при которых одно вещество становилось чем-то другим: например, непрозрачный песок — прозрачным стеклом, сырая глина — звонким и прочным сосудом… Материальное производство всегда было одновременно производством знаний. Ф.Энгельс указывал, что «…существеннейшей и ближайшей основой человеческого мышления является как раз изменение природы человеком, а не одна природа как таковая, и разум человека развивался соответственно тому, как человек научался изменять природу».
Опираясь на данные археологии и свидетельства дошедших до нас письменных и других источников, историки определяющую роль в накоплении первоначальных практических знаний, в том числе и химических, отводят народам северо-востока Африки (долины Нила) и Востока (Двуречья, Индии и Китая): именно здесь возникли первые очаги земной цивилизации. Один из древнейших — египетский. Египтяне, по мнению ряда исследователей, дали нам само слово — химия. Правда, полного единодушия в этом вопросе нет. Одни считают, что химия ведёт свою родословную от древнеегипетских chemi, или chuma, обозначающих и чернозём, и название Египта как страны. Другие считают, что химия — производное от древнегреческих химос, или хюмос — сок, а также от хима, или хюма — литьё, поток, река. Византийский учёный Суидас, живший в X–XI вв., химией назвал «искусственное приготовление золота и серебра».
Есть и другие толкования. Любопытно, однако, что почти всегда в них привлекаются термины и понятия, так или иначе связанные с металлургическим производством. Вероятно, химией в древности называли ту часть знаний и навыков, которая включала в себя добычу руды и обработку металлов, приготовление сплавов, изготовление поделок из драгоценных камней…
В египетских храмах служили одновременно и богам, и знаниям, и ремеслу. При многих из них были музеи и школы, в которых жрецы, наиболее образованные по тем временам люди, обучали инженерному и строительному делу, готовили смотрителей для копей, рудников и мастерских по выплавке и выделке металлов. То, что они знали и умели, для всех смертных вовсе не предназначалось. Во II в. до н. э. Климент Александрийский писал: «Жрецы никому не сообщают своих тайн, храня их для наследников фараонов и для тех из своих, кто отличается добродетелью и мудростью». Особенно строго охранялось так называемое священное искусство — всё, что жрецы умели делать с золотом и серебром.
Восток для народов Средиземноморья был сокровищницей знаний, окутанных тайной и потому ещё более привлекательных. Все, кто хотел познать эти тайны и прослыть мудрецом, стремились сюда. Греки, сами достигшие многого в ремёслах и особенно в мудрости, ездили в Египет учиться. Здесь побывали философы Демокрит и Платон, математик и астроном Эвдокс и многие другие учёные мужи Эллады.
В IV в. до н. э. Египет подвергся очередному завоеванию. За свою долгую историю он уже не единожды попадал под чужеземное владычество. Новому претенденту на власть над страной древнейшей культуры македонскому царю Александру не пришлось давать больших сражений и вести длительную осаду городов: египетская знать и жречество встретили его не как завоевателя, а как освободителя от ига персидского владыки Дария, и нарекли сыном бога Ра.
Египет стал частью огромной греко-восточной империи, созданной Александром в результате почти десятилетнего похода по Азии. В дельте Нила на берегу Средиземного моря Александр основал город — Александрию. Но империя Александра оказалась образованием крайне непрочным. Сразу же после его смерти в 323 г. до н. э. начался распад империи, сопровождавшийся полувековой борьбой за власть между видными сподвижниками Александра — диадохами. На развалинах империи образовался ряд государств, вошедших в историю под названием эллинистических.
Термин «эллинизм» достаточно условный и отражает только одну сторону этого этапа истории народов, живших на территории Восточного Средиземноморья, Западной Азии и областей, прилегающих к Чёрному морю, а именно — установление над ними греко-македонского господства и прорыв греческой культуры далеко на Восток. Другая — более существенная — сторона заключается в том, что в самих восточных рабовладельческих деспотиях вызревали условия, оказавшиеся благоприятными и для греко-македонской колонизации, и для распространения греческих культурных традиций. Завоевания Александра Македонского были вроде катализатора, во много раз ускорившего течение социально-экономических и культурных процессов на Востоке. Из слияния этих двух сторон и образовалась эллинистическая цивилизация — причудливая смесь восточных и греческих элементов и в общественной организации, и в религии, и в искусстве, и в философии.
Наиболее характерной страной эллинизма стал Египет. Так сказать, классика эллинизма. Удачно расположенная географически, египетская Александрия (кроме неё, Александр основал в разных концах своей империи ещё несколько городов своего имени) уже к концу IV — началу III в. до н. э. выросла в крупный центр необычайно оживившегося торгового обмена между Востоком и Западом, древней культуры и ремёсел. Правители Египта Птолемеи, наследники основателя династии македонца Птолемея, сына Лага, нещадно эксплуатируя не только рабов, но и «свободных» земледельцев, ремесленников, отстроили Александрию, сделали её столицей величественного царства. Их двор по пышности не уступал дворам египетских фараонов, по просвещённости — дворам греческих царей.
Широкую известность приобрели такие придворные учреждения Птолемеев, как Мусейон — «святилище муз», древнейшая в мире академия, и библиотека — уникальное по тем временам собрание пергаментных и папирусных свитков, глиняных и восковых таблиц. Целыми кораблями доставляли в библиотеку эти драгоценнейшие памятники восточной и греческой культуры. В городе была ещё одна библиотека, более доступная, — при храме Сераписа, нового божества, сочетавшего в себе черты египетских и греческих богов (типичная деталь эпохи эллинизма).
Александрия манила многих — и тех, кто хотел приобщиться к культуре, к накопленным здесь знаниям, и тех, кого соблазняли «райские» условия для занятий наукой, искусством, философией. Птолемеи освобождали своих придворных учёных, поэтов, скульпторов, архитекторов, философов от податей и брали их на государственное обеспечение.
Оживление экономики, рост торговли заметно повысили потребность в драгоценных металлах, а известные к тому времени месторождения уже не могли её удовлетворить. Отсюда повышенный интерес к священному искусству египетских жрецов. Оно стало предметом пристального изучения. Его рецепты переписывались, из них составлялись целые руководства, их по-своему толковали. В 1828 г. в одной из фиванских гробниц были найдены два папируса, написанные по-гречески. Но учёные считают, что сведения, содержащиеся в этих папирусах, взяты из какого-то египетского источника примерно IV в. до н. э. Оба папируса представляют собой сборники разных рецептов, в том числе касающихся «удвоения» и «утроения» благородных металлов, что на самом деле было не чем иным, как изготовлением подделок из меди путём добавки в него минералов арсенопирита, реальгара и аурипигмента.
Не меньшего внимания заслуживали свидетельства, которые в изобилии поставляла практика. Рудокопы знали, например, что на железных инструментах, пролежавших некоторое время в местах, где добывали медную руду, мог появиться красный налёт меди. Сильное впечатление производило присутствие в медных рудах какого-то количества золота. Ныне этим не удивишь никого. А тогда подобные факты совсем нетрудно было истолковать как «превращение элементов»: железо трансмутируется в медь, а медь — в золото. Только в природе это происходит чрезвычайно медленно. Задача, стало быть, заключается в том, чтобы найти пути и способы искусственного ускорения этого вполне естественного будто бы процесса. Вот их и искали, но не в экспериментах, а в туманных и таинственных текстах, составленных жрецами, и в умозрительных философских построениях греческих мудрецов. При этом ничего «противозаконного» не было в том, чтобы призывать на помощь и многочисленных богов, и небесные светила (астрологию), и различные сверхъестественные силы (магию).
Священное искусство древнеегипетских жрецов, технико-практические знания ремесленников, персидская и вавилонская магия, астрология, связывавшая происхождение известных тогда металлов (золота, серебра, меди, железа, свинца, олова и ртути) с Солнцем и планетами, — всё это смешалось, по меткому выражению одного историка науки, в адскую кашу, из которой тщетно пытались выловить рецепт сказочно быстрого обогащения. Поиски рецепта стали даже разделами официальной академической науки: аргиропея — получение искусственным путём серебра и хризопея — золота.
Ещё не было алхимии с её центральной идеей чудодейственного философского камня, но уже была сформулирована цель, для достижения которой этот камень понадобился. Причём не только в эллинистическом Египте. Установлено, что учение о трансмутации металлов почти в то же время (по некоторым источникам даже раньше) разрабатывалось в Индии и Китае. Во II в. до н. э. философ Вей По-йанг написал «Книгу перемен», в которой фигурируют «пилюли бессмертия», изготовленные, по всей вероятности, из киновари (крови дракона), всегда считавшейся китайскими химиками исходным веществом для получения золота. Легенда утверждает, что Вей По-йанг сам принял такую пилюлю, дал ученику и собаке. Умерли все (что не удивительно: ртутное соединение!), но потом будто бы воскресли и сделались бессмертными. Известен также труд другого китайского учёного II в. до н. э. — Ко Хунга. Здесь тоже говорится о «пилюлях бессмертия», но основной упор сделан на превращение неблагородных металлов в благородные. Рецепты приводятся, как обычно для такого рода литературы, очень туманные, воспользоваться ими мог только тот, кто умел читать не сами слова, а их некий тайный смысл.
Почти одновременно же в разных странах древнего мира сложились представления о строении веществ, которые были использованы для теоретического обоснования трансмутации металлов. История позаботилась о том, чтобы до нас более или менее отчётливо дошли взгляды философов Древней Греции: Фалеса (625–547 гг. до н. э.), Анаксимандра (610–546 гг. до н. э.), Анаксимена (588–525 гг. до н. э.), Гераклита (540–475 гг. до н. э.), Эмпедокла (483–423 гг. до н. э.) и, наконец, Аристотеля, родившегося за год до смерти Эмпедокла, учение которого он воспринял и развил, и скончавшегося через год после смерти Александра Македонского, учителем которого он был и на которого оказал огромное влияние.
То, из чего состоит окружающий мир, стало предметом обсуждения с тех пор, как раб «освободил» мыслителя от необходимости заботиться о куске хлеба насущного. Работу мыслитель презирал, размышление об устройстве мира считал занятием, достойным избранных. Опыт, эксперимент — та же работа, «чистому» размышлению она не нужна. Ему достаточно лишь наблюдения, чтобы построить систему, способную объяснить всё, весь мир. Наблюдение: когда воду нагревают, она частично превращается в воздух, частично — в землю (морская вода действительно дает много земли — осадка — при выпаривании). Вывод (Фалеса): весь мир состоит из воды, она — первооснова всего. Анаксимен рассуждал наоборот: первоначалом следует считать воздух, из которого при «сгущении» образуется вода, а при «разрежении» — огонь. Гераклит роль первоначала по той же логике отводил огню. Анаксимандр заменил всё это ещё большей абстракцией: основу всего сущего составляет некий безграничный, беспредельный принцип апейрон.
У Эмпедокла одинаково равны все четыре начала — огонь, воздух, вода и земля.
Аристотель продолжил рассуждения своих предшественников и завершил их учением, ставшим надолго основой знаний о строении и свойствах веществ. Согласно этому учению все земные тела состоят из четырёх начал-стихий (греческое «стохейя» — первоначало, основа): воды, земли, воздуха и огня. Для небесных тел Аристотель ввёл пятое начало — эфир. На небе он поместил также «двигатель» всех процессов, происходящих в мире. (Поначалу христианские богословы отвергли всю философскую систему Аристотеля, но затем, уцепившись за этого «верховного двигателя» всякого движения и другие идеалистические элементы этой системы, приспособили её для обоснования своей догмы о всемогуществе Бога).
Каждое из четырёх Аристотелевых начал-стихий обладает ещё двумя из четырёх же свойств: теплоты, холода, сухости и влажности. Вода холодная и влажная, земля холодная и сухая, воздух тёплый и влажный, огонь тёплый и сухой. Тут надо особо подчеркнуть, что речь идёт не о реальной воде или земле и т. д., а о стихиях, абстрактных философских принципах, соотношение которых как раз и определяет реальную вещь и её свойства. Практически это значит, что достаточно в каком-либо веществе изменить соотношение (количественно увеличить или уменьшить одно из свойств), как вещество сразу же станет совсем другим. Вот как, например, Аристотель объяснял происхождение металлов и минералов. Если солнечный луч действует на воду, то происходит влажное испарение; если на землю — сухое. Оба испарения взаимодействуют с землёй, соединяются и уплотняются. Если в таком уплотнённом теле будет преобладать стихия огня, получится минерал, если вода — металл. Чем меньше в металле стихии земли, тем он чище, благороднее. Золото, разумеется, — благороднейший из благородных металлов, в нём стихии земли практически нет. Потому-то золото не поддаётся действию жара (не даёт окалины), что в нём гореть нечему.
Аристотелю принадлежит первое определение элемента. По мнению Аристотеля, как слова состоят из букв (l, m, n, t), так и вещи состоят из начал — эль, эм, эн, т. Исходя из этой аналогии Аристотель элементом назвал «то основное в составе вещи, из чего вещь слагается, причём (само) оно не делится (дальше)… наиболее общие (вещи) представляют собой элементы, ибо каждая из них, будучи единою и простою, находится во многом — или во всём…»
Впоследствии толкователи Аристотеля стали подменять одно другим — элемент стихией, а стихию элементом, но затем стихии уступили место атомно-молекулярным представлениям о строении веществ. Слово «элемент» на основе тех же представлений приобрело иное значение. Ныне оно — одно из главных понятий химии и физики.
Во II–I вв. до н. э. эллинистические государства переживали острый социальный и политический кризис. В народных массах шло глухое брожение, находившее выход в религиозных исканиях. Беспощадная эксплуатация и горькое сознание своего бессилия что-либо изменить в этом мире рождали в угнетённых массах мечты о другом мире, где богатых ждёт возмездие, а бедные будут вознаграждены за земные страдания. В той же Александрии появилось множество разных сект, предлагавших наперебой свои рецепты спасения. «Это было время, — отмечал Ф.Энгельс, — когда даже в Риме и Греции, а ещё гораздо более в Малой Азии, Сирии и Египте абсолютно некритическая смесь грубейших суеверий самых различных народов безоговорочно принималась на веру и дополнялась благочестивым обманом и прямым шарлатанством; время, когда первостепенную роль играли чудеса, экстазы, видения, заклинания духов, прорицания будущего, алхимия, каббала и прочая мистическая колдовская чепуха».
Александрию наводнили алхимические «откровения», авторство которых приписывалось и богам, и пророкам, и царям, и философам. Назывались Клеопатра Египетская, бог Озирис, иудейский пророк Моисей, философ Демокрит и «трижды величайший» Гермес.
Чаще всего представление о тайных знаниях связывалось именно с Гермесом. По всей вероятности, это был обожествлённый египетский жрец, названный именем греческого бога, покровителя Александрии.
В IV в. уже н. э. широкую известность приобрело сочинение некоего Зосимы из Панополиса. В 28 книгах этого энциклопедического труда даётся, в частности, исторический обзор священного искусства, которое, как считает автор, имеет неземное происхождение. Падшие ангелы сходились с дочерьми человеческими и в награду за любовь сообщали им приёмы этого искусства. Кстати, Зосима по-своему объясняет слово «химия». Он связывает его с именем пророка Хема, написавшего якобы первую книгу о «секретах» превращения металлов. Зосима утверждает, что сестра иудейского пророка Моисея Мария умела из четырёх металлов получить чудодейственное соединение — «яйцо философов», с помощью которого можно производить любые превращения. Имя Марии после этого стало чрезвычайно популярным, ей приписывали изобретение ряда химических приборов. А во Франции ещё совсем недавно водяную баню называли баней Марии.
После того как Египет вошёл в состав новой могущественной империи — Римской и особенно после возвышения христианства, для александрийских учёных наступили трудные времена. В конце III в. н. э. император Диоклетиан жестоко подавил восстание египтян и заодно приказал сжечь древние книги, видя в них опасного врага римскому владычеству. Он искренне верил, что в книгах содержатся доступные только египтянам достоверные сведения о том, как можно изготовлять золото в неограниченном количестве. Разбогатев таким путём, Египет мог бы стать сильнее Рима…
В 325 г. н. э. по приказу императора Феодосия I был разрушен храм Сераписа, а через пять лет погибла в огне знаменитая Александрийская библиотека. В 415 г. толпа фанатиков-христиан, науськанная патриархом Кириллом, зверски расправилась с александрийскими учёными. Ещё через несколько лет император Юстиниан запретил какие бы то ни было химические занятия, объявив их богопротивным делом.
Итак, химия родилась на Востоке. Там же возникла идея превращения элементов (трансмутации металлов). В своих попытках осуществить её на практике химики пошли по ложному пути, который завёл их в болото мистики и магии. Но по дороге туда они всё-таки успели сделать много полезного. Они, в частности, улучшили процесс выделения золота из золотоносных руд, догадавшись расплавлять их в свинце. Были внесены кое-какие усовершенствования в общую металлургию, в производство керамики, стекла, в крашение тканей. Египетские химики открыли нашатырь, научились извлекать ртуть из киновари и каломели, применять её для нанесения позолоты на предметы (амальгирование)…
Похвалялась синица море поджечь…
Седьмое столетие ознаменовалось возвышением арабов. Они покорили множество народов и создали огромную империю — Халифат, включавший северное и северо-восточное побережье Африки, большую часть Пиренейского полуострова, страны Ближнего и Среднего Востока. Многие центры культуры оказались под их властью.
Отношение арабов к культуре завоёванных государств определялось формулой: «Мудрость мира — заблудшая овца, потерянная верующими; возврати её хотя бы из рук неверующих». И они черпали эту «мудрость» отовсюду — у народов Средней Азии, Закавказья, Персии, Сирии и Египта, развивали её и распространяли по всему миру. Созданный арабами Испанский халифат превратился в своеобразные ворота, через которые усвоенная ими греко-восточная культура хлынула в Европу. Гренадский университет украшала надпись: «Мир держится на четырёх столпах: на учёности мудрого, на справедливости великого, на молитвах праведного и на доблести храброго».
Это арабы к названию науки о веществе и его превращениях добавили приставку «ал», и с тех пор она стала алхимией. Никакого скрытого смысла в этой приставке нет.
Арабская алхимия значительно подняла уровень химических знаний, ввела в практику ремесленного производства много новых веществ, создала и описала методику получения и обработки различных материалов.
Арабская алхимия — это промежуточное звено, связывающее европейскую алхимию с античной химией. Европейские учёные познакомились с идеями греческих мудрецов, в том числе Аристотеля, сначала по сочинениям арабов и лишь потом стали переводить подлинники.
Одним из виднейших арабских учёных был уже упоминавшийся здесь Джабир ибн Гайян, известный в европейской литературе под именем Гебера. Он имел такую громкую славу, что многие жившие после него европейцы свои сочинения подписывали его именем, полагая, что авторитет знаменитого учёного не позволит сомневаться в их истинности.
Гебер писал, что любое предположение может быть принято только тогда, когда будет подтверждено точным доказательством. Главное в химии, наставлял он, — заниматься практической работой и производить опыты, ибо без этого нельзя достичь успеха. Гебер подробно описал все приёмы, которыми пользовался тогда химик-исследователь: кристаллизацию, возгонку, растворение, обжиг и другие операции. Азотная кислота, играющая в современной промышленности огромную роль, впервые была получена этим учёным и детально описана в его книге «Ящик мудрости».
Как же относился этот учёный к идее превращения металлов? «Нам, — писал он, — невозможно превратить металлы один в другой, как невозможно обратить быка в козу, потому что если природа употребляет тысячи лет для приготовления металлов, можем ли мы сделать то же самое, когда мы редко живём более ста лет? Возвышение температуры, которой мы действуем на тела, конечно, может в короткий промежуток времени производить то, для чего природа употребляет года, но это ещё слишком малое преимущество». Однако высказав эту мысль, которую с известной натяжкой можно считать вполне современной, имея в виду радиоактивный распад урана, приводящий к образованию свинца, Гебер добавляет: «Несмотря на все эти препятствия, не нужно терять надежды; многие препятствия более существуют в уме ложных мудрецов, чем в самой природе. Искусство не может подражать природе во всём; но оно может и должно подражать ей в некоторых пределах».
Учеником и последователем Гебера считается багдадский алхимик Аль-Рази — европейцы называли его Разесом. Он автор более 200 естественнонаучных, медицинских и философских трудов. Наибольшую известность доставила ему «Книга объемлющая» — обширный свод по практической медицине. Аль-Рази пересмотрел учение Аристотеля о первоначалах, так как, по его мнению, оно с трудом связывается с наглядными представлениями о свойствах металлов. Металлы, по Аль-Рази, — это сложные вещества, соединение начала металличности (носителем этого начала считалась ртуть) и начала горючести (носитель — сера).
Аль-Рази страстно верил и в трансмутацию металлов. Пожалуй, именно с него стоит начать длинный список жертв, принесённых на алтарь алхимии. Он проводил опыты в присутствии хоросанского князя Аль-Мансура. Опыты не удавались, и князь однажды, рассвирепев, ударил учёного по голове — учёный ослеп.
В Европе широкий интерес к алхимии возник примерно на рубеже XI–XII вв. и вскоре разгорелся большим пожаром. Как всегда бывает при повальных увлечениях чем-то, большинство искателей философского камня к науке не имело почти никакого отношения. Это были дилетанты, слепо верившие, что секрет его получения действительно таится в древних писаниях, но овладеть им может помочь только Бог или на худой конец сатана. Ведь это было время, когда вера в Бога, в чудеса, в существование сверхъестественных сил составляла суть мировоззрения людей. Отсюда тёмный, затуманенный аллегориями и смутными символами язык алхимических рецептов, появлявшихся в изобилии. И те, кто их сочинял, и те, кто ими пытался воспользоваться, не столько работали, сколько молились, гадали, творили заклинания, нередко обращались за помощью к духам, к нечистой силе, а это уж прямая дорога на костёр или виселицу. Церковь искореняла еретиков и колдунов безжалостно, хотя к идеям алхимиков теперь уже не проявляла столь определённого отношения, как это было в первые века. Более того, некоторые церковники не прочь были истолковать в пользу алхимии отдельные места из Святого Писания. Однажды монахи Сен-Назерского монастыря (Франция) получили распоряжение от самого Папы, согласно которому они должны были заняться «поиском тех замечательных веществ, которые превращают неблагородные металлы в благородные». Как ни старались монахи, ничего у них не получилось, конечно; но папа неудачу воспринял как непослушание и наказал — заставил на коленях проделать весь путь от Сен-Назера до Авиньона. По-иному решил проблему пополнения своей казны король Филипп Красивый: он разгромил орден тамплиеров и завладел его сказочными богатствами, накопленными грабежом и другими сомнительными способами. В умение добывать золото с помощью философского камня, которым похвалялись рыцари этого ордена, король не поверил.
И в это же самое время другая часть алхимиков неуклонно прокладывала путь прямому научному эксперименту. Беспорядочно перетирая, смешивая, сжигая, растворяя, перегоняя вещества, подвергая свою жизнь опасности (не раз случалось, что лаборатории взлетали на воздух), алхимики добывали знания, которые подготовили рождение химии как науки. Конечно, всё это они делали ради одной и той же цели — найти способ превращать металлы в золото. Р.Бэкон так определял эту цель: «Алхимия есть непреложная наука, работающая над телами с помощью теории и опыта и стремящаяся путём естественного соединения превращать низшие из них в более высокие и более драгоценные видоизменения. Алхимия научает трансформировать всякий вид металла в другой с помощью специального средства».
На какую же теорию опирались алхимики? В основе своей она мало чем отличалась от той, которую когда-то предложил Аристотель и которую слегка подправили и видоизменили арабы. Главным было прежнее положение, согласно которому золото — самый совершенный металл. В нём природа выразила своё постоянное стремление к идеалу. Другие металлы — просто «недоработка» природы, ей помешали какие-то причины довести дело до конца.
В XIII в. большим авторитетом для алхимиков был Альберт Великий. Как и арабские алхимики, он учил, что металлы — это соединения из ртути и серы, т. е. состоят из тех же абстрактных начал металличности и горючести. Но поскольку эти два начала не передают полностью свойств металлов, то, по мнению Альберта Великого, в состав металлов должны входить ещё вода и мышьяк. О превращении металлов друг в друга можно судить по изменению цвета: ртуть окрашивает металл в белый цвет, сера — в красный, мышьяк — в жёлтый. Присутствие воды в металле придаёт ему плотность.
Прозвище «Великий» этот бывший профессор богословия в Кёльне и Париже, а также бывший епископ Регенсбургский заслужил своими многочисленными сочинениями и большими познаниями в науках. Отказавшись от духовной карьеры и сняв с себя высокий сан епископа, он поселился в монастыре и провёл множество опытов, которые описал в своих естественнонаучных трактатах. Конечно, наивно было бы ожидать, чтобы этот богослов, всю жизнь боровшийся против материалистического истолкования идей Аристотеля, стал последовательным естествоиспытателем: в его трактатах наряду с непосредственными наблюдениями немало фантастического в духе библейских легенд.
Многие алхимики считали, что легче всего превратить в золото ртуть — ведь в ней больше всего металличности, т. е. той самой абстрактной ртути, которая была основной составной частью золота. «Я превратил бы море в золото, если бы оно было из ртути!» — убеждённо заявлял алхимик Раймонд Лулл.
Это очень колоритная фигура. Родился Лулл на острове Майорка, рода богатого и знатного. Служил арагонскому королю, промотал всё состояние. В Париже познакомился с Р.Бэконом, узнал об алхимии, что называется, из первых рук и страстно увлёкся ею. Бурная жизнь этого алхимика кончилась тем, что он был побит камнями в Африке, куда судьба забросила его в роли миссионера. Лулл написал много алхимических сочинений, настолько малопонятных, что они стали для более поздних алхимиков примерно тем же, чем для александрийских академиков было священное искусство древнеегипетских жрецов. Сам же Лулл был убеждён: его не понимают потому, что читают не в надлежащем расположении духа и не с чисто философским стремлением к истине, а с преступной жаждой к новизне или с корыстолюбивой целью.
В 1515 г. император Максимилиан I приказал установить, в каком монастыре жил автор сочинений «Триумфальная колесница антимония», «О великом камне древнейших мудрецов», «Раскрытие таинственных приёмов», разошедшихся по Европе в большом количестве рукописных копий. Розыски кончились неудачей: ни в одном из монастырей не было монаха с именем Василий Валентин, которое стояло на заглавных листах этих сочинений. До сих пор никто не может сказать определённо, кто скрывался под этим именем. Вполне возможно, что Василием Валентином (от греческого: могущественный царь) называла себя группа авторов, хорошо знакомых и с медициной, и с практической химией. Сочинения Василия Валентина выгодно отличались от множества других алхимических сочинений обилием по-настоящему естественнонаучных наблюдений, богатством практических сведений и верным во многих случаях — по тем временам, конечно, — их объяснением. Правда, в них было немало того, что роднило с обычной алхимической литературой: мистики, аллегорий и т. д.
Василий Валентин внёс существенные изменения в теорию строения металлов. В них не два, а три начала: ртуть — носительница металличности, сера — основа горючести и соль. Третий составной элемент обусловливает способность металлов образовывать соли при взаимодействии с кислотами. Ни один из этих элементов не имеет ничего общего с реальными веществами — ртутью, серой и солью. Нельзя «принимать за семена металлов обыкновенную серу и обыкновенную ртуть, потому что обыкновенная ртуть, будучи сама металлом, не может быть семенем металлов. Также и обыкновенная сера представляет собой известь (по-современному — оксид). Каким же образом она может быть семенем?»
Учение Василия Валентина о трёх основных началах-элементах вместе с другими алхимическими представлениями вошло в XVI–XVII вв. в натрохимию — науку о применении химических веществ в медицине. Как и алхимию, врачевание с помощью лекарства европейцы восприняли у арабов. От них же пришла в Европу идея специальных лабораторий по изготовлению лекарств — аптек. Лекарства и арабы и европейские врачи изготовляли преимущественно из растений. Минеральное сырьё почти не использовалось.
До XVI в. химия (алхимия) и медицина развивались, мало соприкасаясь друг с другом, хотя и та и другая искали универсальное средство: алхимия — философский камень, медицина — эликсир жизни. Соединил их выдающийся швейцарский врач и химик Теофраст Парацельс (1493–1541). Подлинное имя основателя натрохимии — Филипп Ауреол Теофраст Бомбаст фон Гогенгейм. Парацельсом он назвал себя демонстративно: в переводе на русский язык это слово означает — сверхблагородный, превосходящий Цельса, а Цельс — знаменитый врач, популяризатор и энциклопедически образованный учёный.
Искусство врачевания Парацельс перенял, видимо, от своего отца, тоже врача и алхимика. Жизнь Парацельса полна удивительных приключений. Он объездил всю Европу, побывал даже, как он сам утверждает, в Татарии и Египте, хорошо изучил знахарство и народную медицину, водился с ворожеями, цыганами, чернокнижниками, приглядывался к цирюльникам, которые в то время были не только брадобреями, но и хирургами. Да и сам зарабатывал себе на жизнь ворожбой и астрологией. После долгих странствий вернулся в Базель и сразу же приобрёл репутацию искуснейшего лекаря. Началось стремительное восхождение по социальной и научной лестнице. Не имея никакого специального образования, он стал профессором Базельского университета. Профессорство начал весьма решительно и нагло: публично сжёг сочинения великих врачей прошлого Галена (II в. н. э.) и Авиценны (980-1037) и призвал целиком полагаться на мудрость природы и его, Парацельса, опыт. В действиях Парацельса нетрудно установить родство с поступками другого реформатора — священника Мартина Лютера, который тоже демонстративно сжёг папскую буллу, перевёл Библию на немецкий язык и возглавил антикатолическое движение в Германии.
Через год противники Парацельса, считавшие его выскочкой и неучем, потребовали, чтобы он предъявил диплом врача и доказал своё право занимать профессорскую должность. Но не так-то просто было справиться с человеком, которого поддерживали власть имущие и самоуверенность которого не знала границ. Его письмо в городской совет Базеля составлено как ультиматум: совет должен «приказать его (Парацельса) врагам прекратить нападки на университетского профессора и не препятствовать ему в чтении курса оскорбительными выражениями и низкими обвинениями, которыми осыпают его».
Пока Парацельс воевал со своими врачами-недругами, он оставался несокрушим. Но он так разошёлся, что повздорил однажды с влиятельным сановником. Ссору их разбирал городской суд. Парацельс вёл себя на суде высокомерно и не рассчитал, естественно, своих сил. Над ним сгустились тучи, и ему ничего другого не оставалось, как покинуть Базель, попросту — сбежать. Так было утрачено решительно всё, чего он достиг. После долгих скитаний на чужбине он умер в Зальцбурге нищим, оставив после себя уйму легенд и версию о том, что он не умер, а его убили.
Парацельс рассматривал человеческий организм как химическую лабораторию и провозглашал, что все болезни происходят от недостатка или избытка тех или иных веществ; задача врача, по Парацельсу, в том, чтобы восстановить правильное их соотношение, введя в организм необходимые химические препараты. Химики должны заниматься не превращением металлов в золото, а приготовлением лекарств. А как готовить такие лекарства, из чего исходить? Парацельс утверждал, что все вещества получены соединением трёх начал: ртути, серы и соли, т. е. как учил Василий Валентин.
Во всём другом Парацельс не выходил из круга обычных для алхимии представлений, писал привычным для алхимиков языком. Он утверждал, в частности, что в желудочно-кишечном тракте обитает некий «верховный дух Архей», управляющий жизненными процессами, отделяющий полезное от вредного, противодействующий отравлению, регулирующий пищеварение. Если, говорил Парацельс, заболевает сам Архей, то работа организма нарушается, и тогда соблюдение равновесия между нужными веществами может и не оказать ожидаемого действия.
И совсем не по склонности к хвастовству, а как истый алхимик он уверял, что знает секрет приготовления философского камня и демонстрировал «превращение железа в медь», погружая нож в раствор медного купороса. А в одном из своих сочинений он писал: «Знайте, что все семь металлов рождены из троякой материи, а именно: из Меркурия, Сульфура и Соли, однако они отличаются друг от друга и имеют особую окраску. Таким образом, Гермес сказал вполне правильно, что все семь металлов произведены и смешаны из трёх субстанций; подобным же образом из этих субстанций составлены тинктуры и философский камень…»
Полемика, вызванная Парацельсом, не ослабевала и после его смерти. Но дело своё Парацельс сделал: химия из душных монастырских келий перекочевала в аптеки, которые до этого времени представляли собой не более чем склады различных кореньев и вытяжек. Её стали изучать на медицинских факультетах университетов. Долгое время основным учебным пособием служил обширный курс, составленный натрохимиком Андреасом Либавием. Этот труд, названный «Алхимией», Либавий написал в значительной части на основе собственных наблюдений и исследований. Он дал развёрнутые характеристики известным к тому времени веществам, привёл способы их получения, рецепты приготовления различных лекарственных смесей. Предложил даже проспект химической лаборатории, иллюстрированный чертежами, сопровождаемый сведениями о химической посуде, аппаратуре, нагревательных приборах. Как и следовало ожидать, трансмутацию металлов этот учёный считал реальным процессом. В частности, именно этим он объяснял осаждение меди из раствора на железных предметах.
Современник Либавия Ван-Гельмонт был широко образованным и талантливым учёным-натрохимиком. Располагая средствами, он большинство своих исследований провёл в собственной домашней лаборатории. В своих сочинениях он, может быть, впервые подверг сомнению положение Аристотеля о четырёх элементах-качествах. Аргумент при этом, правда, нельзя считать достаточно веским: Аристотель-де не был христианином, а потому его утверждения не могут быть достоверными и убедительными.
Не могут, считал Ван-Гельмонт, быть истинными составными частями всех тел и элементы алхимиков — ртуть, сера и соль, ибо их присутствие в телах доказать нельзя. Главной составной частью всех тел, по утверждению этого учёного, является… вода. К такому выводу привёл его ставший хрестоматийным знаменитый опыт с пятилетним выращиванием ивы в цветочном горшке. Дерево, в течение этого времени ничего не получавшее, кроме воды, дало (с учётом опавших листьев и веса земли) привес более 164 фунтов.
Исследования Ван-Гельмонта положили начало развитию химии газов, и его можно считать родоначальником пневматической химии. И сам термин «газ» введён этим учёным. Довольно подробные сведения дал Ван-Гельмонт об углекислом газе, который он назвал «лесным духом» (или лесным газом).
Ван-Гельмонт высказал весьма важное положение о том, что элемент («первоначальная материя»), даже подвергнутый химическим превращениям, в известном смысле сохраняет свою индивидуальность во вновь образованном продукте. Он показал, что серебро после растворения в азотной кислоте содержится в растворе и может быть оттуда выделено в виде рогового (хлористого) серебра, из которого можно получить и металлическое серебро. Проводя параллель, Ван-Гельмонт пришёл к заключению, что известный всем пример с появлением меди на железе никак нельзя считать подтверждением превращения металлов. Просто медь выделяется из раствора и осаждается на железе.
Правда, в этом Ван-Гельмонт не был первым. До него о том же говорил, например, Анджело Сала, но авторитет Ван-Гельмонта как экспериментатора был настолько высок, что пальма первенства в опровержении одного из стойких заблуждений алхимиков досталась ему. Это никак не означает, что Ван-Гельмонт вообще противник алхимии. Совсем наоборот. В идею трансмутации он верил безоговорочно и даже описал опыт, в результате которого ему удалось якобы превратить ртуть в золото и серебро с помощью ничтожного количества философского камня. Однако Ван-Гельмонт ни словом не обмолвился, как досталось ему это чудодейственное вещество — заветная мечта алхимиков.
Заветная, недостижимая и ложная… Ну а если «очистить» эту мечту от религиозно-мистической шелухи и, конечно, оставить без внимания хвастливое заявление Раймонда Лулла, напоминающее угрозу сказочной синицы море поджечь, то что останется?
Мир — это стихии плюс движение. Так учили древние. Тут между ними не было несогласия. Несогласие проявилось в понимании стихий. Стихии непрерывны, говорили одни (от Фалеса до Аристотеля). Нет, стихии прерывны, доказывали другие (от Левкиппа до Лукреция — о них у нас ещё будет разговор). Ну а раз стихии непрерывны, то что им мешает переходить друг в друга? Аристотель сказал: ничто. Алхимики были с ним согласны: опыт и интуиция подсказывали им, что мир един. Они не знали только законов развития этого единого мира и не умели их познавать. Путь, которым они шли, был ошибочен, но они ошибались по незнанию.
И ещё потому, что они взялись за дело раньше времени.
Алхимики в течение ряда веков топтались на месте. К шести металлам, которые были известны с давних пор, они прибавили всего пять новых «элементов» — мышьяк, сурьму, висмут, цинк, фосфор. Число химических соединений благодаря их стараниям увеличилось раз в десять. Было разработано простейшее оборудование. Вот, пожалуй, и всё, чего они достигли. За то же время астрономия и физика достигли неизмеримо большего. Но случаен ли тот факт, что и Лейбниц, и тем более Ньютон, так много сделавшие для научного познания мира, были алхимиками? Отнюдь нет. Механические формы движения материи наглядны, вот они — на виду, а химические скрыты за семью печатями. Простейшее лабораторное оборудование позволяло алхимику соединять одни вещества с другими, но совершенно не давало возможности «заглянуть» внутрь химических превращений. Он работал вслепую, методом «проб и ошибок», но работал, сам того не подозревая, ради накопления знаний.
Вот что останется, если трезво взглянуть на то, чем занимались алхимики более тысячи лет в Европе и более двух тысяч лет на Востоке.
Дракону подрезают крылья
Дракон — распространённый символ алхимии. Той самой, для которой философский камень был и целью, и средством. Но под влиянием растущих общественных потребностей (развития металлургии, ткачества, военного и строительного дела, роста городов с их ремесленным производством) алхимия, не отказываясь от этой цели, стала постепенно расширять круг своих интересов. В её недрах формировалось направление, представителей которого в исторической науке принято называть химиками-технологами. Ещё Р.Бэкон разделял алхимию на теоретическую и практическую. Натрохимики были в известном смысле первыми, кто повернул алхимию лицом к нуждам общества. Больше всего, однако, для развития этого направления сделали Бирингуччо, Агрикола, Палисси и другие химики-практики.
В десяти книгах огромного труда «Пиротехния», составленного Ваноччо Бирингуччо и вышедшего в свет в 1540 г., рассказывается о добыче и свойствах руд, купоросов, серы, поваренной соли, на уровне практических знаний того времени приводятся сведения о добыче и очистке золота, описывается литейное дело, обработка металлов, производство стекла, изготовление фейерверков и многое другое. Любопытно, что Бирингуччо приводит наблюдение, которое было научно объяснено только два столетия спустя — в результате рождения, развития и смерти теории флогистона. Речь идёт об увеличении веса металлов при их прокаливании.
Саксонца Георгия Агриколу называют «отцом металлургии». Он был современником Бирингуччо и в некотором роде его последователем. По образованию — врач, по призванию — учёный, оставивший заметный след в минералогии, горном деле и металлургии.
В молодости Агрикола сполна отдал дань «золотоискательским» увлечениям. Да и потом не отказывался от самой идеи, но со всей определённостью химика-практика отвергал схоластику, невежество и хвастовство, которыми эта идея густо обросла. Он писал: «…хотя повсюду имелось и имеется так много этих химиков (алхимиков), и все они денно и нощно напрягают свои силы, чтобы получить возможность накопить великие груды золота и серебра, утверждения эти, естественно, вызывают сомнения… ибо если бы они действительно усвоили таковые, то… давно наполнились бы города золотом и серебром. Их суесловие изобличают также книги, которые они подписывают именами Платона, Аристотеля и других философов, чтобы эти славные имена в заголовках их книг придавали последним в глазах простых людей видимость учёности».
Главный труд Агриколы «12 книг о металлах», любовно изданный, превосходно иллюстрированный, пользовался широкой популярностью, был в сущности своеобразной энциклопедией для металлургов в течение долгого времени.
Ещё определённее выразил своё отношение к алхимии Бернар Палисси, с именем которого связано раскрытие секрета технологии фаянса и цветных глазурей. Он был против каких бы то ни было умозрительных спекуляций и признавал только опыт и наблюдение. «Я не имел иной книги, кроме неба и земли, которая известна каждому, и каждый может узнать и прочесть эту прекрасную книгу».
У алхимии всегда были скептически настроенные противники, но отношение к ней и Агриколы, и тем более Палисси — это уже тенденция, наметившаяся в XVI в. и окрепшая в следующем столетии, что, как уже говорилось, отнюдь не означает полного исчезновения приверженцев алхимических воззрений.
Всё более и более становились смешными в глазах современников поиски философского камня, язык и символика алхимических сочинений, но время коренного пересмотра идеи трансмутации ещё не пришло.
Провозвестником нового понимания задач науки выступил английский философ-материалист и государственный деятель Фрэнсис Бэкон. Целью науки, считал он, является увеличение власти человека над природой путём достижения истинных причин явлений, т. е. как раз тем путём, который был неведом алхимикам. Не дедукция, которая позволяла учёному строить свою систему из собственных же понятий, как паук ткёт паутину, а индукция, основанная на аналитическом понимании эксперимента, — вот истинный метод познания природы.
Лондонское Королевское общество, основателями которого были такие учёные, как Роберт Гук, Роберт Бойль и Исаак Ньютон, своим девизом избрало стих римского поэта Горация: «Я не буду следовать рабски словам учителя».
«Химики, — писал Роберт Бойль, — до сих пор руководствовались чересчур узкими принципами, не требовавшими особенно широкого умственного кругозора; они усматривали свою задачу в приготовлении лекарств, в извлечении и приготовлении металлов. Я смотрю на химию с совершенно другой точки зрения; я смотрю на неё не как врач, не как алхимик, а как должен смотреть на неё философ. Если бы люди принимали успехи истинной науки ближе к сердцу, нежели свои личные интересы, тогда можно было бы легко доказать им, что они оказывали бы миру величайшие услуги, если бы посвятили все свои силы производству опытов, собиранию наблюдений и не устанавливали бы никаких теорий, не проверивши предварительно их справедливости путём опытным».
Важнейшим печатным трудом Бойля была его книга, названием которой он выражал поставленную перед наукой задачу — «Скептический химик».
Заслуги Бойля в развитии науки огромны, и некоторые историки охарактеризовали его как основателя современной химии. «Я привык рассматривать мнения, как монеты… — признавался Бойль, — я обращаю гораздо меньше внимания на имеющуюся на ней надпись, чем на то, из какого металла она сделана… Если после тщательного исследования я нахожу, что она хороша, то тот факт, что она долгое время и многими принималась не за настоящую, не заставит меня отвергнуть её. Если же я нахожу, что она фальшивая, то ни изображение и подпись монарха, ни возраст её, ни число рук, через которые она прошла, не заставят меня принять её…»
«Скептический химик» имел знаменательный подзаголовок: «Химико-физические сомнения и парадоксы, касающиеся основных положений, выставляемых большинством алхимиков». Бойля не удовлетворили ни аристотелевские начала-стихии, ни первоначала алхимиков. Элементов гораздо больше, и они не продукты, созданные умозрительно, не таинственные, а чисто материальные вещества, тела, которые не могут быть химическим анализом разложены на более простые. Сколько их? Это надо установить экспериментальным путём. Каковы они? Это тоже будет выяснено опытом, когда то или иное тело будет разложено до конца и полученные продукты изучены.
Подобные мысли высказал до Бойля гамбургский ученый Иохим Юнгиус, но он дальше рассуждений не пошёл и ничего не предпринял для нахождения первичных элементов. Бойль же, можно сказать, раскрепостил химию, вывел её за рамки трёх-четырёх первоначал. В «Диалектике природы» Ф.Энгельса значение работ английского учёного охарактеризовано следующими словами: «Бойль делает из химии науку».
Чтобы объяснить, как химические элементы образуют сложные тела, Бойль обратился к атомистике древних.
И вот тут нам пришло время вернуться к спору, который вели между собой греческие мудрецы о непрерывности и прерывности стихий.
Сторонники прерывности Левкипп (ок. 500–440 гг. до н. э.), Демокрит (ок. 460–370 гг. до н. э.), Эпикур (341–270 гг. до н. э.) утверждали, что материя состоит из отдельных, невидимых, неощутимых и более неделимых частичек — атомов. Справедливости ради следует сказать, что мысли на этот счёт были высказаны ещё раньше древнеиндийскими философами, творцами философских систем ньяя и вайшешика, но именно греки придали этим намёткам атомистики форму учения о дискретном строении веществ.
По мнению Демокрита (и его учителя Левкиппа), вокруг нас — пустота, в ней движутся атомы. Сталкиваясь между собой, атомы образуют «все… сложные (тела) и наши тела, и их состояния и ощущения». Атомы могут соединяться по-разному в зависимости от своей формы и расположения в пространстве. Форма же атомов в основном определяет свойства образующихся веществ и их взаимодействие между собой.
Эпикур развил и дополнил взгляды своих великих предшественников. Важно отметить два основных положения Эпикура. Первое. Он считал, что атомы движутся в пустоте не «вообще» — для них возможны три вида движения: в результате столкновений, под действием силы тяжести и самопроизвольного (спонтанного) отклонения от прямолинейного движения. Это положение Эпикура расширяет возможность столкновений, т. е. взаимодействий атомов и, стало быть, точнее обусловливает многообразие веществ и их свойств. Второе. Эпикур ввёл такую важную физическую характеристику атома, как его вес (масса). Правда, нам тут же следует оговориться: масса атома, придуманная Эпикуром (именно придуманная, потому что, как и античное учение об элементах-стихиях, античная атомистика была в основном плодом умозрительных размышлений), — это совсем не та масса, которая экспериментально установлена и математически рассчитана современной физикой.
Атомистика древних греков по самому духу своему была материалистична и атеистична. Она отрицала власть богов над миром, признавала вечными материю и движение. Как говорил Гегель, «естествознание в атомистике впервые чувствует себя освобождённым от необходимости указать основание существования мира». Не случайно атомистика оказалась одним из неприемлемых и гонимых учений. И не случайно же, по-видимому, сочинения древних атомистов не дошли до нас полностью. Так, например, о взглядах Эпикура мы узнали главным образом благодаря великому просветителю, поэту и философу Рима Лукрецию Кару (ок. 99–55 гг. до н. э.) и его поэме «О природе вещей». Атомистику преследовали и в эпоху эллинизма, когда начали процветать идеалистические философские школы, её искореняли и в средние века, когда воцарилось христианство и за приверженность к атомистике можно было легко угодить на костёр, как Джордано Бруно.
Но никогда атомистическое учение не исчезало из поля зрения естествоиспытателей. В средние века оно лишь на время отступило, оттеснённое учением Аристотеля. Учение Аристотеля было сильнее не только потому, что его поддерживала всесильная церковь, но и потому ещё, что оно было более «наглядным». Видел кто-нибудь атом? Никто! Да и невозможно было понять, как это из невидимых, неосязаемых частичек могут образовываться вещества, которые различаются цветом, запахом, плотностью и многим другим. А стихии-элементы объясняли это просто и доступно, потому что каждая стихия уже несла в себе свойство.
И вот теперь Бойль, вслед за Ф.Бэконом и П.Гассенди, обратился к атомистике и предпринял первую попытку на её основе объяснить понятие «элемент». Элементами Бойль назвал «корпускулы первого рода» (с оговоркой можно соотнести с современным определением молекулы), которые сами состоят из более мелких частиц материи (им Бойль названия не дал, но совершенно очевидно, что это атомы). Все химические превращения Бойль объяснял соединением и разъединением корпускул-элементов (по какой причине — не ясно!), каждая из которых «может быть выделена в первоначальном виде». Такими «первоначальными» элементами для него были известные к тому времени металлы, в первую очередь, конечно, золото и серебро. О существовании других элементов он ничего определённого сказать не мог — его время ещё не располагало необходимым для такого вывода теоретическим и экспериментальным материалом. Ещё не было объективных оценок веществ с точки зрения их химической простоты или сложности. Да и самому Бойлю не дано было полностью освободиться от груза традиции. Его можно сравнить с человеком, вступившим на первую, самую нижнюю ступень крутой лестницы. Куда она приведёт — неизвестно, а вот на каком она основании покоится — видно хорошо. Основание — алхимическое представление об универсальной материи, из которой состоят все тела, и вытекающее из этого представления убеждение, что «один вид металла может быть превращён в другой».
Сторонники идеи трансмутации металлов могли быть спокойны: их возлюбленной идее возрождение атомистики пока ничем не угрожало. И Бойль, и его великий современник Ньютон, принявший участие в разработке корпускулярной теории, ставили под сомнение не идею, а её «вульгарное» обоснование. Они сделали первый, но достаточно большой шаг к очищению химии и от алхимической зауми, и от алхимических чудес.
XVII в. — это век торжествующей механики. Она бралась объяснять решительно всё — от движения планет до взаимодействия корпускул. «Части всех однородных твёрдых тел, вполне прикасающиеся друг к другу, сцепляются очень сильно вместе, — пишет в своей работе «Оптика» Ньютон. — Для объяснения этого некоторые изобрели атомы с крючками… другие — что частицы связаны согласованными движениями, т. е. относительным покоем между ними. Я бы, скорее, заключил из сцепления частиц о том, что они притягивают одна другую с некоторой силой, которая очень велика при непосредственном соприкосновении и производит на малых расстояниях вышеупомянутые химические действия…»
Рождение и смерть флогистона
Человек давно связал свою судьбу с огнём. Настолько тесно, что с точки зрения взаимоотношений человека и огня можно посмотреть даже на всю историю земной цивилизации. Огонь — это тепло в жилище. Это переход со звериного на человеческий способ питания. Это замена дубины и камня орудиями труда из металла…
Роль огня становилась всё значительнее и всё разнообразнее, а сам он долгое время оставался таинственным и непознанным. До поры до времени это не очень беспокоило, хотя, конечно, о его природе задумывались всегда.
Рост промышленности и металлургического производства, особенно заметный, как уже отмечалось, с XVI–XVII вв., понуждал заняться этим вплотную. Надо было понять, почему, к примеру, так много теряется металла на окалину; почему вес его увеличивается при нагревании. И вообще, что такое горение?
История открытия химических элементов и создания научной теории горения богата фактами, подтверждающими одну парадоксальную мысль, высказанную современным учёным Джоном Берналом: сделать открытие проще, чем понять, что оно сделано.
Вот кислород. Этот элемент вполне мог появиться уже в VIII в. Сведения о нём — косвенные, разумеется, — есть в трактате китайского алхимика Мао Хао. Китайцы знали «деятельное начало», входящее в состав воздуха, и называли его «йын». В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом они снова теряются — до XVII в., когда голландец Дребелль изобретает подводную лодку и очень скоро убеждается, что обычного воздуха для дыхания в ней хватает ненадолго. И он использует селитру, чтобы её кислородом обогатить воздух в подводной лодке. Но этот факт остался незамеченным.
Или возьмём хлор. Трудно поверить, чтобы алхимики с ним ни разу не сталкивались, прокаливая поваренную соль с медным купоросом и квасцами. Алхимикам было не до него. Золото — вот что их интересовало. Да и как поймать и исследовать то, что поймать невозможно: формы оно не имеет и обладает «летучестью»? Первым, кто обратил внимание на эти «летучие» вещества, был знакомый нам Ван-Гельмонт, давший «летучим веществам» название — газы. Однако Ван-Гельмонт тут же предупреждает: газы «нельзя собрать ни в какой сосуд и нельзя сделать видимым телом».
Вряд ли был на свете такой алхимик, который не знал бы, что для горения нужен обычный воздух и что обжиг металла (тогда это называлось кальцинацией) сродни сгоранию дров в камине. Но за разъяснением этих явлений в силу традиции обращались к аристотелевым первоэлементам и к своим алхимическим принципам. Горение представлялось распадом вещества с выделением воздуха. Стало быть, кальцинация — это тоже распад металла.
В XVII в. эта точка зрения стала подвергаться сомнению. В 1673 г. Р.Бойль опубликовал работу «Новые эксперименты о том, как сделать огонь и пламя стойкими и весомыми». В ней он приходит к выводу, что увеличение веса металлов при прокаливании происходит в результате прилипания к нему «огненной материи», которую выделяет горящий уголь.
Чуть раньше, в 1665 г., соотечественник Бойля — Роберт Гук, начинавший у него ассистентом свою научную карьеру, в сочинении «Микрография» предложил, не называя кислорода, иную теорию горения. В воздухе, по мнению Гука, находится вещество, которое в связанном состоянии содержится в селитре (вспомним Дребелля!). Это вещество при высокой температуре растворяет горючие материалы и получается огонь.
И совсем уже незадолго до выхода книги Бойля ещё один его соотечественник, Джон Майов, выпустил на латинском языке трактат «О селитре и воздушном спирте селитры», в котором растворитель Гука был назван «воздушным спиртом». Горение, считал Майов, — это соединение «серных частиц» (дань алхимическому началу сере) с «воздушными огненными частицами»; они-то и увеличивают вес металла при кальцинации. Свою точку зрения Майов доказал опытами, которые стали хрестоматийными. Он погружал в воду стеклянный колокол и зажигал под ним серу, «воздушные огненные частицы» выгорали, общий объем воздуха под колоколом становился меньше, вода поднималась, а горение прекращалось. Если под колокол поместить мышь, горение прекратится еще раньше. Вывод: «воздушные частицы» одинаково нужны и для горения, и для дыхания.
Майов был не только химик, но и врач. И как врач высказал мысли, поразительные для того времени. «Воздушный спирт», считал он, поглощается лёгкими и кровью человека, при этом выделяется тепло, а кровь меняет цвет: тёмная венозная становится ярко-красной артериальной.
И всё-таки первая общая теория горения возникла на основе старых представлений о горении как о процессе, в котором происходит распад, а не соединение веществ. Её творцом был немецкий врач и химик Георг Эрнст Шталь (1660–1734), профессор Йенского университета. В разработке теории он опирался на учение своего предшественника И.И.Бехера о трёх землях и воде — «составных частях всех смешанных тел». Связь этого учения с алхимическими (натрохимическими) воззрениями несомненна. Есть, однако, и существенное отличие. Земля и вода Бехера — материальны, в то время как алхимики, следуя за Аристотелем, обозначали подобными понятиями абстрагированные стихии-качества. Первая земля, по Бехеру, сообщает смешанным телам «телесность, субстанцию и сущность»; вторая придаёт им «консистенцию, цвет, вкус», а третья — «форму, проницаемость, запах, блеск, свечение и т. д.».
Шталь, придерживаясь бехеровской классификации составных частей смешанных тел, вторую землю назвал флогистоном (от греческого флогистос — огонь, воспламеняющийся). Флогистон, по Шталю, — «горючая субстанция, или способное производить огонь начало, — не только нечто действительное, но и нечто телесное». Когда вещество горит, горючая субстанция «улетучивается», оставляя после себя дефлогистированную массу, а пламя — вихреобразное движение этой субстанции в воздухе.
Флогистонная теория сыграла двоякую роль. С одной стороны, она сблизила и объединила окончательно типичные процессы горения с явлениями, наблюдавшимися при обжиге и кальцинировании (окислении) металлов. А с другой, она же стимулировала поиск подлинно научных объяснений этих явлений.
И раньше не раз бывало, что исходные неверные, ненаучные воззрения приводили к открытиям естественнонаучного характера. Флогистон наиболее разительный в этом смысле пример. Химия, по оценке Ф.Энгельса, «…освободилась от алхимии посредством флогистонной теории». Стремясь поймать эту неуловимую «телесную субстанцию» и тем самым доказать справедливость теории, её сторонники успешно рыли ей могилу. На это ушёл почти весь XVIII в.
Трудности у теории начались сразу же. Как же так: если флогистон — это улетучивающаяся «телесная субстанция», то почему вес металла при обжиге не уменьшается, а увеличивается? Флогистон не имеет веса, отвечали сторонники теории. «Телесная субстанция» не имеет веса? — удивились скептики. У неё «отрицательный» вес — нашёлся ученик Шталя Иоганн Юнкер. Хотя никто никогда не видел материальных веществ с отрицательным весом, тем не менее флогистонную теорию признали многие крупные учёные. Более того, изобретались наглядные представления об отрицательном весе флогистона. Француз Гитон де Морво писал: «Приведём в равновесие на весах под водой два свинцовых шара приблизительно одного веса; затем к одной чашке весов подвесим кусок пробки… тогда эта чашка со свинцовым шаром поднимется вверх… несмотря на то, что вес её, очевидно, увеличился. Подобное же происходит при горении, только здесь взвешивание происходит в воздухе…»
Российский академик Михайло Ломоносов в 1756 г. обжигал металлы в запаянной колбе, сравнивал её вес до обжига и после него, и эти опыты убедили его в том, что «славного Роберта Бойля мнение ложно…», потому что вес колбы не изменялся. Он менялся только при обжиге на открытом воздухе. Стало быть, никакой «огненной материи», прилипающей к металлу, нет. А ещё раньше, в 1744 г., в диссертации «Размышления о причине теплоты и холода» Ломоносов высмеял «огненную материю», которая то входит в поры тел, «как бы привлекаемая каким-то приворотным зельем», то бурно покидает их, «как бы объятая ужасом».
Теплоту Ломоносов понимал как движение материальных частиц и впервые отчётливо показал, из чего состоят окружающие нас тела. По его мнению, тела состоят из «первичных корпускул», которые в свою очередь «есть собрание элементов…» А «элемент есть часть тела, не состоящая из каких-либо других меньших и отличающихся от него тел».
Относительно флогистона Ломоносов придерживался мнения, что он существует и представляет собой «горючий воздух», «горючий пар», выделяющийся «при растворении какого-либо неблагородного металла, особенно железа, в кислотных спиртах…» Мы знаем теперь, что «горючий пар», выделяющийся при этих реакциях, — это водород.
Судьбу флогистонной теории решили многочисленные экспериментальные данные, накопленные к концу XVIII в. Окончательный приговор ей вынес француз Антуан Лоран Лавуазье (1743–1794).
Правда, дело обстоит гораздо сложнее, чем кажется на первый взгляд. Существует мнение, что Лавуазье ничего сам не сделал, а лишь присвоил себе чужие открытия, прежде всего шведа Шееле и англичанина Пристли, открывших кислород. Как в этом разобраться?
Карл Вильгельм Шееле (1742–1786) даже среди сторонников Шталя выделялся своей ортодоксальностью, но он был прирождённый экспериментатор. За свою короткую жизнь на простейшем оборудовании, преодолевая отчаянную нужду и болезнь, успел сделать невероятно много. Открыл хлор и марганец, занимался исследованиями сероводорода, фосфора, синтезировал винную, лимонную, щавелевую и другие кислоты, глицерин и эфиры…
В 1768 г. он приступил к исследованиям, которые привели к открытию газа, поддерживающего горение («огненного воздуха»), но опубликовал свои результаты лишь через семь лет в «Химическом трактате о воздухе и огне». А ещё через два года издал книгу. И Пристли, и Лавуазье к этому времени уже опубликовали результаты своих исследований.
Джозеф Пристли (1733–1804) — священник, что не мешало ему быть материалистом и радикалом — он бурно приветствовал Великую французскую революцию. Химиком был по призванию — никакого специального химического образования не имел. Тем не менее именно ему удалось усовершенствовать пневматическую ванну Гейлса, что позволило собирать и анализировать вещества, до этого считавшиеся неуловимыми, т. е. газы. 1 августа 1774 г., нагревая красную окись ртути с помощью линзы, он получил газ, который напоминал обычный воздух: в нём хорошо горела свеча — даже ещё ярче, а тлеющая лучина вспыхивала. Пристли был, как и Шееле, предан флогистону, поэтому открытый газ назвал «дефлогистированным воздухом». Он и умер с мыслью опровергнуть «новую химию» Лавуазье и защитить «превосходную теорию флогистона».
Первые выступления Лавуазье против флогистона (впрочем, без конкретного его упоминания) относятся к 1772 г., когда он представил Французской академии описание опытов по сжиганию фосфора и серы. Вывод тогда он предлагал такой: при горении воздух вступает в соединение с горящим материалом. Через два года горением он стал заниматься ещё более интенсивно и пришёл к твёрдому убеждению, что «первоэлемент» воздух — не простое тело, а смесь газов. Одна часть этих газов нужна для горения, другая — нет. В 1783 г. Лавуазье счёл, видимо, себя вполне подготовленным, чтобы открыто выступить против флогистона. Он издаёт мемуар: «Размышления о флогистоне, являющиеся продолжением теории горения и кальцинации, опубликованной в 1777 году». «Настало время, — решительно говорит Лавуазье, — когда я должен объясниться более чётко и формально по поводу мнения, которое я считаю пагубным заблуждением в химии, задержавшим, как я полагаю, значительным образом прогресс, вводя дурную манеру философствования».
Флогистон Шталя — воображаемое вещество, твёрдо заявляет Лавуазье. Все явления горения проще и яснее объясняются без него, чем с ним.
Ф.Энгельс назвал кислород элементом, «…которому суждено было ниспровергнуть все флогистонные воззрения и революционизировать химию…» И главную роль в этой революции Энгельс отвёл Лавуазье, который открыл, что «…новая разновидность воздуха была вполне новым химическим элементом, что при горении не таинственный флогистон выделяется из горящего тела, а этот новый элемент соединяется с телом, и таким образом, он впервые поставил на ноги всю химию, которая в своей флогистонной форме стояла на голове. И если даже Лавуазье и не дал описания кислорода, как он утверждает впоследствии, одновременно с другими и независимо от них, то всё же по существу дела открыл кислород он, а не те двое, которые только описали его, даже не догадываясь о том, что именно они описывали».
Первым на сторону Лавуазье стал его соотечественник Клод Бертолле, затем Антуан Фуркруа и Гитон де Морво. Спустя некоторое время энергичным сторонником «новой химии» оказался англичанин Джозеф Блэк. Подавляющее же большинство химиков продолжало стоять на флогистонных позициях.
В 1786–1787 гг. Лавуазье совместно с обращёнными в свою веру Фуркруа и Гитоном де Морво разработал «Химическую номенклатуру». Старые воззрения тяжким грузом ещё висели на ногах новой химии: в «Химической номенклатуре» Лавуазье и его коллег наряду с действительно «простыми телами» (элементами) можно найти и «невесомые флюиды» — свет и теплоту…
И снова таинственный атом
Полная картина влияния состава веществ на их свойства прояснится, писал М.Ломоносов, «не раньше, чем будет определено число химических элементов и будет точно изучена химическая природа их». Пока же, как мы видим у Лавуазье, в ряду химических элементов значатся свет и тепло. Было немало и других флюидов, среди них, в частности, пользовались полным признанием носители магнитных и электрических явлений.
Словом, алхимические воззрения не сдавали без боя своих позиций. Правда, о том, что составляло главную страсть алхимиков в прошлом — о золоте, в научной среде теперь говорить было не принято, это считалось дурным тоном, поскольку такое занятие полностью ассоциировалось с шарлатанством. И вот именно в такой обстановке известный учёный, член Лондонского Королевского общества Джемс Прис печатает вдруг отчёт об экспериментах, в которых ему якобы удались превращения металлов. Ему тотчас предложили выступить на заседании общества. Он отговаривался, ссылался на то, что весь запас философского камня уже израсходован — ничего не помогло, пришлось выступать. Конечно, ничего вразумительного показать членам общества Прис не смог.
Отвергнутый всем научным миром, заклеймённый его презрением, Прис отравился.
В 1800 г. учёные с изумлением, а обыватели с недоверием узнали о таком пророчестве профессора Гитанера: «В XIX веке превращение одних металлов в другие будет осуществлено. Каждый химик будет уметь изготовлять золото. Кухонная посуда будет изготовлена из золота и серебра. Это будет в значительной степени иметь своим результатом то, что мы будем ограждены от многих заболеваний и что наша жизнь будет продлена…»
Вторая половина XVIII — первая половина XIX в. ознаменовались открытием ряда элементов, о существовании которых ранее ничего не знали: кобальт, никель, платина, марганец, молибден, вольфрам, бериллий, титан, хром, калий, натрий, кальций, магний, барий, стронций, кадмий, торий, цезий… Шквал открытий! Бурно развивалось химическое производство, нарастало вполне понятное желание учёных всё многообразие свойств веществ и химических процессов объяснить с позиций единой теории.
Как ни странно, впечатляющие достижения практической химии не только не гасили надежду на достижение пророчества Гитанера, а скорее, подогревали её.
Герметические философы (так называли себя сторонники идеи превращения в золото неблагородных металлов) чурались старого алхимического хлама вроде магии и астрологии и в своих доказательствах опирались на данные современной науки. Они пытались убедить всех, что великие алхимики прошлого действительно умели получать золото из неблагородных металлов, только их секреты, к сожалению, утрачены. Такую, к примеру, точку зрения в 1832 г. высказал в своей «Истории алхимии» профессор Шмидер. В 1844 г. в Париже появился «Химический трактат», автор которого утверждал, что «есть надежда достигнуть осуществления великого дела». В 1854 г. нантский химик Тифферо представил Парижской академии «мемуар» с описанием опытов по превращению серебра в золото. Проверку этих опытов устроили в лаборатории монетного двора в присутствии авторитетного химика Леволя. К неудаче Тифферо парижские учёные отнеслись не в пример английским коллегам снисходительно: возможно, у него действительно «что-то получалось», ведь он имел дело с американским серебром, в котором были примеси золота и платины. Ни золото, ни платина в азотной кислоте не растворяются и выпадают в осадок, а заблуждающийся Тифферо посчитал, что они образуются из серебра.
Среди крупных учёных находились такие, которые достижения экспериментальной науки и усовершенствование техники эксперимента воспринимали как многообещающий подход к осуществлению идеи трансмутации «с другой стороны». Когда электричество широко вошло в физические и химические лаборатории в качестве инструмента исследования, не кто иной, как сам великий Фарадей, мнение которого никому и в голову не пришло бы опровергать, сказал буквально следующее: «Разлагать металлы, преобразовывать их и осуществить некогда казавшуюся абсурдной идею трансмутации — такова задача, которая стоит теперь перед химией».
Спустя десятилетия Э.Резерфорд, впервые осуществивший вторжение в атом, назвал свою книгу о ядерных превращениях «Современной алхимией». Если сопоставить этот факт с высказыванием Фарадея, можно при желании протянуть между ними ниточку. Только ниточка эта непременно порвётся, потому что идее трансмутации металлов суждено было сначала умереть, а потом снова воскреснуть.
Мы уже знакомы с атомистическими воззрениями Бойля, Ньютона, Ломоносова. В этом же ряду находится и голландский химик Герман Бургаве, предполагавший, что причиной химических реакций является притяжение и отталкивание мельчайших частиц вещества. Английский учёный Б.Хиггинс в работах 1775–1796 гг. высказал мнение, что молекулы вещества состоят из одного атома, сами же атомы твёрдые и круглые, как шарики. Силы притяжения между атомами обратно пропорциональны расстоянию между ними. Атомы окружены теплородной оболочкой: когда газы соединяются между собой, их атомы преодолевают сопротивление этой оболочки.
Племянник Б.Хиггинса У.Хиггинс, преподаватель Дублинского университета, написал книгу «Сравнительный анализ флогистонной и антифлогистонной теории» (1789). Работа эта знаменательна тем, что в ней сделана попытка установления постоянства состава химических соединений и высказано предположение о простых кратных отношениях.
Были другие работы, которые в историческом плане можно рассматривать как свидетельства логически неумолимого развития химии в направлении к атомно-молекулярной теории строения вещества.
Рождение химической атомистики связано с именем английского физика и химика Джона Дальтона (1766–1844).
«Занимаясь долгое время метеорологическими наблюдениями, — писал в 1810 г. Дальтон, — и размышляя о природе и строении атмосферы, я нередко удивлялся тому, как может сложная атмосфера или смесь двух или более упругих флюидов представлять массу явно однородную».
Пусть нас не смущает здесь слово «флюид» — его нередко встретишь в трудах учёных и гораздо позже: никакого алхимического смысла оно уже не имело.
Если верно, что науку движет удивление, любопытство, то пример с Дальтоном — лучшее тому доказательство. «Удивляясь и размышляя», он в 1787 г. пришёл к твёрдому убеждению, что испарение воды — это отрыв от неё частичек под воздействием теплоты. В 1801 г. сформулировал ставший классическим закон парциальных давлений: давление смеси газов, химически не взаимодействующих друг с другом, равно сумме их парциальных (свойственных каждому газу в отдельности) давлений. Через год вывел закон равномерного расширения газов с увеличением температуры (так уж случилось, что этот закон в то же самое время открыл французский учёный Ж.Гей-Люссак и под его именем вошёл в учебники по химии).
И наконец, формулирует исходные положения, которые в дальнейшем легли в основу стройной, хотя и противоречивой, атомистической теории. Вот эти положения:
Причиной «отталкивательной силы» (отталкивания газовых частиц друг от друга) является теплота (теплород). Частицы газов (упругих флюидов) состоят из маленького центрального атома, окружённого оболочкой теплорода, наиболее плотной непосредственно у атома. Частицы различных газов (упругих флюидов) имеют различный размер (поэтому смесь газов можно представить себе как смесь крупной и мелкой дроби: мелкие дробинки занимают промежутки, образуемые крупными).
В 1803 г. Дальтон приступил к химическим исследованиям, поставив перед собой цель определить экспериментально величину частиц. Такой цели ещё никто никогда не ставил.
Чтобы найти размер частицы, нужно, очевидно, какой-то объём газа разделить на число составляющих его частиц. Ну, а как узнать, сколько в этом объёме частиц? Надо знать вес частицы — тогда всё просто: вес газа, занимающего данный объём, разделим на вес частицы… Так появляется на свет важнейшая физическая и химическая характеристика элемента — атомный вес (ныне — атомная масса).
Годом раньше Дальтон предположил, что элементы могут соединяться между собой по правилу кратных отношений. Опираясь на это предположение, позже вошедшее в его атомистическую теорию на правах закона, а также на результаты весового и объёмного анализа различных химических соединений, полученные химиками, начиная с Лавуазье, Дальтон рассчитал относительные атомные веса 14 веществ. За единицу расчета он принял вес атома водорода как самого лёгкого газа.
В 1805 г. в «Записках Манчестерского литературно-философского общества» появляется статья Дальтона с первой в мире таблицей атомных весов.
Ф.Энгельс это событие оценил так: «В химии, особенно благодаря дальтоновскому открытию атомных весов, мы находим порядок, относительную устойчивость однажды достигнутых результатов и систематический, почти планомерный натиск на ещё не завоёванные области, сравнимый с правильной осадой какой-нибудь крепости».
Атомистика Дальтона была принята не сразу и не всеми. Даже спустя более чем 60 лет после опубликования первых работ Дальтона президент лондонского Химического общества Уильямсон отмечал, «что, с одной стороны, все химики применяют атомную теорию, а с другой — значительное число их смотрит на неё с недоверием, а некоторые — с откровенной неприязнью».
Причина такого отношения к атомистике не только в том, что Дальтон и его последователи делали множество допущений, часто в буквальном смысле подгоняли практические результаты под свои теоретические положения (особенно этим грешил сам Дальтон), но и в том также, что атомистика не оставляла места для первоматерии, переливающейся из одного вещества в другое, как вода из сосуда в сосуд.
Предшествовавшие теории Дальтона атомистические воззрения без особого напряжения уживались с представлением о непрерывной материи и, стало быть, с идеей трансмутации элементов; теперь же идее наносился сокрушительный удар. Раз материя прерывна, если каждый элемент состоит из неделимых далее элементарных кирпичиков (точнее, шариков, окружённых атмосферой из теплорода), то ни о каком превращении их друг в друга не может быть и речи. (Кстати, Дальтон вымел, можно сказать, остатки алхимического мусора, отказавшись от употребления традиционных знаков для изображения веществ).
Однако «почти планомерный натиск на ещё не завоёванные области» сдержать было уже невозможно.
В 1808 г. Ж.Гей-Люссак экспериментальным путём вывел закон, согласно которому при взаимодействии газов объёмы исходных веществ и продукты реакции относятся как простые целые числа. У Дальтона в таком отношении взаимодействуют атомы. Если принять точку зрения Гей-Люссака, то надо отказаться от дальтоновской размерной неодинаковости атомов различных веществ. Если согласиться с Дальтоном, придётся отвергнуть открытый Гей-Люссаком закон.
Дальтон сам признавал, что «его (Гей-Люссака) представление об объёмах аналогично… представлению об атомах», но отказаться от своего неверного постулата не захотел, прекрасно сознавая, что представление об объёмах выведено экспериментально, а представление об атомах вообще и их неодинаковости в частности — всего лишь допущение.
В 1811 г. итальянский физик и химик Амедео Авогадро (1776–1856) предложил формулировку, которая «примиряла» Дальтона с Гей-Люссаком. По Авогадро, в равных объёмах различных газов, находящихся при одинаковых условиях (температуре, давлении), содержится одинаковое число молекул. Из этого вытекало, что относительный вес молекул газообразных веществ можно получить делением плотностей этих веществ. И ещё один очень важный вывод: количество атомов в соединении — число не произвольное, как у Дальтона (Дальтон, исходя из своего ошибочного рассуждения о размерной неодинаковости атомов, считал, например, что вода состоит из одного атома водорода и одного атома кислорода), а обусловливается объёмными отношениями образующих это соединение элементов (та же вода, например, должна состоять из двух атомов водорода и одного атома кислорода, потому что для образования воды, точнее, водяного пара, как установил Гей-Люссак, необходимы один объём кислорода и два объёма водорода).
Правда, когда Авогадро применил принцип расчёта атомных и молекулярных весов газообразных веществ к металлам, тут он испытал определённую трудность и допустил поэтому много ошибок. Но именно он предположил, что в «твёрдых и жидких телах» постоянство соотношений при соединении атомов в молекулы может не соблюдаться, что и подтвердилось в дальнейшем — уже в XX в.
Огромный вклад в развитие атомно-молекулярной теории внёс шведский химик, блестящий экспериментатор, Якоб Берцелиус (1779–1848). Установив, «что числа Д.Дальтона лишены той точности, которая необходима для практического применения его теории», Берцелиус рассчитал атомные веса 45 элементов и определил состав почти 2000 соединений. За точку отсчёта он взял атомный вес кислорода, приравняв его 100. Некоторые атомные веса, определённые Берцелиусом, дожили до нашего времени — так же, как и принятая им символика, т. е. обозначение химических элементов.
В 1819 г. французские учёные Пьер Дюлонг и Алексис Пти обнаружили, что произведение атомного веса простых тел на их теплоёмкость в твёрдом состоянии — величина почти постоянная. Другими словами, «атомы всех простых тел имеют совершенно одну и ту же теплоёмкость». Это открывало ещё одну возможность определения атомного веса — по экспериментально установленной теплоёмкости элемента. Французский физик А.Реньо в цикле работ, начатых в 1840 г., подтвердил, что закон удельных теплоёмкостей «с пользой может быть применяем при многих научных соображениях».
К середине XIX в. в химии накопилось столько нового материала, возникло столько новых идей и в то же время в ней сохранилось столько старых теоретических представлений, что пора было «остановиться» и разобраться в обширном, сложном и крайне противоречивом хозяйстве. Русский химик-органик А.М.Бутлеров так оценивал сложившуюся ситуацию: «Многочисленность работающих, неусыпная деятельность в лабораториях дают беспрерывно массу новых наблюдений, так что теория не успевает перерабатывать их и остаётся позади фактического развития науки». Правда, эти слова А.М.Бутлерова были сказаны о состоянии органической химии, но их с полным основанием можно отнести и к химии общей. Сами химики испытывали острейшую потребность в уточнении понятий атома и молекулы, поскольку здесь было много путаницы, неясности. Надо было договориться о единых способах и теоретических основах определения атомного и молекулярного весов; найти приемлемое для всех понимание атомного состава молекул — как простых, так и сложных веществ, нельзя было терпеть дальше такое положение, когда чуть ли не каждый химик, придерживавшийся атомно-молекулярной теории, предполагал свой атомный состав одного и того же химического соединения. Вся эта неразбериха, весь этот произвол приводили к тому, что консервативно настроенные учёные (например, У.Уолластон, Л.Гмелин) держались в стороне от атомно-молекулярной теории и отдавали предпочтение добрым старым традициям выражать состав сложных веществ при помощи так называемых химических эквивалентов (принцип, согласно которому элементы соединяются между собой в определённых весовых количествах; одним из первых его предложил еще в 1793 г. И.Б.Рихтер).
Решительную реформу атомно-молекулярной теории произвёл итальянский учёный и революционер (за активное участие в революционных событиях 1848–1849 гг. неаполитанским королевским судом был заочно приговорён к смертной казни) Станислао Канниццаро (1826–1910). Он довёл до конца дело, начатое Марком Антуаном Годэном, Огюстом Лораном и Шарлем Фредериком Жераром по устранению противоречий между атомистическими представлениями Дальтона и молекулярными — Авогадро.
Прежде чем выступить с какими-либо позитивными предложениями, Канниццаро основательно изучил состояние атомно-молекулярной теории и положение в химии. В 1858 г. он опубликовал в основанном Пириа журнале статью «Краткое изложение курса химической философии», в которой обосновал метод Авогадро по определению относительных молекулярных весов и метод нахождения атомных весов металлов по величине атомных теплоёмкостей.
В том же году эта работа вышла отдельным изданием.
Громадное значение для всей судьбы атомно-молекулярной теории имело уточнение двух её кардинальных понятий — атома и молекулы.
Как уже было сказано, химики смешивали эти два понятия, что было, естественно, следствием не столько их злого умысла, сколько гипотетичности и атома, и молекулы. «Я, — писал Дальтон, — избрал слово атом для обозначения… первичных частиц… потому, что это слово кажется мне значительно более выразительным; оно включает в себя представление о неделимости, чего нет в других обозначениях». Иллюстрируя своё понимание атома, Дальтон приводил такой пример: «…я называю первичную частицу угольной кислоты сложным атомом. Однако хотя этот атом и может быть разделён, но, распадаясь при таком делении на уголь и кислоту, он перестаёт уже быть угольной кислотой».
Авогадро, напротив, оперировал такими понятиями, как «интегральная молекула», «сложная молекула» (в современном понимании это просто молекула) и «простая молекула», т. е. атом.
Сначала Ш.Жерар и О.Лоран, а затем Канниццаро положили конец этим кривотолкам. Они дали однозначное определение атомному весу и показали, что атом и молекула — разные понятия и что молекулы в одних случаях состоят из разнородных, а в других — из однородных атомов.
Через год после выхода книги Канниццаро немецкий учёный Август Кекуле обратился к своему коллеге Карлу Вельтцину с предложением организовать международный конгресс для достижения единства в химии и разрешения спорных проблем. Вельтцину идея понравилась, и он взял на себя обязанности организатора и устроителя конгресса. К этому был привлечён также Адольф Вюрц, согласившийся вести заседания и быть секретарём. В марте 1860 г. они собрались в Париже, отпечатали обращение ко всем выдающимся химикам. 45 учёных подписали это обращение, среди них значатся известные русские химики — Н.Н.Бекетов, Н.Н.Соколов и Н.Н.Зинин.
Конгресс открылся 3 сентября 1860 г. в Карлсруэ, где Вельтцин преподавал в Политехническом институте.
Участникам конгресса предстояло сделать выбор по тем вопросам, которые имели жизненно важное значение для развития химии в целом. В сущности, речь шла о том, быть ли ей на старых позициях или принять воззрения Авогадро, Жерара, открывавшие перед ней новые перспективы.
Сторонником первой точки зрения был французский академик, прославленный учёный Ж.Дюма. «Дюма… — писал Д.И.Менделеев, принимавший участие в конгрессе, — старался поставить пропасть между старым и новым, искусственно уладить дело об обозначениях, предлагая в неорганической химии оставить старое обозначение, а в органической — принять новые… При этом Дюма прекрасно характеризовал оба существующие направления. Одно, говорил он, представляет ясное последование за Лавуазье, Дальтоном и Берцелиусом. Исходная точка для учёных этого образа мыслей есть атом, неделимое простое тело; всё прочее есть сумма атомов, величина, производная от первой. Другая партия идёт по пути… Жерара; она берёт готовые тела и сравнивает их; она берёт частицы тела, отыскивает изменения и сличает их физические свойства. Первая партия всё сделала для минеральной химии, в органической она до сих пор бессильна, потому что здесь химия ещё немного может создать из элементов. Вторая партия, несомненно сильно двинувшая органическую химию, ничего не сделала для минеральной». Дюма, свидетельствует далее Менделеев, призывал и тех и других идти своей дорогой.
Сторонником другой точки зрения был Станислао Канниццаро. Его речь потрясла слушателей. «Я не могу… передать того воодушевления, той здравой энергии, вполне сложившегося убеждения, которые так могущественно действовали на слушателей», — отзывался о речи Канниццаро Менделеев.
На конгрессе Канниццаро раздал оттиски своей книги «Краткое изложение курса химической философии». Читатели были поражены чёткостью изложения, убедительностью, с которой устранялись разногласия, и открывавшимися в связи с этим перспективами развития экспериментальной науки. «Я читал книгу неоднократно и был поражён ясностью, с какой она освещала важнейшие спорные вопросы, — писал тогда известный химик Лотар Мейер. — С моих глаз как бы спала пелена, исчезли сомнения, и вместо них возникло чувство самой спокойной уверенности».
Гипотезу Авогадро Канниццаро назвал краеугольным камнем развития атомной теории Дальтона, которая, основываясь только на весовых и объёмных соотношениях, становилась непригодной для экспериментальных исследований. Не надо удивляться, утверждал он, необходимости в гипотезе Авогадро для понимания законов. Именно неприятие идей Авогадро и привело к неудачам многих химиков и даже такого прославленного учёного, как Берцелиус.
С огромным воодушевлением произнёс свою речь Канниццаро, и члены конгресса, несмотря на те несогласия, которые были между ними до этого, встретили её почти единодушным одобрением. Когда предложили резолюцию, в которой характеризовалось различие понятий частицы (молекулы) и атома, то все проголосовали «за». Лишь одна чья-то рука робко поднялась при вопросе «кто против?», но и она тут же опустилась.
После конгресса в Карлсруэ отошли в прошлое разногласия, стоявшие на пути развития экспериментальных определений в химии, а атомный вес стал важнейшей характеристикой элемента.
Более чем на сто лет опередил М.В. Ломоносов всех химиков Европы. В своей незавершённой работе «Элементы математической химии» он дал представление о строении вещества, подобное тому, что приняли химики лишь после конгресса в Карлсруэ. Он писал, что «корпускула (так он называл молекулу) — собрание элементов (т. е. атомов) в одну незначительную массу. Корпускулы однородны, если состоят из одинакового числа одних и тех же элементов, взаимосоединённых одинаковым образом. Корпускулы разнородны, когда элементы их различны и соединены разным образом или в различном числе; от этого зависит бесконечное разнообразие тел. Начало есть тело, состоящее из однородных молекул».
Можно, пожалуй, сказать, что математической химия получила право называться лишь с принятием идей Авогадро, чего так блестяще добился Канниццаро. Ломоносов к этому стремился задолго до знаменитого конгресса. Но, как было уже сказано, работы нашего великого соотечественника не были широко известны на Западе. К тому же сомнительно, чтобы его идеи и выводы были тогда поняты и приняты: они опережали время. По этой же причине пребывала в забвении более поздняя молекулярная теория Авогадро; по этой же причине в известной степени конгресс в Карлсруэ спорные вопросы решил голосованием — случай в науке беспрецедентный.
Да и не истину декретировали участники конгресса, если быть точным. Они обменялись информацией и попытались разрешить кризис путём принятия согласованной платформы для дальнейшего продвижения к истине. «Решающим моментом в развитии моей мысли о периодическом законе я считаю 1860 г., съезд химиков в Карлсруэ, в котором я участвовал, и на этом съезде идеи, высказанные итальянским химиком С.Канниццаро. Его я и считаю настоящим моим предшественником, так как установленные им атомные веса дали необходимую точку опоры». Эти слова Д.И.Менделеева как нельзя лучше характеризуют значение конгресса.
Именно потому, что научная истина не есть то, что принимается голосованием, положение в химии после конгресса не стало идиллическим. Борьба продолжалась. Одни были полностью «за» атомно-молекулярную теорию; другие принимали её постольку, поскольку она казалась неплохим «инструментом» познания; третьи не признавали её совсем.
А в промежутках между этими группами (и внутри групп), как в промежутках между большими дробинками-атомами Дальтона, — переходы, оттенки, колебания. И так до тех пор, пока атом не стал для науки реальностью.
Именно поэтому же нельзя утверждать, что идея трансмутации металлов, получив от атомистики весьма ощутительный удар, почила в бозе. Отнюдь нет. Она удерживала за собой ещё немало «опорных пунктов». Так, например, в 20-х гг. XIX в. было открыто поразительное явление — изомерия: вещества, отличающиеся друг от друга физическими и химическими свойствами, по непонятной причине имеют одинаковый элементарный состав. То же самое с другим непонятным явлением — аллотропией. Атомно-молекулярная теория пока не в состоянии была объяснить, почему олово (элемент!) вдруг само по себе, ни с чем не соединяясь, превращается в порошок. И наконец, третий пример: почему медь, металл мягкий, в соединении с мягким же металлом оловом даёт твёрдый сплав — бронзу?
На рубеже XVIII и XIX вв. химик Винтерль занимался опытами по «разложению» металлов. Никаких реальных результатов он не добился, но сама идея уцелела. Уже после 1860 г. химик Стас не скрывал своего позитивного к ней отношения и потратил немало усилий, чтобы получить ответ на вопрос: не распадаются ли химические элементы на другие, более лёгкие? А сколько раз подвергался проверке закон постоянства состава! И совсем не ради самой проверки: если бы закон экспериментально не подтвердился, то это означало бы, что при различных химических реакциях атомы элементов не остаются неизменными.
Даже Д.И.Менделеев в 60-е годы (после конгресса!), хотя и не признавал безоговорочно — из-за отсутствия экспериментальных подтверждений — принципиальную возможность взаимопревращаемости элементов, относился к ней тогда в целом сочувственно.
Торжество спектра
В том же 1860 г. химики вооружились таким инструментом исследования, о котором не смели и мечтать, — методом спектрального анализа.
К многоцветной дуге на небесном своде, возникающей иногда после дождя, привыкли. Ею восхищались, любовались, иногда и преклонялись, но почему она появляется — никто ничего сказать не мог и ограничивался ссылкой на волю и дар вседержителя — Бога.
В 1675 г. Ньютон, пропустив луч света через призму, получил радугу на стене. Вместо обычного белого пятна он увидел изображение, окрашенное в переходящие постепенно друг в друга цвета — от фиолетового до красного. Ньютон назвал его спектром. Он обнаружил, что белый свет (и цвет) — это некое сложное образование, которое с помощью очень простых средств легко разложить на составляющие.
Но прежде чем заявить об этом во всеуслышание, Ньютон, точности ради и чтобы обезопасить себя от нападок коллег, поставил контрольный опыт. На пути луча он вместо одной призмы поставил две, одну за другой. Первая стояла на основании, вторую он клал на ребро. В опыте только с одной — первой — призмой спектр был, а вот когда на пути луча появлялась вторая призма, спектр исчезал и на экране светилось обычное белое пятно. Вывод мог быть только один: вторая призма снова собирала воедино лучи разного цвета, «смешивала» их и получался прежний белый свет.
В истории науки хорошо известны случаи, когда очень важные открытия делались не высокоучёными мужами, а людьми, не имеющими образования. Таким был, в частности, привратник ратуши и торговец шерстью голландец Антони Левенгук, живший в XVII в. У него было, как это принято ныне называть, хобби: с исключительным трудолюбием и увлечённостью шлифовал он линзы. Из них делал увеличительные приборы, украшал их серебром и золотом, а потом рассматривал через них всякую всячину. Коллеги по купеческой гильдии считали, что Левенгук занимается этим в ущерб своим делам. Но мы теперь знаем, что от его занятий выиграла наука. Левенгук открыл капиллярное кровообращение, ячеистое строение кожи, а в каплях воды и в соскобе со своих собственных зубов — мир живых существ, о котором никто до этого и не подозревал. О своих наблюдениях Левенгук сообщал в письмах, регулярно направляемых в Лондонское Королевское общество. Сообщения торговца шерстью производили там весьма и весьма сильное впечатление.
Деятельность замечательного мюнхенского оптика Йозефа Фраунгофера протекала полтора столетия спустя. В отличие от Левенгука, который, сообщая в Лондонское Королевское общество о замечательных открытиях, ревниво оберегал от чужого глаза устройство своих микроскопов и соглашался передать их в руки учёных только после своей смерти, Фраунгофер снабжал приборами всех, кому они были нужны.
Фраунгофер получил математическое образование, после чего совершенствовался в физике и других науках самостоятельно. Чтобы шлифовать линзы не на авось, а с точным расчётом, он решил вывести коэффициент преломления лучей различного цвета и с этой целью поставил несколько опытов, подобных ньютоновым. Но свет он пропускал не через круглое отверстие, как Ньютон, а через узкую щель, благодаря чему у него получалось более резкое и чёткое изображение цветной полосы.
Для проверки отшлифованных линз Фраунгоферу требовался одноцветный свет. Он поставил перед щелью масляную лампу и получил спектр, но в нём резко выделялись две жёлтые линии. Заменив масляную лампу спиртовкой, он наблюдал такую же картину. Пламя свечи показало то же самое. Тогда Фраунгофер обратился к солнечному свету и увидел, что в означенном месте наблюдаемые им ранее жёлтые линии отсутствуют, но — странное дело! — весь спектр (у него были очень совершенные по тем временам линзы) пересечён множеством тёмных линий. Он насчитал их более пятисот и заметил, что при каждом наблюдении они занимали строго определённое место. Создавалось впечатление, что в солнечном спектре есть какие-то «провалы», что не хватает каких-то цветов.
Если быть строгим, то следует сказать, что идея наблюдения спектра, полученного не через круглое, а через щелевидное отверстие, пришла в голову более чем за десятилетие до работ Фраунгофера английскому химику Уолластону; более того, этот учёный тогда же обнаружил тёмные линии в солнечном спектре. Однако Уолластон, целиком поглощённый работой по открытию новых элементов в сырой платине, не обратил никакого внимания на это явление.
Думается, что наблюдения Уолластона были неизвестны Фраунгоферу, и появление чёрных линий в спектре было для него полной неожиданностью. Мюнхенский мастер показывал свои опыты очень многим светилам научного мира, но объяснить появление чёрных линий в солнечном спектре никто тогда не мог. Так и умер этот замечательный экспериментатор, оставив после себя жгучую загадку «фраунгоферовых линий». Не одно десятилетие потом она привлекала внимание учёных. Разгадать её выпало на долю Роберта Бунзена и Густава Кирхгофа.
Когда в 1854 г. в Гейдельберге был построен газовый завод, Бунзен позаботился о подводке газа в свою лабораторию. Но поскольку существующие горелки не удовлетворили его, он сконструировал свою, ту самую, какой мы пользуемся и в наши дни. Пламя её не коптило, легко регулировалось и было почти бесцветным.
Бунзен был не только большим учёным, но и прекрасным стеклодувом, он сам изготовлял необходимые для научной работы стеклянные приборы самой причудливой формы. Не раз он замечал, что при внесении стеклянной трубки в пламя цвет последнего резко менялся. Иногда в плохо отрегулированной горелке пламя проскакивало внутрь трубки и окрашивалось в красивый зеленый цвет. За два десятилетия до Бунзена один из пионеров фотографии английский учёный Талбот в пламя спиртовой горелки вводил соли разных металлов и наблюдал, как пламя окрашивается в разные цвета. Талбот натренировался отличать малиновую окраску, полученную введением в пламя солей лития, от малиновой же, вызванной солями стронция. Подобно Уолластону, Талбот не пошёл дальше в изучении этого явления, так как занимался фотопроцессом. Ведь это именно ему мы обязаны открытием закрепителя фотоизображения — гипосульфита.
Бунзен знал об опытах Талбота. Знал также, что некоторые химики пытались установить состав вещества по окраске пламени, но из этого ничего тогда не вышло. У Бунзена было некоторое преимущество перед предшественниками: его горелка давала практически бесцветное пламя. Поэтому ему не составляло труда установить, что соли натрия окрашивают пламя в желтый цвет, калия — в фиолетовый, стронция — в малиновый и т. д. Однако затруднение выявилось сразу из-за того, что некоторые элементы вызывали сходную окраску пламени, причём светофильтры не очень помогали. Ещё более сложно было узнать состав вещества, если в него входило несколько металлов. Всеми своими сомнениями по этому поводу Бунзен поделился со своим другом Кирхгофом. После некоторого размышления тот сказал, что на его месте он как физик поступил бы иначе: изучал бы не цвет пламени, а получаемый от него спектр. С этого и началась их совместная, можно сказать, лихорадочная работа.
Из сигарного ящика, обклеенного внутри чёрной бумагой, призм и двух старых подзорных труб Кирхгоф смастерил прибор, через который друзья стали изучать спектры пламени, окрашенного солями различных металлов. Натриевое пламя, например, давало две жёлтые линии на чёрном фоне на вполне определённом месте. Соли калия — одну линию фиолетовую и одну красную. Различить, что находится в пламени — литий или стронций уже не составляло труда: в первом случае появилась одна ярко-красная линия и менее заметная оранжевая, во втором же — ярко-голубая и несколько ярко-красных. Главное же было в том, что их местоположение не совпадало, спутать было невозможно.
Опираясь на эксперименты Онгстрема, изучавшего спектры электрических разрядов в различной газовой среде, учёные пришли к выводу, что цветные линии в спектре дают не сами металлы, а пары этих металлов, образующиеся в пламени горелки.
Усовершенствовав свой прибор, Бунзен и Кирхгоф вооружили химиков новым и очень тонким методом количественного анализа. Достаточно сказать, что натрий новым методом можно было зарегистрировать даже в том случае, если его содержание составляло всего лишь трёхмиллионную долю миллиграмма.
Друзья увлеклись поисками элементов в различных объектах. Считавшийся тогда редким металлом литий они обнаружили в гранитах, в солёной воде Атлантического океана и табаке, молоке и мышечной ткани, крови и винограде.
Кажется, с цветными линиями спектра теперь всё ясно. Оставалось узнать, откуда берутся «фраунгоферовы линии». Был поставлен следующий опыт. Через щель спектроскопа пропустили ослабленные матовым стеклом солнечные лучи и на их пути поместили пламя горелки, окрашенное парами натрия. Спектры наложились один на другой, и на месте «фраунгоферовой линии» светилась жёлтая линия натрия. Когда матовое стекло убрали и солнечный световой поток резко усилился, то в спектре жёлтая линия натрия исчезла и вместо неё появилась жирная чёрная линия.
Кирхгоф не удивился бы, если бы жёлтая линия побледнела, но она исчезла совершенно. Образовался какой-то провал в спектре. Но почему? И Кирхгоф решил прибегнуть к так называемому «искусственному солнцу» — друммондову свету. Получается он накаливанием извести в кислородно-водородном пламени. Ослепительно белый друммондов свет, пропущенный через щель, дал непрерывный, ровный спектр без всяких чёрных линий. Тогда Кирхгоф направил лучи в щель через пламя горелки, окрашенное парами натрия. «Фраунгоферова линия» выступила с предельной чёткостью в той части спектра, где до этого светилась жёлтая линия. Кирхгоф получил искусственную «фраунгоферову линию» и понял: жёлтые лучи натриевого пламени и жёлтые лучи, входящие в состав друммондова света, сложившись, дали чёрную линию. Очень важное открытие! Оно навело на мысль, что таким путём можно исследовать состав околосолнечной атмосферы и, стало быть, самого Солнца. Бунзен и Кирхгоф стали искать на Солнце известные им элементы и находили. Своими сообщениями в Берлинскую академию наук они буквально потрясли учёных всего мира.
Правда, исследованиями солнечного спектра занимался больше Кирхгоф, а Бунзена влекли земные дела. Он, в частности, загорелся мечтой с помощью спектрального метода найти на Земле неизвестный элемент. Что только он не пробовал, но всегда обнаруживал уже известное.
Так он добрался до минеральной воды Дюркгеймских источников. Он упарил её, сгустил и обнаружил всё те же натрий, калий, кальций, литий, стронций.
Бунзен — прекрасный химик с острым аналитическим умом. Рассудил он так: очевидно, присутствие в дюркгеймской воде больших количеств известных веществ мешает обнаружить новое — они его просто «подавляют», затмевают. Надо от них во что бы то ни стало освободиться. Как только это ему удалось сделать, вознаграждение пришло незамедлительно: новый элемент просигналил о себе двумя голубыми линиями в спектре.
Бунзен понимал, что если не сумеет выделить элемент в чистом виде, чтобы показать коллегам, в небесно-голубые линии никто из них не поверит. Но в воде Дюркгеймских источников его ничтожно мало, поэтому в лабораторных условиях эту задачу решить практически невозможно.
Тогда Бунзен поступил как технолог, благо он хорошо знал химическую технологию: в молодые годы он спускался в угольные шахты, бывал на металлургических, химических предприятиях, знал сахарное производство. Недалеко от Гейдельберга располагался содовый завод, и учёный обратился к нему за помощью. За несколько недель по просьбе Бунзена в огромных котлах и резервуарах для него упарили 44 тысячи литров дюркгеймской воды. После переработки остатка Бунзен выделил семь граммов нового металла и назвал его цезием, что означает небесно-голубой (по цвету линии в спектре). Триумф учёного этим ещё не завершился. Когда были отделены посторонние металлы, Бунзен вдруг обнаружил совершенно новые линии в спектре, среди которых особенно отчётливо выступали тёмно-красные. Это был ещё один элемент. Бунзен назвал его рубидием — также по цвету спектральных линий. Из раствора его удалось выделить даже больше, чем цезия, — десять граммов.
Вклад Бунзена в науку поистине велик. В разработанный им совместно с Кирхгофом метод спектрального анализа нельзя было не поверить, ибо он давал очень надёжные результаты. На основе своего же метода, с помощью несложного прибора — спектроскопа Бунзен открыл два неизвестных ранее элемента — металлы рубидий и цезий.
Современники Бунзена и Кирхгофа по достоинству оценили метод спектрального анализа, поняв, какие перспективы он перед ними открывает.
Вслед за Бунзеном успеха добился лондонский химик Уильям Крукс.
Уже в 1861 г., изучая огарки серного колчедана, остающиеся в производстве серной кислоты, Крукс подверг их спектральному анализу и обнаружил новую ярко-зелёную линию. Элемент, сигнализирующий о себе зелёной полосой в спектре, Крукс окрестил таллием (таллос по-гречески — "зелёная ветвь").
Такую же работу проделал бельгийский учёный Клод Огюст Лами. Он также обнаружил новый металл по спектру в огарках серного колчедана, но этим не ограничился, а выделил его и получил химическое соединение, поэтому открытие таллия до сего времени значится за именами двух этих учёных.
Профессор физики высшей горной школы в Саксонии Ф.Рейх, узнав об открытии таллия, решил поискать его в цинковых рудах. Естественно, что ни к какому другому методу, кроме спектрального, он прибегать не собирался, но вся беда была в том, что учёный страдал дальтонизмом. Тогда он на помощь себе привлёк ассистента с нормальным зрением — Иеронима Рихтера. И случилось большее, чем можно было ожидать: дальтоник и его ассистент открыли ещё один элемент — индий. Так его назвали по индиго-синему цвету спектральной линии.
Сигарный ящик со старыми подзорными трубами претерпел значительные изменения. Сам Кирхгоф много потрудился над усовершенствованием спектроскопа, а вскоре за это дело взялись лучшие оптики мира. Дорогие и сложно устроенные спектральные приборы стали изготавливать немецкие оптические фирмы, а лондонская фирма «Браунинг» выпустила дешёвые портативные спектроскопы.
Выясняя природу «фраунгоферовых линий», Кирхгоф и Бунзен прежде всего обнаружили 60 линий в спектре солнца, соответствующих железу. После этого Кирхгоф с помощью своего чудесного прибора последовательно установил, что в атмосфере Солнца присутствуют натрий, медь, свинец, олово, водород и многие другие уже известные на земле элементы. Состав ближайшей звезды, расположенной от нас за миллион километров, оказывался таким же, как и состав Земли.
Если в средние века алхимия (во всяком случае во множестве её трактатов) связывалась с астрологией, что было самой неприкрытой мистикой, то в XIX столетии успехи химии на прочной научной основе оказались связаны с астрономией. Родилась новая наука — астрохимия.
Для астрономов 1860 г. тоже был знаменательным. 18 июля много их съехалось со всех концов Европы в Испанию наблюдать полное солнечное затмение. Длится оно всего несколько минут, и следует представить себе трудность работы астрономов, не располагавших достаточно хорошо отработанными методами скоростного фотографирования. Всё, что происходило с Солнцем, нужно было успеть записать, измерить, зарисовать. Когда тень Луны полностью закрыла диск Солнца, многие астрономы обратили внимание на огненные выступы, выходящие за край. Следует думать, что эти выступы (взрывы) замечались астрономами и ранее, но они считали их просто обманом зрения. На этот же раз солнечные выступы, протуберанцы, многими наблюдателями были зарисованы и явились предметом оживлённой дискуссии по поводу их природы и происхождения.
Следующее затмение произошло через 8 лет, т. е. когда спектральный анализ уже широко вошёл в практику. Наблюдать затмение можно было в Индии. Французский астроном Жюль Жансен, всю жизнь занимавшийся исследованием Солнца, отправился в Индию, вооружившись хорошим спектроскопом. Ему удалось, кроме известных линий в спектре, обнаружить вдруг новую — жёлтую. Ни один ранее известный элемент по местонахождению в спектре этой линии не соответствовал. На следующий день Жансен осторожно и искусно навёл щель спектроскопа на самый край Солнца и опять наблюдал ту же самую линию, уже без всякого затмения. Не было сомнения: на Солнце есть какой-то совершенно новый, неизвестный на Земле, элемент, о котором ничего пока нельзя сказать, кроме того, что он, по-видимому, газ.
В октябре 1868 г. Парижская академия наук получила два одновременно поступивших сообщения. В одном из них Жюль Жансен сообщал о своём открытии солнечного элемента, а в другом астроном Норман Локьер, не выезжавший из Англии, извещал о том же самом. Академики так были поражены совпадением, что решили в честь такого события отчеканить специальную медаль с портретами Жансена и Локьера на одной стороне, а на другой — изображением бога солнца в колеснице, запряжённой четвёркой коней, и надписью: «Анализ солнечных выступов 18 августа 1868 года».
Уже упоминавшийся Крукс ещё до того, как открыл таллий, начал издавать журнал «Новости химии». И следует заметить, что время для этого было очень подходящее: от недостатка новостей журнал не страдал, они сыпались, как из рога изобилия.
Периодический закон и его триумф
Называть, описывать и классифицировать — вот основа и цель науки — провозгласил в своё время знаменитый Кювье. Можно сейчас оспорить высказывание прославленного зоолога и анатома. Однако следует учитывать, что всякая наука начинается с накопления сведений, после чего появляется настоятельная необходимость эти сведения как-то систематизировать. Шведский естествоиспытатель Карл Линней говорил: «Система — это ариаднина нить, без неё всё дело превращается в хаос».
Химикам 60-х гг. прошлого столетия стало известно более 60 элементов. Подробно были описаны свойства каждого из них и их соединений, многие имели широкое промышленное значение, учёные находили между ними черты определённого сходства и разительного отличия. Появилась нужда в систематизации элементов, но, несмотря на то, что по сравнению с зоологией и ботаникой химия располагала сравнительно «небольшим хозяйством», привести его в определённый порядок было не так-то просто.
Первая попытка привести элементы в какую-то систему относится ещё к тому времени, когда классическая химия только становилась на ноги. Она принадлежит Лавуазье. Разделавшись с флогистоном, он составил таблицу простых тел, основанную на классификации их по химическим свойствам. Сейчас эта таблица вызывает к себе лишь исторический интерес, но в своё время она сыграла важную роль.
В начале XIX в., точнее в 1815 г., английский врач и химик (опять врач и химик!) У.Праут, подхватив мысль своего соотечественника Г.Дэви о водороде как первоматерии, построил на ней гипотезу, гласившую, что все элементы происходят из водорода путём какого-то процесса типа конденсации. Гипотеза надолго овладела умами исследователей, хотя бельгийский профессор Жан Серве Стас, вначале её горячий поклонник, своими расчётами и многолетними экспериментами (теми самыми, которыми он хотел подтвердить разложение элементов на другие, более лёгкие) доказал затем, что она — «чистая спекуляция, определённо противоречащая опыту».
Почти одновременно с этим один из последователей Дальтона, Деберейнер, опубликовал таблицы атомных весов некоторых элементов; они объединялись в триады, в которых атомный вес среднего элемента равнялся примерно полусумме крайних. Литий — натрий — калий, кальций — стронций — барий, хлор — бром — йод — вот примеры таких деберейнеровых триад.
К середине прошлого века большое впечатление на учёных произвели успехи органической химии, которая совсем недавно, по выражению Фридриха Велера, представляла собой дремучий лес, из которого нет выхода. В 1850 г. Петтенкоффер попытался найти у элементов соотношения, подобные тем, что обнаруживаются в гомологических рядах, т. е. в рядах соединений, отличающихся друг от друга группой CH2. Он указал, что атомные веса некоторых элементов отличаются друг от друга на величину, кратную 8. Отсюда напрашивался вывод: так ли просты элементы, не являются ли они некими сложными образованиями каких-то субэлементарных частиц? На следующий год подобные соображения высказал Ж.Дюма. Выводы из существования закономерных соотношений атомных весов шли у него далеко: ставился вопрос о возможности разложения элементарных веществ на субэлементарные образования, а стало быть, и возможности трансмутации металлов. Опять следует заметить, что такого учёного, как Дюма, ни в коей мере нельзя причислить к сторонникам алхимических воззрений, но мысль, высказанная им, полностью соответствовала убеждениям алхимиков.
До знаменательного 1860 г. было ещё несколько попыток как-то систематизировать известные химические элементы. Л.Гмелин, Дж. Гладстон, Дж. Кук, Ф.Ленссен, В.Одлинг, А.Штреккер объединяли их в триады, пентады и т. д. и находили при этом какую-то числовую зависимость в возрастании атомных весов сходных элементов. Но этим дело обычно и ограничивалось, а предлагаемые таблицы сильно разнились друг от друга. Да иначе и быть не могло, так как многие элементы ещё не были открыты, а атомные веса уже известных элементов до конгресса в Карлсруэ не имели, как мы знаем, единого для всех химиков значения.
В 1862–1863 гг. попытку систематизировать элементы сделал французский химик Шанкуртуа. Предложенная им система имела своеобразное построение и осталась в истории как «винтовая линия Шанкуртуа». Все известные к тому времени элементы в порядке возрастания их атомных весов были занесены на ленту, которая по спирали накладывалась на цилиндр; поверхность цилиндра была разделена на 16 частей (атомный вес кислорода). Развернутый после этого цилиндр показывал на своей плоскости ряд отрезков параллельных прямых с вписанными элементами атомного веса от 1 до 16, от 16 до 32 и т. д. При таком расположении сходные по своим химическим свойствам элементы часто, но не всегда, попадали на одну образующую цилиндра. По мнению историков науки, в системе Шанкуртуа содержался зародыш периодического закона, но в то же время она давала широкий простор для произвола. Вместе с элементами-аналогами на одну образующую попадали совершенно несхожие с ними. Для углерода атомного веса 12 должна была существовать и какая-то «разновидность» его с атомным весом 44. Парижская академия наук, где делал своё сообщение Шанкуртуа, восприняла его весьма холодно, и об этой работе стало широко известно лишь 30 лет спустя.
Начиная с 1863 г., много занимался классификацией элементов и выступал с сообщениями лондонский химик Джон Ньюлендс. Он обратил внимание на то, что номера аналогичных элементов отличаются на величину 7, как в музыке, и расположил элементы по некоему «закону октав». Когда с очередным докладом Ньюлендс выступал в лондонском Химическом обществе, профессор Фостер с издёвкой спросил: «Не пробовал ли уважаемый докладчик располагать в таблице элементы в алфавитном порядке и не заметил ли при этом каких-либо закономерностей?» Собрание отказало в публикации сообщения Ньюлендса в своих изданиях и надолго отбило у него охоту заниматься подобными вопросами.
В 1864 г. в Германии вышла в свет книга Лотара Мейера «Современные теории химии и их значение для химической статики». В ней, пользуясь уже новыми атомными весами, автор отмечал, что аналогичные по свойствам элементы имеют одинаковую валентность («значность»), а величины их атомных весов отличаются на постоянную разность. В приведённых им таблицах валентности не всегда соответствовали действительности, но Мейер, как говорится, втиснул их в прокрустово ложе, так как не решался хоть на минуту усомниться в правильности атомных весов. Он так и писал тогда: «Нельзя сомневаться, что имеется некоторая закономерность в численных величинах атомных весов… несомненно нельзя — как это делалось достаточно часто — ради предполагаемой законности произвольно исправлять или изменять найденные эмпирически атомные веса, пока опыт не даст более точных чисел».
В 1867 г. молодого тогда профессора Д.И.Менделеева пригласили занять кафедру Петербургского университета. Он стал читать курс лекций по общей химии и одновременно писал свои ставшие потом знаменитыми «Основы химии».
С описания свойств какого элемента следует начинать курс химии? В принципе всё равно с какого: свойства элементов, если не обращать внимания на водородную первоматерию Г.Дэви и гипотезу У.Праута, между собой никак, казалось, не соотносились. Как правило, начинали с описания кислорода — элемента, имеющего наибольшее распространение в природе; некоторые профессора находили более удобным начинать курс с описания водорода — самого лёгкого элемента. С таким же успехом можно было начинать с железа — элемента, имеющего важнейшее значение в промышленности, золота — драгоценного металла и т. д.
Менделеева такое чтение курса «как вам будет угодно» не устраивало, он настойчиво стал искать взаимосвязь элементов, скрытое единство.
Все предыдущие попытки систематизации элементов не производили впечатления на учёный мир Европы. Сложилось убеждение, что от таких работ нельзя получить чего-нибудь большего, кроме разбивки элементов на отдельные группы по признаку их химического сходства. И всё же Менделеев, прекрасно осведомлённый об установившемся взгляде на систематизацию, взялся за это дело. В отличие от других исследователей, он искал не только сходство элементов, но и различие. На отдельных карточках он выписал их свойства и атомные веса и стал, как любят об этом вспоминать историки химии, раскладывать знаменитый «пасьянс». Менделеев расположил все элементы в порядке возрастания их атомного веса и заметил, что свойства их через какой-то период повторяются. Это был титанический труд. Менделеев искал не какую-нибудь частную закономерность, а закон естественного соотношения элементов. Все элементы были разбиты на группы и периоды.
Менделеев открыл закон, кратко выражающийся словами: свойства элементов являются периодической функцией их атомного веса. Окончательную формулировку закона Менделеев дал в 1871 г. в статье «Периодическая законность для химических элементов». Изнурительная работа по классификации элементов привела к созданию «периодической системы». Но хорошо известная ныне таблица Менделеева приобрела стройный вид лишь после долгих проверок, выяснений, уточнений, исправлений, проводившихся в течение десятилетий.
Затруднения в раскладке «пасьянса» начались сразу же. Прежде всего нарушал порядок бериллий, атомный вес которого тогда признавали за 14. Менделеев решился исправить атомный вес, подозревая, что бериллий не двух, а трёхвалентен. На это ещё раньше указывал русский химик И.В.Авдеев. Взяв формулу окиси бериллия (а именно на её основе химики рассчитали атомный вес бериллия), Менделеев произвёл пересчёт и заменил число 14 на 9,4.
Аналогичная трудность возникла с индием: ему никак не находилось место в таблице. Тогда Менделеев произвёл обратный (сравнивая с окислом бериллия) пересчёт и получил атомный вес не 75,6, а 113. В соответствии со своим атомным весом титан должен был бы занять клетку под бором, но он никак туда не подходил из-за несходства химических свойств. Менделеев оставил клетку пустой, а титан передвинул на следующее место. Казалось бы, порядок рушился, однако создатель системы указал, что в пустой клетке должен поместиться элемент, который ещё не открыт. Название этому элементу Менделеев не дал, предоставив это тому, кто его обнаружит, а обозначил его пока экабором (т. е. аналогичным бору). Подобным же образом Менделеев оставил пустые места для экаалюминия и экакремния. Но этим он не ограничился, он подробно описал будущие элементы, предсказал их химические свойства, удельный вес и даже высказал предположение, что откроют их, по всей вероятности, спектральным методом.
Далеко не все и не сразу химики согласились с Менделеевым. По свидетельству Н.А.Меншуткина, сделавшего первое сообщение о системе Менделеева на заседании Химического общества 6 марта 1869 г. (сам Менделеев был болен), оно не вызвало какого-либо интереса или обмена мнений. Современники Менделеева полагали, что никакого реального научного значения подобные построения не имеют. Такое отношение на первых порах встретила система Менделеева со стороны даже тех учёных, которые высоко ценили его талант, таких, как Зинин, Кольбе, Марковников. Чешский химик Б.Браунер рассказал об открытии Менделеева Бунзену. И что же? Знаменитый Бунзен, в лаборатории которого два года работал Менделеев, отнёсся к сообщению крайне иронически и ответил Браунеру: «Бросьте увлекаться этими вещами. Я сам сделаю сколько угодно подобных сообщений на основании различных чисел, которые печатаются в биржевых ведомостях».
Так отнеслись наиболее благорасположенные к Менделееву химики. А были и такие, которые высказывались с гневом и возмущением: как можно включать в курс точной науки выдуманные элементы, что за спекуляция с атомными весами, это химия или хиромантия? Это научный труд или толкователь снов?
Такую реакцию учёных можно объяснить, видимо, только тем, что предложенные Менделеевым таблица и принцип систематизации требовали коренной перестройки мышления.
Сам Менделеев отмечал впоследствии: «Мысль сличить все элементы по величине их атомных весов… была чужда общему сознанию». Тем не менее Менделеев счёл своим долгом и честью учёного отдать должное предшественникам: «Плод, однако, зрел, и я вижу ныне ясно, что Штреккер, де Шанкуртуа и Ньюлендс стояли впереди всех на дороге к периодическому закону, и им недоставало только решимости поставить дело на подобающую ему высоту, с которой виден закон и рефлексы закона на факты».
Оправдана ли была решимость самого Менделеева? Дальнейшие события показали это со всей ясностью. Л.Мейер, ознакомившись со статьёй Менделеева, представил свою таблицу элементов, во многом схожую с таблицей русского учёного, привёл кривую атомных объёмов, но свою работу закончил словами: «Было бы преждевременно на основании таких шатких опорных точек предпринять изменение общераспространённых сейчас атомных весов».
Прошло всего пять лет после публикации Менделеевым его периодического закона, и в Докладах Парижской академии наук появилась заметка об открытии нового элемента галлия с помощью того же спектрального метода. Узнав об этом, Менделеев тут же направил в академию письмо, где указал, что новый элемент не что иное, как предсказанный им экаалюминий. Сходилось всё вплоть до способа открытия.
Автор открытия Лекок де Буабодран узнал о существовании Менделеева только из его письма. Буабодран усомнился в правильности предсказания и склонен был отрицательно отнестись к нему, так как по его измерениям удельный вес нового металла выражался числом 4,7, тогда как Менделеев указал на 5,9–6,0. Менделеев снова отправил во Францию письмо и настойчиво посоветовал более тщательно очистить полученный металл от натрия, который использовался для восстановления. У французского исследователя второе письмо Менделеева вызвало недоумение и раздражение: кто в конце концов открыл новый элемент, он, Лекок де Буабодран, или этот петербургский Менделеев, ничего не имеющий в руках, кроме своей таблицы? И всё же он последовал совету Менделеева, провёл более тщательную очистку нового металла и был буквально потрясён: оказалось, что удельный вес галлия действительно равен 5,935. Из скептика Лекок де Буабодран превратился в горячего приверженца периодического закона. «Я полагаю, — писал он, — что нет нужды настаивать на исключительной важности подтверждения теоретических взглядов г. Менделеева относительно плотности нового элемента».
Это событие было оценено Ф.Энгельсом как научный подвиг Менделеева, подобный подвигу в астрономии Леверье, открывшему новую планету «на кончике пера».
Через пять лет шведский химик Л.Нильсон открыл ещё один элемент — скандий и указал в своём сообщении на полное совпадение свойств нового металла со свойствами предсказанного Менделеевым экабора. «Не остаётся никакого сомнения, — писал он в заключение, — что в скандии открыт экабор… так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование названного простого тела, но и наперёд дать его важнейшие свойства».
Прошло ещё несколько лет, и К.Винклер открыл новый элемент германий, который посчитал аналогом сурьмы. Отношение к периодическому закону было уже несколько иное, и к Винклеру с разных концов поступили письма, в которых указывалось, что он ошибся: новый элемент — аналог не сурьмы, а кремния. Об этом его извещал сам Менделеев из Петербурга, Л.Мейер из Тюбингена и В.Рихтер из Бреславля. Винклер всё перепроверил и написал восхищённо: «Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем оплотворение до сих пор предположительного экасилиция».
«Надо что-либо одно, — писал Менделеев в «Основах химии», — или считать периодический закон верным до конца и составляющим новое орудие химических знаний, или его отвергнуть».
После ряда его блестящих подтверждений отвергать закон было трудно, но и до полного его обоснования было тоже ещё далеко: физический смысл периодического закона стал ясен, когда учёные совершили прорыв в мир атома.
В сентябре 1886 г. Крукс выступил в Бирмингеме с речью «О происхождении химических элементов», в которой высказался в том духе, что атомы всех химических элементов последовательно образовались из первоначальной материи — протила. Эта речь возродила давний умозрительный спор о единстве мира, сведя его теперь к проблеме происхождения элементов и периодичности их свойств. По мнению К.А.Тимирязева, схема Крукса «дополняет менделеевскую систему в том отношении, что уясняет происхождение периодичности свойств участием второго фактора — электрического характера элементов, тогда как один фактор (атомный вес) для этого недостаточен». Природа химических сил оставалась неуловимой, а мысль об электрическом характере их высказывалась на протяжении всего XIX столетия.
Возврат к мысли о происхождении элементов из первоначальной материи, об их сложности сравним с подбрасыванием хвороста в затухающий костёр. Затухающим костром в данном случае была идея трансмутации. Как же относился к ней Менделеев? В 60-е гг., как мы уже отмечали, он относился к ней сочувственно. В одной из статей, написанной на тему о сельском хозяйстве, он писал: «Ни один химик не решится отрицать того, что один элемент может превращаться как-нибудь в другой элемент». С годами, после открытия периодического закона, Менделеев стал осторожен в таких высказываниях. Как-то А.М.Бутлеров подарил ему свою книгу «Основные понятия химии», в которой приводилось менделеевское же положение, высказанное в одной из статей по периодическому закону: «Если бы, значит, какой-нибудь из известных ныне элементов подвергся разложению, или образовался новый элемент, то это могло бы, пожалуй, сопровождаться убылью или возрастанием веса». Менделеев подчеркнул слова «Если бы, значит… подвергся разложению» и написал рядом: «Но ведь этого нет. Сказано лишь для ясности».
После заседания Физического общества, на котором обсуждалась речь Крукса, как вспоминает Тимирязев, Менделеев до поздней ночи спорил с ним и известным физиком А.Г.Столетовым. Этих учёных привлекла речь Крукса тем, что в ней проводилась «плодотворная идея об эволюции». Менделеев же протестовал против вывода, делаемого из его же периодического закона, и отстаивал «индивидуальность» каждого элемента. Истощив все свои возражения в споре с Тимирязевым и Столетовым, Менделеев начал горячиться и пустил в ход совсем уже не научный довод: «Александр Григорьевич, Климентий Аркадьевич! Помилосердствуйте! Ведь вы же сознаёте свою личность? Предоставьте же и Кобальту, и Никелю сохранить свою личность». После этого разговор быстро перевели на другую тему, дабы излишне не раздражать Менделеева; а вспоминалось участникам спора, что в начале 60-х гг. Менделеев вполне сочувствовал гипотезе Праута и даже как бы пожалел, что более точные цифры бельгийца Стаса принуждают от неё отказаться.
В первом издании «Основ химии» Менделеев писал: «Легко предположить, что атомы простых тел суть сложные существа, образованные сложением некоторых ещё меньших частей (ультиматов), что называемое нами неделимым (атом) — неделимо только обычными химическими силами… выставленная мной периодическая зависимость между свойствами и весом, по-видимому, подтверждает такое предчувствие…». Но уже тогда он записал в «Дневнике»: «Следовательно, всё сводится на элементы, всё учение химии состоит в учении о свойствах элементов: цель и задача — превратить один в другой — это будет дальше». Он искал свои «ультиматы» или «предводородные» элементы, полагая, что возможны элементы легче водорода, для чего изучал разреженные газы. Тогда он не получил желаемых результатов.
Такая «непоследовательность» великого учёного смущала не только его современников, но и последующих исследователей. Между тем, если вдуматься, она была вполне в духе времени. Наука о строении веществ напоминала тогда человека, готового принять крайне важное решение, но для этого ему не хватало фактов, а каких — он и сам ещё не знал.
Благородное семейство
В науке нередко так бывало, что одно замечательное открытие не всегда согласовывалось, а то и шло на первый взгляд вразрез с данными другого, не менее важного. Так и здесь: на торжествующий периодический закон отбрасывало чёрную тень… солнечное вещество — гелий. Его открыли раньше, чем Менделеев сформулировал закон. Сложилась неприятная ситуация: Менделеев не находил гелию места в таблице и не хотел признавать его. Выступая в Лондоне с лекцией о своих работах, Дмитрий Иванович с негодованием отозвался о «воображаемом гелии».
Менделеев никак не отрицал спектрального анализа, наоборот, он даже указывал, что такой-то элемент, вероятнее всего, будет обнаружен с помощью этого метода. Однако когда речь шла об открытии гелия, он говорил следующее: «Опыт ясно показывает изменчивость напряжённости света спектральных линий простых тел при различии температур и давлений, а потому можно думать, что линия гелия принадлежит одному из давно известных простых тел, поставленному в неизвестное для наших опытов состояние температуры, давления и напряжения тяжести». Доводы довольно веские: кто знает, как космические условия влияют на смещение спектральных линий.
В 70-е гг. один из первооткрывателей гелия, Локьер, напечатал статью «О спектрах звёзд и о природе элементов», в которой весьма убедительно предположил, что все элементы — это полимерные состояния водорода (никак не угасает гипотеза Праута: видно, в ней «что-то» есть!). Пришёл он к этому из следующего наблюдения: чем выше температура звезды, тем проще её спектр. Отсюда выводилось, что с понижением температуры из водорода образуются металлы, всё более и более тяжёлые, а затем появляются неметаллические элементы, после чего начинается соединение элементов. Известный французский учёный М.Бертло выступил на дискуссии в Парижской академии наук с критикой этих взглядов Локьера, хотя и признавал, что в космическом пространстве действуют иные силы, результатом чего атомы элементов изменяются не по тем законам, по которым изменяются сложные тела; но возможность превращения одних элементов в другие он не отрицал. В какой-то степени был прав и Менделеев: нельзя безоговорочно полагаться на спектральные линии, полученные от далёких светил. Сам он не дожил до такого подтверждения своей мысли. Лишь в 1927 г. был «закрыт» элемент небулий, после того как физик Боуэн показал, что давно наблюдаемые в спектре туманностей линии N1 и N2 принадлежат не какому-то новому элементу, а давно известному кислороду, находящемуся в совершенно необычных (по земным понятиям) условиях. Условия эти — крайняя степень разреженности и интенсивнейший поток ультрафиолетовых лучей.
Англичанину Джону Релею пришла в голову счастливая мысль — заново определить атомные веса. По всей видимости, родилась эта мысль из подозрения, что прежние вычисления неточны, и из пристрастия Релея к точнейшим измерениям. Он любил говорить: «Физика — это измерение». В 1893 г. он приступил к осуществлению своего замысла, пользуясь новейшими приборами, какими не располагали химики и физики середины столетия. Начал он с точного взвешивания различных газов, самых «ходовых» — водорода, кислорода и азота. В последнем случае учёный столкнулся с неожиданным результатом. Он взвешивал азот, полученный из разных веществ, и вес газа совпадал не всегда. Литр азота, добытого из воздуха, весил 1,2565 грамма, а полученного из аммиака — 1,2507 грамма. Естественно, что учёный прежде всего заподозрил самого себя, с досадой отметив: не чисто проведённый опыт! Проверив всё несколько раз, он получил тот же результат. Что же из этого следует? Поставить под сомнение закон постоянства состава? Тогда рухнет вся химия, несмотря на её блестящие достижения. Релей стал получать азот из разных веществ и взвешивать его. Окись азота, закись азота, азотнокислый аммоний, селитра, мочевина послужили ему сырьём для получения чистого азота. Во всех случаях он получил число 1,2507, лишь литр азота из воздуха весил больше на 6 миллиграммов. Релей послал письмо в лондонский научный журнал «Природа» и сообщил о той аномалии в весе, которую он обнаружил у «воздушного» азота. Письмо содержало обращение к учёным попытаться объяснить эту аномалию.
Никакого даже предположительного ответа на имя Релея от учёных не поступило. Тогда Релей рассказал о своих опытах приятелю, профессору химии Уильяму Рамзаю и предложил совместно поискать объяснение этого шестимиллиграммового привеса. Спорили они долго. Рамзай предположил, что «воздушный» азот утяжелён присутствием какого-то другого неизвестного газа. Стали рыться в книгах и журналах, перечитывать все статьи, где описывались опыты с воздухом, но ничего такого, что хотя бы намекнуло им на разгадку аномального привеса, не обнаружили.
Узнав о затруднениях Релея и Рамзая, физик Дж. Дьюар порекомендовал им обратить внимание на работы жившего за столетие до них химика Генри Кавендиша. Того самого затворника Кавендиша, о котором говорили, что он самый учёный из богатых и самый богатый из учёных. Того самого Кавендиша, который никогда не торопился публиковать свои работы, и они стали известны благодаря Максвеллу много и много позже, когда самого Кавендиша давно не было в живых. Максвелл, ознакомившись с работами Кавендиша, нашёл, что многие из них содержат ценнейшие сведения (а автор считал их малозначительными!) и организовал их публикацию.
У Рамзая была такая книга, и, просматривая её после рекомендации Дьюара, он натолкнулся на свою же карандашную пометку: «обратить внимание». В лабораторном журнале Кавендиша описывалось, как он с помощью электрической искры (на машине со стеклянным кругом) соединил в некотором объёме весь азот воздуха с кислородом и удалил образовавшиеся окислы, но с крохотным пузырьком газа так ничего поделать не мог. Этот остаток никак не хотел вступать в соединение. Релей и Рамзай решили проверить каждый у себя в лаборатории, не есть ли этот пузырёк в действительности не азот, а примесь какого-то неизвестного газа. Они договорились не выходить из лаборатории, пока не придут к тому или иному решению. Но оставаться без взаимной информации о ходе работ было выше их сил, и они ежедневно обменивались письмами, посланными с нарочными.
Каждый из них шёл своим путём. Релей просто повторил опыты Кавендиша, но, конечно, не со стеклянной машиной, а с новейшими приборами и в больших объёмах. Рамзай же стал насосом прогонять воздушный азот по трубочке с магнием; магний, естественно, соединился с азотом, но какое-то количество газа так и осталось в свободном состоянии. Пути разные, а к результату пришли одинаковому. Они получили новый газ, для которого придумали название «аргон», что означает «ленивый» или «недеятельный», так как он отказывался вступать с чем-либо в соединение.
Когда в августе 1894 г. Релей доложил в Оксфорде об открытии аргона, то, как и следовало ожидать, английские химики и физики проявили к его сообщению крайний скепсис. Но важно часто бывает не что доложить, а как доложить. Релей достиг эффекта с помощью курительных трубок. Он взял их 8 штук (они были из обожжённой глины), скрепил гуттаперчей и вставил в стеклянный сосуд, соединённый с воздушным насосом. Сосуд был заполнен воздухом, а конец трубок выходил в газометр. Прогнав несколько раз азот, полученный из воздуха, через свою установку, Релей взял из газометра пробу и взвесил её. Все увидели, что он тяжелее обычного азота на 10–12 процентов. «Почему, — обратился Релей к присутствующим, — азот после такой несложной операции, как прогонка через курительные трубки, становится тяжелее?» А потому, ответил он сам, что обожжённая глина — пористый материал, и через него азот просачивается в сосуд. Но в азоте воздуха содержится и другой газ, молекулы которого тяжелее молекул азота, поэтому им и затруднён проход через поры глины. Азот в трубках, таким образом, обогащается этим неизвестным газом, и получается наблюдаемый зрителями привес.
В начале 1895 г. лондонский химик Г.Майерс написал Рамзаю, что в одном из старых журналов он ранее читал статью геолога Хильдебранда, в которой сообщалось, что некоторые минералы при кипячении их в серной кислоте выделяют какой-то газ, не горючий и не поддерживающий горения. Сам Хильдебранд наблюдал выделение такого газа при кипячении клевеита — минерала, найденного в Норвегии известным полярным путешественником Норденшельдом. По всей вероятности, писал Майерс, выделяемый из клевеита газ представляет собой аргон.
Сообщение Майерса заинтересовало Рамзая, и он послал мальчика купить ему как можно больше клевеита. Тот добросовестно выполнил поручение, но во всех химических магазинах Лондона этого минерала набралось всего один грамм. Рамзай повторил опыт Хильдебранда и действительно получил несколько миллилитров газа. Четыре дня этот газ очищали от примесей, после чего заключили в трубочку для того, чтобы исследовать его спектр. Он озадачил Рамзая: линии спектра нового газа не совпадали с теми, что он наблюдал у аргона, добытого из воздуха. Особенно выделялась в спектре жёлтая линия, насторожившая учёного: не натрий ли это, случайно попавший в трубочку? Рамзай перепроверил себя, но жёлтая линия не исчезла. Он разобрал и собрав снова свой спектроскоп, полагая, что имеет дело с «привидением» — линией, появляющейся из-за неисправности прибора, — результат тот же. Выходит, это действительно натрий, но откуда он взялся? Тогда Рамзай наложил на загадочный спектр спектр натрия и получил жёлтую линию, расположенную рядом с уже имеющейся. Значит, жёлтая линия не принадлежит натрию, она принадлежит какому-то газу, но газ этот вовсе не аргон.
И вдруг Рамзая осенило. Да ведь это гелий — солнечное вещество Жансена и Локьера! За 30 минувших лет все уже свыклись с мыслью, что его местонахождение — атмосфера Солнца, и никто не попытался разыскать его на Земле. Трубочку с полученным газом Рамзай отправил Уильяму Круксу, по праву считавшемуся одним из лучших спектроскопистов, и попросил тщательно определить положение всех линий. Ничего о своих предположениях Рамзай Круксу не сообщил, написав только, что нашёл какой-то новый газ, предполагая назвать его криптоном (что по-гречески — скрытый). Ответ Крукса был краток, но до предельности выразителен: «Криптон — это гелий. Приезжайте — увидите. Крукс». Можно ли сомневаться в том, что Рамзай немедленно бросил всё и помчался посмотреть на пойманное им таинственное и манящее «солнечное вещество»?
В тот же день Рамзай послал краткое сообщение о своём открытии в Лондонское Королевское общество и написал письмо французскому химику Бертло.
Гелий обнаружен на Земле. 23 марта 1895 г. мир узнал об этом событии из публикации Рамзая. Прошло всего лишь полмесяца, и тот же Бертло получил послание от шведского химика Ланглэ, из которого следовало, что клевеит открыл свою тайну не только Рамзаю: Ланглэ тоже нашёл в нём гелий.
«Благородные» газы повели себя на первых порах совсем не благородно: кое-кому из химиков они внушили мысль, что поскольку им нет места в таблице Менделеева, то и у самого периодического закона нет права на жизнь. А Браунер и итальянские химики Р.Назини и А.Пиччини высказались в том смысле, что «бесполезны попытки применить к аргону и другим инертным элементам периодический закон, так как элементы эти лишены самого основного свойства, на котором построена вся система, — способности давать соединения, и не могут встать в такую классификацию, где основанием является именно форма соединения элементов».
Закон не отрицался, но для инертных газов делалось исключение: они ему «не подведомственны».
Всё это, конечно, волновало Менделеева, и в августе того же года он побывал в Англии и Франции, где беседовал о новых газах с Рамзаем, Бертло и другими учёными. О своей поездке он доложил на заседании Русского физико-химического общества. О гелии, который он ранее назвал «воображаемым», Менделеев сказал, что хотя о природе его известно мало достоверного, тем не менее он — нечто блистательное; спектр его ярок, оригинален, и можно только порадоваться, что удалось его открыть. Это о гелии, а об аргоне? «Нельзя отрицать, что с аргона началась новая эра в химии», однако «оба (Рамзай и Бертло. — Б.К.) говорят откровенно, что они решительно не знают, что такое аргон».
Рамзай на этот раз оказался более последовательным менделеевцем, чем Браунер, а может быть, и чем сам Менделеев. Он нисколько не сомневался в том, что аргон «даёт новое доказательство закона периодичности». Недаром впоследствии Менделеев «причислил его к лику укрепителей периодического закона», наравне с Буабодраном, Нильсоном, Винклером.
Рамзай не согласился с мнением Менделеева о том, что аргон — «конденсированный азот», и придерживался мысли, что он — смесь газов. Он энергично продолжал погоню за гелием, решив, что если этот элемент обнаружен в клевеите, то он должен присутствовать и в воздухе. Надо было как-то обойти затруднения, заключающиеся в том, что ни гелий, ни аргон нельзя с чем-то соединить, а стало быть, и разделить. Рамзай прибегнул к дробной перегонке: заморозил воздух до жидкого состояния (благо к тому времени была сконструирована нужная холодильная машина), после чего дал ему испариться, справедливо полагая, что это приведёт к разделению замороженного воздуха на составные части. Учёного поджидала неприятность: он упустил гелий, который испарился с воздухом, но тут же был «приятно разочарован», когда при спектральном анализе остатка увидел линии, принадлежащие аргону, и, кроме того, совершенно новые. Так был открыт новый благородный газ. Рамзай окрестил его именем, которое первоначально предназначалось гелию, — криптон. Гелий в воздухе он также нашёл, после чего в одной из публичных лекций отозвался об этом событии так: «Поиски гелия напоминают мне поиски очков, которые старый профессор ищет на ковре, на столе, под газетами — и находит у себя на носу. Гелий очень долго искали. А он был в воздухе!»
К этому времени были сконструированы более мощные холодильные машины, которые позволили Рамзаю открыть ещё два благородных газа — неон и ксенон.
Но по-прежнему ни для одного из инертных газов не находилось места в таблице Менделеева.
В начале 1900 г. бельгийский химик Эррера официально предложил выделить пять новых инертных газов в особую нулевую группу элементов. К такому мнению склонялись и Рамзай, и Крукс, и ряд других учёных. С этим согласился и Менделеев. В 1903 г. он констатировал: «Испытание было критическим как для периодической системы, так и для аналогов аргона. Оба новичка с блеском выдержали это испытание, т. е. атомные веса (по плотности), из опыта найденные для гелия и его аналогов, оказались прекрасно отвечающими периодической законности».
И тут нельзя не упомянуть о том, что задолго до того, как столь благополучно закончилось испытание периодического закона, в Шлиссельбургской крепости, этой мрачной темнице, куда русские цари прятали своих врагов и беззаветных борцов с самодержавием, учёный и революционер Н.А.Морозов пришёл к мысли о существовании группы инертных газов. Он предсказал даже их атомные веса, но об этом мир узнал, когда Морозов вышел на свободу и опубликовал книгу «Периодическая система строения вещества».
Итак, всё стало на свои места. Менделеев мог с полным правом впоследствии написать: «По-видимому, периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает… рамзаевские подтверждения всего многозначительнее». Предположение некоторых учёных о том, что первоначалом всех элементов является обнаруженный на Солнце гелий, было самым убедительным образом опровергнуто. Атомный вес водорода не превышал атомный вес гелия, наоборот, последний был в четыре раза тяжелее.
Приступ лучевой лихорадки
Химик «без знания физики подобен человеку, который всего искать должен ощупом. И сии две науки так созданы между собой, что одна без другой в совершенстве быть не могут».
Это слова великого русского ученого М.В.Ломоносова.
Химики нашли общий язык с физиками, по выражению известного современного учёного и писателя Айзека Азимова, ещё с первых представлений о существовании атомов вещества, т. е. начиная с Левкиппа и Демокрита. Но химия шла своим путём, физика — своим, их пути пересекались очень часто, и, когда это случалось, рождались новые идеи и открытия.
Химический конгресс в Карлсруэ был столь плодотворен именно потому, что химики согласились опереться на физическую теорию Авогадро.
Неоценимую помощь химическим исследованиям дал физический метод спектрального анализа.
Физические измерения теплоёмкости во многом помогли химикам в установлении атомных весов.
Химию и физику соединил в своих работах Фарадей. Таких примеров можно приводить очень много. Взаимопроникновение этих наук с течением времени всё увеличивалось, и это способствовало исключительно быстрому развитию представлений о веществе.
В 1803 г. на полках книжных лавок Петербурга появился труд профессора физики Медико-хирургической академии В.В.Петрова «Известия о гальвани-вольтовских опытах». Несмотря на то что содержание книги было чисто научным, её распространили в предельно короткие сроки. Историки науки уже в XX столетии могли с сожалением отметить, сколь несправедливо забыты заслуги замечательного русского учёного, предвосхитившего многие открытия, признанные потом эпохальными. Среди таких открытий были и электрическая дуга, и различные формы газового разряда. Как сообщал В.В.Петров, наблюдая «светоносные» явления в воздухе, он заинтересовался вопросом: «…может ли свет, которым часто сопровождается течение гальвани-вольтовской жидкости, оказываться в безвоздушном месте?»
Что с того, что на заре электротехники электрический ток понимался как «течение жидкости»? Важно, что и такие представления не помешали поставить замечательные опыты. Петров наблюдал, как мы сказали бы сейчас, электрический разряд в вакууме. Откачав воздух под стеклянным колпаком до 7-10 миллиметров ртутного столба, он увидел, как между электродами возникло «светоносное пламя… а иголка (один из электродов. — Б.К.) по всей длине оставалась раскалённой». Внимательно изучив это явление, Петров установил, что разряд «тем сильнее становился, чем чище был вытягиваемый воздух из колокола». Спустя три десятка лет, ничего не зная об опытах Петрова, занялся изучением тех же вопросов Фарадей и пришёл к тем же выводам, что и русский академик: «Разрежение воздуха удивительно благоприятствует явлениям светящегося разряда».
Пропуская электрический ток через стеклянную трубку, в которую были вмонтированы электроды, Фарадей увидел, что при низком давлении у анода появляется фиолетовое свечение; светился и катод, но промежуток между ними оставался тёмным. Этот промежуток получил у других исследователей наименование «фарадеевого пространства».
Дальнейшему углублению в суть явления мешало отсутствие надлежащей технической базы. В частности, существующие в то время поршневые насосы не позволяли достигать достаточно высокой степени разрежения. Но это были временные трудности.
В 1856 г. боннский профессор Ю.Плюккер заказал небольшую стеклянную трубку для разреженных газов известному тогда стеклодуву Гейсслеру. Включив трубку в электрическую цепь, он, как и другие до него, наблюдал свечение и отклонение стрелки гальванометра. Но Гейсслер сконструировал и ртутный насос, с помощью которого можно было достигать в трубке значительно большего вакуума, чем ранее. Работая с трубкой Гейсслера последней конструкции, Плюккер увидел в ней уже не бледное свечение, а светящийся столб, который заполнил всё её пространство.
Что же так ярко и мощно светилось в трубке? Чтобы ответить на этот вопрос, учёные заполняли трубки разными газами и получали свечение различной окраски.
Предприимчивый стеклодув, заваленный заказами, расширил свою мастерскую и занялся производством трубок, которые приобрели широкую популярность под названием гейсслеровых. Огни цветной рекламы в современном городе — прямые потомки этих трубок. Явление очень красивое, но для тех времён совершенно необъяснимое.
Исследования разряда в разреженном газе предложили немецкие физики В.Гитторф (ученик Плюккера) и Е.Гольдштейн, англичанин К.Варлей и ряд других учёных. Больше всего ясности внёс, пожалуй, известный уже нам физик и химик Крукс.
В 1874 г. в Шеффилдском университете Крукс выступил с докладом на тему «Лучистая материя, или Четвёртое состояние вещества». Он продемонстрировал слушателям свечение в газоразрядной трубке, чем, надо сказать прямо, сначала разочаровал аудиторию, ибо всё это было ей уже известно. Однако со стороны Крукса такое начало было лишь подготовительной операцией к эффекту. Он по ходу опыта откачал воздух в трубке до одной тысячной атмосферного давления, усилил напряжение — и всё пространство ярко осветилось. Исследователь этим не ограничился: насос продолжал работать, откачивая остатки воздуха из трубки. И вдруг огненный столб погас, и лишь на стекле против катода осталось зеленоватое мерцающее пятно. Слушатели снова не были удовлетворены, ибо фосфоресценцию стекла при демонстрации эффекта в катодных трубках они наблюдали и ранее. Крукс это предвидел и, обращаясь к присутствующим, спросил примерно так: вы полагаете, что зеленоватое пятно — всего лишь остаточная фосфоресценция стекла? Никакого иного ответа, кроме утвердительного да, Крукс не ждал, естественно. И тогда он подключил к источнику тока такую же трубку, но с укреплённым внутри неё крестом, между катодом и противоположной стенкой трубки. Из трубки также откачали воздух, также погасло свечение и также осталось зеленоватое пятно на стекле, но на нём чётко вырисовался силуэт креста. Аудитория ахнула: было яснее ясного, что крест осветили какие-то лучи! Осветили, оставаясь невидимыми и распространяясь, как обычно, прямолинейно.
Успех опыта был потрясающе нагляден. Крукс подробно информировал слушателей о своих работах и высказал предположение лишь в конце своего доклада: от атомов отрываются частицы, они и есть вот эти невидимые лучи (Крукс назвал их катодными лучами). Можно представить, как было воспринято такое объяснение, когда и в химии, и в физике уже господствующим стало представление о неделимости атома. На голову Крукса посыпалось столько обвинений в научной ереси, ехидных замечаний, гневных выкриков, сожалений о том, что признанный учёный прельстился славой магов и впал в шарлатанство, — что всего трудно и перечесть.
Докладчику, столь блестяще продемонстрировавшему эффект креста, не дали даже продолжать объяснение. Полемика из зала, где Крукс продемонстрировал свой «шарлатанский» опыт, выплеснулась на страницы научных журналов.
Дело дошло до того, что Крукса публично обозвали сумасшедшим, и сделал это не кто иной, как знаменитый Г.Герц, блестящий учёный, которому человечество обязано открытием радиоволн.
Не будем упрекать знаменитого учёного за излишнюю горячность и некорректность, едва ли уместную в чисто научных спорах. Мысль, высказанная Круксом, действительно казалась чудовищной многим учёным его времени: можно ли подумать, что атом, неделимый атом, разваливается на части с помощью не таких уж сложных, можно сказать, «подручных» средств! Чем не «философский камень», с помощью которого алхимики и герметические философы мечтали превратить простой металл в золото!
Крукс не сдавался и не успокаивался, продолжал свои работы с разрядными трубками. Он показал, что катодные лучи действуют на фотографическую пластинку, отклоняются магнитом и даже, будучи сфокусированы на тонкую фольгу, могут нагреть её до красного каления. Особенно эффектен был опыт Крукса, показывающий, что катодные лучи могут оказать силовое воздействие. Внутри трубки по строго горизонтальным стеклянным направляющим от катода катилось тщательно сбалансированное миниатюрное колёсико с лопатками.
Почти два десятилетия без малого продолжался научный спор между английскими и немецкими физиками о природе катодных лучей. Читающая публика могла убедиться, что определение учёных как «людей ледяного спокойствия» слишком поспешно и далеко не всегда правильно. Видеманн, Гольдштейн, Герц ставили тончайшие эксперименты и опровергали Крукса, утверждая, что его «лучистая материя» не что иное, как определённый вид электромагнитных колебаний, подобных свету.
Их доказательства не всегда были достаточно убедительны. Так, Герц, чтобы опровергнуть Крукса и доказать световую природу катодных лучей, поставил следующий эксперимент. Он изготовил трубку из уранового стекла, которое может сильно фосфоресцировать, а на пути катодных лучей поместил листочки золотой фольги. Никакой тени в районе фосфоресцирующего пятна не было. Катодные лучи, сделал вывод Герц, свободно прошли через поры в металле, как лучи обычного света сквозь дырявую крышу. Однако этот вывод оказался поспешным. Когда на пути катодных лучей поместили пакет из нескольких листочков фольги, тени всё равно не было. Не в порах, видно, дело: смешно же предполагать, что пресловутые поры так удачно могли совпасть во всех листочках пакета. Тем более, что тень не появилась и тогда, когда использовалась фольга других металлов и сплавов.
В пользу мнения, что катодные лучи — это какие-то частицы, говорил и тот факт, что они имеют отрицательный заряд. Это со всей убедительностью показал французский физик Жан Перрен. В 1881 г. Герман Гельмгольц выступил на заседании лондонского Химического общества и, обращая внимание присутствующих на законы электролиза, открытые Фарадеем без малого полвека назад, выразился следующим образом: «…если принимать гипотезу о том, что простые вещества состоят из атомов, то неизбежно заключение: электрический ток состоит из элементарных вполне определённых частиц, которые можно рассматривать в качестве атомов электричества».
Эти слова, сказанные в другой, более ранний период, вряд ли произвели бы сильное впечатление. Теперь же, после стольких экспериментов с катодными лучами и бурных споров об их природе, к ним отнеслись с огромным вниманием. Теперь учёных уже не так занимала сама природа катодных лучей (к тому, что они — какие-то материальные частицы, склонялись многие), сколько интересовал вопрос, что они собой представляют — молекулы, атомы или что-то ещё?
Через пять лет после этого противник Крукса Гольдштейн, сторонник волновой природы катодных лучей, одержимый мыслью опровергнуть ересь англичанина, поставил опыт.
Он использовал разрядную трубку, не отличающуюся замысловатостью конструкции. В ней катод и анод располагались друг против друга, так что «лучистая материя» направлялась не на стенку трубки, а прямо на анод. Катод был просверлен в нескольких местах и располагался на некотором расстоянии от стенки трубки. Это был удивительный эксперимент — из тех, когда ищут одно, а находят нечто уже совсем неожиданное. Стекло трубки зафосфоресцировало в закатодном пространстве, противоположном тому, по которому распространялись катодные лучи, и только против отверстий в катоде.
Эти лучи — их назвали каналовыми — стали предметом такого же пристального внимания, какого сподобились лучи катодные. Было установлено, в частности, что каналовые лучи отклоняются магнитом, но в сторону, противоположную отклонению катодных лучей. И ещё, при одинаковых разрежениях в трубке катодные лучи в одинаковой степени отклонялись магнитом. Причём на величину отклонения не влиял ни газ, каким заполнялась трубка, ни материал самого катода. А вот каналовые лучи чутко реагировали на природу заполняющего трубку газа: отклонялись они одинаковым магнитным полем в разной степени. Напрашивался вывод, что катодные лучи — поток одинаковых отрицательно заряженных частиц, а каналовые — положительно заряжённых частиц, но различающиеся по величине заряда и массе, к тому же значительно превосходящие в любом случае массу первых.
Образование положительных каналовых, или, как их ещё называли, — анодных, закатодных, лучей можно было объяснить лишь действием катодных на атомы заполняющего трубку газа.
Открытие каналовых лучей родило предположение, что в атоме есть и положительно, и отрицательно заряжённые частицы.
Но не только физические эксперименты с разрядными трубками подрывали классические представления о неделимости атомов и вносили сумятицу в умонастроение учёных. И чисто химические исследования заставили о многом задуматься. Так, шведский учёный Сванте Аррениус, опираясь на работы Я.Г.Вант-Гоффа, В.Оствальда и других исследователей в области электропроводности растворов и осмоса (явления одностороннего проникновения растворителя в раствор через полупроницаемую перегородку), а также на законы электролиза, установленные Фарадеем, выступил с теорией электрической диссоциации. Согласно этой теории молекулы вещества в растворе распадаются на заряжённые частицы — ионы. О том, как эта теория была встречена в научных кругах, лучше всего, пожалуй, говорят такие факты. Непосредственный руководитель Аррениуса профессор Клеве, узнав о новых идеях своего ученика, высказался более чем определённо: «У вас новая теория? Это весьма интересно. Прощайте — мы больше не знакомы». А когда основные положения теории Аррениуса были опубликованы, английский профессор Армстронг сравнил её с давно отжившей теорией флогистона.
Однако предположение о «разложимости» атомов вещества получало всё новые и новые подтверждения.
В 1895 г. с катодными трубками много и сосредоточенно работал директор института в Вюрцбурге Вильгельм Конрад Рентген. Он обнаружил, что от разрядной трубки исходят какие-то лучи, способные проникать через непрозрачные предметы. Шесть недель провёл он в лаборатории, лихорадочно ставя опыт за опытом. Делиться ни своими наблюдениями, ни — тем более — выводами он не спешил, что вполне соответствовало его характеру учёного-экспериментатора. Когда его спросили, что он подумал, когда обнаружил свечение (фосфоресценцию) в темноте, он ответил: «Я не думал — я экспериментировал».
Решившись, наконец, обнародовать результаты своих исследований, Рентген назвал открытые им лучи X-лучами, давая тем самым понять, что они требуют ещё изучения, чтобы полностью установить их природу.
Новые лучи немедленно нашли себе практическое применение и стали притчей во языцех.
Что только не говорили и не писали о лучах Рентгена!
Сатирические журналы помещали карикатуры и стихи, в которых утверждали, что Рентген обладает мрачным юмором, предоставляя «влюблённым возможность любоваться костями и безносым черепом объекта своей любви».
Одна из лондонских фирм использовала поднявшийся вокруг нового открытия шум и стала рекламировать бельё, которое «предохраняло от проникновения страшных лучей».
Однажды в адрес Рентгена пришло письмо, в котором автор просил прислать ему несколько X-лучей и объяснить, как ими пользоваться: он хочет найти револьверную пулю, застрявшую у него в груди несколько лет назад. На это Рентген ответил в духе самой просьбы: он сообщил, что, к сожалению, у него нет запасов X-лучей, да и пересылка их — дело хлопотное, не лучше ли поступить проще — прислать ему грудную клетку…
В американском штате Нью-Джерси в 1896 г. некий конгрессмен внёс проект закона, запрещающий применение X-лучей… в театральных биноклях, дабы сохранить чистоту нравов.
Всё это, разумеется, не более чем курьёзы, но не настолько, чтобы от них просто отмахнуться. Они говорят о многом. Пожалуй, это один из тех первых случаев, когда научное открытие сразу же приобрело характер общественной сенсации. Наука становилась общественным явлением. Время, когда она жила сама по себе, оставалась в стороне от общественных потребностей, а её достижения — в сфере её собственных интересов, всё дальше и дальше уходило в прошлое.
X-лучи отличались от катодных: их не удавалось отклонять магнитным полем, и были они глубоко проникающими, хотя также оставались невидимыми и также вызывали свечение. Именно благодаря последним двум свойствам они могли быть открыты и ранее. Ученик Герца Ленард, за два года до Рентгена экспериментировавший с разрядными трубками, попросту не заметил X-лучей, хотя и имел с ними дело. Не заметил потому, что ставил опыты с определённой научной целью — развенчать гипотезу о том, что катодные лучи состоят из частиц. Впоследствии Ленард настоятельно добивался, чтобы его признали первооткрывателем X-лучей. Известный английский физик Г.Стокс заметил по этому поводу, что «Ленард, быть может, открыл рентгеновы лучи в своём мозгу, тогда как Рентген направил их в кости других людей». Озлобленный непризнанием Ленард через много лет стал изгонять «еврейскую физику» из университетов и научно-исследовательских институтов гитлеровской Германии, за что получил награду: фашистская академия наук переименовала лучи Рентгена в «лучи Ленарда».
Итак, открытие X-лучей произвело на научный мир ошеломляющее впечатление. Научные журналы наперебой высказывались об их свойствах, происхождении и, само собой разумеется, перспективах использования.
Многим казалось, что X-лучи — частный случай, что существует огромное количество разного рода излучений. Научные лаборатории Европы и Америки охватила «лучевая лихорадка». Занимались поисками новых лучей с необычными свойствами и большие учёные, и недоучки, и дилетанты, и, конечно, прожжённые шарлатаны. Если к средним векам следует отнести расцвет алхимии, то сейчас начался, с позволения сказать, своеобразный период «алфизики», продолжавшийся не столь уж малое время.
В 1903 г. на почве повышенного интереса к разного рода лучам конфуз случился не с кем-нибудь, а с учёным, членом французской Академии наук, главой физического отделения университета в городе Нанси профессором Блондло.
Он объявил об открытии N-лучей, которые якобы спонтанно, без внешнего воздействия, исходили от некоторых металлов и по многим своим свойствам превосходили лучи Рентгена. Между прочим, произошло это после того, как была уже известна радиоактивность. Поэтому сообщение Блондло было с доверием воспринято многими видными исследователями, в том числе и сыном Анри Беккереля — первооткрывателя уранового излучения. В десятках лабораторий занялись изучением N-лучей, и вскоре выяснилось: никаких таких N-лучей нет. Блондло ошибся, и установил это американец Роберт Вуд, побывавший в лаборатории Блондло, причём очень некстати: французскому учёному собирались выдать медаль и денежную премию на ежегодном заседании академии. Медаль и деньги профессору всё-таки вручили, но не за N-лучи, а «за долголетние труды в науке». На Блондло, которому казалось, что он видел и исследовал свои лучи, вся эта история так подействовала, что привела его к сумасшествию и смерти.
Словом, интерес к разного рода излучениям нарастал. Англичанин Дж. Дж. Томсон, который, кстати, мог бы тоже быть первооткрывателем X-лучей, доказал существование частицы — носителя электричества, предсказанной ранее Гельмгольцем и окрещённой ирландским физиком Стоуни электроном. 29 апреля 1897 г. — день заседания Лондонского Королевского общества, на котором Томсон сделал сообщение о своей работе, — стали считать днём рождения электрона, первой материальной частицы меньше атома. Это значит, что атом перестал быть последним «кирпичиком» материи, который, как считалось, ни измерить, ни разделить уже нельзя. Ну а поскольку, как выяснилось, в атоме есть частицы, несущие отрицательный заряд, то должны быть к другие частицы, которые уравновешивали бы суммарный заряд электронов: ведь атом в целом нейтрален.
Как же они там, в атоме, расположены?
Первым, кто попытался ответить на вопрос, был сам Дж. Дж. Томсон. Он писал: «Я представляю атом состоящим из большого числа микротел, которые я называю корпускулами, эти корпускулы равны между собой; масса корпускулы равна массе отрицательного иона в разреженном газе, т. е. приблизительно 3·10–26 г. В обычном атоме это собрание корпускул образует электрически нейтральную систему. Поскольку отдельные корпускулы аналогичны отрицательным ионам, следовательно, когда они собираются в нейтральный атом, отрицательные заряды уравновешиваются чем-то, имеющим положительный заряд, равный сумме зарядов отрицательно заряженных корпускул».
Это была первая модель атома.
Томсон видел несовершенство своей модели и говорил, что «каждое новое открытие не является пределом, дальше которого нельзя идти, а наоборот, служит проспектом, ведущим в новые, ещё не исследованные страны…». Однако при всём несовершенстве предложенная Томсоном модель обозначила собой крупный шаг теоретической физики. Можно сказать, что она была если не самим проспектом, то, бесспорно, его началом, первой смелой попыткой описать ту «неисследованную страну», тот мир, где за сравнительно короткий срок наука нашла принципиально новый источник энергии — энергии атома и атомного ядра.
Рождение предвестника в сарае мертвецов
Известный французский математик Анри Пуанкаре заинтересовался X-лучами и обратил внимание на то, что исходят они из того места трубки, куда ударяются катодные лучи и где возникает сильная фосфоресценция. Возможно, полагал Пуанкаре, что сама фосфоресценция и является источником X-лучей. Его предположение взялись проверять несколько французских физиков. 10 февраля 1896 г. Шарль Анри сообщил Парижской академии о своих опытах с сернистым цинком. Он заворачивал фотографическую пластинку в чёрную бумагу, после чего помещал на неё кусочек сернистого цинка и некоторое время освещал солнечными лучами. После проявления на пластинке чётко видны были тёмные пятна, полученные от проникающей через бумагу фосфоресценции сернистого цинка. Подобные эксперименты поставил и Нивенгловский, использовав не сернистый цинк, а сернистый кальций. Пятна на пластинке точно обрисовывали контуры фосфоресцирующих кристаллов. То же самое проделал член Парижской академии Трост и получил такие же результаты. «Выбросьте свои хрупкие стеклянные трубки Крукса, — поспешил заявить Трост. — Невидимые X-лучи можно получить всюду, где есть фосфоресцирующие вещества».
Беккерели шли по фосфоресцирующей тропе. Ещё летом 1835 г. Антуан Сезар Беккерель наблюдал сказочную картину свечения Адриатического моря в Венеции и с тех пор увлёкся проблемой фосфоресценции. Сын его Эдмонд, также профессор физики, стал работать с отцом в той же области. В 1857 г. он описал многие фосфоресцирующие вещества и оставил после себя большую сводную работу по этой проблеме. С 1872 г. он занялся изучением фосфоресцирующих свойств урана, и в этой работе помогал ему третий представитель рода Беккерелей — Анри, ставший членом Парижской академии наук в 36 лет.
По совету Пуанкаре Анри Беккерель занялся проверкой: не являются ли X-лучи свечением фосфоресцирующих веществ?
Первые опыты как будто подтверждали мысль Пуанкаре. Беккерель действительно получил неясные силуэты фосфоресцирующих веществ на проявленных фотопластинках. Но эти результаты его мало удовлетворили — то ли из-за нечёткости силуэтов, то ли потому, что он в глубине души не был убеждён в справедливости догадки Пуанкаре. Беккерель повторил опыт, взяв для этого соли урана, благо их было достаточно в полученной по наследству коллекции отца. Он ожидал, что соль урана, которая, как считалось, фосфоресцирует сильнее, даёт более чёткие силуэты. Однако проявленная пластинка едва потускнела. Тогда Беккерель всё проделал сначала, с той лишь разницей, что на пластинку, как всегда завёрнутую в чёрную бумагу, он положил металлическую фигурку, а на неё насыпал урановую соль. Снова всё это облучил солнечным светом и проявил пластинку. На ней он увидел отчётливый силуэт металлической фигурки. Что ж, Пуанкаре, выходит, прав — при фосфоресценции действительно излучаются X-лучи… Впрочем, при встрече с Пуанкаре Беккерель выразился несколько осторожнее — не X-лучи, а подобные им.
В конце февраля 1896 г. в Париже установилась плохая погода, и Беккерель не смог продолжить эксперимент. Полностью подготовленные к нему пластинки и соль урана он положил в ящик стола. Прошло два дня, снова выглянуло солнце, можно было начинать опыт. Очевидно, интуитивное побуждение к чистоте эксперимента заставило Беккереля проявить одну из пластинок, прежде чем освещать их солнечным светом. И вот первая неожиданность: урановая соль оставила на пластинке следы. Сразу вопрос: каким образом? Беккерель твёрдо знал, что урановая соль в темноте не фосфоресцировала. Первый вывод: по-видимому, соли урана совсем не обязательно выставлять на солнце, чтобы они испустили какие-то лучи, как и лучи Рентгена, свободно проникающие сквозь плотную чёрную бумагу. Именно так Беккерель высказался 2 марта 1896 г. по поводу своих наблюдений в Парижской академии наук. По его мнению, между фосфоресценцией и испусканием рентгеновских лучей никакой связи нет. Это второй очень важный вывод.
Случилось парадоксальное. Эксперименты, поставленные Беккерелем, должны были подтвердить гипотезу Пуанкаре, но полученные результаты похоронили её. Так в науке бывало нередко, и Беккерель, как настоящий учёный, поступил в полном соответствии с известным изречением древних: Платон мне друг, но истина дороже. Возражения со стороны других учёных были. Были и предостережения. Не рано ли, говорили ему, ниспровергать гипотезу Пуанкаре, ведь Шарль и Нивенгловский — серьёзные исследователи, их опыты с засвечиванием пластинок сернистыми соединениями кальция и цинка давали подобный же эффект.
Беккерель проверял всё снова и снова как свои, так и те результаты, что были получены другими учёными, и каждый раз убеждался, что только вещества, содержащие в себе уран, дают тот эффект, который он обнаружил 1 марта.
К этому времени другой французский учёный, Анри Муассан, нашёл способ выделения химически чистого металлического урана. Беккерель получил в своё распоряжение немного такого урана, и он окончательно похоронил гипотезу Пуанкаре. Чистый порошкообразный металлический уран излучал неведомые лучи ещё сильнее, нежели его соли, и без всякого влияния на то солнечного света.
Беккерель назвал это таинственное излучение урановым, а в научных кругах его часто называли лучами Беккереля.
Это уже — открытие.
Беккерель открыл явление, которое окончательно подорвало старое представление о неделимости атома и неизменности химических элементов, хотя он этого сам до конца не понял. И слово «радиоактивность», которое теперь знают все и которым обозначают открытое Беккерелем явление, произнёс не Беккерель.
Но Беккерель подошёл, бесспорно, к той черте, когда перед ним со всей очевидностью вставал вопрос: что же представляют собой открытые им лучи и какие ещё элементы, кроме урана, способны их испускать?
Заняться решением задачи он предложил молодому профессору Пьеру Кюри, частому гостю его лаборатории. Этим очень заинтересовалась супруга Кюри — Мария Склодовская, она и начала интенсивное исследование, вооружившись более совершенной методикой, разработанной её мужем. Поиски Марии Склодовской-Кюри увенчались успехом, она установила, по её собственным словам, что «излучение соединений урана можно точно измерить в определённых условиях и что это излучение есть свойство атомов элемента урана; интенсивность излучения пропорциональна количеству урана, заключённому в соединении, и не зависит ни от рода химического соединения, ни от внешних условий, каковы, например, освещение или температура».
Это крайне редкое и загадочное свойство атомов некоторых элементов по предложению Марии Кюри было названо радиоактивностью (от слова «радиус», что значит «луч»). Случилось это в 1898 г. Запомним эту дату — ещё одну важную дату в цепи великих, славных и трагических открытий, которых мы коснёмся, однако, лишь в той мере, в какой это нам нужно для сюжета.
Нет пророка в отечестве своём. Когда на ежегодном заседании Парижской академии наук её президент Корню доложил собранию о наиболее значительных работах за истекший период, он исключительный интерес проявил к работам Рентгена и почти ничего не упомянул о Беккереле. Анри Пуанкаре, гипотезу которого Беккерель, выражаясь современным языком, «зарезал», заметил по этому поводу, что прекрасному физику Корню, видимо, изменила объективность. Сам Пуанкаре писал, что Беккерель «добавил новые лучи к славе своей династии». Пуанкаре показал себя в этой ситуации как настоящий рыцарь науки.
Можно слегка и оправдать президента академии тем, что не сразу выявилась особенность уранового излучения, его отличие от физических процессов, получаемых с помощью разрядной трубки.
В апреле 1898 г. Мария Склодовская-Кюри доложила академии о том, что существует не только урановое, но и ториевое излучение. Она не считала исчерпывающими все возможности своего поиска и продолжала долгую и кропотливую работу. Пьер Кюри оставил занимавшие его проблемы пьезоэлектричества и включился в работы жены. Научные лаборатории мира были взволнованы первыми результатами французских учёных и, как могли, старались помочь супругам Кюри. Одна из лабораторий предоставила им чистые соли и окислы, минералогическая коллекция музея выделила образцы самых разнообразных минералов. Анри Муассан дал чистый уран, от известного химика Эжена Демарсе поступили окислы редких и редкоземельных элементов. Всё опробовали Пьер и Мария Кюри, но, кроме тория и урана, ни один элемент не сигнализировал им своим излучением. И тут они натолкнулись на необъяснимое явление: два урановых минерала давали более интенсивное излучение, чем чистый уран. Возникло подозрение, что в минералах содержится примесь какого-то неизвестного элемента, более активного, чем уран. О влиянии примесей на фосфоресценцию, чем первоначально считалась радиоактивность, говорил ранее Пьеру Кюри Беккерель, когда предлагал поработать с урановым излучением: «Пьер, ведь вы физик и химик одновременно, проверьте, не имеется ли в этих излучающих телах примесей, играющих особенную роль». С этого, пожалуй, и началась работа Кюри с «беккерелевыми лучами», но лишь сейчас оправдались надежды самого Беккереля, хотя он имел в виду нечто другое.
Но предположение предположением, оно может и не оправдаться. Для проверки решили приготовить искусственный хальколит (так назывался один из минералов) с таким же составом, как у естественного. Замер его активности показал, что она во много раз ниже, чем у природного минерала. Пример исследования, когда отрицательный результат приводит исследователя к самым радужным надеждам.
Когда сорбонский профессор Г.Липпман информировал академию о статье М.Кюри, где высказывалось убеждение в том, что урановая руда содержит в себе неизвестный элемент, восторга такое сообщение не вызвало. Наоборот, сразу было заподозрено, что эксперимент проведён не в достаточной мере чисто и точно. Марию и Пьера Кюри, увлечённых поисками нового элемента, этот скепсис только подстегнул. Они были так убеждены в своей правоте, что уже и имя придумали таинственному пока незнакомцу — полоний. Им было очень трудно: явно не хватало опыта и знаний по методике разделения элементов, приходилось то и дело обращаться за помощью к специалистам. Тем не менее «поиски иголки в стоге сена» завершились успехом гораздо большего масштаба, чем ожидали. В июле 1898 г. они сделали сообщение об открытии нового элемента полония, а в декабре того же года известили о другом элементе — радии, интенсивность излучения которого в несколько сотен раз превосходила урановое.
Однако почему искали один элемент, а нашли два, и кто же в действительности из них первый — радий или полоний? При растворении урановой руды и последующим осаждением находящихся в растворе солей обнаружилось, что и осадок и фильтрат радиоактивны. Это дало основание подозревать, что в руде находятся два новых элемента. Последующее фракционное разделение полностью подтвердило это. Полоний соосаждался с висмутом, радий с барием. Хотя сообщение о полонии было сделано ранее, выделить его, пусть даже в виде чистых солей, оказалось значительно труднее, а без этого нечего было и рассчитывать на его признание. Радий отделялся гораздо легче, и на этом были сосредоточены все усилия Кюри.
Существование радия подтверждено было первоначально Э.Демарсе: в спектре концентрированного бариевого образца, с которым работали затем супруги Кюри, он обнаружил в ультрафиолетовой области новую линию. Это очень важное свидетельство, поскольку спектр элемента почитался такой же индивидуальной характеристикой элемента, как и его атомный вес.
Но хотя этой характеристики и было достаточно для признания радия, важно было знать также его атомный вес и химические свойства. В известной степени это обстоятельство и укрепило желание супругов Кюри проделать ту — без преувеличения — титаническую работу, которая вызвала потом восхищение во всём мире и которой посвящено немало ярких страниц в научной, научно-популярной литературе и публицистике. Благодаря ходатайству Парижской академии наук и поддержке Венской удалось от австрийского правительства получить несколько тонн отходов от переработки урановой руды в Богемии. Когда этот хлам, перемешанный с хвоей, был доставлен на тяжёлой подводе, Кюри обрадовались ему, как величайшему сокровищу. Да он и заключал в себе сокровище, только добыть его предстояло каторжным трудом. Старый заброшенный сарай — образец неудобства, настоящий холодильник, в котором двум (всего только двум!) французским учёным пришлось перерабатывать тонны отходов урановой руды в течение сорока пяти месяцев, стал таким же героем эпопеи, как и сами исследователи. Редко, однако, упоминается, что это был за сарай и почему у него была стеклянная крыша. В этом помещении когда-то помещали трупы и проводили анатомические вскрытия. Оно было совершенно заброшенным, поэтому его без дальних проволочек отдали в распоряжение Пьера Кюри. В мрачном обиталище мертвецов долго и мучительно рождался младенец, которому вскоре предстояло перевернуть устоявшиеся понятия в науке, открыть новую эру физики.
Скептически настроенные химики не отступали от принципа: «Покажите нам радий — и мы поверим!»
Требование химиков было выполнено супругами Кюри уже после того, как XIX век уступил место XX.
И вот итог этой неустанной работы, львиная доля которой выполнена Пьером и Марией Кюри.
«Работы, сделанные в то время нами и некоторыми другими учёными, — писала впоследствии М.Склодовская-Кюри, — выясняли главным образом свойства лучей, испускаемых радием, и доказывали, что эти лучи принадлежат к трём различным категориям. Радий испускает поток частиц, обладающих большими скоростями; некоторые из них имеют положительный заряд и образуют альфа-лучи; другие обладают отрицательным зарядом и образуют бета-лучи. Эти две группы при своём полёте отклоняются магнитом. Третья группа состоит из гамма-лучей, нечувствительных к действию магнита и, как теперь известно, являющихся излучением, сходным со светом и рентгеновскими лучами».
Прочитав это, мы невольно вспоминаем споры вокруг катодных лучей, открытие каналовых лучей и гипотезу Пуанкаре о связи фосфоресценции с испусканием лучей Рентгена… Какими извилистыми тропами шла мысль учёных к истине, которая спустя некоторое время становилась бесспорной и самоочевидной!
Как и Беккерель, супруги Кюри, получившие выдающиеся результаты при изучении явления радиоактивности, не смогли увидеть в этом явлении всего того, что увидели последующие поколения исследователей, что, конечно, никоим образом не умаляет их великого вклада в науку. Просто каждому — своё.
Но уже тогда Пьер и Мария Кюри предвидели общественную и социальную опасность, таящуюся в том явлении, которое они изучали. В Нобелевском докладе (Нобелевская премия супругам Кюри и Беккерелю была присуждена в 1903 г.) Пьер Кюри писал: «Можно думать, что в преступных руках радий способен быть очень опасным, и можно в связи с этим спросить себя: выиграет ли человечество от познания тайн природы, достаточно ли человечество созрело, чтобы извлекать из него пользу, или же это познание принесёт ему вред?»
Д.И.Менделеев сообщение об открытиях супругов Кюри получил от своего ученика варшавского химика И.Г.Богуского, двоюродного брата Марии. Оно не могло не заинтересовать великого учёного.
Новые элементы — каковы их свойства, где им место в таблице? Само явление радиоактивности заставило Менделеева, как и весь учёный мир того времени, глубоко задуматься.
В 1902 г. Менделеев отправился в научную командировку во Францию; конечно, он побывал и у Беккереля, и у Кюри, чтобы убедиться самому во всём том, о чём так много говорят и пишут. Он записал тогда: «Всё, что можно, радиоактивное видел». В письме Винклеру Дмитрий Иванович очень осторожно высказался о природе радиоактивности: «Что же касается до той Вашей мысли, что радиоактивность есть следствие некоторых физико-химических отношений вроде магнетизма, а не определяется одною химическою природой радия, то я справедливость её вполне разделяю, пока не явится что-либо более убедительное, чем современные опыты».
Точно так же он в то время относился и к явлению трансмутации, которое, по его мнению, «ни разу ещё не доказано с достаточной убедительностью». Откуда берётся энергия для того, чтобы вырвать заряженные частицы из нейтрального атома? На этот вопрос не было ответа.
Первые шаги новых алхимиков
Радиоактивными элементами оказались не только уран и торий, но и только что открытые полоний и радий. Затем был обнаружен и ещё один радиоактивный элемент — актиний.
Изучением радиоактивности, как и следовало ожидать, помимо Беккереля и супругов Кюри, занялись многие учёные. Увлекла эта тема и выдающегося физика новозеландца Эрнста Резерфорда.
В 1892 г. Резерфорд был ещё студентом-третьекурсником, когда в научно-студенческом обществе выступил с докладом, который назывался «Эволюция элементов». Точный текст доклада не сохранился, однако уже название говорит само за себя. Надо сказать прямо: для подобного взгляда физика тогда ещё не созрела — никаких фактических данных, чтобы рассматривать известные науке элементы с точки зрения их эволюции, не было. Студент Резерфорд проявил незаурядную смелость, очевидно, основательно подогретую идеями Крукса.
Доклад встретили с нескрываемой иронией, пылкому студенту пришлось спуститься с небес на землю и признаться в том, что он «зашёл слишком далеко».
В 1895 г. молодой провинциальный учёный Эрнст Резерфорд прибыл из далёкой Новой Зеландии в Кембридж к директору знаменитой Кавендишской лаборатории Дж. Дж. Томсону. Он попал туда в удачное время, ибо Томсон как раз задумал «мощное наступление» на малоисследованные проблемы физики и нуждался в молодых и энергичных помощниках. Сам Томсон был занят изучением электрических разрядов в газах. Катодные, каналовые, рентгеновские лучи стали объектом его пристального внимания.
Славная плеяда молодых учёных собралась вокруг Дж. Дж. Томсона. Таунсенд, Релей-младший, Вильсон и целый ряд других, ставших впоследствии выдающимися физиками. Знаменитый французский учёный Поль Ланжевен в тот период был совсем молод, он с упоением погрузился в работу, предложенную Томсоном, и тогда же началась для него подготовка к известной докторской диссертации «Исследования в области ионизации газов».
И всё же самым видным, энергичным, нетерпеливым среди них следует считать Эрнста Резерфорда, говорившего иногда: «Ионы — это весёлые малыши, вы можете наблюдать их едва ли не воочию».
Сказать, что весь учёный мир был тогда в восторге от открытия электрона, было бы слишком необоснованным заявлением. Большинство физиков твёрдо держалось понятия неделимости атома. Как ни странно, наиболее упорным в своих убеждениях оказался знаменитый Рентген. Он в своей лаборатории просто запрещал произносить слово «электрон» и отрицал его существование в течение целых десяти лет. Лишь в 1907 г., когда научные открытия, связанные с представлениями о сложной структуре атома, следовали одно за другим, Рентген позволил уговорить себя своему ассистенту из России А.Ф.Иоффе и разрешил пользоваться понятием «электрон».
На Кавендишскую лабораторию сильное впечатление произвело известие о работах А.Беккереля, и Резерфорд решил немедленно заняться изучением урановых лучей. Он потратил на это целый год и тоже пришёл к заключению, что к лучам Рентгена они никакого отношения не имеют. Мы сейчас хорошо знаем, что рентгеновские лучи как вид электромагнитных колебаний могут иметь большую или меньшую проникающую способность в зависимости от частоты колебаний и длины волны. В те времена также уже различали «жёсткие» и «мягкие» X-лучи, хотя и пошучивали, говоря, что их проникающая способность целиком зависит от Эбенизера Эверетта — искуснейшего стеклодува, изготовителя разрядных трубок.
Резерфорд один из первых установил, что урановые лучи неоднородны. Помещая на пути этих лучей листочки алюминиевой фольги, он наблюдал по электрометру, как ослабевал ток, возникающий под влиянием радиации. Четыре листочка уменьшали ток в двадцать раз по сравнению с исходным, но дальнейшее прибавление их почти не влияло на стрелку электрометра, которая никак не хотела вернуться в исходное положение; лишь сотый листок уменьшил этот «застывший» на определённом уровне ток вдвое. Так было выяснено, что излучение урана состоит из двух компонентов: порождающего сильную ионизацию, но сильно поглощающегося веществом, и создающего менее заметную ионизацию, но обладающего гораздо большей проникающей способностью. Так были открыты альфа- и бета-лучи. Разделение их с помощью магнита было осуществлено позднее.
В разгар работы Резерфорда в печати появилось научное сообщение М.Кюри «О лучах, испускаемых соединениями урана и тория». По рекомендации Дж. Дж. Томсона Резерфорду была предоставлена возможность занять должность профессора физики в Мак-Гиллском университете в Монреале. Молодой учёный расстался с друзьями по Кавендишской лаборатории и отправился за океан — в Канаду. Там он немедленно стал продолжать исследования уранового излучения.
Его коллега, профессор электротехники Б.Р.Оуэнс, тоже заинтересовался этим и попросил Резерфорда указать, с чего ему начать. Резерфорд, не колеблясь, ответил: с тория.
Радиоактивность этого элемента была совершенно неизученной областью; кроме того, что она существует, о ней ничего не было известно. Правда, Беккерель, наблюдая ториевое излучение, отмечал любопытное отличие его от уранового. Если последнее в течение двух лет было неизменным, то первое меняло свою интенсивность по самым, можно сказать, пустяковым причинам, вплоть до чихания ассистента или хлопанья лабораторной двери. Беккерель, конечно, мог и ошибиться, но если всё точно, то такое непостоянство излучения может дать ключ к пониманию радиоактивных явлений.
Так рассуждал Резерфорд, предлагая Оуэнсу обратить самое серьёзное внимание на торий.
Правота Беккереля в опытах Оуэнса подтвердилась самым неожиданным образом. Кафедра физики Мак-Гиллского университета была основана на средства чудака-миллионера Макдональда, который и в дальнейшем подбрасывал ей значительные суммы. Это был табачный король, не выносивший табачного дыма, в его присутствии никто не курил. Однажды он неожиданно посетил университет, и Резерфорд ворвался в подвальное помещение, где работал Оуэнс, с криком: «Настежь окна, уберите трубки! Живей пошевеливайтесь: Макдональд обходит лаборатории!» Требование было выполнено с предельной поспешностью, и сквозняк вымел весь табачный дым. Но когда Оуэнс снова сел измерять активность тория, то обнаружил, что она резко упала. Выходило, что интенсивность ториевой радиации зависела от движения воздуха. Говорят, Резерфорд поздравил Оуэнса с тем, что непонятное стало ещё непонятней. Дальнейшие опыты показали, что «в безветрии» радиация восстанавливала свою интенсивность.
Оуэнс уехал в Англию, и Резерфорд уже без него пытался разрешить загадку тория. По проведённым наблюдениям из тория что-то выделялось радиоактивное, и его, как это ни странно, можно самым примитивным образом сдуть. Что это — пар, пыль или ещё что-то? Неизвестно, а пока Резерфорд дал ему имя «эманация», заимствуя это слово из лексикона мистиков, где оно означает — «выделение», что, конечно, никак не свидетельствует о склонности Резерфорда к мистике. Физики умели, оказывается, шутить и раньше…
Загадочную эманацию учёный пропустил через фильтр из стеклянной ваты, — приём, которым он пользовался ещё в Кавендишской лаборатории. Интенсивность радиации не изменилась. Это говорило о том, что эманация — не пылинки и не ионы, так как первые задерживались фильтром, а вторые прилипали к стенкам стекла. Не исключалась возможность, что эманация — просто пары тория. Однако прогоняя воздух с эманацией через крепкую серную кислоту, Резерфорд убедился, что и пары тут не при чём: если бы это были пары, они обязательно бы вступили в реакцию с кислотой, отдав ей свою радиоактивность и освободив от неё воздух. Между тем кислота оставалась не радиоактивной, а воздух — да. Новый газ? Новый элемент? Можно было ожидать такого же триумфа, какой был у Рамзая при открытии благородных газов. Следовало немедленно воспользоваться методом, который не раз уже с успехом сыграл роль непогрешимого разведчика, — спектральным анализом. К сожалению, в Монреале не было опытного спектроскописта, а посылать трубочку с газом в Англию было совершенно бессмысленно: пока она переплывала бы океан, газ утратил бы радиоактивность — это Резерфорд твёрдо знал. Надо было найти какой-то другой путь, чтобы убедить исследователей в том, что эманация — это новый благородный газ, дополняющий группу, открытую Рамзаем. И Резерфорд попытался это сделать с помощью старой машины Линде, переведя газ в жидкое состояние. Но машина давала только минус 100 °C, а этого оказалось мало. Пришлось искать более совершенную холодильную машину, дававшую минус 200 °C. Когда газ, наконец, удалось ожижить, физики признали, что эманация — это действительно благородный газ. Назвали его тороном.
Всему этому предшествовало одно очень любопытное наблюдение. Предметы, которых касалась эманация тория, становились радиоактивными. Резерфорд поторопился обозначить новое явление термином «возбуждённая радиоактивность», но вскоре сам же понял, что поступил слишком неосмотрительно, ибо не было никакого «возбуждения», а просто появлялся какой-то новый излучатель. Это было вещество, порождаемое эманацией и осаждающееся на самых различных материалах. Резерфорду долго не удавалось отделить это вещество от предмета, на котором оно осело. Наконец дело завершилось успехом. Вся радиоактивность с платиновой проволочки была переведена в раствор с разбавленной кислотой. Выпарив такой раствор на песчаной бане, Резерфорд получил сухой остаток, продолжавший интенсивно излучать. Излучение это не было постоянным, со временем оно ослабевало, но в 660 раз медленнее, чем у эманации.
Через некоторое время в Докладах Парижской академии появилась статья супругов Кюри, в которой они сообщали, что радий и полоний возбуждают радиоактивность в окружающих предметах. Французские учёные назвали это явление «индуцированной радиоактивностью» и объяснили его как фосфоресценцию. Резерфорд, ознакомившись с статьёй, увидел сразу, что речь идёт об одном и том же явлении, что Кюри заблуждаются так же, как заблуждался и он сам. Он отправил в Европу письмо.
Но что же было у Кюри? Впоследствии выяснилось, что радий, как и торий, порождает газ, также радиоактивный — он-то и был причиной «индуцированной радиоактивности», так как, в свою очередь, порождал новый излучатель. Эта эманация радия получила имя радон. По своим химическим свойствам он не отличался от торона и должен был занять клетку в столбце благородных газов, но по атомному весу эти элементы несколько различались.
Судьба свела Резерфорда с талантливым и энергичным молодым химиком Фредериком Содди, только что окончившим Оксфордский университет. Ему было всего 22 года. С пылкой юношеской страстью он настаивал, что строение материи — это область химии, а не физики. С такой же прямотой он провозгласил свою приверженность к алхимическим взглядам и утверждал, нисколько не смущаясь: «Очень мало может быть узнано о строении материи, пока не будет совершено превращение элементов. Сегодня, как и всегда, это реальная цель химика».
Вспомним, что и сам Резерфорд в молодости не был чужд этой идеи, хотя и вынужден был потом признать, что зашёл слишком далеко.
Совместная работа этих учёных дала замечательные результаты. Однажды Содди удалось отделить от тория какую-то примесь, рождавшую, как оказалось, эманацию. Очевидно, не сам торий, а именно эти примеси ответственны за образование радиоактивного газа. Однако при проверке было установлено, что и очищенный торий также давал эманацию. Это было удивительно! И вдруг они узнали, что ещё годом раньше с подобным явлением столкнулся Крукс, экспериментировавший не с торием, а с ураном. Будучи прекрасным химиком, он очистил урановый препарат и также отделил какую-то излучавшую примесь. Исследовав её химические свойства, Крукс убедился, что это не радий и не полоний. Зато уран, очищенный от примеси, перестал излучать. Беккерель, первооткрыватель уранового излучения, тотчас повторил опыты Крукса и получил те же результаты, но очищенный и переставший излучать уран он сохранил и проверил на радиоактивность спустя несколько месяцев. Результат был ошеломляющим: радиоактивность полностью восстановилась! Между тем Крукс сумел выделить новое вещество и дал ему имя — уран-X. Беккерель с удивлением обнаружил, что в то время, как радиоактивность чистого урана восстановилась, у второго она исчезла.
Резерфорд и Содди по аналогии с ураном-X Крукса выделенное ими вещество назвали торий-X.
А некоторое время спустя о наблюдениях Беккереля им сообщил сам Крукс. Это заставило их немедленно взяться за работу, чтобы выяснить, не восстанавливается ли утраченная радиоактивность у тория. Да, очищенный торий вёл себя так же, как и очищенный уран, — то терял радиоактивность, то снова её приобретал. Постепенно вырисовывалась картина: торий, излучая, рождает торий-X, а последний — эманацию. Если в целом интенсивность излучения остаётся постоянной, то это потому что торий-X со временем распадается, однако запас его постоянно пополняется. Это было смелым, для того времени почти невероятным предположением. Но исследователи уже имели возможность измерять и взвешивать полученные вещества, хотя и было их крайне мало. Ими давно было установлено, за какое время наполовину снижается интенсивность излучения этих веществ, а это можно было сопоставить с их общей массой. Они решили проверить себя химическим путём. По закономерности спада интенсивности радиации они рассчитали, сколько должно образоваться тория-X из неактивного очищенного тория через определённые промежутки времени, и опыт блестяще подтвердил их расчёты. Ошеломлённый Содди воскликнул: «Резерфорд! Это превращение элементов!» Шеф и сам был в восторге, но опыт есть опыт: «Ради святого Майка, Содди, не называйте это трансмутацией! Они снимут нам головы, как алхимикам. Вы же знаете их».
Резерфорд знал, что говорил: на заседании Макгиллского физического общества, где он изложил теорию самопроизвольного превращения элементов, монреальские учёные настойчиво рекомендовали докладчику воздержаться от публикации статей на такую тему. Они опасались полного их провала и дискредитации Мак-Гиллского университета. Один за другим выступали коллеги, советуя Резерфорду быть осмотрительным, осторожным в выводах, тщательным в проверке и перепроверке данных. Резерфорд не выдержал и закатил такую ответную речь, о которой благожелательно к нему настроенный профессор Н.Шоу выразился очень сдержанно: «Его ответная жаркая речь была не совсем удачной…»
Разразившуюся бурю успокоил профессор Джон Кокс. Он мягко и спокойно внёс необходимые разъяснения и дал понять аудитории, что за честь Мак-Гиллского университета едва ли есть основания беспокоиться; наоборот, работы Резерфорда ещё принесут Мак-Гиллу мировую славу, настанет день, когда экспериментальные исследования этого учёного будут рассматриваться, как величайшие со времён Фарадея.
Фарадей — не это ли имя вдохновляло герметических философов XIX столетия?
Работы Резерфорда и Содди по «теории дезинтеграции материи» были опубликованы в Европе в солидном научном журнале и стали предметом жаркого обсуждения.
Содди навсегда уехал в Англию с намерением работать в лаборатории знаменитого Рамзая. Резерфорд же собирался поехать в Европу в отпуск. К тому времени европейская пресса была полна сообщениями о канадских работах по радиоактивности и о трансмутации. Даже юмористические журналы взяли эту тему на вооружение. Секретарь Лондонского Королевского общества Д.Лармор, узнав, что Резерфорд намерен побывать в Европе, написал ему: «Вы будете львом сезона для газет, которые стали радиоактивными». Так оно и случилось в широких слоях общества, в журналистике, но пока ещё не в учёном мире. У последнего необходимо было ещё завоевать признание. В Саутспорте на конгрессе Британской ассоциации содействия развитию науки Резерфорд открыл дискуссию об эманациях радия и тория. Он пытался убедить аудиторию в том, что «теория дезинтеграции материи» объясняет необычайный феномен. В дискуссии принял участие видный учёный того времени сэр Оливер Лодж и зачитал послание отсутствующего знаменитого физика лорда Кельвина. Лорд Кельвин предупреждал членов ассоциации, чтобы они не слишком полагались на новые теории мистера Резерфорда. Давалось понять, что выводы его ошибочны, что трансмутация — плод воображения, а радиоактивные излучения — радиевые пары или, возможно, молекулярная пыль бромида радия. Зал разразился аплодисментами, и Резерфорд почувствовал, что трудно будет ему противостоять мнению такого авторитета, как лорд Кельвин, знаниям и опыту которого безоговорочно верили два поколения физиков. Президент Химического общества Англии Генри Армстронг после зачтения письма Кельвина сказал с нескрываемой иронией: «Я был поражён подвигами воображения мистера Резерфорда». Он выражал удивление по поводу того, что, оказывается, существуют атомы, одержимые «неизлечимой манией самоубийства», и «считал своим долгом» сообщить аудитории, что «у химиков, конечно, нет никаких доказательств распада атомов на земле».
Резерфорд, как известно, не отличался сдержанностью, но монреальский погром пошёл ему на пользу. Он взял на вооружение выдержку и спокойствие Джона Кокса — можно представить себе, чего это ему стоило. Не выдержал Содди. Он с таким неистовством и язвительностью накинулся на Армстронга, на всех, кто не хотел слушать аргументов, что председательствующий лишил его слова. Здесь он проявил себя настоящим «каустиком Содди», как было потом скаламбурено о нём в юмористическом журнале.
Резерфорд на этот раз держался с исключительным хладнокровием и твёрдостью. Он подробно разбирал факты и давал им оценку, предлагал найти другое объяснение. Ничего серьёзного его оппоненты не могли ему противопоставить.
Драма Рамзая и природная трансмутация
Замечательное открытие Уильяма Рамзая — гелий на Земле! — оставило после себя загадку. Благородство «солнечного вещества» установлено со всей несомненностью, но откуда он в клевеите взялся — ведь в химическом составе этого минерала он «не значился»? Удовлетворительного ответа на вопрос долгое время не было.
Фредерик Содди с большим интересом следил за всеми работами Рамзая по инертным газам. С весны 1903 г. Содди стал работать в лаборатории Рамзая. Здесь он продолжил исследования, начатые ещё в Мак-Гилле. После долгих и «придирчивых» экспериментов Рамзай, непререкаемый авторитет в области инертных газов, мог с удовлетворением подтвердить вывод Резерфорда и Содди: эманация радия — благородный газ.
Но это произошло позже, через пять лет, а начало совместной работы Рамзая и Содди ознаменовалось экспериментальным подтверждением того факта, что гелий — результат превращения эманации радия. Едва ли нужно подробно описывать знаменитый опыт. Достаточно сказать, что бромид радия (мизерные количества!) был растворён в воде, а выделившийся при этом газ скапливался в колбах. Затем его сушили и переводили в трубку Плюккера, с помощью которой исследуют спектр газа. Первоначально в спектре видны были только линии углекислого газа, но со временем начинали проступать жёлтые линии, что наводило на подозрение о присутствии здесь гелия. В конце опыта эманация и углекислый газ вымораживались, и тогда ярко и четко проступили жёлтые линии гелия. Рамзай посмотрел в спектроскоп и взволнованно воскликнул: «Это D3!» Гелия не было, гелий появился. В комнату повалили сотрудники Рамзая и студенты. Каждому хотелось увидеть новорождённый гелий. Содди с улыбкой вспоминал это событие: его самого, участника открытия, почти что оттёрли от спектроскопа, и он увидел счастливую жёлтую линию чуть ли не последним.
Резерфорд был очень рад этому событию. Ведь подтверждалась его догадка: гелий родится из радия. Поэтому-то он, только что ставший обладателем 30 миллиграммов бромида радия (потрясающее богатство!), одолжил их Рамзаю и Содди. Опыт, конечно же, был повторен и дал те же результаты, после чего Содди написал обо всём Резерфорду, отметив, что «это был подлинный триумф». Рамзай не только доказал предположенное Резерфордом, но и показал его — в буквальном смысле, так что каждый мог убедиться во всём своими глазами. Он был прав, когда утверждал, что это был первый фактически наблюдаемый случай перехода одного химического элемента в другой. Полное удовлетворение получил «каустик Содди»: профессор Армстронг, президент Химического общества, так недавно насмехавшийся над «атомами-самоубийцами», вынужден был сложить оружие.
Превращение элементов можно было считать совершившимся фактом. Однако превращение это ни в коей мере не зависело от воли учёного и шло само по себе. Можно было изучать его, объяснять, как кому заблагорассудится, но повлиять на него — задержать или ускорить, или тем более направить в желательную сторону — такой возможности не было.
А ведь именно об этом мечтал великий Фарадей: «Разлагать металлы, преобразовывать их и осуществить некогда абсурдную идею о превращении элементов — вот задача, поставленная теперь химиками для разрешения». И Рамзай с пылом и страстью отдался работе, полагая, что время для решения этой задачи наступило. «Я рискну, — писал он, — предположить, что если энергия передаётся обычным формам материи, то происходит нечто вроде полимеризации и образуются радиоактивные элементы с более высокими атомными весами». Чтобы так рассуждать, у Рамзая были основания. Локьер, тот самый, что открыл гелий на Солнце, написал книгу «Неорганическая эволюция», в которой обращал внимание на то, что более раскалённые светила в спектре дают меньшее количество линий. Отсюда следовал вывод: при остывании звезды появляются новые элементы. «Упрощение» элементов, стало быть, происходит вследствие колоссальнейших температур Солнца и звёзд. Для осуществления трансмутации, рассуждал Рамзай, нужно найти на Земле источник громадной энергии. Такой источник он видел в эманации. Он писал тогда: «В эманации мы имеем техническое оружие, превосходящее обычные реактивы настолько же, насколько современное оружие превосходит лук наших предков».
Рамзай пробовал использовать и другой источник энергии. К тому времени уже стало достоянием науки открытие русского учёного Столетова — фотоэффект. В приборе Столетова свет падал на цинковый кружок, вызывая в цепи появление электрического тока. Было установлено, что этот эффект не зависит от интенсивности светового потока, а лишь от длины волны. В 1905 г. Рамзай вместе со своим сотрудником Д.Спенсером поставил ряд опытов по воздействию ультрафиолетовых лучей на металлическую пластинку (она была цинковой, как у Столетова). Допускалась мысль, что лучи смогут «детонировать» атомы металла с освобождением электронов, и тогда они преобразуются в атомы другого элемента. Нет, нет, Рамзай не настаивал на такой мысли, он только пробовал! Как здесь не вспомнить Рентгена с его великолепным ответом на вопрос, что он подумал, когда открыл X-лучи: «Я не думал, я экспериментировал».
Но отношение к эманации как источнику энергии у Рамзая было иное. «Я хочу высказать предположение, — говорил он, — что элементы, по существу, являются просто весьма устойчивыми соединениями, которые для того, чтобы претерпеть изменения, поглощают очень большое количество энергии. Как же должна передаваться эта энергия? По всей вероятности, процесс этого рода происходит в самых горячих звёздах. Вполне возможно осуществить подобные изменения на Земле, вызвав так называемую трансмутацию элементов. При этом я исхожу из того доказанного факта, что радий через эманацию переходит в гелий и что металлы под воздействием ультрафиолетовых лучей освобождают электроны. Какие это будут элементы, пока сказать трудно».
Рамзай не ограничился общими рассуждениями, он приступил к экспериментам. В августе 1906 г. в частном письме к Дж. Мак Гоуэну он писал: «Мне кажется, я уже сообщал, что мной обнаружен Li в первоначальном CuSO4. Но это доказывает, что в этом есть что-то необычное… Мне думается, что CuSO4 может быть источником образования лития». В том же письме он сообщал, что египтолог Флиндерс Петри передал ему 15 килограммов серебра, которые лежали в кувшине (видимо, медном) на протяжении 3 тысяч лет. Рамзай не исключал, что медь могла за такой большой промежуток времени сама по себе превратиться в литий. Разве не подобную мысль несколько столетий назад высказал несравненный Гебер?
В апреле 1907 г. Рамзай писал своей жене: «Я наконец установил вне всяких сомнений, что медь превращается в литий».
А в июне 1908 г. грянул гром: Рамзай сумел получить новые элементы! Это была сенсация. В сообщении об этой работе Рамзая говорилось, будто он при смешивании эманации радия с водой обнаружил в растворе неон со следами гелия, а при смешивании с раствором медного купороса — аргон без следов гелия, но с присутствием лития. Рамзай и работавший с ним Камерон разъяснили это следующим образом: под воздействием ударов альфа-частиц, выделяемых эманацией, некоторые атомы меди раскалываются, в результате чего образуются элементы с меньшим атомным весом.
В Химическом обществе Германии к этому сообщению отнеслись с большим интересом, но и с осторожностью, указав что поразительные наблюдения требуют ещё дальнейшего изучения, которое уже начато авторами.
В 1909 г. Рамзай сам выступил в лондонском Химическом обществе, рассказал о своих экспериментах и выразил убеждение в том, что его опыты доказали превращение элементов большего атомного веса в элементы с меньшим атомным весом.
На этот раз недоверие возросло. Опыты Рамзая взяли на проверку М.Кюри и её сотрудница Е.Гледич. Они нашли ошибку: литий был в кварцевой посуде, а не образовывался из сернокислой меди. Об этом сообщили Рамзаю, но тот стоял на своём: «Всё, что я могу сказать, — это то, что нам удалось вызвать эту трансформацию и что Кюри это не удалось».
Возможность превращения меди в литий была проверена учеником Рамзая Е.Перманом — весьма способным и опытным химиком. Результат опыта был отрицательным. Рамзай не придал значения данным Пермана. Траверс, коллега Рамзая, вместе с ним открывший инертные газа — неон, криптон и ксенон, заметил по этому поводу: «Подлинным источником лития является пепел от сигарет Рамзая. Рамзай был несколько небрежен и не заботился о том, где стряхивать пепел с сигарет».
Наконец за проверку утверждений Рамзая взялись Резерфорд и Ройдс и нашли, что всё гораздо проще: в аппарат Рамзая проник воздух.
Но Рамзай не внимал всем этим доводам и доверял лишь себе. Ведь именно в этот период он не только показал, что гелий рождается из эманации, но и провёл тончайшее исследование её свойств. Именно Рамзаю удалось поставить невероятный по тонкости эксперимент, в результате которого был измерен атомный вес эманации — 222. К этому времени уже был опредёлен и атомный вес радия — 226. И схема радиоактивного распада рисовалась такой:
Ra 226 = Rn 222 + He 4
Рамзай вместе с Н.Колли и Г.Паттерсоном опубликовал работу, в которой утверждалось, что им удалось осуществить превращение уже не более сложных, а менее сложных элементов, т. е. не распад, а синтез. Они якобы получили в катодной трубке гелий из водорода — в одном случае, а в другом, когда там были следы кислорода, — неон. После смерти Рамзая была обнаружена рукопись, в которой есть такая фраза: «Доказано, что в присутствии серы образуется аргон; при отсутствии серы аргона не образуется».
Можно было бы, конечно, не рассказывать о несколько странном поведении Рамзая, чтобы не бросать тень на учёного с мировым именем. Но вряд ли это было бы правильно. Даже его ошибки были ступенями познания, поскольку ошибочность его утверждений выяснилась не в словесном поединке, а в результате многочисленных экспериментов, проверки и перепроверки учёными друг друга.
Интерес к радиоактивности продолжал нарастать. Резерфорд, принявший предложение Манчестерского университета и занявший там должность профессора физики, увлёкся альфа-излучением. Что представляют собой эти загадочные альфа-частицы? Ещё в монреальских экспериментах Резерфорд выяснил, что масса альфа-частиц больше массы водорода. Измерив отношение их заряда к их массе, Резерфорд пришёл к заключению, что они представляют собой не что иное, как атомы гелия, потерявшие по два электрона.
В Манчестере Резерфорд организовал эксперимент, наглядно убедивший всех сомневающихся. Была изготовлена стеклянная трубка с толщиной стенок всего 0,01 миллиметра. Через такие стенки свободно проходят альфа-частицы, но они непроницаемы для газообразного гелия. Трубка была помещена внутри другой (с более толстыми стенками), соединённой с капилляром и трубкой Плюккера. Тонкостенная трубка заполнялась эманацией радия, из внешней трубки откачивали воздух. Через некоторое время было замечено, что в ней накапливается газ. Поступить туда он мог только через тонкие стенки первой трубки, затем по капилляру он прошёл в трубку Плюккера. Спектроскоп чётко удостоверил, что это гелий. Самые упорные скептики могли видеть своими глазами, как гелий образуется из альфа-частиц. Но Резерфорд этим не удовлетворился и поставил контрольный опыт. Внутренняя тонкостенная трубка заполнялась не эманацией, а чистым гелием. Через несколько дней спектроскоп показал, что в разрядной трубке гелия нет — через тонкие стенки газ не проходил, они были проницаемы лишь для альфа-частиц.
В 1908 г. Резерфорд стал лауреатом Нобелевской премии и на заседании по традиции должен был прочитать лекцию. Он озаглавил её так: «О химической природе альфа-частиц радиоактивных веществ». Премия Резерфорду была присуждена не по физике, а по химии. Радиоактивность была совершенно новой областью исследований, и учёные не знали с уверенностью, к какой науке её причислить. А новый лауреат изящно пошутил по этому поводу: «Я имел дело со многими разнообразными превращениями с разными периодами, но самым быстрым из всех оказалось моё собственное превращение в один момент из физика в химика».
Полуспиритическое состояние и кризис в науке
Всё смешалось в доме элементов. В том самом великолепном здании, которое построил Д.И.Менделеев, — в знаменитой периодической системе. Так, во всяком случае, казалось многим прославленным физикам и химикам начала XX столетия. Всё новые и новые элементы обнаруживались исследователями в цепи радиоактивного распада. Но куда их помещать? В таблице не хватало клеток для этого.
Пьер Кюри не сразу признал теорию превращения элементов. Ему казалось, что тем самым признаётся непостоянство материи. Он первоначально склонялся к мысли объяснить временную радиоактивность процессом передачи энергии. Однако, повторив опыты Рамзая и Содди по образованию гелия из эманации радия, он успокоился и начал измерять альфа-активность так же, как это делал Резерфорд. Эманация, или радон, распадалась и превращалась в какое-то вещество A, но и оно не оставалось стабильным, а также распадалось, давая вещество B; в свою очередь и это вещество распадалось, давая некое C. Резерфорд ко всему этому отнёсся с большим вниманием и, не мудрствуя лукаво, обозначил эти вещества: радий-A, радий-B, радий-C. Он детально изучил всё относящееся к радиоактивности этих новых элементов, установил период полураспада для каждого — 3, 21, 28 минут.
Выяснилось, что это не конец. Есть ещё радий-D, радий-E и радий-F.
Осенью 1904 г. для усовершенствования в науках в лабораторию Рамзая прибыл «неспециалист» — химик-органик Отто Ган. Молодого учёного сразу усадили за отделение радия от бариевой фракции, извлечённой из 250 килограммов нового радиоактивного минерала с Цейлона. Новичку пришлось нелегко, так как навыка в работе с радиоактивными веществами у него совсем не было. Но он порученное задание выполнил с честью. Даже больше. Он не только выделил бромистый радий, но нашёл в маточном растворе новое радиоактивное вещество, которое давало эманацию с периодом полураспада в одну минуту. Твёрдый налёт — результат превращения эманации — также был активен (полураспад 11 часов). По всем химическим признакам это был торий, но с исключительно сильной радиоактивностью. Успехи молодого учёного произвели хорошее впечатление на Рамзая, и он сразу рекомендовал его в качестве специалиста по радиоактивности в исследовательский институт Эмиля Фишера. Молодой химик-органик, «птенец» по сути дела, прибыл к маститому органику с новой, совершенно неожиданно приобретённой специальностью физика. Но чувствуя себя в ней ещё не очень уверенно, Ган отправился в Монреаль к Резерфорду подучиться и накопить опыт. Ему быстро удалось убедить Резерфорда в существовании радиотория, как было названо им новое вещество, и в том, что в цепи радиоактивного превращения торий — эманация тория (торон) он предшествует ранее обнаруженному торию-X. Началась упорная работа. Всё было правильно, но вдруг пришло письмо, в котором его автор Болтвуд сообщал, что располагает препаратом радиотория, сохраняющим радиоактивность постоянной в течение двух лет. Это было интересное сообщение, так как по измерениям Гана такой срок должен привести к почти полному распаду этого вещества. Если сведения Болтвуда достоверны, можно было предположить, что запас радиотория постоянно пополняется за счёт распада какого-то другого радиоактивного вещества. Оказалось, что и в самом деле так, — Ган тонко поставленными экспериментами доказал это и новое вещество назвал мезоторием. В работу включились Болтвуд, Мак-Кой и другие исследователи. В конечном счетё было установлено, что есть и другой мезоторий. Цепочку превращения тория в его эманацию оказалось необходимым удлинить: торий — мезоторий I — мезоторий II — радиоторий — торий-X — торон (эманация).
То обстоятельство, что радий всегда добывался только из урановых руд, наводило на мысль, что и сам он — всего лишь ступень в цепи превращений элементов. Содди попытался накопить сколько-нибудь радия непосредственно из урана, однако это ему не удалось, и исследователи сделали вывод, что уран и радий — не соседние звенья радиоактивной цепи. Так оно и оказалось впоследствии. Болтвуд тогда заинтересовался актинием, радиоактивность которого показана была А.Дебьерном ещё в 1899 г. Исследования, начатые Болтвудом и следом за ним Резерфордом, закончились установлением новой цепи превращений: актиний — радиоактиний — актиний-X — актинон — актиний-A — актиннй-B — актиний-C.
Все эти превращения сопровождались излучением; в большинстве своём испускались альфа, реже бета-, а иногда и гамма-лучи.
Описание всех подробностей этих трансформаций не является предметом нашего рассмотрения, и мы того, кто этим заинтересовался, отсылаем к современному учебнику физической или даже неорганической химии, либо к соответствующим популярным изданиям.
Для нашей темы любопытно было то, что активность в ряде превращений, наконец, прекращалась и образовывалось вещество, уже не излучающее. Химики, определяя его атомный вес, получали неодинаковые величины, но всякий раз очень близкие к атомному весу одного из самых известных и обиходных элементов — свинца.
Профессор Берлинского университета В.Марквальд извлёк из остатков урановой иоахимстальской руды короткоживущий радиоэлемент и назвал его радиотеллуром. Некоторые учёные не согласились с Марквальдом. По мнению одних, открытый им радиотеллур не что иное, как полоний; по мнению других, это висмут. Марквальд много спорил и с теми, и с другими. Последних ему удалось разбить очень просто и наглядно. Он погружал висмутовую палочку в раствор, содержащий радиотеллур, и тот отлагался на палочке — хорошо известный способ контактного вытеснения одного металла другим.
Однако Марквальду всё же пришлось уступить, ибо другие исследователи, и прежде всего Мария Кюри, доказали, что радиотеллур идентичен не только полонию, но и радию — всё это разные названия одного и того же вещества. Марквальд отнёсся к этому в высшей степени философически и сказал шекспировскую фразу: «Как розу ни назови, а пахнуть она будет так же приятно». Но любопытно то, что и радий-E тоже оказался полонием, если судить об этом по атомному весу. Таким образом, теория превращения элементов приобрела необычайную притягательную силу, хотя и вызывала в умах сторонников классических взглядов невообразимую путаницу и тревогу.
Жестокие сомнения испытывал Д.И.Менделеев. Не только потому, что для всех новообразованных элементов не хватало места в таблице. Совершенно необъяснимым казался тот факт, что эманация получалась из различных исходных веществ, имела совершенно одинаковые химические свойства, но… различный атомный вес. Ведь этим, казалось, подрывается вся сущность периодического закона, согласно которому свойства элементов есть периодическая функция их атомного веса.
Так до сих пор блестяще оправдывал себя этот закон, так много дал науке, а теперь вот на основании сомнительных экспериментов кое-кто спешит объявить его ниспровергнутым…
Радиоактивность — замечательное явление, в реальности его никто не сомневается, но что оно такое? Менделеева по-прежнему волнует вопрос: откуда берётся энергия, чтобы вырвать из атома все эти пресловутые частицы?
В седьмом издании «Основ химии» Д.И.Менделеев писал: «…всё то, что мне было показано… первыми исследователями радиоактивных веществ… производило на меня впечатление особых состояний, свойственных лишь преимущественно (но не исключительно, как магнетизм свойствен преимущественно, но не исключительно, железу и кобальту) урановым и ториевым соединениям».
Незадолго до кончины Дмитрия Ивановича Н.А.Морозов подготовил к печати книгу «Периодические системы строения вещества», в которой проводил идею эволюции элементов. По свидетельству Морозова, об этой книге он беседовал с Менделеевым; он пытался убедить Дмитрия Ивановича в том, что выделение радием особой эманации, «превращающейся постепенно в гелий», — общепризнанный факт. Однако Менделеев отнёсся к этому факту скептически. «Скажите, пожалуйста, — воскликнул он, — много ли солей радия на всём земном шаре? Несколько граммов. И на таких-то шатких основаниях хотят разрушить все наши обычные представления о природе веществ!»
Тем не менее Морозов сумел заинтересовать Дмитрия Ивановича новой теорией; они условились ещё раз поговорить на эту тему, когда Морозов вернётся из деревни. К сожалению, больше встретиться им не удалось…
Д.И.Менделеев не отмахивался от экспериментальных достижений науки, но проявлял величайшую осторожность и предостерегал от поспешных выводов. В уже упомянутом письме к Винклеру Менделеев сообщал, что намеревался было посетить Сан-Луи, Чикаго и Нью-Йорк, куда его приглашали, и там «изложить своё мнение о полуспиритическом состоянии, в которое ныне хотят вовлечь нашу науку». Это сказано немного резковато, но не безосновательно. Менделеева насторожило то, что явление радиоактивности, в котором ещё столько неясного, некоторыми учёными использовано для ниспровержения атомов и вообще материи. Так, Вильгельм Оствальд, которому наука многим обязана, в начале 90-х гг. прошлого столетия провозгласил, что первоосновой мира является не материя, а энергия. В своей книге «Учение об энергии» он писал, что материя является не носителем, а формой проявления энергии. Взгляды Оствальда были подняты на щит философами-идеалистами. В восторженных статьях они возглашали, что учение Оствальда «навсегда положило конец субстанциальному понятию материи».
Против «заболевшего энергетизмом» Оствальда выступили даже его ближайшие друзья, коллеги по работе в области физической химии, крупнейшие термодинамики. С.Аррениус писал Оствальду: «При помощи бескровных термодинамических функций крайне трудно двигаться вперёд. Мне кажется, что физикам всегда будут необходимы материальные механические представления… Энергетика никуда не годится для экспериментальных работ…» Вант-Гофф считал, что не термодинамика, а атомистика составляет «центр тяжести» химической науки. В.Нернст был раздражён выступлением Оствальда, где тот провозгласил, что «гипотезы об атомах и молекулах можно отбросить, как костыли, в которых не нуждается зрелая наука». «Как тебе нравится, — писал он Аррениусу, — что Оствальд пичкает нас, бедных читателей «Цейтшрифт», своей любекской стряпнёй?»
С резкой критикой Оствальда выступил и Д.И.Менделеев, который показал, что учение Оствальда представляет собой не что иное, как возвращение к «динамизму» древних, считавших, что материя — всего лишь проявление сил. «В динамизме, — писал творец периодической системы, — движется, так сказать, ничто». А.Г.Столетов, Н.Н.Бекетов, Д.П.Коновалов, Н.А.Умов, И.А.Каблуков, Н.С.Курнаков и другие русские учёные также энергично выступали против энергетизма и отстаивали атомно-молекулярное учение.
Очень аргументированной критике подверг все положения Оствальда Л.Больцман. По этому поводу С.Аррениус заметил: «С энергетикой ему (Оствальду. — Б.К.) не особенно повезло, Больцман разрушил ему всю систему».
Крупнейшие учёные XIX в. стояли на позициях естественноисторического материализма, т. е. разделяли, по словам В.И.Ленина, «…стихийное, несознаваемое, неоформленное, философски-бессознательное убеждение подавляющего большинства естествоиспытателей в объективной реальности внешнего мира, отражаемой нашим сознанием». А тут эта «объективная реальность», настолько привычная и, казалось бы, так очевидная, вдруг начала куда-то исчезать в таинственных явлениях радиоактивности, в самопроизвольном распаде атома. И вот уже Анри Пуанкаре, тот самый, что в своё время так помог Беккерелю, провозгласил вдруг, что современная физика — это «руины старых теорий», что в новейшей физике происходит «всеобщий разгром принципов». С лёгкой руки физика Л.Ульвига на все лады стало склоняться утверждение: «Материя исчезла».
Очень нелегко было тогда во всём разобраться. Если Менделеев впадал в большие сомнения при рассмотрении вопросов электрохимических диссоциаций и радиоактивности («откуда берётся энергия?»), то и многие другие учёные над этим серьёзно задумывались. «Великий революционер — радий», по утверждению того же Пуанкаре, подрывал принцип сохранения энергии. А принцип сохранения массы, казалось, подорван электронной теорией материи.
Все эти «шатания мысли» в вопросе материальности мира и объективности истин, установленных наукой, подробно рассмотрены В.И.Лениным в его замечательной работе «Материализм и эмпириокритицизм». Сокрушительной критике подверглись все те, кто капитулировал перед идеализмом, будучи обескуражен новыми, непонятными на первом этапе научными открытиями. Досталось в этой работе и Э.Маху, и В.Оствальду, и другим «физикам-идеалистам», и в то же время отмечалось, что Больцман, раскритиковавший энергетизм, «конечно, боится назвать себя материалистом и даже специально оговаривается, что он вовсе не против бытия божьего, но его теория материалистическая и выражает она… мнение большинства естествоиспытателей».
Несколько ранее с возмущением писал Д.И.Менделеев: «От физики до метафизики теперь стараются сделать расстояние до того обоюдно ничтожно малым, что в физике, особенно после открытия радиоактивности, прямо переходят в метафизику, а в этой последней стремятся достичь ясности и объективности физики. Старые боги отвергнуты, ищут новых, но ни к чему сколько-либо допустимому и цельному не доходят: и скептицизм узаконяется, довольствуясь афоризмами и отрицая возможность цельной общей системы. Это очень печально отражается в философии, пошедшей за Шопенгауером и Ницше, в естествознании, пытающемся «объять необъятное» по образу Оствальда или хоть Цыглера…»
С пространной речью против взглядов Пуанкаре и всех тех, кто утверждал, что «атом дематериализуется», выступил в 1901 г. президент физической секции английских естествоиспытателей А.У.Риккер. Аргументируя достижениями науки последних лет, он отверг все сомнения в существовании атомов. «…Несмотря на приблизительный характер некоторых наших теорий, — закончил он свою речь, — несмотря на многие частные затруднения, теория атомов… в главных основах верна… атомы не только вспомогательные понятия для математиков, а физические реальности».
В.И.Ленин в своей работе посвятил целый раздел этому выступлению и беспощадно раскритиковал Д.Уорда, пытавшегося опровергнуть Риккера. «Материя исчезает», — писал В.И.Ленин, — это значит исчезает тот предел, до которого мы знали материю до сих пор, наше знание идёт глубже…» «…Диалектический материализм настаивает на временном, относительном, приблизительном характере всех этих вех познания природы прогрессирующей наукой человека. Электрон так же неисчерпаем, как и атом…»
Последняя фраза в то время могла показаться многим слишком смелой, но спустя годы её смогли оценить как пророческую. «Ум человеческий, — утверждал Владимир Ильич, — открыл много диковинного в природе и откроет ещё больше, увеличивая тем свою власть над ней…»
«Модное» течение втянуло в своё русло далеко не подавляющее большинство учёных, хотя среди них были и крупные имена. Не менее крупные имена, как уже отмечалось, были и среди тех, кто резко восставал против идеалистического толкования успехов физики. П.Ланжевен, например, писал в 1904 г.: «В настоящее время происходит научная революция. Она выводит атомические идеи из той тени, в которой их оставляют, и сопоставляя с новыми фактами, переводит из области гипотез в область принципов».
Философы-идеалисты всё более теряли опору в естествознании. Полным их конфузом стало то, что учёные, из-за которых, собственно говоря, и «разгорелся сыр-бор», совершенно отказались от своих прежних взглядов. А.Пуанкаре, например, заявил: «…атомы более уже не являются удобными фикциями… Атом химика сейчас реальность». Такое же признание в 1908 г. сделал и В.Оствальд: «…атомическая гипотеза поднята на уровень научно обоснованной теории».
Атомистика восторжествовала, но уже в новом качестве. А для нашего повествования важно подчеркнуть, что новая атомистика признала «старую» идею превращения элементов, вдохнула в неё жизнь. Сама идея пережила трансмутацию — из недосягаемой мечты она превратилась в реальность. «Таким образом, давно всеми отвергнутая, скомпрометированная идея алхимиков о возможности трансмутации (превращения) вещества была возрождена». Это слова советского учёного академика П.Л. Капицы из предисловия к одной книге о Резерфорде.
Твёрдые факты природы
Резерфорд работал лихорадочно и быстро. Работал с напором. «Кризис в науке» его интересовал мало. Много позже он сказал, что вправе был бы сказать и тогда (а кто знает, может быть, и тогда говорил): «Они играют в свои символы, а мы в Кавендише добываем неподдельные твёрдые факты природы». Резерфорд нередко бравировал: «я не теоретик», хотя прекрасно знал, что эксперимент и теория взаимно дополняют и подтверждают друг друга и, пожалуй, никто больше его не демонстрировал это с такой наглядностью.
Альфа-частицы заявили о себе не только косвенно, через показания электрометра или какого-нибудь другого прибора, а ощутимо, зримо. Резерфорд, встретившись с супругами Кюри у них дома ещё в июне 1903 г., был восхищён зрелищем, которое показал ему Пьер Кюри. В трубке, часть которой покрыта сернистым цинком, находился раствор радия, и трубка в темноте светилась удивительным светом. Это было эффектно, впрочем, не так уж и ново. За год до этого прославленный Уильям Крукс сконструировал несложный приборчик, названный им спинтарископом. В нём ничтожнейшее количество соли радия было помещено перед экраном из сернистого цинка. Альфа-частицы, вырываясь из радия, ударяли в экран, и на нём происходили вспышки света, тут же исчезающие. Многие учёные смотрели на спинтарископ как на очень любопытную, забавную даже, научную игрушку, в лучшем случае демонстрационный прибор для какой-нибудь лекции по новой отрасли науки — радиоактивности. Резерфорд отнёсся к этому иначе. Он сделал спинтарископ важнейшим инструментом глубоких исследований. Ведь этот прибор позволял считать альфа-частицы. Каждая вспышка регистрировала одну альфа-частицу, показывала, в какое место она ударялась.
В Мак-Гилле Резерфорд, изучая полёт альфа-частиц, засвечивал с их помощью фотопластинки. Резкого пятна на фотопластинке у него долгое время не получалось — до тех пор, пока он не добился достаточно высокого вакуума. Но с высоким вакуумом пришла и аномалия. Если на щель, через которую пропускали поток альфа-частиц, накладывался кусочек слюды, то на пластинке опять появлялось размытое пятно (или линия, в зависимости от щели). Отклонение было невелико, но его трудно было объяснить, поскольку время полёта частиц очень короткое, кинетическая энергия их колоссальна, расстояние до фотопластинки-мишенн — ничтожно. Резерфорд решил, что разгадка рассеяния альфа-частиц может пролить свет на внутреннюю структуру атома. Именно для такой работы и подходил спинтарископ, точнее установка, основанная на его принципе. Вместе со своим учеником Гансом Гейгером Резерфорд стал подсчитывать, какое число альфа-частиц сильно отклоняется от общего потока. Щель, через которую пропускали альфа-частицы, прикрывалась листочком из золотой фольги. Установили, что отклонение незначительно, всего полградуса, но число отклонений в разные стороны составляет две трети всех альфа-частиц. Поток рассеивается — почему? Резерфорд поручил студенту последнего курса Эрнсту Марсдену проверить, не происходит ли отражение альфа-частиц от поверхности золотой фольги. С большим старанием отнёсся студент к порученному делу и скоро сделал небольшую установку, в которой источник альфа-частиц был отделён от регистрирующего экрана массивным свинцовым блоком, а золотая фольга располагалась несколько в стороне.
Первоначально, как и ожидалось, экран из сернокислого цинка «молчал» — альфа-частицы не могли преодолеть массу свинцового блока. Но затем вдруг на экране стали появляться единичные вспышки. Чтобы попасть на экран, альфа-частица должна была отклониться на угол в 150°, т. е. почти что вернуться к излучателю. «Это казалось столь же невероятным, — говорил много позже Резерфорд, — как если бы вы выстрелили пятнадцатифунтовым снарядом в папиросную бумагу, и этот снаряд отскочил бы и поразил вас».
Вспышки на экране были редки, может быть, одна из восьми тысяч альфа-частиц так отскакивала от золотой фольги, но сам факт сомнений не вызывал.
Резерфорд с Марсденом (к ним присоединился и Гейгер) погрузились в изучение странного явления. В мрачном погребе, вверху которого проходил горячий трубопровод, а внизу — две водопроводные трубы (о чём всегда предупреждал Резерфорд туда спускавшихся), были установлены самые чувствительные приборы. Предположение, что альфа-частицы отражаются от поверхности, опровергалось простым экспериментом: золотые листочки укладывались пачками, и чем толще получался пакет, тем заметнее было рассеяние альфа-частиц. Вывод был недвусмысленный: это не поверхностный эффект, т. е. не простое отражение от поверхности, а действие какой-то силы, находящейся внутри металла, возможно, внутри атома.
Но как же может это быть, если по общепринятой тогда модели Дж. Дж. Томсона в атоме равномерно распределены положительные и отрицательные заряды («пудинг с изюмом»)? Пробовали менять материал экрана — фольга из золота, олова, платины, серебра, меди, железа, алюминия и других металлов. Выявилась интересная особенность: отражалось альфа-частиц тем больше, чем выше был атомный вес металла.
Резерфорд мучительно обдумывал эти данные. Что за сила отбрасывает альфа-частицы, почему не все они отбрасываются, а только лишь одна из огромного общего числа, при чём здесь атомный вес?
Нескоро он пришёл к определённому заключению и решился, наконец, сказать историческую фразу: «Теперь я знаю, как выглядит атом». Тогда-то и была предложена им планетарная модель атома, по которой в центре его находится ядро, сосредоточивающее в себе почти всю его массу; ядро имеет положительный заряд, а электроны вращаются вокруг ядра подобно планетам на огромнейших расстояниях, так что основной объём атома оказывается пустотой. Альфа-частица, направленная на какой-нибудь атом, может миновать ядро и почти, или совсем, не отклониться от своей траектории. Так происходит с большинством альфа-частиц, но некоторые из них по закону вероятности могут приблизиться к ядру на самые малые расстояния и, поскольку заряд их одинаков, будут отброшены с огромнейшей силой, причём сила эта будет тем больше, чем массивнее ядро, чем больше его заряд и, стало быть, атомный вес элемента. Много проверочных очень тонких экспериментов поставил Резерфорд, много произвёл он и математических расчётов, прежде чем решился изложить новые представления о структуре атома, и в мае 1911 г. об этом оповестил других через «Философский журнал».
Читатели, знакомые с историей науки, могут возразить: планетарная модель атома была предложена до Резерфорда. Действительно, в работе В.И.Ленина «Материализм и эмпириокритицизм», которая, как известно, появилась в 1909 г., можно прочесть такие слова: «…атом удаётся объяснить как подобие бесконечно малой солнечной системы, внутри которой вокруг положительного электрона двигаются с определённой (и необъятно громадной, как мы видели) быстротой отрицательные электроны». В чём тут дело? А дело в том, что мысль о планетарном строении атома действительно высказывалась (и не раз печатно) несколькими исследователями до Резерфорда. Жан Перрен, например, свою гипотезу изложил в статье «Нуклеарно-планетарная структура атома» ещё в 1901 г. Японский учёный Нагаока предложил атомную модель с ядром, вокруг которого вращаются электроны «подобно кольцам Сатурна». В 1903 г. его статью публиковали «Труды Токийского физико-математического общества», а в 1904 г. перепечатали в европейском издании.
К подобному суждению, о структуре атома пришли также в разное время Д.Стоуни, Н.Морозов, М.Павлов, Б.Чичерин и другие. Совсем недавно стало известно, что замечательный русский физик П.Н.Лебедев придерживался такой же гипотезы ещё в 1887 г., когда самому ему было лишь двадцать лет. Можно представить себе его радость, когда появилось сообщение Резерфорда, подтвердившее его предвидение.
Выходит, Резерфорд далеко не первый в этом вопросе? Нет, первый. Первый в том смысле, что все прежние гипотезы были только догадками, ни одна из них не опиралась на эксперимент; Резерфорд пришёл к своей модели, можно сказать, «вынужденно», под напором фактов, полученных в эксперименте.
Не слишком ли много уделено внимания структуре атома в книге о превращении элементов? Нет, не слишком, ибо без знания того, как устроен атом, все попытки осуществить превращение, как выяснилось, были обречены на неудачу. Рамзай, который так безуспешно старался превратить один элемент в другой, с появлением резерфордовской модели пришёл к мысли, что необходимым условием трансмутации является раскол ядра атома. Он писал тогда: «Альфа-частица проходит через встречные молекулы, как пуля проходит через мишень… Что же случится, если произойдёт центральное столкновение? По всей вероятности, одно из 8000 столкновений будет таковым. Задетый атом получит количество энергии, эквивалентное поднятию температуры на тысячу миллионов градусов Цельсия. Можно предположить, что в этом случае произойдёт ионизация самого ядра атома, и, вероятнее всего, это будет сопровождаться необратимыми изменениями — другими словами, трансмутацией».
Эти слова Рамзая оказались пророческими. Прошло всего лишь семь лет, и правоту их подтвердил всё тот же Резерфорд: он получил из азота кислород. Как же это произошло? Для того, чтобы рассказать об этом хотя бы вкратце, следует заметить, что инструментарий исследований всё время совершенствовался. Удалось установить, какое расстояние пробегает альфа-частица, сохраняя способность к ионизирующему воздействию. Затем было замечено, что она оставляет след на фотопластинке, но длина её пробега в таком случае была в тысячу раз меньше. Этот след стал вполне определённой характеристикой альфа-частицы.
Резерфорд сконструировал приборчик, представляющий собой горизонтальный цилиндр, заполняющийся газом. В середине цилиндра на особой подставке на расстоянии от передней стенки, превышающем длину пробега альфа-частиц, укреплялся источник радиоактивного излучения. В стенке имелось окошечко с экраном из сернистого цинка, позволяющим с помощью микроскопа наблюдать сцинтилляции (свечение в виде вспышек).
Когда цилиндр заполнили азотом и начали эксперимент, на экране стали замечать вспышки. По расчётам, этого не должно было быть, так как альфа-частицы не могли достигать поверхности экрана. Очевидно, сцинтилляции вызываются ударами каких-то других частиц, имеющих большую длину пробега. Опытный Резерфорд, воздействуя электрическими и магнитными полями, измерил заряд и массу этих частиц и со всей несомненностью установил, что это ядра атомов водорода — протоны. Откуда они могли там взяться, если азот (было проверено) абсолютно чист? Вероятнее всего, протоны могли появиться только из недр атомных ядер азота. Что же произошло тогда с альфа-частицами? Ученик Резерфорда Блекетт целой серией тонко поставленных экспериментов выяснил, что альфа-частица, выбивая протон из ядра атома азота, сама в нём «застревает». Но ведь тогда ядро, поглотившее альфа-частицу, перестанет быть ядром атома азота? Совершенно верно, так и было: азот превращался в кислород. Результаты опыта подтвердились многократной и самой придирчивой проверкой — всё было правильно: обстреливая альфа-частицами азот, Резерфорд получил из него два других элемента — кислород и водород.
Так, наконец, в 1919 г. была достигнута великая цель, мечта алхимиков — превращение одного элемента в другой, и уже не естественным природным процессом, а по воле человека.
Естественно, что Резерфорд после такого триумфального результата не успокоился, а продолжил и расширил эксперименты по превращению элементов. Для этого ему пришлось видоизменить и усложнить условия опыта, усовершенствовать регистрирующую аппаратуру, — успех ему сопутствовал и на этот раз. Из алюминия он получил водород и кремний. Подверглись бомбардировке альфа-частицами также бор, фтор, натрий, фосфор и другие элементы, и всякий раз наблюдалось появление протоков и преобразование одного элемента в другой. В каждом случае происходило не только превращение, но и усложнение элемента. Если при естественном радиоактивном распаде образовывались элементы со всё меньшим и меньшим атомным весом, то в экспериментах Резерфорда получали элемент с возрастанием атомного веса. Любопытно было и другое. При таком превращении выделялось огромнейшее количество энергии, это было подсчитано подведением так называемого энергетического баланса. Можно было подумать, что этот факт особенно возбудит надежды учёных. Отнюдь нет, сам Резерфорд не придавал этому значения, так как считал такое получение энергии абсолютно невыгодным делом: ведь слишком редок был случай превращения. Превращение, например, одного ядра алюминия произойдёт лишь после того, как пролетят 125 тысяч альфа-частиц!
Начало первой мировой войны застало Резерфорда на пути в Австралию, куда он направился на очередной конгресс Британской ассоциации. По пути он побывал и в родных местах в Новой Зеландии. Когда ему предложили прочитать публичную лекцию в стенах Кентерберийского колледжа, откуда начался его путь в науку, то знаменательно, что темой он избрал не что иное, как «эволюцию элементов», — ту самую, из-за которой ему пришлось признать, что «зашёл слишком далеко». Но что очень существенно при этом отметить, так это то, что он осмелился повторить лекцию до того, как ему удалось совершить первое превращение. Стало быть, он никогда с этой мыслью не расставался.
Любопытно и другое. Длиннопробежные частицы, обнаруженные в экспериментах Резерфорда, сравнительно долго не имели названий. Их именовали Н-частицами. Предполагались самые различные названия, но Резерфорд, их открывший, настоял на том, чтобы их назвали протонами. Их так называют и по сей день. Как свидетельствуют современники Резерфорда, учёному хотелось, чтобы это название отмечало «изначальность», ибо «протос» — первый, первородный, и в то же время напоминало людям о Прауте, том самом химике, который за сто лет до Резерфорда выдвинул свою гипотезу: все элементы построены из водорода.
В чём тут дело?
После того как описано первое превращение элементов, напрашиваются слова: всё стало на свои места. Однако такое утверждение было бы эффектным, но… бессодержательным. Можем ли мы и сейчас сказать, что в физике не осталось никаких неясностей? Ни в коем случае! А тогда? Тогда и тем паче… Прежде всего и сам Резерфорд, предложив модель строения атома, не столь уж твёрдо был в ней убеждён на первых порах и прекрасно осознавал её уязвимость для математиков. Математические расчёты со всей неумолимостью доказывают, что в такой модели электроны должны непременно упасть на ядро, поскольку, как утверждает классическая электродинамика, заряжённая частица, двигаясь с ускорением, непрерывно теряет энергию. Но атом-то на самом деле устойчив. В чём тут дело?
Это становилось ясным по мере уточнения и развития резерфордовской модели. В 1913 г. датский физик Нильс Бор предложил свою модель атома, опираясь на идеи Резерфорда и квантовую теорию Макса Планка. Модель Н.Бора сложна для описания, и поэтому мы изложим её так, как это принято в популярных изданиях. В ней, в модели Н.Бора, электрон вращается не на любой орбите, а только на определённой, «разрешённой», и при этом никакого излучения не наблюдается. Излучение происходит только тогда, когда электрон «перескакивает» с одной орбиты на другую, выделяя или поглощая порцию, квант, энергии.
В 1913 г., когда Нильс Бор сформулировал принципы, объясняющие устойчивость атома, было уже известно около 40 радиоактивных элементов, в то время как в таблице Менделеева пустовало всего 7 клеток. Как же разместить на них такое количество элементов?
«Подкопы» под таблицу, как мы видели, предпринимались не раз, но такое случалось в более ранние годы её существования, когда в ней было больше гениального предвидения и интуиции, нежели экспериментальных подтверждений. Теперь же подвергать её какому-либо сомнению просто невозможно. Что же остаётся? Может быть, произвести некоторую перестановку, не особенно считаясь с последовательностью возрастания атомных весов? Ведь и сам Менделеев, как было замечено, не единожды нарушал это правило: тяжёлый кобальт помещал впереди более лёгкого никеля, то же самое относится к теллуру и йоду, аргону и калию.
Но всё решилось по-иному. Оказалось, что в одну и ту же клетку следует помещать по нескольку радиоактивных элементов, химически одинаковых, но имеющих разный атомный вес. Ф.Содди назвал их изотопами, что в переводе с греческого значит «одноместные».
Рентгеновские лучи много уже дали и науке, и практике, а природа их всё ещё оставалась неясной. Их не удавалось ни отразить от какой-нибудь поверхности, ни преломить через какую-нибудь линзу. Отсюда предмет спора: волны это или частицы? Лишь в 1912 г. Макс фон Лауэ предсказал, а затем совместно со своими учениками показал дифракцию рентгеновских лучей в кристаллах.
Спор был разрешён: это волны, гораздо более короткие, нежели видимый свет или даже ультрафиолетовое излучение.
Развивая достигнутый Лауэ успех, отец и сын Брегги разработали рентгеновский метод анализа кристаллических структур.
Всё это было далёкими вопросами для лаборатории Резерфорда. Поэтому-то он и был очень удивлён, когда один из его учеников Генри Мозли выразил непреодолимое желание работать с X-лучами. Но он не стал этому препятствовать. А Мозли был увлечён боровской теорией устойчивости атома и писал Резерфорду, что всем своим существом чувствует её справедливость, что готов сделать всё возможное, дабы положить конец широко распространённому убеждению, будто построение Бора сводится к удачному жонглированию хорошо подобранными числами.
Выяснилось, что X-лучи также неоднородны, т. е. хотя все они коротковолновые, но одни из них имеют большую частоту, другие меньшую; иначе говоря, у них тоже свой спектр.
Как рождаются X-лучи? При падении катодных лучей на твёрдое тело. Это уже установлено. Мозли вооружился катодной трубкой, им же сконструированной и изготовленной, и целиком погрузился в измерение частот рентгеновских спектров. Он последовательно наносил на антикатод различные вещества и подвергал их воздействию катодных лучей, регистрируя в каждом случае длину волны характерного рентгеновского излучения. Ему удалось найти зависимость между длиной волны главных линий рентгеновского спектра и порядковым номером атома химического элемента. Об этом сам он сказал так: «В атоме имеется основное свойство, которое увеличивается на известную величину при переходе от одного элемента к следующему. Это свойство может быть только заряд положительного ядра атома».
Такая гипотеза была выдвинута ещё до Мозли голландцем Ван дер Броком в 1913 г., и её поддерживал Бор. Но гипотеза была совершенно бездоказательна, не связана ни с каким экспериментом. Мозли вовсе не сделал случайного открытия. Он прекрасно был осведомлён о гипотезе голландца, она ему нравилась своей ясностью и простотой, и он в том же 1913 г. заявил своему шефу, что собирается «решить эту проблему систематическими измерениями высокочастотных спектров».
Титаническая работа Мозли показала, что последовательность расположения элементов в таблице Менделеева строго закономерна, порядковый номер каждого элемента — это вполне опредёленная его характеристика — заряд ядра. Правда, формулировку закона пришлось несколько видоизменить: свойства элементов находятся в периодической зависимости не от их атомного веса, а от заряда их ядра. То, что казалось досадным исключением в таблице элементов («неправильность» расположения кобальта и никеля, калия и аргона), после работ Мозли нашло себе объяснение и вызвало восхищение блестящей интуицией Менделеева.
Всего три-четыре работы Мозли были опубликованы (он погиб в 1915 г. на турецком фронте), но они по праву признаны классическими. Измерив рентгеновский спектр самого тяжелого элемента — урана, Мозли выяснил, что порядковый номер его — 92 и, стало быть, элементов всего должно быть 92. Как известно, Менделеев оставил в таблице пустые места, предсказав, что в будущем найдут элементы, соответствующие указанным химическим свойствам. Часть из них была открыта еще при жизни Дмитрия Ивановича, некоторые же клетки продолжали пустовать. Сличая рентгеновские спектры, Мозли подтвердил, что должны быть открыты элементы с порядковыми числами 43, 72, 75, 85 и 87.
И всё же существование изотопов не было понятным даже после того, как Резерфорду удалось наблюдать первое «искусственное» превращение элементов. Проще всех устроен атом водорода: ядро, состоящее из одного протона, и один электрон на орбите. Масса протона настолько велика по сравнению с массой электрона, что последнюю при расчетах можно не принимать во внимание. Если так, то масса любого ядра определяется числом входящих в него протонов, чем выразится и атомный вес элемента. Однако почему же атомные веса дробные? Ведь нельзя же допустить, что в ядре помимо целых протонов заключены и какие-то части его. На это, кажется, есть ответ: изотопы одного и того же элемента неравномерно распределены в природе, и потому атомный вес элемента является фактически средним (не арифметическим, а сообразно с учётом процента распространения каждого изотопа). Таким образом даётся объяснение и «неправильностям» в клетках периодической системы, хотя бы аргона и калия. Просто в природе больше тяжёлых изотопов аргона, чем лёгких, а у калия картина обратная.
Однако очень трудно было объяснить разницу между зарядом ядра и атомным весом — ведь если последний определяется числом протонов, а каждый из них несёт один положительный заряд, то численно эти величины должны были совпадать. Атом в целом нейтрален. Следовательно, число электронов, вращающихся на орбитах, должно быть равным заряду ядра. Если, к примеру, у лития атомный вес — 7, а заряд ядра 3, то и электронов на орбите тоже 3. Что же даёт ему «лишнюю» массу в 4 единицы? Оставалось предположить только одно: в ядре находится 7 протонов и 4 электрона, остальные 3 — на орбитах (вспомним модель Дж. Дж. Томсона). Представление малоубедительное, ибо естественно возникал вопрос: а почему они в ядре не слипаются? Тем не менее лучшего объяснения в то время придумать не могли.
После замечательного эксперимента Резерфорда по превращению азота в кислород в течение довольно длительного времени ничего такого, что остановило бы всеобщее внимание, в атомной физике открыто не было. Объясняется это несколькими причинами. Одна из главных — это усиленное развитие физики теоретической, когда вводились в науку ранее неприемлемые понятия, без которых теперь физика не могла двигаться дальше.
Ещё в 1913 г. обсуждалась планетарная модель атома Резерфорда, основанная на новых квантовых законах. Лорд Релей, председательствовавший на собрании, где был сделан доклад, на предложение высказаться по существу вопроса, сообщил, что он придерживается правила, по которому человеку в его возрасте не следует принимать участия в дискуссии по поводу новых идей.
Представления о структуре атома видоизменялись, усложнялись, — при этом производились сложнейшие математические расчёты, продолжались давние споры о природе света, будоражила всех волновая механика, не давали покоя понятия о квантах, теория относительности Эйнштейна и многое другое.
Дискуссии по всем этим вопросам были ожесточённые, новые идеи завоёвывали себе дорогу с большим трудом, так как требовали отказа от привычного, устоявшегося образа мышления. Хорошо известно относящиеся к тем временам парадоксальные высказывания Нильса Бора: «Перед нами, без сомнения, безумная идея. Весь вопрос о том, достаточно ли она безумна для того, чтобы быть правильной». Лорд Релей же, отрицательно отнесшись к квантовой механике, выразился очень дипломатично: «У меня есть трудности в принятии этого как картины, которая действительно имеет место». Но далеко не все учёные из числа неразделявших новые взгляды в науке, были столь сдержанны и тактичны в своих высказываниях, поэтому страсти на всевозможных конгрессах и совещаниях достигали высокого накала. Высшей язвительности по адресу сторонников новых идей достиг, пожалуй, известный физик-теоретик Пауль Эренфест, пообещавший на дискуссию по квантовой механике привезти своего попугая и выдвинуть его «кандидатуру» в председатели. Попугай был им обучен произносить фразу: «Но, господа, это не физика!»
Экспериментальная физика, таким образом, оказалась призванной подтвердить или опровергнуть новые представления. Но не только это затормозило продвижение в области превращения элементов.
Удачам Резерфорда по получению новых элементов при использовании для этого альфа-частиц вскоре наступил предел. Не удалось наблюдать разрушения элементов более тяжёлых, чем калий. Объяснить это было нетрудно: с увеличением порядкового номера возрастает заряд ядра, и направленная на него альфа-частица, имеющая одноимённый заряд, отбрасывается в сторону со всё большей силой. Некоторые из лёгких элементов, такие, например, как те же гелий, углерод, кислород, также не поддавались воздействию альфа-частиц. Составление энергетического баланса показало, что здесь причина была в том, что имевшаяся в распоряжении Резерфорда «артиллерия» не была достаточно мощной: энергии его альфа-частиц не хватало для того, чтобы выбить протон из ядер этих элементов.
Встал вопрос: как получить более мощные снаряды? Конечно, различные радиоактивные элементы давали альфа-частицы неодинаковой энергии, но достаточно ли ограничиться подбором такого источника их?
Употребляя язык современных понятий, можно было бы сказать: необходима механизация подобных исследований. И это было сделано. Ученики Резерфорда Ж.Кокрофт и Э.Уолтон сконструировали установку, в которой можно было ускорять протоны, заставляя их проходить через сильные электрические поля.
Добившись успеха, они приступили к непосредственному эксперименту превращения, логически рассудив, что наиболее подходящим объектом для этого будет литий: сила отталкивания будет не столь велика вследствие малости заряда ядра элемента и самого «снаряда» — протона, у которого он равен не двум, как у альфа-частицы, а всего лишь единице.
Опыт удался, и по длине пробега образовавшихся частиц исследователи определили, что они являются не чем иным, как ядрами гелия, т. е. альфа-частицами.
Понятие «расщепление ядра», применявшееся без достаточных оснований к другим ядерным превращениям, в этом эксперименте получило своё конкретное выражение. Ядро лития под ударом протона распалось на два ядра гелия. Обычно сдержанный и уравновешенный Кокрофт пришёл в неописуемое волнение. Правда, он не выскакивал, как Архимед, из ванны голым и не кричал «Эврика!», но выбежал вечером из лаборатории на людную улицу и с дикой радостью оглядывал прохожих, а когда замечал знакомого, то ошалело сообщал ему: «Мы расщепили атом! Мы атом расщепили!» И так с обалделой улыбкой бежал дальше в поисках нового знакомого.
Успех Кокрофта и Уолтона воодушевил других исследователей, и они форсировали уже ведущиеся ими разработки конструкций для получения частиц высоких энергий. Наиболее удачной из таких следует считать циклотрон, разработанный и построенный Э.Лоуренсом и М.Ливингстоном. Это циклопическая установка, в которой ускорения частиц достигают с помощью магнитного поля и высокочастотного переменного тока.
Конечно, циклопической эта установка была лишь для тех времен; ныне на фоне гигантских ускорителей она выглядела бы малюткой. Однако эта малютка позволила учёным достичь больших успехов в изучении строения атома и превращения элементов. Не случайно элемент № 103, полученный впоследствии американскими учёными, получил имя лоуренсий.
Особым вниманием учёных по-прежнему пользовались изотопы. Физик Ф.Астон разработал метод определения величины массы частицы и сконструировал прибор, названный масс-спектрографом, с помощью которого атомный вес можно стало определять с большей точностью, чем вычислением по эквиваленту. Астон, подвергнув масс-спектрографическому анализу таблицу Менделеева, обнаружил, что изотопы есть у всех известных в то время химических элементов.
В 1932 г. сенсационным было сообщение американских учёных Г.Юри, Ф.Брикведде и Г.Мерфи об открытии ими изотопа водорода с атомным весом не единица, а два. Нашли способ его получения из так называемой тяжёлой воды, молекула которой состояла из изотопа водорода и обычного кислорода. Сама тяжёлая вода всегда присутствовала в очень незначительных количествах в воде обычной. Такой особый водород стали называть дейтерием. Если атом его ионизировать, т. е. оторвать от ядра его единственный электрон, то образуется «снаряд», более тяжёлый, чем протон, но имеющий тот же заряд. Э.Резерфорд предложил назвать новую частицу диплоном, но в науке закрепилось другое название — дейтерон, или дейтрон.
С помощью циклотрона оказалось возможным ускорять, сообщая им тем самым большую энергию, как протоны, так и дейтероны и альфа-частицы. «Атомная артиллерия» совершенствовалась, но всё же обстрел атома всегда представлялся очень непростой задачей, так как все её «снаряды» подвергались отталкивающему действию одноимённо заряженного ядра.
Что же касается изотопов, то в их изучении, разделении, использовании достигли многого, но вопрос о том, почему атомы одного и того же элемента имеют различную массу, оставался открытым.
Чем дальше в лес…
О первом превращении ядра, как уже говорилось, Резерфорд мог судить по появлению протонов. С помощью экрана из сернистого цинка не представлялось возможным регистрировать появление бета- (электронов) или гамма-лучей. А немецких учёных Боте и Беккера как раз интересовало, не возникает ли при бомбардировке атомного ядра альфа-частицами что-нибудь ещё, кроме протонов. В качестве источника альфа-частиц они применили полоний, для мишени взяли некоторые лёгкие элементы. В опыте было обнаружено возникновение каких-то исключительно энергичных лучей, для которых не был преградой даже свинцовый экран с толщиной, вполне достаточной, чтобы задержать не только бета-, но и гамма-излучение. Особенно заметно было возникновение таких лучей, когда под обстрелом альфа-частиц находился элемент бериллий. Следует заметить, что энергия альфа-частиц, используемых Боте и Беккером, была ниже, чем та, которую несли альфа-частицы в экспериментах Резерфорда. И именно тот элемент, у которого Резерфорд не мог зарегистрировать акта превращения, в опыте немецких учёных показал возникновение исключительно мощного излучения.
Бериллиевое излучение, как стали его называть, заинтересовало многих физиков, так как, по всей видимости, свидетельствовало о том, что альфа-частицы захватываются ядром без выбивания из него протонов.
Научные наследники Пьера и Марии Кюри — их дочь Ирен с мужем, супруги Жолио, взялись за изучение этого процесса и воспроизвели эксперименты немецких учёных с использованием более совершенной регистрирующей аппаратуры. В специальной установке они подвергли действию бериллиевого излучения различные вещества. Ничего особенного не было замечено при прохождении этих лучей через массивные свинцовые экраны, кроме того, на что уже было указано ранее. Но неожиданный эффект получился тогда, когда лучи пропускались через преграды из веществ, содержащих водород (парафин, целлофан).
В камере Вильсона, замечательном регистрирующем приборе, позволяющем сфотографировать пути летящей частицы, появились следы, со всей несомненностью указывающие на то, что частицы эти — протоны.
Этому явлению требовалось объяснение. Оно напрашивалось: бериллиевые лучи, обладающие огромной энергией, приводят в движение протоны, находящиеся в ядре лёгкого элемента. У массивных ядер такой процесс затруднён, поэтому и зарегистрированных камерой Вильсона протонов гораздо меньше.
Казалось бы, всё логично. Но вот беда: не сходится энергетический баланс. По величине пробега протонов представлялось возможным измерить их энергии, и это, конечно, было сделано. Результат измерения был ошеломляющим. Энергия лучей, под воздействием которых вылетали протоны, в десять с лишним раз превосходила энергию альфа-частиц первоисточника — полония. Возникал старый тривиальный вопрос: откуда энергия?
Супруги Жолио-Кюри опубликовали результаты своей работы, не скрывая своих трудностей. Естественно, что многие учёные недоверчиво отнеслись к экспериментам Жолио-Кюри, так как они не дали удовлетворительного объяснения. Однако в лаборатории Резерфорда сообщению французов оказали исключительное внимание. Джеймс Чэдвик немедленно проверил эксперименты Жолио-Кюри и получил результаты, ещё более несовместимые с предположением об электромагнитной природе бериллиевых лучей. Их воздействию он подверг азот и аргон, значительно превосходящие своей массой водород, и также обнаружил появление частиц с большой кинетической энергией. Расчёт показал, что в таком случае энергия новых лучей должна превосходить исходную уже в 20 и 30 раз. Но не могло же быть так, что энергия этих лучей менялась в зависимости от того, на что они действовали. Всё это навело Чэдвика на мысль, что бериллиевое излучение вовсе не электромагнитной природы, а представляет собой поток частиц, по массе примерно равных протонам, но совершенно не имеющих заряда.
Так была открыта новая элементарная частица — нейтрон.
Открытие, можно сказать, было в руках у французских учёных, но оно выскользнуло, как сказочная жар-птица. Всего пять недель минуло с тех пор, как опубликовали Жолио-Кюри результаты своей работы, и вот англичанин строго и последовательно разбирает их, проверяет, ставит добавочные эксперименты и совершает открытие.
Не следует, однако, думать, что резерфордовскому ученику сильно повезло, что он счастливчик, волей сложившихся обстоятельств пожавший плоды трудов французских учёных. Совсем нет! Он был подготовлен к открытию, шёл к нему уже много лет. За двенадцать лет до описываемых событий Резерфорд высказал убеждение в том, что со временем должна быть обнаружена частица, не имеющая заряда. Он говорил об этом в так называемой бейкерианской лекции ещё в 1920 г. Ни Ирен, ни Фредерик Жолио-Кюри своевременно не ознакомились с текстом её, полагая, что в таких лекциях редко можно найти что-нибудь новое, прежде не публиковавшееся. По собственному признанию Фредерика Жолио-Кюри, если бы случилось иначе, то нейтрон почти наверняка был бы открыт в Париже раньше, чем в Кембридже.
Что же дала новая частица физикам-исследователям? Очень много. Появилась возможность обстреливать ядра элементов, не преодолевая отталкивающего их действия. Ведь нейтрон не имеет заряда, он электрически не взаимодействует ни с протоном, ни с электроном. Открылась перспектива, правда, ещё пока не совсем ясная, попадать в ядро тяжёлой частицей с большей лёгкостью, не прибегая к помощи циклопических установок.
В том же году советский учёный Д.Д.Иваненко и независимо от него немецкий — В.Гейзенберг разработали теорию строения атомного ядра, отличную от прежних представлений. В ядре нет никаких электронов, не надо больше задавать вопроса — почему они не слипаются? Ядро составлено из протонов и нейтронов. Этим и объясняется разница в массах изотопов. Ядро тяжёлого водорода, например, в своём составе имело один протон и один нейтрон, поэтому заряд этого изотопа оставался неизменным, тогда как масса была удвоенной. В скором времени, менее чем через два года, был открыт и ещё один изотоп водорода, названный тритием, или сверхтяжёлым водородом, у которого в ядре было два нейтрона и один протон. Каждый химический элемент стал рассматриваться теперь как совокупность атомов, располагающих одинаковым числом протонов в ядре и неодинаковым — нейтронов.
Не столь многообещающее, но тоже сильно впечатляющее открытие было сделано в том же году. Физик-теоретик П.Дирак предсказал существование своеобразного антипода электрона — частицы его массы, но противоположного заряда. Далеко не всех убедил этот учёный, однако при исследовании следов частиц космического излучения американец К.Андерсон нашёл этот антипод, который был назван позитроном. Видимо, сам он считал, что у него ещё недостаточно данных, чтобы твёрдо говорить о «внеземной» положительно заряженной частице, и первую публикацию об этом сделал не в научном, а научно-популярном журнале. Знаменитый физик Милликен вскоре показал Резерфорду фотографию, снятую в камере Вильсона, находившейся в магнитном поле, на которой явственно был виден след частицы малой массы. След этой частицы изгибался в противоположную сторону от следа, оставляемого электроном. Появились в атомной физике новые загадки, но многое, до того необъяснимое, стало для учёных ясным и определённым, был получен импульс для новых поисков и исследований.
Как же повели себя супруги Жолио-Кюри после того, как они «немного не дотянулись» до открытия нейтрона? Разочаровались в своих исследованиях и, что называется, опустили руки? Ничего подобного; наоборот, они повторили эксперименты Чэдвика и опубликовали сообщение, в котором подтверждали его вывод. Начался, по выражению Резерфорда, «бег на старте исследования», в котором лидировали Ирен и Фредерик Жолио-Кюри. Они стали систематически изучать, от каких веществ под воздействием альфа-частиц можно получить нейтроны. В октябре 1933 г. они выступили в Брюсселе на Сольвеевском конгрессе с сообщением о том, что под ударами альфа-частиц лёгкие элементы вроде алюминия испускают не только протоны, но и нейтроны и положительные электроны — позитроны. Но французов ожидал блистательный провал. Известный немецкий физик Лиза Мейтнер сказала, что она знакома с работами Жолио по предварительным сообщениям, повторила их эксперименты со всей тщательностью, но ничего, кроме эмиссии (испускания) протонов, обнаружить не смогла.
В несколько изменённом виде повторилось то, что в своё время было с Резерфордом. Некоторые участники брюссельской встречи восприняли доклад Жолио-Кюри с сожалением. Они заподозрили у Жолио-Кюри желание поспешным выступлением «отыграться» за неудачу с нейтроном. Только Нильс Бор, а затем и Вольфганг Паули ободрили французских учёных. Бор отвёл их в сторону и сказал, что считает полученные ими результаты очень важными. Эта, хотя и кулуарная, поддержка придала им силы и уверенности, несмотря на общее неприятие их выводов. Как знать, может быть, именно такой поворот событий и помог супругам Жолио сделать не менее важное открытие.
Не было бы счастья, да несчастье помогло.
Сразу же по возвращении в Париж супруги перепроверили всё, что ими было получено, убедились в своей правоте и продолжили опыты. В эти, по выражению биографа Фредерика Жолио, «враждебные дни» они старались «расчленить» свой эксперимент на отдельные этапы, максимально упростив его.
Они поставили себе целью ответить на вопрос: как зависит излучение нейтронов и сопутствующих им позитронов от скорости бомбардирующих атом альфа-частиц? Это изучалось постепенным отдалением от мишени радиоактивного источника. В одном из опытов источник альфа-частиц был убран совсем, а счётчик Гейгера, регистрирующий выделение из обстрелянной алюминиевой фольги заряженных частиц, продолжал щёлкать. Что-нибудь более непонятное было трудно придумать. Боясь ошибки, супруги попросили немецкого физика В.Гентера проверить исправность счётчика. Тот внимательно исследовал прибор и удостоверил, что он в полном порядке. Выходило, что алюминий после воздействия на него альфа-частиц сам становился радиоактивным. Волей-неволей вспомнилось давнее заблуждение, в которое впали и Резерфорд, и Мария Кюри, сделав вывод, что излучения радия или тория заставляют быть радиоактивными окружающие предметы. Выходит, что никакого заблуждения не было? Жолио-Кюри не затруднились измерить продолжительность эмиссии — 3 часа 15 минут. Называйте это как хотите — возбуждённая, наведённая, искусственная радиоактивность, но она — установленный факт! Получена даже фотография следов частиц с помощью камеры Вильсона в магнитном поле.
Сомнений нет: это те самые позитроны, которые предсказал Дирак, которые обнаружил Андерсон в составе космического излучения. Теперь они обнаружены на Земле, французские учёные вызвали их к жизни. Эксперименты были продолжены — заменены мишени. Под воздействием альфа-частиц возбудилась позитронная эмиссия у бора и магния. Измерили её продолжительность: в первом случае — 14 минут, во втором — 2 минуты 30 секунд.
Теперь надо объяснить, что происходит с мишенью, в частности с алюминием; картина представляется такой: поглотив альфа-частицу, атом алюминия увеличивает свой заряд на 2 и становится атомом фосфора; правда, несколько необычного, имеющего массовое число не 31, а 30.
Но как убедить в этом химиков? Для них присутствие химического элемента можно доказать, только проведя характерную аналитическую реакцию. Химической разницы у изотопов нет, потому не так уж и трудно показать присутствие фосфора, ибо известна специфическая реакция его обнаружения. Беда лишь в том, что существует-то этот фосфор в течение трёх с половиной минут, да и образуется его ничтожные доли миллиграмма. Жолио обратилась за содействием к знакомым химикам, но те ничем не могли помочь: не существует экспресс-анализ фосфора; требуется несколько часов, чтобы определить его наличие. Пришлось физикам стать в какой-то степени химиками. Они сами разработали метод, который дал им возможность зарегистрировать новообразованный фосфор. Облучённую альфа-частицами алюминиевую фольгу они быстро растворили, после чего в раствор ввели обычную фосфорную соль и туда же добавили реактив, осаждающий фосфор. Весь фосфор, как прибавленный, так и новообразованный, был отделён от алюминия. Поднесённый после этого к осадку счётчик Гейгера зарегистрировал своими щелчками выбрасывание фосфором заряженных частиц.
Что и требовалось доказать!
Не столь уж трудно было написать после этого схему процесса: поглощая альфа-частицу, атом алюминия выбрасывает нейтрон и превращается в изотоп фосфора, который существует недолго; он радиоактивен и, выбрасывая позитрон, становится кремнием. Аналогична последовательность для двух других элементов: бор — радиоактивный азот — углерод; или: магний — радиоактивный кремний — алюминий.
Совокупность таких доказательств могла убедить самого предубеждённого скептика. Узнав об этих результатах (они были опубликованы в Париже в «Отчётах» Академии наук), Резерфорд не замедлил направить в адрес французских учёных письмо, в котором сообщал, что он в восторге от проделанных ими опытов и полученных результатов.
Значение работы Жолио было оценено всем учёным миром, что выразилось в присуждении им Нобелевской премии. Если до этого времени радиоактивность можно было лишь наблюдать, регистрировать, изучать, то теперь оказалось возможным её создавать в элементах, которые в природе самопроизвольно не распадаются.
…Тем больше абсурда?
Искусственная радиоактивность произвела на всех ошеломляющее впечатление, и группа молодых итальянских физиков, возглавляемых Энрико Ферми, задалась вопросом: а что, если произвести аналогичную работу, но в качестве снарядов использовать не альфа-частицы, а нейтроны, которые в ядро будут проникать несравненно легче?
Ферми был замечательным теоретиком, но в экспериментальной физике не имел тогда достаточного опыта, а дело было совершенно новое. Прежде всего необходимо было располагать источником нейтронов. Полоний-бериллиевый источник был испробован на облучении нескольких элементов, но никаких признаков наведённой активности обнаружено не было. Тогда Ферми решил его заменить более сильным — радон-бериллиевым. В этом молодым физикам помог директор физической лаборатории департамента здравоохранения Джулио Трабакки, которого шутливо называли «божьим промыслом» за то, что у него, как у человека, педантично любившего порядок, можно было найти всё, начиная с отвёртки и кончая источником нейтронов.
Один грамм радия, хранившийся в подвалах физического института, непрерывно отделял при своём распаде благородный и радиоактивный же газ радон. Его-то и отдал «божий промысел» Ферми и его группе. Трубочку, в которой был бериллий, заполняли радоном, погружали конец её в жидкий воздух, чтобы газ сконденсировался; после этого трубочку запаивали, и она становилась источником нейтронов. Так как активность радона через несколько дней исчезала, трубочки приходилось всё время изготовлять заново.
Ферми не предполагал провести какой-то единичный лабораторный эксперимент, он хотел проверить нейтронным облучением все элементы периодической системы. Для этого, конечно, нужно было располагать ими, если и не в чистом виде, то хотя бы в соединениях. Эмилио Сегре, ставший потом знаменитым учёным, повесил на плечо сумку и отправился «в поход за добычей» к известному тогда торговцу химикалиями Троколли. К великому удивлению и счастью, Сегре удалось набить свою сумку сразу же чуть ли не всеми нужными химикалиями, причём торговец проявил отсутствие какой бы то ни было корысти. Когда Сегре, просмотрев свой список, дошёл до цезия и рубидия, Троколли отдал две банки бесплатно, сказав, что их никто не спрашивал уже 15 лет, и возгласил при этом торжественно по-латыни: «Даю тебе рубидий и цезий даром из любви к Господу нашему».
Облучение элементов нейтронами было начато строго систематически в порядке возрастания атомного веса. Начали с водорода, затем облучили литий, бор, углерод, азот, кислород и… не получили никакого эффекта. Наступил период разочарования и уныния. А у кого он в своё время не наступает? Тут важно не упасть духом и найти в себе силы преодолеть этот неприятный и трудный рубеж. Ферми сумел преодолеть и продолжил работу. И вот первый, пока ещё слабый успех: облучённый фтор заставил несколько раз щёлкнуть счётчик Гейгера — Мюллера.
Дальше пошло лучше.
Чтобы измерения не искажались радиацией источника нейтронов, счётчики находились в комнате, далеко отстоящей от лаборатории, где проводилось облучение. Возбуждённая радиоактивность в том или ином элементе бывала очень непродолжительной, и, чтобы успеть её зарегистрировать, экспериментаторы неслись по коридору сломя голову.
Понятно, что одного щёлканья счётчика для каких-то научных выводов из эксперимента было недостаточно; следовало определить, что же получается из элемента, подвергшегося воздействию нейтронов. Для этого нужен был профессиональный химик. «Божий промысел» располагал и этим. В его лаборатории работал Оскар Д'Агостино, и профессор Трабакки познакомил с ним всех нейтронных энтузиастов группы Ферми. Правда, Д'Агостино стажировался тогда в области радиохимии в Париже, в лаборатории М.Кюри, в Риме же он находился лишь на пасхальных каникулах. Но узнав о работе, которую предлагает ему Ферми, он «не воспользовался обратным билетом в Париж», по выражению Сегре.
Определение образовавшихся элементов проводилось по методу, который использовал недавно Фредерик Жолио-Кюри. Эксперименты велись систематически и последовательно освещались в научном журнале.
Резерфорд, которому Ферми направил отчёт о своих опытах по наведению радиоактивности с помощью нейтронов, не замедлил горячо поблагодарить молодого физика. «Поздравляю Вас, — писал он, — с успешным побегом из сферы теоретической физики! По-видимому, Вы откопали неплохое занятие для начала. Возможно, Вам будет интересно узнать, что профессор Дирак также проводит некие опыты. Это кажется хорошим предзнаменованием для будущего теоретической физики!».
Следует иметь в виду, что вовсе не обязательно, чтобы после воздействия нейтронов на ядро в нём возбуждалась позитронная эмиссия. Стандарта не было: при ядерных превращениях наблюдалось выделение альфа-частиц или протонов, гамма-лучей или электронов. При поглощении нейтрона ядро становилось неустойчивым, нестабильным, но предугадать, какого характера излучения последует за этим, в то время не представлялось возможным.
Приняв все предосторожности, Ферми и его группа обстреляла нейтронами уран, установила, что он активизируется, и стала выяснять, какой элемент получается в результате ядерного превращения. Уже описанным методом соосаждения и последующей регистрацией активности молодые итальянцы искали в осадке элементы, расположенные согласно периодическому закону в непосредственном соседстве с ураном. Ни один из элементов, начиная с атомного номера 86 и кончая ближайшим к урану номером 91, не регистрировался. Оставалось предположить, что образуется совершенно новый, в природе неизвестный элемент, номер которого больше последнего в таблице, т. е. 93.
Рассуждение было вполне логичным: при захвате нейтрона ядро элемента становилось неустойчивым, после чего выбрасывался электрон и образовывалось устойчивое ядро большего порядкового номера.
Сообщение о проделанных опытах было очень осторожным, и в нём не упоминалось об открытии нового элемента, ибо Ферми и его группа считали, что для такого утверждения требуются более веские доказательства.
Вся исследовательская группа римских физиков организовалась стараниями декана физического факультета профессора Корбино. Он всегда покровительствовал ей, помогал во всём, был в курсе всех её работ и гордился достижением своих мальчуганов, как он их называл. Крайне обрадованный их успехами, Корбино на сессии академии в присутствии короля выступил с речью и обронил неосторожные слова: «По этим успешным опытам, за которыми я слежу ежедневно, я полагаю себе вправе заключить, что этот элемент (93-й. — Б.К.) уже получен». Страстная речь патрона очень обеспокоила Ферми, настолько, что он не спал по ночам. Дело в том, что фашистская печать на следующий день подняла трезвон о «культурных завоеваниях фашизма», о том, что «Италия при фашистском строе снова выступает в своей давнишней роли учителя и представляет собой ведущую силу во всех областях».
Сам Ферми не имел абсолютной уверенности в получении им элемента № 93, не говоря уже о том, что шумиха вокруг этого события ему просто претила. Он чувствовал, что вся его репутация учёного поставлена на карту: его легко могут обвинить в неоправданных спекуляциях, хотя он сам к этому не имеет никакого отношения. А тут ещё в одной из итальянских газет появилась сенсационная выдумка о том, что Ферми подарил королеве Италии маленький флакончик с 93-м элементом.
Зарубежная пресса живо откликнулась на известие о новом элементе — броские заголовки останавливали внимание физиков всего мира. В Лондоне отнеслись ко всему этому с большой осторожностью: «Известие из Рима об искусственном получении нового элемента… вызвало огромный интерес в научных кругах. Английские учёные воздерживаются от каких-либо выводов до получения дальнейших подробностей о работе академика Ферми, а до тех пор не считают возможным согласиться с предположением, высказанным сенатором Корбино».
Ферми был страшно огорчён: ведь английских физиков возглавлял не кто иной, как Резерфорд, который, конечно, был для него непререкаемым авторитетом. Именно от него так недавно было получено замечательное, одобряющее и ободряющее письмо, вдохновляющее на продолжение работ по наведению радиоактивности с помощью нейтронов. Сейчас же Ферми чувствовал, что сомнения английских физиков, и Резерфорда в том числе, вполне правомерны.
Корбино, с которым посоветовался Ферми, несмотря на свою убеждённость в том, что открытие состоялось, согласился с доводом, что подобные заявления слишком опасны, и необходимо как-то утихомирить разбушевавшиеся страсти. Совместно они написали заметку в газету, где Ферми указывал на то, что его работы показали лишь возникновение радиоактивности в элементах, обстреливаемых нейтронами, и превращение их в другие элементы; открытие элемента № 93 пока только предположительное; чтобы считать его доказанным, потребуется ещё немало тщательнейших исследований… С полной недвусмысленностью Ферми указывал, что главная цель исследований его группы заключается не в том, чтобы получить новый элемент, а в изучении явления в целом.
Это заявление Ферми мало чему помогло, и вокруг 93-го элемента в учёной среде разгорелись споры и дискуссии.
Когда-то алхимики верили в существование «философского камня», с помощью которого можно было бы превращать одни элементы в другие, прежде всего, конечно, неблагородные металлы в золото. Теперь же передовые учёные склонялись к мысли, что нечто подобное найдено. Нейтрон — это истинный философский камень, именно он превращает одни элементы в другие. Какое там золото! С помощью нейтрона удалось получить элемент, какого и в природе не существует!
Но удалось ли? Физики разных стран повторяли эксперимент Ферми, проверяли, уточняли и расходились во мнениях. У приверженцев получения 93-го элемента складывалось мнение, что он тоже радиоактивный элемент. В общем, представлялась такая же картина, какую давно уже выявили физики — цепь радиоактивных превращений урана или тория, только идущая за пределы периодической системы. Среди опровергателей особенно выделились немецкие физики супруги Ида и Вальтер Ноддак, которым принадлежала честь открытия редчайшего элемента рения. Ида Ноддак в серьёзном научном журнале выступила со статьёй, в которой указала на возможность получения при бомбардировке урана нейтронами не новых тяжёлых («сверхтяжёлых» — по таблице) элементов, а наоборот, уже хорошо известных — лёгких, образующихся в результате распада ядра на два или несколько крупных осколков.
Несмотря на большой авторитет Ноддак, к их предположению никто из ведущих физиков с серьёзностью не отнёсся, слишком оно казалось невероятным. Ида Ноддак уговорила своего мужа обратиться по этому вопросу к его близкому другу, ученику Резерфорда — Отто Гану, состоявшему профессором в Институте кайзера Вильгельма. Свидание учёных состоялось, но осталось без последствий. Отто Ган, выслушав своего друга, придал своему лицу суровое, даже воинственное выражение и, затянувшись сигарой, безапелляционно заявил: «Это невозможно!» Он предложил Ноддакам оставить сумасбродную идею о расщеплении урана и никогда о ней не вспоминать, ибо в научном мире такую глупость никогда не простят. Ида Ноддак свою статью прислала Ферми, но ни сам он, никто из его группы не придал ей значения.
В работе группы Ферми произошло такое, что заставило заняться исключительно новым непонятным явлением. По-прежнему испытывали на радиоактивность некоторые металлы, облучённые нейтронами. Однажды, когда таким металлом было серебро, вдруг заметили, что радиоактивность его изменяется в зависимости от… находящихся поблизости предметов. Сначала, конечно, это было приписано неточности измерения, ошибке опыта, но проверка показала, что всё правильно. Стали между источником нейтронов и облучённым металлом помещать различные экраны. Свинцовая пластинка очень незначительно повлияла на величину возбуждённой радиоактивности. Тогда Ферми рассудил: свинец — вещество тяжёлое, испытаем лёгкое, и поставил парафин. Облучив нейтронами, прошедшими через парафиновый экран, серебряный цилиндрик, его поднесли к счётчику — он словно с цепи сорвался, показав увеличение радиоактивности серебра в сотню раз. Это казалось какой-то чёрной магией: наиболее массивное вещество свинец ничем почти не воспрепятствовал потоку нейтронов, а лёгкое, парафин, сделало что-то невообразимое.
Ферми очень скоро объяснил неожиданный эффект. В парафине много водорода. Его ядра (протоны) обладают такой же массой, как нейтроны. Сначала происходит столкновение нейтрона с протоном, а затем уже попадание его в ядро серебра. При столкновении теряется значительная часть энергии нейтрона (как у двух бильярдных шаров), и он замедляет своё движение. Медленный же нейтрон с гораздо большей вероятностью будет захвачен ядром серебра и вызовет превращение.
Если такое объяснение правильно, то ещё больший эффект можно будет наблюдать от нейтронов, прошедших через большое количество воды. Чтобы проверить это, физики отправились к дому Корбино, в сад, где находился большой бассейн с золотыми рыбками. Они погрузили источник нейтронов и серебряный цилиндрик в воду на определённом расстоянии, после чего замерили наведённую радиоактивность. Предположение Ферми блестяще подтвердилось. В тот же вечер физики собрались на квартире, чтобы написать первое сообщение о неожиданном эффекте в научный журнал. Все кричали, подсказывали, спорили друг с другом, срывались с места и носились по комнате. Когда они ушли, прислуга вежливо спросила хозяйку дома, с чего это они так перепились?
Предстояла большая работа — последовательно изучать радиоактивность, наведённую воздействием замедленных нейтронов, а пока следовало написать подробный отчёт о своих опытах. Через два дня их посетил профессор Корбино, который, как уже говорилось, всё время был в курсе того, что они делали и чего достигли. Узнав об их намерении, он довольно энергично воспротивился тому, чтобы об их открытии узнала печать. «Неужели вы не понимаете, — говорил он, — что ваше открытие может иметь промышленное значение? Вы должны сначала взять патент, а потом уже сообщать подробности вашего способа производства искусственных радиоактивных веществ».
Для молодых исследователей такая постановка вопроса была совершенно новой и неожиданной. Правила и порядки промышленности им были совсем неизвестны, едва ли они представляли себе, что их открытие может составить интерес для производства большого масштаба, а затем — в обычае ли учёных брать патент на свои открытия? Но Корбино настоял на своём. Мальчуганы привыкли слушать его советы и полностью им доверять. Совместная заявка была ими подана; авторами значились Ферми, Розетти, Сегре, Амальди, Д'Агостино, Понтекорво и Трабакки. Они не забывали своего «божьего промысла», который так старался помочь им во всех их исследованиях.
Однако попытки заинтересовать кого-нибудь из промышленников открытием оказались безуспешными: руководители фирм оставляли тогда ядерную энергию любителям фантастики.
На фоне многих интересных достижений новой физики не столь шумным и заметным было сообщение Ф.Панета в лондонском журнале «Природа» об опытах по бомбардировке бора нейтронами.
Между тем эти опыты имели принципиальное значение. Дело в том, что до сих пор последствия бомбардировки элементов нейтронами наблюдались лишь по косвенным показателям — регистрацией радиоактивности и по наличию следа элементарной частицы на фотопластинке. Ф.Панет, в течение семи недель обстреливая бор нейтронами, получил литий и гелий. Показать наличие гелия спектроскопически не составляло труда, но Панет не ограничился этим и измерил количество полученного газа. Это был первый случай, когда продукт превращения элементов стал доступен непосредственному измерению.
Но что же всё-таки 93-й элемент, получил его Ферми или не получил? Неужели этот вопрос ведущими физиками и химиками был оставлен без внимания? Нет, конечно, опыты Ферми повторялись, но выводы из них у учёных были неодинаковы. Гипотеза Иды Ноддак показалась Отто Гану настолько дикой, что он не желал о ней даже упоминать, сказав её супругу Вальтеру, что не хочет выставлять учёного в смешном виде, ибо предположение о раскалывании ядра урана — чистейший абсурд.
Да, в это, действительно, было трудно поверить, чтобы нейтроны ничтожной энергии производили бы такие разрушения в ядре, каких не удавалось добиться воздействием на него самых мощных снарядов. «Это напоминало, — по выражению Р.Юнга, автора книги «Ярче тысячи солнц», — то, как если бы на войне кто-нибудь предложил артиллеристам, безуспешно ведущим огонь снарядами самых крупных калибров по укрывшемуся в подземных убежищах противнику, попытаться добиться успеха с помощью шариков для пинг-понга».
Отто Ган и Лиза Мейтнер в 1917 г. заполнили 91-ю клетку периодической системы неизвестным ранее элементом протактинием. Теперь вместе с радиохимиком Фрицем Штрассманом они воспроизвели все эксперименты Ферми по воздействию нейтронов на уран и пришли к выводу, что при этом получались не один, а последовательно несколько заурановых (радиоактивных) элементов с порядковыми номерами от 93-го до 96-го.
К этому времени весьма интересные результаты получили Ирен Жолио-Кюри и югославский радиохимик Павел Савич. В продуктах реакции после обстрела урана нейтронами они, как сообщалось, обнаружили новый элемент, химическими свойствами напоминающий актиний. Однако более тщательное исследование показало, что новый элемент не может быть актинием; он, хотя и напоминает его, но ещё более похож на соседа по третьей группе — на лантан. Это было не что иное, как подтверждение абсурдной гипотезы Иды Ноддак. Ирен в неё не верила и старалась отделить новообразованный элемент от настоящего лантана. Ей казалось, что разделения удалось добиться методом фракционной перегонки. Судя по всему, новый элемент — трансурановый, но не из тех, что получены группой немецких физиков. Узнав обо всём этом, Ган сказал, что «Кюри и Савич очень сильно запутались». Он написал им частное письмо с просьбой повторить эксперименты с большей тщательностью. И не получил ответа. А вскоре вышла вторая статья Ирен, дополняющая первую. Оскорблённый Ган не захотел её читать, но Штрассман с таким жаром пересказал ему основные положения этой статьи, что Ган положил горящую сигарету на письменный стол и помчался в лабораторию. Выявилась фатальная ошибка Жолио-Кюри: не «похожий на лантан», а сам лантан обнаружила она!
Ган и Штрассман — первоклассные химики, они со всей несомненностью установили в продуктах реакции присутствие таких элементов, как лантан, барий и церий. Ошибка Жолио-Кюри состояла в убеждении, что она отделила от лантана элемент, «похожий на лантан», тогда как она отделила барий или церий. Но как могло это произойти, откуда здесь взялись элементы № 56, 57 и 58, так далеко отстоящие от урана? Это всё равно, как если бы в инкубатор положили яйцо страуса, а вылупились цыплёнок и голубь. Выходит, что атом урана под воздействием нейтрона расщеплялся на приблизительно равные части. В соответствии с общепринятыми в физике взглядами, это был чистейший абсурд, и разве сам Ган не то же самое говорил Вальтеру Ноддак? Тем не менее всё было настолько очевидным, что и химикам, и физикам ничего не оставалось, как заняться многократной и тщательной проверкой. У Гана и Штрассмана не осталось больше никаких сомнений в правильности полученных результатов. Они подготовили статью, в которой описали всё, но, проявляя исключительную осторожность, оговорились, что «как ядерные химики, тесно примыкающие к физикам, они не могут заставить себя совершить этот скачок, столь противоречащий всем явлениям, до сих пор наблюдавшимся в ядерной физике». Они даже допускали, что «редкое стечение случайностей привело их к ошибочным наблюдениям».
Почему же только Ган и Штрассман, а где же Лиза Мейтнер? Она не могла участвовать в этих экспериментах. «Коричневая чума» захлестнула Европу. Разжигалась расовая ненависть. Антисемитские законы гитлеровцев заставили многих учёных искать спасения вне пределов Германии. Эйнштейн был объявлен главарём «еврейской физики». Когда Германия захватила Австрию, Эрвин Шрёдингер, виднейший физик-теоретик, перешёл границу с одним лишь рюкзаком за плечами, добрался до Рима и отправился к Ферми с просьбой проводить его в Ватикан, где он надеялся найти убежище. Сам Ферми, слава итальянской науки, дождался вызова в Стокгольм на церемонию присуждения ему Нобелевской премии, поехал туда, зная, что уже не вернётся в Италию. Он давно уже обдумал свою эмиграцию, ибо расовые законы свирепствовали и в Италии, а жена Ферми была еврейкой. Лиза Мейтнер также была еврейкой, но пока она была австрийской подданной, ей не препятствовали работать в берлинской лаборатории. Когда же Австрии не стало, то ясно было, что она попадёт под действие фашистских антисемитских законов. Это грозило физическим уничтожением. Ей помогли голландские коллеги, доставшие разрешение на въезд в Голландию без паспорта. Оттуда она направилась в Стокгольм и тем избежала трагической участи.
Именно Лизе Мейтнер написал Отто Ган обо всех своих экспериментах и полученных результатах, прежде чем решился кому-нибудь о них сообщить. Он безоговорочно доверял её острому взгляду и наблюдательности, боялся строгой критики и ответа её ждал с большим волнением.
Лиза Мейтнер получила письмо Гана в то время, когда у неё гостил Отто Фриш, её племянник, тоже физик. Мейтнер рассказала ему о расщеплении урана в экспериментах Гана, но Фриш от какого бы то ни было обсуждения старался уклониться, ему это казалось пустой тратой времени; он хотел поговорить о перспективах своей работы — за этим, собственно, он и приехал к своей знаменитой тётке. Но от неё не так легко было отделаться. Он предложил пойти прогуляться и надел лыжи, надеясь, что свежий воздух охладит тётушку. Какое там! Она шла за ним и настойчиво говорила об одном и том же, не позволяя уклониться от темы. И она добилась своего, увлекла его новой проблемой, заставила спорить о природе открытия, выставляя аргументы и контраргументы. Своей матери он написал тогда: «Я чувствую себя как человек, который, пробираясь через джунгли, не желая этого, поймал за хвост слона и сейчас не знает, что с ним делать». Прежде всего они решили известить Нильса Бора. Когда Фриш добрался до Копенгагена и рассказал обо всём знаменитому учёному, тот воскликнул: «Как мы могли не замечать этого так долго!» Он был так взволнован, что едва не опоздал на пароход, отправляющийся в Швецию, откуда он должен был отбыть в США. Там он намеревался провести несколько месяцев в Институте прогрессивных исследований, где работал в то время А.Эйнштейн. Но, прибыв на место, Бор отправился прежде всего не к Эйнштейну, чтобы обсуждать с ним теории космоса, как предполагалось ранее, а к своему ученику Д.Уиллеру, профессору физики Принстонского университета, и сообщил ему об опыте Гана и Штрассмана и истолковании этого опыта Мейтнер и Фришем.
Если ранее развитие событий в исследованиях по физике атома исчислялось годами, то с этого момента стали решать дни и даже часы.
Урановый кошмар
Строго говоря, не церий, лантан и барий, полученные Ганом и Штрассманом, так взволновали физиков и химиков. Важно было другое: в процессе их образования из урана выделялось такое количество энергии, которое трудно было себе представить. Как подсчитали Лиза Мейтнер и Отто Фриш, при расщеплении одного атома урана энергии должно выделиться в 50 миллионов раз больше, чем при сгорании одного атома водорода в кислороде.
Бор был ещё в пути, когда Фриш повторил опыты Гана и Штрассмана с использованием осциллографа, регистрирующего электрические импульсы. Этот прибор был своеобразным атомным термометром; высота импульса на его экране характеризовала выделившуюся энергию. Сомнения не было: таких всплесков на экране Фришу никогда не приходилось наблюдать ранее.
На следующий день Фриш и Мейтнер послали в английский журнал статью «Деление урана с помощью нейтронов — новый тип ядерной реакции». В статье указывалось на возможность деления ядра урана после захвата нейтрона на два ядра других элементов. Так как они первоначально будут находиться в непосредственной близости и оба несут большие положительные заряды, то последует их взаимное отталкивание с огромной кинетической энергией. Она в 20 миллионов раз превосходит взрывчатую силу тротила.
Когда эта потрясающая новость дошла до Ферми, он понял, насколько был близко у цели, открывая 93-й элемент. Не теряя времени, он вместе с профессором Дж. Пегрэмом и Дж. Даннингом обсудил возможность постановки эксперимента по делению ядер урана, а сам устремился на свидание с Бором в Вашингтон. Даннинг вместе с профессором Дж. Слэком и Ю.Бутом сконструировали необходимую установку в тот же вечер. К 23 часам они провели решающий эксперимент, не зная, что уже 10 дней назад это всё сделано О.Фришем по другую сторону океана. А утром аудитория университета Джоржда Вашингтона, где проходила встреча по вопросам теоретической физики, с нетерпением ожидала выступления Бора и Ферми. Уже распространился слух, что два лауреата Нобелевской премии намереваются сообщить аудитории сведения первостепенного значения.
Бор не отличался красноречием, но его выступление произвело на всех присутствующих ошеломляющее действие. Когда он в последних своих словах пояснил, что ядерные осколки высокой энергии можно обнаружить простейшим прибором, то несколько физиков сорвались с мест и помчались в свои лаборатории, чтобы самим убедиться в том, что всё, сказанное Бором, — правда.
Через сутки о произведённых опытах своим читателям сообщили многие американские газеты. Доктор Л.Альварец, физик Калифорнийского университета, в этот день сидел в кресле парикмахера и был уже наполовину подстрижен, когда взгляд его упал на заголовок в газете: «Атом урана разделён на две половины, высвобождено 200 миллионов электрон-вольт энергии». Учёный отстранил парикмахера, вскочил с кресла и выбежал на улицу с развевающейся на ветру салфеткой. В радиационной лаборатории университета он ошарашил коллег необычайным известием, оценить по достоинству которое могли, конечно, не обыватели, уже привыкшие к различным газетным сенсациям и эффектам, а лишь те, кого непосредственно касались проблемы превращения элементов.
Как же всё-таки могло случиться, что такой учёный, как Энрико Ферми, мог не заметить деления ядер урана, которое, несомненно, происходило в его экспериментах? Много лет спустя этот вопрос был ему задан, и он пояснил, что виной всему была тонкая алюминиевая полоска, толщиной всего в три мила (0,0762 миллиметра), не позволявшая регистрировать всплески энергии на экране осциллографа. Ее ставили, чтобы отделить радиацию предполагаемого 93-го элемента, т. е. в качестве «радиационного сита». К слову сказать, два года спустя после группы Ферми такие же опыты поставили швейцарские физики. Аппаратура была та же. Однажды они забыли поставить алюминиевую фольгу в камеру и были поражены невероятно высокими кривыми на экране осциллографа, но посчитали, что «проклятый аппарат искрит». Перейдя на другой аппарат, в котором уже была алюминиевая фольга, они больше не наблюдали такого явления и вспомнили о нём, надо полагать, лишь в 1939 г., когда были проведены эксперименты Фриша, Даннинга и других физиков.
Итак, атом урана расщеплён — какие это может иметь практические последствия? О том, что при ядерных превращениях выделяется значительное количество энергии, знали ещё в 1919 г. благодаря экспериментам Резерфорда. Однако именно Резерфорд проявлял до конца дней своих обоснованный скепсис в отношении практического использования этой энергии. По словам Эйнштейна, это всё равно, что «стрелять птиц в темноте, к тому же если их вообще немного». Эта образная фраза Эйнштейна точно характеризовала реальное положение вещей: как мы помним, в экспериментах Резерфорда из миллиона альфа-частиц только одна попадала в ядро азота и вызывала реакцию превращения.
По-иному эта проблема выглядела сейчас. Выступая в аудитории университета Джорджа Вашингтона, Энрико Ферми дал понять изумлённым слушателям, что, по всей вероятности, при расщеплении урана испускаются нейтроны. Это существенно меняло дело, поскольку в этих условиях возможно возникновение цепной реакции. Правда, всё это Ферми преподнёс пока лишь как предположение, не подкреплённое экспериментально.
В начале марта 1939 г. Лео Сциллард, венгерский физик, давно уже эмигрировавший в США, и Уолтер Зинн поставили эксперимент, который убедил их в том, что при делении ядра урана действительно выбрасываются нейтроны. Почти в это же время две другие группы учёных удостоверились в том же — группа Э.Ферми и Г.Андерсона в Колумбийском университете и группа Фредерика Жолио-Кюри в Париже, в которую входили также X. фон Халбан, Лев Коварски и Ф.Перрен. Последние немедленно опубликовали в английском журнале сообщение — «Высвобождение нейтронов в ядерном взрыве урана». Физики больше не сомневались в том, что практическое использование ядерной энергии не за горами, но не всех это радовало. Напротив, та часть учёных, которая понимала, чем это грозит человечеству при политической ситуации, сложившейся в мире накануне второй мировой войны, была весьма встревожена. Лео Сциллард, например, признавался впоследствии, что у него тогда «почти не оставалось сомнений, что мир ждёт беда».
В мир и так уже стучалась беда: всей Западной Европе грозила гигантская военная машина фашистской Германии. Захватнические устремления Гитлера уже не скрывались, и претензии его становились всё наглее. Не существовало уже Австрии, было ясно, что вот-вот германские армии хлынут на территории других государств. Много учёных с мировым именем эмигрировали из континентальной Европы в США или Англию, опасаясь фашистских концлагерей, куда их запрятали бы без малейших колебаний. Но не так уж и мало прославленных физиков осталось в самой Германии. Среди них были тот же О.Ган, К.Вейцзекер, В.Боте, В.Гейзенберг и многие другие. Они прекрасно разбирались в физике атомного ядра и в идеях, связанных с новейшими её достижениями. Где была гарантия тому, что, уяснив себе, какие возможности открываются в работах по высвобождению атомной энергии, Гитлер не заставит этих учёных трудиться над созданием чудовищного оружия для порабощения мира? Промышленный потенциал Германии очень высок, средств для этого Гитлер не пожалеет, если только поверит в то, что это достижимо.
Понимая, какую угрозу таит опубликование новых данных по расщеплению ядра урана в создавшейся обстановке, ведущие физики в США, прежде всего Лео Сциллард, решили, что весьма своевременным было бы для учёных воздержаться от публикации работ на эту тему. Предлагалось ввести добровольную самоцензуру, чтобы важные данные не стали достоянием гитлеровской Германии. С этой целью Сциллард и В.Вайскопф направили соответствующую телеграмму Ф.Жолио-Кюри. В Париже её получили 1 апреля 1939 г. и… отклонили содержавшееся в ней предложение. Первоначально французы её восприняли вообще как первоапрельскую шутку, но затем стали понимать всю её серьёзность. Что же было причиной их отказа? Во-первых, Ф.Жолио-Кюри не был уверен в том, что это предложение будет поддержано всеми физиками мира, полагая, что Сциллард и его товарищи выступают здесь лишь с частной инициативой, и вряд ли тот, кто добьётся успеха в ближайшее время, воздержится от патентования своего открытия. Во-вторых, Жолио-Кюри твёрдо придерживался принципа М.Кюри — всегда публиковать каждый научный результат. И наконец, пожалуй, самое важное. Коллектив французских учёных очень нуждался в финансовой поддержке, а получить её, не публикуя результатов, возможности не представлялось.
Прошла всего лишь неделя, и французы написали в лондонский журнал новую статью, в которой указывалось, что при делении ядра урана выделяется не один, а несколько нейтронов. Это уже говорило о том, что реакция, если она начнётся в уране, будет не только самоподдерживающейся, но и нарастающей. Фриш сказал по этому поводу: «Мне казалось это невозможным, так как тогда не было бы залежей урана…».
Однако Бор рассудил по-другому. Природный уран состоит из нескольких изотопов с массовыми числами 238, 235 и 233. Главную массу составляет уран-238, его в природном уране 99,3 %. Но как раз его атомы под воздействием медленных нейтронов не расщепляются. Этому были подвержены атомы урана-235, а их-то было очень мало, так что нейтроны, выброшенные ими, прежде чем оказать свое действие на такие же атомы, поглощались ураном-238. Таким образом, «нейтронный вор» уран-238 останавливал реакцию, и потому о «выгорании» природного урана не было оснований беспокоиться.
Разделить эти изотопы химическим путём невозможно, так как это один и тот же элемент, для которого характерны совершенно одинаковые реакции.
Трудности, стоявшие перед физиками, замышлявшими осуществить цепную реакцию расщепления урана, были очень велики, но не настолько, чтобы их нельзя было преодолеть. Во всяком случае за последнее время наука не раз доказывала, что она умеет находить и прямые, и обходные пути для решения самых сложных и запутанных задач. Кто поручится, что выдающиеся физики, оставшиеся в фашистской Германии, первыми не преодолеют эту трудность?
15 марта 1939 г. Гитлер оккупировал всё то, что осталось от Чехословакии после пресловутого Мюнхенского соглашения. 16 марта Э.Ферми прибыл в Вашингтон с письмом декана Колумбийского университета к начальнику штаба военно-морского флота США. Он был принят молодыми офицерами, которые вежливо и внимательно выслушали знаменитого физика, пытавшегося объяснить им, как важно в настоящий момент форсировать работы по овладению атомной энергией. Ферми говорил, что осуществление контролируемой цепной реакции может означать создание атомных реакторов для подводных лодок и военных судов или же бомб, мощность которых в миллионы раз превосходила бы всё известное до сих пор. Его выслушали очень терпеливо, просили и в дальнейшем держать в курсе исследований, но, как утверждают, после его ухода один из офицеров сказал другому: «Этот итальяшка — сумасшедший!»
Опасность, нависшую над миром, понимали только сами учёные. Они решили во что бы то ни стало внушить эту мысль об опасности непосредственно президенту США Рузвельту.
О том, как был осуществлён этот план, рассказано во многих публикациях. Поэтому мы её коснемся только в общих чертах. Было составлено письмо на имя Рузвельта, уговорили А.Эйнштейна, разделявшего пацифистские убеждения, подписать его и попросили экономиста Александра Сакса вручить президенту. К письму была приложена пояснительная записка, написанная Сциллардом.
Президент встретил Сакса с некоторой иронией. «Что за блестящая идея у вас появилась? — спросил он. — Сколько времени вам надо, чтобы изложить её?» Сакс настроился на предложенный иронический тон и рассказал президенту о том, как в своё время Наполеон выгнал изобретателя парохода Фултона. Этим Сакс намекал президенту, что Англия тогда своим спасением была обязана лишь близорукости противника. На президента это в некотором роде подействовало, и он стал более внимательным. Дело закончилось тем, что он вызвал генерала Уотсона и, указав ему на принесённые документы, сказал: «Па (прозвище Уотсона), это требует действий».
Но немедленных действий не последовало.
Через полгода тот же Сакс передал президенту новое письмо Эйнштейна, в котором сообщалось, что по имеющимся сведениям над проблемой урана при поддержке правительства интенсивно работают немецкие учёные. На этот раз на проведение исследований было выделено… 6 тысяч долларов.
Колумбийский университет использовал деньги на постройку опытного реактора, и поручил исполнение лучшему специалисту — Ферми.
Реактор представлял огромное сооружение, колонну, сложенную из окиси урана и графитовых блоков. Графит служил замедлителем нейтронов. К этому времени Бор и Уиллер установили, что уран-238 может захватывать нейтроны лишь высоких скоростей, тогда как уран-235 поглощает медленные нейтроны.
В конце 1941 г. в США из Англии прибыл доктор М.Олифант и сообщил, что английские учёные, оказывается, провели серию экспериментов, которые окончательно их убедили в возможности создания атомной бомбы. Игнорировать подобные сообщения было нельзя, было принято решение о проведении соответствующих крупномасштабных работ.
Вспоминая об этом, Лео Сциллард говорил, что если бы конгресс знал истинную историю создания атомной бомбы, то он учредил бы специальную медаль за заслуги для иностранцев, сующих нос не в своё дело, и доктор Олифант был бы первым из награждённых.
2 декабря 1942 г. работа Ферми завершилась успехом. Атомный реактор был пущен; в нём возникла цепная реакция, регулируемая кадмиевыми стержнями (поглотители нейтронов), и тем самым доказывалась целесообразность уже начатых работ по созданию атомного оружия. Физики могли торжествовать: они сотворили машину для превращения элементов. Одно из названий атомного реактора такое и было — урановая машина. О её пуске сообщили по телефону шифром: «Итальянский мореплаватель только что прибыл в Новый Свет».
Очевидно, если бы не вторая мировая война, французы раньше всех могли бы прийти к практическому использованию атомной энергии. После того как группе Ф.Жолио-Кюри дали субсидии, ей предложили свои работы запатентовать. Жолио-Кюри возражал, считая, что взятие патентов — не в обычаях учёных, и ссылался на пример своей знаменитой тёщи Марии Кюри. Ему, однако, напомнили, что супругам Кюри открытый ими элемент радий пришлось выпрашивать по всему миру и что половину всего того количества, которым располагала их лаборатория, они получили в дар от женщин Америки. И Ф.Жолио-Кюри сдался — пять патентов были положены на хранение. Один из них был патентом на конструкцию урановой бомбы. После регистрации патентов работы были продолжены и обеспечены сырьём. Более того, обсуждалось даже предложение о проведении пробного взрыва урановой бомбы в Сахаре, и оно было в принципе одобрено. Помешала война и последующая оккупация Франции. Ф.Жолио-Кюри, оставшийся в своей лаборатории, делал всё возможное, чтобы затруднить немцам их продвижение к атомному оружию. Страх перед тем, что Германия овладеет им, во Франции и Англии, находящихся от неё в непосредственной близости и уже испытавших её удары, конечно, ощущался гораздо острее, чем в Америке. Вот почему миссия доктора Олифанта в Америку была такой успешной.
В самой Англии специалисты обратили внимание своего правительства на то, что немцы в оккупированной Норвегии пустили завод «Норск Хайдро» — для производства тяжёлой воды. Такая вода — эффективный замедлитель нейтронов. Было яснее ясного, что в Германии ведутся работы по созданию атомного оружия. Силы норвежского Сопротивления при поддержке Англии устроили диверсии на заводе и уничтожили большой запас тяжёлой воды. Завод всё же работал, и немцы настойчиво требовали увеличения его продукции. Налёты английской авиации на гидростанцию и завод электролиза уничтожили ещё некоторое количество воды и произвели сильные разрушения, но не ликвидировали предприятие. Немцы поспешили переправить завод в Германию. Ценный груз ожидался в Гамбурге, но он туда так и не прибыл, его потопили норвежские патриоты.
Достоверных сведений о том, чего достигла Германия в области атомного оружия, не было до конца войны. Были только предположения, догадки и косвенные данные вроде производства тяжёлой воды. Как только американские войска вступили на территорию фашистской Германии, начала усиленно работать секретная миссия «Алсос». Это была неслыханная по своим масштабам разведывательная операция по розыску и интернированию учёных, захвату оборудования, лабораторий, документов, сырья — всего, что имело отношение к атомному производству.
Всё это было позже, а пока в США шла лихорадочная работа гигантского масштаба и невероятной секретности.
Пустив в ход урановый реактор, Ферми, по выражению известного американского физика Р.Лэппа, открыл дверь в атомный век.
Почему же реактор заработал, ведь его заполнял природный уран, в котором основная масса состояла из неделящегося под воздействием нейтронов урана-238? Каким образом этот неактивный изотоп не заглушал реакции? Первый ответ на этот вопрос уже был дан выше, где говорилось о замедлении нейтронов. Второй заключается в том, что при делении ядра урана-235, как было выяснено ещё Ф.Жолио-Кюри, выбрасывался не один нейтрон, а примерно три. Для самоподдерживающейся реакции «уранового пожара» этого достаточно, хотя сам вопрос создания взрывчатого материала для атомной бомбы таким образом не решался. Необходимо было полностью разделить изотопы урана-238 и 235 и последний использовать в качестве делящегося материала. Для решения такой очень сложной задачи нужны были столь же сложные и невероятно громоздкие технологические установки. В них весь уран переводился в газообразное соединение — фтористый уран, а затем этот продукт многократно прогонялся через полупроницаемые перепонки, в результате чего газовая смесь всё более и более обогащалась соединением урана-235. Это так называемый диффузионный метод. Применялся и другой метод — электромагнитный.
Путь этот к накоплению взрывчатого материала был, однако, не единственный. Второй совершенно не предусматривал получения урана-235.
Ещё до того, как Ферми пустил в ход урановый реактор, американские физики Ф.Абельсон и Э.Макмиллан, использовав остроумную методику, выяснили, что уран превращается (после бета-излучения) в элемент № 93, тот самый, который причинил столько волнений Ферми и другим европейским физикам. Теперь его открытие не вызывало сомнений, и он получил имя нептуний. Этот первый заурановый элемент оказался очень недолговечным, примерно через две недели от него ничего не оставалось. Самопроизвольно распадаясь, он превращался в следующий заурановый элемент № 94 — плутоний, по своим ядерным характеристикам схожий с ураном-235. Таким образом, название уранового реактора как машины для превращения элементов вполне оправдано: с помощью этого устройства в больших количествах стали получать не какие-нибудь, а такие элементы, которые до того не значились в числе «жителей» периодической системы.
В «Манхеттенском проекте», как условно были названы работы по созданию атомной бомбы, взрывчатый материал получали на разных заводах в виде урана-235 и плутония.
Европейская война была завершена, и гитлеровская Германия пала под ударами Советских Вооружённых Сил и союзных войск. До использования атомного оружия в этой части земного шара не дошло. Япония изнемогала в борьбе и была близка к капитуляции. Тем не менее американские политики, исходя из своих далеко идущих планов, решили продемонстрировать силу своего оружия перед всем миром.
6 августа 1945 г. на японский город Хиросиму одиночный американский самолёт сбросил бомбу, изготовленную из урана-235, и более 140 тысяч человек мирного населения было убито и ранено. А через три дня испепеляющая смерть обрушилась на другой японский город — Нагасаки. Её принёс не уран, а новый, созданный человеком химический элемент — плутоний. Спустя некоторое время ещё несколько тысяч человек умерло от последствий этой варварской акции.
Вот во что воплотилась, казалось бы, наивная и фантастическая мечта алхимиков.
Против атомного шантажа
Президент Рузвельт, давший указание на развёртывание работ по созданию атомного оружия, не дожил до конца войны. Его место в Белом доме занял Гарри Трумэн. Новый президент, говорят, не знал о ведущихся работах, и военное министерство не торопилось что-нибудь сообщать ему по этому вопросу. Лишь незадолго до безоговорочной капитуляции гитлеровской Германии военный министр США Г.Стимсон передал Трумэну записку, в которой просил безотлагательно принять его по чрезвычайно важному и секретному делу. Он намекал, что решение некоего вопроса представляется исключительно важным для дальнейшего развития международных отношений. Президент тут же согласился принять министра и был подробно информирован о содержании программы ядерных исследований.
Рассчитывая, что США в самом ближайшем времени будут располагать невероятной силы боевым средством, Трумэн стал под любыми предлогами уклоняться от запланированных встреч с руководителями государств-союзников. Дважды ему это удавалось. Но наступил момент, когда развитие международных событий исключало возможность дальнейшей оттяжки такой встречи. Работы по созданию атомного оружия стали вестись в лихорадочном темпе. Роберт Оппенгеймер, возглавлявший всю научную и техническую программу проекта, вспоминал потом: «Я не думаю, что мы когда-нибудь работали быстрее, чем в период капитуляции Германии».
15 июля 1945 г. президент США прибыл в Потсдам. Вечером же следующего дня военный министр США получил сообщение, в котором говорилось: «Провели операцию этим утром. Диагноз ещё не окончателен, но результаты представляются удовлетворительными и уже превзошли ожидания». Эта информация, пока крайне общего характера, немедленно была передана Трумэну и государственному секретарю Бирнсу.
На конференции обсуждались сложные вопросы, и по ним выявились серьёзные расхождения. Тянулось длительное обсуждение. Но вот к президенту США прибыл специальный курьер с донесением, в котором подробно и полно были описаны результаты первого атомного взрыва. Президента словно подменили, он стал выступать против советских предложений самым решительным образом. Черчиллю он сообщил о полученном документе, советскую же делегацию они оба решили не ставить в известность. В частном же разговоре президент сделал осторожный, но прозрачный намёк на то, что разработано новое оружие неслыханной силы, не упомянув при этом слов «атомное», «урановое», «ядерное» или других, по которым и можно было догадаться, о чём идет речь. Однако советская делегация почему-то никак не отреагировала, и Черчилль с Трумэном заключили, что их просто не поняли.
Применение атомных бомб в войне против Японии было совершенно ненужным — исход был уже предрешён и без них. Однако у тех, кто стоял за немедленное их применение, были свои расчёты, сводившиеся к тому, чтобы произвести устрашающее впечатление на весь мир и прежде всего на союзника по оружию — Советский Союз.
Началась так называемая атомная дипломатия, исходившая из уверенности реакционных, воинствующих кругов США в том, что они монопольно владеют атомным оружием и что при самых оптимистических оценках ни у кого не может быть создана бомба ранее чем через 7-10 лет.
23 сентября 1949 г. успешно прошло испытание атомной бомбы в Советском Союзе. Оказалось, что отсутствие реакции на намёки Трумэна на Потсдамской конференции — вовсе не результат какого-то недопонимания. В СССР давно уже велись подобные работы.
В Советском Союзе в области атомной физики работали молодые талантливые учёные, чьи научные интересы в немалой степени сформировались под влиянием А.Ф.Иоффе — папы Иоффе, как величала его молодёжь. В молодые годы, как уже упоминалось, он работал у знаменитого Рентгена. Его хлопотами П.Л.Капица был принят в институт Резерфорда. Им был создан Ленинградский физико-технический институт ещё в 1918 г. Позже, в 30-х гг., вторым притягательным центром для советских физиков стал институт в Харькове. В этом институте очень скоро был повторен опыт Кокрофта и Уолтона по расщеплению лития.
Открытие нейтрона на советских физиков произвело такое же неотразимое впечатление, как и на западных учёных. Советские учёные не только с огромным интересом следили за теми работами, которые выходили из Кембриджа, Парижа, Рима и других центров новой физики, но и сами работали — жадно и страстно.
И.В.Курчатов, его брат Б.В.Курчатов и Л.И.Русинов приступили к изучению искусственной радиоактивности, открытой супругами Жолио-Кюри. И уже в апреле 1936 г. они опубликовали сообщение об открытом ими новом явлении — ядерной изомерии. Они облучили нейтронами бром и установили, что при этом образуются бета-радиоактивные изотопы с разными периодами полураспада.
Лиза Мейтнер на физическом съезде в Цюрихе в июне того же года в своём докладе не обошла вниманием сообщение советских учёных, хотя и отнеслась к нему с крайней осторожностью: «В настоящее время трудно поверить в существование «изомерных атомных ядер», то есть таких ядер, которые при равном атомном весе и равном атомном номере обладают различными радиоактивными свойствами». Нет, она не отрицала открытие, а говорила лишь, что «трудно поверить в настоящий момент». Эта трудность была вскоре преодолена. В декабре 1936 г. немецкий учёный Вейцзекер предложил теорию, подтверждающую правомерность изомерных ядер. Их существование — это проявление двух возможных состояний: метастабильного и возбуждённого. После этого работа советских физиков получила всеобщее признание.
Изучая изомерию ядер, Курчатов с сотрудниками убедился, что при некоторых энергиях нейтронов происходит чрезвычайно сильное их поглощение, часто в сотни и тысячи раз интенсивнее, чем при слегка отличных энергиях; иначе говоря, существует какой-то резонанс. Измерять изомерию становилось всё труднее из-за недостатка мощной аппаратуры. Курчатову, так же как и Ферми, приходилось носиться по коридору от нейтронного излучателя к счётчику.
В Радиевом институте уже начат был монтаж циклотрона, но сооружался он, к сожалению, крайне медленно. Курчатов заразил всех своей энергией, чёткостью понимания частных задач и целиком окунулся в работу по созданию циклотрона. Первый циклотрон в Европе был пущен в работу на советской территории. Правда, интенсивность и энергия его частиц были ещё недостаточны для проведения важнейших экспериментов, и Курчатов, заручившись поддержкой А.Ф.Иоффе, решил в ближайшем будущем строить новый большой циклотрон. Спустя некоторое время приступили даже к строительству, но началась Великая Отечественная война, и стало не до циклотрона.
Мы, однако, несколько забежали вперёд. О том, что ядро урана под воздействием нейтронов может быть разбито на два осколка, А.Ф.Иоффе узнал из письма к нему Ф.Жолио-Кюри. Это крайне взволновало его. Письмо бурно обсуждалось на институтском семинаре. В лаборатории Курчатова исследования по делению ядра урана заняли центральное место. Старейший радиохимик В.Г.Хлопин развернул работы по изучению этого процесса. Этой же проблемой занялись И.М.Франк в Москве и А.И.Лейпунский в Харькове. Курчатов и его сотрудники были заняты поиском условий, при которых может возникнуть в уране цепная реакция. Ю.Б.Харитон и Я.Б.Зельдович подробно изучили этот вопрос и в двух статьях журнала экспериментальной и теоретической физики опубликовали свои выводы.
Прежде всего всех интересовало, сколько нейтронов выделяется при делении одного ядра урана. Тонкую экспериментальную работу по выяснению этого вопроса Курчатов поручил двум молодым физикам Г.Н.Флерову и К.А.Петржаку, которые, по его выражению, на совместной научной работе «составили величину больше, чем два». Вскоре эти экспериментаторы открыли совершенно новое явление. Оказывается, ядро урана может и самопроизвольно распасться на две приблизительно равные части, хотя такое деление в природе наблюдается крайне редко.
Чтобы защититься от всевозможных помех при регистрации возникающей радиации, в частности от сильно проникающих космических лучей, молодые физики решили проводить свои опыты глубоко под землёй.
Идеальным местом для этого оказалось московское метро. Для работы Г.Н.Флеров и К.А.Петржак облюбовали служебное помещение на станции «Динамо». В начале 1940 г. они послали краткое сообщение о самопроизвольном делении урана в американский журнал.
Письмо их опубликовали, но странно, никаких откликов на него не было. Совсем недавно страницы физических журналов заливал поток статей по урановой проблеме, а сейчас вдруг об этом — полное молчание. В отношении Европы это было бы ещё объяснимо — война, не до того; но почему полностью прекратились такие публикации в Америке?
О самоцензуре ведущих физиков в Америке советским учёным ничего не было известно, но такая ситуация их, конечно, насторожила. Не имея связи с зарубежными учёными, физики в Советском Союзе пришли вполне самостоятельно к заключению о возможности создания нового оружия фантастической разрушительной силы. Академик Н.Н.Семёнов написал об этом письмо в Наркомат тяжёлой промышленности. Но вскоре настала пора, когда об этом нечего было и думать: грозный, неумолимый и жестокий враг топтал советскую землю. Физики занялись безотлагательными проблемами: обработкой кораблей для защиты их от магнитных мин, радиолокацией, танковой бронёй, просто пошли в ополчение.
Оборудование Ленинградского физического института было эвакуировано в Казань и лежало там в ящиках нераспечатанным. После успешного наступления наших войск под Москвой Г.Н.Флеров выехал в Казань для встречи с Курчатовым, но тот ещё не вернулся с юга. Тогда Флеров выступил с докладом перед Иоффе, Капицей и другими физиками, в котором обрисовал постановку опытов, необходимых, по его мнению, для изучения «динамитных» цепных реакций. Всего этого сделать в обстановке того времени было почти невозможно, но Флеров продолжал хлопотать, писать письма Иоффе, Курчатову и другим учёным; поскольку в американской печати по-прежнему избегали каких-либо упоминаний об уране, это лишь укрепляло его в необходимости самых срочных действий.
В мае 1942 г. Флеров написал письмо в Государственный Комитет Обороны, указывая на необходимость срочно «делать урановую бомбу». В правительстве уже имелась информация о том, что как в США, так и в Германии в условиях сверхсекретности ведутся работы во созданию сверхмощного оружия. А.Ф.Иоффе, В.И.Вернадский, В.Г.Хлопин и П.Л.Капица были вызваны в Москву для обсуждения полученной информации и определения возможности проведения работ по созданию атомной бомбы в СССР. Затем по совету Иоффе в Москву вызвали Курчатова и предложили ему возглавить такие работы. Он приступил к порученному делу с исключительной энергией. Летом того же года в Казани Флеров продолжил прерванные ранее эксперименты по исследованию размножения нейтронов. Никто не знал тогда, что в Этнографическом музее под чучелами производится сборка сложнейшей физической аппаратуры.
В феврале 1943 г. Курчатов и его соратники по урановой проблеме прочно обосновались в Москве и развернули широкомасштабные эксперименты. Одна за другой следовали победы на фронте, и параллельно этому ускоренными темпами продвигались к решению поставленной задачи советские учёные. Им было несравненно труднее, чем американским физикам: на территории США не было военных действий, не было разрушений, они располагали мощнейшей промышленностью и опирались на добровольные услуги ведущих теоретиков мира, эмигрировавших из Европы.
Когда Трумэн сделал на Потсдамской конференции намёк на имеющееся в его распоряжении сверхмощное оружие, в Советском Союзе были уже на подступах к овладению им. Не всё, конечно, шло гладко, было много затруднений, но они с успехом преодолевались. В урановом реакторе, или «котле», как его тогда называли, предполагалось использовать графит для замедления нейтронов. Лаборатория Курчатова предъявила такие технические требования на чистоту графита, что исполнители только руками развели. Но иначе было нельзя: малейшая примесь остановила бы цепную реакцию. И объяснить, зачем им нужен графит такой чистоты, также было нельзя. Однажды к работнику лаборатории Н.Ф.Правдюку подошёл представитель организации, исполнявшей заказ, и спросил: «Я понимаю важность жёстких требований. Но скажите, каким методом вы делаете алмазы? Я всю литературу перечитал. Как вы создаёте давление и каков выход продукции?» Узнав об этом, Курчатов рассмеялся и сказал: «В колокола звонить мы не можем».
В сентябре 1949 г. самолёты военно-воздушных сил США доставили пробы воздуха, взятого на большой высоте. Предварительный их анализ показал сильно повышенный уровень радиации, а радиохимическая лаборатория подтвердила наличие в них осколков плутония.
Через два дня после испытания советской атомной бомбы, 25 сентября 1949 г., ТАСС выступил по этому поводу с заявлением, в котором, между прочим, обращалось внимание на прежнее сообщение 1947 г. о том, что секрета атомной бомбы уже не существует.
Факт наличия у Советского Союза атомной бомбы в американских военно-политических кругах вызвал шок и растерянность. Однако вместо поисков путей мирного сосуществования и отказа от оружия массового уничтожения агрессивные круги США стали думать о том, как восстановить свой престиж. И среди учёных нашлись сторонники «жёсткого курса», «атомной дипломатии». В частности, ярым пропагандистом ещё более мощной бомбы, супербомбы, стал Эдвард Теллер, с 1942 г. занимавшийся изучением термоядерной реакции, т. е. реакции синтеза, слияния двух ядер.
В ноябре 1952 г. на атолле Эвениток был произведён взрыв водородного устройства, доставивший огромное удовлетворение творцам и проводникам «атомной дипломатии».
При первых же попытках США опереться в своей политике на супербомбу правительство СССР запросило Курчатова, на чём основан этот шантаж. Спустя два месяца после успешного испытания атомной бомбы коллектив Курчатова смог вплотную приступить к решению новой ответственной задачи. 12 августа 1953 г. в СССР был произведен взрыв первой в мире водородной бомбы. И в этом утверждении нет ни ошибки, ни преувеличения. То, что взорвали американцы, было термоядерным устройством, огромным сооружением, а не бомбой, какую можно взять, например, на борт самолёта.
Выделение чудовищной разрушительной энергии при взрыве термоядерного устройства происходит за счёт слияния друг с другом двух ядер лёгких элементов. Существует несколько вариантов «начинки» водородной бомбы; наиболее «рациональная» из них, если позволительно применить такое определение к устройству, предназначенному для разрушения и убийства, — это дейтерид лития. Не обязательно брать водород в чистом виде, можно использовать и его соединения, ибо пойдёт не химическая, а ядерная реакция. Но вовсе не всякий водород для этого подойдёт. Энергия выделяется при слиянии ядер очень редких изотопов — водорода-2 (дейтерия) и водорода-3 (трития). Дело, однако, в том, что тритий накопить в нужном количестве неимоверно трудно. Дейтерий — значительно легче, хотя тоже не так уж просто. Поэтому в качестве исходных материалов брали чистый дейтерий и редкий изотоп лития — литий-6. При химическом взаимодействии этих элементов и образуется дейтерид лития. Теперь, чтобы эта «начинка» сработала, нужен толчок, нужны особые условия — температура в миллионы градусов, которую в земных условиях давал лишь взрыв атомной бомбы. Поэтому в термоядерном устройстве, кроме дейтерида лития, есть ещё запал в виде атомного — уранового или плутониевого — заряда.
Взрыв термоядерной бомбы длится доли секунды, но за это мгновение происходит цепь сложнейших превращений. При температуре в миллионы градусов нейтроны обрушиваются на ядра атомов лития-6 и образуется крайне неустойчивое соединение, которое тут же распадается на тритий и гелий. Затем тритий вступает в ядерное взаимодействие с дейтерием, а это уже, как мы говорили выше, и есть, собственно, термоядерный взрыв.
Заполнение пробелов в менделеевской таблице
Уже были открыты и получены заурановые элементы нептуний и плутоний, уже нашли им область применения, а в менделеевской таблице по-прежнему оставались незаполненные клетки.
К двадцатым годам нашего столетия учёным были неизвестны элементы № 43, № 61, № 75, № 85 и № 87. Поиски велись очень интенсивно, с применением новейших по тому времени средств, но элементы эти, можно сказать, не столько открывали, сколько закрывали.
Задолго до появления периодического закона было заявлено, что найден элемент с атомным весом около 104. Русский химик и минералог Г.Р.Германн извлёк его из минерала, найденного в Ильменских горах, и назвал ильмением. Химик Г.Розе не замедлил опровергнуть новое открытие, хотя Германн энергично его отстаивал. Менделееву при составлении таблицы очень хотелось заполнить этим элементом клетку под марганцем, но он удержался от соблазна, и клетка осталась пустой с пометкой, что в ней должен находиться эка-марганец.
В 1886 г. Керн сообщил, что удалось найти в платиновой руде с острова Борнео элемент дэвий, напоминающий по свойствам марганец и имеющий подходящий атомный вес — около 100. Через 10 лет подобное открытие было сделано Баррером. Но ни первое, ни второе открытие не были подтверждены.
Тот самый Розе, который отверг ильмений, заявил вдруг, что он сам нашёл новый элемент в минерале колумбите, и назвал его пелопием. Теперь Германн не пощадил своих усилий, чтобы показать, что открытие Розе — фикция, и элемента пелопия не существует.
После смерти Менделеева японский химик Огава оповестил мир, что ему, наконец, удалось найти экамарганец, который он назвал ниппонием. Прошло некоторое время, и ниппоний исчез так же, как и его неудачливые предшественники.
Крушение надежд на открытие неизвестных элементов для заполнения пустых клеток повергли некоторых учёных в уныние. Более того, они стали сомневаться в правильности расположения элементов в таблице.
Может быть, сам марганец стоит не там, где положено, не представитель ли он семейства железа? В таком случае нет никаких оснований искать его аналога.
В 1913–1914 гг. англичанин Г.Мозли опубликовал две небольшие работы, сыгравшие огромную роль в дальнейших поисках новых элементов. Мозли, как уже говорилось, доказал, что основной характеристикой химического элемента следует считать не массу, а заряд ядра атома, численно равный порядковому номеру в таблице Менделеева. Работы Мозли положили конец спорам по поводу помещения редкоземельных элементов в одну клетку и по поводу того, сколько их. Благодаря работам англичанина стало ясно, какие химические элементы ещё ожидают своего открытия. Прежде всего это элемент с порядковым номером 43 и редкоземельный элемент № 61.
Ида и Вальтер Ноддак были твёрдо убеждены в существовании аналогов марганца. По их мнению, эти очень редкие элементы в природе должны быть вместе. На основании не столько практических поисков, сколько теоретических расчётов они пришли к выводу, что, вероятнее всего, экамарганец и двимарганец присутствуют в таких минералах, как колумбит и танталит. 1925 г. ознаменовался в химии сообщением супругов Ноддак о том, что ими обнаружены элементы 43 и 75 в колумбите, первый в количестве 0,5 процента, второй — 5 процентов.
Как обычно, сообщение Ноддак подверглось проверке, в результате символы Ма (мазурий) и Re (рений) появились в таблице Менделеева, напечатанной в самых разных странах.
Казалось, можно было торжествовать победу, но не тут-то было! Под давлением неопровержимых доводов немецкого химика В.Прандтля 43-й элемент мазурий пришлось снова «закрыть». Такой же угрозе подвергался и рений, однако Ноддаки его отстояли, предъявив учёным и прежде всего Прандтлю вещественное доказательство — целых 100 миллиграммов вещества в металлическом виде. 75-я клетка в таблице Менделеева была окончательно заполнена.
43-м элементом увлёкся один из молодых римских физиков, работавших под руководством Э.Ферми, — Эмилио Сегре. В 1936 г. он побывал в США, в городе Беркли, где был установлен циклотрон. Лобовая часть пластины циклотрона («зуб»), предназначенная отклонять поток заряженных частиц и направлять его на мишень, поглощала примерно половину ускоренных частиц и сильно разогревалась. Поэтому этот «зуб» приходилось изготовлять из тугоплавкого молибдена, который в таблице Менделеева соседствует с неуловимым 43-м элементом.
Сегре подумал: почему бы молибдену после длительного обстрела дейтеронами не стать радиоактивным и не превратиться в одного из своих ближайших соседей, в тот же 43-й элемент, например? Образец продолжительно облучённого молибдена Сегре привёз с собой в Палермо, где он в это время работал, и совместно с минералогом К.Перье приступил к исследованиям.
Прежде всего было установлено, какие частицы выбрасывает облучённый элемент. Оказалось, что это бета-излучение — электроны. Затем молибден растворили в царской водке и стали разделять полученную смесь, широко используя метод, разработанный супругами Жолио-Кюри. Путём отделения соосаждаемых элементов удалось выяснить, что радиоактивность принадлежит совершенно новому элементу. Авторы назвали его технецием, что означает «искусственный».
Сегре — очень крупный учёный, с его именем связано не одно замечательное открытие, но когда у него как-то спросили, какое из них более всего им любимо, он ответил: открытие технеция. Не только потому, что это была первая оригинальная работа, совершённая в ранней ещё молодости, но и потому, что проведена она с использованием самых простых средств.
Ещё один элемент, 43-й, навечно поселился в отведённых ему покоях.
В отличие от 43-го и 75-го элементов два других элемента, 85-й и 87-й, такими безнадёжно неуловимыми не казались, особенно после работ Мозли и Бора. На деле же всё вышло иначе. Искали их так же долго, и так же поиски сопровождались разочарованиями, а порой — отчаянием.
Предполагалось, что 85-й элемент, экайод, — галоген вроде хлора, а 87-й, экацезий, — щелочной металл вроде натрия. Зная об этом, английский учёный А.Фриенд отправился к Мёртвому морю, где плотность воды такая, что там не может обитать рыба. При такой концентрации солей, полагал Фриенд, легче обнаружить и галоген экайод, и щелочной металл экацезий. Ничего из этого не вышло, несмотря на адский труд Фриенда.
Где только и в чём только не искали эти два элемента — в минералах, водах морей, золе сена, грибах, патоке, пепле сигар и т. д. и т. п. Были испробованы различные наисовершеннейшие методы — от спектрального анализа до растворов солей настоящего цезия; успеха не было.
В 1931 г. много шума наделали работы американского физика Фреда Аллисона, применившего разработанный им так называемый магнитооптический метод, который позволяет обнаруживать в растворах совершенно незначительные количества элементов. С его помощью Аллисон обнаружил целый ряд изотопов у элементов, до этого считавшихся простыми: золота, радия, палладия, тантала, таллия, рутения. Теперь этот учёный заявил, будто он нашёл экайод в монаците, и экацезий — в редких щелочных минералах поллуксе и лепидолите. Он даже придумал им названия — алабамий и виргиний. Более десяти лет эти элементы прожили на свете в соответствующих клетках периодической системы, но потом снова бесславно исчезли в небытие. Оказалось, что метод Аллисона превосходно служит самообману. Впрочем, несмотря на это, символы мертворожденных элементов некоторое время ещё оставались в таблице.
Многие физики пришли к заключению, что элементы 85 и 87 вообще бесполезно искать, поскольку они не имеют стабильных изотопов. Первое сообщение такого рода поступило ещё в 1913 г. от Кранстона. Этот учёный работал с чистым препаратом актиний-228, который обычно распадается с выбросом электрона и превращается в торий-228. Кранстон обнаружил, что актиний-228 выбрасывает иногда не электроны, а наоборот, альфа-частицы. Тогда этот факт показался учёным нелепостью, поэтому сообщение Кранстона и осталось незамеченным. Примерно через год Мейер, Гесс и уже знакомый нам Панет пришли к подобным же выводам. В их работе с чистым актинием-227 наблюдалось появление альфа-частиц с длиной пробега 3,5 сантиметра. Стало быть, они не могли принадлежать ни радию-226 (длина пробега 3,30 сантиметра), ни торию-232 (пробег — 2,59 сантиметра). Учёные предположили, что эта альфа-частица принадлежит образовавшемуся в цепи радиоактивного распада изотопу 87-го элемента. Разгорелась бурная полемика. Разобраться в этом помешала первая мировая война.
В 1926 г. была сделана попытка «поймать» экацезий в цепи радиоактивного распада. Исследования проводил Хевеши. Никаких обнадёживающих результатов он не получил. Возможно, 87-й элемент и образовывался, но в таком, очевидно, ничтожном количестве, что обнаружить его было просто невозможно.
В 1938 г. Маргарита Перей, французская исследовательница, решила повторить работу, проведённую в своё время Мейером, Гессом и Панетом, и ей повезло: частицы с длиной пробега 3,5 сантиметра действительно принадлежали 87-му элементу, названному францием. Это было доказано со всей тщательностью, хотя и с большим трудом. Период полураспада франция составляет всего 21 минуту, и за это время радиохимикам предстояло его изучить. Правда, были открыты и другие его изотопы, но срок их жизни был ещё меньше. Проводились очень хитроумные химические операции, чтобы отделить франций от других элементов; дополнительная трудность была в том, что франций — активнейший щелочной металл, почти не образующий нерастворимые соединения. Тем не менее химики, проведя тончайшую реакцию с применением кремнийвольфрамовой кислоты, подтвердили, что франций — это именно тот элемент, которому предназначалась 87-я клетка в таблице Менделеева.
Примерно так же был открыт экайод. О.Ган ещё в 1926 г. предположил, что элемент № 85 может образовываться при бета-распаде полония или же при выбросе альфа-частицы из ещё не известного экацезия. В 1940 г. Эмилио Сегре в содружестве с американскими учёными Д.Корсоном и К.Маккензи, работавшими в Беркли, идя этим путём, синтезировали 85-й элемент и назвали астатом, что в переводе с греческого значит — неустойчивый. Мысль о синтезировании элемента подал Сегре — по аналогии с тем, как был синтезирован технеций. Однако тот циклотрон, который позволил получить технеций, для нового эксперимента не годился — был очень слаб. Как только построили более мощный циклотрон, исследователи обстреляли альфа-частицами висмут, затем кусочек облучённого висмута поместили в тигель и накрыли платиновой пластинкой. После нагрева пары нового элемента, схожего по химическим свойствам с йодом, стали выделяться и осаждаться на пластинке, тут же сигнализируя о себе через счётчик Гейгера — Мюллера.
Это было первое доказательство существования экайода (астата); второе было получено спустя некоторое время австрийцами Карликом и Бернертом, которые показали, как могут распадаться изотопы полония с образованием экайода.
В таблице Менделеева оставался неизвестным лишь один элемент — № 61. Его отсутствие было замечено после работ Мозли. Поиски очень долгое время были совершенно безрезультатными. Новый элемент относится к группе редкоземельных, а они вообще-то очень нелегко поддаются разделению. В 1926 г. американские учёные Гаррис и Гопкинс сообщили, что им удалось выделить этот элемент, и поспешили дать ему имя — иллиний, в честь Иллинойского университета. Однако Прандтль, в своё время блестяще опровергнувший открытие мазурия супругами Ноддак, и на этот раз сделал то же самое, потратив на проверку работы американцев целый год. Затем проверкой результатов американских исследователей занялись Ноддаки. Располагая сотней килограммов редких земель, они имели возможность поставить опыты, что называется, на широкую ногу, и вынуждены были присоединиться к своему «чёрному гению» — Прандтлю: американцы и в самом деле допустили ошибку. А тут ещё подали голос итальянские химики: они, дескать, об открытии 61-го элемента объявили гораздо раньше — в 1924 г. в закрытом пакете, направленном в национальную академию. Новый элемент был получен ими будто бы в результате кристаллизации дидимовой земли. Но, как выяснилось позже, работа итальянцев, хотя и представляла бесспорный интерес, никакого открытия не содержала.
Были и другие сообщения об открытии 61-го элемента, но все они не выдержали проверки. И тогда стало ясно, что 61-й элемент тоже не имеет стабильных изотопов. Стало быть, и его можно получить только искусственно, как технеций. В 1941 г. американские физики Лау, Пул, Курбатов и Квилли, обстреливая ядрами тяжёлого водорода образцы неодима и самария, получили несколько радиоактивных изотопов, среди которых согласно предварительным расчётам должен был непременно присутствовать изотоп 61-го элемента. Сегре, к которому обратились они за подтверждением, согласился с ними и… ошибся. Элемент циклоний был закрыт так же быстро, как и открыт. По-настоящему его открыли несколько позже, в 1945 г., с помощью не циклотрона, а уранового реактора. Изучая продукты деления урана, американские химики Е.Глендин, Дж. Маринский и Ч.Корнэлл разделили их хроматографическим методом и выделили два изотопа нового элемента с периодом полураспада 2,7 года у одного и 47 часов у другого. Этот элемент получил название от имени мифического титана Прометея, похитившего у Зевса огонь и передавшего его людям, — прометий. Такое название, писали учёные в своём сообщении об открытии, «не только символизирует драматический путь получения нового элемента в заметных количествах в результате овладения людьми энергией ядерного деления, но и предостерегает людей о грозящей опасности наказания стервятником войны».
Так были заполнены все клетки таблицы элементов, и ещё раз блестяще подтвердился гений русского учёного Менделеева.
Все четыре незнакомца, за которыми так долго гонялись, чтобы написать их портреты, в земных минералах встречаются в чрезвычайно незначительных количествах, но они постоянно образуются в результате сложных ядерных процессов, протекающих в природе. Например, технеций и прометий рождаются при самопроизвольном делении урана, франций — при распаде актиния-227 в случае, если он испускает альфа-частицу. Примерно тем же путём образуется и природный астат. Немудрено поэтому, что их так долго искали и нашли только на пути искусственных превращений. Правда, сегодня их можно обнаружить в земных рудах и минералах благодаря сверхточным и сверхчувствительным методам исследования. Но для нас в данном случае интересно то, что элемент астат ныне научились получать, бомбардируя ядрами углерода… золото!
С головы на ноги (или наоборот) перевернулась мечта алхимиков. Они стремились получить золото из других, неблагородных, металлов. Современные же алхимики использовали золото как сырьевой материал для получения элементов, дотоле неизвестных. Возможно, что средневековые алхимики сочли бы такую работу противной воле Творца, форменным кощунством, но современная наука считает её своим великолепным достижением.
Заурановый мир
Открытие элементов, находящихся за пределами существовавшей тогда таблицы периодической системы, началось, как уже упоминалось, раньше, нежели были заполнены её пробелы. Честь открытия первого зауранового элемента принадлежит Э.Макмиллану.
Сейчас даже трудно поверить в то, что послужила ему в этом всего лишь книжечка из папиросной бумаги.
На первый её листок учёный нанёс слои окиси урана, а затем использовал её в качестве мишени в циклотроне. После обстрела нейтронами Макмиллан извлёк книжечку из установки и с помощью счётчика Гейгера стал измерять радиоактивность каждого её листика. Нужные данные были получены, но выявились и некоторые побочные результаты, значительно более важные, нежели те, ради которых был поставлен эксперимент.
Главным было то, что первый листок бумаги содержал какое-то вещество, имевшее совершенно непохожий (по сравнению с другими листиками) период полураспада. Если бы это было более лёгкое вещество, то ничто не мешало бы ему пройти через толщу листка с остальными продуктами. Наблюдалась радиоактивность, с которой Макмиллан ранее не встречался. Прежде всего это было бета-излучение, приводившее к повышению заряда ядра, а стало быть, к появлению нового, более тяжёлого элемента.
В это время к Макмиллану приехал на летние каникулы старый его друг Ф.Абельсон, здесь он намеревался отдохнуть, но вместо отдыха получил напряжённую, изнурительную работу по изучению химических свойств нового радиоактивного вещества. Это и был 93-й элемент, который они без долгих размышлений нарекли нептунием, в честь планеты Нептун. Их ожидал сюрприз. Согласно периодической системе новый элемент — это экарений. Два друга стали искать у него свойства, подтверждающие это, и не нашли. Нашли они другое: свойства нового элемента лишь незначительно отличались от свойств «родителя» — урана.
Абельсон вернулся на место своей постоянной работы, а Макмиллан продолжал эксперименты, надеясь открыть и следующий, 94-й элемент. Надежда была вполне обоснованной: нептуний радиоактивен, он выбрасывает электроны, следовательно, заряд ядра его должен повыситься. Поиски, начатые Макмилланом, продолжила группа американских учёных, возглавленная Гленном Сиборгом.
После того как выяснилось, что в урановом реакторе накапливается плутоний-239, способный к делению так же, как уран-235, возникла проблема отделения этого нового элемента; естественно, прежде чем что-либо можно было придумать для этого, следовало узнать, что он собой представляет, какими химическими и физическими свойствами обладает. Но как изучать, если весь запас плутония умещался на острие иглы? В ультрамикровесах, которыми пользовались тогда химики, для поддержки коромысла и чашек использовались кварцевые нити тоньше человеческого волоса, и взвешивались на них количества порядка трёх тысячных миллиграмма. Недаром, пожалуй, химики шутили тогда, что им приходится взвешивать невидимые образцы на невидимых весах.
С химической точки зрения плутоний оказался интересным элементом, так как его соли в растворе изменяли окраску в зависимости от валентного состояния, как это бывает у марганца или хрома. Но ни с марганцем, ни с хромом его ничто не связывало, он был похож опять-таки на уран.
По сходству этих элементов с ураном их стали называть уранидами, но связь их между собой оставалась для учёных непонятной. И Сиборг предположил, что не уран, а актиний является родоначальником группы схожих элементов, подобно тому как это наблюдается у группы редкоземельных — лантаноидов. С принятием этой гипотезы всё становилось на место, и после ряда неудач открылась возможность синтезировать следующие элементы — 95-й и 96-й. Достигли этого сравнительно быстро. 95-й элемент обнаружили, когда обстреляли плутониевую мишень нейтронами, а 96-й — альфа-частицами.
Словом, все эти новые элементы по названию составляют своеобразный параллельный ряд группе редкоземельных элементов. Даже между диспрозием и калифорнием в этом смысле есть та же параллель. Диспрозий значит труднодоступный, а калифорний — производное от штата Калифорния, крайнего Запада Америки, заселение которого было, как считается, очень трудным. Синтеза калифорния ждали целых пять лет по той причине, что слишком мало было исходного материала — элементов америция и кюрия. Открыли калифорний в 1950 г., а первое поддающееся взвешиванию количество (порядка трёх стотысячных миллиграмма) было получено лишь в 1958 г. Синтез дальнейших элементов таким образом упёрся в отсутствие исходных материалов. Однако пример плутония, который был получен в урановых реакторах в количествах, достаточных для того, чтобы совершить акт изуверства над населением города Нагасаки, наводил на мысль о том, что возможно для синтеза более тяжёлых элементов найдутся другие пути.
Под кодовым названием «Операция Майк» было проведено испытание термоядерного устройства в 1952 г.
В радиоактивное облако, взметнувшееся над океанским простором, были направлены беспилотные самолёты, управляемые по радио. В специальных бумажных фильтрах они доставили всё, что удалось собрать в атмосфере вблизи взрыва. Эта операция получила название «дорогостоящая грязь».
Разделение захваченного материала на ионообменной колонке сразу показало, что он содержит ещё неизвестные тяжёлые элементы. Выяснилось, что при многомиллионноградусной температуре, развивающейся в момент взрыва, ядро урана способно захватить до 17 нейтронов и увеличить свою массу до 255. Этот чрезвычайно тяжёлый изотоп немедленно распадается с образованием заурановых элементов от № 93 до № 100. Чтобы получить сколь-нибудь заметные количества 99-го и 100-го элементов, названных эйнштейнием и фермием, пришлось переработать тонны кораллов, собранных на месте взрыва.
Таково было первое знакомство с новыми элементами, а потом их научились получать в атомном реакторе. Для этого стали изготовлять образцы из плутониевого сплава в виде салфеточных колец и помещать в реактор, предварительно окружая их алюминиевыми чехлами (для постоянного охлаждения). Часть плутония поглощала нейтроны, превращаясь (после бета-излучения) в америций, который выбрасывал электрон и становился кюрием; кюрий в свою очередь поглощал нейтроны, после чего через бета-излучение становился эйнштейнием и т. д. Это принцип так называемой горячей лаборатории.
Массовое производство искусственных тяжёлых элементов началось с 1956 г.; облучение колец нейтронами велось в течение двух лет, и стоимость их была в тысячи раз выше, чем стоимость такого же количества золота.
Располагая опредёленным количеством эйнштейния, учёные могли уже задуматься и над способом получения (точнее, «сотворения») элемента № 101. В самой реакции его образования сложности не было: эйнштейний нужно было подвергнуть бомбардировке альфа-частицами. Трудность была в техническом исполнении эксперимента — в том, чтобы успеть уловить сигналы нового элемента, если он, конечно, синтезируется. Схема эксперимента рисовалась такой. В циклотрон нужно поставить в качестве мишени кусочек золотой фольги с нанесённым на задней поверхности тончайшим слоем эйнштейния. Позади мишени ещё один кусочек такой же фольги. Её назначение — быть сборником-ловушкой тех немногих атомов нового элемента, которые будут выбиты из мишени. Большой стеклянный бак на роликовых катках, заполненный водой, отделял помещение, где был циклотрон, от исследователей.
Чтобы во время операции не было никаких задержек, провели репетицию. И вот началась сама операция. Как только выключили установку, закончив облучение мишени, двое физиков немедленно откатили «водяную дверь» и ворвались в помещение. Один из них вынул из мишени держатель, второй снял ловушку, запихнул её в пробирку и помчался по коридорам и лестницам в комнату временной лаборатории. Там уже был наготове химик, сразу же приступивший к растворению золота в пробирке. Первый физик к тому времени уже сидел в готовой сорваться с места автомашине и, как только к нему подбежал второй с драгоценным раствором, помчался на холм, где была расположена за милю от циклотрона (ближе было нельзя из-за опасности искажения результатов испытания) радиационная лаборатория. Было высчитано, что период полураспада нового элемента всего лишь полчаса, за это время нужно было успеть зарегистрировать излучение элемента, которого, по всей вероятности, было всего лишь несколько атомов.
В радиационной лаборатории всё было наготове, раствор немедленно был пропущен через ионообменную колонку, отделявшую золото (как ненужный отброс!), затем через вторую — для задержания любых других элементов. Драгоценные капли раствора падали на платиновую пластинку и тут же высушивались с помощью нагревательной лампы. После всего этого пластинка с высохшими на ней каплями была помещена в радиационные счётчики. Удержать новый элемент не представлялось возможным, но при распаде его атомов регистрировались характерные импульсы.
Драматическим событием ознаменовалась одна из попыток синтезировать 102-й элемент. В Беркли у физиков вдруг вырвало окно в циклотроне, и в экспериментальную комнату полетели кусочки кюриевой мишени, испускающие опаснейшее для людей излучение. Лишь через три недели после интенсивнейшей и тщательной дезактивации здания появилась возможность возобновить работы. Взрыв в циклотроне случился уже после того, как объявлено было о создании 102-го; объявлено, но не общепризнано.
Трудности продвижения в заурановый мир всё возрастали. Главной была короткоживучесть создаваемых элементов и их исходных материалов. Становилось ясным, что прежний путь использования мишеней из элементов, ближайших по заряду ядра к тому элементу, какой намереваются получить, малоперспективен. Выход виделся единственный: обстреливать не короткоживущие элементы, а более стабильные, но не нейтронами или альфа-частицами, а снарядами более крупными — многозарядными ионами. Для такого решения задачи требовалось создание совершенно новых, значительно более мощных ускорителей.
Летом 1957 г. интернациональная группа учёных в Нобелевском физическом институте Стокгольма произвела обстрел ионами углерода-13 мишени из изотопов кюрия. Эксперимент был очень сложный, но, как казалось, удачный. В небе над зданием газеты «Нью-Йорк таймc» поздней ночью вспыхнули гигантские пляшущие буквы: «Открыт элемент 102! Он назван нобелием!»
Когда же эксперимент стокгольмской группы был повторен физиками Института атомной энергии имени Курчатова в Москве и радиационной лаборатории в Беркли, то выяснилось, что концы с концами не сходятся. Явно не совпадал и сильно различался период полураспада новообразованного элемента. Да и у стокгольмских физиков зарегистрированный полураспад составлял 10 минут, а по их же расчёту он не должен был превышать 10 секунд.
Взрыв циклотрона в Беркли уничтожил запас ценнейшего исходного материала для синтеза и нанёс сильнейший психологический удар исследователям. Лишь через несколько лет учёные в Беркли, разработав самые тщательные меры предосторожности, решились продолжать эксперименты. Препятствия возникали на каждом шагу. Учёные «прошли пока мимо» злополучного 102-го и сделали попытку синтезировать 103-й элемент.
Весной 1961 г. они обстреляли калифорний ионами бора и зарегистрировали рождение элемента, который нарекли лоуренсием. Он имел период полураспада всего 8 секунд.
В таблице элементов вновь образовался пробел, но уже в заурановой её части. Физики довольно зло шутили, что от нобелия осталось только «но», что по-английски означает «нет».
В конечном итоге после долгих и трудных экспериментов усилиями советских физиков, с одной стороны, и американских — с другой, синтез 102-го элемента был осуществлён, и все неясности, сбивавшие до этого с толку, разрешились.
Группу актиноидов, по расчётам физиков, должен был завершить 103-й элемент. Его назвали лоуренсием. На очереди стал вопрос о дальнейшем продвижении, о 104-м элементе, по поводу которого Глен Сиборг, глава американских физиков-заурановиков, сказал, что он «может быть, окажется наиболее интересным из трансурановых элементов». Где найдётся ему место в таблице, каковы будут химические свойства — этого учёные ещё не представляли себе. Он мог принести много неожиданностей и потому, конечно, стал элементом «таинственным и манящим».
Триумф советских физиков
Под руководством Г.Н.Флерова в Объединённом институте ядерных исследований в Дубне за получение элемента № 104 взялась группа энергичных, настойчивых, инициативных и молодых учёных, среди которых были и физики, и механики, и представители других профессий. Путь их был неимоверно тяжёл, можно сказать, что это была добровольная каторга. Работы проводились на большом циклотроне, который за свои внушительные размеры был прозван одним из гостей «циклотропом».
Руководящих исходных данных для поисков почти не было. Существовала лишь одна гипотеза шведского учёного Юханнесена о том, что время жизни элемента № 104 должно составлять всего лишь 0,014 секунды.
Неуловимый миг, который, казалось, зафиксировать просто невозможно. Сама гипотеза не располагала к тому, чтобы полностью на неё положиться, но другой не было, и Флеров решил ею руководствоваться.
Легче всего получить новый элемент традиционным путём обстрела самого близкого по периодической системе соседа с несколько меньшим зарядом. Однако соседи в данном случае и сами появлялись на свет на такое короткое время и в таком малом количестве, что о традиционном методе и думать было нечего. Снова обратились к не раз уже выручавшему плутонию, решив воздействовать на него ионами неона. Расчёты показывали, что после слияния ядер этих элементов образуется ядро элемента 104, которое, конечно, самопроизвольно распадётся так быстро, что о его кратковременном существовании можно будет судить только по осколкам. Для регистрации осколков против мишени была расположена движущаяся лента — сборник. Скорость движения ленты выбрали с таким расчётом, чтобы за время предполагаемого распада только что родившееся ядро успело подойти к фиксирующим его деление стеклянным детекторам и своими осколками «процарапать» стекло, т. е., как говорят физики, оставить следы, треки, а потом эти следы надо найти, рассмотреть и изучить. Пойди, однако, найди их, если они короче длины световой волны! В электронный микроскоп такой след можно увидеть, но чтобы найти его, потребуются годы — ведь поле зрения у электронного микроскопа очень и очень мало. Совсем не радужная картина. И тогда вспомнили о химической обработке стекла. После лёгкого травления стекла в плавиковой кислоте следы от осколков выявлялись в виде лунок, в тысячу раз больших, чем их первоначальная величина, — искать их уже легче. Но почему выбрали для этой цели стекло, неужели нет ничего получше? Достоинство стеклянных детекторов в том, что они фиксировали лишь крупные осколки, никакие другие частицы — протоны, нейтроны, альфа-частицы — следов не оставляли. Стекло для детекторов требовалось особо чистое. Малейшая примесь урана могла сразу испортить результаты эксперимента. Наиболее подходящим было признано фосфатное стекло, полированное до умопомрачительной чистоты.
После решения этой проблемы много хлопот доставила конструкция ленты-сборника. Собственно говоря, не столь конструкция, сколь её материал. Традиционное в таких случаях золото никак для такой цели не подходило — слишком мала была его прочность. Рассчитанная скорость движения ленты достигала 110 километров в час, и этого не выдерживала даже нержавеющая сталь. После долгих и мучительных поисков подобрали, наконец, сплав на никелевой основе. Эксперимент был начат, но его результаты сразу повергли исследователей в отчаяние. Стеклянные детекторы регистрировали осколки ядер 102-го, 100-го, 95-го и других элементов, только никак не 104-го. Невообразимый фон, хор, из которого выделить нужный голос просто невозможно. Строго говоря, появлению такого фона надо было бы тоже порадоваться — ведь это то самое открытие, которого обычно не ждут. Оно говорило о том, что реакция идёт не так просто, как предполагалось, она, как говорится, не однозначна, могут наряду с ней существовать и многочисленные побочные. Это явление требовало — пожалуй, ещё и сейчас требует — весьма детального изучения, между тем основная цель поиска — 104-й элемент. Есть от чего опустить руки, но этого не произошло. Пришлось мастерить масс-спектрограф, который по размерам занял одну четверть циклотрона. Трудность была преодолена с большой затратой умственной и физической энергии исследователей. Казалось бы, теперь дело пойдёт, но физиков подстерегали новые неожиданности. Соблазнительно сосредоточить на них внимание, но, к сожалению, такой возможности у нас нет, к тому же они уже описаны другими авторами.
Откуда же всё-таки появился такой невообразимый фон? Ведь расчёты показывали, что при слиянии ядер плутония и неона образуется ядро 104-го элемента с выбросом нескольких нейтронов. Всё дело в том, что расчёты исходили из одного характера реакции, реальная же реакция пошла по иному пути. В одном случае при таком слиянии образовывался 102-й элемент, альфа-частица и нейтрон, в другом — 103-й (лоуренсий), протоны и нейтроны. Были и другие варианты, совсем уж, казалось бы, невозможные — на стекле обнаруживали следы более лёгких элементов. Последнее обстоятельство сыграло с исследователями шутку, которая чуть не привела их к ложным результатам.
Когда после долгих бессонных ночей молодые физики отрегулировали установку и запустили её, то вся лаборатория смогла предаться ликованию: на стеклянных детекторах начали появляться следы от осколков новообразованного элемента. Их было немного, но они были! И всё соответствовало тому периоду распада, что был предсказан Юханнесеном, т. е. 0,014 секунды. Но радость оказалась слишком преждевременной. Контрольные опыты не подтвердили, что физики имели дело с 104-м элементом. Странности начались, когда вместо плутония взяли уран, заведомо зная, что ничего получиться не должно, а результат был тот же — следы на стекле, свидетельствующие о периоде распада в 0,014 секунды. Заменили теперь уран бором, и тот же эффект. Казалось, что природа просто издевается над расчётами физиков. От таких «успехов» можно было полностью растеряться, и сказать, что уныние не заглядывало в лабораторию, было бы преувеличением. В конце концов рядом тонко поставленных опытов удалось выяснить, что виновником неожиданного эффекта является изотоп америция с массовым числом 242.
Откуда он взялся? Впрочем, это не сложный вопрос. На него ответ нашли быстро.
Уже говорилось о многообразии ядерных реакций, которые имели место при обстреле плутония ионами неона. При этом выбрасывались нейтроны, которые в свою очередь могли проникать в другие ядра плутония, и происходило образование америция.
Обескураживало физиков не появление этого элемента, а столь неправдоподобно быстрый, не укладывающийся в рамки всех предшествующих расчётов его распад.
Оказывается, здесь пришлось столкнуться с явлением, которое было открыто Флеровым и Петржаком много лет назад, когда они — помните? — работали в служебном помещении станции метро «Динамо», т. е. с самопроизвольным делением ядер тяжёлых элементов. Тогда это был уран, теперь же — америций. Физики знали, что акт такого деления чрезвычайно редок. Для америция-242 это деление ранее не наблюдалось, и по сложным расчетам выходило, что оно может происходить один раз в 1014 лет. Невообразимая редкость и многократное повторение одного и того же периода жизни — 0,014 секунды.
Есть от чего сойти с ума! Дело дошло до того, что один из исследователей, представляясь, назвал себя вместо Анатолия Америцием. Член-корреспондент АН СССР Д.И.Блохинцев, ознакомившись с результатами работ, проведённых молодыми физиками, и с их «америциевым тупиком», был восхищён открытием нового явления, но сказал, что они «нашли негра с белой кожей».
Работа продолжалась — упорная, тяжёлая, изнурительная. Гипотеза Юханнесена оказалась ошибочной, а период деления америция-242 совершенно случайно совпал с тем, какой предсказал ученый для 104-го элемента. Это и было причиной ошибочных результатов. От гипотезы Юханнесена пришлось отказаться, а повторяющиеся 0,014 секунды твёрдо закрепить за одним из изотопов америция. Условия опыта были таковы, что у этого изотопа, при других условиях распадавшегося за несравнимо более длинный срок, образовывалось изомерное, возбуждённое ядро. Он просто не мог из-за этого жить дольше.
Нечто подобное открыл И.В.Курчатов без малого за 30 лет до эксперимента в Дубне. Мы говорим «нечто» потому, что в Дубне разница между метастабильным и возбуждённым состояниями ядра оказалась неправдоподобно большой, у Курчатова она была куда меньше.
Один из английских физиков охарактеризовал это открытие примерно следующим образом: по сравнению с аномалией америция, перспективы исследования которой даже трудно представить, новый 104-й элемент не что иное, как трофей, повешенный на стену. Но этот трофей по-прежнему не давался в руки.
Только в 1964 г. после долгих трудов, преждевременной радости и горьких разочарований, неоднократных остановок и отступлений рождение 104-го элемента было безоговорочно, вне всяких сомнений зарегистрировано. Его получили не 17, как предыдущего 103-го, а целых 150 атомов. Целое состояние! Весь мир узнал об этом с большим удовлетворением, и в адрес Флерова посыпались восхищённые письма с предложениями имён для новорождённого.
Но почти два года он оставался без имени; более того, в соответствующую клетку менделеевской таблицы его заносить не торопились. Флеров воздерживался от этого, ожидая, что скажут химики. Ведь 104-й, как предполагалось, должен сильно отличаться от других заурановых элементов; очевидно, он — экагафний, но это надо было доказать.
За изучение химических свойств 104-го взялся чехословацкий учёный Иво Звара, окончивший Московский государственный университет. Можно представить себе, к решению какой задачи он приступил. За пять часов работы ускорителя в лучшем случае удавалось наблюдать образование лишь одного атома 104-го элемента. И жизни ему было отпущено совсем ничтожный срок. Правда, не 0,014 секунды, но и не намного больше — 0,3 секунды. То, что Иво Звара справился с почти неразрешимой задачей, заставляет восхищаться мужеством, самоотверженностью, беспредельной преданностью учёных науке и уровнем технического обеспечения современного научного эксперимента.
Иво Звара создал своеобразную методику «мгновенной химии», которую отрабатывал в течение четырёх лет. Если 104-й — не актиноид и принадлежит к соседней группе, то у него должны быть существенные отличия в соединении с хлором. Хлориды всех актиноидов нелетучи, и их легко отделить на фильтре от хлоридов IV группы, которые летучи. В приборе Иво Звары атомы 104-го выбивались из мишени и попадали в трубки, по которым шёл газовый поток, где он и тормозился. Газ прежде всего был чистым азотом, но в него добавлялись летучие хлориды элементов аналогов — старый принцип, разработанный ещё Жолио-Кюри, но не в жидкой фазе, а в газовой. Редкие атомы 104-го, попадая в поток, немедленно образовывали хлорид и в виде такого соединения устремлялись к счётчику самопроизвольного деления ядер. Чтобы повысить летучесть хлоридов 104-го, которая всё же ниже, чем у его аналогов, опыты велись при температурах порядка 300-350°, что требовало большой надёжности и коррозионной стойкости аппаратуры. Побочно образовавшиеся хлориды актиноидов легко задерживались специальными фильтрами, а 104-й достигал «места своего назначения» за время менее 0,1 секунды и сигнализировал там о своём присутствии, не допуская сомнений в том, что он не что иное, как экагафний, со всеми химическими свойствами, присущими IV группе.
Эпопея 104-го элемента была завершена, и Г.Н.Флеров мог без всяких колебаний дать ему название. Он написал: курчатовий.
Нужны ли они?
Убеждённый «в том, что исследование урана, начиная с его природных источников, поведёт ещё ко многим новым открытиям, — писал в своё время Д.И.Менделеев, — я смело рекомендую тем, кто ищет предметов для новых исследований, особенно тщательно заниматься урановыми соединениями».
Этот завет стал соблюдаться ещё при жизни великого учёного и в последующее время привёл к таким результатам, которые и фантастическими романами не были предусмотрены.
Создание целого ряда заурановых элементов можно, пожалуй, назвать научной героикой.
Теоретическая физика тоже пришла к великим результатам.
И тут не постесняемся задать один, как говорят учёные, некорректный вопрос: ну и что? зачем всё это нужно? Какая нам польза от элементов-призраков, жизнь которых определяют даже не в прямую, на ощупь, а по каким-то следам? А ведь всё это денег стоит — и, по всему, немалых!
Практическое использование одного из первых заурановых элементов — плутония не вызывает сомнения. Оно тридцать лет назад было потрясающе трагичным. При создании этого элемента, как, впрочем, и других заурановых, учёные интересовались не столько физическими и химическими свойствами его, сколько энергией, выделяющейся при распаде. Да и сам уран рассматривался прежде всего с этой точки зрения. «Манхеттенский проект» завершился военным использованием атомной энергии, и мир содрогнулся от трагедии Хиросимы и Нагасаки.
В СССР при разработке методов овладения атомной энергией сразу же было обращено внимание на возможности её мирного использования. Это выразилось в постройке первых атомных электростанций, о которых Д.И. Блохинцев шутливо сказал, что схема их немногим сложнее самовара, с той лишь разницей, что вместо угля горит уран.
Дальновидность советских учёных, заставивших атом работать на благо людей, приобрела особую ценность сейчас, когда мир стал перед проблемой истощения известных природных энергоресурсов. «Помнится, — пишет академик А.Александров, — что ещё 20 лет назад, когда только начала работать первая в мире советская атомная станция мощностью всего 5 тысяч киловатт, многие считали, что атомная энергия — это, в общем, скорее забава учёных и инженеров и вряд ли найдёт когда-либо широкое применение, вряд ли будет конкурентоспособной с энергетикой на обычном топливе — нефти, газе и угле. Теперь так не думают. Сегодня в 16 странах мира действуют более ста атомных электростанций общей мощностью примерно 40 миллионов киловатт». А к концу века, считает академик А.Александров, до 60 процентов мирового энергопотребления обеспечит атомная, а впоследствии термоядерная энергетика.
В «Основных направлениях развития народного хозяйства СССР на 1976–1980 годы», принятых XXV съездом КПСС, намечается ввести в действие мощности на электростанциях в размере 67–70 миллионов киловатт, в том числе на атомных — 13–15 миллионов киловатт. Причём, как сказано в этом документе, необходимо «предусмотреть опережающее развитие атомной энергетики в европейской части СССР». Почему — в европейской? Да потому, что здесь сосредоточено около 75 процентов потребителей электроэнергии, в то время как подсчитанных запасов минерального топлива по стране на её европейскую часть приходится около 20 процентов. Кроме того, ставится задача постепенного сокращения потребления в качестве топлива такого ценного сырья для химической промышленности, как нефть и газ.
Плутоний постоянно вырабатывается в атомных реакторах. Это металл, физические и химические свойства которого установлены с предельной чёткостью. Выяснены точки его плавления и кипения, изменение плотности в зависимости от температуры, образование шести кристаллических форм и другие свойства, «подведомственные» физике, химии, кристаллографии, металлографии и другим точным наукам. Область технического использования очень широка, не говоря уже о том, что он — «сырьевой материал» для получения других заурановых элементов.
Плутоний, ужаснувший мир в 1945 г., в настоящее время рассматривается как средство в борьбе за продление человеческой жизни. Сердце изнашивается, деятельность его ослабевает, и ведёт это к неотвратимому концу. Вживлённый в организм больного миниатюрный стимулятор из изотопа плутония-239 сопоставим с аккумулятором, дающим добавочную энергию сердцу, но не требующим никакой перезарядки. Чтобы активность его снизилась наполовину, требуется 90 лет. На человеческую жизнь, даже с больным сердцем, этого более чем достаточно.
Поскольку плутоний в реакторах сейчас получают в больших количествах, то плутониевый аккумулятор используется в чисто технических целях: мощность его во много раз превосходит мощность аккумуляторов химических как щелочного типа, так и свинцового; конечно, такой аккумулятор значительно дороже, но помимо мощности он располагает и ещё одним незаменимым преимуществом — миниатюрностью.
Техническая служба последующих элементов более ограничена, но и она немалая; это пока, а в дальнейшем, следует полагать, она будет расширяться. Америций, доставивший столько треволнений открывателям 104-го, помог установить новое явление в физике, которое трудно переоценить. Гамма-излучение одного из его изотопов используется для многих измерительных целей. Тончайшая фольга или уровень жидкости с его помощью измеряются с поразительной точностью.
Давно уже использовался искусственно радиоактивный изотоп йода для изучения состояния щитовидной железы. Теперь вовсе не обязательно вводить «меченые атомы» йода в организм. Гамма-лучи крошечного препарата америция выявят всё по накоплению в железе обычного стабильного изотопа йода. Радиографические приборы для исследования нефтяных скважин также пользуются услугами америция-241.
Кюрий-244 — один из наиболее доступных в весовых количествах заурановых элементов. Он образуется в недрах работающего реактора. Как источник энергии он, естественно, дорог, поэтому и используется в особо ответственных приборах — автоматических метеостанциях, искусственных спутниках и аппаратуре для исследования глубин океана. С увеличением мощности атомных реакторов стоимость кюрия значительно снизится. А как источник альфа-излучения он и сейчас значительно дешевле, чем радий и полоний, требующие огромных затрат и усилий для извлечения их из рудных месторождений.
Изотопы берклия используются пока лишь в исследовательских работах. Самый долгоживущий из них, берклий-249, имеет период полураспада 290 дней, и следует оценить его как перспективный для практического использования. Его собрат калифорний также накапливается в весовых количествах в процессе работы ядерного реактора. Некоторые изотопы его выгодно отличаются от других заурановых элементов большим числом испускаемых нейтронов при каждом акте деления (в среднем 3,5).
Как источник нейтронов калифорний значительно выгоднее «древнего» полоний-бериллиевого, к тому же он исключительно компактен. Радиотерапия изучает возможности использования его в борьбе с раковыми опухолями. Специальные иглы, содержащие всего несколько микрограммов (тысячных долей миллиграмма) калифорния, представляют собой нейтронный источник значительной интенсивности и могут быть введены непосредственно в раковую опухоль. Многотонные установки используются для целей активационного анализа, решения задач, связанных с исследованием нефтяных скважин, целого ряда геофизических проблем. Их может заменить миниатюрное устройство, в котором содержится всего пять микрограммов калифорния.
В урановом «котле» постоянно варится такая «каша», из которой можно извлекать изотопы самых разнообразных элементов, в том числе и заурановых, в весьма ощутимых весовых количествах. Это прежде всего даёт возможность изучить свойства элементов, что обязательно влечёт за собой их техническое применение. Пока что их использование связано с энергией выделяемых частиц, очень важное и многообразное. Изучению их предшествовала широкая практика применения радиоактивных изотопов обычных элементов — так называемых меченых атомов. Здесь просто не место уделять этому большое внимание, оно описано в десятках научных и научно-популярных книг. Следует лишь напомнить, что меченые атомы — не что иное, как искусственно созданные элементы, определённый этап в работах учёных по трансмутации, так долго считавшейся полнейшим абсурдом.
Сомнения в целесообразности получения новых заурановых элементов стали возникать ввиду непродолжительности их существования. Однако выяснилось, что если одни изотопы какого-нибудь элемента распадаются за доли секунды, то другие (у него же) довольно устойчивы. Взять хотя бы америций-243, его период полураспада — 8800 лет; или кюрий-248, у которого время жизни 470.000 лет; у берклия-247 — 7000 лет; у калифорния-249 — 400 лет. Правда, в общей массе элемента таких изотопов совсем немного, и не они определяют в целом время его жизни. Именно это обстоятельство заставило учёных искать заурановые элементы «не по порядку».
Ещё в 30-х гг. нашего столетия физиками была подмечена любопытная закономерность: атомные ядра, в которых число протонов или нейтронов равнялось 2, 8, 20, 50, 82, 126, отличались высокой стабильностью. Почему это так — тогда никто не знал, и такие числа в шутку назвали магическими. Позже кое-что здесь прояснилось, но название так и осталось. Сейчас выяснено, что ядро отличается особо высокой устойчивостью, если в нём количество протонов и нейтронов измеряется магическим числом. Примером может служить свинец-208, ядро которого содержит 126 нейтронов и 82 протона.
Рядом теоретических работ показано, что число протонов 114 также является магическим, а потому следует ожидать стабильности от элемента с таким номером. Две лаборатории мира — ядерных реакций в Дубне и радиационная в Беркли — занялись изучением возможности получить элемент 114. Обычный путь — обстрел нейтронами, альфа-частицами или дейтеронами мишеней из близлежащих к 114-му элементов в таком случае бесперспективен. Эти близлежащие просто ещё не получены. Для использования же в качестве «артиллерийских снарядов» ускоренных ионов не хватает мощности ускорителей. Современные ускорители позволяют разгонять ионы элементов, ещё не достигших по своему атомному весу середины периодической системы, а при таких условиях, как показали эксперименты американских физиков, получить 114-й элемент не удаётся.
Параллельно работам по созданию 114-го элемента ведутся поиски его в природных объектах. На первый взгляд это кажется странным, так как известно, что поиски куда более простых элементов, таких, например, как технеций, не увенчались успехом именно потому, что все его запасы за время существования Земли распались. Но это ничего не значит. Мы уже говорили о том, что заурановые элементы как результат естественных радиоактивных превращений могут снова и снова появляться в недрах и что благодаря сверхточным и сверхчувствительным методам их можно в конце концов обнаружить. Так, например, в 1942 г. американские учёные Сиборг и Перльман показали присутствие плутония-239 в природе, в урановых рудах, с содержанием 10–14 грамма на один грамм руды.
В 1952 г. в урановых смоляных рудах из Конго учёные обнаружили ничтожное количество нептуния-237. Такие элементы получили название вторичных. Что касается 114-го элемента, то он должен быть, по-видимому, аналогом свинца, подобно тому, как 104-й оказался аналогом гафния. По всей вероятности, 114-й элемент следует искать в свинцовых соединениях. Как ни медленно, но он всё же самопроизвольно распадается. Следы этого распада можно уловить в толще свинцового стекла после обработки его плавиковой кислотой.
Рассуждая так, учёные из группы Г.Н.Флерова стали собирать старинные рюмки, подвески, зеркала, куски стеклянного литья. Совершенно не играет роли состояние годности этих предметов, они могут быть разбитыми, представлять собой просто обломки, лишь бы были они древними, а стекло — свинцовым. После травления кислотой и шлифовки какие-то следы действительно были обнаружены, но принадлежат ли они 114-му элементу — сказать пока трудно.
Вполне вероятно, что 114-й элемент мог оказаться на земле как космический пришелец. Академик А.П.Виноградов, геохимик и космохимик, обратил внимание физиков на железо-марганцевые конкреции, покрывающие значительную площадь на дне Тихого океана. Это бурые шарики, образовавшиеся вокруг каких-то центров кристаллизации. Не исключено, что в них спрятались и пришельцы из космоса. Научно-экспедиционное судно «Витязь» доставило физикам «подарки дна морского», и следы распада какого-то элемента были в них обнаружены. Ведутся поиски экасвинца и в свинцовых рудах — с помощью счётчика и самописца, регистрирующего редкие акты самопроизвольного деления.
Торжество идеи, или похвала алхимикам (Вместо послесловия)
В 1924 г. мир был взволнован сообщением о том, что профессор Мите при работе с ртутно-кварцевой лампой обнаружил в ней следы золота. Из солидных учёных мало кто поверил этому сообщению: слишком уж оно попахивало шарлатанством средних веков. Проверкой сообщения занялся известный японский учёный Нагаока и после тщательно проведенной работы подтвердил его. Можно представить себе, какую сенсацию это вызвало.
Просто поразительна интуиция алхимиков средневековья: ведь в качестве материала для изготовления золота они всегда предлагали не какие-нибудь металлы, а близлежащие к нему ртуть и свинец. Хотя и с трудом верилось, но чем чёрт не шутит: ведь с 1924 г. не только была установлена эмиссия электронов (т. е. потеря атомом какой-то своей части), но даже осуществлено настоящее превращение. Резерфорд получил из азота кислород путём обстрела его альфа-частицами. Правда, и азот, и кислород — газы. А с другой стороны, что мешает допустить, что в металлах процесс превращения облегчён, и электрические поля большой мощности способны осуществить трансмутацию? Конечно, это было заблуждением, в которое поверили немногие учёные, но на непросвещённых сообщение Мите и затем Нагаоки производило сильное впечатление. Им заинтересовалась даже такая солидная фирма, как «Сименс». Она и предоставила в распоряжение профессора средства для проведения дальнейших исследований. Ошибка была обнаружена самим же автором «открытия». Золото в ртути действительно было, но отнюдь не ртутного происхождения. Подвела слишком большая чувствительность новейших методов анализа. Достаточно было работать, имея на носу очки в золотой оправе, как следом за этим драгоценный металл обнаруживался в ртути.
Мите не суждено было свернуть науку на алхимический путь, но его работа, хоть и ошибочная, сыграла очень даже немалую положительную роль в химии. Как так? Да очень просто: усилились исследования по изучению веществ сверхвысокой чистоты, которые, как наглядно показано в наше время, обладают уникальными свойствами, что необычайно важно для современного научного и технического прогресса.
Идея трансмутации насчитывает не одну сотню лет. Её много раз хоронили и много же раз возрождали.
Последний раз она возродилась благодаря успехам химии и физики, но возродилась на принципиально иной основе, не имеющей ничего общего с той, на которую опирались алхимики в своих попытках превратить металлы в золото. Уцелела лишь сама идея превращения элементов. Более того, без признания этой идеи наука должна была бы остановиться в познании окружающего мира. Блестящие работы замечательных учёных показали это со всей несомненностью. Их удачи и их неудачи в одинаковой, можно сказать, степени заставляли науку продвигаться вперёд, руководствуясь идеей превращения элементов. Достижения в этой области грандиозны, а перспективы дальнейших исследований и технического их применения просто величественны.
Можно сказать, что идея превращения элементов лишилась алхимического содержания, но приобрела содержание научно-техническое, притом очень важное. Стоимость и значение не только новых элементов, но даже и имеющихся в природе, таких, например, как радий, несравненно выше стоимости и значения золота, хотя оно и благородный металл.
Золото вдохновляло алхимиков, и они, не жалея сил, трудились, подготовляя почву для развития подлинно научной химии. Идея трансмутации пробилась сквозь века, несмотря на позолоченные виселицы, изгнание из академий, анафему всем тем, кто в неё верил.
Идея восторжествовала и открыла перед наукой необозримые горизонты исследований и технического прогресса. Что же касается алхимиков, то после всех грандиозных достижений науки нашего времени уместно напомнить высказывания замечательного советского учёного А.Е.Ферсмана: «…я думаю, алхимики должны были бы признать, что их фантазии претворены в жизнь и даже превзойдены человеческим гением».




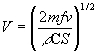
Комментарии к книге «Превращение элементов», Борис Игнатьевич Казаков
Всего 0 комментариев