Стивен Липкин, Джон Луома Время генома: Как генетические технологии меняют наш мир и что это значит для нас
Переводчики М. Багоцкая, П. Купцов
Научный редактор Е. Померанцева, канд. биол. наук
Редактор А. Никольский
Руководитель проекта Д. Петушкова
Корректоры Е. Аксёнова, С. Чупахина
Компьютерная верстка А. Фоминов
Дизайн обложки С. Хозин
© 2016 by Steven Monroe Lipkin and Jon R. Luoma
© Издание на русском языке, перевод, оформление. ООО «Альпина нон-фикшн», 2018
Просветительский фонд «Эволюция» основан в 2015 году сообществом российских просветителей.
Цель фонда – популяризация научного мировоззрения, продвижение здравомыслия и гуманистических ценностей, развитие науки и образования.
Одно из направлений работы фонда – поддержка издания научно-популярных книг.
Каждая книга, выпущенная при содействии фонда «Эволюция», тщательно отбирается серьезными учеными. Критерии отбора – научность содержания, увлекательность формы и значимость для общества.
Фонд сопровождает весь процесс создания книги – от выбора до выхода из печати. Поэтому каждое издание библиотеки фонда – праздник для любителей научно-популярной литературы.
Больше о работе просветительского фонда «Эволюция» можно узнать по адресу
Все права защищены. Произведение предназначено исключительно для частного использования. Никакая часть электронного экземпляра данной книги не может быть воспроизведена в какой бы то ни было форме и какими бы то ни было средствами, включая размещение в сети Интернет и в корпоративных сетях, для публичного или коллективного использования без письменного разрешения владельца авторских прав. За нарушение авторских прав законодательством предусмотрена выплата компенсации правообладателя в размере до 5 млн. рублей (ст. 49 ЗОАП), а также уголовная ответственность в виде лишения свободы на срок до 6 лет (ст. 146 УК РФ).
* * *
Моей замечательной семье:
Джине, Рейчел, Софи, Элисон, Итану и Зоуи – за их огромное терпение и помощь на протяжении тех часов, когда я работал над этой книгой
Предисловие
Начало каждого из нас – наш личный геном, он появляется, когда мы еще меньше клетки, и с тех пор навсегда остается с нами и определяет всю нашу дальнейшую жизнь. Геном похож на сложный штрихкод. Из-за того, что он очень длинный и сложный, каждый из нас отличается не только от 8 млрд людей, живущих на планете сегодня, но и от всех 20 с лишним миллиардов, которые существовали с момента возникновения человечества 200 000 лет назад. И конечно же, у нас он не такой, как у любых других видов, живших за последние 4 млрд лет, будь то животные, растения, вирусы или археи. Что же может быть более индивидуальным?
Даже когда на улице жара, мы не ходим голыми. Люди обычно стесняются публично обнажаться, потому что не желают, чтобы каждая деталь их репродуктивной анатомии была выставлена на всеобщее обозрение. Однако подобная скромность не простирается дальше поверхности кожи. Что обнажает нас сильнее, чем публичное раздевание? Сегодня на этот вопрос можно ответить однозначно – последовательность личного генома намного интимнее тела: именно в ней суть нашего существования.
И хотя мы не любим прилюдно обнажаться, мы это делаем, когда появляется веская причина. Например, в кабинете врача. Мы раздеваемся, несмотря на чувство неловкости, располагаемся на столе для обследований, который обычно бывает холодным, мы позволяем врачу увидеть самые интимные части нашего тела, так как знаем, что, несмотря на неудобство, это позволит сохранить здоровье. И наоборот, сокрытие от врача этих областей тела может стать причиной страданий или закончиться совсем плохо. По тем же причинам люди решают поделиться своей интимностью in silico[1] и открыть врачам доступ к личной генетической информации. В перспективе с помощью таких сведений медицина сможет обеспечить около 150 лет жизни без болезней. И это не астрология, это честная, добросовестная биологическая наука. Но неужели это возможно?
Около 20 лет назад полный анализ всей ДНК человека (то, что обычно называют полногеномным секвенированием) был сопоставим со стоимостью авианосца. Сейчас этот анализ дешевле мотороллера Vespa, и на него не требуется направления от врача. Мы живем в удивительное время! Полногеномное секвенирование стало хорошо отработанной технологией, с его помощью выявляются ранее не диагностируемые заболевания у пациентов и членов их семей, обнаруживаются онкологические заболевания на ранней стадии, оно используется даже для самопознания, поиска своих корней и объяснения, как мы стали теми, кто мы сегодня есть. Сейчас в академических кругах идет бурное обсуждение перспектив секвенирования генома из капли крови, взятой из пятки каждого новорожденного США (так называемое «поколение XX/XY[2]»); предполагается, что этим займутся в ближайшее десятилетие. Некоторые авторитетные специалисты упорно призывают покончить с вековой врачебной практикой постановки диагноза на основании клинических проявлений и симптомов и вместо этого переориентировать медицинскую диагностику на генетические и биохимические механизмы заболевания. Наступают основательные и многообещающие перемены.
Для «постройки» человека необходимо около 20 000 генов. Немного обидно, что примерно столько же их требуется растению резуховидке[3], а крошечная муха дрозофила, которую с трудом можно заметить, обходится всего в два раза меньшим числом генов. Тем не менее именно такова наша личная «инструкция по эксплуатации», которую, вероятно, можно использовать и для путешествия назад, в те далекие века, из которых мы вышли.
Когда генетики или консультанты по генетическим вопросам имеют дело с геномом человека, они ищут в нем особые изменения, называемые мутациями[4]. Нить ДНК можно представить в виде предложения, написанного на скрученной двойной спирали. Отдельные «буквы» этого предложения образованы парами четырех типов азотистых оснований: аденином, гуанином, цитозином и тимином, сокращенно их обозначают буквами А, Г, Ц и Т соответственно. Мутации можно уподобить орфографическим ошибкам, как в слове «дикабраз» вместо «дикобраз», или переставленным буквам – «диокбраз», в «текст» могут добавляться или выпадать из него фрагменты длиной до нескольких миллионов оснований. В конечном счете судьба каждого из нас зависит от этой генетической программы.
Представьте, что все измененные гены можно разложить по нескольким отдельным кучкам, так же как сортируют грязную одежду. В первой корзине окажутся относительно редкие мутации, которые часто называют «поддающимися лечению». Это как куча заляпанной одежды, которую надо отложить отдельно, чтобы отправить в химчистку, поскольку в этой корзине наиболее важные и востребованные мутации. Для таких мутаций медицина может разработать план лечения, о них обязательно информируют самого пациента, указывая, что надо делать, и дают пояснения для лечащего врача, как это делать. Если собрать в комнате десять врачей и спросить, как надо поступить при наличии такой мутации, то все сразу поднимут руки и каждый будет гордо и восторженно цитировать медицинскую литературу, описывающую лучший способ борьбы с этим наследственным заболеванием.
Как только мы нашли мутацию, вызывающую излечимое заболевание, врач и пациент оказываются перед дорогой, уходящей за горизонт. Дорога эта может разветвляться. Существуют разные варианты дальнейших действий. Возьмем, к примеру, ген BRCA1, связанный с развитием рака груди и яичников. Про него написаны терабайты статей в научных журналах, проведено множество клинических испытаний с рекомендациями, что должны делать пациенты (или чего не делать), чтобы снизить риск развития рака, предлагается диагностическая визуализация, превентивная химиотерапия или превентивная хирургическая операция. Это те мутации, из-за которых у моих пациентов тревожно замирает сердце. Мы, врачи, проверяем пациентов на эти мутации в первую очередь (а умные приложения к электронной медицинской карте в последнее время контролируют нас и подсказывают, что надо сделать). Из-за таких мутаций люди, как правило, стараются поскорее попасть на прием к генетику.
Если последствия мутации поддаются лечению, многое можно сделать не только для пациента, сидящего перед вами, но и для его родных: польза будет подобна живительной влаге, которая просачивается к корням семейного дерева и распространяется по ветвям далеко в будущее. После того как врач сформулирует все плюсы и минусы возможных действий и узнает, что пациент думает о перспективах, надо обсудить с ним что, как и когда он будет сообщать братьям, сестрам, тетям и дядям, детям и будет ли он общаться с ними на эту тему, потому что с этого момента пациент сам распоряжается информацией о своих генах. Человек всегда сам решает, раскрывать или нет свою личную генетическую информацию.
Иногда мутации обнаруживаются неожиданно. Такие случаи называют инциденталомами или (в последнее время) побочными находками. Это мрачная противоположность серендипности – способности обнаружить что-то удачное, чего не искали. Вы начинаете поиск причин врожденной формы рака толстой и прямой кишки, чтобы вовремя обнаружить опухоли и спасти жизнь, и находите… болезнь Гоше. Откуда она тут взялась? Это неожиданное открытие не сопровождается анамнезом, но с ним приходит надежда улучшить будущую жизнь этой семьи. Вы заметили болезнь в зародыше, для нее есть заместительная ферментная терапия, четкий план действий, но у человека, который сидит перед вами, нет никаких проявлений или симптомов этой болезни, по крайней мере пока. Зная о мутации, вы сможете предотвратить болезнь, боль и страдание, прежде чем все это начнется.
Во вторую корзину попадают мутации, которые можно назвать «хотелось-чтобы-их-последствия-поддавались-лечению», но пока с ними ничего нельзя сделать. Эти ужасные мутации предвещают мрачное будущее, но, к сожалению, медицина мало что может предложить. Знание без силы беспомощно. Многие люди вообще не хотят знать, какое несчастье их ждет, пока оно не наступит. Например, мы почти ничего не можем предложить тем пациентам с семейной формой болезни Альцгеймера, которые еще находятся в сознании и способны думать о будущем. В этом случае знание о предполагаемых последствиях может усилить тревогу, а в худшем случае – привести к состоянию глубокого отчаяния. Кроме того, наличие мутаций такого типа говорит лишь о повышенном риске заболевания, а не том, что оно обязательно разовьется. Так что осведомленные носители обрекают себя на тревогу, которая может растянуться на десятилетия. В подобных случаях, вероятно, разумно отказаться о того, что дает нам геномная эра, и просто не знать.
В то же время некоторые люди хотят узнать о возможной болезни для того, чтобы спланировать свою жизнь. Может быть, лучше поехать в кругосветное путешествие сейчас, не откладывая? А может, забрать детей из школы пораньше, чудесно провести с ними время и поесть мороженого, вместо того чтобы опять работать до вечера, стремясь стать партнером в деле? К счастью, иногда случается, что со временем эти гены перекладывают в предыдущую корзину. Например, синдром Горлина – генетическое заболевание, при котором на коже по всему телу появляется множество опухолей. Мутации, вызывающие эту болезнь, ведут себя как герой стихотворения «Ученик чародея» и заставляют клетки кожи бесконтрольно делиться. Сегодня уже есть препарат, позволяющий заблокировать сигналы, идущие от сломанного гена. Целая армия умных, упорных, низкооплачиваемых, вечно недосыпающих ученых и практикующих врачей постоянно работает, чтобы найти возможность перенести мутацию из второй корзины в первую.
В третий корзине лежат мутации, последствия которых поддаются лечению, но сейчас это не нужно. Скажем, у вас есть аллель, вызывающий повышенную чувствительность к «Клопидогрелу» – препарату, про который вы никогда не слышали, но, возможно, столкнетесь с ним в ближайшее десятилетие. Дело в том, что он используется при сердечных приступах, а у вас никогда не было сердечного приступа. Но если в будущем у вас возникнут неполадки с сердцем, то, заблаговременно зная об этом аллеле, вы не будете медленно умирать. Такие мутации похожи на содержимое коробки в дальнем углу гаража, которое редко используется, но вы не желаете его выбросить. Одни пациенты хотят быть в курсе подобных мутаций, а другие – нет. Надо ли сообщать им эту информацию – зависит от их личных предпочтений и общего уровня тревожности.
В четвертой корзине лежит белье, которое на самом деле не ваше. Это гены, которые не влияют непосредственно на личное здоровье, но могут быть важны для ваших детей, братьев и сестер, кузин и кузенов. По моему личному опыту, множество людей делают генетические анализы не ради себя, а ради своих детей. Они любят свои семьи сильнее, чем самих себя. Они обыкновенные герои.
Каждый из нас несет более сотни мутаций в разных генах. Многие из этих генов, по-видимому, не очень важны. В других генах мутации не вызывают серьезных последствий, если у вас одна копия гена хорошая, а другая – «сломанная», потому что болезнь возникает только в случае, если испорчены обе копии. Например, тяжелое заболевание легких и поджелудочной железы – муковисцидоз. У вас может быть мутация в одной копии гена, которая никак не проявится: она встречается примерно у одного из каждых 23 человек европейского происхождения, которые сейчас бегают по улицам Нью-Йорка. Если вы больше не собираетесь заводить детей, то знание об этой мутации никак на вас не повлияет, у вас все и так хорошо. Однако, если ваш сын или племянница планируют создать семью, результаты вашего генетического тестирования могут содержать очень полезную для них информацию, потому что у их партнера тоже может быть сделан тест на мутации, вызывающие муковисцидоз. И если результат положительный, есть разные методы, позволяющие снизить риск рождения ребенка с выраженным муковисцидозом, например использующееся сейчас преимплантационное генетическое тестирование, а в ближайшем будущем, вероятно, появится возможность редактировать геном.
В пятой корзине находятся гены, которые позволяют узнать что-то личное, но при этом неинтересны никому, кроме хозяев этого «белья», то есть вас и вашей семьи. Это могут быть даже не мутации, а тонкие изменения, которые могут незначительно повлиять на ваш вес, рост, возраст полового созревания и на само течение вашей повседневной жизни. Может быть, эти гены объяснят, почему в хоре вы никогда не могли взять верхнее до и стояли в заднем ряду или почему вы чуть не завалили школьную математику, зато у вас был абсолютный слух.
Назовем их «генами самопознания». Они не попадут в вашу медицинскую карту, но знакомство с ними позволит по-другому взглянуть на свое отражение, которое вы видите каждый день в зеркале. Иногда эти гены идут вразрез с семейными преданиями. У многих этнических групп есть свои характерные генетические признаки. Например, по геному часто можно определить, относится ваш пациент к афроамериканцам, европейцам, азиатам, индусам или евреям-ашкенази, даже если вы никогда не видели его в лицо. Один уважаемый ученый, которого я никогда не видел, опубликовал в рамках научной работы последовательность своего генома. Помнится, до того как я увидел его фотографию в интернете, я смотрел на его генетические особенности и пытался представить себе, как он выглядит. Надо сказать, у меня это получилось успешнее, чем я ожидал. Личный геном гораздо интимнее поверхности тела.
Я также помню очень неловкую ситуацию, когда я консультировал семью с ребенком, больным муковисцидозом, и случайно обнаружил, что отец мальчика был… не его биологическим отцом. Это называется ложным отцовством и в действительности встречается у нескольких человек из 100, которые делают анализ всего генома или отдельных генов.
В шестой корзине лежат мутации, которых у вас нет, и вы стремитесь избежать их любой ценой. Они похожи на ярко-красную рубашку, которая при стирке может испортить все ваши вещи. Это мутации, приводящие к раковой опухоли. Сегодня мы знаем, что рак на самом деле – болезнь ДНК. Полногеномное секвенирование поможет найти самые глубокие корни рака и, надеюсь, хотя бы иногда выкорчевывать эту болезнь.
На сегодняшний день одна из самых распространенных причин, почему люди делают генетический анализ, как раз и есть поиск мутаций, участвующих в развитии рака. Они ищут мутации, имеющиеся в раковых клетках, но отсутствующие в здоровых – такие, при которых рак лечится существующими на рынке препаратами или лекарствами, проходящими клинические испытания. Список генетических изменений, встречающихся только в раковых клетках, огромен, в нем тысячи пунктов. Однако с подавляющим большинством таких мутаций мы ничего не можем сделать.
Мутаций, при которых возможно лечение, всего около десятка. Этот показатель варьирует для разных типов рака, к тому же из года в год увеличивается за счет разработки новых лекарственных средств.
Люди, которые секвенируют свой раковый геном, заодно получают полную последовательность генома и для здоровых клеток, как в рекламной акции «два по цене одного». Это делают, чтобы можно было различить, где собственные генетические особенности раковых клеток, а где то, что они унаследовали от здоровых. Таким способом можно случайно наткнуться на гены из всех описанных корзин.
Естественно, представленный в этой книге обзор того, что можно узнать с помощью полногеномного секвенирования, в чем-то очень упрощен. Не так-то легко уложить в одну книгу рассказ о 20 000 генах. Если напечатать последовательность генома в одну строку шрифтом Times New Roman 12 кеглем, то она протянется через всю континентальную часть США.
Эта книга для тех, кто любит приключения, жаждет новых знаний, хочет погрузиться в глубины человеческого генома и миллионы лет эволюции, чтобы лучше прочувствовать масштаб и характер той информации, которую можно получить при анализе вашего генома. В последующих главах будут рассказаны истории об отважных людях с наследственными заболеваниями – истории, фоном для которых служит современный Нью-Йорк, один из наиболее разнообразных с генетической, этнической и культурной точек зрения, а также самых экономически неоднородных городов США.
Поскольку генетический анализ и секвенирование генома – сложные темы, вокруг них возникает большая путаница. В современной атмосфере стремительного роста генетических знаний и появления совершенно новых технологий заблуждения и ошибки могут возникать из-за ажиотажа, раздуваемого СМИ, недостаточной квалификации врачей и не вполне научной литературы, попадающей к читателю. Истории, описанные в этой книге, покажут огромные перспективы, подводные камни и ограничения, которые есть у генетического тестирования в эпоху доступного секвенирования генома.
Глава 1 Парижская домохозяйка
Сержант Винсент – бывший пилот вертолета, общительный человек – пришел к нам в амбулаторное отделение Больницы для ветеранов в Сан-Диего. Он ветеран флота и оказался достаточно крепким, чтобы выжить в Дананге во время Вьетнамской войны, но я подумал, что он упадет в обморок и мне придется звать на помощь, когда мы сообщили ему новости о его здоровье.
«Та девка заразила меня сифилисом? Черт возьми, док, это так мерзко!» Затем он повернул голову и взглянул на нас расширенными от ужаса глазами. «И что со мной будет? Что мне теперь делать?»
Объявлять пациентам хорошие новости в тысячу раз проще, чем плохие, – жаль, что хорошие новости бывают в десять раз реже. Я быстро успокоил сержанта Винсента, объяснив, что у нас есть много разных средств для лечения сифилиса и он может расслабиться и рассчитывать, что скоро будет здоров, если, конечно, не заразится снова.
Сифилис – инфекционное заболевание с дурной славой, известное также под названиями «французская болезнь» в Италии, «итальянская болезнь» во Франции, «испанская болезнь» в Нидерландах и т. д. Хотя ни один народ не признавал эту болезнь своей, сифилис был широко распространен и очень опасен.
Во времена эпохи Возрождения сифилисом болел миллион с небольшим европейцев, то есть большая часть населения. Много веков эта болезнь причиняла невыразимые страдания и унижения мужчинам и женщинам. Однако сегодня ей отведено всего несколько строчек в медицинских учебниках. Обычно сифилис вылечивают одним уколом антибиотика в дельтовидную мышцу плеча.
На протяжении тысячелетий инфекционные заболевания, особенно бактериальные, такие как «французская болезнь», были самой распространенной причиной смерти. На заре ХХ в. каждый третий американец умирал от инфекции; чаще всего гибли дети. Прошло чуть более века, и в Соединенных Штатах количество смертей от бактериальных заболеваний резко снизилось. У нас есть эффективные, безопасные и часто дешевые методы борьбы с большинством таких болезней. Этот великий прорыв привел к существенному уменьшению количества смертей, сейчас смертность от инфекций меньше 5 %. Бактериальные заболевания вроде сифилиса из безнадежной трагедии превратились в легкоизлечимые болезни; важно только, чтобы врач не пропустил их по небрежности.
Заветная цель медицинской генетики, направленной на диагностику и лечение наследственных заболеваний, – найти столь же эффективные методы лечения для примерно 6000–7000 генетических болезней, приобретенных человечеством на протяжении долгого эволюционного пути. Заболевания такого типа имеются в среднем у одного человека из 20.
Болезнь Гоше – пример успеха в генетической медицине. Это одно из тех немногих (по сравнению с инфекционными) наследственных заболеваний, с которыми на данный момент можно что-то сделать{1}. Когда-нибудь мы сможем амбулаторно лечить не только болезнь Гоше, но и все другие наследственные заболевания так же, как сейчас легко лечим большинство бактериальных инфекций.
Филипп Шарль Эрнест Гоше был дерматологом, практикующим врачом в период Fin de siècle[5] в Париже. В эпоху Бодлера, Виктора Гюго и раннего модернизма в искусстве Гоше был профессором сифилографии – дисциплины, изучающей возбудителей сифилиса и саму болезнь, и основателем специализированного медицинского журнала, посвященного венерическим заболеваниям. Однако сегодня Гоше помнят в основном из-за болезни, которую он описал, будучи еще студентом-медиком. Это была тема его дипломной работы.
Заболевание, которое впоследствии назовут его именем, Гоше впервые выявил у 32-летней парижской домохозяйки, которая жаловалась на боли в левом боку. Источником дискомфорта была увеличенная и болезненная селезенка – орган, расположенный в брюшной полости наискосок от аппендикса, в ней клетки иммунной системы собираются для обмена информацией. Есть множество причин, почему селезенка человека увеличивается в размерах: это могут быть инфекции, рак, а также нечто, называемое идиопатической причиной. С медицинского жаргона на современный язык «идиопатический» переводится примерно так: «Я понятия не имею, почему этот человек заболел». Этот термин используется, когда врачи ничего не знают о причинах болезни, но не хотят выглядеть глупыми или некомпетентными перед своими пациентами. Такой подход еще называют «мусорный диагноз». Столкнувшись с ним, доктора, вероятно, понимают, что их коллега пытался сохранить лицо.
С учетом вышесказанного диагноз для этой невезучей молодой парижанки звучал как «рак или неопределенное заболевание». Однако Гоше видел в больнице множество раковых пациентов, присутствовал на вскрытии умерших больных и вместе с патологоанатомами исследовал их клетки под микроскопом. Никаких признаков рака не было ни в увеличенной селезенке этой больной, ни в печени, ни в крови, ни где-нибудь еще. Именно про этот парадокс он и написал свою дипломную работу. Вместо клеток рака Гоше и его профессора увидели неправильной формы звездчатые клетки иммунной системы, называемые макрофагами. Эти клетки выглядели так, будто были набиты миниатюрными шариками из скомканных бумажных салфеток, а их центр был окружен чем-то похожим на ореол. Оказалось, что эти признаки характерны для макрофагов в селезенке у пациентов с болезнью Гоше. Эти иммунные клетки были неспособны переварить то, что поглотили. Первоначальные выводы Гоше подтвердились три года спустя, когда умер шестилетний французский мальчик с такими же клетками в селезенке.
Причины увеличения селезенки несчастной молодой женщины, мальчика и других, у кого впоследствии диагностировали болезнь Гоше, оставались идиопатическими еще долго после того, как все они умерли, – до 1960-х гг. В это время Роско Брейди, усидчивый биохимик из Национальных институтов здравоохранения США в Бетесде, штат Мэриленд, вместе с Дэвидом Шапиро из Института Вейцмана в Израиле и другими коллегами показал, что отсутствие определенного фермента вызывает накапливание в макрофагах селезенки структур, выглядящих как мятая бумага. Семь лет спустя они смогли выделить достаточное количество такого фермента из плаценты, чтобы показать, что введение его пациентам может смягчить эту болезнь. Так впервые была изобретена ферментозаместительная терапия для наследственного заболевания еще до того, как был найден соответствующий ген.
В 1981 г. Эдвард Джиннз со своими коллегами также из Национальных институтов здравоохранения клонировали ген болезни Гоше и описали истинные молекулярные основы этого наследственного заболевания. У одного из 100 человек присутствует мутация в этом гене, но так как заболевание рецессивное, он будет носителем, а не больным. Когда ген был идентифицирован, появилась возможность производить фермент в промышленных масштабах для помощи пациентам во всем мире – это одна из историй успеха ранних биотехнологий.
Благодаря этим невоспетым героям лабораторий давно истлевшая селезенка парижской домохозяйки была извлечена из корзины с идиопатическими «мусорными диагнозами» и перемещена в новую этиологическую корзину, не существовавшую во времена Филиппа Гоше: к наследственным заболеваниям.
Многим врачам, так же как и мне, трудно выговорить название гена, мутация в котором вызывает болезнь Гоше, – ген лизосомальной глюкоцереброзидазы, – поэтому знакомьтесь с более удобным сокращенным именем и официальным названием этого гена: GBA.
GBA – один из тех генов, которые ученые называют генами домашнего хозяйства. Главная «домашняя обязанность» GBA – утилизация определенного типа отработанных жировых клеточных отходов, научное название которых – глюкозилцерамиды. Когда GBA не работает, глюкозилцерамиды (сокращенное называние GL-1) накапливаются в макрофагах селезенки, заставляя ее увеличиваться в 10 раз. У некоторых пациентов при определенных мутациях болезнь также может вызывать увеличение печени, нарушения в работе клеток костного мозга, кожи, легких и – в особо серьезных формах – головного мозга, то есть нарушения могут быть во всех местах, где работают GBA и макрофаги патрулируют и поглощают отходы других клеток.
Почти через 100 лет после открытия, сделанного Гоше, родился Наполеон Джексон. Он вырос и получил образование на одном из идиллических островов Карибского архипелага. Его предки поселились здесь на семейной ферме так давно, что уже никто не помнил те времена. За долгие годы он и его семья пережили много тропических штормов.
Будучи молодым человеком, Наполеон переехал в окрестности Нью-Йорка в поисках возможности стать актером и музыкантом и в надежде на светлое будущее. Но он точно прибыл туда не ради холодной погоды, к которой так и не смог привыкнуть. В 30 с чем-то лет он переехал с женой и детьми в Нью-Джерси и, чтобы прокормить семью, устроился на работу в качестве технического служащего в одну из больниц Верхнего Ист-Сайда в Манхэттене – районе, который местные жители называют «аллеей больничных уток» из-за большого количества медицинских учреждений.
Я встретил его в клинике через несколько дней после того, как гигантский ураган «Сэнди», образовавшийся в тропиках, обрушился на окрестности Нью-Йорка. Ужасный шторм ударил по Нью-Йорку и штату Нью-Джерси с такой яростью, какую я никогда раньше не видел. Это был самый мощный ураган на Атлантике, и он навсегда изменил пейзаж нашего города. Десятки тысяч деревьев были вырваны ветром. Целые поселки смыты наводнением или, как это случилось на Статен-Айленде, сожжены пожаром. Погибли сотни жителей.
Ураган обрушился и на мой собственный дом в Уэстчестере, на 11 дней лишив меня электричества, тепла и чуть ли не надежды. В то утро, когда Наполеон пришел в клинику, я чувствовал себя помятым, замерзшим и бессильным в городе, пережившем «Сэнди», – городе без метро, городе, похожем на сцену «Манхэттен опять в руинах» из фильма-катастрофы.
Однако мой новый пациент был в еще худшем состоянии. Наполеон был измотан – за последние несколько дней он спал всего одну ночь. Его форма была очень грязной и мятой, штаны порваны. Он побывал в аду во время урагана, и ему посчастливилось выжить.
Он страдал от загадочной болезни, которая изматывала его. У него болели кости. А при осмотре лечащий врач обнаружил, что его селезенка была огромной и настолько распухшей, что казалось, вот-вот разорвется, залив его внутренности, как лопнувший воздушный шарик с водой. Это несчастье легко могло произойти, если бы Наполеон, допустим, поскользнулся на мокром полу больничного подвала, где провел долгую ночь во время урагана, неприметно, с полной отдачей, спасая людей.
Неподалеку от клиники, в которой Наполеон обратился ко мне, располагается Медицинский центр Лангон при Нью-Йоркском университете, который встретился с катастрофой лицом к лицу, когда ураган «Сэнди» обрушился на побережье. Больничные подвалы, лифтовые шахты и нижние этажи были затоплены водой Ист-Ривер, поднявшейся на высоту более трех метров. Из строя вышли резервные генераторы, и почти вся больница лишилась электроэнергии, в том числе хирургическое отделение, отделения интенсивной терапии и реанимации новорожденных, где живут и иногда умирают самые слабые больные. Пациентов, в том числе недоношенных детей, подключенных к почти разряженным аппаратам жизнеобеспечения, преодолевая девять пролетов по скользким ступеням, выносили в темноте на улицу, где бушевал шторм. Наполеон был одним из многих героев, которые мужественно боролись в этом районе на протяжении целой ночи. Подвалы манхэттенской больницы, где он работал, также были затоплены. Замерзшие и измученные, он и его коллеги сражались с безжалостным Атлантическим океаном всю ночь. Неоднократно рискуя жизнью, они успешно спасли той ночью многих людей, иначе воды Ист-Ривер смыли бы пациентов Медицинского центра Лангон в океан.
Первые симптомы заболевания появились у Наполеона несколькими годами ранее, когда обычный анализ крови показал низкий уровень тромбоцитов – клеток крови, останавливающих кровотечение. Хотя иногда из-за этого возникали синяки, в том числе точечные синяки петехии, которые образовывались на кончиках пальцев во время игры на гитаре, он не обратил на это внимания, и это никак не повлияло на его работу и личную жизнь.
Как и у первой парижской пациентки Гоше, селезенка Наполеона была наполнена раздувшимися макрофагами. Из-за малого количества тромбоцитов и увеличенной селезенки возникло предположение о лейкемии, и лечащий врач направил его на биопсию костного мозга. Врач-патолог не нашел клеток, чьи ядра были бы похожи на ядра раковых клеток, поэтому лейкемию исключили. В костном мозге имелись другие отклонения: клетки крови были более морщинистые, чем обычно, и они были наполнены микроскопическими пузырьками, называемыми вакуолями. Однако, хотя эти результаты были явно ненормальными, для постановки диагноза они были столь же мутными, как Ист-Ривер после урагана. К счастью, поскольку раковых клеток найдено не было, Наполеона не мучили неспецифической цитотоксической химиотерапией. На самом же деле из-за особенностей работы GBA его костный мозг был наполнен макрофагами, поэтому появились анемия и быстрая утомляемость.
При дальнейших обследованиях внимательный гематолог, выясняя причину снижения количества тромбоцитов, заметил, что родители Наполеона были дальними родственниками, потому что родились и выросли на одном и том же острове в Карибском море. Острова называют божьим даром для генетиков, потому что на них больше вероятность обнаружить рецессивное генетическое заболевание, которое создает проблемы, если человек получает две копии этого гена – по одной от каждого родителя. На островах из-за их изоляции и поскольку иногда жители стремятся вступать в брак только с членом своей группы, например в религиозной общине, вероятность, что носители одного и того же вредоносного гена (все мы несем от 2 до 5 таких генов) вступят в брак, выше, чем в неизолированных сообществах, таких как большой город.
Этот дотошный гематолог предположил, что у Наполеона может быть синдром Германски – Пудлака – редкое рецессивное наследственное заболевание, при котором в костном мозге накапливается другой вид клеточного мусора, больше похожий на кусочки вощеной бумаги. Кроме того, один из предков Наполеона был альбиносом с очень светлой кожей, светлыми волосами и светлыми глазами, а синдром Германски – Пудлака может проявляться таким образом.
Тем не менее Наполеону не сделали генетический анализ на синдром Германски – Пудлака, потому что эти анализы не оплачивались его медицинской страховкой. Почему? Синдром Германски – Пудлака не считается страховым случаем, поскольку для него нет лечения. Компания заявила, что, хотя результаты анализа помогут Наполеону узнать о своем будущем и будущем его семьи, они практически никак не повлияют на медицинский уход за ним{2}.
Мы попытались опротестовать это решение. Я лично встретился с врачом, работавшим в страховой компании, обслуживающей Наполеона, чтобы обсудить этот случай. Я рассказал ему историю и наши выводы, но страховщик нам отказал, найдя вежливый способ назвать меня ученым-выскочкой, который заказывает слишком много тестов для своих пациентов, – «доктор Дон Кихот», один из тех, которые гоняются за диагностическими «ветряными мельницами» и разоряют нашу систему здравоохранения (однако при этом не упомянул стоимость страховых взносов). Мы безуспешно пытались найти исследовательскую лабораторию, которая заинтересовалась бы изучением тромбоцитов Наполеона с помощью электронной микроскопии: так тоже можно было бы поставить диагноз, не платя за обследование. Клинические исследования с бесплатным генетическим анализом встречаются очень редко, и, думаю, вам бы не хотелось, чтобы врачи считали вас настолько интересным случаем.
Не только селезенка, но и печень Наполеона была увеличена. Его мать и брат страдали от болезни Паркинсона, и это повышало вероятность того, что у Наполеона болезнь Гоше. (Считается, что болезнь Гоше может вызывать паркинсонизм, потому что «скомканная бумага» откладывается в микроглии – макрофагах нервной системы.) Чтобы попытаться разобраться в симптомах Наполеона, его направили к гастроэнтерологу, и он сосредоточил внимание на печени, которая настолько увеличилась, что заняла почти весь живот и почти касалась селезенки. Печень не разорвется так же легко, как нежная селезенка. Это позволяло безопасно провести любые инвазивные процедуры, которые помогли бы подтвердить или опровергнуть наличие возможных заболеваний. Мы подозревали еще одну наследственную болезнь – гемохроматоз, когда железо в опасных количествах накапливается в печени и других органах.
Гастроэнтеролог провел биопсию печени. Это было что-то вроде диагностического подбрасывания монеты. Если бы выпал «орел», мы нашли бы накопление восковидного мусора в печени, как при болезни Германски – Пудлака. Если «решка» – мы бы нашли белые пенистые макрофаги, указывающие на болезнь Гоше. Если бы монета легла на ребро, нужно было бы начинать все с нуля.
Под микроскопом клетки печени Наполеона выглядели сильно поврежденными. Некоторые из них были замещены липкими белково-углеводными волокнами, которые играют в нашем организме роль изоленты. Врачи называют это научным термином фиброз. Патолог не смог сказать, было ли это последствием воздействия какого-то токсина (например, химических веществ на работе) или же причина была генетическая. Таким образом, результаты оказались весьма неопределенными.
Но был еще один важный аспект, на который обратил внимание патолог: в печени присутствовали пенистые макрофаги, характерные для болезни Гоше, и это навело нас на точный диагноз.
Поскольку для этого диагноза существовало лечение, страховая компания согласилась оплатить «доктору Дон Кихоту» генетическое исследование Наполеона для подтверждения болезни Гоше. Мы взяли кровь и отправили в лабораторию проверить ген GBA. Там призвали на помощь генетического «ученика чародея» – так мы называем полимеразную цепную реакцию (ПЦР), чтобы сделать миллион копий GBA гена Наполеона. ПЦР была разработана в 1983 г. Кэри Муллисом и Майклом Смитом с коллегами. При высокой температуре двойная спираль ДНК разрушается. Затем при понижении температуры однонитевые праймеры (маленькие синтезированные фрагменты ДНК, взаимодополняющие определенные области генома) ищут и находят участок с подходящей для них последовательностью нуклеотидов. Очищенный фермент, называемый ДНК-полимераза, добавляет новые элементы (А, Ц, Т и Г) к концам праймеров, и генетическая последовательность образца реплицируется. Этот цикл повторяется много раз, и только что синтезированные фрагменты сами становятся матрицами для синтеза, поэтому процесс усиливается в геометрической прогрессии, как при расщеплении атомов.
На следующем этапе ДНК секвенируют – это повторение процесса синтеза, но теперь есть А, Ц, Т и Г, окрашенные специальной флуоресцирующей меткой, которая реагирует на свет аргона, показывая, где какой нуклеотид. В конце концов секвенатор ДНК, анализируя огромное множество нуклеотидных последовательностей, определяет, где находится каждый фрагмент этой мозаики, и мы получаем ответ.
В случае с Наполеоном мы нашли мутацию, которую искали. У него было две копии мутировавшего гена, который его родители получили, вероятно, от общего дальнего предка, поскольку их семьи жили на одном и том же острове в Карибском море. Произошла замена только одной из 536 аминокислот в белке GBA, но этого оказалось достаточно, чтобы Наполеон тяжело заболел.
Эта мутация в GBA уже неоднократно обнаруживалась прежде. Известно, что впервые она появилась около 50 поколений назад, в период Раннего Средневековья, у человека, который был евреем по национальности. Происхождение этой мутации легко проследить до того времени, анализируя аллели этого гена у разных этнических групп сегодня. Каждый раз, когда сперматозоид и яйцеклетка сливаются, родительские геномы объединяются и перемешиваются. Изучив нынешние аллели и насколько эти аллели различаются у разных этнических групп, мы можем определить историю той или иной мутации. В настоящее время эта мутация, вызывающая болезнь Гоше, распространилась по всему миру и чаще всего (но не всегда) встречается у евреев.
Если мутация возникает у человека, принадлежащего к определенной этнической группе, в которой принято вступать в брак внутри этой группы – как, например, у евреев, – мутация будет распространятся внутри группы. Это иногда называют эффектом основателя.
Мутации в других генах, например в гене BRCA1, связанном с риском рака молочной железы, про который мы поговорим позднее, часто встречаются как у евреев, так и у некоторых людей испанского происхождения, которые, предположительно, могут быть потомками одного конверсо. Конверсо – это евреи, которые были вынуждены перейти в католицизм во время Испанской инквизиции в XVI в., спасаясь от аутодафе. Таким образом, можно предположить, что у Наполеона был дальний предок с такой мутацией, который бежал на Карибские острова в Новом Свете и передал мутацию своим детям. Она передавалась из поколения в поколение, пока двое его потомков не нашли друг друга и не стали счастливыми родителями Наполеона.
Однако есть вероятность, что такая же мутация возникла в семье Наполеона случайно, не связанная ни с каким конверсо. Независимо от произошедшего много веков назад по случайному совпадению поменялась та же аминокислота, и активности белка хватило, чтобы носители гена выжили.
Мутация, которая была обнаружена у Наполеона, частично препятствует GBA производить «уборку» организма. Ни у людей, ни у животных не было найдено такой мутации GBA, которая бы полностью выключала работу этого белка, но позволяла носителю выжить. Следовательно, полная утрата работоспособности GBA несовместима с жизнью.
Теперь, когда диагноз прояснился, Наполеон начал лечиться. Принцип лечения болезни Гоше понятен каждому, кому доводилось наводить чистоту в доме. Если в гене GBA есть мутация и синтезируемый белок неспособен в полной мере заниматься уборкой, вы получаете помощника – молекулярную горничную. Вы приглашаете работников с навыками белка GBA, которые помогут избавиться от скомканной бумаги, скопившейся в клетках.
Изготовление белка GBA для пациентов с болезнью Гоше – биотехнический эквивалент высокого кулинарного искусства с бюджетом более $400 000 в год. Его приготовление похоже на приготовление клеточного рагу в огромных емкостях. Хотя обычно его делают из животных клеток, есть вегетарианская версия белка GBA, полученного из моркови. Когда «рагу Гоше» готово, его отжимают и процеживают так, чтобы остался только GBA. Если использовать только немодифицированный GBA, то около 95 % белка не попадет в макрофаги, которые в нем нуждаются. В процессе подготовки GBA покрывают специальными сахарами, к которым у макрофагов есть особые рецепторы, чтобы макрофаги их съели; кроме того, добавляют и некоторые другие ингредиенты, включая антиоксиданты, консерванты и стабилизаторы, которые, кстати, содержатся еще и в чипсах. Потом вы вводите эту смесь в кровь, и ее поедают макрофаги в селезенке, костном мозге и в других органах, где она нужна. GBA – белок очень трудолюбивый, поэтому достаточно восстановить всего 10 % GBA, чтобы обеспечить работу клетки.
Наполеону начали колоть заменитель GBA каждые две недели – в этом случае заменитель был сделан с помощью клонированного гена в клетках животных, а не моркови. Поскольку имелся однозначный результат генетической диагностики, а медицинская литература отлично подтверждала преимущества метода, страховая компания не стала возражать против дорогостоящей ферментозаместительной терапии. Молекулярная горничная начала уборку мусора, который накапливался в организме с самого рождения. За несколько месяцев миллионы крошечных вспененных вакуолей, загромождавших его костный мозг, печень и селезенку, были переварены макрофагами.
Сейчас Наполеон чувствует себя лучше. Его боль утихла, да и анализ крови улучшился. Он перестал страдать от загадочного хронического заболевания, которое может лишить его жизни или средств к существованию или (что еще хуже) заставить замирать от страха за свое будущее, в котором могли бы возникнуть множественные миеломы, болезнь Паркинсона и пр. Теперь Наполеон мало чем отличается от тысяч других людей, которых он встречает каждый день по дороге в больницу. Сейчас у него гораздо больше сил для игр со своими детьми. Будем надеяться, что генетический риск внезапной смерти от внутреннего кровотечения для него в прошлом. Лечение болезни Гоше очень недешево. В целом ежегодно на один препарат для лечения только этого наследственного заболевания тратится сумма всего в три раза меньшая, чем весь бюджет проекта «Геном человека». Сейчас в мире около 10 000 пациентов с болезнью Гоше. Около 5000 получают ферментозаместительную терапию, большинство из них платят за лечение меньше $400 000. Примерно 10 % – в большинстве своем это люди, живущие за пределами США, – платят очень мало или вообще ничего.
Почему это лечение так дорого? Отчасти годовые затраты, превышающие стоимость автомобиля Maserati, это результат принятого правительством США в 1983 г. «Закона об орфанных препаратах»{3}. Этот закон периода администрации Рейгана должен был стимулировать фармацевтические компании к созданию лекарств от редких заболеваний, таких как болезнь Гоше, подвесив у них перед носом «финансовую морковку», в частности разрешив назначать любую цену на одобренный препарат в течение первых семи лет (кроме того, несколько лет добавляют неизбежные юридические проволочки). Закон запрещает выпуск конкурирующего препарата для той же болезни, если только не доказано превосходство этого препарата над уже утвержденным.
Тогда думали, что без этих стимулов фармацевтические компании не будут тратить деньги на исследования лекарств от редких заболеваний. Как правило, запуск на рынок нового препарата в бюрократизированном, регулируемом и любящем судебные разбирательства западном обществе – это длительное, сложное и рискованное бизнес-начинание. И его стоимость в XXI в. превышает $1 млрд.
Сейчас есть по крайней мере четыре компании, производящие лекарство от болезни Гоше, однако, как ни странно, цена его не слишком падает. При нынешнем объеме норм, правил и законов генетическая медицина стоит недешево. Но и невозможность вылечить пациентов тоже обходится очень дорого. Без лечения многие пациенты с болезнью Гоше, в отличие от Наполеона, будут многократно госпитализированы, прооперированы, пройдут процедуры, не смогут работать и приносить какую-либо пользу обществу.
Почему на сегодняшний день существует лечение только для очень небольшого числа наследственных заболеваний, несмотря на то что мы сделали большой рывок в области изучения генома? При болезни Гоше и некоторых других, влияющих на «уборку» в клетках, чтобы модифицированный лечебный препарат начал работать, он должен быть введен в кровь и добраться до места с нужным типом клеток. К сожалению, при большинстве генетических заболеваний сделать это не удается. Фактически многие из них считаются неизлечимыми, что означает, что мы не настолько умны (пока), чтобы точно доставить «по адресу» действующую молекулу для устранения проблемы, не оказав вредного влияния на другие органы.
Многие генетические заболевания вызваны мутациями в нескольких генах, а не только в одном, и поэтому их нельзя эффективно вылечить. Научный язык называет их «сложными признаками». К их числу относятся любые измеряемые характеристики человека, которые не укладываются в простую систему доминантного и рецессивного наследования, изучаемую студентами-медиками. Там может участвовать несколько генов, мутации в которых взаимодействуют друг с другом дьявольски сложными путями, вызывая заболевания. Кроме того, может влиять жизненный опыт и условия среды. Часто такими заболеваниями занимаются не генетики, а другие специалисты. Яркий пример такого сложного признака – ожирение.
Когда много лет назад я учился на психиатрическом отделении, пожилой врач признался мне, что никогда не будет нанимать на работу людей с ожирением, потому что, дескать, у них «не хватает силы воли». Подобная психодинамическая точка зрения, скажем прямо – «ожирение в мозгах», сегодня кардинально изменилась, потому что выяснилось, что это целая группа заболеваний физиологического и неврологического происхождения, а не просто проявление недостаточной силы воли или психологическое нарушение.
Говоря простыми словами, ожирение – это набор заболеваний с общей чертой: накоплением жира в организме, которое может привести к сокращению продолжительности жизни{4}. С медицинской точки зрения человек страдает ожирением, если индекс массы тела (масса тела в кг, деленная на квадрат роста в кв. м) больше 30. Хотя человеческий генофонд за последние десятилетия не очень поменялся, количество людей с ожирением во многих странах резко возросло.
Есть несколько «простых» одиночных мутаций, которые могут привести к сильному ожирению. Однако считается, что чаще всего оно возникает из-за взаимодействия сотен мутаций в десятках различных генов{5}, доступности разных типов пищи и низкого уровня ежедневной активности. Генетические мутации могут влиять на эффективность обмена веществ, то есть сжигания калорий, способность мозга регулировать аппетит, эффективность усвоения пищи, психологическое состояние, уровень тироидных гормонов и множество других важных биологических механизмов. Имеются даже данные о том, что определенные мутации могут влиять на пищевые предпочтения, например любовь к жареной еде. У нас также есть доказательства того, что некоторые мутации, найденные на разных континентах, влияют на ожирение нынешнего поколения не так, как на поколение наших прадедов, когда образ жизни был более активным (хождение пешком вместо езды на машине, работа на ферме вместо сидения в офисе) и воздействия окружающей среды были иными.
Есть несколько утвержденных препаратов для снижения веса, но большинству людей они помогают относительно слабо и могут быть использованы только как дополнение к диете и упражнениям.
Сложные признаки – большая проблема для фармацевтической промышленности. В настоящее время к изготовлению лекарств мы подходим как охотники, которые едут на сафари с крупнокалиберной винтовкой, чтобы поразить большую цель, скажем, тигра. Большинство компаний направляют свои усилия на крупные, очевидные цели, которые с помощью современных технологий могут быть достигнуты и превращены в «охотничий трофей», составляющий более $5 млрд ежегодно.
Однако генетические заболевания со сложным наследованием – другой тип мишени. Они больше похожи на пчелиный рой. Не важно, насколько точно бьет винтовка, выстрелы пулями в рой пчел не принесут пользы. Чтобы сделать неизлечимые заболевания со сложным наследованием излечимыми, необходимы совершенно другие фармакологические подходы (что-то вроде дыма или инсектицида вместо пуль). Может быть, надо использовать разнообразные лекарства, одновременно влияющие на несколько основных узких мест, новые технологии для регулирования включения и выключения генов, нанороботов, патрулирующих кровеносные сосуды, или другие, пока еще не созданные технологии.
Да, возможность влиять на сложные признаки обязательно придет, но мы пока не знаем когда. Наши достижения в области геномики вселяют в меня надежду, что будущее прольет свет на заболевания, которые сегодня являются медицинским аналогом темной материи. Сто лет назад «французская болезнь» была неизлечима. Сегодня если мы приглядимся, то увидим будущее, в котором большинство наследственных заболеваний, и в том числе сложные признаки, будут легко лечиться.
Глава 2 Неизлечимые Вам может навредить то, чего вы не знаете, но также может навредить и то, что вы знаете.
Все виды животных обременены наследственными заболеваниями. Королевский пудель, которого я видел в своем районе несколько лет назад, падал в обморок всякий раз, когда приходил почтальон. Все потому, что у него, как и у множества других пуделей, доберманов, лабрадоров, такс и представителей еще ряда пород, была собачья нарколепсия – рецессивное наследственное заболевание, которое заставляет собак засыпать, получив кусочек еды со стола или прямо во время погони за любимой игрушкой. При этом поврежден ген, кодирующий белок-рецептор – что-то вроде антенны, которая находится снаружи нервной клетки и реагирует на вещество, отвечающее за сон и пробуждение. У животных уже найдены тысячи генетических болезней и, видимо, будет открыто во много раз больше.
Хотя у нас, так же как и у других животных, наследственные заболевания возникают из-за мутаций в ДНК, есть кое-что, чем мы отличаемся: наши чисто человеческие свойства. Например, в отличие от собак, которые в основном живут только сегодняшним днем, когда они здоровы и сияет солнце, мы можем представить, что в будущем подхватим грипп или что пойдет дождь. У нас есть сознание, мы способны к рефлексии и можем представить, что в один прекрасный день заболеем и умрем. Наше самосознание позволяет думать о будущем и не ограничивать наш мир текущим моментом – как если бы наш мозг видел одновременно два изображения: одно настоящее, а другое – воображаемое будущее.
Из-за нашей способности представлять себе будущее возникают проблемы с генетическим анализом на заболевания, для которых нет лечения. Неизлечимые наследственные заболевания кардинально отличаются от таких, как болезнь Гоше, и после генетического анализа носителю остается только надеяться, что придет лучшее время и будет найдено эффективное лечение.
Многие люди не хотят знать о генах, сулящих слишком мучительные и страшные неизлечимые заболевания, на которые никак нельзя повлиять, если тяжелая болезнь надвигается неотвратимо и нет (по крайней мере сейчас) ни возможности облегчить состояние пациента, ни тем более вылечить. Это самое ужасное в генетическом тестировании. Знание без силы делает неизлечимые заболевания похожими на древнегреческие трагедии, когда всем остается только наблюдать, как неумолимо появляются симптомы.
Звучит странно, но Лидию я встретил не на приеме у себя в клинике, а на светском мероприятии. Мы оба были приглашены на вечерний прием в районе Челси в Манхэттене около реки Гудзон. Примерно 20 или 30 человек собралось на квартире у одной супружеской пары (ученый и финансист), чтобы под обильные закуски с напитками послушать и обсудить доклад физика из ЮАР «Что нового в космологии». Я ничего не знал об этой теме, что и привлекло меня в первую очередь. Приглашенный астрофизик прочел нам лекцию, после которой состоялась бурная дискуссия о предетерминизме (согласно которому все вселенские события предопределены) и физическом индетерминизме (который занимает противоположную позицию). Насколько я понял, вторую концепцию разделяет большинство современных физиков.
После лекции и обсуждения я смотрел с 22-го этажа на невероятное звездное небо над Вест-Виллидж. Когда я стоял у окна, любуясь видом, Лидия подошла ко мне и представилась. Она была темноволосой женщиной лет 40, жила в городе и работала финансистом. Ранее тем же вечером, перед лекцией, я общался еще с одним гостем, который недавно переехал в Нью-Йорк из Аргентины, на тему генетического тестирования, когда оно полезно, а когда нет и что люди из разных стран интерпретируют одну и ту же информацию совершенно по-разному. Например, американки по сравнению с женщинами из некоторых европейских стран чаще проводят превентивную операцию, снижающую риск развития опухоли, после выявления мутаций в генах BRCA1 и BRCA2, связанных с раком груди и яичников. Когда эта тема обсуждалась, Лидия разговаривала с другим гостем, а сейчас подошла ко мне.
Она спросила: «Вы врач, который делает генетические анализы? Мне кажется, моей семье нужна помощь такого рода».
На следующей неделе Лидия позвонила мне в офис. Она сделала несколько звонков, не оставив сообщений. Часто это значит, что пациент беспокоится о конфиденциальности и тема разговора для него деликатная. Наконец, увидев тот же номер на определителе, я взял трубку.
«Здравствуйте, доктор», – она начала с того, что напомнила наш предыдущий разговор. «Я Лидия Герстман. Мы познакомились на той лекции. Моей матери диагностировали рак яичника примерно два года назад. Она умерла вскоре после того, как ей исполнилось 57 лет. Что она пережила! На ее страдания было невозможно смотреть. Я очень похожа на мать и внешне, и по характеру. Я очень беспокоюсь, что у меня будет такой же рак, как и у матери. Я читала про это в интернете, и если мне это суждено, то я хотела бы сделать операцию, чтобы предотвратить рак. Я готова заплатить за генетический анализ, если моя страховка не покроет расходы».
Очевидно, эта личная трагедия оставила тяжелый след в душе Лидии, и было совершенно ясно, что она очень боится повторить судьбу матери. Кроме того, у Лидии было распространенное заблуждение о наследственности, что якобы у человека, похожего внешностью и поведением на какого-то члена своей семьи, выше вероятность развития того же заболевания, в данном случае рака яичников (это может быть верно только в ситуации с однояйцевыми близнецами и некоторыми редкими синдромами). Лидия не считала себя очень похожей на своего отца и поэтому не беспокоилась, что унаследует его гены.
Однако, пока я по телефону знакомился с семейным анамнезом, становилось совершенно ясно, что нет никаких признаков того, что в ее семье рак яичников был вызван какой-то классической генетической причиной. Не было других близких родственников с раком яичника, груди, матки или других органов. Поскольку рак яичников часто возникает после 50 лет и без какой-либо явной генетической причины и Лидия не относится к этнической группе, где риск развития этого заболевания повышен, из того, что я услышал, я не нашел никаких веских оснований рекомендовать ей приходить в клинику для тестирования. Вероятность, что у нее найдется мутация в пресловутых BRCA1 или BRCA2 генах, связанных с развитием рака груди и яичников, была примерно 3 %.
Однако в медицинской генетике есть старый совет (вроде тех, что обычно дают студентам-медикам): если вас пригласили обследовать ребенка с шестью пальцами, смотрите на руку в последнюю очередь. Не надо отвлекаться на очевидную проблему настолько, чтобы забыть обо всем остальном. В этом смысле медицинская генетика отличается от скорой помощи, где, как правило, необходимо сосредоточиться над решением острой проблемы, а остальные оставить на потом.
Когда я спросил Лидию про другие, не раковые, заболевания в ее семье, она сообщила, что у отца, когда ему было около 50 лет, развилась болезнь Альцгеймера.
«Около 50? Вы уверены, что это именно болезнь Альцгеймера?» – спросил я.
Она ответила: «Да». Она была в этом уверена. «Он находится в Медицинском центре Святого Франциска в Нью-Джерси. Если хотите, я могу сказать, как зовут его доктора. Но врач никогда не говорил, что это генетическое».
Наследственная форма болезни Альцгеймера, бесспорно, одно из самых страшных неизлечимых заболеваний. На эту тему написано огромное множество хорошей литературы, так что здесь я лишь очень кратко изложу суть. Болезнь Альцгеймера – наиболее часто встречающаяся разновидность деменции, она обнаружена у более чем 4 млн американцев и занимает шестое место по причинам смерти в стране. Конечно же, эта болезнь поражает людей во всем мире. Большинство становятся ее жертвами после 65 лет.
Обычно болезнь Альцгеймера начинается с небольших провалов в памяти. Вы не можете вспомнить, где оставили свою машину или где гуляли с собакой сегодня вечером. Далее туман сгущается, жертвы Альцгеймера могут стать очень растерянными, встревоженными и социально замкнутыми. Часто бывает, что неврологические и психиатрические симптомы оказываются все более выраженными, а в остальном организм сохраняет относительное хорошее здоровье. Однако в итоге болезнь Альцгеймера приводит к инвалидности и смерти, обычно из-за отсутствия общей заботы о себе и окружающем, в частности потери интереса к еде и личной гигиене. Как правило, это происходит в течение восьми лет, однако длительность заболевания может варьироваться от года и менее до 20 и более лет. Среди десятка самых распространенных причин смерти в Америке только для болезни Альцгеймера в настоящее время нет способов лечения, замедления или предотвращения заболевания.
Принято считать, что болезнь Альцгеймера имеет по меньшей мере три стадии. На первой у людей возникают специфические, четко определяемые молекулярные изменения, которые часто обнаруживаются еще до появления первых симптомов. Если мы имеем дело с генетическими мутациями, то их можно определить за много десятилетий до первых признаков потери памяти. Негенетические признаки заболевания на этой первой стадии ищут многими способами – от сканирования мозга и анализа крови на различные биомаркеры до разработки специального программного обеспечения, способного анализировать электронные письма и телефонные разговоры и находить небольшие изменения в их содержании. На второй стадии болезнь прогрессирует, и такие симптомы, как потеря памяти, становятся хорошо заметными. В последнюю, третью, стадию заболевание неумолимо приближается к своему завершению.
Однако до появления симптомов большинство биомаркеров, в том числе и результаты генетического анализа, не дают точных предсказаний о будущем человека. Например, довольно много написано о генетическом анализе на наличие аллеля APOE e4. Надежная связь между присутствием этого аллеля и высокой вероятностью развития болезни Альцгеймера после 65 лет показана во многих этнических группах, и особенно она выражена у тех, у кого обе копии гена представлены этим аллелем. Но как именно APOE e4 связан с началом болезни Альцгеймера, неясно и остается предметом обсуждения. Необходимо заметить, что примерно половина людей с болезнью Альцгеймера не имеют ни одного такого аллеля. В настоящее время тест на этот аллель в целом не используется в клинической практике для досимптоматического выявления у людей ранней стадии болезни Альцгеймера, но он важен для научных исследований, занимающихся разработкой новых способов лечения, предназначенных для предотвращения болезни и уменьшения интенсивности ее симптомов. Недавно найдена мутация в другом гене (TREM2), которая также повышает риск возникновения болезни Альцгеймера после 65 лет. Из тех, у кого есть эта мутация, заболевает каждый четвертый. Точно так же, как и в случае с APOE e4, медицинское сообщество пока не пришло к единому мнению о том, надо ли делать генетический анализ на мутацию в TREM2 и в некоторых других генах-кандидатах для пресимптоматической диагностики болезни Альцгеймера у пациентов без отягощенной наследственности.
В то же время врачи значительно чаще рекомендуют генетический анализ для людей, у членов семьи или близких родственников которых была ранняя форма болезни Альцгеймера. Примерно каждый четвертый случай болезни Альцгеймера встречается в семье, где такой диагноз уже есть у двух и более человек. Кроме того, примерно у 2–5 % пациентов выраженные симптомы болезни Альцгеймера появляются в возрасте младше 65 лет – это так называемая ранняя форма болезни. Наличие ранней формы заболевания у родственников – веская причина для проведения генетического анализа.
У детей, братьев и сестер человека с болезнью Альцгеймера риск развития этого заболевания составляет 20–25 %, что в 2,5 раза выше, чем у обычного человека. Наличие нескольких больных родственников на одной стороне семейного дерева, особенно если их симптомы появились в возрасте до 70 лет, увеличивает риск возникновения болезни Альцгеймера до 30–50 %.
В настоящее время известны три гена, присутствие которых значительно повышает вероятность развития симптомов, если у близких родственников была ранняя форма болезни Альцгеймера, то есть у них деменция возникла в возрасте до 65 лет. Это гены белков пресенилин-1, пресенилин-2 и белка-предшественника бета-амилоида (А4), все они связаны с переработкой бета-амилоида, своего рода белкового мусора, который не выводится должным образом и накапливается в клетках мозга, подобно грязи в засорившейся раковине (очень похоже на болезнь Гоше, описанную в прошлой главе, но накопление идет именно в нервных клетках, а не в печени, селезенке или костном мозге). Мутации в этих генах приводят к увеличению вероятности развития заболевания в течение жизни до 90 % и даже более.
Лидия хорошо помнила, как ее отец стал терять память, например забывал взять свой бумажник. Через какое-то время он перестал справляться со своими обязанностями государственного служащего в Нью-Джерси. Он показался неврологу и прошел ряд тестов. Лидия говорит, что после того, как отцу поставили диагноз «болезнь Альцгеймера», он постепенно превратился в «бледное подобие себя» всего за несколько лет. Вначале ее мать ушла с работы и целыми днями ухаживала за мужем. Позже его поместили в санаторий, поскольку он становился все более и более раздражительным и рассеянным. К несчастью, в этот напряженный период у матери Лидии развился рак яичников, из-за которого она в итоге умерла.
Затем Лидия упомянула своего дядю Мартина с отцовской стороны, которому диагностировали болезнь Альцгеймера незадолго до того, как ему исполнилось 60 лет, и он умер от нее несколько лет назад. Поскольку ее дядя был женат на женщине из Аризоны, то он переехал в этот штат, и Лидия не знала подробностей его жизни, но была уверена насчет диагноза.
Сведения об остальных – дедушках, прадедушках, кузенах и других членах семьи – были обрывочные. У Лидии был брат, но они не общались. Небольшая семья не позволяет собрать адекватный семейный анамнез, но это то, с чем нам приходится работать. Несмотря на недостающие детали в семейной истории, то, что я услышал, меня встревожило. Такое положение дел указывало на наследственную форму ранней болезни Альцгеймера.
Был еще один настораживающий факт: ее фамилия – немецкого происхождения, однако родственники со стороны отца приехали в США из Центральной России. Это напомнило мне кое-что. Наследственная форма болезни Альцгеймера распространена среди поволжских немцев. Эта замкнутая этническая группа образовалась в XVIII в. из-за того, что Екатерина II поощряла иммиграцию. Культура немцев отличалась от окружающих их славянских народов, и, возможно, поэтому они были склонны к внутригрупповым бракам, образуя так называемый генетический остров. Как я уже писал раньше, это понятие отражает ситуацию, когда люди вступают в браки внутри своей группы чаще, чем с представителями других групп, как правило из-за требований культуры. Болезнь Альцгеймера так легко распространяется, поскольку поражает взрослых, и ее симптомы проявляются, когда у человека уже есть дети. Поэтому такие поздно проявляющиеся мутации, как та, что вызывает наследственную форму болезни Альцгеймера, могли передаваться через многие поколения поволжских немцев, и из-за эффекта основателя определенные изменения в последовательности ДНК оказались широко распространены в этой этнической группе. Таким образом, происхождение Лидии повышало риск того, что ее семья несет одну из мутаций, отвечающих за развитие наследственной болезни Альцгеймера, и это усилило мое беспокойство.
Я спросил: «Вы можете получить копии медицинской карты вашего отца и дяди?»
«Могу, если вы считаете, что это важно». Она сделала паузу. «А что насчет карты моей матери? Так вы не думаете, что у меня будет рак яичников?»
«В том, что я услышал, нет никаких показаний для генетического тестирования на наследственную форму рака груди и яичников. Мы можем сделать этот анализ, но, скорее всего, страховая компания откажется его оплачивать».
«Ох, спасибо. Это отличное известие», – сказала Лидия. Затем помолчала. Она описывала себя как практичного человека, который любит принимать меры заранее. Лидия хотела знать, может ли она что-нибудь сделать, чтобы снизить вероятность развития у нее рака. Я порекомендовал регулярные физические упражнения, здоровое питание, сбросить вес и полностью бросить курить (это я советую всем, независимо от того, нужен ли им генетический анализ или нет).
После короткого раздумья я сказал: «И все-таки я хочу, чтобы Конни, которая работает генетическим консультантом вместе со мной, позвонила вам и помогла собрать больше информации и медицинских документов о вашей семье».
Я продолжал: «Я на самом деле беспокоюсь из-за того, что вы рассказали о своем отце и дяде, у которых была болезнь Альцгеймера. Я бы хотел, чтобы Конни поговорила с вами и нашла их медицинские карты. Если, проверив медицинские записи, мы убедимся, что у вашего отца и дяди действительно была болезнь Альцгеймера, то я бы направил вас к неврологу для тщательного обследования. После этого мы можем поговорить про анализ или исследование генов, нарушение которых повышает риск болезни Альцгеймера».
Застигнутая врасплох, Лидия ответила не сразу. «Когда я звонила вам, то не думала про это. Я почти ничего не знаю об анализе на болезнь Альцгеймера. Сколько это будет стоить?» Сейчас казалось, что цена ее волнует больше, чем когда речь шла о раке. «Это будет анализ крови, или… э… анализ мозга? Анализ мозга звучит неприятно».
Я заверил ее, что «это будет только анализ крови. Мы поговорим с вашей страховой компанией, оплатит она анализ или нет. Однако есть и другие вопросы, которые я хотел бы обсудить лично, и поэтому приглашаю вас к себе на прием».
Лидия опять задумалась. «Ну, я могу понять, как хирургическая операция может помочь в чем-то вроде рака груди и яичников, но мозг же отличается? Что вы сможете сделать с болезнью Альцгеймера? Есть ли какие-то лекарства, предотвращающие ее?»
«Нет, никакого лечения не существует. Есть несколько исследований, в которых показано, что регулярные тренировки, здоровое питание, поддержание нормального веса и отказ от курения могут помочь».
«Но вы же уже мне говорили, что надо это делать, – ответила Лидия. – Упражняться больше, питаться здоровой пищей. Я знаю, что мне следует бросить курить в любом случае, и сейчас у меня есть для этого веская причина. Но если нет средства, способного остановить надвигающееся слабоумие, такое, как у моего отца, и у меня обнаружится этот ген, я просто буду все время переживать и тревожиться». Она помолчала. «Итак, зачем этот тест, если вы все равно ничем не сможете помочь?»
«Ну, некоторые люди предпочитают знать, чтобы спланировать свою дальнейшую жизнь соответствующим образом. Возможно, они хотят сменить работу, или сосредоточиться на том, что для них действительно важно, или же использовать полученную информацию, чтобы проследить, что их дети не унаследуют эту мутацию».
«Вы можете с помощью такого теста предотвратить появление детей с этой мутацией?» Теперь она была заинтригована. «Я ведь несколько лет назад, когда была моложе, заморозила свои яйцеклетки, чтобы сберечь их, если я решу завести детей в более позднем возрасте{6}. Но я не планирую заводить детей прямо сейчас. Ну, мне уже пора. Спасибо, доктор, что уделили время. Дайте мне подумать на эту тему, и я обращусь к вам и Конни».
Итак, один и тот же человек, Лидия, была готова сделать генетическое тестирование для определения риска развития рака яичников и что-то предпринять, если понадобится, но у нее было гораздо меньше желания делать анализ на неизлечимую раннюю форму болезни Альцгеймера, для которой нет четкой программы действий, если анализ даст положительный результат. Надо добавить, что по сегодняшний день Лидия так и не сделала этот генетический анализ, по крайней мере в моей клинике.
В научной литературе обсуждается, не будут ли генетические анализы на неизлечимые заболевания, такие как болезнь Альцгеймера, способствовать появлению депрессии, повышенной тревожности и других расстройств, в первую очередь склонности к самоубийству. Несколько лет назад в хорошо продуманном статистическом клиническом исследовании было показано, что среди людей без симптомов болезни Альцгеймера, но имеющих больных родителей, тех, кто прошел генетическое тестирование на выявление APOE e4 и узнал свои результаты, тревожность, депрессия и другие расстройства были выражены не сильнее, чем у тех, кто не проходил тестирования{7}. При этом неудивительно, что среди получивших положительные результаты анализа уровень тревожности был выше, чем среди получивших отрицательные.
Любое клиническое исследование имеет определенные ограничения. В этой работе исключили участников (по понятным этическим причинам), которые перед проведением тестирования признались, что могут покончить жизнь самоубийством, если результат анализа на ген APOE e4 будет положительным. Таким обзором, те самые люди, которые наиболее чувствительны к худшим результатам генетического анализа, были исключены из исследования, что затрудняет перенос его результатов на сотни тысяч других пациентов. Дина Дэвис, специалист по этике из Лихайского университета в Пенсильвании, в 2013 г. подняла связанный с этой темой очень неоднозначный вопрос, можно ли рассматривать самоубийство как действенную превентивную стратегию для людей, имеющих мутацию генов, связанную с высоким риском развития болезни Альцгеймера или других форм деменции{8}. Спорящее об эвтаназии медицинское сообщество никогда раньше не обсуждало эту тему в таком тревожном и непростом ракурсе.
Отчасти подход к решению некоторых трудных проблем, возникающих при проведении анализа на раннюю форму болезни Альцгеймера, вырос из медицинского опыта тестирования на болезнь Хантингтона. Для болезни Хантингтона характерно тяжелое прогрессирующее ухудшение физических и психических функций, которое, как правило, начинается в первой половине жизни, с 35–45 лет. Это заболевание всегда поражает своих жертв так рано.
В 1983 г. ученые объявили, что им удалось определить местоположение мутации, вызывающей болезнь Хантингтона, – на коротком плече четвертой хромосомы человека. После 10 лет интенсивных исследований в 1993 г. был выявлен конкретный ген. Директор Национального института неврологических расстройств и инсульта (одного из подразделений Национальных институтов здравоохранения США) назвал это «бриллиантом в короне недавних неврологических открытий»{9}.
Первые анализы на мутацию, вызывающую болезнь Хантингтона, начали делать еще до того, как определили местоположение этого гена. Исследователи из Массачусетской больницы, больницы Джона Хопкинса и их коллеги из разных стран (вплоть до Венесуэлы) определяли и затем отслеживали маркеры этого гена в разных семьях; таким образом, в 1986 г. был создан тест, работавший с 95 % точностью. По мере открытия новых генетических маркеров и подключения к работе большего числа исследовательских центров точность анализа несколько повысилась.
В последующие годы тестирование набирало обороты, у международного сообщества сформировалось представление о том, как проводить анализ и связанную с ним генетическую консультацию. В итоге появилось руководство, разработанное Всемирной федерацией по неврологии и Международной ассоциацией по болезни Хантингтона. В руководстве описан комплексный подход к консультированию пациентов. Этот процесс начинается задолго до проведения анализов, и в нем участвуют разные специалисты – от медицинских генетиков и генетических консультантов до неврологов, психологов и социальных работников.
Рекомендуется начинать работу с беседы, которую можно провести по телефону. Затем три визита к врачам: генетическая консультация, неврологическое и психологическое обследование. Если человек решит делать анализ, то его результаты объявляют при четвертой встрече, и, кроме того, в последующие два года пациент приходит на прием еще несколько раз{10}.
Канадское исследование 1990-х гг. показало, что предположение о повышенной вероятности случаев самоубийства у людей, которые находятся в группе риска по болезни Хантингтона, но пока без выраженных симптомов заболевания, неверно. К тому времени генетический анализ на мутацию, связанную с болезнью Хантингтона, сделали более 4500 человек из 21 страны, среди них 5 покончили жизнь самоубийством и 21 совершили такую попытку. Из этих 5 человек у двоих в это время уже были клинические признаки болезни. Для сравнения: уровень самоубийств среди тех, у кого появились симптомы болезни Хантингтона, и так почти в 10 раз выше, чем в среднем в США, отчасти потому, что это заболевание само по себе может вызывать депрессию{11}.
Лидия не стала делать анализ по поводу ранней наследственной формы болезни Альцгеймера, и среди тех, кому был рекомендован генетический анализ на болезнь Хантингтона, его делают очень немногие (примерно 15 %){12}. В то же время проверку на мутации, вызывающие рак, проходят до 95 % людей из группы риска. Очень похоже, что такая низкая частота анализов на болезнь Хантингтона во многом обусловлена страхом перед неизлечимостью этого заболевания, в то время как с раком можно что-то сделать, если провести генетический анализ на ранних стадиях болезни или даже до ее появления (такие анализы делают, например, для удаления рака груди или ободочной и толстой кишки). Хотя каждое генетическое заболевание имеет свои особенности и нюансы, по-видимому, для наследственной болезни Альцгеймера ситуация аналогична. Предположительно, частота генетических анализов на такие заболевания значительно вырастет, если появятся эффективные способы предотвращения развития болезни. Сейчас эти анализы делают люди, которые стремятся максимально контролировать и планировать свою жизнь.
Гиппократ – один из самых известных врачей в истории. Он жил в Древней Греции в эпоху Перикла, но продолжает оказывать сильное влияние и на сегодняшнюю медицину. Врачи произносят современную версию клятвы Гиппократа. И хотя они пропускают обращение к античным богам Аполлону и Гигиее, этические требования, изложенные в этой клятве, актуальны и в современной медицине, спустя почти 3000 лет. Основной этический принцип, которому должна соответствовать любая медицинская, фармакологическая, хирургическая или диагностическая процедура (в том числе и генетические тесты), заключается в том, что преимущества процедуры должны перевешивать ее риски. Когда врачи обсуждают любые действия с пациентом, они всегда должны помнить про это правило. В случае неизлечимых заболеваний есть много мнений, но мало данных о том, как можно оценить риски и преимущества генетического тестирования. Очевидно, лучший способ решить проблему – разработать эффективную терапию и способы предотвращения этих болезней. Пока этого не произошло, интерес к генетическому выявлению неизлечимых заболеваний будут проявлять те люди, кому интересно это знание само по себе, кто хочет спланировать свою жизнь соответствующим образом, а также те, кто не хочет передать эти мутации своим детям. В ближайшее время мы вряд ли придем к единому мнению о необходимости генетического анализа на неизлечимые заболевания для людей, у которых нет ни симптомов, ни серьезного семейного анамнеза.
Глава 3 Высотная болезнь
Параганглиома отличное слово, если вы с семьей, сидя за столом, играете в скрэббл, потому что в этом слове целых 13 букв и за некоторые можно получить даже два или три очка. Но это отнюдь не выигрышное слово, если вы узнали его в связи с тем, что у кого-то в вашей семье рак.
Параганглиомы образуются из клеток нервной системы, которые примостились на крупных кровеносных сосудах, сбегающих вдоль средней линии тела вниз от места соединения головы с шеей до ягодиц. Эти клетки похожи на часовых в сторожевой башне, которые должны обнаруживать кислород. Если клетки не чувствуют кислород, они выделяют в кровь химические вещества для ускорения сердцебиения и дыхания, чтобы увеличить приток крови, повысить давление и, соответственно, снабжение тканей кислородом. Это элемент стратегии «бей или беги»{13}. Когда множество таких клеток собирается вместе, образуя параганглиому, их общий химический сигнал усиливается, и возникает учащенное сердцебиение, потливость, панические атаки, а в худшем случае даже сердечные приступы. Страшнее всего, что параганглиомные группы клеток могут превращаться в раковые, отрываться и бесконтрольно распространяться по организму, образуя разрушительные метастазы.
Параганглиомы очень редко бывают у человека. Они встречаются у коров, свиней и даже африканских слонов. Кислород нужен всем животным. Поскольку у нас, Homo sapiens, и у них одни и те же основные физиологические механизмы, обусловленные схожими генами, то, как правило, у разных видов встречаются схожие генетические заболевания.
Розалинд Темасек выросла в Скалистых горах в семье, где было восемь детей. Ее здоровью в детстве можно было только позавидовать. Образованная, в хорошей физической форме, после колледжа она отправилась в восточную часть страны, в Нью-Йорк, за теми широкими профессиональными возможностями, которые открываются при работе в крупнейших мировых компаниях, обосновавшихся среди небоскребов Манхэттена. Здесь она вышла замуж и ловко управлялась со всем множеством обязанностей, которые сваливаются на городскую семью, где оба супруга заняты карьерой.
Отправиться к врачу – это, пожалуй, совсем не то, чего хотелось бы занятому человеку, а тем более работающей матери в прекрасный осенний день в Нью-Йорке. Однако Розалинд приехала через весь город, чтобы рассказать мне о своем случае. Ей было за 30. Высокая, уверенная в себе, хорошо одетая в деловом стиле, Розалинд была на третьем месяце беременности. И у нее возникли вопросы.
У мамы Розалинд было два двоюродных брата. И у обоих после 30 развилась параганглиома. Поскольку этот диагноз со сложно произносимым названием весьма необычен, очень неожиданным было такое совпадение внутри одной семьи. И действительно, в США ежегодно регистрируется менее 500 случаев этой формы рака, поэтому вероятность, что она случайно возникнет у двух родственников одного возраста, живущих неподалеку друг от друга, примерно такая же, как вероятность встретить сразу двух знаменитостей, случайно прогуливающихся в одном и том же районе в одно и то же время.
Из-за столь необычного совпадения семейный врач порекомендовал проконсультироваться со специалистом по медицинской генетике. Примерно от четверти до половины случаев параганглиомы связано с генетическими нарушениями. Во всей стране менее 2000 врачей, занимающихся медицинской генетикой (причем ординатура в этой области заполнена только наполовину, а значит, в дальнейшем ситуация может стать еще хуже), причем специалисты распределены неравномерно и работают преимущественно в крупных городах. Поэтому удачно сложилось, что, хотя первые члены семьи, у которых обнаружилась параганглиома, жили вдалеке от крупных городов, их врачи знали про роль наследственности в развитии этого заболевания и порекомендовали родственникам сделать генетический анализ.
Хотя это очень редкая опухоль, существует как минимум девять генов (а скорее всего, их больше), мутация в которых приводит к развитию параганглиомы и родственного ей чуть более редкого заболевания – феохромоцитомы. Эти гены активны в первые несколько месяцев беременности, когда в нервном гребне эмбриона образуются стволовые клетки, из которых разовьется мозг и нервная система. По мере развития плода некоторые из этих стволовых клеток мигрируют из нервного гребня, чтобы помочь мозгу регулировать давление крови. Клетки, из которых потом разовьются параганглии, карабкаются, перескакивают и огибают артерии и вены, в то время как родственные им хромаффинные клетки мигрируют к верхней части почек, и там из них формируются надпочечники (название надпочечников происходит от лат. ad renal – «на почках»). При опасности надпочечники могут быстро выделять в кровяное русло вещества, которые называются катехоламины[6] и помогают запустить реакцию «бей или беги». Феохромоцитому иногда называют параганглиомой надпочечников. Если вы смотрите в микроскоп при большом увеличении, клетки феохромоцитомы и параганглиомы почти невозможно отличить друг от друга, но вы легко различите их, если видите окружающую ткань.
Непонятно, почему мутации в таком большом количестве генов вызывают столь редкую форму рака, может быть, это связано с тем, что в клетках нервной системы обычно экспрессируется (то есть с них производится синтез РНК и белков) больше генов, чем в клетках других органов. Там, где больше активных частей, может быть больше поломок.
Некоторые другие гены, связанные с семейной параганглиомой, ведут себя необычно: они вызывают заболевание только в том случае, если были получены от отца. Так получается потому, что эти гены обладают нетипичным свойством: за счет механизма, который называется геномный импринтинг, экспрессия происходит только с отцовской копии гена.
У большинства генов «включаются» и производят РНК, а затем белок, обе копии, и отцовская и материнская одновременно. Однако существует чуть меньше 2000 генов, у которых синтез РНК и белка происходит только с копии, полученной от одного из родителей, эти гены называют импринтированными. В некоторых случаях работает только отцовская копия гена, а в других – только материнская.
Геномный импринтинг был впервые описан в начале 1980-х гг., когда проводились эксперименты по пересадке мужского или женского ядра в одноклеточном эмбрионе, так что в итоге получался полный набор хромосом. Выяснилось, что для нормального развития плода и рождения затем здорового ребенка нужно, чтобы генетический материал был и от матери, и от отца. Хотя некоторые, возможно, считают себя совершенством, мы не можем воспроизводить себя сами, чтобы появился ребенок, нам нужен партнер. В процессе импринтинга на одну из копий гена в качестве химической метки вешается метильная группа, таким образом обозначается, какой ген от папы, а какой – от мамы, и влияние каждого четко ограничивается и должным образом контролируется.
В этом есть некоторое родительское «соперничество». Считается, что импринтинг нужен для генов, которые играют важную роль в стимуляции деления клеток во время беременности и, возможно, для тех генов, которые связаны с поддержанием уровня кислорода в матке, где, вероятно, и происходит главная борьба между полами с эволюционной точки зрения. Предполагается, что у отца и матери неодинаковый вклад в потомство и поэтому они заинтересованы в активности разных генов у ребенка. Таким образом, у трех генов, повышающих риск развития параганглиомы (c трудно произносимыми именами SDHD, SDHAF2, а также ген MAX, это название может показаться забавным некоторым родителям сыновей), за счет импринтинга выключены копии, полученные от матери. Поскольку у этой тройки генов работают только отцовские копии, мутации в них приводят к развитию параганглиомы, только если получены с отцовской стороны.
У родственников Розалинд взяли кровь, провели ДНК-анализ, и через несколько месяцев им сообщили, что у них одинаковая мутация в гене, связанном с семейной формой параганглиомы. Как и предполагалось на основе семейного анамнеза, это был не импринтированный ген, а такой, который вызывал заболевание независимо от пола. Это был ген сукцинатдегидрогеназы В (SDHB).
В общей сложности более десяти человек из этой семьи сделали анализ. В их числе была и мать Розалинд, которая с изумлением узнала, что у нее та же мутация, хотя за более чем 50 лет жизни у нее никогда не было каких-либо явных проблем со здоровьем. Однако у ее двоюродного брата Мартина, у которого тоже была эта мутация, после 20 лет начали появляться симптомы: учащенное сердцебиение, головные боли и приступы тревожности. Оказалось, что это было вызвано ни одной, ни двумя, а целыми тремя ранее не выявленными параганглиомами, образовавшимися вокруг верхней части почек. Большинство параганглиом доброкачественны, они не способны образовывать метастазы в других частях тела, проникать в органы и создавать проблемы. Поэтому в данном случае, несмотря на то что неприятности могли бы возникнуть, вопреки опасениям, все три опухоли удалось успешно удалить, и Мартина вылечили.
По иронии судьбы эти приступы, которые были достаточно неприятными, возможно, спасли Мартину жизнь, поскольку привлекли внимание к опухолям. Если бы опухоли «молчали» и не давали таких тревожных симптомов, то они остались бы незамеченными, пока не накопились дальнейшие мутации и не появились бы метастазы. Эта проблема особенно актуальна для гена SDHB, поскольку среди остальных девяти именно он чаще всего вызывает образование перемещающихся опухолей, которые распространяются по организму. Если такое происходит, с опухолями становится крайне сложно бороться. Одна женщина, консультант-генетик, рассказала мне мнемоническое правило, которое она использует, чтобы запомнить последнюю часть названия генов, вызывающих развитие параганглиомы: в названии SDHB у нее буква B означала «будет плохо»[7].
Мы пока не знаем, как влияют гены и окружающая среда, почему у одного человека заболевание возникает, а у другого с точно такой же мутацией – нет. По-видимому, в процессе задействованы митохондрии. Митохондрии – это клеточные «машины», которые потребляют кислород и используют его для получения энергии, необходимой для работы организма, например когда нужно убежать от хищника. Если в одной из двух копий гена SDHB имеется мутация, время от времени в работе митохондриальных «машин» происходят сбои. Это приводит к образованию свободных радикалов, которые, выйдя из митохондрии, могут повреждать ДНК, вызывая мутации.
Кроме того, SDHB помогает расщеплять вещество, которое называется сукцинат. В целом сукцинат обычно накапливается, когда клетка недополучает кислород. Когда сукцината много, клеткам кажется, что они задыхаются. Накопившийся сукцинат прикрепляется к определенным белкам, изменяя их форму. Подобно центральному бейсбольному игроку, надевшему теплую куртку при выходе на поле в жаркий день, белок, облепленный сукцинатами, просто не сможет хорошо выполнять свою работу. Молекулы с прицепившимся сукцинатом липкие и пухлые, и, когда они сталкиваются с другими белками, запускается процесс, подобный падению костяшек домино.
Это приводит к своеобразной внутриклеточной панике, которая называется «клеточный стресс». Организм получает сигнал, что нужно больше клеток, отслеживающих содержание кислорода. Клетки, находящиеся в стрессе, начинают делиться и вырабатывать катехоламины, передающие химический сигнал о том, что нужно больше кислорода. Хотя одна и та же мутация имеется во всех клетках тела, но у параганглионарных клеток для определения содержания кислорода в митохондриях используются белки, к которым особенно хорошо приклеивается сукцинат, поэтому среди всех работающих клеток эти страдают особенно сильно.
Существует гипотеза, что проживание высоко над уровнем моря в условиях пониженного содержания кислорода может повышать риск развития параганглиомы. Может быть, тот факт, что родственники Розалинд выросли в разреженном воздухе на западе Скалистых гор, и эта мутация не просто совпадение. И действительно, в недавних исследованиях показано, что параганглиомы по меньшей мере в пять раз чаще встречаются у людей, живущих на больших высотах, и, предположительно, то же характерно для свиней, коров и слонов, обитающих на горных плато. Но такие параганглиомы часто остаются незамеченными, потому что редко вырастают до размера, при котором возникают явные медицинские проблемы.
Я думаю, что любой человек может представить себе, как высота над уровнем моря и чистота воздуха, которым мы дышим, может повлиять на ход различных заболеваний. В прошлом, вероятно, наиболее известный пример – использование горных санаториев для больных туберкулезом, когда еще не было эффективных антибиотиков для лечения этого заболевания. В романе «Волшебная гора» немецкого писателя Томаса Манна (его жена вылечилась от туберкулеза в Швейцарских Альпах в санатории Waldsanatorium в Давосе, расположенном на высоте 1,5 км), в операх Джакомо Пуччини «Богема» и «Тоска» и в других произведениях, созданных в эпоху, предшествующую появлению медицинской химии, туберкулез называется чахоткой.
Классическим признаком чахотки был кашель с кровью. Кашель способствовал распространению заболевания. Туберкулезная палочка (Mycobacterium tuberculosis) обычно передавалась от человека к человеку в крошечных капельках жидкости, вылетающих из легких в воздух. При отсутствии современных химических и генетических методов для лечения этого заболевания в период до Первой мировой войны врачи рекомендовали так называемое «лечение сменой обстановки». Это означало, что больным чахоткой надо пожить в горах, где чистый разреженный воздух и где с их заболеванием будут бороться с помощью того, что современники иронически называли «хорошим уходом за пациентом». В те времена существовали сотни санаториев в горах Европы и на западе Америки. Город Колорадо-Спрингс, расположенный недалеко от того места, где жили родственники Розалинд, был построен на волне массового появления санаториев на рубеже веков. Торговая палата города рекламировала его как «крупнейший американский санаторий», здесь предлагался широкий выбор условий – от проживания чуть ли не в палаточных городках до роскошного пристанища для богачей со всеми благами цивилизации, как на круизном лайнере, и даже с изданием собственного литературного журнала. За несколько десятилетий лечение туберкулеза стало основным градообразующим фактором, тысячи местных жителей обслуживали санатории.
Почему бактерии, вызывающие туберкулез, медленнее растут в горах – не вполне понятно. Этим бактериям нужен кислород, и они растут чуть медленнее на больших высотах и, соответственно, подрывают здоровье своего хозяина чуть меньше в условиях высокогорного разреженного воздуха. Другие возможные причины – сниженное количество кислорода влияет на pH в легких (меняется кислотность среды) или на высоте, где воздух более разрежен, кожа получает больше ультрафиолета. По-видимому, некоторым пациентам, чтобы выжить, просто нужно было уехать из толчеи промышленных городов с загрязненным воздухом. Кроме того, может быть, эти вылечившиеся пациенты были просто теми 30 %, которые, по современным оценкам, выживают без лечения антибиотиками{14}.
Вполне вероятно, что лечение было вообще неэффективно. Одним из его побочных эффектов оказалась высотная болезнь. В те времена, когда автомобили и самолеты еще не стали доступным средством передвижения, долгий путь в санаторий, а затем высотная болезнь, вероятно, способствовали отбору наиболее здоровых пациентов. После открытия противотуберкулезных антибиотиков, которые были значительно эффективнее, высокогорное лечение с помощью хорошего ухода стало в значительной степени неактуальным, и санатории закрылись или были перестроены в дома отдыха.
Поскольку жизнь в высокогорном районе могла ухудшить состояние Розалинд, я оказался в необычной ситуации и сказал ей, что, несмотря на выхлопные газы, табачный дым и промышленное загрязнение воздуха, весьма вероятно, что переезд в Нью-Йорк, который расположен на уровне моря, полезен для ее здоровья (при условии, что она не выходит на проезжую часть, когда там носятся лихачи-таксисты). Кроме того, тем, у кого есть мутантный ген семейной параганглиомы, настоятельно не рекомендуется курить. Курение табака или электронных сигарет не только снижает содержание кислорода в легких, но и заставляет рецепторы мозга приспособиться к более низкому уровню кислорода. Разумеется, важно также избегать пассивного курения (к счастью для нее и других, курение в ресторанах и магазинах Нью-Йорка теперь запрещено законом).
Лучшее нападение – это защита. Чтобы Розалинд могла вести прежний образ жизни и оставаться успешной работающей матерью, ей нужно стараться избегать стрессов, при которых может учащаться сердцебиение, выделяться пот, возникать паника и т. д., то есть появляются все те симптомы, которые мучили ее двоюродного брата. Конечно, это сложно, поскольку у каждого из нас иногда случаются такого рода приступы, например когда вам одновременно звонят начальник и детская няня, а вы в это время пытаетесь маневрировать в плотном транспортном потоке. Но если панические приступы возникают спонтанно, без каких-либо провоцирующих факторов, надо провести обследование, чтобы проверить, не повышен ли уровень веществ, выделяемых параганглионарными клетками.
У другой пациентки, Терри, после 30 лет появились приступы, которые начинались с довольно слабых проявлений, но за последующие два с половиной года быстро прогрессировали. Даже когда она занималась самыми обычными делами, например пылесосила в гостиной, периодически на нее накатывало волнение, так что все ее тело становилось напряженным и зажатым. Ее руки начинали дрожать, как у пожилой женщины. Сердце ускорялось, и каждый его удар отдавался в висках. Она начинала задыхаться, лицо бледнело, она была на грани обморока. Чтобы облегчить свое состояние, она бегала трусцой, ездила на велосипеде или занималась на беговой дорожке.
В этом случае упражнения оказались полезными для ее здоровья весьма неожиданным и непрямым способом. От бега на асфальте у Терри появилась боль в правом тазобедренном суставе – это частая проблема у тех, кто занимается бегом в Манхэттене. Она вынуждена была обратиться к услугам спортивной медицины и сделать МРТ больного сустава. В углу снимка внимательный рентгенолог из нашей больницы случайно заметил светло-серое пятно на верхней части правой почки. Это пятно оказалось близким родственником параганглиомы – феохромоцитомой. Терри была убеждена, что ее приступы были чистой психосоматикой, стандартным последствием современной городской семейной жизни в наше тревожное время. Многие люди, не подозревающие о наличии у себя подобных опухолей, чувствуют себя неловко, потому что им говорят, что все проблемы у них в голове.
С одной стороны, феохромоцитома – это не повод для радости, но, с другой стороны, Терри испытала облегчение, узнав, что ее приступы имеют определенную физиологическую причину и, кроме того, болезнь поддается лечению. Она вспоминает, что, проснувшись после операции, впервые за многие годы почувствовала облегчение и возможность отдохнуть. С тех пор у Терри все хорошо, новые опухоли у нее не появляются.
Пациентам, у которых была параганглиома или феохромоцитома, мы рекомендуем в дальнейшем регулярно обследоваться, чтобы не пропустить новую параганглиому на ранней стадии, еще до появления симптомов. Для них мы проводим ежегодный осмотр и МРТ, чтобы заметить подозрительные комочки и вздутия, так же, как мы это делаем для некоторых пациентов с наследственной формой рака молочной железы. С помощью МРТ мы осматриваем все тело, кроме головы, рук и ног.
Розалинд узнала, что у нее мутация SDHB, когда была на 20-й неделе беременности. Имея хорошее образование и сложную работу в области корпоративных финансов, она поняла, что с помощью новейших технологий репродуктивной генетики можно оценить риск появления семейной параганглиомы у будущего ребенка. На сегодняшний день мы можем проверить наличие этой мутации у плода, просто взяв кровь у матери, и нам не нужно вводить длинную иглу в матку или проводить другие инвазивные процедуры.
Для тех, кто хочет завести детей, существует целый ряд вспомогательных репродуктивных технологий (ВРТ), которые помогают все большему числу семей, и в том числе семьям, в которых есть какая-нибудь из 3000 или 4000 мутаций, связанных с развитием заболеваний.
Метод основан на потрясающей возможности соединить в чашке Петри сперматозоиды с яйцеклетками, погруженными в специальную жидкую среду. ВРТ возникли во времена технологической революции 1960–1970-х гг., когда появилась возможность выращивать клетки человека вне организма. При использовании этого метода сперму смешивают с яйцеклетками и помещают чашку Петри в инкубатор, где поддерживается температура и необходимый уровень кислорода, чтобы условия были такими же, как в матке. На следующий день проверяют, произошло ли оплодотворение. Если ядро клетки разделилось, такая клетка теперь называется зиготой, и из нее будет развиваться плод. Клетки продолжают делиться. Через пять-шесть дней после искусственного оплодотворения получается полый шарик из сотен клеток. На одной его стороне – клетки, которые потом станут плодом, а на другой – клетки, из которых сформируется плацента, через нее эмбрион будет питаться, пока не родится.
Первый ребенок, зачатый с помощью искусственного оплодотворения, родился более 30 лет назад, в 1978 г. С тех пор во всем мире более 4 млн здоровых и успешно завершившихся беременностей начинались с оплодотворения in vitro (в пробирке). Предполагали, что к 2000 г. детей «из пробирки» будет больше, чем детей, зачатых естественным, «традиционным» способом, и ВРТ заменит собою секс, но такие прогнозы оказались слишком оптимистичными, ну или пессимистичными, в зависимости от того, с какой стороны посмотреть. Однако как минимум один выдающийся генетик, Ли Сильвер из Принстонского университета, публично сказал, что «в будущем люди не станут использовать секс для размножения. Это [при наличии пренатального[8] генетического тестирования] станет слишком опасным»{15}.
Сейчас в США и Европе около 2 % детей рождается с помощью ВРТ. Первоначально были сомнения, не повысится ли количество осложнений при беременности и нет ли каких-то долгосрочных последствий для таких детей. И действительно, в некоторых ранних исследованиях была показана связь ВРТ с медицинскими проблемами у детей. В большинстве этих исследований участвовало относительно небольшое количество детей. Не так давно, около 10 лет назад, появились статьи, где было высказано предположение, что такие технологии в принципе могли бы способствовать возникновению проблем, связанных с геномным импринтингом у плода (который был описан ранее в этой главе). При искусственном оплодотворении в хромосомах обоих родителей могла бы запускаться экспрессия генов, связанных с ростом, а это приводит к детскому раку и разным формам гипертрофии.
В большинстве медицинских статей, где авторы описывают результаты исследований, в конце имеется фраза: «Необходимы дополнительные исследования, чтобы подтвердить эти результаты на большей выборке». К сожалению, популярные СМИ, например телевидение, хватаются за эти предварительные исследования, подавая их результаты как установленный факт, хотя это действительно всего лишь предварительные данные. Статистический анализ научных и медицинских данных неизбежно выдает предварительные результаты, полученные в ходе небольших исследований, которые затем могут и не подтвердиться для более крупных и разнообразных групп людей (это так называемые ложноположительные результаты). Первоначальные небольшие исследования нужны, поскольку играют роль канареек в угольной шахте, гарантируя, что если проблемы имеются (истинноположительные результаты), то они будут быстро обнаружены.
По законам статистики, практически невозможно избежать получения ложноположительных результатов на ранних исследованиях с маленьким объемом выборки. Внутри сообщества мы могли бы договориться о критериях так, чтобы получалось меньше ложноположительных результатов, но тогда мы рискуем пропустить истинноположительные. Появление ложноположительных результатов в небольших медицинских исследованиях – неизбежное зло. И это одна из причин, почему правительственным организациям вроде Управления по санитарному надзору за качеством пищевых продуктов и медикаментов часто приходится вмешиваться, чтобы помочь оценить все имеющиеся доказательства (или их отсутствие) и решить, нужно ли как-то регулировать эту область, например запретить какие-то процедуры или лекарственные средства.
Теперь, когда на протяжении уже нескольких десятков лет рождаются дети, зачатые с помощью ВРТ, накопилась более надежная статистика. На больших выборках не обнаружилось доказательств того, что ВРТ связаны с повышенным уровнем заболеваний, обусловленных нарушением геномного импринтинга. Однако что касается более долгосрочных последствий, таких как рак у взрослых, диабет, аутоиммунные или какие-то другие заболевания, в том числе и более редкие, то здесь, чтобы увидеть результат, придется еще подождать.
При высоком риске генетического заболевания эмбрион можно обследовать с помощью методики, которая называется преимплантационное генетическое тестирование (ПГТ). Для этого используется «вспомогательный хетчинг»: специалист с помощью лазера, химических веществ или даже очень тонкой стеклянной иглы может проколоть наружную оболочку эмбриона, полученного с помощью искусственного оплодотворения. Затем из тех клеток, которые в будущем должны образовать плаценту, через полученное отверстие можно аккуратно забрать до двух-трех и провести секвенирование генетического материала, чтобы найти определенные мутации. После такой процедуры эмбрионы обычно выживают, но из них с большей вероятностью могут развиться однояйцовые близнецы. Те эмбрионы, у которых с помощью генетических тестов обнаруживаются вредные мутации, не переносят в матку.
Поскольку любая технология несовершенна, при современных методах ПГТ вероятность пропустить рецессивное генетическое заболевание (когда обе копии гена повреждены мутацией и ни одной здоровой копии нет) примерно два из 100, а вероятность пропустить доминантное генетическое заболевание (когда достаточно одной копии гена с мутацией) примерно один из десяти[9].
В следующем десятилетии мы, вероятно, увидим преимплантационное генетическое тестирование нового поколения, когда фактически появится возможность у эмбриона, полученного с помощью ВРТ, «ремонтировать» гены, вызывающие генетическое заболевание. Недавно фундаментальная наука совершила мощный прорыв, и есть надежные доказательства того, что с помощью технологии CRISPR (произносится «криспер», а расшифровывается как «короткие палиндромные повторы, регулярно расположенные группами») можно исправить генетические дефекты у эмбрионов нескольких модельных видов и в том числе у нечеловекообразных обезьян. Это недорогая и удивительно эффективная технология редактирования генов, она достаточно проста, чтобы можно было использовать ее буквально в тысячах лабораториях по всему миру. Эта технология позволяет редактировать изменения в последовательности ДНК, помогая и при рецессивных, и при доминантных генетических заболеваниях. Сейчас можно получить эмбриональные стволовые клетки пациента, исправить их с помощью CRISPR, а потом размножить в лаборатории и использовать для того, чтобы сгладить проявление генетических заболеваний, от которых страдают трудно поддающиеся лечению нервная и сердечная ткани. Кроме того, можно будет вносить изменения в сперматозоиды и яйцеклетки, чтобы ослабить бремя генетических заболеваний у будущих поколений{16}.
CRISPR – это ген иммунной системы бактерий, которая защищает их от внедрения вирусов. Его называют также Cas9, и впервые он был описан в 1987 г. Поскольку его предназначение было не вполне понятно, первоначально считалось, что Cas9 – незначимый участок ДНК без какой-либо функции. Теперь мы знаем, что эти гены могут применяться для того, чтобы в прямом смысле редактировать гены человека и других видов. CRISPR умеет перерезать обе нити ДНК, его можно вводить в оплодотворенную яйцеклетку вместе с РНК-проводником, который может быть разным в зависимости от того, какие требуются изменения в геноме. Эту систему применяли для лечения мышей с генетическим заболеванием печени. Китайские ученые использовали CRISPR для внесения изменений в нормальные эмбрионы обезьян и получили животных с искусственными мутациями в трех разных генах, участвующих в работе иммунной системы и развитии диабета. У новорожденных обезьянок внесенные с помощью CRISPR изменения были обнаружены в большинстве, хотя и не во всех клетках, поскольку CRISPR-белок обычно не начинает свою работу, пока одноклеточный эмбрион не начнет делиться. И в результате секвенирования генома новорожденных обезьян не было обнаружено никаких нежелательных мутаций в других участках генома.
Впоследствии китайские генетики из Гуанчжоу опубликовали работу, в которой описывалось, как впервые с помощью CRISPR был отредактирован геном человеческих эмбрионов – ученые исправляли мутацию в бета-глобине, которая вызывает заболевание бета-талассемию. Однако в этом исследовании они работали исключительно с теми эмбрионами, которые уже предназначались для уничтожения, их нельзя было бы дорастить и выносить с помощью суррогатной матери. Как бы то ни было, в результате этого исследования выяснилось, что существующая сейчас CRISPR-технология не работает с человеческими эмбрионами так хорошо, как ожидалось. У многих эмбрионов CRISPR не исправил мутацию в бета-глобине. Но, что еще хуже, с помощью полногеномного секвенирования были обнаружены новые мутации, произошедшие в нецелевых участках, в том числе мутации в гене дельта-гемоглобина, у которого ДНК-последовательность схожа с бета-гемоглобином. В целом трудно предсказать, какими были бы последствия таких побочных мутаций, если бы эмбрионам позволили дальше развиваться.
Поскольку эта технология потенциально может стать мощным инструментом для редактирования генома, многие ученые, и в том числе создатели методики, выступили за введение полного запрета на ее применение на эмбрионах, пока врачи, ученые, правительство и общественность не определят все возможные риски.
Понятно, что многое еще предстоит сделать, тем не менее эта технология уже хорошо развита. Я ожидаю, что в ближайшие десять лет мы услышим о рождении детей, которым успешно отредактировали мутантные гены с помощью CRISPR (вероятно, сначала это будет происходить не в США). Как уже обсуждалось выше для ВРТ и ПГТ, в долгосрочном плане оценить последствия и безопасность редактирования генома с помощью CRISPR мы сумеем, вероятно, только через несколько десятилетий.
У матерей, которые проходят через искусственное оплодотворение и пренатальное тестирование, может возникнуть ряд проблем. Это инвазивная процедура: под контролем УЗИ производится аспирация яйцеклетки, чтобы потом оплодотворить ее in vitro. Хотя по сравнению с некоторыми другими медицинскими процедурами эта – довольно безобидная, психологически она может отпугнуть женщину, которая считает себя здоровой, а совсем не «пациенткой». Другой, более важный вопрос: что думают родители по поводу перспективы рождения более одного ребенка в случае успешной беременности? Поскольку в матку, как правило, переносится несколько оплодотворенных яйцеклеток[10] и из каждой может развиться ребенок, при ВРТ часто бывают многоплодные беременности, а у двух женщин даже родилось по восемь детей (восьмерняшки).
Кроме того, проблема, которая, видимо, не будет решена в США, – высокая стоимость процедуры. Несколько попыток использования ВТР запросто могут стоить десятки тысяч долларов. Некоторые расходы можно покрыть страховкой. Если преимплантационное генетическое тестирование производится в США, к этой сумме обычно добавляется от $3000 до $5000, при этом в медицинских центрах в Азии стоимость ниже.
Эти процедуры могут привести и к осложнениям. Примерно две из сотни попыток забеременеть с помощью ВРТ заканчиваются госпитализацией из-за синдрома гиперстимуляции яичников (СГЯ). Легкая форма СГЯ возникает примерно в четверти случаев применения ВРТ. Из-за гормонов, которые вводятся для стимуляции овуляции, яичники увеличиваются и возникает боль в животе, начинается общая воспалительная реакция с повышением количества лейкоцитов, вздутие живота, спазмы и тошнота. Тяжелый СГЯ возникает примерно в одном случае на каждую тысячу попыток использования ВРТ (а женщина, чтобы забеременеть, может предпринять пять, шесть и более попыток). Из-за повышенного уровня гормонов в печени вырабатываются белки фибриногены, которые могут вызывать образование мелких и крупных тромбов в разных частях тела. Иногда это приводит к катастрофическим последствиям. СГЯ может вызвать отказ почек и легких и в экстремальных случаях приводит к смерти матери и плода. Некоторые ученые и врачи считают, что использование высоких доз половых гормонов может повышать риск развития у матери рака молочной железы, матки и яичников, но все не так просто, поскольку определенные сочетания половых гормонов могут играть защитную роль, а другие, наоборот, усиливать риск. Кроме того, женские половые гормоны на самом деле могут снизить вероятность появления других злокачественных опухолей, таких как рак толстой кишки. За несколько десятилетий в исследованиях до сих пор не было выявлено четкой связи между использованием ВРТ и риском развития рака у матери.
В целом эти проблемы, неудобства и затраты могут отпугнуть родителей, имеющих генетические мутации и заинтересованных в использовании ВРТ и ПГТ. Пока что при опросе пар с высоким риском генетических заболеваний от 25 до 75 % сказали, что предпочли бы попробовать более простой вариант: рискнуть пойти естественным путем и сделать аборт, если окажется, что ребенок получил опасную мутацию. В разных исследованиях очень различалась заинтересованность в ВРТ и ПГТ (в среднем этим заинтересовалась примерно половина пар), что говорит о том, что это решение личное и субъективное.
ВРТ и ПГТ очень привлекательны. Эти технологии могут дать родителям возможность сделать то, чего многие хотят больше всего на свете: значительно улучшить качество жизни своих детей, детей своих детей и детей детей своих детей.
Рассмотрим случай Дакшины и Рамы Венатарам{17}. Ему было 23, ей 24 года, и они были женаты уже два года, когда родился их первый ребенок, девочка Ванани с рецессивным генетическим заболеванием, которое называется большая бета-талассемия. Это заболевание возникает из-за мутации в гене бета-глобина, одного из двух основных компонентов гемоглобина. Гемоглобин – один из наиболее интенсивно вырабатываемых белков в человеческом организме. Он непосредственно связывается с кислородом. Красные кровяные клетки, переносящие кислород по организму, буквально набиты гемоглобином, в процессе эволюции они утратили свои ядра и ДНК, чтобы в них помещалось больше гемоглобина, который связывается с кислородом. У Ванани была одинаковая однонуклеотидная мутация в обеих копиях гена, отвечающего за синтез бета-глобина – составной части гемоглобина. Поскольку известно более 200 мутаций бета-глобина, похоже, что ее родители были в кровном родстве, у них был общий предок.
У больных большой бета-талассемией, таких как Ванани, развивается тяжелая форма анемии, ткани их организма не получают достаточно кислорода. Им нужны регулярные переливания крови, примерно раз в месяц, чтобы увеличить количество работающих красных кровяных клеток, переносящих кислород к месту назначения. Поскольку нормально работающий гемоглобин использует железо, чтобы захватывать кислород в легких и высвобождать в разных частях тела, переливания крови приводят к накоплению железа в печени, костном мозге, селезенке и других органах и нарушению их работы. И хотя для выведения железа из организма пациентам можно дополнительно давать хелаторы – препараты, связывающие железо, дети с большой бета-талассемией обычно отстают в росте и у них много медицинских проблем. В целом качество их жизни значительно страдает, а ее продолжительность в среднем составляет 28 лет. Примерно у каждых трех индийцев из 100 есть мутантная копия гена бета-гемоглобина, поэтому дети с бета-талассемией рождаются довольно часто.
Дакшина и Рама хотели бы иметь большую семью. В последующих двух беременностях у плода тоже обнаруживалась большая бета-талассемия. Поскольку у них уже был тяжелый эмоциональный опыт ухода за больным ребенком, они прервали эти беременности. Для следующего зачатия они решили использовать искусственные технологии и генетическое тестирование. Дакшина сделала две попытки. Во время первой успешно извлекли четыре яйцеклетки. Две из них оказались незрелыми, и их нельзя было использовать. Из двух успешно оплодотворенных яйцеклеток одна оказалась с большой бета-талассемией (с парой мутантных генов, по одному от каждого родителя), поэтому ее не использовали. Подсаживание второй оплодотворенной яйцеклетки не привело к беременности. Поскольку первая попытка искусственного оплодотворения оказалась неудачной, через пять месяцев попытались снова. На этот раз получили четыре эмбриона. ПГТ показала, что у каждого из них один (доминантный) нормальный и один (рецессивный) мутантный ген бета-глобина, значит, у детей, которые могут получиться из этих эмбрионов, заболевания не будет. Было подсажено три эмбриона, и это привело к успешной беременности и рождению одного ребенка.
Существует единое мнение, что преимплантационное генетическое тестирование детских наследственных заболеваний, которые приводят к значительным страданиям и преждевременной смерти, должно стать широкодоступным. И более чем три четверти всех родителей, столкнувшихся с такой ситуацией, заинтересовались этой технологией.
Однако нет согласия по вопросу использования ВРТ и ПГТ для выявления наследственных заболеваний, проявляющихся во взрослом возрасте, таких как синдром семейной параганглиомы, выявления носительства гена рецессивного заболевания или даже менее тяжелых форм бета-талассемии, когда продолжительность жизни может достигать и 60 лет.
Этическая комиссия Американского общества репродуктивной медицины, объединяющего врачей, оказывающих эти услуги, в 2013 г. постановила, что «ПГТ болезней, проявляющихся во взрослом возрасте, этически допустима, как часть репродуктивной свободы»{18}. Не известно точное количество родителей, использовавших ВРТ/ПГТ для заболеваний, проявляющихся во взрослом возрасте, эта процедура не регулируется в США ни на уровне штата, ни на федеральном.
В США, Европе и Японии ПГТ наследственных заболеваний, проявляющихся во взрослом возрасте, широко распространено. В настоящее время существуют серьезные разногласия среди общественности, различных медицинских учреждений и отдельных врачей о том, в какой степени возможные риски ПГТ перевешиваются преимуществами от предотвращения серьезных заболеваний, которые могли бы и не проявиться в течение жизни.
Среди аргументов в поддержку использования ПГТ для серьезных заболеваний, проявляющихся во взрослом возрасте, приводятся такие: право родителей на репродуктивный выбор, медицинская польза от предотвращения передачи наследственных заболеваний, возможные социальные выгоды от снижения общего уровня заболеваемости. Кроме того, для родителей это возможность избежать угрызений совести, что они были недостаточно хорошими родителями и не сделали всего, что можно было сделать для улучшения жизни своих детей. Для собственного спокойствия семейные пары стараются сделать все возможное, чтобы уменьшить неуверенность и страх, которые могут омрачить детские годы их сыновей и дочерей, если дети знают, что, скорее всего, серьезно заболеют во взрослом возрасте. Родители могут опасаться «синдрома выжившего», который иногда возникает у детей, знающих, что у них не будет наследственного заболевания, которое есть у их братьев и сестер{19} С другой стороны, Американская академия педиатрии сейчас рекомендует не проводить генетические тесты на неизлечимые заболевания, проявляющиеся во взрослом возрасте, пока дети не достигнут совершеннолетия{20}.
В отдельных случаях у родителей разные требования для себя и для своих детей. Например, некоторые люди, у чьих родителей была болезнь Хантингтона, по личным или страховым причинам не хотят знать, получили они эту мутацию или нет. Однако они хотят на всякий случай использовать ВРТ и ПГТ при планировании своих детей (внуков людей с болезнью Хантингтона и детей тех, у кого вероятность унаследовать мутантный ген была 50 %), чтобы предотвратить передачу мутации{21}. С этической точки зрения медицинские работники могут оказаться в сложной ситуации, если выяснится, что у родителей, пришедших за ВРТ/ПГТ, нет мутантного гена, то есть им на самом деле не нужна помощь репродуктивных технологий, но врачи не имеют права сказать об этом, поскольку это не соответствует желанию пациентов.
Часто ВРТ /ПГТ используют, чтобы предотвратить передачу следующему поколению наследственного заболевания, которое нельзя излечить, но при котором можно улучшить состояние больного. Например, тысячам больных с синдромом Линча проводят частые колоноскопии и хирургические операции, чтобы выявить и предотвратить развитие рака желудочно-кишечного тракта, который возникает примерно у семи из десяти носителей этой мутации, доживших до 70 лет. В качестве химиопрофилактики для дальнейшего снижения риска может использоваться аспирин. Кроме того, хотя у носителей этой мутации риск развития рака желудочно-кишечного тракта выше, прогноз в отношении уже возникшей опухоли лучше, чем у тех, у кого рак появился по другим причинам, например вследствие естественного процесса старения или накопления случайных мутаций. В ближайшие десятилетия, вероятно, произойдет значительное улучшение методов визуализации, позволяющих обнаруживать рак, и появятся новые средства для профилактики и лечения. Кроме того, может получить широкое распространение исправление генома с помощью описанных выше технологий. Поэтому есть серьезные разногласия – нужно ли использовать ВРТ/ПДГ для тех генетических заболеваний, которые проявляются во взрослом возрасте, поскольку существует возможность, что болезнь у носителя мутации так никогда и не разовьется.
Основной аргумент против использования ВРТ/ПГТ для наследственных заболеваний, проявляющихся во взрослом возрасте, заключается в том, что болезнь может и не возникнуть: на сегодняшний день это надо учитывать вместе со стоимостью и рисками ВРТ и ПГТ. Кроме того, могут быть технические ошибки при проведении диагностики у эмбриона. И более абстрактные соображения: пойдя по этой скользкой дорожке, можно дойти до слишком легкомысленного использования генетических технологий, например для выбора определенного роста, спортивных качеств или интеллекта будущего ребенка{22}. Идея воспользоваться репродуктивными технологиями для создания «дизайнерских младенцев» звучит как научная фантастика. А вот для чего действительно можно использовать преимплантационное тестирование, хотя это и не так важно, как выявление серьезных детских наследственных заболеваний, так это для выбора пола будущего ребенка.
Тысячелетиями супружеские пары пытались повлиять на то, чтобы у них рождались именно сыновья или дочери, из-за чего возникло множество суеверий. В том числе предлагалось вступать в половые отношения, повернувшись лицом в сторону Северного или Южного полюса (предполагалось, что магнитное поле по-особенному влияет на подвижность сперматозоидов с Y-хромосомой), заниматься любовью в определенные фазы луны или определять время проведения полового акта в зависимости от температуры тела женщины. Существует даже (как уверяют по телевизору) диета, которая якобы повышает вероятность рождения дочери, если в пище много кальция и магния. Однако все это не очень эффективно.
В древних культурах, в том числе в Риме и в Греции, для того, чтобы оставались дети определенного пола, часто совершали детоубийство, обычно просто выбрасывали младенца на произвол судьбы. В одном римском папирусе содержится такое указание: «Я все еще в Александрии… я прошу и умоляю тебя заботиться о наших маленьких детях, и, как только мы получим оплату, я отправлю ее тебе. Если же в это время ты родишь (желаю тебе удачи!) и если это будет мальчик, то пусть живет, а если девочка, выкинь ее»{23}.
Знаменитые попытки короля Генриха VIII произвести наследника мужского пола привели, в частности, к созданию англиканской церкви, он отделил свою страну от Римской католической церкви с ее запретом на развод. Став главой только что созданной англиканской церкви Генрих смог аннулировать свой брак с Екатериной Арагонской, которая не смогла родить ему наследника. Археолог Катрина Бэнкс Уайтли и антрополог Кира Крамер в статье, опубликованной в 2010 г., предположили, что Генриху вообще было сложно зачать ребенка, который не умер бы в раннем младенчестве, поскольку умирали дети от всех шести его жен. Они предположили, что у Генриха имелось генетическое нарушение: на поверхности эритроцитов мог присутствовать редкий антиген Kell{24}. Если у матери в крови нет такого антигена, у нее может развиться иммунная реакция на плод, у которого антиген есть. Если мать и отец несовместимы по гену Kell, первый ребенок может родиться здоровым, но при каждой последующей беременности от того же отца иммунная система матери будет атаковать плод, что часто приводит к выкидышу или смерти новорожденного. Единственный способ узнать, правы ли авторы, – отыскать и эксгумировать останки Генриха, надеясь, что для секвенирования найдется достаточное количество ДНК, например в кости.
На сегодняшний день с помощью ВРТ и ПГТ можно точно выбрать пол ребенка. Могут быть разные причины, почему родители хотят выбрать определенный пол своему ребенку, начиная с того, чтобы избежать генетических заболеваний, сцепленных с Х-хромосомой, – такие заболевания по-разному проявляются у мужчин и женщин (например, синдром Мартина – Белл при котором у мальчиков возникает умственная отсталость), и заканчивая личным желанием иметь определенное распределение полов в семье или чтобы между детьми одного пола были дружеские отношения. В некоторых культурах предпочитают детей мужского пола.
Рабочая группа по этике ведущей организации Евросоюза в этой области – Европейского общества репродукции человека – в 2013 г. рекомендовала использование ПГТ для выбора пола, чтобы избежать сцепленных с полом наследственных заболеваний, при этом остались некоторые разногласия для случаев, например, когда все дети в семье только одного пола{25}. Американское общество репродуктивной медицины – ведущее профессиональное сообщество в этой отрасли медицины – первоначально не одобрило использование ПГТ для выбора пола ребенка, но позже пересмотрело свою позицию и разрешило выбор пола при проведении ПГТ для поддержания равновесия полов детей в семье и удовлетворения запроса родителей на выбор пола будущего ребенка. Все это свидетельствует об отсутствии единого мнения по данному вопросу{26}.
Между тем в США нет федеральных законов, которые запрещали бы использовать ПГТ для выбора пола ребенка. По подсчетам, примерно четыре из каждых десяти расположенных в США клиник, занимающихся искусственным оплодотворением, предлагают использование ВРТ/ПГТ для выбора пола ребенка не по медицинским показаниям. Некоторые клиники открыто рекламируют ПГТ для выбора пола ребенка, так же как это делают аналогичные организации по всему миру, которые занимаются обслуживанием американского и европейского «медицинского туризма». И наоборот, поскольку в некоторых странах запрещено использование ПГТ для выбора пола не по медицинским показаниям (например, в Китае, Германии, Великобритании, Канаде), США становится одним из мест медицинского туризма и для этих целей тоже. Один известный центр, предоставляющий такие услуги, – Институт оплодотворения – сообщает на своем сайте, что у него есть ПГТ-центры в Нью-Йорке, Лос-Анджелесе и в Гвадалахаре (Мексика) и планируется в Индии (скоро открытие!), и откровенно заявляет: «Если вам нужна уверенность, что ваш следующий ребенок будет того пола, которого вы хотите, то никакой другой метод не сравнится по надежности с ПГТ (преимплантационным генетическим тестированием). При традиционных методах сортировки сперматозоидов вероятность успеха составляет [sic!] 60–70 %, и только ПГТ дает 100 %-ную точность»{27}.
В Израиле обычно не выбирают пол будущего ребенка, но семейная пара с большим количеством детей одного пола может обратиться в Министерство здравоохранения, чтобы было сделано исключение; если министерство разрешает, единая система здравоохранения может оплатить ВРТ и ПГТ для выбора пола.
Однако, помимо ВРТ и ПГТ, имеются другие способы решить проблему наследственного заболевания. Аборт – одна из наиболее распространенных стратегий, которую используют пары во всем мире, столкнувшись с трудной ситуацией, когда у ребенка наследственное заболевание. Однако приемлемость такого подхода в значительной степени зависит от культурных традиций и действующего законодательства.
Так, в Китае врач может направить на аборт (по генетическим или негенетическим причинам) даже против воли родителей. В то же время есть государства, например Ватикан, Мальта и Иран, где аборты запрещены, даже если у ребенка есть мутация, вызывающая тяжелое или смертельное заболевание.
США и Европейский союз в этом вопросе находятся в середине между двумя крайностями, уважая личную независимость и свободу выбора. Для тысяч наследственных заболеваний аборт – принятая практика, на него решаются многие пары, когда узнают о высоком риске для ребенка.
Воспользоваться абортом, если ребенок неподходящего пола, сейчас допустимо в 42 штатах и запрещено в Аризоне, Иллинойсе, Оклахоме, Канзасе, Северной Каролине, Пенсильвании, Северной и Южной Дакоте. Писатель Эмили Базелон в 2014 г. отметила в публикации в Slate, что «Южная Дакота дошла до того, что требует, чтобы врачи спрашивали у женщин, собирающихся делать аборт, знают ли они пол будущего ребенка и не потому ли делают аборт. В Оклахоме ваш муж, отец или брат может подать на вас в суд, если вы сделали аборт по этой причине»{28}.
В большинстве случаев ПГТ используют, чтобы повысить шансы родить мальчика, и чаще всего это делают при планировании первого ребенка. В США четыре из каждых пяти пар, использующих эту диагностику для выбора пола, хотят мальчиков. Такое желание часто возникает из-за предпочтения наследников мужского пола в некоторых этнических субкультурах и связано с правом наследования, финансовой поддержкой пожилых вышедших на пенсию родственников, передаче фамилии и религиозными традициями, зависящими от гендера.
В Китае ВРТ и ПГТ для выбора пола ребенка однозначно незаконно. Тем не менее есть данные, что этот закон, очевидно, не соблюдается, вероятно, из-за сложившейся исторически традиции предпочтения мальчиков и из-за абортов плодов женского пола среди новорожденных получается более 117 мальчиков на каждые 100 девочек.
В Индии особенно заметно использование репродуктивных технологий для выбора пола, там применяются и ВРТ, и ПГТ, и другие методики. Мощные культурные традиции в Индии, особенно у большинства, исповедующего индуизм, способствуют выраженному предпочтению сыновей. Большое значение имеет широко распространенная система получения приданого. Когда дочь выдают замуж, по древнему обычаю семья невесты передает молодоженам приданое, стоимость которого может равняться доходу, полученному за шесть лет{29}. В результате получается, что «растить девочку – все равно что поливать растение во дворе соседа». Есть и другие культурно обусловленные причины предпочтения сыновей, в том числе требование, чтобы сыновья финансово помогали престарелым родителям. У индуистов, которые составляют 80 % населения Индии{30}, религиозные принципы тоже поддерживают сыновей, а не дочерей, при смерти родителей сын зажигает погребальный костер, чтобы обеспечить им спасение после смерти{31}.
В 1970-х гг. в Индии начали делать амниоцентез и более сложную инвазивную процедуру, которая называется биопсия ворсин хориона, обе эти методики позволяли определить пол эмбриона. Вскоре индийские медики начали активно использовать эти методы для внутриутробного отбора детей нужного пола{32}. Считалось, что такой отбор поможет Индии контролировать численность населения, поскольку семьи не будут рожать, пока не получится мальчик, и тем самым убийств новорожденных девочек станет меньше. В исследовании 1977 г. выяснилось, что среди пар в Индии, определивших пол будущего ребенка с помощью амниоцентеза, 96 % сделали аборт, если у них была девочка, но никто не сделал аборт, если у них был мальчик. Те же выводы были получены в более крупных исследованиях после появления УЗИ плода в 1980-х гг. Индийская перепись населения 1991 г. показала неравномерность в распределении полов, и в 1994 г. появился закон, запрещающий использование пренатальных технологий, чтобы сохранять детей только определенного пола, теперь это стало нелегально. Частично этот запрет был обжалован, но в 2003 г. Верховный суд Индии отдельно выделил запрет на использование ВРТ и ПГТ для выбора пола будущего ребенка{33}.
Однако технологии меняются и приспосабливаются. С середины 2000-х гг. появилась возможность определить пол будущего ребенка на седьмой неделе беременности, просто взяв кровь из пальца матери. Этот тест показывает присутствие мужской Y-хромосомы среди внеклеточной ДНК плода в материнской крови. Хотя в Индии нет своего производства наборов для массового проведения таких тестов, ими могут торговать американские компании, чем и занимаются как минимум с 2006 г. Это значит, что тестовые наборы могут попасть и в Северную Индию, где соотношение полов уже составляет почти два мальчика на каждую родившуюся девочку (в мире в среднем этот показатель составляет 105 мальчиков на 100 девочек; специалисты по демографии предполагают, что мальчиков обычно рождается чуть больше, чтобы уравновесить то, что у детей и взрослых мужского пола чаще встречаются более серьезные проблемы со здоровьем и взрослые мужчины чаще убивают друг друга).
Помимо предпочтения мальчиков, бывает и обратная тенденция. Как показывает опрос о детях, проведенный Институтом Гэллапа в разных странах, в Испании и Исландии родители часто предпочитают девочек{34}. Непонятно, общие или разные причины существуют для одинакового предпочтения в Испании и Исландии, но отчасти это может быть связано с желанием иметь большую семью. В Соединенных Штатах примерно у четырех из каждых десяти опрошенных пар предпочтений нет. Среди пар, имеющих предпочтение, сына хотят в среднем шесть из десяти.
Я встречал родителей, заинтересованных в выборе пола ребенка именно из-за болезней, которые по-разному проявляются у мужчин и женщин, и особенно заинтересованы в ПГТ семьи, где уже есть дети с расстройством аутического спектра.
Аутизм значительно чаще встречается среди мальчиков, чем среди девочек, и эта тенденция особенно заметна у тяжелобольных детей, тех, у кого наиболее выражено стереотипное поведение. Девочки оказываются менее уязвимы и для наследственных форм, и для возникших de novo (то есть когда ни у кого в семье не было такого заболевания). Это заболевание имеет сложное наследование, сотни разных генетических вариаций могут влиять на проблемы с речью, стереотипное поведение, например размахивание руками, трудности с обучением и другие проявления заболевания. Однако другие факторы, такие как мужской половой гормон тестостерон и его производные, могут сложным путем менять степень проявления аутизма, возможно, за счет изменения определенных областей мозга в процессе развития. Это заболевание может быть очень разрушительным как для ребенка, так и для всей семьи.
Если у родителей уже есть один или несколько детей с расстройством аутистического спектра, возрастает вероятность, что у следующего ребенка будет тот же диагноз. Поэтому, хотя аутизм редко бывает вызван изменениями в каком-то одном гене, использование ВРТ и ПГТ для рождения девочки происходит все чаще, по крайней мере создается такое впечатление.
По данным Всемирной организации здравоохранения (ВОЗ), США тратят на здравоохранение порядка 17 % ВВП, в 2013 г. это составило $3 трлн{35}. В этой сфере работают около 1 млн врачей и несколько миллионов других специалистов, связанных с медициной. В научных и правительственных организациях, частных компаниях, некоммерческих организациях и сотнях политических организаций имеются тысячи экспертов в области медицинской политики, которые наряду со множеством псевдоэкспертов имеют весомое мнение о роли генетики в пренатальной медицине. Однако в конце концов во многом пациент свободен принять то медицинское решение, которое сочтет нужным. Право пациента должно быть важнее точной генетической медицины на всех уровнях, и я надеюсь, что так и будет.
Стоит ли использовать мощные существующие и появляющиеся генетические технологии для своего будущего ребенка, Розалинд с мужем не задумывались ни минуты. ВРТ, ПГТ и аборт можно сделать в Нью-Йорке, финансово, интеллектуально и эмоционально это все было доступно им после генетической консультации. Однако они предпочли «старомодное» решение для себя, их двухлетней дочери и будущего ребенка. Возможно, это не соответствует существующим стереотипам об энергичных нью-йоркских парах, но Розалинд была из большой семьи с Американского Запада с традиционными семейными ценностями. Розалинд подумала, что она, ее родители, двоюродные братья, тети, дяди и все остальные переживали и гораздо худшие времена. Ее семья переживала депрессии и кризисы, стихийные бедствия и личные трагедии, с которыми не сравнятся эти генетические проблемы. Семья процветала, несмотря на то что у них были «плохие» SDHB-мутантные гены, из-за которых возникали панические атаки и рак. Муж Розалинд, тоже из большой и успешной семьи с традиционными ценностями, был того же мнения. Он стоял рядом с Розалинд и излучал уверенность в том, что они выдержат. Спустя четыре месяца после беременности без осложнений у них родилась красивая дочка. Розалинд чувствует себя хорошо, и в ее семье все благополучно.
Глава 4 Покер вслепую и копченый лосось
Майкл Брэденбергер обратился ко мне через нашего общего друга Рика, которого мы знали со студенческих времен, проведенных в Принстоне. Рик описал Майкла как интересного парня: талантливый, квалифицированный управляющий хеджевого фонда, всего в жизни добившийся самостоятельно. По словам Рика, если бы я поискал информацию о Майкле в интернете, то нашел бы несколько десятков страниц: статьи о его бизнесе в The Wall Street Journal и Businessweek, об его участии в благотворительности, а в блогах – светские сплетни из Чикаго, где он живет.
Несколько лет назад ему диагностировали наследственное заболевание – полипоз, ассоциированный с геном MUTYH. Рик рассказал, что Майкл недавно сделал секвенирование своего генома и хотел бы получить больше информации, чем дал его генетический консультант.
Рик также поведал мне, что Майкл просто помешан на конфиденциальности. Он хранил информацию о своем геноме на веб-сайте с таким высоким уровнем защиты, что даже Агентство национальной безопасности не смогло бы его взломать. Довольно скоро я испытал на себе пристрастие Майкла к приватности, попав в ресторан на Манхэттене, который был специально спроектирован для тайных и уединенных бесед. Его номер телефона отсутствовал в телефонных книгах. С улицы в него можно было попасть через неприметную красную дверь, а само здание снаружи выглядело незаконченной стройкой. Столы, покрытые белыми скатертями, стояли далеко друг от друга. Внутреннее убранство было оформлено в стиле усадебной постройки XIX в.
Наши тела обладают по меньшей мере семью способами защиты своих генов от многочисленных и разнообразных опасных внешних воздействий. Нам постоянно угрожают: воздух, которым мы дышим, ультрафиолет и солнечная радиация, а также неизбежные случайные ошибки в нашей ДНК, замены или потери нуклеотидов, которые накапливаются в процессе естественного старения из-за того, что на протяжении всей нашей жизни клетки регулярно делятся.
Первыми формами жизни на Земле были ДНК-содержащие бактерии, появившиеся более 3 млрд лет назад. В те времена в атмосфере Земли кислорода почти не было, и эти организмы дышат другими газами, такими как метан.
Перенесемся вперед еще на миллиард (плюс-минус несколько сотен миллионов) лет, когда появились цианобактерии, которые развили неслыханное умение расти и получать энергию с помощью фотосинтеза, используя солнечные лучи. Древние цианобактерии были чудовищно плодовиты, неистово размножаясь, они заполнили все теплые и солнечные места на нашей планете.
Однако таким образом цианобактерии приблизили то, что теперь называется кислородной катастрофой. В процессе фотосинтеза, когда организмы, используя энергию света, поглощают углекислый газ из воздуха, они выделяют кислород в качестве побочного продукта, который накапливается в атмосфере планеты. Кислород очень нестабильное токсичное вещество, он может повреждать ДНК и РНК, а также множество других важных биомолекул, таких как липиды и белки. Кислород моментально вырывает у них электроны, отрывая кусок молекулы или разрушая ее на части.
Эволюционный успех цианобактерий и повышение содержания кислорода в атмосфере привело к одному из крупнейших массовых вымираний в истории Земли. Было две причины, из-за которых погибли почти все живые организмы. Во-первых, бактериальная жизнь в то время не была приспособлена к такому страшному мутагену и не могла с достаточной скоростью исправлять кислородные повреждения молекул. Во-вторых, кислород реагирует с метаном в атмосфере, приводя к антипарниковому эффекту: средняя температура на Земле снизилась на несколько градусов. Результаты оказались не менее губительны: начался крупнейший за все 4,5 млрд лет истории Земли ледниковый период.
Через несколько сотен миллионов лет установилось равновесие. Сегодня в воздухе, которым мы дышим, содержится 21 % кислорода, и мы не можем жить без него. Если кислород заканчивается, то и мы «заканчиваемся» довольно быстро и неприятно. Когда мы кормим огонь дровами, ему, чтобы их сжечь, нужен кислород, так же и наши тела используют силу этого вещества, чтобы разрушать молекулы, в которых запасена энергия, и обеспечивать нас топливом, которое используется во всех жизненно важных процессах. Параллельно иммунная система успешно использует токсичное свойство кислорода в наших интересах. Занимаясь патрулированием, специальные защищенные клетки, называемые макрофаги и гранулоциты, используют кислородные радикалы как оружие для борьбы с инфекциями и даже с раковыми клетками.
Чтобы защититься от этого ужасного загрязнителя атмосферы, который мы называем кислородом, бактерии, растения, насекомые, а позже и люди начали использовать особый восстановительный механизм, получивший название эксцизионной репарации оснований. Он занимается исправлением повреждений, которые постоянно возникают в нашем теле под действием кислорода.
Гены постоянно эволюционировали с момента их возникновения во времена древней жизни на Земле, создавая новые способы защитить геном, так что получилось некоторое подобие многофункционального швейцарского армейского ножа для нуклеотидов.
Кроме кислорода, существуют и другие вещества, повреждающие ДНК схожим образом. Например, в подгорелой пище имеются макромолекулы, содержащие окисленный углерод, азот и серу. К окислительному стрессу также может приводить взаимодействие нашего микробиома – бактерий, живущих в кишечнике, – с иммунной системой, которая поддерживает порядок среди полезных микробов, при необходимости выделяя собственные кислородные радикалы. В нижних отделах кишечника особенно высокое содержание серы, наверное, вы об этом уже знаете, потому что у большинства из нас, к несчастью, нет меркаптанной аносмии – врожденной неспособности ощущать запах кишечных газов. Сера, как и кислород, может образовывать радикалы и повреждать кишечник человека. Это большая проблема для клеток, образующих желудочно-кишечный тракт. Среди более 100 различных видов клеток нашего организма клетки кишечника делятся быстрее всех, раз в несколько дней. Большинство людей обычно начинают проверяться на рак ободочной и прямой кишки в возрасте 50 лет, значит, к тому времени стволовые клетки их кишечника успеют поделиться более 130 000 раз. А чем чаще клетка делится, тем больше вероятность, что ДНК будет повреждена при копировании из-за окислительного или серного стресса, что в свою очередь увеличивает риск развития рака. Относительно недавно исследователи с разных континентов независимо друг от друга показали, что тонкие вытянутые серные бактерии Fusobacteria могут также увеличивать риск развития рака ободочной и прямой кишки, а кроме того, способствовать воспалению и заставлять клетки кишечника делиться чаще.
Если вещества из окружающей среды повредили ДНК, большое значение для восстановления имеют некоторые дополнительные гены. Есть семьи, в которых из поколения в поколение передаются мутации в таких генах, защищающих ДНК. Раньше у людей из этих семей чаще развивался рак желудка. Но теперь это не так. Когда в первой половине XX в. широкое распространение получили холодильники для хранения еды, у потомков с теми же самыми мутациями рак желудка стал возникать гораздо реже. Одно из объяснений заключается в том, что раньше, чтобы сохранить мясо надолго, люди использовали копчение и вяление. Процесс копчения убивает все скрывающиеся в нем болезнетворные бактерии, но при этом в процессе горения выделяются определенные химические вещества. После того как такие вещества попадают в пищу, съедаются и расщепляются в желудке, они могут вызвать повреждения ДНК{36}. К таким веществам относятся окисленные и алкилированные белки, жиры и другие соединения, вызывающие мутации, химически изменяя ДНК, а также другие виды возможных канцерогенов, которые повышают риск развития рака.
При копчении, вялении и засолке говядину, птицу, свинину и рыбу обычно замачивают в растворе различных солей. Таким образом мясо становится нежнее, но в то же время несет в себе потенциальные проблемы, так как некоторые традиционные рецепты предлагают использовать нитраты. При этом увеличивается образование вредных веществ, в том числе и нитрозаминов, которые могут прицепляться к ДНК и сбивать с толку полимеразу, определяющую, какой из нуклеотидов – А, Ц, Г или Т – надо поставить на данное место при удвоении ДНК. Кстати, нитрозамины найдены в табачном дыме и в дыме электронных сигарет.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США ограничивает содержание нитритов в мясе и мясопродуктах, потому что опасается возможного роста числа раковых заболеваний населения{37}. Эта проблема, безусловно, не ограничена семьями с наследственными синдромами, связанными с системой репарации ДНК. Совсем недавно ВОЗ, основываясь на эпидемиологических данных, а не на более убедительных клинических исследованиях, пришла к выводу, что потребление бекона, ветчины и хот-догов немного увеличивает риск развития рака желудка и толстой кишки{38}.
Тем не менее использование копчения, вяления и засолки для приготовления пищи сопровождало нас на протяжении веков (и, возможно, тысячелетий) и уже стало неотъемлемой частью культуры и традиции.
Кроме того, мы знаем, что важным фактором риска для развития раковых заболеваний желудочно-кишечного тракта является воспаление. Воспалительные заболевания кишечника – это комплекс как наследственных, так и приобретенных расстройств, которые вызывают хроническое раздражение клеток тонкого и толстого кишечника, что может повышать вероятность развития рака ободочной и прямой кишки.
Кроме наших генов, на увеличение риска возникновения рака могут оказывать влияние бактерии, живущие в кишечнике. Хроническое инфицирование бактерией Helicobacter pylori и воспалительная реакция, направленная на то, чтобы избавить желудок от этой бактерии, хорошо известные факторы риска развития рака желудка отчасти из-за сопутствующего повреждения, которое наносит иммунная система, вооруженная кислородом. Как правило, H. pylori легко уничтожаются за несколько недель, если принимать нужные антибиотики и лекарства, которые регулируют кислотность желудка.
В развивающихся странах со слабой инфраструктурой здравоохранения H. pylori присутствует в желудке почти всегда, что повышает частоту случаев рака желудка. В то же время в развитом мире заболеваемость раком желудка резко упала благодаря массовому использованию холодильников, очистке воды и безопасности продуктов питания.
С одной стороны, благодаря системе здравоохранения снизилась заболеваемость раком желудка, с другой – необычайно возросло число случаев рака легких. Из-за эволюции системы эксцизионной репарации оснований и связанных с ней генов наши легкие отлично приспособлены для работы со страшным ядом кислородом, который врывается в нашу грудь каждую секунду благодаря матушке-природе, создавшей ужасную армию растений, выделяющих кислород. Два века назад стало очевидно, что вдыхаемый кислород не вызывает рак легких. До той поры рак легких был редким заболеванием и составлял 1 % случаев из всех смертельных злокачественных опухолей. Сегодня от него гибнет больше всего людей, на его долю приходится чуть менее четверти всех смертей от рака. В начале XX в. ученые предположили, что рак легких из редкого превратился в ужасающе частое заболевание из-за распространения по воздуху токсических веществ, образовавшихся благодаря выбросам промышленных газов, выхлопу автомобилей и асфальтированию дорог. Однако частота встречаемости рака легких растет со схожей скоростью в странах с менее развитой промышленностью, меньшим числом машин и асфальтированных дорог.
Рост заболеваемости раком легких происходил параллельно с распространением дешевого и массового производства сигарет в конце XIX – начале XX в. Табачный дым содержит смесь канцерогенов и кислородных радикалов. По еще неокончательно понятным причинам только у каждого седьмого курильщика со стажем развивается рак легких. Создается впечатление, что на устойчивость или склонность к этой форме рака может влиять наследственная изменчивость.
Майкл вырос на границе трех штатов в благополучном пригороде Нью-Йорка. Его детство было вполне обычным. С медицинской точки зрения ни он сам, ни его семья не представляли собой ничего интересного. Это хорошая неинтересность, люди обычно ее не ценят, пока их жизнь не наполнится тревогой, реанимационными отделениями, визитами к врачу и медицинскими процедурами.
Однажды холодным чикагским утром связанная с медициной сторона жизни Майкла в плохом смысле стала гораздо менее скучной. Тогда ему было 27 лет. Его разбудили завывания ветра, дувшего от озера Мичиган в сторону небоскреба, в котором он жил. Его постельное белье и пижама окрасились ярко-красной кровью, текшей из заднего прохода Майкла. Он отправился в отделение скорой помощи.
В целом он заботился о своей повседневной жизни и прекрасно себя чувствовал, поэтому был искренне потрясен тем, что у него могло случиться что-то серьезное. Он чувствовал себя достаточно неплохо, чтобы самостоятельно поймать такси для поездки в больницу, а не вызвать машину скорой помощи. Майкл был геем, и в первую очередь он испугался СПИДа. Естественно, врачи в отделении сначала заподозрили инфекцию, но у него не было ни жара, ни лихорадки, ни боли, ни поноса, никаких других признаков инфекционного заболевания.
Ко всеобщему удивлению, у Майкла обнаружили рак толстой кишки. Опухоль шириной всего в несколько сантиметров, к несчастью, повредила крупную кишечную артерию. Поэтому возникло кровотечение. Такое неприятное и нетипичное проявление болезни, возможно, спасло жизнь Майклу. Его ближайшие родственники не болели раком, Майкл был первым. Вся его семья была в шоке. Рака не было ни у его родителей, ни у сестры. У одной из его бабушек был рак груди, но он появился, когда ей было 60 лет. Ничто в семейном анамнезе не предвещало, что Майкл скоро познакомится с генетикой раковых заболеваний человека.
Поскольку на момент получения диагноза Майкл был молод, ему в Чикаго сделали генетический анализ. У него обнаружилась мутация в гене MUTYH. Белок, кодируемый этим геном, отвечает за решение весьма распространенной проблемы. Кислород или другие вещества повреждают в ДНК гуанины (Г), которые должны связываться с цитозинами (Ц). В этом случае, когда ДНК копируется перед делением клетки, напротив гуанина (Г) вместо нужного нуклеотида может случайно встать аденин (А). Соответственно, в клетках людей с полипозом, связанным с геном MYH, и особенно в раковых клетках есть хороший опознавательный молекулярный признак: пары Г – Ц заменяются на А – Т. В опухоли будет пониженное содержание пар Г – Ц и повышенное Т – А.
Выявить мутацию в MUTYH очень важно. Таким пациентам надо часто обследовать толстый и тонкий кишечник и, возможно, желудок, потому что у них возникают новообразования, называемые полипами, которые иногда превращаются в раковые опухоли. Полипы могут быть одиночными, но могут исчисляться сотнями. Если полипов много и они выходят из под контроля, то проводят хирургическую операцию. Однако эта операция отличается от обычно практикуемой при раке толстой кишки. Как правило, чтобы предотвратить развитие новых опухолей, появляющихся из полипов, удаляют больше здоровой ткани кишечника.
Поскольку такое заболевание встречается редко, провести клиническое исследование носителей мутаций довольно сложно. Хотя в настоящее время данных немного, считается, что у носителей может быть выше риск развития рака щитовидной железы. Она накапливает йод, который входит в состав тироидных гормонов, а йод может окисляться.
Учитывая, что такой полипоз встречается нечасто, «генетическая молния» ударила в одно место дважды. Во-первых, в США риск развития рака толстого кишечника в течение жизни составляет 6 %, и из них только у 10 % он возникает в возрасте младше 30 лет. И среди всех пациентов с такой формой рака только у нескольких процентов есть мутация в гене MUTYH.
Во-вторых, у Майкла был мозаицизм. Полипоз, связанный с геном MUTYH, – рецессивное заболевание, и это значит, что обе копии гена должны быть с мутацией. Поэтому в семье Майкла не было проблем с раком кишечника в более ранних поколениях. У его родственников, помимо мутантной рецессивной копии гена, была работающая доминантная. Они были носителями этого заболевания, но по большому счету это им не мешало.
Большинство людей с такого рода заболеваниями наследуют одну испорченную копию гена от отца, а другую от матери. Однако та мутация, которая есть у Майкла, унаследована только от отца. Примерно у двух третей клеток его тела обе копии гена мутантные. После зачатия, когда его эмбрион состоял всего из нескольких клеток, одна из них получила две копии одного и того же участка хромосомы, который содержал мутацию в гене MUTYH. Соответственно, все потомки этой эмбриональной клетки были обречены нести две копии рецессивной мутации.
Явление, когда у одной и той же особи возникают клетки с разным набором генов, называется мозаицизмом. Впервые у животных он был показан в 1930-х гг. во время исследований мух дрозофил. В 1950-х гг. ученые обнаружили, что мозаицизм возможен и у человека, они открыли то, что сегодня называют термином «гермафродитизм», хотя более правильно называть «интерсексуальностью» ситуацию, когда у людей есть и мужские, и женские признаки из-за того, что в организме есть клетки с XX- и XY-хромосомами. Другие примеры мозаичности – трехцветные коты, чья окраска представляет собой смесь пятен разных цветов, и, может быть, покойный Дэвид Боуи, рок-звезда, у которого радужные оболочки правого и левого глаза были разного цвета.
C этой точки зрения почти все мы во многом похожи на лоскутное одеяло – с разной степенью мозаичности по разнообразным редким мутациям в наших клетках. И наша генетическая неоднородность может со временем меняться. Считается, что развитие генетической мозаичности – важная часть процесса старения и в первую очередь основа для развития раковых заболеваний. Таким образом, хотя геномы наших клеток относительно постоянны на протяжении жизни, непрерывный ручеек мутаций, приводящих к мозаичности, делает генетическую стабильность не реальностью, а скорее теоретическим принципом. В недавних исследованиях выяснилось, что примерно у 2 % людей старше 50 лет наблюдается мозаичность более чем в 5 % клеток{39}. Возможно, это лишь верхушка айсберга. Вероятно, это число значительно увеличится по мере усовершенствования технологий выявления мозаичности.
Масштабные исследования, в том числе выполненные более чем на 50 000 человек, также свидетельствуют, что при увеличении мозаичности при старении повышается и риск развития различных форм рака, в первую очередь рака крови, для которого в процессе старения риск возрастает более чем в 10 раз.
Майклу удалили опухоль толстого кишечника вместе с большой частью кишки, так как был риск появления нового рака. Восстановившись, Майкл обнаружил, что эта процедура незначительно повлияла на его жизнь.
Он вернулся к своей работе. Из соображения конфиденциальности генетический анализ был анонимным и результаты не были внесены в медицинскую карту Майкла. То, что у него был мозаицизм и две мутантные копии MUTYH присутствовали не во всех клетках тела, означало, что появление проблем в его случае несколько менее вероятно, чем у многих других людей, у которых обе мутантные копии были во всех клетках организма. Однако рак кишечника в 27 лет напомнил, что заболевание для каждого человека событие бинарное. У вас либо будет рак, либо нет.
Мы обнаружили у него мозаичность по анализу клеток крови, но на основе этой информации довольно сложно предположить, сколько клеток, образующих его кишечник, желудок, мочевой пузырь и другие органы, несут эту мутацию. Для обоснованных научных и медицинских выводов можно было бы провести инвазивное исследование клеток во всех прочих органах, но это было бы не очень приятно для Майкла. А не сделав этого, мы бы знали только, что как минимум одна клетка его толстого кишечника развилась в опухоль. Поэтому из практических соображений Майкл согласился, что ему необходимо вовремя проходить онкологический профилактический осмотр. Даже после операции ему надо ежегодно обследовать оставшуюся часть ободочной и прямой кишки, а раз в пять лет – желудок. Кроме того, он решил ежегодно делать МРТ брюшной полости и головы в поисках других форм рака, хотя не было ясно, какую пользу это ему принесет.
Майкл снова встал на ноги и не позволил диагнозу замедлить свою жизнь. Он начал собственное дело, основал инвестиционный фонд и вложил туда свои деньги и деньги родственников и друзей. Он потратил годы на разработку алгоритмов, помогающих выиграть хотя бы в половине сделок на рынке ценных бумаг. Это позволило ему попасть в 1 % самых богатых людей. Он рассказал, что привык корректировать свои коммерческие стратегии раз или два в году. Но в последнее время, по мере того как в этой области становилось все больше участников и росла конкуренция, ему приходилось пересматривать свои компьютерные алгоритмы раз в месяц или даже чаще. По словам Майкла, фонд процветал, пусть и с некоторыми головокружительными подъемами и спадами, прибавившими ему несколько седых волос. Однако Майкл был скрупулезным парнем, который верил в написанные им алгоритмы, держал свои эмоции под контролем и умел в суете увидеть суть. Скоро я получил возможность наблюдать, как он применяет свой аналитический детализированный подход к своей болезни.
Я встретился с Майклом в Манхэттене в том безымянным ресторане вдали от Мэдисон-авеню. Это не было злачным заведением: обстановка в стиле конца XIX в., расположенные отдельно друг от друга столы, чтобы можно было вести доверительные разговоры, и блюда континентальной кухни. Я до сих пор не знаю названия этого ресторана и есть ли у него номера телефона. Майкл был высокого роста и с узким лицом. У него были светлые волосы, небольшие залысины и усы. Одетый немного официально, он носил сшитый на заказ изысканный костюм темно-серых и синих тонов. Он быстро и четко говорил, в его речи безошибочно узнавался немного суховатый акцент выпускника Лиги плюща. Из-за полипоза и мозаицизма Майкл буквально подсел на генетику. Он запоем читал все статьи по этой теме. Он секвенировал свой геном в частной клинике и из соображений конфиденциальности хранил копию результатов на жестком диске, отдельно от своей медицинской карты. Он уже общался со многими медицинскими генетиками и теперь хотел бы узнать мое мнение по ряду вопросов. Он внимательно изучил информацию обо мне и даже прочитал некоторые из моих научных статей о генетике рака толстой кишки.
Майкл заработал много денег, заставляя законы вероятности работать на себя. Он хотел сделать то же самое и с генетической информацией. Он сказал, что «не любит играть в покер вслепую».
Он был восхищен тем, что узнал о своих генах. Особенно Майкла позабавило, что, несмотря на его высокий интеллект, доля неандертальских генов в его геноме была необычно высока. У него, как и примерно у 1 % всех мужчин, среди предков был Чингисхан, об этом свидетельствовали особенности его Y-хромосомы. Секвенирование выявило у него аллель, который немного ухудшает переваривание лактозы, и действительно, когда он ел молочные продукты, у него бывало легкое вздутие живота. Но Майкл хорошо понимал, что это все праздные разговоры.
С медицинской точки зрения были более серьезные особенности, которые он хотел со мной обсудить. Майкл серьезно беспокоился о здоровье и профилактике заболеваний. И он очень хотел, чтобы отсеквенированный геном этому помог.
Из-за сексуальной ориентации у Майкла была высокая вероятность заразиться гепатитом C. При этом у него была фармакогенетическая особенность, обеспечивающая наилучший ответ на противовирусные препараты, применяемые для лечения этого заболевания. Он был расстроен, что у него нет того аллеля гена CCR5, который эффективно защищает от ВИЧ. Однако он считал, что лучше знать, чем не знать.
Кроме того, предыдущий генетический консультант рассчитал, что у Майкла на 20 % выше вероятность того, что к 50 годам случится сердечный приступ. Сам Майкл не был согласен с методом, используемым для расчета этой вероятности, потому что там имелось множество допущений. Так, предполагалось, что риск связан с повышенным кровяным давлением, однако у Майкла его пока не было. Это заставило Майкла сомневаться в статистическом методе, используемом для такой количественной оценки. Было очень интересно общаться с пациентом, разделяющим мою страсть к генетическим тонкостям. Я закончил свой обед задолго до Майкла и теперь просто сидел и слушал.
Майкл понимал, что большинство генетических предрасположенностей – это сложные признаки. Гены и факторы среды взаимодействуют такими хитрыми способами, что мы, как правило, не знаем точно, что именно делают те или иные варианты генов и внешние факторы. Он понимал также, что без серьезного семейного анамнеза и без очевидных мутаций в генах, вызывающих заболевания сердца, очень сложно оценить риск для конкретно его комбинации аллелей, многие из которых никогда ранее не были описаны в научной литературе.
Тем не менее Майкл тщательно следил за своим рационом и уровнем холестерина. Его подход заключался в оценке не относительного, а абсолютного риска развития заболеваний. И теперь он был уверен, что для большинства болезней этот риск очень низкий.
В то же время Майкл не видел особого смысла в том, что говорил врач, направивший его на генетический анализ. Большую часть своих открытий Майкл сделал самостоятельно, используя PubMed – интернет-ресурс для поиска по научным публикациям (многие из которых доступны бесплатно){40}. Этот ресурс спонсируется Национальными институтами здравоохранения США и доступен каждому.
Довольно долго Майкл жаловался на низкое качество многих генетических исследований и что «мы» (генетики) работаем плохо, а должны работать лучше. Также он пожаловался, что у большинства врачей по сравнению с людьми, работающими в области экспериментальной экономики, низкий интеллект и они не умеют хорошо считать, кроме тех случаев, когда речь идет об оплате их услуг.
Майкл привык к методам, позволяющим расправиться с огромным объемом данных в экспериментальной экономике. Он мог бы придумать идею коммерческой стратегии, многократно протестировать ее на разных больших наборах данных, чтобы повысить надежность, и делал это быстро. В то же время он был расстроен отсутствием в генетике таких огромных массивов данных. Это мешало ему разобраться со своим геномом, несмотря на жажду получить эту информацию. Я предположил, что для работы с такими объемами данных мировому сообществу потребуется секвенировать геномы миллионов людей и сопоставить все их электронные медицинские карты с найденными вариантами генов. Я сказал, что, вероятно, понадобится некоторое время, чтобы заставить людей задуматься над этой идеей, и что для этого нужны крупные начальные инвестиции от мецената. К сожалению, Майкл, похоже, не стремился выступить в этой роли.
Однако главный вопрос, с которым хотел разобраться Майкл, секвенируя свой геном, касался риска развития рака. Майкл был мозаичным, и он был очень озабочен вопросом, почему он получил рак толстой кишки в таком раннем возрасте, ведь это означало наличие неопределенно высокого риска возникновения рака где-нибудь еще в организме. Если примерно каждый пятый может прожить всю жизнь с такой же мутацией, но без раковой опухоли, то почему Майкла коснулось это еще в молодости? Он не сумел найти в своем геноме такие взаимодействия, которые могли бы это объяснить. С его точки зрения, оставалось еще много непонятного.
Наконец он меня озадачил самой главной проблемой, ради которой в первую очередь и затевалась эта встреча. Дело касалось дыма. Но не сигаретного, а дыма для копчения рыбы.
Майкл хотел понять, может ли его питание повлиять на риск развития рака. В частности, он все говорил и говорил, как ему нравится копченый лосось. Он каждую неделю с удовольствием ел самого лучшего копченого лосося еще со времен своего детства, проведенного в окрестностях Нью-Йорка. Майкл выезжал на спортивную рыбалку в Финляндию, Ньюфаундленд и Аляску в поисках идеального лосося. Это была его страсть, граничащая с одержимостью.
Для людей, у которых хорошо исправляются повреждения в ДНК, такая диета была бы нормальной, но в желудочно-кишечном тракте Майкла исправление повреждений было нарушено. Прочесав свой геном в поисках причины рака, он предположил, что виновато взаимодействие генов и факторов среды. Могла ли мутация вместе с избытком копченого лосося, которого он ел с детства, привести к развитию рака толстого кишечника? Похоже, питание влияет на общий риск возникновения рака толстого кишечника и на развитие различных синдромов, связанных с исправлением ДНК. Майкл ознакомился с литературой, в которой было описано, что у семей, которые столетиями подвергались высокому риску развития рака желудка, это заболевание перестало возникать после появления холодильников и снижения содержания нитратов в пище. Майкл хотел узнать, может ли он продолжать есть своего любимого копченого лосося или это опасно?
С точки зрения Майкла, стоимость ежегодной колоноскопии и МРТ вкупе с причиняемыми ими неудобствами были вполне приемлемы. Однако его аппетит и разум не могли договориться друг с другом. Это странная ситуация, но она очень распространена среди моих пациентов (конечно же, и среди всех людей в целом). Даже после того, как Майкл глубоко разобрался в собственном геноме и хорошо изучил механизмы развития полипоза, связанного с геном MYH, перспектива отказаться от чего-то, что он так сильно любит, возмущала его до глубины души.
Я сказал Майклу, что есть уйма вопросов, многого мы вообще не знаем. Мы пока копнули совсем неглубоко. Некоторым читателям может показаться, что вопрос про копчености несколько странный, но на самом деле это очень разумный вопрос. Многие вопросы подобного рода просто пока не имеют однозначных ответов. Может быть, мы никогда не сможем найти достаточно пациентов, чтобы получить статистически значимые данные для ответа, каким бы жизненно важным ни был вопрос Майкла. Ни у него, ни у нас еще долго не будет возможности применить подходы, используемые в экспериментальной экономике к данным генетики. Возможно, они не появятся никогда.
Итак, что мы пока можем сделать? Как быть, если у нас нет необходимой информации? Мы могли бы на скорую руку вывести собственное соотношение риска и выгоды для этой ситуации. В тот день во время обеда с Майклом я по старой традиции начал записывать все известные плюсы и минусы на обратной стороне салфетки.
Самые хорошие и эффективные клинические рекомендации строятся на принципах доказательной медицины. Этот термин придумал Дэвид Эдди – врач, медицинский аналитик и математик. В 1990 г. он определил доказательную медицину как «точное описание доказательств, имеющих отношение к медицинским процедурам, и выбор процедур на основе доказательств» с целью лечения конкретных пациентов{41}.
Чтобы дать Майклу наилучшие рекомендации на основе особенностей большинства его генов, у нас было недостаточно данных. Хотя про полипоз, связанный с геном MUTYH, существует обширная научная литература, описывающая, как с ним справиться в клинике. Получить генетические данные относительно просто. Гораздо сложнее дать Майклу те точные практические советы касательно профилактики, которых он требовал. Не существовало ни клинических исследований, ни многочисленных работ в области молекулярной эпидемиологии, которые позволили бы ответить на вопрос, засевший в голове у Майкла. А пока что, не имея всего этого, нам надо было сделать наиболее вероятное предположение. Поедание копченого лосося действительно может быть вредно для Майкла, но на самом деле у нас нет возможности узнать, насколько серьезными могут быть последствия. Может быть, он никогда не заболеет раком, даже съев тонну копченостей. Его может сбить машина или даже убить самолет, врезавшийся в здание задолго до того, как у него разовьется рак. На 100 % было известно лишь то, что Майкл любит копченую лососину.
Майкл был расстроен, исчерпав возможности современного генетического знания. В конце концов тяга к вкусу детства взяла верх над его высоким интеллектом. Этот любитель риска, успешно играющий с вероятностями, решил, что в отсутствие однозначной информации он продолжит есть своего любимого копченого лосося. Субъективная польза перевесила субъективный риск.
Примерно год спустя я разговаривал c Майклом. В оставшейся части толстой кишки у него нашли и удалили два быстрорастущих полипа. Он еще раз обдумал эту тему и пересмотрел свое решение, хотя все еще любит копченого лосося. Сейчас он ест его в меньших объемах и бережет до особого повода. Он обнаружил, что теперь, когда он из предосторожности ест рыбу значительно реже, он получает от этого большее удовольствие.
Глава 5 Неприятные находки
Я опаздывал, пытаясь успеть на вечернюю встречу – ужин с коллегами в честь визита онколога, известного клинического специалиста по раку толстой кишки из Клиники Мэйо. Утром следующего дня почетный гость читал лекцию. Отдавая дань уважения доктору, мы встретились в районе Ист-Сайд в итальянском ресторане Felidia. Этот ресторан получил признание, эквивалентное Нобелевской премии для итальянской кухни: там ужинал Папа, конкретнее – Его Святейшество Папа Бенедикт XVI. Когда я добрался, все уже сидели за столом. Мне сразу рассказали о нескольких недавних интересных пациентах, которые, казалось, имели отношение ко мне как к парню, который занимается генетическими тестами. Один из них особенно привлек мое внимание.
В свои почти 50 лет Тим Реггерс был успешным предпринимателем в области технологий и программного обеспечения. Он был родом из Нью-Йорка и летом жил здесь, а зиму проводил во Флориде. Он использовал свои знания гелиотехники и материаловедения, чтобы создать наилучшую конструкцию для преобразования солнечного света в электроэнергию. После продажи пары стартапов у него появилось свободное время. Тим с женой недавно вернулись из месячного путешествия. Они посетили технологическую конференцию в Северной Европе и гольф-клуб в Шотландии. Поездка была одновременно приятной и полезной, а по дороге они приобрели новую модель BMW. Но в путешествии человек всегда попадает в новую обстановку. Новая еда, новые впечатления, новый климат. У Тима начали необычно зудеть руки, ноги и все тело. У него появилось что-то похожее на диарею путешественника, но ничего необычного в этом не было. Тим не испытывал ни малейшего беспокойства и вообще чувствовал себя довольно хорошо, только аппетит немного снизился.
Возвращаясь из Европы в Нью-Йорк, он совершал пересадку в международном аэропорту Амстердама. Жена Тима заметила, что его кожа выглядела необычайно темной. Хотя Северная Европа и занимает лидирующее положение в области гелиотехники, туда обычно не ездят загорать. Действительно, погода во время их путешествия была скорее пасмурной и дождливой. Жена также заметила, что белки глаз Тима не такие белые. Скорее, они были желтые. В том же аэропорту они посетили медицинский пункт. Там невозмутимый врач скорой помощи сказал, что у Тима гепатит, который и вызвал желтуху.
Желтуха возникает, когда печень работает неправильно. Печень избавляется от старых эритроцитов, превращая их в желчь, которая выводится через кишечник. Гепатит был самым вероятным объяснением его поноса, желтых белков глаз и бронзового цвета кожи. Тима явно ничто не беспокоило, кроме слегка сниженного аппетита. Ему рекомендовали посетить своего врача в Нью-Йорке, он должен был сделать это после прибытия в аэропорт имени Джона Кеннеди следующим утром. Все казалось довольно обычным и не особенно срочным, поэтому Тим счел, что ему важнее после возвращения навестить своих пожилых родителей.
По возвращению в Нью-Йорк Тим встретился со своим терапевтом, и тот подтвердил, что содержание ферментов печени повышено. Комплекс тестов показал, что печень на самом деле работает нормально, но не происходит правильного оттока желчи в тонкий кишечник, поэтому возникает бронзовый цвет кожи. Врач предположил, что у Тима маленькие желчные камни, которые блокируют желчные протоки, что обычно, но не всегда приводит к боли в правом верхнем квадранте живота. Однако с помощью компьютерной томографии брюшной полости никаких камней не обнаружили. Не было выявлено и других отклонений – опухолей, увеличенных лимфоузлов. Протоки были немного расширены, но в этом не было ничего специфичного. В целом у Тима не было ничего, что могло бы вызвать вопросы у врача.
У матери Тима в возрасте 40 лет был рак желудка. К счастью, симптомы проявились сразу, поэтому тревогу подняли вовремя, болезнь была обнаружена и успешно вылечена. Однако наличие близкого родственника с раком пищеварительной системы заставило домашнего врача задуматься.
Семейный анамнез в сочетании с неопределенностями в диагнозе побудил врача направить Тима на эндоскопическое ультразвуковое исследование. При выполнении этой процедуры тонкая гибкая трубка эндоскопа вводится через рот в желудок и далее по желчным протокам, соединяющим печень и желчный пузырь с тонким кишечником. Через ветвистую сеть протоков желчь выделяется в кишечник, чтобы помочь пищеварению. На кончике эндоскопа есть миниатюрный ультразвуковой датчик, который позволяет выявить аномалии вроде раковых клеток. Ультразвуковое исследование показало, что действительно около желчного пузыря в протоке есть грибовидное образование. Биопсия ткани из этого выроста выявила раковые клетки.
При исследовании не обнаружилось никаких аномалий в других органах, и Тима направили на операцию Уиппла, названную так в честь американского хирурга, который в 1930-х гг. усовершенствовал и без того сложную хирургическую процедуру, впервые описанную в 1898 г.
Мы используем эту процедуру уже более века. Операция, которую модифицировал Уиппл, заключается в удалении нижней половины желудка, желчного пузыря и его протоков, а также примерно двух третей поджелудочной железы, первых нескольких десятков сантиметров тонкого кишечника и лимфоузлов (где раковые клетки могут накапливаться и разрушаться иммунной системой). Дальше начинается процесс реконструкции. Верхняя часть желудка, хвост поджелудочной железы и печень прикрепляются к оставшейся части тонкого кишечника.
Это одна из самых изнурительных и обширных хирургических операций, которая может длиться часами. Она требует значительной выносливости как от пациента, так и от операционной бригады. Даже сегодня после нее не выживает примерно один из 20 или 50 человек, в зависимости от хирургов и больниц. Пациент может потерять более трех литров крови, а удаление большей части поджелудочной железы может затруднить поддержание постоянного уровня глюкозы в крови.
Цель этой операции – добиться полного исцеления. Поскольку вмешательство очень сложное и рискованное, на него идут только в том случае, когда можно удалить все раковые клетки до последней. Повреждения и риск не будут иметь смысла, если рак вернется снова.
В бета-клетках поджелудочной железы вырабатывается гормон инсулин, отвечающий за контроль уровня сахара в крови, поэтому иногда, если удалена слишком большая часть поджелудочной железы, после операции пациент может стать диабетиком. Но если все прошло хорошо, пациент и его пищеварительная система начинают восстанавливаться, это длительный процесс, который будет успешным при наличии терпения и большой заботы со стороны близких и специалистов по реабилитации.
Будучи студентом-медиком, я участвовал в нескольких операциях Уиппла. После открытия брюшной полости задача студентов, дежуривших в операционной, была удерживать в течение нескольких часов хирургический ретрактор, который помогал сохранять большой разрез открытым, чтобы все внутренние органы были видны и доступны для хирурга. Нам советовали не выпрямлять колени и не стоять слишком ровно, так как несколько часов в такой позе могут привести к тому, что кровь уйдет в ноги и студент упадет в обморок в операционной.
Операция Уиппла у Тима длилась более четырех часов. Все получилось, как и было запланировано. Большая часть поджелудочной, начало тонкого кишечника там, где он прикреплялся к желудку, и желчные протоки были вырезаны en bloc (то есть единым блоком), как и положено при этой процедуре.
Операционная бригада успешно выполнила свою задачу, но многое еще оставалось сделать. Изъятую ткань надо было отправить патологоанатомам для визуальной диагностики и проведения исследований. И хотя этим врачам никогда не достается звездной славы хирургов, от незаметной работы внимательного и умного патологоанатома может зависеть жизнь пациента.
Суть науки и искусства патологоанатомии – в распознавании образов. В процессе просмотра тысяч изображений, каждое из которых – тонкий срез ткани, у патологоанатома развивается способность интуитивно различать диагнозы. Это немного похоже на обучение микроскопии. Представления каждого патологоанатома и умения находить закономерности для диагноза были сформированы его наставником так же, как это происходит у экспертов-искусствоведов. Наставников, в свою очередь, учили их собственные наставники. Таким образом, в каждой больнице есть свои традиции патологоанатомической диагностики, а универсальные критерии или стандарты, общие для нескольких больниц, встречаются редко.
Субъективные суждения бывают не менее значимы, чем объективные. Патологоанатомы из одной больницы чаще соглашаются между собой насчет большинства диагнозов, чем те, кто работает в разных учреждениях. Особенно это выражено для редких заболеваний, с которыми мало опыта работы. Помимо внутренней культуры больниц, которая формируется наставниками, иногда существует еще и эффект авторитета, когда все собравшиеся в одной комнате и рассматривающие один и тот же объект пытаются сделать заключение, отражающее мнение либо самого опытного, доминирующего и немолодого врача, либо врача, который говорит четче, громче и самоувереннее остальных{42}.
Когда патологоанатомы рассмотрели под микроскопом часть желчных протоков, которая называется фатеров сосочек, где ранее с помощью УЗИ было обнаружено выпячивание, они увидели вырост, выступающий над протоком. Эта опухоль была размером с ноготь большого пальца (примерно 1 см), внешне похожая на маленькое соцветие брокколи, а ниже располагался сантиметрового размера другой комочек патологических клеток, вросший прямо в основной проток. Но были и хорошие новости: по-видимому, раковые клетки не начали метастазировать.
Патологоанатомы обработали образцы, взятые из опухоли, с помощью почти тех же методов, которые применялись более 100 лет назад, когда клетки окрашивали веществами, изначально используемыми для покраски женской одежды, и полученные препараты обследовали под микроскопом, освещая их снизу. Специалисты охарактеризовали эти раковые клетки как «недифференцированные». Их ядра были похожи на большие, расширенные и злые зрачки глаз. Они были разбухшие, с неупорядоченным, неравномерно распределенным хроматином – молекулами ДНК, намотанными на белки как пряжа на катушки. Словно зомби, эти клетки превратились в нечто ужасное из-за генетических нарушений.
Когда раковые клетки дышали кислородом, питались и делились, образуя дочерние клетки, они вырабатывали вещества, которых нет в здоровых клетках, поэтому их окраска отличалась. Клетки опухоли имели темный оттенок. Их зернистая цитоплазма была дымчато-красной. Ткань, взятую для исследования, обработали формалином и залили воском, чтобы сохранить и зафиксировать клетки и то, что было вокруг них. Затем изготовили тонкие срезы толщиной с человеческий волос и поместили на специальные адгезивные стекла для детального изучения патологоанатомом. С помощью визуального осмотра и других тестов, выявляющих различные белки, подтвердили, что это раковые клетки, произошедшие от клеток желчных протоков. Другой тип лабораторных анализов, в котором используются антитела, чтобы показать наличие или отсутствие различных опухолевых белков, также подтвердил, что это был рак желчных протоков, а не какой-то другой, чьи метастазы занесло сюда. Такую форму рака сложно вылечить. Желчь производится печенью для участия в пищеварении, и клетки, образующие протоки, приспособлены к сложным химическим условиям. Так же как и зомби, раковую опухоль, выжившую в желчных протоках, сложно убить.
Далее возникал вопрос: какого именно типа эта раковая опухоль? Ответ на него важен, потому что от этого зависит, какие противоопухолевые препараты Тим должен принимать.
Раньше, в XX в., диагноз был бы простой – «рак желчных протоков». Часто говорят, что вся история медицинских исследований – это перетягивание каната между двумя лагерями врачей: объединителей и разделителей. Чтобы разобраться в различных болезнях, врачам надо упорядочить их по признакам и симптомам, по причинам или по механизмам, лежащим в основе заболевания. «Объединители» ищут общее в разных болезнях. «Разделители» пытаются разобраться, как похожие на первый взгляд заболевания вызываются на самом деле разными причинами. В целом в последние несколько столетий разделители уверенно вырываются вперед.
В своей практике, когда я работаю с семейным анамнезом, то часто слышу, что чья-то бабушка умерла от «рака в животе» – и больше никаких подробностей. Или отец пациента умер от рака почек или кишечника. Такое общее описание отражает развитие медицины того времени, когда было мало известно про разные типы новообразований, возникающих в одном и том же органе. И сегодня считается нормальной сложившаяся практика наименования разных форм рака по органу их возникновения (рак легких, рак толстой кишки, рак груди и т. д.). Однако, после того как недавно было признано, что рак – это в первую очередь болезнь ДНК, классификацию начали менять, упорядочивая эти заболевания более точно по тому, какие мутации несут опухолевые клетки.
Патологоанатомы нашли то, что стало главной подсказкой для определения типа рака у Тима. Его опухоль была заполнена большим числом лимфоцитов – хорошо узнаваемых иммунных клеток. Это маленькие круглые клетки с небольшим объемом цитоплазмы, поскольку большая часть их занята ДНК-содержащим ядром. Они – часть адаптивной иммунной системы. Предполагается, что эта система возникла примерно 5 млн лет назад у древних челюстных рыб, чтобы бороться с инфекциями, а также, возможно, и с раковыми опухолями. Однако подобные клетки наблюдаются и у просто организованных животных, таких как радиально-симметричные морские ежи. Иногда приходится бить противника его же оружием, и адаптивная иммунная система использует мутации во благо: для борьбы с нашими врагами и ликвидации чужеродных объектов – бактерий, вирусов, а также и раковых клеток.
Это эволюционная война. Каждая из сторон использует мутации и эволюцию, чтобы победить противника. Элитные подразделения спецназа, состоящие из 10 млн T- и B-лимфоцитов, несут на своей мембране белки, похожие на трехмерные замки`, которые в результате комбинации различных мутаций могут принимать почти любую форму. Благодаря процессу, который называется гипермутация, можно с помощью небольшого числа генов, кодирующих эти белки, создавать огромную и разнообразную армию, имеющую буквально миллиарды различных вариантов белков.
Во время этой борьбы T- и B-клетки заглядывают в каждый уголок нашего тела в поисках подходящих «ключей» в виде чужеродных организмов. Большинство этих клеток никогда не найдет инфекционного захватчика с ключом подходящей формы. Однако штабные помощники, которые называются антигенпрезентирующие клетки, помогают T- и B-лимфоцитам найти ключи. И в том редком случае, когда одиночный лимфоцит обнаружит подходящий ключ, которого в норме нет в организме, антигенпрезентирующая клетка запускает процесс клональной экспансии. Он заключается в том, что горстка лимфоцитов начинает быстро и многократно делиться, формируя армию вооруженных лимфоцитов, готовых защищать наш организм. Так армия адаптивного иммунитета получает дополнительные клетки для участия в атаке.
Когда эти T- и B-лимфоциты связываются с белками чужеродной формы на раковых клетках, окружают клетки и атакуют их, такие лимфоциты называют интратуморальными (проникающими в опухоль). Их присутствие – хороший признак по двум причинам. Во-первых, это значит, что иммунная система пациента работает исправно и оказывает сопротивление чужим белкам опухоли (многие формы рака могут сопротивляться и подавлять иммунную систему организма с помощь множества подлых приемов). Во-вторых, это показывает, что на поверхности клеток этого конкретного рака есть специфические белки, и проникающие в опухоль лимфоциты могут их узнать и взаимодействовать с ними при атаке. Таким образом, присутствие лимфоцитов в опухоли – хороший знак. Их многочисленность повышала шансы Тима на победу.
Число интратуморальных лимфоцитов у Тима было необычно велико. То, как они теснились и толкались, стараясь добраться до раковых клеток и вступить с ними в бой, напомнило патологоанатому картину, которую можно часто наблюдать при синдроме Линча (раке толстой кишки). Как уже обсуждалось раньше, мутации в клетках этой опухоли встречаются на порядок чаще, чем в норме, из-за того, что повреждена система исправления ДНК. И поэтому такие клетки синтезируют белки с чужеродной формой, которую может распознать адаптивная иммунная система. Как следствие, в таких образованиях очень много интратуморальных лимфоцитов. И хотя рак желчных протоков при синдроме Линча встречается довольно редко – всего у нескольких процентов пациентов, наблюдение патологоанатома вкупе с раком желудочно-кишечного тракта в семейном анамнезе послужили причиной проведения генетического анализа.
Онколог направил пациента на прием к медицинскому генетику, и я встретился с Тимом и его женой в клинике через несколько месяцев после операции Уиппла. У него не было аденом сальных желез – доброкачественных кожных образований, которые часто встречаются при синдроме Линча и могут подсказать нам ДНК-диагноз. Тим держался уверенно, был в хорошем настроении и начал набирать вес. У него был вид человека, решившего делать все, что нужно, для выздоровления. Его энергичный взгляд говорил, что Тим зол на свою болезнь и хочет покончить с ней. Такой энтузиазм передается врачу, так что доктор и пациент становятся верными соратниками. Мы сделали анализ ДНК крови и обнаружили, что у Тима мутация в гене MSH6. Это одна из редких причин синдрома Линча. Мутация была расположена не в той области гена, которая кодирует белок, а в соседней части, отвечающей за правильное вырезание и сшивание РНК.
Центральная догма молекулярной биологии гласит, что на основе ДНК создается РНК, на основе которой потом с помощью рибосом синтезируется белок. Для многих генов, в том числе и MSH6, РНК формируются отдельными фрагментами, которые затем сшиваются вместе, образуя код для полноценного белка. В нашем случае из-за мутации один участок РНК не соединялся с соседним фрагментом, поэтому последняя часть белка не синтезировалась.
В норме это не порождает проблем, поскольку у нас есть запасная копия большинства генов, которая работает взамен испорченной. Можно провести аналогию с двумя глазами: если мы травмируем правый, то левым еще сможем видеть. Однако у Тима в какой-то момент его жизни в изначально здоровой клетке в глубине желчных протоков произошла поломка и второй копии гена MSH6. Следовательно, этот ген не смог исполнять роль защитника генома в этой единственной судьбоносной клетке, которая изменила всю жизнь Тима. По мере того как эта клетка многократно делилась, она воспроизводила свою ДНК со множеством ошибок, что в конечном счете и привело к онкогенезу – появлению раковых клеток.
Большое число ошибок объясняет и причину, по которой было так много интратуморальных лимфоцитов. Клетки этой конкретной опухоли синтезировали белки со многими «опечатками», потому что белок MSH6, служащий для проверки и исправления «орфографии» ДНК, был утерян. Лимфоциты связывались с этими новыми молекулами, появляющимися на поверхности клетки. Поскольку иммунная система Тима никогда раньше не встречала таких белков, она атаковала раковые клетки точно так же, как клетки, зараженные вирусом.
Восстановление после операции Уиппла непростое, но Тим медленно и уверенно шел на поправку. У Тима не было диабетических проблем, потому что оставшейся части поджелудочной железы хватало, чтобы вырабатывать инсулин и контролировать уровень сахара в крови. Ему стало сложнее полноценно питаться, так как его желудок теперь был более чувствителен к потребляемой пище. Поскольку Тим потерял некоторое количество пищеварительных ферментов поджелудочной железы, он принимал их в виде таблеток четыре раза в день, и это помогло ему набрать около 7 кг после операции.
Затем было ужасное испытание, через которое проходят все онкологические пациенты: наступил день, когда проводят обследование, чтобы проверить, не вернулся ли рак. Тим и его жена облегченно выдохнули, когда узнали, что компьютерная томография брюшной полости не выявила никаких признаков опухоли.
Тим продолжал выздоравливать и набираться сил, надеясь оставить все это в прошлом и жить дальше. Поскольку был выявлен синдром Линча, Тим прошел колоноскопию и эндоскопию желудка и мог планировать дальнейшие диагностические процедуры, чтобы не допустить появления других проблем, связанных с этим синдромом.
Это случилось в конце лета, когда Нью-Йорк был расслаблен, разморен и относительно безлюден. Наконец-то на «аллее больничных уток» можно было легко найти недорогое такси. В один дождливый и ничем не примечательный день Тим вернулся в клинику, чтобы пройти еще ряд тестов, через полгода после предыдущих. Результаты оказались не такими, как мы надеялись. У него обнаружилось три новых неопознанных ярких пятна неправильной формы в печени – неподалеку от места операции Уиппла. Другой анализ подтвердил то, чего никто из нас не хотел бы услышать. Рак Тима вышел из тени. Поскольку желчь из печени стекает по протокам вниз, некоторые раковые клетки, по-видимому, поднялись против течения вверх или, возможно, попали в печень с другой стороны из окружающей соединительной ткани. Хорошо хоть, что был один обнадеживающий признак – за пределами печени не было признаков опухоли.
Теперь в жизни Тима начался новый этап: он попал в сложный мир химиотерапии. Стандартный набор препаратов для рака желчных протоков в среднем продлевает жизнь всего на несколько месяцев и, как правило, не приводит к излечению. Это было не то, что нужно Тиму. Он чувствовал себя хорошо и согласился на новый интенсивный режим, обозначаемый труднопроизносимым акронимом FOLFIRINOX. Иначе говоря, при лечении используются несколько препаратов (в данном случае четыре), и они сильнодействующие. Мои пациенты, принимающие такую смесь лекарств, сравнивали возникающие ощущения слабости и болезненности с тем, будто «большой мул ударил копытом в грудную клетку». Среди прочего в этот набор входит оксалиплатин (вещество, повреждающее ДНК: оно было открыто при наблюдении за гибелью бактерий при взаимодействии с платиной), иринотекан (препарат, проникающий почти в каждую клетку тела и блокирующий раскручивание спирали ДНК при делении) и 5-фторурацил (который похож на тимидин и может встраиваться в нуклеиновые кислоты, делая их более хрупкими и разрушающимися изнутри). В войне против редкой формы рака Тима эти вещества должны были начать батарейный огонь и убить наиболее быстро делящиеся клетки. Этот способ редко используется для атаки на «хемонаивные» опухоли (которые никогда ранее не подвергались химиотерапии) отчасти из-за того, что пациентам трудно переносить побочные эффекты, которые могут быть очень серьезными.
Однако, по общему мнению, потенциальная польза от мучительного и редкого лекарства против рака желчных путей перевешивала мучения. И хотя никому не нравится, когда его лягает мул, эти чудодейственные вещества давали небольшой, но ощутимый шанс на исцеление. Удар наносился с благими целями.
Тиму назначили четыре цикла инъекций FOLFIRINOX. Он прошел их все, держась с оптимизмом, решимостью и упорным желанием победить свой рак. Да, он был утомлен, слаб и помят из-за этой борьбы, но в его печени исчезли все опухоли, кроме двух. Контролируя процесс с помощью рентгена, рядом с этими ужасными пятнами в брюшную полость поместили катетер и разрушили оставшиеся опухоли с помощью высокочастотного излучения.
Три месяца спустя Тим чувствовал себя хорошо, у него были лишь слабые мышечные судороги. К нему вернулся аппетит, и он стал набирать вес. Когда летом Тим сделал очередное МРТ, на снимке не было никаких аномалий.
Затем, осенью, при следующем обследовании выяснилось, что раковые клетки вернулись и разрослись на тех местах, где были уничтожены два пятна. Тиму опять выполнили радиочастотную катетерную деструкцию. Затем еще один круг химиотерапии, уже с меньшим количеством препаратов, которые было легче перенести. Но уже стало ясно, что надо делать что-то еще. Злокачественные террористы защищались, передвигаясь, адаптируясь и постоянно меняя правила игры.
Раньше в онкологии для всех видов рака был принят подход в стиле «одно лечение годится всем». Для распространенных типов раковых опухолей препараты для пациента выбирались на основе доказательной медицины, построенной на широкомасштабных испытаниях. С помощью информации, полученной благодаря этим героическим усилиям, исходя из рациональных соображений, подбиралась определенная комбинация препаратов для химиотерапии. Клинические испытания, упорядоченные, естественно, по месту возникновения раковой опухоли, могут проводиться с участием многих тысяч мужчин и женщин, в них используется статистическая обработка и тщательная диагностика, точная до такой степени, что позволяет выявить разницу в несколько дней жизни при разных способах лечения. Все это предоставляет врачу точную информацию о том, какой способ лечения лучший среди тех, что были доступны на момент проведения исследования.
Этот подход важен для национальной политики в области здравоохранения и для определения того, какие лекарства надо оплачивать. И действительно, качественно выполненные широкомасштабные клинические испытания и доказательная медицина относятся к самым выдающимся достижениям XX в., они способствовали постепенному росту продолжительности жизни. Однако такие работы чрезвычайно дороги, стоимость может достигать более $10 млрд за определенное клиническое испытание. Кроме того, они занимают очень много времени. Как следствие, сейчас есть множество вопросов, для ответа на которые нам не хватает точных данных.
Отчасти поэтому пациенту и его лечащему врачу, непосредственно участвующим в сражении с болезнью, такой подход не всегда годится. Для каждого человека, которому только что диагностировали рак, последствия будут его личными, не статистическим усреднением по сотням или тысячам пациентов. Получая свой план лечения рака, данный конкретный человек хочет, чтобы это было не усредненное решение для среднего гипотетического пациента с серо-коричневой кожей, в которой смешались тысячи разных цветов, а чтобы это была программа, специально разработанная для него или для нее. Этого требует XXI в. Этого требуют наши пациенты.
В борьбе за победу в этой игре Тим и его семья готовы были делать все возможное, чтобы вернуть Тиму жизнь, чтобы с помощью технологий, как на машине времени, возвратиться к тому, что было до того, как ему поставили диагноз. Тима сбивал с толку широкий выбор возможностей. Стоит ли ему остаться дома, принять свою судьбу и максимально увеличить количество времени, проводимое с семьей и друзьями? Или согласиться на экспериментальные препараты и летать туда-сюда из Бостона? Должен ли он гнаться за новыми, связанными с РНК способами терапии, успешно вылечившими от рака мышей в Техасе, но не протестированными на людях? Или отправиться за похожей генетической процедурой в Калифорнию? Чтобы быстро разобраться в теме рака желчных протоков и определить оптимальный план борьбы, Тим искал и взвешивал разные мнения о том, что делать дальше. Он сравнивал и оценивал возможные варианты в Институте рака Дана-Фарбер в Бостоне и в нью-йоркских больницах – Мемориальной и Пресвитерианской, фактически мотаясь между аэропортами Ла-Гуардия и Логан. Таким образом, можно было обговорить и обдумать множество вариантов. Детальное обсуждение и взвешивание всех рисков и преимуществ позволило бы увериться, что построенный на самых современных знаниях план уничтожения микроскопического врага будет точен и надежен.
Затем, чтобы улучшить связь между врачами и выписками в разных организациях и даже на разных континентах, Тим с семьей наняли куратора из PinnacleCare – частной консультативной медицинской службы в Нью-Йорке. Эта служба, помогающая ориентироваться в сложном ландшафте здравоохранения, работает как личная финансовая консультация, но в области здоровья, а не богатства. Она изучает возможности лечащих врачей, представляет независимые медицинские заключения, записывает на прием к труднодоступным специалистам, пытается смягчить риск при принятии решений и делает все остальное, что необходимо. Все это не бесплатно, разумеется.
Медицинским куратором Тима стал бывший работник реанимации. Он сопровождал Тима с семьей в клиники, переводил термины онкологии и генетики на бытовой язык и передавал информацию консультирующим Тима врачам. Они, в свою очередь, изучали ситуацию и советовали, что сделать дальше.
Тим верил в силу современных технологий и стремился точно выяснить, какие мутации произошли в его клетках, чтобы использовать эту информацию для лечения рака. Сейчас, когда мы знаем, что рак возникает из-за повреждения ДНК, меняется вся система понятий, которую используют врачи и ученые для диагностики и лечения. Сегодня мы также знаем, что на генетическом уровне существует огромная неоднородность раковых заболеваний: по некоторым оценкам, количество разных вариантов сопоставимо с числом людей, населяющих Нью-Йорк. Учитывая тысячи и тысячи генетических мутаций, которые могут вызывать то или иное онкологическое заболевание, рак каждого пациента, будь то рак фатерова сосочка или рак груди, имеет свои уникальные особенности. Важно, что медицина, может быть, никогда не встречалась с этими особенностями у какого-нибудь другого пациента.
Это поразительное генетическое разнообразие опухолей плохо укладывается в статистические средние показатели клинических испытаний. Много ли пациентов реагировали на лечение иначе, чем предполагалось на основе статических данных, и насколько сильна была разница? Если обычное снадобье не помогает, каждый мужчина и каждая женщина хотят знать, нет ли где-то на полке другой смеси, которая может победить их рак? Может быть, это препарат для химиотерапии, который обычно не используют для рака в этом органе, но которым успешно лечат другие злокачественные опухоли или вообще используют при других заболеваниях? Пациенты вроде Тима ищут оружие с точным действием, способное метко поразить именно их уникальный рак.
Тим и его семья много слышали из разных источников, в том числе по радио, из рекламы в интернете, от друзей, родственников и нанятого медицинского куратора о новой стратегии борьбы с опухолями – прецизионной медицине. Это совершенно иной подход, отличающийся от традиционной цитотоксической химиотерапии, сила которого скорее в технологии, а не в грубой силе. Прецизионная медицина стремится работать с конкретными, подчас уникальными данными о том, какие именно генетические мутации несет каждая опухоль. Она собирает огромное количество генетической информации об опухолях, нащупывая редкие слабые места у рака, в надежде разработать наилучшую схему атаки на него. С помощью математических алгоритмов и мощных компьютеров, наподобие тех, которые использовались для обработки изображений с беспилотников во время поисков Усамы бен Ладена, исследуются не только хорошо видные даже из задних рядов конференц-зала статистические моды, медианы и средние значения, как в клинических испытаниях, но и малозаметные на графике крайние значения выборки, манящие возможностью исцеления.
Тим подписал согласие пациента, и наша больница отправила образцы его рака желчных протоков. Онколог и больница послали стекла с микрометровыми срезами опухоли для анализа в молодую компанию молекулярной диагностики в Массачусетсе. Это стоило около $6000. Страховая компания Тима отказалась оплачивать счет. Однако из-за особенностей работы медицинской системы в условиях свободного рынка эта компания все равно сделала для Тима анализ, даже притом, что за него никто не заплатил. Это отдельная история, почему биотехнологические компании предпочитают терять деньги сейчас, но при этом захватывать быстроразвивающийся сектор (в данном случае это генетическая диагностика рака), чтобы выиграть в долгосрочной перспективе. Генетическое тестирование без оплаты может принести большую пользу пациентам, которые были первыми пользователями этой, только зарождающейся передовой технологии. Тусклую, полупрозрачную ткань опухоли, прилипшую к стеклу, под большим увеличением с помощью скальпеля из хирургической стали отделили от нераковой ткани и упаковали в пластиковую пробирку. Туда добавили фенол, этиловый спирт, соли и другие реактивы, чтобы очистить ДНК от фрагментов и обломков клеток. Затем ДНК, которая представляла собой незаметную точку на дне пробирки, амплифицировали и разделили на отдельные фрагменты, пропустив через агарозный гель, сделанный из водорослей, собранных в «зарослях» в Тихом океане у берегов Калифорнии. Потом для подготовки ДНК к секвенированию добавили ферменты, в том числе выделенные из бактерий, обитающих в термальных источниках парка Йеллоустоун в Вайоминге. Далее после небольшой подготовки триллионы коротких ДНК фрагментов из опухоли Тима были размещены на маленьких шариках. С фрагментами ДНК связывались комплементарные нуклеотиды, и этот процесс непрерывно фотографировался, чтобы определить точную последовательность нуклеотидов для каждого такого шарика.
Чуть более 200 генов из клеток опухоли Тима были параллельно отсеквенированы в поисках мутаций. И хотя это только около 1 % от всех генов, мы нацелились именно на них по одной важной причине: нарушения работы этих генов на сегодняшний день поддаются лечению. Это используется для нового, более точного способа классификации разных форм рака взамен старого, основанного на местоположении опухоли.
Если мы найдем у Тима такие мутации, это означает, что мы сможем применить существующие методы терапии, чтобы заблокировать те клеточные реакции, которые приводят к разрастанию опухоли. Например, для лечения рака желчных протоков обычно не используют препараты, тормозящие работу мутировавшего гена BRAF, который способствует размножению раковых клеток. Однако если анализ выявит у Тима именно такую мутацию, то Тим станет счастливым исключением и для него эти лекарства будут работать. Это значит, что его болезнь можно контролировать лекарством в виде таблеток без сильных побочных эффектов, ему, возможно, не понадобится пластиковая порт-система для химиотерапии на правой стороне груди и он не получит еще одного удара от огромного мула. А если обнаружится мутация в гене AKT1, значит, Тиму надо попасть в больницу в Германии или в Калифорнии и получить недавно синтезированное низкомолекулярное средство, действующее именно при нарушениях в этом гене (или, может быть, всего лишь горькую таблетку плацебо). Если бы карты легли так, что обнаружилась бы комбинация мутаций, поддающихся воздействию лекарств, что ж, это было бы похоже на флеш-рояль или выигранный джекпот.
Почему бы тогда не проверить все 20 000 генов Тима за $10 000–15 000? В конце концов, это дешевле многих хороших лекарств от рака или стоимости недельного пребывания в больнице. К тому же врачи любят информацию. Однако в данном случае по ряду причин стрелка весов склонилась в сторону «лучше меньше, да лучше».
Помните, что заветная цель прецизионной медицины – найти, как вылечить рак. Единственный вопрос, который серьезно волновал Тима и его семью, – какое именно лекарство точно убьет его опухоль. Если бы мы решили секвенировать весь раковый геном или его большую часть, то получили бы терабайты информации, которая по большей части ничем не помогла бы при выборе лучшей терапии для Тима. Это известная проблема современной прецизионной медицины. Наша способность получить генетическую информацию пока сильно опережает нашу способность понять значение той или иной находки, чтобы подобрать наилучшее лечение для пациента.
Кроме того, специалисты в области секвенирования ДНК знают, что существуют важные типы мутаций, которые в настоящее время могут остаться незамеченными даже при использовании самых современных технологий. Чтобы выяснить последовательность нуклеотидов в гене, все фрагменты ДНК объединяются с помощью компьютерной программы. Этот процесс похож на составление пазла, где из отдельных кусочков можно собрать целую картинку. Однако большинство генов у нас находится в двух копиях. Итак, представьте себе, что вы собираете пазл, где у каждого фрагмента есть копия, а чтобы было еще «веселее», там присутствует куча случайных фигурок, которые вообще не подходят к данной картинке (это потому, что при секвенировании качественные ДНК последовательности всегда смешаны с мусором). Если у вас в конце концов получилось собрать все фрагменты в единую картину и в какой-то из копий осталось место для одного кусочка, то, скорее всего, вы знаете, куда его поставить. Однако, если в этом оставшемся фрагменте последовательность нуклеотидов далека от нормальной, бывает нелегко найти для него правильное место и поэтому его просто выбрасывают в мусорную кучу. Таким образом, если в опухоли присутствуют мутации, сильно меняющие ген, анализ их, к сожалению, не выявляет.
Вспомним, что патологоанатомы изучали срезы опухоли Тима с помощью микроскопа. Так же как работа патологоанатомов важна для анализа пораженной ткани, работа специалистов в области молекулярной генетики необходима для анализа того потока информации, который льется из приборов для секвенирования ДНК и связанных с ними компьютеров. К сожалению, клинические молекулярные генетики, работающие в самой передовой области науки, сильно различаются по своим способностям. Очень хорошо, если вы знакомы со специалистом, который точно знает, как все устроено.
Когда мы искали молекулярного генетика для Тима, нам не был нужен «узкий специалист широкого профиля». Мы хотели найти экспертов, которым были бы известны все тонкости сбора информации о мутациях в интересующих нас генах. Моя личная гипотеза, не подтвержденная никакими клиническими испытаниями, заключается в том, что мы получим более качественную информацию о мутациях, для которых есть лечение, если выберем лабораторию с лучшими экспертами и позволим им сосредоточиться на небольшом количестве генов.
Был случай, когда один практикующий врач обратился ко мне по поводу выбора правильного диагноза. Примерно в течение месяца он наблюдал трех неродственных пациентов с раком толстого кишечника. Опухоли свидетельствовали о наличии мутаций, приводящих к синдрому Линча, однако анализ ДНК, взятой из клеток крови (то есть не из раковых клеток) дал отрицательный результат при проверке на множество мутаций, связанных с раком. На основе своего опыта, анализа опухоли, а также личного и семейного анамнеза пациента я предположил что по меньшей мере в одном случае мы имели дело с синдромом Линча. Подозревая, что во всех трех случаях эти мутации просто-напросто ускользнули, я связался с директором молекулярно-генетической лаборатории, в которой проводили анализ, и попросил его перепроверить исходные данные. И действительно, при внимательной проверке результатов секвенирования генов обнаружились малозаметные мутации, при которых в одной из двух копий исчезает несколько участков, кодирующих белок, при этом в оставшейся части сохранится нормальная последовательность ДНК. У одного из пациентов это случилось в гене MLH1 и было подтверждено дальнейшими экспериментами. Примерно 80 % случаев синдрома Линча вызывают мутации типа делеций и дупликаций. Поэтому я и сомневаюсь, что в загруженных молекулярно-генетических лабораториях заказ сразу многих тестов даст лучший результат.
Поиск мишеней для лечения Тима оказался успешным. В опухолевых клетках анализ выявил мутации в генах ERBB2 и EGFR, для которых есть лекарства уже одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов, а также препараты, находящиеся на стадии клинических испытаний.
Одним из первых препаратов направленного действия в химиотерапии был «Трастузумаб». Это антитело, которое связывается с белком, продуктом гена ERBB2, и блокирует передаваемые им сигналы. Ген ERBB2, описанный впервые под названием neu в 1979 г. учеными из Массачусетского технологического института, играет важную роль в развитии многих типов раковых опухолей. Однако из-за того, что мутация в этом гене чаще обнаруживается при раке груди, чем при других формах рака, а в онкологии сохраняется традиция классификации опухолей по пораженному органу, мутации в ERBB2 ищут обычно при раке молочной железы.
По иронии судьбы, несмотря на всю важность ERBB2 в качестве мишени для противораковых лекарств, изначальные доклинические исследования этого гена, проведенные в 1980-х гг. и показавшие возможность воздействия на него препаратами, не удалось воспроизвести в работах, выполненных несколькими конкурирующими лабораториями. Это замедлило разработку препаратов направленного действия против опухолей, связанных с мутациями в ERBB2. Впоследствии несовпадение данных связали с «использованием загрязненных реагентов, неисправностью техники и глупыми ошибками в лабораториях, проводящих эксперименты»{43}. Исследования по разработке препарата против опухолей, связанных с мутациями в ERBB2, застопорились еще на несколько лет, пока у матери вице-президента биотехнологической компании Genentech не диагностировали рак молочной железы. Только тогда эти работы были возобновлены. Изначальное исследование воспроизвели, и в соответствии с самыми строгими стандартами в онкологии было подтверждено, что препарат продлевает жизнь пациентов с раком груди. На сегодняшний день существует три работающих препарата, тормозящих действие белка ERBB2, и еще несколько находятся в стадии разработки. Кроме того, сейчас мы знаем, что, как и предполагалось изначально, этот ген интенсивно работает не только при раке груди, но также и при других типах раковых опухолей.
Когда у Тима начался следующий этап химиотерапии, к его обычным лекарствам добавили «Трастузумаб». Ознакомившись с имеющимися основаниями, страховая компания оплатила этот препарат, хотя его воздействие на рак желчных протоков никогда не проверяли в рандомизированных клинических исследованиях. Как и предполагалось, опухоли в печени Тима уменьшились, а самому ему стало лучше. Его рак не исчез полностью, но Тим чувствует себя хорошо и доволен, что перед ним открылись возможности, которых не было раньше.
Ограничение числа анализируемых генов дает еще одно преимущество – таким образом, мы можем избежать синдрома инциденталомы. Так называют проблему, которая возникает, когда находят что-то изначально незапланированное, отвлекающее от основной проблемы. И иногда это может иметь неожиданные и серьезные последствия.
Эта распространенная проблема в медицине касается не только генетических анализов. Например, у здорового парня, который играет в теннис, вдруг заболело плечо. Врач направил его на МРТ плечевой кости, но пациент захотел сделать сканирование всего тела, «так, на всякий случай». Почему бы и нет, если страховая это оплатит. Но любопытство наказуемо. И вот МРТ выявила какое-то пятнышко в правом легком. В результате интервенционный радиолог, проткнув это маленькое пятнышко иглой для биопсии, определил, что это просто узелок, с клинической точки зрения не представляющий никакого интереса. Отличная новость! Однако в процессе прокалывания врач случайно проткнул легкое, случился его коллапс, и наш бедный парень оказался в больнице с трубкой в груди. После того как он оправится от коллапса легкого, ему придется еще ждать некоторое время, прежде чем он сможет вернуться на теннисный корт. Это доброкачественное образование в легком никогда бы не причинило ему столько проблем, если бы он не делал сканирование всего тела. Такие желания пациентов поддерживаются нашей системой здравоохранения с ее гонорарным способом оплаты[11].
Случайные находки создают особенно много проблем, когда выполняются сложные тесты, такие как секвенирование генома. На самом деле при секвенировании всего генома мы имеем дело с 3 млрд отдельных тестов. Но случайные находки могут появиться и при проверке небольшого набора раковых генов, включающего всего пару сотен, а не тысячи генов.
Вероника – еще один мой пациент. Она прошла генетическое тестирование на похожий набор генов, чтобы выяснить причины рака яичников, который возник у нее еще в молодости. Только один ген из всего набора нес мутацию. Это была замена одного нуклеотида в гене TP53, одном из самых известных генов во всем мире. Про него написано тысячи статей. Его называют «стражем генома». Целые научные карьеры были посвящены изучению механизмов его работы. И поскольку он так активно изучается, у TP53 есть собственная база данных по всем его мутациям, а такой ресурс редко встречается для других генов.
Белковый продукт гена TP53 предотвращает развитие рака. В первую очередь перед началом деления клетки он помогает определить, есть ли повреждения в клеточной ДНК. Таким образом, он помогает блокировать деление клеток со многими мутациями и, следовательно, снизить риск появления измененных раковых клеток.
Парадоксально, что, когда мутация возникает в самом TP53, клетки с поврежденной ДНК начинают бесконтрольно, неуправляемо делиться, образуя опухоли. Поэтому в видоизмененной форме этот важнейший антираковый ген сам участвует в формировании большого разнообразия опухолей.
Поиск клинических исследований той мутации, которая была в опухоли Вероники, ничего не дал{44}. И хотя мутации в TP53 связаны с устойчивостью опухоли к стандартным противораковым препаратам, все равно оставалась вероятность, что при такой мутации химиотерапия подействует.
У нас не было четкого пути. К сожалению, несмотря на все, что мы знаем про множественную роль TP53 в различных механизмах подавления опухолей, выявление мутации в этом гене не играет большой роли для поиска оптимального лечения. За пределами научных знаний онкологи должны руководствоваться своей интуицией, решая, что лучше для каждого конкретного пациента. Персонализированный подход в онкологии, как и ее точность, пока оставляют желать лучшего. Я уверен, что когда-нибудь мы сможем решить эту проблему и создать эффективное лечение для восстановления функций TP53. К сожалению, этот день еще не настал.
Находка мутации в опухоли Вероники вызвала много вопросов. При секвенировании генома ее опухоли обнаружилась действительно вредная мутация в TP53. Однако мы пока не могли сказать, возникла ли мутация недавно во время образования опухоли (соматическая мутация) или же все клетки Вероники несли эту мутацию (герминальная мутация).
Генетическое заболевание, при котором все клетки тела несут мутацию в гене TP53, называется синдромом Ли – Фраумени, в честь американских врачей Фреда Ли и Джо Фраумени-младшего, которые впервые его описали. Этот синдром передается из поколения в поколение, но примерно у 20 % пациентов это заболевание развивается из-за недавно возникшей мутации и обнаруживается в их семье впервые. У родственников пациентов с синдромом Ли – Фраумени после 50 лет риск возникновения злокачественных образований в 25 раз выше, чем в среднем по популяции. У людей с такой мутацией больше вероятность развития разных форм рака, как часто встречающихся, так и более редких, в том числе и рака яичников, как у Вероники.
У Вероники с обеих сторон есть родственники, у которых были множественные раковые опухоли. Если все клетки Вероники несут мутацию в ДНК, это означает, что она передается по наследству и ее могут получить оба ребенка Вероники. Я объяснил ее семье, что на настоящий момент мы не знаем этого точно. Конкретно ее мутация в TP53 не встречалась ранее у пациентов с синдромом Ли – Фраумени. Но что если это редкий вариант? Существуют редчайшие генетические аллели, которые нам не известны, некая «темная материя» генома. Или же дело в том, что в публичных базах данных очень мало информации об особенностях генов женщин северно-европейского происхождения, чтобы мы могли сравнить.
Эти находки заставили Веронику и всю семью сильно волноваться, как если бы этот рак мог дать метастазы в ее детях. И теперь, когда мутация была определена, было важно понять, могла ли она передаться детям Вероники. Дети с синдромом Ли – Фраумени должны регулярно проходить обследование, потому что у них велика опасность появления рака крови, мышц, мозга и других органов.
Обычно мы не проводим детям до 18 лет генетические анализы на те онкологические синдромы, которые проявляются у взрослых, а не у детей. Почему? Потому что положительный результат только усилит излишнюю тревогу.
Однако в случае синдрома Ли – Фраумени мы делаем анализ детям, поскольку это имеет практические последствия: если интенсивно отслеживать появление опухолей, можно уменьшить страдания и спасти жизни. Получается парадокс: когда мутация гена TP53 находится только в опухоли, с этим ничего сделать нельзя, но когда она есть у всей семьи, то помочь можно. Это одно из тех заболеваний, на которые делают преимплантационное генетическое тестирование при искусственном оплодотворении, чтобы родители могли иметь детей без склонности к развитию рака.
Анализ мутаций в гене TP53 Вероники пришел с ясным ответом: результат не отрицательный, а положительный. Однако преимущество данных, полученных массовым параллельным секвенированием, заключается в том, что вы получаете количественную информацию, которую можно как-то использовать. Поскольку такие данные обычно не предоставляются, мы позвонили в проводившую тест компанию и спросили, какая доля ДНК несла эту мутацию? После паузы они вежливо ответили, что такой ДНК было ровно 5 %, что позволило предположить, что мутация есть только в опухоли и не передастся детям. Синдром Ли – Фраумени – заболевание с доминантным типом наследования, следовательно, у больного человека 50 % этих генов должно нести мутацию, а 50 % – нет. И если бы в анализе Вероники этот ген был бы в равной степени представлен мутантным и нормальным вариантами, можно было бы предположить, что это наследуемая форма заболевания, и это дало бы повод для дальнейшего тестирования ее ДНК, взятой из других клеток. Но в данном случае родственники Вероники могли не волноваться по поводу передачи синдрома Ли – Фраумени. К несчастью, Вероника из-за своей болезни ушла в мир иной и не получила никакой пользы от проведенного ДНК-анализа.
В качестве еще одного примера можно вспомнить Лоуренса Эндрю Мэгика, или просто Ларри. Ларри было 35 лет, и он был уважаемым иммунологом в Нью-Йоркском медицинском институте, где считался крупным специалистом в области связывания антител с их мишенями. Он прекрасно себя чувствовал и был в отличной форме, накатывая сотни километров на велосипеде каждые выходные в Нью-Джерси. Ларри никогда не курил, пил только за компанию, из лекарств принимал исключительно мультивитамины и во время работы не сталкивался с необычными химическими или радиационными канцерогенами. В один прекрасный летний день, в обеденное время после одной из его велопрогулок, у Ларри неожиданно случилось стойкое расстройство желудка. В первую очередь он связал это с тем, что съел слишком много сметаны в забегаловке с мексиканской кухней. Он прошел обследование, и анализ крови показал, что нарушена работа печени. Затем у него появилась боль в средней части спины. С помощью компьютерной томографии была обнаружена опухоль в области головки поджелудочной железы. Как и Тиму, Ларри пришлось пройти операцию Уиппла для удаления большей части поджелудочной железы. Патологоанатомы легко обнаружили множество раковых клеток, выбравшихся из поджелудочной железы в вены, и лимфатические сосуды. Это был дурной признак. Во время операции было хирургически удалено 11 из 22 лимфатических узлов. Патологоанатомы обнаружили в них клетки, такие же как в опухоли, и это означало, что рак уже распространился за пределы поджелудочной железы.
Рак поджелудочной железы – один из самых страшных диагнозов в медицине. Через пять лет после постановки диагноза только 8 % пациентов все еще живы. Это такое заболевание, для которого необходимо искать более эффективные способы лечения.
Ларри получил стандартную начальную терапию препаратом под названием гемцитабин, который почти без разбора убивает все быстро делящиеся клетки. Однако, несмотря на лечение, у Ларри образовались три новых метастаза в печени. Кроме того, он стал очень уязвим для инфекций, так как препарат сильно понизил содержание лейкоцитов в иммунной системе. Для борьбы с опухолями в печени Ларри, как и Тим, перенес «удар мула» под названием FOLFIRINOX и был настолько измотан, что ему было сложно дойти утром до работы. Невзирая на эти трудности, Ларри занялся самообразованием в области онкологии. Он читал о причинах рака поджелудочной железы и обсуждал со своим врачом статьи из New England Journal of Medicine про плюсы и минусы различных видов лечения. Оставаясь уважаемым коллегой, он превратился в активного участника собственного лечения.
Ларри пришел ко мне делать генетический анализ, поскольку интересовался своим новым диагнозом в связи с семейным анамнезом. Его мать пережила многое. У нее нашли рак толстого кишечника, когда ей было 40 лет. В 60 лет обнаружили рак эндометрия и вслед за этим в 70 лет смертельный рак груди. Рак груди обнаружили у бабушки с материнской стороны, когда ей было 50 лет, а у кузины Ларри его нашли в 30 лет.
Генетический анализ показал, что у Ларри есть мутация в гене BRCA2. Гены, повышающие риск развития рака яичников и молочной железы BRCA1 и BRCA2, пожалуй, самые печально известные причины генетических заболеваний. Многие знаменитости, среди которых Анджелина Джоли, Шэрон Осборн и Мелисса Этеридж, сыграли важную роль, показав общественности возможные преимущества генетического тестирования на мутации в этих генах для тех женщин, у кого высокий риск развития рака груди. Гораздо менее известно, что и мужчины могут пострадать от этих мутаций. Эти же гены повышают риск развития рака поджелудочной железы и других органов.
Ларри был евреем-ашкенази. Примерно каждый 40-й представитель этой группы несет мутацию в генах BRCA1 или BRCA2. Можно сравнить этот показатель со средним по Америке – на 500 человек будет один носитель мутации. Среди ашкеназских евреев примерно у 90 % носителей имеется какая-то из трех характерных мутаций. Эти же три мутации встречаются у латиноамериканцев, видимо, потому, что в XV в. некоторые евреи перешли в католицизм или исповедовали иудаизм тайно, под страхом аутодафе испанской инквизиции (как и в случае болезни Гоше, о которой я рассказывал выше, мутация распространилась, вероятно, из-за внутригрупповых браков среди евреев, живших в то время в Европе).
Рак молочной железы развивается чуть больше чем у половины женщин – носителей мутаций в генах BRCA1 или BRCA2 и примерно у каждой шестой в течение жизни возникает рак яичников. Риск развития рака поджелудочной железы составляет 5 %, но он одинаков и для мужчин, и для женщин.
В поисках наилучшего лечения Ларри прочел о недавно разработанном классе препаратов, называющихся ингибиторы PARP, которые только проходили клинические испытания. У этих веществ побочные эффекты были гораздо слабее, чем у тех препаратов, которые он принимал ранее.
У клеток с мутациями в генах BRCA1 и BRCA2 нарушена способность ремонтировать разрывы в обеих нитях двойной спирали ДНК, так называемые двухцепочечные разрывы. PARP1 – важный фермент для исправления одноцепочечных разрывов. Когда препарат тормозит действие PARP1, клетки с мутацией в генах BRCA1 или BRCA2 умирают чаще, чем окружающие их здоровые клетки. Ларри увидел на сайте clinicaltrials.gov (поддерживаемый Национальными институтами здравоохранения полезный ресурс для поиска информации о клинических испытаниях), что в больнице в Филадельфии проводят исследование ингибиторов PARP, в котором он может принять участие. И хотя Ларри пришлось принимать по пять таблеток препарата «Рукапариб» дважды в день, побочных эффектов почти не было. Через несколько месяцев Ларри снова чувствовал себя хорошо и опять начал ездить на велосипеде в выходные. Мы надеемся, что его хорошее состояние и дальше сохранится.
Сейчас для онкологических пациентов с плохим прогнозом появляются новые надежды. Лечение пошло на пользу Тиму и Ларри, и они оба очень благодарны за то дополнительное драгоценное время жизни, которое получили после этого лечения.
У нас имеются запасные варианты борьбы с опухолью Тима. Кроме ERBB2, в его раковых клетках активно синтезируется рецептор эпидермального фактора роста (EGFR) – мембранный белок, способствующий росту клетки. Этот ген часто экспрессируется в раковых опухолях ободочной и прямой кишки, легких, головы и шеи. Уже доступны несколько препаратов, чтобы атаковать эту мишень. Поскольку изначальная опухоль фатерова сосочка Тима могла мутировать после нескольких циклов химиотерапии, то, возможно, в выживших клетках опухоли надо искать новые мишени, поддающиеся действию лекарств. И кроме этого, с учетом высокой частоты мутаций при синдроме Линча и большого числа лимфоцитов, проникающих в опухоль, есть еще одна возможность: с помощью нескольких новых мощных препаратов, влияющих на иммунную систему, усилить атаку адаптивной иммунной системы на рак.
И хотя эти новые подходы и не дотягивают до заветной мечты о полном излечении от рака, они позволяют посмотреть на рак как на хроническое заболевание, которое можно контролировать, если понимать, откуда берутся эти ужасные клетки, и иметь арсенал лекарственных средств для борьбы с ними. И несмотря на то, что перед онкологией лежит огромный путь не только с научной точки зрения, но и с позиции финансовой доступности для пациентов, понимание генетики рака дает нам ощущение движения вперед и вселяет оптимизм.
Глава 6 Мадонна и ангелочек, кирпичи и цемент
Найти няню на короткий срок в середине недели в Манхэттене может оказаться сложно, даже сложнее, чем попасть к врачу. Поэтому я был польщен, когда Саманта Беркли, не найдя няню и опаздывая, все же пришла ко мне на прием в клинику генетики. И я с удивлением и радостью увидел, что она принесла с собой своего красивого и здорового сына Джорджио, которому только что исполнилось шесть месяцев.
В своей жизни я встречал много симпатичных младенцев, но Джорджио был настоящий ангелочек. Он улыбался, лепетал и раскачивался в своей высокотехнологичной коляске Maclaren, словно путто со скульптуры Донателло, протягивал ручки в сторону матери, пока она не взяла его на руки и не усадила уютно у себя на коленях. У Джорджио были мягкие, тонкие, светлые волосики, красивые круглые голубые глаза и пухлые щечки, за которые хочется потрепать.
Разглядывая ребенка, поглощенного попытками передвинуть набор ярко окрашенных колечек для младенцев, сидящего на коленях у этой женщины, я был очень смущен. Взглянув на список пациентов, я прочел запись, сообщающую, что Саманта пришла сюда из-за того, что у нее был диагностирован синдром Лойса – Дитца. Я снова посмотрел на мать и ребенка, и действительно, Саманта выглядела как человек с синдромом Лойса – Дитца.
Ей было чуть за 30, ее рост превышал 180 см, она имела стройное телосложение и хорошо развитую мускулатуру. Лицо было вытянутым, с острыми скулами, с широко расставленными глазами (казалось, что эта особенность усиливалась, когда она улыбалась) и маленькой челюстью. Ее нёбо, скорее всего, было высоким и выпуклым. Руки Саманты были изящными и длинными, даже длиннее ног. Если она вытягивала их в стороны, как во время занятий аэробикой, то расстояние от кончиков пальцев одной руки до кончиков пальцев другой оказывалось больше, чем ее полный рост. Пальцы на ногах и руках у Саманты были тоже элегантно-тонкими, с изящными изгибами, и она могла сгибать их так, как я ни за что не смогу, сколько бы ни занимался упражнениями на растяжку. Например, она могла согнуть большие пальцы на правой и левой руке так, что их фаланги выступали за противоположную сторону ладони.
Генетики обычно называют это марфаноидной внешностью, термин произошел от названия наследственного заболевания, при котором пациенты выглядят так же. В конце XIX в. французский педиатр Антуан Марфан впервые описал синдром, который был назван его именем. Доктор Марфан отличался хорошей наблюдательностью при проведении медицинского осмотра. Хотя у большинства людей с такими же чертами, как у Саманты, нет наследственного заболевания, существует более дюжины генов, мутация в которых приводит к формированию марфаноидной внешности. Посмотрев на разнообразные черты прохожих, прогуливающихся, например, по улицам Манхэттена, можно предположить, что у пациентов комбинации этих черт встречаются случайно. Но это впечатление обманчиво, синдром Марфана и характерную для него внешность формируют скрывающиеся под поверхностью кожи мутации во вполне определенных генах.
Похожая внешность может возникать и вне связи с генетическим заболеванием. Часто она появляется «просто» в результате случайного сочетания многочисленных непатологических генетических особенностей и сложных взаимодействий между генами и средой, в том числе из-за особенностей питания и физических упражнений.
У многих исторических личностей была такая внешность. Начиная от правителей, таких как Мария, королева Шотландии (она была долговязой, ростом 180 см во времена, когда большинство людей были низкорослыми), египетских фараонов Эхнатона и Тутанхамона, американского президента Авраама Линкольна, скрипача-виртуоза Никколо Паганини и заканчивая такой темной личностью, как Усама бен Ладен.
Этот последний был ростом 195 см, а весил всего около 70 кг. Его длинное узкое лицо хорошо известно, но в описании, которое использовали службы по борьбе с терроризмом, отмечаются также длинные тонкие руки и пальцы. Особенности его здоровья тоже могли быть связаны с синдромом Марфана. Он был близоруким и хромал, некоторые считали, что это связано с искривлением позвоночника и другими костными аномалиями. По-видимому, у него имелись и проблемы с пищеварением и получившая широкую известность почечная недостаточность, из-за которой требовался диализ{45}.
Те, кто интересовался национальной безопасностью и медицинской информацией, предположили, что у бен Ладена могла быть гомоцистинурия – заболевание с менделевским типом наследования, при котором проявляются марфаноидные черты. Гомоцистинурия возникает из-за мутации в гене цистатионин бета-синтазы (CBS) или, реже, в гене сульфитоксидазы (SUOX). Мутантный ген SUOX появился как раз в Саудовской Аравии, откуда происходит семья бен Ладена. Эти гены влияют на метаболизм содержащих серу аминокислот, в частности гомоцистеина. Мутации в генах CBS или SUOX могут вызывать множество проблем со здоровьем. Одно из возможных последствий – нарушение структуры белков внеклеточного матрикса соединительной ткани, которые содержат серу. Из-за этого появляется марфаноидная внешность, ломкость костей, и косвенными путями это может привести к расстройству личности и даже психотическим эпизодам. Кроме того, могут возникнуть тромбы, которые повреждают почки настолько, что требуется диализ. Злая ирония заключается в том, что если у бен Ладена действительно была гомоцистинурия, то он смог дожить до дней, предшествовавших 11 сентября 2001 г., только благодаря современной медицине, поскольку должен был получать пиридоксин, бетаин или фолиевую кислоту. Весьма вероятно, что без помощи западной медицины башни-близнецы, располагавшиеся в 6 км к югу от моей клиники, стояли бы и по сей день.
После того как бен Ладен был убит в своем укрытии в Пакистане, ЦРУ вывезло тело и с помощью анализа ДНК подтвердило его личность. Было бы здорово, если бы ЦРУ провело генетический анализ, чтобы разобраться, действительно ли у бен Ладена и его кровных родственников, которые вызывают повышенный интерес у Министерства внутренней безопасности, были мутации в гене CBS, SUOX или в каком-то другом, связанном с марфаноидной внешностью.
Из-за марфаноидной внешности Авраама Линкольна высказывалось предположение, что у него было наследственное заболевание: множественная эндокринная неоплазия типа IIb. При этом заболевании также возникают опухоли щитовидной железы, расположенной на шее. В молодости Линкольн, как правило, был чисто выбрит или носил небольшую бороду. В более позднем возрасте у него появилась его знаменитая большая борода, а шея обычно была скрыта высоким воротником рубашки. Поэтому некоторые историки медицины предположили, что он мог что-то прятать, например доброкачественную опухоль на шее.
Множественная эндокринная неоплазия типа IIb может внешне проявляться в виде небольших доброкачественных опухолей, которые выглядят как бугорки на губах. И действительно, у Линкольна (как и у трех его сыновей) были бугорки на губах, они видны на прижизненных фотографиях, отсюда и возникло предположение, что у него была множественная эндокринная неоплазия типа IIb.
В 2009 г. с помощью методов генетического тестирования, используемых в археологии, были обследованы некоторые оставшиеся от Линкольна предметы, в частности фрагмент платья, предположительно принадлежавшего Лауре Кин, актрисе, игравшей в театре Форда в спектакле «Наш американский кузен», на котором присутствовал Линкольн тем вечером, когда Джон Бут его убил. Историки пишут, что после выстрела Кин положила голову Линкольна себе на колени и ее платье пропиталось кровью президента. Однако на этом куске ткани от платья не осталось никаких видимых следов крови, и анализ ДНК не выявил мутации.
В современной культуре марфаноидные черты воспринимаются двояко. Люди с такими особенностями часто вызывают зависть и пользуются популярностью у модельных агентств, режиссеров, спортивных тренеров, старшеклассников и старшеклассниц. В нашем обществе высоко ценятся и поощряются такие физические характеристики, как высокий рост, худоба и гибкость, даже если человек с такими особенностями не занят в сфере, где ключевыми требованиями являются стройность и спортивное мастерство. Генеральные директора компаний из списка Fortune 1000 в среднем примерно на 7 см выше, чем большинство из нас, то же касается американских президентов, многих моделей и звезд Голливуда. Мужчины ростом от 182 см и выше по сравнению со своими более низкими коллегами в среднем зарабатывают на $5000 больше. Полистайте каталоги магазинов Bloomingdales или Saks Fifth Avenue, сайт IMDb или сайты с кандидатами на президентских и губернаторских выборах – и вы поймете, что я имею в виду.
Эти черты способствуют карьере в модельном бизнесе и баскетболе. В Соединенных Штатах Национальная баскетбольная ассоциация (NBA), проводя отбор кандидатов по физическим характеристикам, проверяет их и на наличие некоторых наследственных заболеваний, для которых характерна марфаноидная внешность. Те, у кого обнаруживается заболевание, не могут стать игроками NBA из-за повышенного риска разрыва аорты.
Заболевания, для которых характерна марфаноидная внешность, могут сопровождаться различными видами болей и другими проблемами, в том числе функциональными шумами в сердце и близорукостью, которые хотя и мешают, но не приводят к инвалидности и не опасны для жизни. На самом деле, как свидетельствует мой медицинский опыт, большинство людей с заболеваниями, сопровождающимися марфаноидной внешностью, даже не подозревает об этом, и их лечащие врачи часто не могут это обнаружить, поскольку у них есть всего 15 минут и надо сосредоточиться на актуальных медицинских проблемах пациента.
Изредка, однако, мутации могут иметь потенциально катастрофические последствия. Как показал анализ ДНК, именно такая ситуация была у Саманты. Среди наследственных заболеваний, для которых характерна марфаноидная внешность, первое – это собственно синдром Марфана, впервые описанный доктором Марфаном. Считается, что это заболевание встречается примерно у одного человека из 10 000. Забавно, что схожесть внешних марфаноидных проявлений многих заболеваний, имеющих разную наследственную природу и кардинально разные последствия, сбила с толку даже самого Марфана. Он дал описание болезни в 1896 г., наблюдая пятилетнюю девочку Габриель, у которой, по-видимому, был не синдром Марфана, а другое заболевание соединительной ткани – синдром Билса, или врожденная контрактурная арахнодактилия (CCA){46}.
Синдром Марфана и CCA вызываются мутациями в генах белков фибриллин-1 и фибриллин-2 соответственно. Кажется, что различие между названиями невелико, но оно может оказать огромное влияние на жизнь человека. Наиболее серьезное осложнение при синдроме Марфана – внезапная смерть из-за разрыва аорты – главного кровеносного сосуда в организме. Синдром Марфана был у Фло Хайман, высокой американской волейболистки, выигравшей серебряную медаль на Олимпиаде в 1984 г. Она внезапно умерла на соревнованиях в Японии в 1986 г. от разрыва аорты, и только посмертно ей диагностировали синдром Марфана. Точно так же писатель и композитор Джонатан Ларсон, автор популярного бродвейского мюзикла «Богема», у которого по мере приближения к премьере от стресса, по-видимому, повышалось давление, умер от разрыва аорты в день перед премьерой мюзикла в Нью-Йорке. У него тоже диагностировали синдром Марфана и тоже лишь после смерти.
В то же время CCA протекает более безобидно, и, как оказалось, по прошествии более 100 лет у Габриель, пациентки доктора Марфана, имевшей марфаноидную внешность, не было выявлено каких-то проблем с сердцем до подросткового возраста (о дальнейшей ее жизни нам ничего не известно). CCA также встречается у других млекопитающих, в том числе у коров. Телята с этим наследственным заболеванием бывают высокого роста из-за необычно длинных костей конечностей, но у них не бывает случаев внезапной смерти из-за разрыва кровеносных сосудов или иных осложнений, сокращающих продолжительность жизни.
Наши тела состоят из клеток и межклеточного вещества. Если представить себе, что большинство клеток – кирпичи, то межклеточное вещество будет цементом, соединяющим эти кирпичи. Существуют также соединительные ткани, в которых очень много межклеточного вещества, и они служат опорой, разделяют и скрепляют все органы тела, удерживая их на своих местах.
Соединительные ткани состоят из разных типов специализированных клеток. Некоторые ткани твердые, как цемент в стенах здания (например, в ногтях и костях), а другие мягкие и эластичные (например, в носу и ушах). Разные соединительные ткани служат опорой другим органам и составляют более половины объема и веса тела. В них работают сотни генов. Эти гены отвечают за выработку белков, таких как коллагены, миозины, кератины, фибриллины и других, заканчивающихся на -ены и -ины. Они формируют сложно переплетающуюся структуру из множества самособираемых волокон, действующих по принципу застежки-липучки, и иногда могут даже самостоятельно восстанавливаться.
Благодаря работе многих дополнительных генов к этим структурам добавляются разные хитроумные «крючки и блоки», а также «теплоизоляционные и гидроизоляционные» материалы. Такие добавки имеют большое значение, поскольку белки, кодируемые одним и тем же геном, но доработанные по-разному, могут обеспечивать губчатость почки или твердость лобной кости.
В прошлые десятилетия соединительные ткани обычно считались пассивными рабами органов-хозяев. Однако сейчас мы понимаем, что большинство органов гораздо более демократичны и настроены на сотрудничество и соединительные ткани ведут усиленный диалог со своими клеточными и синцитиальными собратьями, чтобы сообща поддерживать единство организма и гомеостаз. Сигналы, поступающие от соединительной ткани, окружающей клетки органов, помогают предотвратить разрыв кровеносных сосудов, переломы костей, внезапное развитие слепоты и другие заболевания.
Кроме того, соединительные ткани отправляют важные сигналы в кровь и к иммунной системе и сдерживают раковые клетки, не давая им распространяться. Соединительная ткань похожа на «умный дом», который сам за собой следит и себя контролирует, например автоматически поддерживает температуру в течение дня на комфортном уровне так, чтобы тратилось меньше энергии, управляет бытовой техникой, автоматически отпирает и запирает двери, когда приходят и уходят жильцы, или предупреждает вас, когда вы находитесь в отпуске за границей, что ваш домашний водонагреватель только что дал течь. Эти взаимодействия могут осуществляться с помощью Wi-Fi, например, через приложение вашего смартфона. В организме животного соединительная ткань – это своеобразная версия интернета вещей, постоянно информирующего соседние клетки.
При синдроме Марфана мутации в гене белка фибриллин-1 дают два эффекта. Во-первых, ослабляются волокна, укрепляющие кровеносные сосуды, глаза, позвоночник и другие органы. Кроме того, те же мутации нарушают сдерживание сигнальной активности другого белка, который называется трансформирующий ростовой фактор бета (TGF-β). Чрезмерно активный TGF-β ослабляет гладкие мышцы вокруг кровеносных сосудов, например вокруг аорты, и внеклеточное вещество, которое их скрепляет. Это важная информация, поскольку определенный тип лекарств, регулирующих кровеносное давление, – антагонисты рецепторов ангиотензина II – могут не только понижать кровеносное давление, но и снижать уровень TGF-β. Антагонисты рецепторов, такие как лозартан, помогают предотвратить разрыв аорты у людей с синдромом Марфана.
Как несложно догадаться, существует множество типов соединительной ткани, и сотни генов участвуют в приготовлении этих строительных растворов. Как и в любой ситуации, где имеется много функциональных элементов, столь большое количество задействованных генов может вызывать проблемы. Вполне возможно, что почти у каждого десятого человека присутствуют мутации, приводящие к какому-то заболеванию соединительной ткани; сейчас таких заболеваний известно более 70.
Это большая часть соображений, из-за которых я смутился, увидев младенца Джорджио, счастливо воркующего на коленях у матери. Тем, кому диагностировали синдром Лойса – Дитца (названный в честь бельгийского и американского врачей, которые в конце 1990-х гг. определили, в каких генах происходят мутации при заболевании, раньше имевшем название синдром Марфана II типа), беременности следует избегать любой ценой, потому что она может привести к фатальным последствиям. Может быть, я ошибся и перепутал пациентов? К сожалению, когда клиника переполнена (не говоря уже о сбоях больничной сети), может возникнуть дикая путаница, и такое уже бывало.
Хотя это расстройство встречается достаточно редко – у одного человека на миллион, есть по меньшей мере четыре гена, мутация в которых приводит к синдрому Лойса – Дитца. Все они играют важную роль, влияя на инфраструктуру клетки, а также на управление и координацию для правильного производства скрепляющего раствора, в изготовлении которого участвуют белки со сложными названиями: трансформирующий ростовой фактор бета{47} и костный морфогенетический белок – родственники фибриллина-1, который связан с синдромом Марфана.
Когда один или несколько этих маленьких генов не дают межклеточному «цементу» затвердевать до нужной консистенции, могут возникнуть большие проблемы в самых неподходящих местах. Именно поэтому такому сильному риску подвергается аорта. Аорта – самый крупный кровеносный сосуд в теле человека. Это главный канал от сердца к каждому органу тела: можно сказать, Бродвей кровеносной системы. Сокращаясь, сердце выбрасывает волну крови примерно раз в секунду. У пациентов с синдромом Марфана, Лойса – Дитца и другими заболеваниями соединительной ткани соединительный цемент, поддерживающий целостность большой трубы, то есть аорты, может расслоиться, вызвав внезапные катастрофические последствия.
Кроме того, другой орган, подвергающийся большому риску у людей с синдромом Лойса – Дитца, – это матка. Во время беременности там находятся ребенок и околоплодная жидкость, и матка заметно растягивается. Если у матери синдром Лойса – Дитца и соединительная ткань, окружающая матку с ребенком, порвется, то опять же последствия для матери и ее еще не родившегося ребенка будут катастрофическими.
Саманта знала, что у нее синдром Лойса – Дитца потому, что у ее отца был не только соответствующий внешний вид, но и другой симптом: прогрессирующее расширение аорты, видимое на УЗИ и на компьютерной томографии. Это означало, что оболочка аорты в плохом состоянии, что предвещало большие проблемы и требовало хирургического укрепления дуги аорты с помощью спасительной пластиковой сетки. Дуга аорты – место, куда напрямую бьет кровь из сердца, поэтому она испытывает наибольшее напряжение. Пластиковая сетка выступает в роли армирующей обшивки для поврежденной трубы, которая растягивается под давлением жидкости.
Проблемы с аортой нарастают из-за порочного круга. Подобно тому как воздушный шар от вдуваемого воздуха становится тоньше и натягивается, когда у кровеносного сосуда стенка выпячивается наружу, она становится тоньше в этом месте и в дальнейшем ослабляется еще сильнее при хотя бы небольшом увеличении давления и потока крови. Для этого явления существует медицинский термин аневризма. Когда аневризма аорты достигает определенных размеров, расширенная часть стенки кровеносного сосуда может разорваться или расслоиться (кровеносный сосуд отделяется от оболочки). Это может привести к внезапной смерти, если аорта даст течь. Такое заболевание привлекло к себе внимание всей страны, когда актер Джон Риттер, сын певца и актера, игравшего ковбоев, Текса Риттера, звезда популярных телевизионных программ, таких как «Трое – это компания» (Three’s Company), внезапно умер в 2003 г. в возрасте всего 54 лет из-за разрыва аневризмы аорты. Чтобы снизить риск разрыва аорты, необходимо изменить образ жизни, отказавшись от курения и поддерживая низкий уровень холестерина.
К сожалению, симптомы аневризмы часто незаметны, пока она не станет совсем большой. Достаточно крупная аневризма может давать о себе знать сильной болью в груди или спине (в зависимости от того, какая часть аорты отслаивается от соединительнотканной оболочки), головокружением (потому что к голове не поступает достаточно крови), учащенным сердцебиением или затрудненным дыханием (потому что недостаточно крови поступает к другим органам).
Кроме того, у отца Саманты трижды происходило отслоение сетчатки. Отслоение сетчатки может произойти, когда соединительная ткань, удерживающая глазное яблоко на месте, изнашивается и рвется, причем происходит это во время повседневной жизни, безо всяких травм вроде падения или автомобильной аварии. Это может проявляться как внезапная вспышка света в одном глазу из-за того, что при механическом растяжении фоторецепторные клетки посылают электрические импульсы, ошибочно интерпретируемые мозгом как что-то вроде шквала журналистских фотовспышек.
На сегодняшний день отслоение сетчатки обычно легко исправляется с помощью лазерной хирургии. Как и большинству людей с синдромом Лойса – Дитца, отцу Саманты восстановили нарушенное зрение. Однократное отслоение сетчатки обычно не вызывает интереса у генетиков, потому что может случиться у кого угодно. На второй раз это уже подозрительно, но может быть просто невезением. Однако, если отслоение повторяется трижды, это уже настолько необычное и сильное невезение, что отец Саманты был включен в программу исследований синдрома Марфана и других похожих наследственных заболеваний. В рамках этих исследований у него нашли мутацию в гене SMAD3, это наиболее редкая причина синдрома Лойса – Дитца{48}.
Таким образом, «генетическая молния» ударила в семью Саманты два с половиной раза: у них была мутация, которую пока не нашли ни у одной другой семьи на свете, к тому же обнаружилась она в гене, мутации в котором реже всего становятся причиной этого очень редкого генетического заболевания. Практически это означало, что у нас почти не было информации, чтобы каким-либо способом предсказать с некоторой точностью, с какими медицинскими проблемами может столкнуться Саманта.
Кое-какие подсказки мы можем получить, проанализировав ее семейный анамнез. Саманта рассказала мне, что у ее бабушки с папиной стороны тоже была марфаноидная внешность. Кроме того, у ее бабушки дважды происходило отслоение сетчатки, так что, похоже, у нее тоже была эта мутация в SMAD3. Однако бабушка прожила более 60 лет, умерла от других причин, и у нее никогда не было ни значительного снижения зрения, ни каких-либо проблем с аортой или чем-то еще, явно связанным с этим заболеванием. Что еще важнее, бабушкины соединительные ткани, видимо, не читали учебник, где описываются типичные проблемы при синдроме Лойса – Дитца: у нее было две беременности без осложнений и два здоровых сына. Однако у бабушкиной дочки (тети Саманты) были проблемы с аортой, и она уже находилась под наблюдением. Саманте сделали анализ на мутацию, которая была у отца, и выяснилось, что у нее такая же мутация в SMAD3.
Саманта очень умна, у нее мощное математическое мышление и ученая степень в области точных наук, полученная в престижном университете. Всегда здорово, когда пациент явно умнее врача и может активно сотрудничать в процессе лечения. Саманта ясно понимала свое состояние и много знала об экстракорпоральном оплодотворении (ЭКО) и ПГТ.
Сейчас при синдроме Лойса – Дитца можно использовать суррогатное материнство. Это значит, что, если Саманта захочет иметь еще одного ребенка, ее оплодотворенные яйцеклетки могут быть помещены в матку другой женщины, чтобы Саманта избежала риска разрыва аорты или матки.
Несмотря на то что сейчас эти технологии хорошо развиты, есть некоторые менее явные проблемы, которые Саманте также надо учесть. Материнство было для нее чем-то очень личным и важным. Несмотря на все свои достижения в высшей школе, она решила на некоторое время отложить карьеру, чтобы сосредоточиться на воспитании своего ребенка или даже нескольких детей. Саманта была очень обеспокоена тем, как все эти генетические технологии повлияют на тесную связь с ребенком во время беременности. Генетические методы могут лишить «все эти переживания большей части удовольствия и радости». Оценка риска могла бы пригодиться при решении этого уравнения. Однако значение связи между матерью и ребенком нельзя выразить в виде процентов при подсчете риска. Кроме того, поскольку у Джорджио не было каких-либо признаков синдрома Лойса – Дитца, Саманта решила не делать ему анализ в детстве.
Много лет назад, когда я учился в медицинской школе, разрыв матки считался характерным для синдрома Марфана. Однако сейчас благодаря прогрессу в области генетики человека мы можем разделить заболевания в зависимости от их молекулярных механизмов, поскольку знаем, какие конкретно мутации их вызывают, и оказывается, что это осложнение характерно в основном для синдрома Лойса – Дитца (прежде чем мы узнали, какие конкретно гены участвуют в развитии этих внешне похожих заболеваний, его называли синдромом Марфана II типа). Благодаря возможности различить эти заболевания со схожими симптомами люди могут точнее понимать сопутствующие риски.
Однако есть много такого, чего мы до сих пор не знаем. В таком случае, как этот, у нас очень мало статистических данных о том, что может случиться с пациентом. У Саманты нарушен ген, изменения в котором не часто бывают причиной весьма редкого синдрома, а точная мутация, свойственная ее семье, вообще не описана в медицинской литературе. Диагноз приходится экстраполировать на основе известных данных о случаях Лойса – Дитца, вызванных мутациями в соседних участках гена. В истории ее собственной семьи были люди, у которых наличие этой мутации вызвало проблемы. Однако была и ее бабушка, родившая двух здоровых детей и имевшая нормальную для того времени продолжительность жизни.
Когда мы попытались понять и предсказать проблемы, оказалось, что в определенной степени генетический анализ противоречил семейному анамнезу. Кроме того, в случае с Самантой мы могли провести диагностическое исследование состояния ее аорты и не обнаружили вообще никаких признаков расширения, следовательно, снижался и риск появления серьезных проблем во время беременности.
У Саманты была беременность без осложнений, она родила Джорджио и собирается завести еще одного ребенка. Она все еще не понимает, надо ли использовать мощные молекулярные методы, которые имеются в нашем распоряжении, чтобы уменьшить риск. У этой задачи нет правильного или неправильного ответа. В этом генетическом уравнении личные предпочтения важнее жестких исходных данных. Я сказал Саманте, что если бы это был я или моя семья, то, руководствуясь тем, что я знаю о синдроме Лойса – Дитца, я, вероятно, использовал бы ЭКО и ПГТ, чтобы ребенок не получил эту мутацию. Однако моя роль не в том, чтобы принять решение вместо Саманты. Моя задача – как можно полнее информировать ее о тех мощных технологических возможностях, которые могут ей помочь. Ее судьба будет зависеть как от ее собственных решений, так и от ее генома. Сейчас у Саманты, ее мужа и у Джорджио все хорошо.
Первоначально Саманта сказала мне, что собирается родить следующего ребенка естественным образом. Однако, когда я позвонил ей позже, чтобы узнать, как у них дела, она уже склонялась к тому, чтобы использовать ЭКО и ПГТ – не ради себя, а ради Джорджио и будущего ребенка. У нее начались проблемы с сердцем в связи с изменениями в соединительно-тканном строительном растворе, которые возникли из-за синдрома Лойса – Дитца, это были первые осложнение, вызванные заболеванием. Тогда она лучше стала понимать, как важно защитить себя и своего будущего ребенка, остаться здоровой, чтобы растить своих чудесных детей.
Глава 7 Узнай свой геном
Я так много общался по электронной почте и телефону с Луцем и Женевьевой Рингольски, что, когда в холодный зимний день они наконец посетили мою клинику, у меня появилось ощущение, что мы давно знакомы. Это была очень успешная и известная нью-йоркская пара. Оба имели докторские степени по уважаемым специальностям. Луц долгое время работал инвестиционным менеджером во всемирно известном хеджевом фонде и был опытным специалистом в области количественного анализа. В частности, он был экспертом в оценке и контроле рисков. Женевьева была преподавателем. Она обучала американской и европейской истории учеников одной почтенной частной школы. Вне работы они проводили время вместе, погруженные в нью-йоркские проблемы социальной сферы и благотворительность, в том числе участвовали в организации практических курсов финансовой грамотности для малообеспеченных жителей восточного Гарлема.
И хотя у них были некоторые хронические заболевания, по меркам моей клиники пара была вполне здоровой. У Женевьевы был язвенный колит (одно из воспалительных заболеваний кишечника), но у родственников ничего похожего не было. Хотя это заболевание может возникать еще в детстве, у Женевьевы не проявлялось никаких симптомов до взрослого возраста. К счастью, когда я закончил описывать личный и семейный анамнез этих пациентов, в моем блокноте свободного места осталось больше, чем обычно. Писательский кризис такого рода радует всех, кто имеет отношение к медицинской генетике. Луц и Женевьева ценили свое здоровье и хотели сохранить его и дальше.
Так с каким же клиническим вопросом они пришли ко мне? Хорошее здоровье. Они записались на прием ко мне и к сертифицированному генетическому консультанту Элеоноре, чтобы выяснить, что они могут узнать из своих генов, чтобы еще несколько десятков лет сохранять хорошее здоровье и рассказать двум своим подрастающим детям, как предотвратить развитие возможных заболеваний. Луц и Женевьева занимались общественно важной работой, помогая малоимущим жителям Нью-Йорка, и хотели, чтобы и дальше эта важная деятельность продолжалась под их руководством. В некотором роде это были долгосрочные инвестиции и надежная защита от медицинских кризисов. Кроме того, им было интересно узнать свое этническое происхождение и другую немедицинскую информацию, помогающую в XXI в. восстановить семейную историю.
Они понимали, что находятся на передовом рубеже и что медицинская страховка не оплатит это профилактическое сканирование генома – платить им придется из своего кармана. В целом они хотели получить то, что уже было в медицинских картах у тысяч здоровых (а также в основном и богатых) американцев. Мне нравится, когда пациенты толковее меня, и это был именно тот случай. Луц и Женевьева пришли ко мне после длительного сбора информации и долгих размышлений на эту тему. Они были хорошо ознакомлены с рисками, положительными сторонами и ограничениями полногеномного секвенирования.
Поскольку они умели обращаться с большими массивами данных, то попросили записать последовательность ДНК на внешний жесткий диск, чтобы в дальнейшем, когда будут открыты новые гены заболеваний и старые подходы будут изменены и усовершенствованы, они смогли заново проанализировать свой отсеквенированный геном.
Наша встреча, на которой присутствовал и генетический консультант, заняла больше часа. Мы подробно обсудили ограниченность генетических знаний, существование аллелей, значение которых мы пока не понимаем, возможные риски, которые могут возникнуть из-за случайных неприятных находок, маловероятную, но возможную ситуацию генетической дискриминации и другие вопросы. Луц и Женевьева по отдельности подписали три бланка информированного согласия: один для больницы, один для лаборатории, которая будет проводить секвенирование, и еще один – для научного исследования, цель которого – лучше понять соотношения между риском и выигрышем при генетическом анализе и определении полного экзома. У человека существует примерно 180 000 экзонов в приблизительно 22 000 генах. Большинство мутаций, которые мы определили и значение которых мы понимаем, расположены именно в экзонах. Экзом – это те 2 % генома, которые отвечают за синтез белков – самую важную задачу нашего генома. В целом секвенирование экзома считается эффективным способом поиска таких изменений в последовательности ДНК, про которые мы можем точно сказать, что это мутации, вызывающие генетические заболевания.
Вышло так, что их стремление к самопознанию сразу же зашло в тупик. В штате Нью-Йорк пациенты могут заказать генетические тесты только в том случае, если этот анализ предварительно одобрил Департамент здравоохранения штата. Поскольку секвенирование полного генома и экзома относительно новые генетические тесты, появившиеся в других штатах лишь несколько лет назад, в Нью-Йорке не было сертифицированных лабораторий, где можно было бы заказать этот анализ. Мы с Элеонорой подали заявку на проведения тестирования для Луца и Женевьевы, учитывая их высокий интеллект и полное понимание пользы и риска от такого профилактического секвенирования экзома. Следуя инструкциям, мы отправили по факсу запрос на разрешение воспользоваться услугами молекулярной лаборатории в Медицинском колледже Бейлора в городе Хьюстон, штат Техас. Эта лаборатория провела уже несколько тысяч подобных клинических исследований, и к качеству анализов претензий не было. Теперь мы ждали ответа. Прошло около десяти дней. Наконец мы получили факс из Олбани. Департамент здравоохранения штата Нью-Йорк ответил отказом на запрос о секвенировании полного генома и полного экзома для Луца и Женевьевы. Что же касается желания записать копию на жесткий диск… об этом можно было забыть.
Я лично позвонил в Департамент здравоохранения штата, чтобы обжаловать это решение. Я объяснил, что это образованные и умные пациенты, которые получили консультацию у двух генетиков, имевших профессиональную сертификацию. Полученную информацию пациенты планируют использовать для поддержания здоровья в долгосрочной перспективе, и мы следуем рекомендациям Американской коллегии медицинских генетиков и Американского общества генетических консультантов. Департамент здравоохранения повторно без лишних формальностей выдал отказ. Причина в том, что Луц и Женевьева были слишком здоровы для полногеномного секвенирования.
Это единственный пример генетической дискриминации (а точнее, обратной генетической дискриминации), с которой я, как врач, столкнулся лично за мои 18 лет практики. Правительство штата Нью-Йорк постановило, что генетический анализ экзомов должен проводиться только для тех, у кого есть серьезный личный или семейный медицинский анамнез определенных генетических заболеваний. Штат решил, что при отсутствии такого анамнеза генетическая информация слишком опасна и несет большой риск. Руководствуясь принципом «не навреди» Гиппократа, они сочли, что этот потенциальный риск (как для Луца и Женевьевы, так и для всей страны) перевешивает возможную пользу такого анализа. В следующей главе «Поколение XX/XY» я буду подробно обсуждать некоторые опасения в области здравоохранения в связи с широким распространением секвенирования геномов здоровых людей.
Однако Луц и Женевьева могли законно секвенировать свои геномы и получить в виде файлов всю первичную информацию в любых других штатах, а также в Канаде. В большинстве штатов такое тестирование разрешено, вероятно, потому, что Американская коллегия медицинской генетики и геномики – ведущая организация в этой области – в 2012 г. разработала рекомендации, согласно которым допускается профилактическое изучение генома здоровых людей, если они проконсультировались у генетических медиков (как в случае Луца и Женевьевы) и подписали согласие, что полностью понимают возможные риски{49}.
Мне хочется спросить: не должны ли все жители Нью-Йорка получить карточку с предупреждением о том, что знание о своей генетической информации вредит здоровью, как это пишут на пачках сигарет? И если они могут узнать свою последовательность ДНК, просто приехав в Нью-Джерси, изменятся ли свойства их генов на середине моста Джорджа Вашингтона при пересечении реки Гудзон?
Или же, если выразиться более прямо, кому в конце концов принадлежит этот геном? Надо ли дать здоровым людям право доступа к своей собственной ДНК? Или это слишком мощное и потенциально опасное знание, которое может обратить в соляные столбы даже таких думающих и образованных людей, как Луц и Женевьева?
Представления о том, что генетические данные особенные и поэтому должны обрабатываться иначе, чем другая медицинская информация, называются исключительностью генетики. Я считаю, что здесь повторяются давно опровергнутые аргументы в пользу витализма.
Витализм – это философские представления о том, что живые организмы фундаментально отличаются от неживой материи наличием élan vital – некоторой особой нематериальной жизненной силы, иногда приравниваемой к человеческой душе, иногда нет. Виталисты полагали, что органические вещества не могут синтезироваться из неорганических. Однако в 1828 г. Фридрих Вёлер опроверг это мнение, синтезировав основной компонент мочи – мочевину – из неорганических компонентов. Должны ли мы сейчас, спустя два столетия, сделать то же самое для ДНК и развеять представление о том, что у этой молекулы есть волшебные свойства, которые отличают генетические тесты от других медицинских диагностических процедур?
Главный вопрос, касающийся последствий ДНК анализа для общественного здоровья, заключается в том, как люди будут реагировать на случайные или побочные находки, определяемые как «обнаруженные в результате преднамеренного поиска патогенных или предположительно патогенных генетических изменений, очевидным образом не имеющие отношения к диагностическим показателям, ради которых проводилось определение нуклеотидной последовательности»{50}.
Подход генетиков к побочным находкам не таков, как у других врачей. Например, если вы делаете компьютерную томографию грудной клетки, врач-рентгенолог не должен перед процедурой спрашивать: «Мы делаем томографию легких. А как насчет костей? Если мы обнаружим, что с костями что-то не так, вы хотите об этом узнать или вам не надо это сообщать? Хорошо, пожалуйста, подпишите согласие здесь. Теперь, как насчет мышц? Отлично, сейчас подпишите тут. Что, если мы увидим аневризму аорты, которая может разорваться? Вы хотели бы об этом узнать?» И так далее. Но если я генетик, практикующий в Нью-Йорке, то с юридической и этической точки зрения обязан вести себя именно так, когда обследую ДНК – ту часть организма, на которой я специализируюсь.
Я утверждаю, что у ДНК нет никаких волшебных свойств и что это обширный источник информации, но он принципиально не отличается от других типов медицинских данных. Да, он, возможно, своеобразный, но никак не уникальный. Мой собственный опыт говорит, что люди, которым разъяснили риски, преимущества и ограничения секвенирования генома, могут получить информацию о своей ДНК.
Проведение медицинских экспериментов на самом себе имеет давнюю и интересную историю. В 1931 г. Вернер Форсман через вену предплечья ввел катетер, направил его вверх к шее, затем на больничном лифте добрался на другой этаж и там, контролируя свои действия с помощью рентгена, опустил катетер вниз в правое предсердие и сделал рентгеновский снимок. За этот подвиг Форсман получил Нобелевскую премию по физиологии и медицине. В 1950 г. Уильям Харрингтон перелил себе кровь от пациента с низким уровнем тромбоцитов, показав, что у пациента были аутоантитела, которые снизили уровень тромбоцитов и у самого Харрингтона. В этой области были и мрачные истории. В 1885 г. Даниэль Каррион заразил себя бактериями Bartonella, чтобы проверить, действительно ли эти микробы вызывают заболевание человека (это действительно было так), и в итоге через несколько недель умер от этой болезни.
Поэтому вскоре после того, как заявку моих пациентов отклонили, я, воодушевленный примерами Форсмана и Харрингтона, но не Карриона, решил провести секвенирование своего собственного генома, хотя у меня и не было на это достаточных медицинских оснований (по крайней мере по стандартам штата Нью-Йорк). Я пошел на это, чтобы лучше понять риск и пользу этой процедуры, кроме того, мне было очень любопытно заглянуть в инструкцию к собственному организму.
Для начала, поскольку у меня относительно хорошее здоровье (хотя мой вес примерно на 5 кг больше желательного), я должен был найти профессионального генетика за пределами штата Нью-Йорк, чтобы на законных основаниях секвенировать мой геном. Я решил обратиться к Генри Линчу, описавшему синдром Линча, чтобы он проконсультировал меня по поводу моего генома. Генри уже несколько десятилетий консультирует пациентов по генетическим вопросам. Кроме того, он близкий друг нашей семьи и коллега моего отца, который работал гастроэнтерологом. В 1970-х гг. Генри с моим отцом даже путешествовали по Среднему Западу в специально оборудованном фургоне и бесплатно делали колоноскопию для сельских жителей, у которых в семейном анамнезе был рак желудочно-кишечного тракта, но не было возможности получить хорошую медицинскую помощь. Генри знал меня еще с тех пор, когда я учился в начальной школе.
Генри – генетик до мозга костей. Помню, он мне рассказывал историю, случившуюся с ним и дерматологом Рамоном Фусаро, который впервые в 1980-х гг. описал FAMMM-синдром. Это генетический синдром, при котором наблюдается множество предраковых родинок и меланом. Генри и Рамон летели на самолете в Алабаму изучать семью с FAMMM-синдромом. Генри заметил у стюардессы необычные родинки, которые располагались на шее и руках, но не на лице (это типично для FAMMM-синдрома, при котором по неизвестным причинам лицо остается чистым). Было раннее утро, и в самолете было мало пассажиров. Генри и Рамон с искренней профессиональной прямотой предложили стюардессе, если она готова, провести быстрый врачебный осмотр. В хвосте самолета стюардесса сняла блузку. Вся ее грудь и спина были покрыты родинками, как при FAMMM-синдроме. И хотя некоторые могли увидеть в этой ситуации сексуальный интерес, намерения Генри и Рамона были исключительно профессиональные и касались только медицины и здравоохранения. После посадки стюардесса немедленно направилась к дерматологу.
«Конечно, Стивен. Я буду рад помочь», – сказал Генри. Потом помолчал и спросил: «Есть что-то конкретное, что тебя беспокоит? Я знаю твою семью уже много лет и не думаю, что в вашем семейном древе коренится опасное генетическое заболевание».
«Нет, я просто один из тех, кто озабочен своим здоровьем, – немедленно признался я. – Хочу использовать свой геном для того, чтобы сохранить здоровье до старости». И после паузы добавил: «А еще я хочу знать просто ради знания».
Генри рассмеялся: «Ну, это же как разбивание стакана на еврейской свадьбе, правда? Как только ты раздавил его на тысячи кусочков, назад пути нет. Это может отвлечь тебя от твоей работы и семьи». Генри посоветовал мне не спешить с секвенированием генома и еще немного подумать над этой идеей. Такой неспешный подход в сочетании с многократными обсуждениями обычно используется при консультации пациентов с подозрением на неизлечимые заболевания, имеющие высокую пенетрантность[12], такими как, например, болезнь Хантингтона.
Подход Генри «остановись и подумай» заставил меня задуматься. Генетический анализ – это непривычный и недешевый способ получить медицинскую информацию о себе и своей семье. Узнаю ли я что-то, чего не знал раньше? Не лучше ли потратить эти деньги на отпуск с семьей в Сан-Диего? Но отпуск продлится всего несколько дней. В эпоху медицинского туризма, когда американцы едут в другие страны за более дешевыми процедурами, я всегда смогу отправиться в виртуальное путешествие по моему собственному геному. Это позволит мне найти генетические связи со своими живущими родственниками и всеми нашими предками за последние 200 000 лет.
Из моей личной и семейной медицинской истории я знал, что шансы обнаружить у меня что-то, однозначно требующее лечения, довольно низкие. При консультации по поводу генетических рисков это иногда называют априорной вероятностью. В целом для человека со скучной медицинской историей, как у меня, вероятность найти мутацию, требующую медицинского вмешательства, составляет 1–3 %. Для меня важнее была личная информация, позволяющая выяснить мое генетическое происхождение и корни нашей семьи. Кроме того, если у меня при анализе выявятся рецессивные опасные мутации, это может принести пользу моим детям. Но начну ли я тревожиться, если окажется, что я носитель неизвестного аллеля какого-то гена, важного для развития заболевания? Генри Линч предупреждал, что эта информация без возможности принять превентивные меры может меня обеспокоить. Может ли это расстроить и встревожить меня до такой степени, что помешает наслаждаться жизнью?
Однако же мы не обязаны анализировать весь геном сразу, мы можем выбрать группы генов или даже отдельные гены, а какие-то можем исключить из анализа. Например, Джеймс Уотсон, один из открывших структуру ДНК, выложил свой геном в интернет, но при этом он не хотел знать о возможном риске возникновения болезни Альцгеймера и потребовал удалить эту информацию прежде, чем ему сообщат результаты. Это был его личный выбор.
Что касается меня, возможно, я несколько наивен, однако не только решился делать анализ, но и выбрал полногеномный вариант. При этом я понимаю, что многие могут не захотеть узнать о неизлечимых мутациях, поскольку это может привести к нежелательной тревожности и депрессии.
Итак, врач стал пациентом. В следующий раз, когда я посетил Генри в его клинике в Небраске, я сдал кровь, прочитал бланк информированного согласия, и образцы крови были отправлены при комнатной температуре службой экспресс-доставки, потому что ДНК, как правило, очень стабильна.
За почти 20 лет я ни разу не встречал пациентов, жалующихся мне на генетическую дискриминацию (Луц, Женевьева и штат Нью-Йорк не в счет), и понимал, что такое бывает очень редко. Но теперь, когда сам стал пациентом, я заметно волновался по этому поводу. Я несколько раз внимательно перечитал Закон о запрете генетической дискриминации. Если анализ выявит у меня мутацию с неблагоприятным прогнозом (вчера я забыл ключи от дома, значит ли это, что у меня начинается преждевременная деменция?), то этот закон не позволит работодателю уволить меня по такой причине. Закон гарантирует, что я не потеряю медицинскую страховку из-за проявления генетической дискриминации. Как и некоторые пациенты, я подумал, не следует ли мне увеличить страховую сумму и купить дополнительно полис, обеспечивающий страхование на случай длительного ухода. Однако, по предварительным данным, вероятность мутации, о которой следует беспокоиться, слишком низка (хотя, возможно, я весьма оптимистично считал себя более похожим на Форсмана и Харрингтона, а не на Карриона) и из-за моей страсти к генетическому самопознанию решил идти до конца, невзирая ни на что.
Прошли месяцы, а секвенатор все продолжал секвенировать. Наконец я встретился с виртуальным двойником своего генома. Инструкция к моему организму находилась на маленьком серебристом жестком диске, почти таком же тонком, как и мое свидетельство о рождении. Мне пришло в голову, что однажды его можно будет использовать, чтобы клонировать мои органы или даже всего меня. Если мне понадобится напечатать на 3D-принтере почку или сердце, на этом жестком диске можно найти все гены, чтобы получить совместимые ткани, вся необходимая информация была там. Возможно, в будущем кто-нибудь захочет меня воскресить, чтобы я написал продолжение этой книги. Или же более мрачная перспектива: если я умру до того, как выплачу ипотеку, агентство Fannie Mae может захотеть клонировать меня и заставить клон работать, пока долг не будет выплачен.
Что касается интерпретации полученных результатов, то мой опыт работы профессиональным генетиком подсказывал мне, что надо сосредоточиться не на полутонах, а на черном и белом – на тех аллелях, с которыми явно все в порядке, и тех, которые в случае мутации меняют структуру белка и значительно влияют на предрасположенность к заболеваниям. Этот черно-белый набор иногда называют интерпретомом. Это гены, изменения в которых сильно повышают риск заболевания, и те аллели, которые с большой вероятностью могут содержать мутацию. В моем случае этот список оказался коротким, возможно, из-за того, что я делал тест не по медицинским показаниям.
Моя мать была из евреев-ашкенази, и в 40 лет у нее диагностировали рак груди. Опухоль была обнаружена рано при тщательном мануальном осмотре и была хирургически удалена до того, как рак успел бы распространиться в лимфоузлы или другие области организма. Мать полностью восстановилась, и, хотя с того времени прошло уже почти 40 лет, у нее не появилось ни новой опухоли в груди, ни вторичных метастазов. Рак груди часто встречается у евреев-ашкенази, у моей матери были все основания просить, чтобы страховая компания оплатила анализ на гены, связанные с этим заболеванием. Но мать так никогда и не прошла генетическое тестирование.
Она сказала: «Чему быть, того не миновать, у меня и без того достаточно забот. С моим везением, кто знает, что у меня найдут». И пожала плечами. «Я не хочу думать о генетическом анализе». Она продолжала приходить на осмотр, но не хотела дополнительно тратить душевные силы. Она лишь хотела жить своей жизнью.
Моя мама была еврейкой и росла во времена нацизма и холокоста. Поэтому она очень беспокоилась на тему генетического тестирования и возможности использовать его для социальной дискриминации. Поскольку я был ее сыном, риск получить в одном из BRCA-генов мутацию, повышающую вероятность возникновения рака груди, яичников и поджелудочной железы, составлял от 4 до 13 %. Мог ли у меня быть повышенный риск возникновения рака поджелудочной железы? Или, что еще хуже, мог ли я передать мутацию в гене BRCA своим дочерям?
По отцовской стороне в моей семье у мужчин повышенный уровень холестерина, хотя у нас и нет ранних инсультов, инфарктов и аневризм аорты. Могут ли у меня быть мутации в генах семейной гиперхолестеринемии LDLR, APOB или PCSK9? Поскольку сейчас есть эффективные препараты для лечения этого заболевания, выявление мутации помогло бы мне сохранить здоровье в старости. Вот только стоимость этих лекарств может быть непомерной. Не получится ли так, что я спущу все пенсионные накопления своей семьи на препараты, которые мне на самом деле не нужны, учитывая высокую продолжительность жизни по отцовской линии, несмотря на повышенный уровень холестерина?
Секвенирование показало, что у меня не было мутации ни в BRCA-генах, ни в других генах, связанных с гиперхолестеринемией. Но один момент меня озадачил. В отчете было указано, что у меня явная мутация в хорошо известном гене, вызывающая заболевание, даже если только одна копия дефектна. Эта мутация обрезает один важный белок на середине, таким образом, он, очевидно, не может выполнять своей функции.
Этот был ген ARID1А. Его повреждение вызывает редкое генетическое заболевание – синдром Коффина – Сириса. ARID1А способствует аккуратному и упорядоченному упаковыванию ДНК. Такая упаковка похожа на нить с бусинами, намотанную на катушку. Это помогает правильно включать и выключать необходимые гены. Таким образом, работа этого гена важна во всех типах клеток нашего тела, и его мутации могут привести к тяжелым последствиям.
При синдроме Коффина – Сириса наблюдаются дефекты лица и мизинцев рук. У плода с этим синдромом в процессе развития гибнут клетки наружной части руки. Соответственно, ребенок рождается без мизинцев рук, а иногда и ног. Аналогично во время внутриутробного развития определенные черты лица становятся более выраженными. У людей с таким синдромом широкий рот и переносица, полные губы, в отдельных случаях встречается вздернутый нос и открытые вперед ноздри, длинные ресницы и густые, темные, изогнутые брови, которые выглядят нарисованными графитовым карандашом.
Для начала я осмотрел свои руки. Десять пальцев на руках, десять – на ногах, все на месте. Для надежности я пересчитал дважды. Далее я поступил так же, как поступил бы любой уважающий себя генетик. Я взял свой iPad, открыл приложение Face2Gene и сделал селфи.
Face2Gene использует передовые алгоритмы распознавания лица, которые изначально были предназначены для поиска террориста в толпе, для диагностики генетических заболеваний, которые вызывают специфические изменения лица, как, например, «нарисованные» брови и полные губы при синдроме Коффина – Сириса.
Однако программа Face2Gene, по-видимому, решила не согласиться с моей ДНК по поводу синдрома Коффина – Сириса, подтверждая мои подозрения, что в процессе секвенирования или обработки информации что-то пошло не так.
Кроме того, мутация в ARID1А вызывает когнитивные нарушения, то, что раньше называли олигофренией. Такое встречается почти у всех людей с этим синдромом. Также должны нарушаться речевые способности, причем воспроизведение речи страдает сильнее, чем восприятие. К числу других симптомов относится низкий рост (в чем-то верно для меня) и потеря слуха (пока я слышу неплохо, но жена убеждена, что у меня серьезное расстройство слуха, хотя, наверно, это можно связать с Y-хромосомой у всех женихов и мужей). И в довесок повышенный риск развития рака печени.
Итак, что же все это значит? Может быть, у меня есть мутация в ARID1А, которая из-за какой-то случайности никак не проявилась? В принципе возможно, чтобы в генетическом окружении встретилась комбинация таких аллелей, которые, сложно взаимодействуя, смогли подавить проявление синдрома Коффина – Сириса. На языке генетических терминов такое явление называется неполной пенетрантностью, когда у человека есть мутация, но нет очевидных признаков заболевания. Но тем не менее эта мутация может передаваться по семейному дереву дальше и вызвать неприятности у будущих поколений. Известно, что многие генетические мутации иногда «пропускают» поколения по причине неполной пенетрантности.
Я подумал, не написать ли мне научное сообщение о своем клиническом случае. Однако у меня две здоровые дочери, у которых, как и у моих родителей и братьев, нет никаких признаков синдрома Коффина – Сириса. Тут мой скептицизм уже зашкаливал.
Я сталкивался с подозрительными результатами и раньше у других пациентов. Когда врач смотрит на результаты анализа, а затем на пациента и понимает, что что-то тут не так, то надо подумать, не может ли быть, что анализ проведен недостаточно качественно или что образцы перепутались.
И опять я поступил так, как должен поступать любой уважающий себя генетик. Я повторно сдал кровь, и мою ДНК повторно секвенировали, чтобы подтвердить синдром Коффина – Сириса. Этот анализ показал, что мутация в ARID1А, изначально найденная при полногеномном секвенировании, была просто ошибкой, ложноположительным результатом, который тем не менее смутил и встревожил меня, а также повлек дополнительные ненужные тесты и денежные траты. Теперь я с большим пониманием отнесся к покровительственной заботе Департамента здравоохранения штата Нью-Йорк и признал, что, возможно, поспешил со своей критикой.
Мой опыт послужит важным уроком для тех, кто озабочен своим хорошим здоровьем и хочет получить результаты одновременно 3 млрд анализов после секвенирования одного генома.
В США, прежде чем врач назначит какое-либо лекарство, оно должно быть испытано, проверено и должно получить одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов. В целом такое разрешение гарантирует высокий уровень контроля качества во всем процессе разработки и реализации препарата. В настоящее время есть несколько генетических тестов, одобренных этим управлением, и в них соблюдается два важных условия. Во-первых, они точно, по четким критериям измеряют то, что должны измерять. Во-вторых, есть убедительные свидетельства их клинической ценности. Клиническая ценность означает, что эти тесты дают информацию, полезную для непосредственного ухода за пациентом. Например, с помощью тестирования можно получить достоверные данные, необходимые для того, чтобы решить, давать ли женщине определенный тип химиотерапии для лечения ее рака груди или нет.
В то же время для большинства генетических тестов, в том числе и для полногеномного секвенирования, одобрение получено на уровне отдельных штатов, и в этом случае требования к тестам могут сильно различаться. В целом во многих штатах единственное условие, которое должно выполняться, – это чтобы тест точно измерял то, что должен измерять, независимо от его клинической ценности.
Более того, требования к контролю качества зачастую менее строги. Вероятно, этим частично объясняется, почему в штате Нью-Йорк заблаговременно были запрещены генетические тесты, доступные потребителю непосредственно (не требующие участия профессиональных генетиков и генетических консультантов, с возможностью заказа через интернет), которые, например, проводит компания 23andMe. Клиенты отправляют образцы слюны, их них извлекается ДНК; данные генетического тестирования по более чем 90 позициям, от облысения до риска рака молочной железы, публикуются в защищенном паролем файле на веб-сайте компании. В 2008 г. журнал Time назвал 23andMe изобретением года. В 2013 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов отправило 23andMe и аналогичным компаниям, напрямую работающим с пациентами, письмо-предписание о прекращении их деятельности в США. Однако в 2015 г. компания 23andMe получила разрешение на проведение анализа, результаты которого получает непосредственно потребитель, но только для синдрома Блума – редкого рецессивного заболевания, увеличивающего риск развития рака[13].
Информация о контроле качества часто закрыта и для генетиков, которые заказывают тесты, и для их пациентов. Например, насколько велика глубина покрытия при секвенировании – ведь если она небольшая, то проще обнаружить несуществующую мутацию? Какой именно алгоритм используется для классификации аллелей генов на полезные и вредные? Иногда проблемы возникают оттого, что ДНК другого пациента, с которой работали на том же оборудовании, вызывает загрязнение образца. Я наблюдал подобную ситуацию, возникшую из-за того, что по меньшей мере одной компании по генетическому тестированию следовало бы работать лучше.
Для генома есть возможность сделать высококлассные анализы, но есть и дисконтный вариант. Я купил невозвратный билет экономкласса и получил то, за что заплатил. Когда я внимательно изучил полученный результат, то заметил, что для некоторых из моих 22 000 с лишним генов нет достаточной глубины покрытия, чтобы можно было обнаружить мутации. Когда ген прочитывают недостаточное число раз для адекватного покрытия, программное обеспечение находит мутацию там, где ее нет. Если контроль качества не очень хорош, может просочиться ошибочная информация такого рода.
В моем случае это произошло с геном ARID1A. И хотя анализ покрывал весь геном, глубина покрытия составляла около 30. Это значит, что каждая позиция в геноме была прочитана в среднем 30 раз. Однако разброс глубины покрытия секвенирования составлял от 0 в некоторых областях (большинство из них неинтересны и поэтому их игнорируют) до 100 и более, из-за технических аспектов подготовки «библиотек» ДНК для секвенирования. Так случилось, что в конкретной позиции в гене ARID1A глубина покрытия составила всего 8. В каждом прочтении последовательности встречаются ошибки, связанные с встраиванием неправильного нуклеотида. Анализирующая программа усредняет множество прочтений, чтобы выдать конечный результат по конкретной позиции. К сожалению, алгоритм плохо справился с этой задачей, и я получил ложноположительный результат – мутацию, которой на самом деле нет, призрак, порожденный вычислениями.
На самом деле я нашел по меньшей мере дюжину своих генов, в некоторых экзонах которых была такая же плохая глубина покрытия и в которых присутствовали аналогичные ошибки, хотя эти конкретные места в геноме и соответствующие аминокислоты не влияют на заболевания. Например, мне определили мутацию в гене ActinB, который никогда не был связан с каким-либо человеческим заболеванием, и это был ложноположительный результат из-за плохой глубины покрытия. Однако же, если эти плохо прочитанные области содержали клинически важные гены, при секвенировании моего генома можно было легко пропустить важные результаты. Возможно, отеческая забота штата Нью-Йорк была не такой бессмысленной, как я изначально предполагал. Что ввел, то и получил, как говорят компьютерщики.
Первое секвенирование моего генома обошлось мне примерно в $2750. Позже мой геном секвенировали в другой лаборатории с более высоким уровнем контроля качества, и это стоило около $5000. Эта версия пришла на iPad со специальным геномным приложением. Я вручную проверил первичные данные, прежде чем смотреть, что там нашлось. Общая глубина покрытия была намного лучше (более чем в 40 раз), и по ряду дополнительных признаков я смог убедиться, что эта последовательность действительно моя. Это был геном мужчины (верно!). В нем были десятки аллелей, частота которых выше у евреев-ашкенази, что соответствует моему этническому происхождению.
В общей сложности у меня было идентифицировано около 4 млн нуклеотидных замен. Среди этого множества лишь немногие предположительно имели хоть какое-то отношение к здоровью. Большинство просто составляли длинный список генетических изменений, значение которых не ясно, по крайней мере в настоящее время. Просматривая этот список, я мог лишь пожать плечами и понадеяться, что медицинская генетика еще при моей жизни сумеет понять, какое значение имеют эти варианты, если это не бессмыслица и они вообще имеют какое-то значение.
Около 25 000 таких вариаций найдено в моем экзоме. В отличие от стандартного генетического набора Homo sapiens у меня примерно в 80 генах, в одной или в обеих копиях были изменения, мешающие производить белок, потому что в этих генах появились новые стоп-кодоны. Когда информация с гена скопирована на информационную РНК и по ней начинает синтезироваться белок, появление нового стоп-кодона означает, что процесс прервется в этом месте и белок не будет синтезирован до конца. Если мы возьмем слово «геном» для иллюстрации, то ошибки такого рода приведут к тому, что мы получим лишь фрагмент «гено». Точно так же у меня было около 30 генов, в которых мутация испортила стоп-кодон и белок получался длиннее, чем надо. В нашем примере вместо слова «геном» получился бы неологизм «геномаут». Однако для меня было важно, что в настоящее время никакие из этих укороченных или удлиненных белков не имеют значения для здоровья. Поэтому сейчас они лишь удовлетворяют мое генетическое любопытство. Например, интересно, что я не чувствую многие серные запахи и у меня повреждены несколько генов ольфакторных (запаховых) рецепторов. Что ж, возможно, мне следует записаться на исследование по генетике обоняния или основать компанию по производству препаратов, блокирующих восприятие неприятных запахов. Но в остальном эта информация не имеет отношения к медицине, по крайней мере пока.
Неандертальцы – вымерший вид человека, у них примерно один из 300 нуклеотидов отличается от тех, что имеются у современного вида Homo sapiens. Оказалось, что содержание неандертальской ДНК в моем геноме было чуть выше среднего уровня, составляющего немного менее 2 %. Значит, предположительно, у моей семьи есть далекие неандертальские родственники, жившие около 50 000 лет назад.
В длинном списке моих аллелей был вариант кожного белка кератина, который делает кожу, волосы и ногти более устойчивыми к низким температурам. Многие нуклеотидные особенности соответствовали тому, что моя мать говорила все время: я – еврей-ашкенази. Кроме того, я, несомненно, был одним из удивительно большого числа потомков Чингисхана, который жил примерно 30 поколений назад. Генеалогические ДНК-исследования свидетельствуют, что он и его наследники оплодотворили тысячи женщин по мере того, как полчища монголов продвигались из Азии в Европу. Эта генетическая информация сейчас содержится у 0,5 % населения Земли. И хотя неизвестно, какая именно ДНК была у Чингисхана, потому что нет ее образцов, мы знаем, что эта ДНК распространялась через Евразию тем же путем, что и монголы с Чингисханом.
У меня есть много известных, но не связанных со здоровьем аллелей, имеющих слабое влияние. Например, в моем геноме записано, что у меня выделяется ушной серы больше среднего. Есть аллели, соответствующие моим карим глазам и каштановым волосам. Я приберегаю эти фрагменты личной информации для светской болтовни.
Однако, когда я переключил внимание на конкретные мутации в генах, которые однозначно вызывают заболевания, то обнаружил, что у меня нет ни одной такой. Моей первой реакцией было небольшое разочарование, что я потратил время, деньги, усилия и не нашел ничего очевидно полезного для поддержания хорошего здоровья. Конечно, я понимал, что должен быть счастлив из-за такого результата. Отсутствие мутаций, связанных с повышенным риском развития раковых или неврологических заболеваний, безусловно, положительный результат.
В будущем некоторые из этих результатов могут пригодиться, если когда-то мне назначат определенные лекарства. Если я когда-нибудь подхвачу гепатит C, то у меня есть аллель гена IL-28B, и можно предположить, что при заражении вирусом гепатита C я с большей вероятностью смогу дать отпор естественным образом, уничтожить вирус и не заболеть. Это значит, что мне может не понадобиться лечение. Кроме того, наличие этого варианта гена свидетельствует, что если после воздействия вируса гепатита C у меня все-таки разовьется заболевание, то я с большей вероятностью могу вылечить его с помощью препаратов интерферона и рибавирина. Это потенциально полезная информация, поскольку некоторые лекарства имеют неприятные побочные эффекты, в том числе ломоту, как при тяжелом гриппе. Зная, что я, скорее всего, получу пользу от этих препаратов, мне будет легче перетерпеть эти неизбежные побочные эффекты.
Далее я посмотрел на аллели, которые могут повлиять на мою семью. Я был рад за моих двух дочерей, так как, несмотря на то что у моей матери был рак груди, у меня нет мутации ни в одном из дюжины с лишним генов, которые связаны с повышенным риском рака груди и яичников, в том числе в печально известных BRCA1 и BRCA2.
Однако я обнаружил, что я носитель четырех рецессивных заболеваний, которые могут проявиться в следующих поколениях. Это значит, что у меня есть по одной нормальной и одной мутантной копии этих генов. У каждой из моих дочерей есть 50 %-ная вероятность получить мутантную копию. Это может создать проблемы для их потомков, если у отцов их детей будут мутации в тех же генах. И хотя этот риск и так небольшой, благодаря генетическому тестированию, в будущем мои дочери и их супруги могут свести до нуля вероятность того, что у их детей (моих внуков) проявятся эти рецессивные заболевания.
Первая рецессивная мутация, которую я увидел, была в гене ASPA. Она многократно обсуждалась в научной литературе. У детей, имеющих два мутантных аллеля этого гена, нарушена работа фермента аспартоацилазы, и вещество под названием N-ацетиласпартат накапливается по всему телу. Это особенно токсично для клеток, образующих защитный материал миелин, который важен для правильного функционирования нервной системы и работает как изоляция на электрических проводах. Такое заболевание называется болезнь Канавана. У детей с этим заболеванием вырастает более крупная голова и часто уже в возрасте до шести месяцев проявляется задержка развития. Когда дети становятся старше, им бывает сложно сидеть, ходить и говорить. Многие дети умирают от болезни Канавана в подростковом возрасте или даже раньше. Та конкретная мутация, которая была у меня, встречается среди европеоидов реже, чем в 1 случае на 10 000, однако среди детей с синдромом Канавана она была замечена ранее не менее дюжины раз.
Вторая мутация, которую я заметил, была в гене DHCR7, который влияет на способность организма синтезировать холестерин. Наличие двух мутантных копий этого гена вызывает синдром Смита – Лемли – Опица, названный так в честь американского, бельгийского и немецкого ученых, которые его открыли. Это заболевание связано с синтезом холестерина, который важен для развития плода, в особенности его мозга. Нарушение выработки холестерина мешает нормальному производству миелина, важнейшей жировой субстанции, которая работает как изоляция и не дает пересекаться различным нейронным «проводам». При синдроме Смита – Лемли – Опица наблюдается умственная отсталость, расщепление верхней губы и у некоторых детей формируются наружные половые органы промежуточного типа. Многие дети с этим синдромом необычайно агрессивны и склонны к самоповреждениям. Наблюдаются специфические нарушения, которые схожи с расстройством аутистического спектра, в том числе ритмичное раскачивание верхней части тела и характерные движения пальцев. Та мутация, которая была у меня, встречается у 1–2 % представителей европеоидной расы. Поскольку такой синдром с большой вероятностью приводит к гибели плода, то носитель двух мутантных копий встречается реже, чем 1 на 10 000 новорожденных.
Кроме того, у меня была мутация в гене NEU1. Этот ген кодирует фермент нейраминидазу, которая расщепляет еще один тип липидных отходов. Когда повреждены обе копии гена, возникает заболевание муколипидоз. При муколипидозе происходит дегенерация мышц и мозга и увеличение печени и макрофагов селезенки за счет накопления жировых отходов, которые не могут быть переработаны, так же как и при болезни Гоше. Лабораторные эксперименты показали, что, когда в гене NEU1 имеется эта мутация, белок не складывается в правильную форму, которая необходима для связывания и расщепления липидов.
Моя четвертая рецессивная мутация была в гене ATP7B. Этот ген кодирует белок, который работает как сливной насос, откачивая медь из клеток. Нам всем жизненно необходимо получать немного меди с пищей, но ее избыток токсичен. Когда этот насос плохо работает, чрезмерное количество меди может накапливаться в печени, мозге и других органах, приводя к синдрому, который называется болезнь Вильсона – Коновалова. У пациентов с таким заболеванием может образовываться характерное зеленовато-бурое кольцо вокруг радужной оболочки глаза, когда там накапливается медь. Наблюдаются такие симптомы, как желтуха, повышенная утомляемость, вздутие живота, депрессия, перепады настроения, неуклюжесть и дрожание рук. Моя конкретная мутация встречается среди американцев европейского происхождения в трех случаях на 1000 человек{51}.
Насколько я могу судить, ни одно из этих заболеваний не влияло на мое здоровье, поскольку, как я уже говорил, это рецессивные заболевания, а я был лишь носителем мутации. Все четыре мутации очень редки, и обычно на них не делают анализы будущим родителям, которые планируют зачатие, если только они сами или члены их семей не болеют соответствующими заболеваниями. Но теперь, вооруженные этой информацией, мои дочери, племянники и кузины могут, если захотят, сделать анализ на мутации в этих генах. Будущие поколения моей семьи могут не заводить детей с партнерами, несущими эти рецессивные мутации. Хотя обсуждение этого дивного нового мира с потенциальными супругами будет непростым. Готов ли я генетически дискриминировать моего будущего зятя, если у него обнаружатся мутации в ATP7B? Надеюсь, что нет. Тем не менее я ожидаю, что таких первопроходцев в области секвенирования генома, как я, будет все больше и больше и они будут оказывать давление на предполагаемых супругов, чтобы те сделали генетический анализ для выявления рецессивных заболеваний, прежде чем заводить детей.
В 2013 г. Национальные институты здравоохранения объявили о новой экспериментальной программе стоимостью $25 млн по секвенированию геномов сотен новорожденных детей в США, чтобы больше узнать, насколько полезным может оказаться такое тестирование и как это выглядит с точки зрения этики. Алан Гуттмахер, директор Национального института здоровья ребенка и развития человека, инициировавший эту программу, сказал: «Можно представить себе тот день, когда геном каждого младенца будет секвенирован при рождении, это станет частью его электронной медицинской карты и может использоваться на протяжении всей жизни не только для лучшей профилактики, но и для того, чтобы внимательнее относиться к ранним клиническим проявлениям заболевания»{52}.
Рецессивные заболевания встречаются редко, однако их примерно 4000, и от таких заболеваний страдает 2 % населения, а это уже веская причина для полногеномного секвенирования у новорожденных. Большая часть этих страданий непропорционально ложится на самое дорогое и уязвимое, что у нас есть: наших детей.
Дефицит среднецепочечной ацил-КoA дегидрогеназы жирных кислот (MCADD) – одно из заболеваний, на которое проверяют младенцев с помощью биохимического анализа капли крови, взятой из пятки вскоре после рождения[14]. Однако родителям не делают генетический анализ, поскольку это довольно редкое заболевание.
Анна Моррис – мой друг и коллега-генетик – одна из тех матерей, чья семья получила генетический удар, и ей бы точно пригодилась более полная генетическая проверка до оплодотворения. Анна родила ребенка от донора спермы. Банки спермы обычно тестируют доноров на такие распространенные генетические заболевания, как муковисцидоз, но не на редкие рецессивные болезни.
Анна и донор несли мутацию в гене ACADM, которая вызывает болезнь MCADD. Это относительно редкое заболевание встречается примерно у 1 из 10 000 новорожденных. Белок ACADM участвует в метаболизме и помогает превратить липиды в сахара для обеспечения организма энергией. У новорожденных часто снижается уровень сахара в крови, когда они болеют и не потребляют достаточного количества грудного молока или молочной смеси. Если есть MCADD, но оно не диагностировано, то это может стать причиной внезапной детской смерти или судорог после легкого недомогания. В то же время у других детей с MCADD может не проявляться никаких симптомов, если они не испытывают периодов длительного голодания, которое может привести к сильному снижению уровня сахара в крови. Дети с MCADD могут прожить долгую и насыщенную жизнь при правильном наблюдении со стороны членов их семей и врачей. Анна и ее семья, зная о диагнозе сына, сумели сохранить его здоровье (сейчас он уже подросток) благодаря тому, что за его диетой тщательно следили. То есть перед нами генетическая профилактическая медицина в своем лучшем виде.
Анна основала компанию по генетическому тестированию будущих родителей и сейчас в должности генерального директора делает все возможное, чтобы помочь другим родителям снизить риск подобных ударов со стороны генетики, поскольку они случаются гораздо чаще, чем хотелось бы. По аналогии с вакцинацией если каждый сделает анализ примерно на 600 генов, то это поможет избежать многих страданий, а также излишних трат.
Я обнаружил, что у меня есть миллионы нуклеотидных замен неясного значения, про которые не известно, связаны они с заболеваниями или нет. И хотя это не поможет моей семье прямо сейчас, знание об их существовании может быть вложением в будущее. Тут есть важный момент: если вам известна последовательность вашего генома, вы можете выбрать лабораторию, которая будет продолжать следить за интерпретацией этой информации по мере накопления генетических знаний и затем оповещать вас. Но будьте бдительны, если выбираете дешевые варианты секвенирования!
Получив последовательность своего генома и обнаружив, что с высокой вероятностью у меня впереди долгая здоровая жизнь, я почувствовал воодушевление и желание в дальнейшем улучшить заботу о своем организме. Я торжественно пообещал регулярнее заниматься физическими упражнениями, лучше питаться, сбросить вес и скопить средства для жизни на пенсии, которая может быть долгой. Я также узнал кое-что новое о моем происхождении и о связи со всем остальным человечеством. Я рад, что мои находки могут принести полезную информацию будущим поколениям моей семьи.
А еще я понял, что мой геном может быть полезен и другим людям, не только моим родственникам. Существует много неизвестного, обнаруживается масса аллелей с непонятным значением, и единственный способ разобраться – оценить геномные данные максимально большего числа людей. Это поможет понять, какие аллели с какими заболеваниями связаны. Я надеюсь, что мой геном и мою медицинскую карту можно будет сохранить в базе данных, чтобы о них могли узнать другие люди. Я готов участвовать в крупных международных программах, которые, я считаю, помогают медицинским исследованиям и делают мир лучше.
Лично для себя я в полной мере понял необходимость генетической конфиденциальности. Говорят, что вам не надо самому болеть гепатитом, чтобы вылечить пациента с гепатитом, однако точно так же, как мое отцовство помогло мне как врачу лучше понимать детей и их родителей, секвенирование моего генома позволило мне лучше понять переживания по поводу генетической конфиденциальности и дискриминации. В Школе медицины Маунт-Синай в Нью-Йорке есть курс для студентов магистратуры, где они изучают свои геномы, а все врачи-психиатры высшей категории обязаны пройти как минимум годичный курс психодинамической терапии в качестве пациентов. Возможно, студентам-медикам и профессиональным генетикам следует сделать секвенирование собственного генома, чтобы, занимаясь медицинской генетикой, лучше понимать чувства пациентов.
И в заключение я хотел добавить, что Департамент здравоохранения штата Нью-Йорк отклонил казавшуюся мне разумной просьбу о секвенировании генома для моих здоровых пациентов в начале 2014 г. В октябре 2016 г. Департамент изменил свою политику. Теперь можно делать полногеномное и полноэкзомное секвенирование без предварительного разрешения штата. Ньюйоркцы, интересующиеся поддержанием своего хорошего здоровья, могут провести секвенирование своих геномов и экзонов в этом штате, не оплачивая лишних пошлин, и не проводят время в пробках на мосту Джорджа Вашингтона.
Как бы то ни было, в 2013 г. после отказа штата Нью-Йорк Луц и Женевьева съездили в Нью-Джерси, где и сделали секвенирование своего экзома. К счастью, оказалось, что с медицинской точки зрения у них довольно скучный экзом. По моему мнению, генетические тесты и лаборатории должны иметь рейтинговую систему для пользователей, как это сделано для ресторанов. Класс A означает уровень, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Класс B получат те, кто качественно выполняет анализы, но их тесты не обязательно имеют клиническую ценность. Например, анализы C-класса менее качественные и не обязательно имеют клиническую ценность и т. д. Сегодня Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, конгресс и индустрия генетического тестирования продолжают спорить о том, насколько строго должно регулироваться качество генетических тестов в США и как разграничить контроль качества и торможение непрерывного процесса введения новых генетических тестов.
Глава 8 Поколение XX/XY
Сегодня полногеномное секвенирование стало обычным элементом медицинской помощи гражданам в развитых странах при широком спектре заболеваний, и сотни тысяч людей уже провели полное секвенирование своего генома или экзома.
Эти потрясающие достижения вызвали огромный энтузиазм не только среди ученых, врачей и пациентов, но и среди политиков и экспертов в области здравоохранения. Появилось новое направление – «прецизионная медицина» (ее еще называют персонализированной или индивидуальной). Ожидается, что благодаря такому подходу меньше людей будут болеть диабетом, раком или другими заболеваниями.
Поскольку мы можем это сделать, в США и за рубежом идут серьезные политические дискуссии среди ученых, политиков и специалистов в области здравоохранения о том, надо ли нам в ближайшие, скажем, 10 лет начать секвенировать геном всех детей, рождающихся в США, так называемого поколения XX/XY. Секвенирование всего генома при рождении дополнило бы или заменило существующий сейчас скрининг новорожденных, когда берут кровь из пятки и проводят тесты на пару десятков заболеваний, которые хорошо поддаются лечению (в основном наследственных и, кроме того, ВИЧ и некоторых других). Мы надеемся, что полногеномное секвенирование новорожденного даст больше возможностей для индивидуального подхода при оказании медицинской помощи с первых дней жизни ребенка. Это поможет поймать сразу двух зайцев: здоровье будет лучше благодаря прецизионной медицине с самого рождения, а улучшенная профилактика поможет сдержать стремительный рост затрат на здравоохранение, который в последнее время обретает чудовищные масштабы.
Если мы проведем этим малышам полногеномное секвенирование, то благодаря прецизионной медицине сможем снизить количество хотя бы наиболее тяжелых из 6000–8000 заболеваний с менделевским типом наследования. Эти заболевания вызывают страшную боль, страдания и смерть и потребляют непропорциональное количество ресурсов здравоохранения – и государственных, и личных. Например, можно обнаружить некоторые редкие заболевания, которые нарушают иммунную систему так, что у детей развиваются опасные для жизни инфекции, и вылечить их пересадкой костного мозга. Мы сможем бить врага его же оружием, бороться с наследственными заболеваниями с помощью геномики.
Первой попыткой применить такую стратегию, то есть использовать полногеномное секвенирование, чтобы выявить у детей заболевания с менделевским типом наследования и облегчить их состояние, была кампания, проведенная в Бруклине расположенной в Нью-Йорке международной организацией Dor Yeshorim (דור ישרים), название которой переводится как «Поколение праведных» (Псалтырь 111:2)[15]. На примере Dor Yeshorim хорошо видны огромные преимущества и возможные подводные камни.
В Книге Иова мы читаем, что Иов был богатым и знатным человеком, жившим на северо-востоке Израиля со своей любящей семьей, где было семь сыновей и три дочери. Затем Бог решил испытать веру своего благочестивого слуги. Иов потерял богатство и покой, все его дети погибли в руках Сатаны. Если бы эта книга Ветхого Завета создавалась в наше время, при описании проклятия Сатаны могла бы упоминаться болезнь Тея – Сакса, наследственное заболевание, возникшее как будто из самой глубины ада.
При развитии болезни Тея – Сакса красивый цветущий младенец в шесть месяцев вдруг перестает держать голову. Затем у малыша появляются проблемы с глотанием, и он не может есть. Потом утрачиваются двигательные и когнитивные навыки, появляются судороги, паралич и слепота. По мере того как прогрессирует заболевание, ребенок переходит в вегетативное состояние, которое обычно заканчивается смертью к трем-четырем годам из-за отказа нервной системы. Более поздняя форма болезни Тея – Сакса может возникать у подростков и сопровождается прогрессирующей мышечной слабостью, проблемами при ходьбе, потере связности речи и психическими нарушениями.
Болезнь Тея – Сакса была впервые описана более века назад неврологом из Нью-Йорка Бернардом Саксом, который заметил, что среди его пациентов маленькие дети, страдавшие от этого заболевания, очень часто оказывались потомками евреев-ашкенази (сам Сакс тоже был из этой этнической группы). Болезнь Тея – Сакса – рецессивное заболевание с менделевским типом наследования, то есть, чтобы ребенок заболел, он должен получить две мутантных копии гена HEXA, по одной от каждого из родителей. В то же время у родителей, у которых вторая доминантная копия была неповрежденной, не наблюдалось никаких подозрительных симптомов. Шансы любого из детей унаследовать по рецессивной копии от каждого из родителей, так, чтобы возникло заболевание, составляют один из четырех. Таким образом, во многих семьях, особенно в тех, где предыдущие дети были здоровыми, это событие становилось неожиданным и ужасным ударом. В 1969 г. впервые было показано, что болезнь Тея – Сакса – наследственное нарушение обмена веществ, и был разработан анализ крови для определения повреждения этого гена у родителей. Первая экспериментальная программа скрининга началась в 1971 г. среди населения евреев-ашкенази в Балтиморе, штат Мэриленд. С тех пор благодаря анализам число детей с болезнью Тея – Сакса снизилось почти на 90 %.
Для любой этнической группы есть такие заболевания, которые встречаются в этой группе чаще или реже, чем обычно, потому что так сложилась генетическая история. Например, наследственные заболевания крови под названием талассемия (обсуждаются в главе «Высотная болезнь») более распространены среди потомков жителей Африки или стран Юго-Восточной Азии. В целом, однако, разные этнические группы из разных концов планеты удивительно похожи генетически. Если рассмотреть усредненный человеческий геном, окажется, что примерно девять из каждых десяти генетических вариаций будут найдены практически в любой этнической группе. Поэтому можно предположить, что, если мы сравним две случайно выбранные этнические группы из Европы или Азии, они между собой будут различаться не намного сильнее, чем два случайно выбранных человека из одной группы. Мутации в гене HEXA, которые приводят к заболеванию Тея – Сакса, встречаются не только у евреев-ашкенази, но именно в этой популяции они наиболее широко распространены. Почему так получилось, непонятно.
Раввин Йозеф Экштейн прошел через то же испытание, что и Иов, наблюдая, как четверо его детей умирали от этой болезни, и в итоге основал Dor Yeshorim в 1983 г. Dor Yeshorim и другие подобные программы обеспечили резкое сокращение этого заболевания среди ортодоксальных евреев. Был проведен анализ для более 150 000 человек. Невероятно, но до сегодняшнего дня у участников программы Dor Yeshorim не родилось ни одного ребенка с болезнью Тея – Сакса.
Организация Dor Yeshorim вначале делала анализ только на болезнь Тея – Сакса. Когда были идентифицированы гены, вызывающие еще девять тяжелых рецессивных наследственных заболеваний, часто встречающихся у евреев-ашкенази, список вырос до десяти заболеваний. Ученики старших классов ортодоксальной еврейской школы сдают анализы за несколько лет до того, как начинают планировать семью. При тестировании используется стратегия анонимности участников. Человеку, сдающему кровь или слюну для анализа ДНК, присваивается уникальный буквенно-цифровой код (вроде PIN-кода). Однако имя человека никак напрямую не связывается с результатами теста, ни подростку, ни его родителям не выдают результаты.
Ортодоксальные евреи по сей день используют сватовство, чтобы получить согласие на брак. Свахами обычно выступают женщины, которых называют шадханитами (хотя дети обычно зовут их хлопотуньями), они руководят формальной процедурой сватовства – шидух, и эта традиция до сих пор во многом похожа на сватовство дочерей Тевье с их будущими мужьями в популярном мюзикле «Скрипач на крыше».
Позвонив на горячую линию Dor Yeshorim и назвав коды обеих сторон, пара может получить нужную генетическую информацию. Вопрос, когда именно ортодоксальные еврейские юноша и девушка должны позвонить в Dor Yeshorim, чтобы «провериться на носительство», обсуждается во время чая со сладостями, кошерной выпечкой и кружевными салфетками. В принципе, вопрос о носительстве может быть выяснен перед первым свиданием. Но на практике это неудобно. Некоторым родителям может казаться, что их дети слишком часто ходят на первое свидание и поэтому слишком много звонят по телефону горячей линии. Другим кажется, что проверка на носительство – слишком сильное давление на детей, подталкивание их к раннему браку. Хуже того, просьба провериться на носительство может быть воспринята так, будто один из партнеров ведет себя слишком напористо и торопит развитие отношений, вместо того чтобы выбрать темп, комфортный обоим. Даже я, неортодоксальный еврей, клинический генетик и отец, понимаю, что обсуждать наследственные заболевания перед первым свиданием – верный способ убить романтический настрой, смутив детей, у которых, конечно, полно других важных мыслей в голове. На самом деле некоторым родителям надо бы понимать, что из-за необходимости проверки на носительство в Dor Yeshorim некоторые стеснительные молодые мужчины и женщины могут вообще не начать встречаться.
На практике получается, что генетическая проверка обычно осуществляется примерно при третьей встрече, прежде чем отношения станут достаточно серьезными. Когда дети или их родители звонят на горячую линию Dor Yeshorim, им сообщают, есть ли риск рождения больного ребенка с этим конкретным потенциальным партнером.
Dor Yeshorim не сообщает им, гены какого заболевания у них есть. Аборт не одобряется ортодоксальным еврейским законом и допускается только в определенных ситуациях. Однако, если отношения продолжаются, будущие молодожены могут использовать преимплантационное генетическое тестирование для снижения риска рождения больного ребенка. Кроме того, они могут усыновить ребенка или же все-таки рискнуть, несмотря на шанс рождения больного ребенка.
Когда выясняется, что оба партнера – носители наследственного заболевания, и отношения резко прекращаются, возникают опасения, что сообщество может заметить это, догадаться, что проблема в генетике, и отвернуться от молодых людей или их родственников. На семьи, прежде пользовавшиеся популярностью, могут навесить ярлык «носители наследственного заболевания», когда они попытаются найти своему отпрыску другого партнера. Неудивительно, что возникает много жалоб и обоснованных этических возражений, касающихся подхода, который использует Dor Yeshorim для контроля наследственных заболеваний. Раввин Моше Давид Тендлер, профессор медицинской этики в Иешива-университете в Нью-Йорке, говорит, что деятельность Dor Yeshorim «поддерживает евгеническую идею, что евреи – это скопление плохих генов»{53}. Другие опасаются, что Dor Yeshorim много на себя берет, и считают, что эта организация, стремясь уменьшить число детей, рожденных с наследственными заболеваниями, использует подход оруэлловского «Большого брата». Кроме того, в газете Jewish Chronicle было опубликовано письмо по поводу скрининговой программы, которую использует Dor Yeshorim для контроля болезни Тея – Сакса. Там написано, что люди, у которых обнаружены рецессивные мутации, связанные с болезнью Тея – Сакса и другими заболеваниями, переживают чувство отверженности и психологический стресс, если результат анализа на какое-то из этих заболеваний оказывается положительным{54}.
Хотя я и разделяю некоторые опасения насчет Dor Yeshorim, но лично, как врач и специалист по медицинской генетике, которому довелось заботиться о многих людях с наследственными заболеваниями, считаю, что это великая мицва (доброе дело). Когда я родился в 1960-х гг., болезнь Тея – Сакса встречалась более чем в десять раз чаще, чем сейчас. За всю мою врачебную карьеру я видел всего одного ребенка с болезнью Тея – Сакса (его родители были каджунами, а не евреями, поэтому не проходили скрининга в Dor Yeshorim). За то, что мне не доводилось больше встречать таких пациентов, я очень благодарен Dor Yeshorim и другим подобным организациям, которые помогли повысить осведомленность о необходимости проверки среди неортодоксальных евреев и других этнических групп.
Теперь вернемся к будущим новорожденным детям поколения XX/XY. Если будет введено полногеномное секвенирование всех американских младенцев, весьма вероятно, что распространенность многих наследственных заболеваний с менделевским типом наследования, особенно рецессивных, значительно снизится, поскольку у большинства носителей будет информация, которая подтолкнет их рассмотреть ПГТ, суррогатное материнство, усыновление и другие варианты. С политической точки зрения это дает, вероятно, интересную возможность увидеть согласие сразу в обеих партиях[16], поскольку генетический скрининг, скорее всего, значительно снизит количество абортов в США, потому что уменьшится число генетических заболеваний, которые в настоящее время обнаруживаются только после начала беременности.
Но возможно ли, что всеобщее тестирование несет не только пользу, но и серьезную опасность? «Анализы ДНК младенцев ускоряют диагностику редких заболеваний» – читаем мы заголовок в свежем номере The New York Times{55}. Чем же это может быть плохо и кто может быть против того, чтобы начать делать полногеномное секвенирование новорожденных как можно скорее? Пожалуй, основная проблема – страх перед генетической дискриминацией и евгеникой.
Развитие генетической дискриминации и чрезмерный энтузиазм по поводу возможностей использования генетической информации начались еще до открытия ДНК, они возникли в конце XIX в., когда зародилась евгеника.
Впервые термин «евгеника» ввел британский ученый сэр Фрэнсис Гальтон в 1880-х гг. Гальтон был блестящим психологом, социологом, антропологом и вообще эрудитом (ему также приписывают создание первой синоптической карты), сделавшим серьезные открытия в области статистики. Он описал некоторые важные понятия, которые до сих пор используются в генетике и во многих других областях, например корреляцию (так, веснушки и рыжие волосы у детей коррелируют с веснушками и рыжими волосами у родителей).
Как родоначальник социологии Гальтон первым начал создавать опросы и анкеты для сбора данных, чтобы проанализировать различные социологические, психологические и биологические характеристики. Считается, что именно он ввел в обращение широко используемое выражение «природа или воспитание», описывающее взаимодействие генов и окружающей среды. Поэтому неудивительно, что Гальтон хотел применить социологические методы для улучшения социальных условий в Великобритании. Его книга «Наследственность таланта» (Hereditary Genius)[17] была одной из первых, где достижения и богатство рассматривались как фамильные черты. Используя такие источники, как «Справочник современников» (The Dictionary of Men of the Time), который был аналогом нынешних книг «Кто есть кто», Гальтон отметил, что британцы с выдающимися успехами в области искусств, наук и политики с большей вероятностью оказывались в родстве друг с другом, чем с остальной частью населения. Гальтон заключил, что наследуются не только рост, цвет кожи и другие физические свойства, но и способность быть умным, богатым, творческим и занимать высокое социальное положение.
По-видимому, не случайно, что с конца XIX в. по начало XX в. был период поразительного научного прогресса в биологии и физике. В это время в физике появилась теория относительности и повсеместно распространялись новейшие технологии, такие как электрическое освещение, телеграф и автомобиль. Широкая публика постепенно принимала теорию эволюции Чарльза Дарвина (Гальтон был двоюродным братом Чарльза Дарвина), и стали известны классические генетические опыты Грегора Менделя, остававшиеся забытыми на протяжении предыдущих нескольких десятков лет. Томас Морган с коллегами, работая с дрозофилой, установили фундаментальные принципы наследственности, за открытие которых они потом получат Нобелевскую премию. В эти времена «позолоченного века» стремительно росла численность населения, усилилась конкуренция за природные ресурсы, увеличилось этническое разнообразие, а заодно выросло и социальное неравенство.
Гальтон определил евгенику как «саморегуляцию человеческой эволюции»{56}. И как физика применяется в инженерном деле, методы социальных наук должны были использоваться в евгенике. Основной целью евгеники было использовать поразительные научные открытия того времени во благо, содействуя более высокой скорости размножения людей с желательными чертами, но у нее была и обратная сторона: с помощью евгеники предполагалось снижать воспроизводство людей с признаками, которые считались менее желательными. Кроме того, евгеника была способом научно обосновать расовые и классовые предрассудки.
К началу XX в. евгеника получила признание в Северной Америке и Европе. Чтобы не позволить «нежелательным» людям иметь детей, предлагалось использовать методы стерилизации, такие как гистерэктомия и вазэктомия. Обсуждалась даже идея стерилизовать людей с полной цветовой слепотой. Евгеника не была движением фанатиков, она была актуальной социальной философией и часто воспринималась как прогрессивная научно обоснованная идея. В 1913 г. президент Теодор Рузвельт писал известному стороннику евгеники Чарльзу Давенпорту: «Когда-нибудь мы поймем, что первейшая обязанность, важнейшая обязанность хорошего гражданина правильного типа – оставить после себя на земле продолжение своего рода. Неправильные типы использовать не надо»{57}.
Сегодня лаборатория Колд-Спринг-Харбор на Лонг-Айленде – культовое место для генетиков, там по-прежнему происходят самые современные генетические открытия, но раньше это был главный центр американских евгенических «исследований». В 1910 г. там был открыт Государственный евгенический архив, его работу финансировали Рокфеллеры и Институт Карнеги{58}.
Уинстон Черчилль поддерживал британскую евгенику, беспокоясь о том, как Англия сможет конкурировать с растущей мощью Германии. Он предложил использовать новейшую технологию той эпохи – рентгеновские лучи для эффективной стерилизации нежелательных для размножения, например психически больных и инвалидов (заболевания которых предположительно, но необязательно имели генетические причины){59}. Евгеника стала научной дисциплиной во многих колледжах и университетах, и это придало ей респектабельность. Среди известных и уважаемых общественных деятелей, поддержавших евгенику, были экономист Джон Мейнард Кейнс (руководитель Британского евгенического общества), Лайнус Полинг, Джордж Бернард Шоу (евгеническая философия обсуждается в его классической пьесе «Человек и сверхчеловек»), Герберт Уэллс, Александр Белл и Оливер Уэнделл Холмс.
Пожалуй, самый печально известный случай практического применения евгеники в США – это история с принудительной стерилизацией по приговору суда, когда в 1927 г. в Верховном суде было рассмотрено дело «Бак против Белла». Мать Керри Бак была афроамериканкой без образования и с медицинским диагнозом «слабоумие», ее содержали в колонии штата Вирджиния для эпилептиков и слабоумных. Керри была подростком и воспитывалась в приемной семье, поскольку ее мать содержалась в лечебном учреждении. Дальний родственник ее приемной семьи изнасиловал ее, и она родила дочь. Непонятно, из-за генетических причин или нет, дочка Керри отставала в развитии, и в шесть месяцев ей диагностировали слабоумие{60}. Впоследствии мать Керри обследовали местные врачи и поставили ей диагноз «наследственное слабоумие». Хотя Керри тоже не хватало образования, она хотела выйти замуж и иметь семью, поэтому сопротивлялась принудительной стерилизации, и было несколько судебных слушаний и апелляций. Одним из назначенных судом защитников оказался Обри Строд, юрист, известный тем, что поддерживал евгенику и был поэтому не вполне беспристрастен.
В 1927 г. дело дошло до Верховного суда США. Суд вынес решение против Бак, поддержав ее стерилизацию, чтобы она не могла больше иметь детей. Принимая историческое решение по делу «Бак против Белла» сторонник евгеники и главный судья Оливер Уэнделл Холмс поддержал принудительную стерилизацию людей, имеющих родственников с наследственной задержкой умственного развития, своей печально известной фразой «достаточно и трех поколений имбецилов»{61}. В постановлении суда говорилось, что «лучше дать обществу возможность ограничить в правах тех, кто явно не подходит для продолжения рода, чем дожидаться, пока их дегенеративные отпрыски окажутся на скамье подсудимых или умрут с голоду из-за своей имбецильности».
США были мировым лидером в области евгеники. В период с начала века и до 1981 г. на основании евгенических законов примерно 65 000 американских граждан более чем из 30 штатов были принудительно стерилизованы без их согласия. Калифорния возглавила Американское евгеническое движение, стерилизовав за эти годы около 20 000 жителей штата. В 1930-х гг. Адольф Гитлер ссылался на Американскую программу стерилизации в Калифорнии в качестве примера того, как крупномасштабные евгенические решения, и в том числе принудительная стерилизация нежелательных лиц, могут быть эффективно реализованы.
К сожалению, заинтересованность Гитлера и нацистов в евгенике скоро вышла очень далеко за пределы принудительной стерилизации. Используя идеи евгеники, к 1939 г. нацистское правительство разработало программу так называемой «эвтаназии» психически и физически неполноценных младенцев и детей. Медицинским работникам было приказано фиксировать имена детей, родившихся с тяжелой инвалидностью, небольшие группы врачей решали, каких детей следует подвергнуть так называемому «умерщвлению из милосердия» в специальных «клиниках», к концу Второй мировой войны таким образом было уничтожено более 5000 детей. Вскоре также начали убивать психически и физически больных взрослых, более 70 000 человек были задушены угарным газом в камерах, замаскированных под душ, и еще 130 000 были убиты разными способами, начиная от передозировки лекарств и заканчивая голодом{62}. Кульминацией того, что нацисты считали расовой, то есть генетической, чисткой, было «окончательное решение» – план массового уничтожения практически всех европейских евреев, гомосексуалов и других «нежелательных» лиц. Во время Нюрнбергского процесса устроившие геноцид нацисты говорили в свою защиту, что развитие евгеники в США и решение, принятое Оливером Уэнделлом Холмсом в деле «Бак против Белла», вдохновило их на создание и применение лагерей смерти{63}.
Среди более 65 000 несчастных жертв узаконенной принудительной стерилизации в Калифорнии и других штатах оказались многие из наиболее уязвимых граждан США. Жертвами стали «социально неадекватные личности, к числу которых относятся слабоумные, психически больные, преступники, эпилептики, пьяницы, больные, слепые, глухие, калеки, а также иждивенцы, то есть сироты и бездомные»{64}. В 2003 г. губернатор Калифорнии Грей Дэвис официально извинился за евгеническую программу и принудительную стерилизацию в штате{65}.
Селекция в отношении человека отвратительна с моральной точки зрения, но применительно к животным она позволяет управлять эволюцией и снижать частоту появления нежелательных черт, а также передачу их по наследству: такая практика дает хорошие результаты тысячи лет. Фермеры и скотоводы с давних пор знают, что можно усилить определенные желаемые свойства стада, контролируя разведение. Многие считали, что это совершенно естественно. В давние времена люди и животные жили значительно ближе друг к другу, чем сегодня, возможно, отчасти поэтому многие так хорошо приняли евгенику. Хмельной аромат чистой науки в сочетании с аморальной принудительной политикой, которая подчеркивала преимущество общественных интересов над правами граждан, сделали евгенику такой жуткой.
Тридцать три американских штата приняли поддерживающие евгенику законы в период с 1900 по 1925 г., последний такой закон был отменен в штате Орегон только в 1983 г. В Орегоне евгенические законы были впервые приняты в 1913 г., а десять лет спустя был создан совет по евгенике. Позднее он был переименован в Орегонский совет социальной защиты, это учреждение существовало и во времена президентства Рональда Рейгана, а последняя назначенная судом принудительная стерилизация произошла в 1981 г. С 1920-х по 1980-е гг. в одном только штате Орегон в соответствии с законом было принудительно стерилизовано 2648 мужчин и женщин путем кастрации, вазэктомии, перевязки маточных труб и гистерэктомии. В их числе были дети из исправительных школ и даже девочки-подростки, которые считались здоровыми, но морально неполноценными и были названы «распутными». В 2002 г. губернатор штата Орегон Джон Кицхабер публично официально извинился за эти принудительные процедуры стерилизации, но штат еще должен будет выплатить компенсацию этим жертвам евгеники{66}.
Из тех 33 штатов США, где были евгенические законы, Вирджиния и Северная Каролина недавно стали первыми штатами, выплатившими компенсацию жертвам своих программ по евгенике, соответственно, по $25 000 и $50 000 каждому человеку. В Вирджинии последняя принудительная стерилизация была проведена в 1979 г., затем программа была официально закрыта{67}.
Среди жертв, в итоге получивших компенсацию от штата Вирджиния, был афроамериканец Луис Рейнольдс. Когда ему было 13 лет, в результате несчастного случая в игре он получил удар камнем по голове. Впоследствии врач диагностировал у Рейнольдса врожденную эпилепсию, вызванную генетическими причинами и передающуюся по наследству, хотя на самом деле его симптомы были временными и вызванными травмой головы. Пока подросток был в больнице, его стерилизовали с помощью вазэктомии без его согласия, даже не изложив ему суть медицинской процедуры, которую проводили под наркозом. Он узнал об этом только спустя годы, когда женился и захотел иметь детей. Он служил в морской пехоте в течение 30 лет, а затем, уйдя со службы, стал электриком. В 2015 г. Рейнольдс сказал новостному агентству Associated Press: «Я думаю, что со мной поступили неправильно. Я не мог завести семью, как все остальные. Они лишили меня моих прав». Он был среди всего 11 доживших до наших дней жертв, получивших $25 000 компенсации от штата из тех примерно 7000 человек, кого подвергли стерилизации в Вирджинии{68}.
Вскоре, когда в 1990-х гг. Национальные институты здравоохранения начали проект «Геном человека», его первый руководитель Джеймс Уотсон, который был также директором лаборатории в Колд-Спринг-Харбор, ввел этическую программу. «Я сразу же вынес на обсуждение этические вопросы, поскольку боялся, что очень скоро критики проекта напомнят, что я был представителем лаборатории в Колд-Спринг-Харбор, где раньше располагался сомнительный евгенический отдел», – рассказывал Уотсон. Позже, в 2007 г., заявление Уотсона для британской газеты, что чернокожие люди не такие умные, как белые, вызвало бурную критику{69}.
Сегодня санкционированная штатом принудительная стерилизация людей с генетическими мутациями кажется неправдоподобной, но страх перед различными формами генетической дискриминации становится все более распространенным. В 1997 г. ЮНЕСКО сформулировала заявление о политике, направленной против «дискриминации на основе генетической информации»{70}. Однако явных документально подтвержденных примеров генетической дискриминации в то время было мало. В журнале Genetics in Medicine в 2000 г. в статье о том, как пациенты воспринимают генетическую дискриминацию, утверждалось: «По-видимому, дискриминация настолько незначительна, что невозможно подобрать подходящие прецеденты» и «опасаясь генетической дискриминации, пациенты и врачи сильно сгущают краски»{71}.
В 2001 г. первый случай предполагаемой дискриминации был зарегистрирован комиссией США по соблюдению равноправия при трудоустройстве: в нарушении обвинялась железная дорога Burlington Northern Santa Fe (BNSF). Этот инцидент широко известен и подробно задокументирован, но это тот случай, когда реальность диковиннее любых вымыслов. Железная дорога BNSF была создана в 1995 г. в результате слияния компаний Atchison, Topeka, Santa Fe и Burlington Northern Railroads. Сейчас перевозимого по ней угля хватает для производства примерно 10 % всей электроэнергии в континентальной части США. Компания Уоррена Баффетта Berkshire Hathaway приобрела эту железнодорожную компанию в 2009 г. за $44 млрд. Эта железнодорожная компания не имеет прямого отношения к генетическим методам, анализам и даже к здравоохранению вообще, и, конечно, никогда раньше ее репутация не была связана с какими-либо медицинскими или генетическими проблемами.
Синдром запястного канала (СЗК) – распространенное заболевание, при котором возникает слабость, боль и онемение вблизи большого пальца. Чаще всего это бывает вызвано повторяющимися движениями (вроде печатания и управления мышкой – то, чем я занимаюсь прямо сейчас) или давлением на запястье. К другим распространенным причинам относятся переломы запястья, которые возникают, когда при падении человек подставляет руку, чтобы смягчить падение, игра на музыкальных инструментах, ожирение или беременность (последнее актуально для тех, у кого две Х-хромосомы). Если врач потратит время на то, чтобы провести тщательный физический осмотр и постучит пальцем по внутренней стороне запястья, это может вызвать стреляющую боль, идущую от запястья к кисти (тест Тинеля). А сгибание запястья в течение примерно минуты может вызвать некоторое покалывание, дискомфорт или слабость (тест Фалена). Для лечения обычно используют фиксирующие шины, эргономично обустраивают рабочее пространство и стараются не делать запястьем повторяющихся движений. При работе, связанной с повторяющимися движениями, такого рода заболевания возникают очень часто.
У меня иногда возникает СЗК, когда я еду на велосипеде долгое время, а руль поднят так высоко, что мои запястья слишком выгнуты и возникает давление на срединный нерв. Я не думаю, что это связано с каким-то наследственным заболеванием, особенно теперь, когда у меня на руках есть результаты секвенирования моего генома, и вместе с тем я обнаружил простой способ профилактики: достаточно опустить руль. Однако, хотя СЗК обычно связан с определенными видами повторяющейся деятельности, а не с ДНК, он оказался в центре самого громкого за всю историю США судебного процесса, касающегося генетической дискриминации.
В 2000 г. Burlington Northern Santa Fe организовала секвенирование ДНК примерно 20 своих сотрудников, которые жаловались на СЗК, чтобы выявить редкое наследственное заболевание, встречающееся менее чем у 0,01 % людей в популяции, – наследственную нейропатию со склонностью к параличам от сдавления (ННПС), но сотрудникам об этом не сообщили{72}.
ННПС впервые описал голландский невропатолог де Йонг в 1947 г. Он рассказал про семью, у которой в трех поколениях был «паралич копальщиков луковиц» из-за выращивания тюльпанов. Члены семьи жаловались также на слабость нижней части ног после копания картофеля в положении на корточках; обычно эти симптомы впервые появлялись в подростковом возрасте. Проблемы возникали эпизодически, приходили и уходили, состояние сопровождалось временной слабостью. При врачебном осмотре ахиллов рефлекс у этих пациентов обычно был слабый или отсутствовал полностью, но позже восстанавливался. Это же заболевание также называли «параличом худеющих», после того как у некоторых молодых женщин, сидящих на диете, начали по утрам появляться похожие симптомы предположительно из-за недостатка шоколадного мороженого и печенья «Мадлен». В другой семье 18-летний молодой человек, любивший прыгать с парашютом, сообщил о резкой слабости в левом плече после прыжков. Еще у одной девушки левое плечо провисало после того, как она ходила в школу с тяжелым рюкзаком. И все эти симптомы были связаны с СЗК. В 1999 г. появилось сообщение о семье, где было много поколений людей с СЗК из-за ННПС.
ННПС возникает из-за делеции в гене, кодирующем белок, важный для синтеза миелина – вещества, образующего защитные оболочки вокруг нервов. Нет никакой очевидной связи между СЗК и железнодорожной отраслью. Нет также данных о том, чтобы ННПС особенно часто встречалось на западе США, где живут и работают сотрудники Burlington Northern. Приказ проверить на наличие ННПС сотрудников, жалующихся на СЗК, имеет столь же мало смысла, как проверка на СПИД всех, кто простудился прошлой зимой{73}.
В 2001 г. комиссия США по соблюдению равноправия при трудоустройстве потребовала временно запретить железнодорожной компании организовывать дополнительные анализы, пока не будет проведено расследование. Когда позже она обвинила железнодорожную компанию в нарушении Закона о защите прав нетрудоспособных граждан, поскольку генетическое тестирование проводилось без согласия пациентов, Burlington Northern почти не сопротивлялась. В мае 2002 г. компания подписала договор с комиссией, согласившись практически на все требования и на выплату штрафа в $2,2 млн. Однако в итоге так и не было четко озвучено, кто именно внутри нее знал об этой политике и одобрил ее{74}. Компания утверждала, что провела генетическое тестирование на наличие столь редкого заболевания, как ННПС, чтобы выяснить, почему у большого количества сотрудников были такие повреждения от повторяющихся движений, как СЗК. Любопытно, что стоимость генетического анализа на ННПС, по-видимому, намного превышала ту сумму, которую можно было бы сэкономить по результатам этого поиска.
Было ли это всего лишь ошибкой запутавшихся врачей, отвечавших за охрану труда, никогда не обучавшихся генетике человека и просто пытавшихся выполнять свои обязанности? Было ли распоряжение начальства любой ценой, любыми средствами, во что бы то ни стало снизить размер крупных медицинских выплат по нетрудоспособности? Возможно, мы никогда не узнаем правды. Поскольку, по-видимому, ни у кого из работников Burlington Northern тест не дал положительного результата и можно сказать, что генетической дискриминации не произошло. Это был случай дискриминации, которой не было.
История с Burlington Northern ясно показала, что генетический анализ – как заряженное ружье: если вы раздадите толпе людей заряженные ружья без четких инструкций, когда и как их надо использовать, в какой-то момент неизбежно кто-нибудь где-нибудь подстрелит кого-нибудь. Отсутствие обучения медицинских работников основам генетического анализа и тому, насколько низка вероятность, что редкое наследственное заболевание окажется причиной СЗК, сопоставимо со снятым предохранителем на ружье.
После случая с Burlington Northern обнаружились и другие факты генетической дискриминации. В том числе был случай с женщиной из Кентукки Хайди Уильямс и ее детьми Джейми и Джесси, которым тогда было 8 и 10 лет соответственно. В 2004 г. она выступала перед конгрессом, рассказывая о генетической дискриминации ее семьи. У Хайди была недостаточность альфа-1-антитрипсина (ААТ). При этом заболевании отсутствует белок, который подавляет ферменты, повреждающие легкие и печень. В итоге пациент начинает постоянно задыхаться, становится желтушным или умирает от печеночной недостаточности. Если повреждения легких или печени приобретают угрожающие масштабы, это заболевание можно лечить с помощью ферментозаместительной терапии.
Здесь важно отметить, что AAT – заболевание рецессивное. Это значит, что Хайди Уильямс была больна, потому что у нее присутствовали обе копии гена с мутацией, но у ее детей одна из копий была здоровая, и поэтому у них не было риска развития ААТ и связанных с этим проблем.
Летом 2003 г. Хайди смотрела телевизор и увидела рекламу страховой компании Humana, Inc., которая предлагала доступное медицинское страхование. «Позвоните на этот бесплатный номер», – говорилось в рекламе, и так она и сделала. Страховой агент задала несколько вопросов, подсчитала страховые риски и предложила ей стоимость страхования $105 в месяц за обоих детей. Хайди заинтересовалась и сказала приятной молодой женщине на том конце провода, что хочет застраховаться как можно скорее. Тогда агент задала дополнительные вопросы, в том числе, что неудивительно, о хронических заболеваниях.
«Под угрозой штрафа или тюремного заключения за фальсификацию информации я сообщила девушке, что мои дети – носители наследственного заболевания ААТ, это нарушение в печени, которое может оказывать прогрессирующее влияние на печень, или легкие, или на то и другое. У меня есть легочные симптомы, но мои дети, в отличие от их матери, никогда не пострадают от этого заболевания», – объяснила Хайди в своем заявлении конгрессу.
Возникла пауза. Агент попросила Хайди не класть трубку, а затем пересказать эту историю руководству. Хайди рассказала, что у ее мужа нет этой мутации, что ее дети никогда не заболеют ААТ и что они исключительно здоровые и активные.
Молчание. «Пожалуйста, не кладите трубку», – попросил руководитель. Затем Хайди повторила свою историю руководителю более высокого уровня, а затем агент, которая разговаривала с ней вначале, сказала, что они дадут ответ в течение 24 часов. Ровно через неделю Хайди получила письмо, в котором сообщалось, что страховая компания Humana отказывалась страховать ее детей именно из-за того, что они носители ААТ, а не по какой-то другой причине. Это был уже второй случай, когда ее детям отказывали в медицинской страховке.
Хайди написала о своей истории в социальной сети для больных и носителей ААТ – Alpha-1 Lungs and Life Chat Group. Ее историю передали Генетическому альянсу – более крупной некоммерческой группе, которая специализируется на оказании помощи людям с генетическими заболеваниями. Организация предложила Хайди публично рассказать свою историю. Хайди согласилась. Она связалась с врачом, специализирующимся на ААТ, и с известной адвокатской конторой в Вашингтоне, которые в августе 2003 г. написали обращение в компанию Humana. Прошло несколько месяцев, а дочери Хайди по-прежнему оставались без медицинской страховки. В феврале 2004 г. Humana ответила на письменное обращение и подтвердила, что ее детям было отказано в медицинском страховании «только из-за того, что они носители ААТ, и ни по какой другой причине»[18].
Впоследствии Humana предложила медицинское страхование обоим детям Уильямс, но это произошло, только когда газета Washington Post заинтересовалась этой историей и начала расспрашивать сотрудников страховой компании об этом случае. Разумеется, сейчас дети Хайди застрахованы в другой организации. «Humana заставила меня почувствовать вину и стыд из-за генетики моих детей, – сказала она в обращении к конгрессу в 2004 г. – Мне не следовало бы тратить лучшую часть этих 6 месяцев на раздумья о том, не было ли чудовищной ошибкой послушаться совета педиатра и сделать моим детям генетический анализ». Представитель Humana в 2007 г. в интервью CNN заявил: «Это было недоразумение, а не дискриминация. Была ошибка в документах, которую позже обнаружили и исправили{75}.
Из-за таких ситуаций, как у Хайди, в мае 2008 г. президент Джордж Буш подписал Закон о запрете генетической дискриминации, который ранее более чем на 12 лет застрял в лабиринтах лоббирования. В сенате законопроект прошел с результатом голосования 95: 0, в палате представителей – с результатом 414: 1. Единственный голос «против» был от конгрессмена Рона Пола{76}.
Закон запрещает генетическую дискриминацию в сфере здравоохранения и при трудоустройстве. При страховании здоровья и найме на работу не разрешается запрашивать генетическую информацию для принятия каких-либо решений, и родителям не нужно приобретать медицинскую страховку еще до зачатия ребенка, чтобы не столкнуться с отказом из-за «уже существующего заболевания». Генетический альянс назвал эту веху в истории генетики в США «первым документом о гражданских правах нового века»{77}. Но этот закон не защищает от дискриминации, связанной со страхованием жизни, а также со страхованием на случай нетрудоспособности или длительного ухода, и не применяется к компаниям, где работает менее 15 сотрудников.
Однако в некоторых штатах существуют дополнительные законы, которые обеспечивают защиту в тех случаях, когда неприменим основной Закон о запрете генетической дискриминации. Совет по ответственной генетике – это хороший источник информации о конкретных мерах защиты, которые предоставляются в каждом штате{78}. Например, в Калифорнии дополнительный закон обеспечивает некоторую защиту от дискриминации не только при страховании здоровья и при приеме на работу, но и при страховании жизни, и страховании на случай длительного ухода или нетрудоспособности. В исследовании, проведенном специалистами по генетике рака, показано, что до появления Закона о запрете генетической дискриминации 26 % заявляли, что будут делать генетический анализ под псевдонимом из-за опасений по поводу возможной дискриминации, а после того, как закон был принят, только 3,2 % сказали, что подумывают об использовании псевдонима{79}.
Когда законопроект был подписан и стал законом, появилось более 700 заявлений о нарушениях. Многие из этих случаев свидетельствуют о неоднозначности судебных требований к доказательствам генетической дискриминации.
У Памелы Финк, директора по связям с общественностью компании MXenergy в Стамфорде, штат Коннектикут, было две сестры, и у обеих развился рак груди. В 2004 г. Финк сделала генетический анализ и выяснила, что у нее мутация в гене BRCA2 (которая повышала риск развития рака груди и яичников). В 2009 г. она решила сделать профилактическую мастэктомию, чтобы снизить риск развития рака груди, и, пока восстанавливалась после операции, четыре недели не ходила на работу{80}.
Тем временем MXenergy наняла на работу друга семьи генерального директора, человека, которого он лично рекомендовал. Когда Финк вернулась, друг гендиректора остался работать и фактически стал ее начальником, заняв должность, которой раньше не существовало. Финк почувствовала, что рискует потерять работу и подала жалобу в отдел по работе с персоналом, но там ее жалобу сочли необоснованной. В то время как Финк готовилась уйти еще на 10 дней для проведения другой медицинской процедуры, она получила отрицательный отзыв на свою работу. После того как она вернулась на работу, ее уволили. Когда Финк подала в суд на работодателя, обвинив его в нарушении закона, MXenergy отрицала любые обвинения в дискриминации, но так и не назвала причину увольнения. С делом была ознакомлена Комиссия США по соблюдению равноправия при трудоустройстве, но не стала этим заниматься.
На примере ситуации с Финк видна некоторая двусмысленность, связанная с генетической дискриминацией. Действительно ли Финк уволили из-за мутации в BRCA2, поскольку эта маленькая компания не хотела повышать размер выплат на медицинское страхование? Или ее уволили, потому что генеральный директор хотел оказать услугу другу семьи? Или заменивший ее человек работал лучше? Это мутная история, и мы, вероятно, никогда не узнаем, что на самом деле произошло.
Как писал Роберт Клицман, биоэтик из Колумбийского университета в Нью-Йорке, в Journal of Genetic Counseling, «дискриминация бывает не только явной, прямой и открытой, но и скрытой, непрямой и неочевидной и тогда ее трудно доказать. С пациентами можно обращаться “неодинаково” и несправедливо, и непонятно, как определить “дискриминацию”»{81}.
Этот случай напомнил мне про одну мою коллегу, которая вот уже более 10 лет проводит генетическое консультирование больных раком. Она не хотела, чтобы я упоминал ее имя по причинам, которые станут понятны дальше. Давайте назовем ее Таней. Таня говорит, что может вспомнить несколько случаев, когда раковые больные, имеющие генетические мутации, говорили ей, что их уволили с работы либо они потеряли медицинскую страховку после того, как у них нашли рак, но никто из них не сталкивался с дискриминацией до того, как у них нашли рак.
Я занимаюсь клинической генетикой почти 20 лет, начинал еще до того, как был завершен проект «Геном человека», и мне довелось поработать как на Западном, так и на Восточном побережье. Никто из моих пациентов никогда не говорил мне, что стал жертвой явной и несомненной генетической дискриминации (если бы с кем-то такое случилось, я помог бы подать иск о нарушении закона). Судя по моим и Таниным наблюдениям, заявления о явной дискриминации, по-видимому, бывают очень редко, и, к сожалению, в научной литературе нет достаточно полных исследований на этот счет. Однако неявная, более тонкая дискриминация – это отдельная тема. Я слышал о беспокойстве по поводу дискриминации на рабочем месте от пациентов, имеющих генетические мутации, особенно если они работали там, где высокая и жесткая конкуренция на профессиональных рынках труда.
На самом деле опасения по поводу генетической дискриминации весьма распространены, их высказывает большинство пациентов, делающих генетический анализ. По данным исследований 2005 г. и 2014 г., предполагается, что около 40 % людей отказываются от генетического тестирования именно по этой причине{82}. Именно это мы обычно обсуждаем с пациентами, когда я получаю их информированное согласие перед проведением генетического анализа.
Будет сложно получить надежные сведения о том, насколько распространена скрытая генетическая дискриминация. Пожалуй, именно поэтому моя коллега Таня не хочет, чтобы я использовал ее настоящее имя. Она опасается реакции своего работодателя, крупного медицинского центра, или что ее пациенты будут возмущены ее взглядами и испортят ей карьеру. Она боится дискриминации на рабочем месте, если выскажет свои взгляды о различных формах дискриминации. Таким образом, если люди считают весьма распространенной дискриминацию по разным негенетическим причинам, то генетическая дискриминация будет просто естественным (хотя и новым) продолжением существующей проблемы, страх перед которой никогда не удастся полностью искоренить.
Поскольку Закон о запрете генетической дискриминации явным образом не защищает американских военнослужащих, Министерство обороны в 2008 г. начало последовательно проводить во многом схожую политику. Однако и до того из-за выявленных генетических заболеваний ежегодно отмечалось около 250 увольнений.
Например, Эрик Миллер семь лет служил рейнджером в Афганистане. Во время службы у него появилась боль в спине. В итоге был поставлен диагноз – болезнь Гиппеля – Линдау (VHL), которая встречается примерно у трех из каждых 100 000 человек. Продукт гена VHL участвует в определении содержания кислорода. При этом заболевании неправильная оценка содержания кислорода вызывает, помимо прочего, чрезмерный рост кровеносных сосудов (организм пытается повысить содержание кислорода) и образование опухолей. У Миллера многочисленные опухоли давили на мозг и позвоночник. Поскольку VHL – наследственное заболевание, армия сочла его «уже существовавшим заболеванием» и уволила Миллера в 2005 г., оставив без медицинской страховки или пособия по нетрудоспособности. Однако позже он опротестовал это решение и восстановил право получения пособия.
Мы можем значительно облегчить страдания, вызванные тысячами наследственных заболеваний, но как мы собираемся уравновесить прогресс в области геномики с появлением новых возможностей для дискриминации своих соседей? Несколько лет назад я участвовал в комиссии Управления по санитарному надзору за качеством пищевых продуктов и медикаментов, где обсуждались все плюсы и минусы такого генетического анализа, который можно заказать напрямую через интернет, и для этого не нужно обращаться к врачу или генетическому консультанту. Сотрудники управления, ученые и специалисты из компаний, проводящих генетические анализы, выступили с научными докладами. На одном из заседаний могли присутствовать все желающие. Любой мог прийти и внести свою лепту в обсуждение. Сотрудник одной из некоммерческих организаций защиты потребителей в области права и генетики встал и осудил комиссию. Он заявил, что мы все проспали, поставили общество под угрозу, не позаботились о помощи людям. Затем другой участник, бывший сотрудник Управления по санитарному надзору, работающий сейчас в генетической компании, напрямую предоставляющей услуги потребителям, сказал нам, что мы действуем чересчур покровительственно, душим отрасль своей регуляцией, не даем людям получить информацию, которая могла бы изменить их жизнь, и дальше в том же духе. Мы потратили некоторое время на критику с обеих сторон. Однако в итоге мы должны были составить сводную таблицу со всеми замечаниями и разработать наилучшую федеральную политику, чтобы пациенты были защищены от генетической дискриминации и можно было продолжать законно проводить анализы и спасать жизни членов общества.
Дело здесь в том, что из-за снижения стоимости и повышения популярности этого метода число людей, которые могли бы воспользоваться преимуществами секвенирования генома, может сильно возрасти. Однако наши законы по-прежнему недостаточно широко и эффективно защищают народ от генетической дискриминации.
Прежде чем полногеномное секвенирование станет широко распространенным, нам нужно срочно разработать более сильные федеральные законы, защищающие людей от генетической дискриминации, и долгосрочное страхование на случай нетрудоспособности, что-то вроде того, что пытается делать Великобритания с 1990-х гг.
Американские, европейские и скандинавские евгенические законы и государственная принудительная стерилизация перестали действовать всего несколько десятилетий назад, в 1970-х и 1980-х гг. К сожалению, мы не можем сказать «Здесь этого не может быть», поскольку история евгенических программ в США, Канаде и Европе свидетельствует, что иногда ужасные идеи могут получить реальное воплощение. Хотя кажется невероятным и немыслимым, что сегодня в развитых странах генетическая дискриминация может проявиться в виде экстремистской политики, вроде новых программ принудительной стерилизации генетически «нежелательных», но не исключено, что дискриминация в более легкой форме возникнет в будущем, во времена социальных кризисов. Как свидетельствуют исторические примеры, такое часто возникает из-за путаницы, дезинформации или по финансовым причинам, а не из-за явных предрассудков. Когда мы обсуждаем широкое распространение полногеномного секвенирования для американских малышей, история напоминает нам, что спустя 40 лет все может выглядеть совсем иначе, и мы не можем предвидеть, как именно. И что для младенцев, в геноме которых найдут «дефекты», могут возникнуть серьезные негативные последствия.
Хотя трудно представить себе, что в нашем обществе может быть выделен генетически выявляемый низший слой, который будет дискриминирован при приеме на работу, получении государственных социальных пособий, страховании или еще как-то, более слабые формы генетической дискриминации могут, возможно, иметь сходство с легкими формами расизма, гендерных предрассудков, религиозной нетерпимости и гомофобии.
Глава 9 Неравенство на экзамене по вождению
В США обучение вождению стало своеобразным обрядом посвящения для подростков и членов их семей.
В этот период все внимание подростка поглощено тренировочными площадками и тем, как пройти испытания, необходимые для получения прав. До сих пор происхождение из очень богатой семьи никак не помогало на экзамене умело выполнить параллельную парковку машины или понять, в каком ряду следует двигаться на многополосном шоссе.
Однако многие компании, от технологического гиганта Google и до некоторых производителей эксклюзивных автомобилей, уже начали внедрять целый спектр датчиков и различных приспособлений с искусственным интеллектом. Такие устройства помогают машине самостоятельно делать почти все: производят пресловутую параллельную парковку, предупреждают водителя, если в слепой зоне оказывается пешеход или другое транспортное средство, автоматически тормозят, если опасность внезапно возникла перед авто. Сейчас существует по меньшей мере одна немецкая марка элитных автомобилей, где есть дополнительная система, способная самостоятельно управлять машиной в стиле «тронулись-остановились» при движении в дорожных пробках, с которыми часто сталкиваются многие автомобилисты. А Google тестирует беспилотные автомобили, которые могут перемещаться везде, вплоть до скоростных шоссе Калифорнии.
Конечно, маловероятно, что какое-либо государство разрешит подростку, у которого оказался такой «волшебный» автомобиль, легко проскочить экзамен по вождению, позволив машине автоматически выполнить все сложные задания. Но давайте представим реакцию ребенка из малообеспеченной семьи, который видит, как кучка богачей, чьи родители могут позволить себе эту чудо-машину, приезжает сдавать на ней экзамен по вождению. Подросток скажет: «Это же нечестно». И он будет прав.
Мы живем в эпоху имущественного неравенства, когда самая обеспеченная часть населения владеет несоразмерной, постоянно растущей долей мировых богатств и финансовых средств. Плохо это или нет, но, как бы то ни было, современные достижения генетики и возможность применять генетические знания для лечения только увеличили неравенство между богатыми и бедными по всей планете, и это, вероятно, отразится и на дальнейших поколениях. Неравенство в американской жизни, в том числе и в нашей системе здравоохранения, присутствует давно. Поражает глубина этого неравенства, когда речь идет о новых методах лечения генетических заболеваний. Некоторым пациентам почти недоступна такая помощь, другим доступно больше, так как им повезло оформить «правильную» страховку, а третьим, самым состоятельным, доступно все – некое медицинское следствие деления общества на «имущих, неимущих и владельцев яхт».
В настоящее время более чем для 1000 болезней широко используются генетические анализы, и каждый год к ним прибавляется по 10 % за счет того, что появляются новые тесты. Ежегодно на 20 % увеличивается число генетических анализов для диагностики заболеваний. Для сравнения: количество негенетических медицинских анализов растет только на 2 % в год. Постоянное увеличение числа генетических анализов в будущем может серьезно изменить американское общество.
Сейчас генетический анализ в США может стоить от менее одной тысячи до нескольких тысяч долларов. Эти анализы часто недоступны для пациентов, у которых нет «правильной» медицинской страховки, даже если у них в анамнезе есть серьезные основания для генетического тестирования. В зависимости от индивидуальных особенностей пациента программы страхования и даже от того, в каком штате он проживает, обращения к страховой компании могут быть успешны, но часто только после того, как пациенты и их врачи потратят уйму времени на споры, письма и личные встречи.
Очевидно, что стоимость таких анализов слишком велика и ее надо снижать. Однако, даже если пациенты и врачи выигрывают сражение со страховыми компаниями или такими программами, как Medicaid и Medicare[19], и генетический анализ проводится, длительная война за медицинский уход и лечение будет продолжаться. Мы сталкиваемся с миром, где цены на лечение хронических генетических заболеваний, при которых может потребоваться жизненно необходимая терапия, затмевают стоимость анализов. Например, ежегодные затраты на препараты для лечения таких заболеваний, как болезнь Гоше (о ней шла речь в первой главе), легко могут достигать $400 000.
В этих случаях незастрахованные пациенты и имеющие страховку представители среднего класса оказываются в одинаковой ситуации: они сами не могут оплатить длительное лечение, и его не покрывает страховка. При этом очень богатые могут просто заплатить за лечение и уход из своего кармана. Возвращаясь к аналогии с экзаменом по вождению, представим себе богачей и средний класс, которых не волнует, что чьи-то семьи не могут позволить себе машину. Только теперь застрахованных представителей среднего класса отделили от первых рядов, где сидят их более богатые товарищи, и оставили вместе с их обездоленными собратьями где-то позади бормотать: «Это нечестно».
Наследственные болезни тяжелым бременем ложатся на семью. Расходы на хроническое заболевание могут истощить ресурсы даже очень обеспеченной семьи. От того, какой уход требуется больному ребенку, зависит, смогут ли родители работать вне дома. Что касается генетических заболеваний, поражающих взрослых, болезнь одного из родителей может губительно сказаться на финансовом положении всей семьи. Хроническое заболевание, длительная нетрудоспособность или преждевременная смерть серьезно отразятся на жизни и следующих поколений семьи.
Тимоти Пауэрса я встретил в 2000 г., когда обучался медицинской генетике. Добрый, высокий парень со светлыми волосами, карими глазами и острым умом, он был студентом в элитном частном университете в Вашингтоне. Ему было 20, и к этому времени он уже перенес три сердечных приступа. Его отец умер от инфаркта, когда Тим был еще малышом. Это ужасное событие сильно повлияло на его психику.
Тим страдал тяжелой формой семейной гиперхолестеринемии. При этом заболевании в гене, белковый продукт которого помогает избавляться от холестерина, присутствует мутация и холестерин накапливается в кровеносной системе и других частях тела. У Тима на локтях и веках были маленькие бугорки, в которых откладывалось это жироподобное вещество. Такие же бугорки из холестерина образовывались и внутри кровеносных сосудов, питающих сердце, из-за этого некоторые сосуды могли оказаться закупоренными и часть сердечной мышцы не получила бы кислорода и погибла. Такая тяжелая форма гиперхолестеринемии встречается у одного человека из миллиона. При менее тяжелой форме случаются инфаркты уже ближе к 30–40 годам, эта форма шире распространена и встречается у каждого пятисотого.
Чтобы снизить уровень холестерина у Тима, использовали диету, медицинские препараты и физические упражнения. Его регулярно подключали к капельнице, чтобы отфильтровать холестерин из крови. Он не был кандидатом на пересадку печени, хотя это помогло бы снизить уровень холестерина. Но тогда Тим должен был бы всю жизнь принимать препараты, подавляющие иммунитет, а это могло привести к большей восприимчивости к инфекциям, хрупкости костей, диабету и, возможно, к раку крови и кожи. К сожалению, этот талантливый молодой человек, у которого могло бы быть блестящее будущее, умер примерно через год после того, как я его увидел.
Если бы у Тима в раннем возрасте нашли мутацию семейной гиперхолестеринемии, то он мог бы раньше начать лечение, снижающее уровень холестерина, и дожить примерно до 30 лет. А сейчас у нас уже есть новые, мощные, надежные, точные с научной точки зрения препараты, одобренные специально для применения при семейной гиперхолестеринемии, помогающие хорошо контролировать это заболевание. Если бы Тим жил сейчас, я думаю, что он смог бы прожить до средних лет или, возможно, даже дольше.
Исследование, проведенное несколько лет назад, показало, что генетическое тестирование всех 16-летних подростков на семейную гиперхолестеринемию позволит предотвратить несколько смертей до 26 лет. Каждая сохраненная жизнь обойдется в $700 000, в эту сумму входит и 10 лет лечения статинами{83}. Расчеты были проведены для Великобритании из расчета стоимости статинов $400 в год. Сейчас цена на это лечение упала и в США, и в Великобритании за счет появления дженериков. Однако фармацевтические компании выпустили на рынок два новых, более эффективных препарата, одобренных специально для лечения этого заболевания, стоимостью от $150 000 до $300 000 в год, то есть в несколько сотен раз дороже. Если их использовать для всех пациентов, страдающих семейной гиперхолестеринемией, то каждая предотвращенная смерть, вероятно, обойдется в десятки миллионов долларов. Впрочем, и эта сумма будет расти, если мы захотим дать каждому пациенту лучшее лечение, а число пациентов с таким диагнозом будет увеличиваться в результате всеобщего генетического тестирования. Эти новые препараты для лечения семейной гиперхолестеринемии гораздо более эффективны, чем дешевые старые, но их цена ошеломляющая. Высокая стоимость ставит нас в трудную ситуацию выбора: какие-то дети могут получать менее качественное лечение или не получать его вовсе.
В мире ограниченных ресурсов обычно проводится анализ экономической эффективности, чтобы оценить соотношение затрат и результатов. Экономисты в области здравоохранения и для наследственных, и для ненаследственных заболеваний используют показатель, который называется сохраненные годы качественной жизни (сокращенно QALY, от англ. quality-adjusted life-year). Этот показатель позволяет оценить пользу от разных типов терапии, конкурирующих друг с другом за финансирование. Каждый год, прожитый с идеальным здоровьем, принимается за 1, а смерть – за 0. Этот показатель может принимать и отрицательные значения, если пациент в коме и подключен к аппарату искусственной вентиляции легких. Обычные расходы в США на лечение тяжелого заболевания составляют от $50 000 до $200 000. Например, стоимость диализа почек составляет около $75 000–$100 000 в год, а качество такой жизни оценивается примерно в половину от «здоровой» жизни. Это позволяет вычислить стоимость диализа с поправкой на QALY, она составляет от $150 000 до $200 000 в год, что считается приемлемым в рамках программы Medicare и для частных страховых компаний.
Конечно, сложно, если вообще возможно, договориться о том, что такое «идеальное здоровье». Например, некоторые утверждают, что по сравнению с физическими страданиями психическое здоровье недооценивается, но другие с этим не согласны. При таких расчетах не учитывается и влияние больного на качество жизни семьи и на ухаживающий за ним медперсонал.
Когда дело доходит до определения эффективности различных типов лечения или оценки, как долго кто-то проживет при этом лечении и без него, то тут у нас может быть очень конкретная информация. Года, месяцы, дни и даже часы и минуты мы можем точно измерить, и это не вызовет сомнений. Но качество жизни – это совсем другое. Спросите десяток человек, что они понимают под словосочетанием «качество жизни», и вы получите 11 разных ответов. Это очень затрудняет определение значения QALY для экономистов и политиков в области здравоохранения, которые решают, покрывается та или иная медицинская процедура страховкой или нет. Из-за такого разнообразия мнений возникают большие сложности, когда надо решить, должна ли страховая компания оплачивать лечение, которое улучшает качество жизни, но не увеличивает ее продолжительность.
Стоял чудесный солнечный день, типичный для Южной Калифорнии, когда я встретил Шона Родригеса в местной генетической клинике. Шон сидел в приемной перед длинным, во всю стену аквариумом и смотрелся очень странно, совсем как рыба, вытащенная из воды. Это был крутой калифорнийский парень. В свои 20 с небольшим он был мускулистым красавцем, покрытым натуральным бронзовым загаром, и с волосами, высветленными океаном. Он носил ковбойскую шляпу, футболку с эмблемой спортивной команды Университета Южной Калифорнии, бриджи и, конечно, наушники. У него был характерный стиль, который мне постоянно встречался на местных пляжах и в торговых центрах: некий гибрид Джейсона Мраза и Патрика Суэйзи[20]. Шон сильно отличался от большинства моих пациентов. Что его сюда привело? Мне пришло в голову, что, возможно, он ошибся клиникой.
Оказалось, что у Шона была слабая форма наследственного ангионевротического отека (НАО). Это редкое генетическое заболевание, при котором неисправен ген, помогающий контролировать воспаление и отеки (например, когда вы ударились пальцем ноги о дверной косяк). У пациентов с этим расстройством воспалительный процесс становится неуправляемым, при этом не важно, вызван ли он давлением на определенную часть тела (как в случае с косяком), инфекцией или иной, неясной причиной. Страшнее всего, если такое воспаление возникает в горле, это может быть опасно для жизни, так как у человека с НАО отек может перекрыть дыхательные пути. В этом случае требуется установка дыхательной трубки или даже трахеостомия. Отек может возникнуть и в других мягких тканях, например в кишечнике, ягодицах, на подошвах ног и других местах.
Шон работал в калифорнийском городе Ориндж в магазине, специализирующемся на продаже оборудования для серфинга, роликовых коньков и лыж. Он сам был увлечен всеми тремя видами спорта, связанными с этими товарами. Когда Шон еще учился в школе в пригороде Лос-Анджелеса, то занимал высокие места на некоторых соревнованиях по роликовым конькам. Травмы, полученные во время катания, конечно, могли вызвать приступы НАО, но он был аккуратным, опытным и просто не мог отказаться от спорта, несмотря на громкие протесты со стороны семьи и врача. Несколько раз после падений он обращался за неотложной помощью, но серьезных проблем у него из-за этого пока не было. После школы он поступил в местный колледж, но продержался там всего несколько четвертей. Работа в спортивном магазине была идеальна для него, вот только медицинской страховки она не давала.
Один из уроков, которые мы получаем, занимаясь врачебной деятельностью, состоит в том, что у каждого пациента есть свои обстоятельства, которые необходимо учитывать. Во время встречи группы взаимопомощи пациентов с НАО Шон услышал о мощных новых лекарствах – С1-ингибиторах, которые предотвращают ангионевротический отек. Однако, поскольку эти препараты были еще под защитой патента, стоимость курса составляла более $100 000 в год. Для Шона это было так же недоступно, как если бы их одобрили для использования на Марсе, а не на Земле.
Я думал, что Шон впервые понял, что у него НАО, когда возникла угрожающая жизни ситуация, например внезапный отек горла. Но я ошибся. Оказалось, что этот крепкий молодой человек столкнулся с определенной проблемой в связи с особенностями его образа жизни. По собственному признанию, Шон болтался со своей холостяцкой компанией, прожигающей жизнь на пляжах округа Ориндж, и, как он пояснил, был довольно успешен в плане случайных связей. Но во время секса у него возникала сильная боль из-за НАО. Он не мог точно предсказать, когда это случится, но иногда после полового акта Шон обнаруживал у себя болезненный отек гениталий. Эта боль физически и психологически мешала половой жизни Шона, порождая постоянную тревогу даже тогда, когда отек не возникал. Его родственник со схожими проблемами в итоге принял духовный сан (возможно, посчитав это не генетической проблемой, а личным посланием от Всевышнего). И видимо, никто в их семье раньше не слышал о НАО.
Шон хотел получить рецепт на С1-ингибиторы, чтобы использовать их для профилактики перед сексом. Шон просто хотел жить нормальной жизнью молодого человека в Южной Калифорнии, как живут все его друзья. К несчастью, покрытие его медицинских расходов осуществляла компания MediCal – калифорнийская версия Medicaid. И у MediCal была другая точка зрения: она не была готова оплачивать дорогие С1-ингибиторы.
Шон остался как голодный диккенсовский сирота, уставившийся поутру в окно богатой булочной. Перед ним «за стеклом» были эффективные, но недоступные лекарства XXI в. С его точки зрения, это было худшее, что могло случиться с ним, и он ощущал, что качество его жизни сильно пострадало.
Я мог предложить Шону начать использовать более дешевый препарат, даназол, который помогает при его симптомах. Даназол – это стероид, который уже многие годы используется, что бы снять приступ НАО, но у него есть неприятные побочные эффекты. Шон был очень спокойным, но после начала приема лекарства у него стали появляться опасные реакции, в том числе и эпизоды ярости, которые создавали ему проблемы на работе как с начальством, так и с покупателями. И, кроме того, он рисковал нарваться в баре на драку. Удары по лицу в драке могут быть особенно опасны для людей с НАО. И хотя благодаря своей внешности и приятному характеру Шон был успешен в обществе, он впал в депрессию из-за того, что у него было генетическое заболевание, но он не мог получить самое лучшее лечение.
Этот случай, как и многие другие, показывает, что американское здравоохранение зачастую гораздо более эффективно в области инновационных разработок, чем в длительном лечении хронических больных. Если открыть кран на пожарном трубопроводе, промокнет много народа, точно так же рост числа генетических анализов неизбежно приведет к тому, что у многих людей, которым раньше не поставили бы никакого диагноза, сейчас обнаружат семейную гиперхолестеринемию, НАО и ряд других генетических заболеваний, которые поддаются терапии. При нынешней системе здравоохранения в США расходы на длительное лечение могут быть ошеломляющими.
Вспомогательная репродукция с участием третьих лиц – еще одна дорогостоящая генетическая технология, которая становится все более распространенной и, очевидно, повлияет на будущие поколения. Это разнообразные методы, при которых, помимо традиционных «матери и отца», участвуют другие люди и, как правило, используется искусственное оплодотворение (оно было подробно описано в третьей главе «Высотная болезнь»), а иногда суррогатное материнство.
Третьим участником может быть мужчина, который не будет социальным отцом, но предоставляет сперму. Может быть и женщина, которая предоставляет будущей матери яйцеклетку, митохондрии из яйцеклетки, свою матку для яйцеклетки настоящей матери или комбинацию всего вышеперечисленного. Под суррогатным материнством подразумевают ситуацию, когда женщина вынашивает генетически неродственного ребенка (гестационное суррогатное материнство) или же является одновременно еще и донором яйцеклетки (традиционное суррогатное материнство)[21].
Теоретически у новорожденного может быть до шести различных родителей. Первый – генетический отец, который дал свою часть генетического материала (сперму) для создания ребенка. Второй – отец социальный, который помогает выращивать и воспитывать ребенка, даже если тот биологически ему не родственен. Кроме того, может быть до четырех матерей. Первая дала яйцеклетку с ядерным геномом. Вторая обеспечила митохондрии для этой яйцеклетки. Третья – гестационная мать, которая выносила ребенка, и четвертая – социальная мать, которая будет его выращивать. Конечно, социальные родители необязательно должны быть разного пола. Развод и повторный брак может еще сильнее увеличить число социальных родителей по мере роста ребенка.
И хотя мне трудно представить такой секстет родителей (в частности, совершенно бессмысленно социальным родителям выбирать такого донора яйцеклетки, что будет нужен дополнительный донор митохондрий), мой опыт говорит, что бывают самые неожиданные ситуации и в определенный момент действительно может появиться комбинация из многих родителей. На самом деле я предполагаю, что через пару десятилетий с помощью человеческих стволовых клеток и уже существующих технологий мы придем к тому, что на свет будут рождаться клоны человека.
При традиционном суррогатном материнстве будущую суррогатную мать оплодотворяют спермой мужчины из пары, которая хочет ребенка (или одного из мужчин в случае однополой пары) или спермой другого донора. Затем суррогатная мать вынашивает ребенка до родов.
При гестационном суррогатном материнстве будущей суррогатной матери имплантируют в матку эмбрион, который появился из яйцеклетки другой женщины (из разнополой пары, из однополой или матери-одиночки). Эта яйцеклетка могла быть оплодотворена спермой партнера-мужчины, одного из мужчин однополой пары, одинокого отца или донора спермы. Первый ребенок, рожденный с помощью донорства яйцеклетки, был зарегистрирован в 1983 г. в Австралии. С тех пор в США с помощью донорских яйцеклеток и переноса эмбрионов появилось более 50 000 детей, среди родителей которых есть и очень известные люди, такие как популярный музыкант Элтон Джон, актриса Николь Кидман и актер Нил Патрик Харрис. Примерно один из каждых шести новорожденных, родившихся в результате ЭКО, появился из донорской яйцеклетки.
Социальное и юридическое отношение к гестационному суррогатному материнству неодинаково в разных странах. В Германии и Италии суррогатное материнство полностью запрещено. В Канаде разрешено, но без денежной компенсации гестационной суррогатной матери, например, суррогатной матерью может быть родственница одного из биологических родителей. В Испании эта процедура не запрещена, и родители могут оплатить расходы, но не дополнительное вознаграждение. В большинстве штатов США разрешено донорство яйцеклетки за вознаграждение. Однако это запрещено в штатах Нью-Йорк, Аризона, Индиана, Мичиган, Небраска и в округе Колумбия. В некоторых странах, таких как Испания, среди доноров яйцеклеток непропорционально много женщин из малообеспеченных слоев населения. Суррогатное материнство может также повлиять на национальность и гражданство. Государственный департамент США придерживается политики, что «для получения гражданства США ребенком, рожденным за границей… необходимо, чтобы между ребенком и его родителями с американским гражданством было биологическое родство»{84} Таким образом, чтобы ребенок родился гражданином США, нужно, чтобы гражданином США был кто-то из его биологических родителей – отец или мать, а гражданство суррогатной матери не имеет значения.
Денежное вознаграждение для доноров яйцеклетки в США может быть очень существенным. Просматривая газеты престижных колледжей с высоким конкурсом, можно найти объявления, в которых за «правильную» яйцеклетку от молодой женщины предлагают от $25 000. Оплата может варьировать в зависимости от индивидуальных характеристик, способностей и этнического происхождения. Часто требуется (в дополнение к безупречному личному и семейному анамнезу) рост выше 178 см (это больше моего роста). Кроме роста к донору могут предъявляться такие требования, как учеба в престижном колледже, определенный цвет и тип волос, конкретный цвет глаз, определенный оттенок кожи, высокие показатели в тесте на IQ и в математическом разделе теста SAT, документально подтвержденные достижения в спортивной команде, наличие музыкальных способностей, подтвержденных аудиозаписями и выбор будущей специальности (если в области медицины, то это выше ценится). Некоторые анкеты запрашивают более подробную информацию, например тип личности (отзывчивый, прилежный и др.). Разумеется, некоторые из этих характеристик зависят не только от генов, но еще и от обстановки, в которой рос человек (поощряли ли родители донора занятия музыкой, были ли у нее братья и сестры и т. д.), поэтому не совсем очевидно, насколько они важны. И еще, хотя в банках спермы используют моделирование на компьютере желаемой внешности ребенка, я не нашел, чтобы аналогичную программу применяли для донора яйцеклетки.
В Нью-Йорке и других больших американских городах есть агенты по продаже яйцеклеток, подобные агентам по продаже элитной недвижимости, личных самолетов и яхт. Пара, планирующая ребенка, может лично или в режиме видеоконференции встретиться с кандидатами в доноры яйцеклетки, их детьми (если они уже появились) и другими членами их семей. В США больше всего кандидатов в доноры, поскольку там яйцеклетки продаются по самой высокой цене. Рыночные цены отражают популярность доноров яйцеклеток разных этнических групп. Кроме европейцев, самые популярные доноры – это японцы, корейцы, индусы, китайцы и евреи-ашкенази.
Недавно стало возможным и донорство митохондрий. Митохондрии – это клеточные органеллы, которые с помощью кислорода синтезируют универсальную «энергетическую валюту» – аденозинтрифосфат (АТФ), которая используется клеткой в ее повседневной деятельности. Митохондрии в клетке произошли от симбиотической бактерии, которая проникла внутрь и стала сотрудничать с нашим одноклеточным предком. Это произошло более миллиарда лет назад, еще до появления животных и растений. Поскольку митохондрии – потомки бактерий, у них есть свой геном, содержащий 37 генов, он меньше человеческого генома примерно в 180 000 раз. Частота мутаций в митохондриальных генах примерно в 10–20 раз выше, чем в человеческих, вероятно потому, что они повреждаются кислородом (подробнее мы об этом говорили в третьей главе). Увеличение числа повреждений в митохондриях, которое происходит с возрастом, рассматривается как основная причина возрастного женского бесплодия и генетических заболеваний, связанных с неправильным расхождением хромосом, таких как, например, синдром Дауна, поскольку для расхождения хромосом используются мощные молекулярные моторы, которым нужно много энергии[22].
Чтобы улучшить рождаемость женщин в возрасте, можно трансплантировать цитоплазму из донорской яйцеклетки молодой женщины. Эта процедура иногда называется трансплантацией ооплазмы. У ребенка, родившегося из такой яйцеклетки, можно обнаружить митохондрии как донора, так и реципиента, что отражает генетический вклад обеих матерей в одно дитя.
Трансплантация ооплазмы увеличивала вероятность беременности и успешных родов, это было показано в работах, проведенных на мышах, кроликах, свиньях, коровах, а также в предварительных исследованиях на людях. Однако остается еще много вопросов, касающихся безопасности этой процедуры в долговременной перспективе и этической стороны дела. И хотя трансплантация ооплазмы в настоящее время разрешена в нескольких странах, в США ее использование пока не одобрено. В Великобритании эта процедура проводится для женщин, у которых имеются мутации, вызывающие митохондриальные генетические заболевания.
С экономической точки зрения ситуация сложная и имеет свои тонкости. С одной стороны, эти технологии помогают избежать передачи наследственных заболеваний и снизить соответствующие расходы в то время, когда стоимость и так дорогого лечения наследственных болезней будет, по-видимому, стремительно нарастать. Однако этичность технологий, позволяющих снизить вероятность появления генетических заболеваний у эмбриона, продолжает обсуждаться, и, по-видимому, обсуждение затянется на многие годы.
Чтобы задержать (а лучше остановить) надвигающийся кризис, связанный с медицинскими затратами из-за увеличения числа генетических анализов, нам надо сделать три вещи. Во-первых, необходимо инвестировать в новые перспективные технологии, позволяющие удешевить лечение наследственных заболеваний. Это не получится сделать быстро, но это было бы лучшим решением нашей проблемы. Во-вторых, стоимость современного лечения наследственных болезней должна быть снижена до приемлемого уровня, тем более что в этом случае число пациентов и объем продаж соответствующих препаратов увеличится. В-третьих, мы должны обратить внимание на то, как повысить эффективность лечения хронических заболеваний, не важно, генетических или негенетических.
Если эти проблемы не будут решены, общество США может расколоться на две неравные части: с одной стороны будут состоятельные люди, которые могут себе позволить дорогостоящее лечение генетических заболеваний, с другой – малоимущие. В конечном счете важно, чтобы мы использовали генетические знания не для усиления неравенства в будущем, а, наоборот, для уравнивания правил игры и увеличения разнообразия американского общества. Чем выше генетическое разнообразие, тем больше вероятность возникновения гетерозиса. Гетерозис – это улучшение наследственных признаков, возникающее при смешении генов обоих родителей: в результате потомок превосходит по этим признакам своих предков и даже могут появляться новые свойства, не присутствующие ни у одного из родителей. Если Америка будет заботиться о пациентах с наследственными заболеваниями и позволит им благополучно существовать в обществе, будет создано такое этническое и генетическое разнообразие, опираясь на которое мы сможем справиться с любыми возникающими проблемами. И в этом кроется одна из самых сильных сторон США.
Глава 10 Отпечатки пальцев в капельке крови
Для Кирка Бладсуорта, рыбака-торговца и бывшего морского пехотинца, кошмар начался в июле 1984 г. незадолго до рассвета. Он вспоминает, как в 2 часа 15 минут «раздался громкий стук в дверь. Бух, бух, бух! Я открыл дверь, и мне в глаза ударил свет фонарика. Я вышел»{85}.
«Голос за ярким светом произнес: “Бладсуорт, сукин ты сын, ты арестован за убийство первой степени”. Они зачитали мои права, и я покинул свой городок на 8 лет, 9 месяцев и 19 дней».
Кирку Бладсуорту было предъявлено обвинение, а впоследствии его судили, признали виновным и приговорили к смерти за зверское преступление, которого, как потом выяснилось, он не совершал. В конце концов он оказался первым американцем, которого сначала приговорили к смертной казни, а потом оправдали на основании ДНК-экспертизы.
Благодаря СМИ, особенно телевизионным программам, таким как сериал «C.S.I.: Место преступления», для большинства американцев использование ДНК-анализа в первую очередь ассоциируется с криминалистической экспертизой. Однако на примерах разных людей в этой книге уже было показано, что, хотя использование ДНК в медицине имеет огромное значение, это сопряжено с большими сложностями; точно так же дело обстоит и с анализами ДНК в криминалистике.
Благодаря ДНК системе уголовного правосудия удалось поймать и наказать жестоких преступников. Кроме того, с помощью ДНК было оправдано большое количество сидящих в тюрьме невинно осужденных людей. Но если сложную хирургическую операцию можно провести одному пациенту, это еще не означает, что точно такие же операции можно проводить всем пациентам – так и в криминалистической экспертизе пробелы, упущения и ошибки в мелочах могут создать реальные проблемы.
Наши коллеги – когнитивные психологи – обычно говорят, что мы видим не реальный мир, а то, что соответствует нашим особенностям восприятия. Человеческий мозг запрограммирован, чтобы видеть закономерность в случайно собранных данных, даже когда ее нет, это врожденная склонность разумных животных, которая называется апофения. Поэтому люди видят фаллические объекты в тестах Роршаха, привидения в ночной темноте и непонятные объекты на нечетких сканах МРТ.
Доказательства считаются косвенными, если приходится строить предположения и догадки, прежде чем прикрепить их к делу. По определению, косвенные доказательства могут быть объяснены несколькими различными способами. Например, очевидец наблюдает объект, который может быть оружием, однако это может также быть алюминиевой трубой, телескопом, отражением луча света от окна при определенном ракурсе – или вообще ничем.
Сегодня умение находить, сохранять и с помощью репликации значительно увеличивать объем очень малых образцов ДНК улучшилось настолько, что можно работать с несколькими капельками пота, слюны из плевка или частичками перхоти, оставленными на месте преступления. И общество, и СМИ, и, что более важно, присяжные заседатели, воспитанные новостями и телевизионными детективными сериалами, – все ожидают, что следователи представят генетические доказательства вины, особенно для таких тяжелых преступлений, как сексуальное насилие или убийство.
Технологическая возможность использования генетических «отпечатков» в качестве судебных доказательств возникла на удивление недавно. Ведь на самом деле, после того как Уотсон и Крик в 1950-х гг. описали структуру ДНК, прошло около трети века, прежде чем идентификация ДНК начала использоваться в криминалистике.
Когда в 1984 г. впервые выяснилось, что ДНК может быть использована для идентификации людей (а заодно, как случайно обнаружилось, и их родственников), это оказалось неожиданностью даже для совершивших открытие – для Алека Джеффриса и его исследовательской группы из Университета Лестера.
«Мы и подумать не могли о криминальной идентификации», – сказал Джеффрис в своем интервью журналу Investigative Genetics в 2013 г.{86} Джеффрис утверждал, что открытие было вызвано только «научным любопытством». Они очень хотели найти «гораздо более информативные генетические маркеры», чем любые из ранее известных.
Неожиданное открытие произошло в одно сентябрьское утро примерно в 9 часов. Джеффрис только что получил рентгеновский снимок радиоактивно помеченных фрагментов ДНК членов нескольких семей. Сотрудники лаборатории взяли образцы крови и с помощью биохимии отделили геномную ДНК от других веществ. Затем использовали специальные ферменты – рестриктазы, которые выделяют из бактерий. Эти ферменты распознают и отрезают определенные последовательности ДНК. Рестриктазы появились у бактерий в процессе эволюции, чтобы вырезать ДНК вирусов, называемых бактериофагами, которые узнаются по определенным последовательностям ДНК. Но Джеффрис знал, что эти же самые ферменты могут и в ДНК человека распознавать и вырезать фрагменты с такими же, обычно палиндромными, последовательностями, например фрагмент ГААТТЦ.
Джеффрис вырезал кусочки ДНК, которые, казалось, не имели важного биологического значения: в этих последовательностях не были закодированы какие-либо инструкции. Специалисты в области вычислительной биологии, которые изучают генетические последовательности, считают эти бессмысленные фрагменты «мусором». Такой «мусор» сильно засоряет анализ уникальных нуклеотидных последовательностей, от которых фактически зависят биологические признаки. Фрагменты, называемые «сателлитной ДНК», вставлены между кодирующими последовательностями, как пустыни между оазисами, – однообразные повторяющиеся участки, которые должны удаляться при сканировании генома. В большинстве исследований эти элементы не рассматривают и удаляют после работы, как будто после ужина выбрасывают мусор.
Но старая пословица гласит: «Что для одного мусор, то для другого сокровище». Среди многочисленного хромосомного мусора встречаются миллионы коротких фрагментов некодирующей ДНК: те самые сателлиты и их младшие родственники – мини- или микросателлиты. У мини-сателлитов повторяющиеся фрагменты длиннее, чем у микросателлитов, но и те и другие могут образовывать сотни и тысячи повторений на нити ДНК.
В процессе копирования генома, когда образовываются предшественники сперматозоидов и яйцеклеток, в ДНК вносятся изменения из-за потери фрагментов, замены или добавления новых. В мусорной ДНК может увеличиваться или уменьшаться количество повторов. Такие же случайные ошибки происходят и в неповторяющихся фрагментах, не отвечающих за жизненно важные процессы (например, за синтез нужных белков). У каждого ребенка среди таких повторяющихся сателлитов есть несколько, отличающихся от родительских. Поскольку большинство таких ошибок никак не влияет ни на предрасположенности к различным болезням, ни на основные признаки, такие как рост или интеллект, и, следовательно, не уменьшают шансы человека на выживание и размножение, они сохраняются и могут быть переданы будущим поколениям. Суть в том, что у каждого из нас есть множество некодирующих фрагментов, таких же, как у родителей и других родственников, но при этом имеется и несколько уникальных сателлитных последовательностей.
Поскольку в сателлитных ДНК разное количество нуклеотидов, они по-разному весят, и их легко отделить друг от друга. Они и оказались самородками, закопанными в мусоре, и Джеффрис извлек из них большую пользу для генетического картирования и криминалистической идентификации.
Джеффрис разделял ДНК с помощью электрического тока. Этот процесс называется электрофорез. При этом нарезанные рестриктазой фрагменты ДНК меньшего размера быстрее движутся к одному краю гелевой пластинки, в то время как более крупные фрагменты остаются на другой стороне.
Затем в лаборатории Джеффриса использовали различные последовательности сателлитной ДНК в качестве зондов, помеченных радиоактивным фосфатом, чтобы можно было определить местоположение пятна. ДНК каждого человека двигалась по своей отдельной полосе, каждый радиоактивный фрагмент находил комплементарный ему участок, так что содержащие радиоактивную метку ГАТЦ связывались с соответствующими им ЦТАГ. На рентгеновской пленке радиоактивные участки выглядели как черные размытые параллельные полосы там, куда продвинулись различные фрагменты ДНК, так что снимок был похож на старинный валик механического пианино или перфокарту компьютеров прошлого века.
«Я думаю, что до меня около минуты доходило, что мы получили на том первом рентгеновском снимке… Вся моя жизнь в корне поменялась за эти 60 секунд», – говорит Джеффрис.
Джеффрис почти сразу понял, что распределение пятен на рентгеновской пленке было уникальным для каждого человека, причем среди родственников различия были меньше. Это стало первым доказательством того, что по ДНК можно определить, кому она принадлежит и на чью похожа.
Сегодня это кажется очевидным, но тогда было абсолютно неожиданным. Джеффрис вспоминает, как он удивился, когда внезапно понял, что его открытие можно использовать для определения отцовства, а биологам оно поможет изучать биологическое разнообразие. И еще он понял, что это окажется потрясающим инструментом для криминалистов.
По воспоминаниям Джеффриса, он так же быстро сообразил, что наука очень мало знает о том, как ДНК сохраняется, скажем, в капле крови. Поэтому всю вторую половину дня он провел прокалывая свой палец и оставляя капли крови по всей лаборатории, чтобы посмотреть, что произойдет через некоторое время, когда кровь высохнет.
Уже поздним вечером, когда он взволнованно рассказал своей жене Сью о новом открытии, она сразу предложила использовать технологию в совершенно другой области: в иммиграционных вопросах, когда власти сомневаются или оспаривают заявленные семейные отношения. И действительно, в скором времени решение именно такого вопроса стало первым практическим применением генетической дактилоскопии.
Однако коллеги не разделяли его уверенность. Через несколько недель после того, как было сделано открытие, он рассказал о нем коллегам в неформальной беседе во время обеденного перерыва в университете:
Я рассказал про биологию этих кусочков ДНК, про их сходство у родственников, и как можно одновременно получить множество таких мини-сателлитных последовательностей, и что их рисунок у каждого свой. Пока все было в порядке. Затем я сказал: «И мы могли бы использовать эту технологию, чтобы ловить насильников». Я помню те насмешливые возгласы… половина моих коллег подумала, что Джеффрис сошел с ума. Это только добавило мне решительности, вы знаете, такое помогает{87}.
Генетической дактилоскопией это назовут позже. На семинаре, который Джеффрис проводил в другом университете, он отметил некоторые закономерности и высказал свои предположения о том, как этот метод можно использовать. Потом к нему подошел друг и коллега и предположил, что это похоже на дактилоскопию. Джеффрис сразу решил, что это идеальный способ объяснить предлагаемую технологию.
«Это было очень мудрое решение, – говорит он. – Если бы мы назвали ее, скажем, индивидуальный саузерн-блот мини-сателлитный гибридизационный профиль, мы бы погубили все дело. Технология не покинула бы стен научной лаборатории».
Благодаря истории угандской иммигрантки по имени Кристиана Сарба, которая безуспешно пыталась доказать властям, что ее сын Эндрю действительно был ее биологическим сыном, этот метод все-таки вышел за пределы научной лаборатории. Спор вообще-то возник в 1983 г., за год до удивительного открытия, сделанного Джеффрисом в лаборатории. Тринадцатилетний Эндрю был задержан иммиграционной службой в лондонском аэропорту Хитроу. У него имелся британский паспорт, но власти заподозрили обман. Его родители были разведены, и паренек провел несколько месяцев в Уганде с отцом. Сотрудники иммиграционной службы были уверены, что либо паспорт поддельный, либо подросток, прилетевший в аэропорт, не был настоящим владельцем паспорта. В итоге ему разрешили отправиться в Лондон домой к матери, но это произошло только после вмешательства члена парламента. Эндрю по-прежнему подлежал депортации.
Британский некоммерческий юридический центр Хаммерсмита попытался помочь, собирая отзывы родственников, семейные фотографии и даже некоторые биологические сведения. Они установили совпадение групп крови – это позволяло предположить, что Кристиана и Эндрю действительно близкие родственники. Однако в британском Министерстве внутренних дел продолжали сомневаться, предположив, что молодой человек, выдающий себя за Эндрю, мог быть сыном одной из живущих в Гане сестер его матери. Мать и сын проиграли иммиграционное слушание, но добились права обжаловать решение. Если бы они проиграли апелляцию, Эндрю, который вырос и провел всю свою жизнь в Англии с матерью, братьями и сестрами, был бы депортирован.
После того как в газете написали про Алека Джеффриса и его новое открытие, юридический центр Хаммерсмита попросил ученого о помощи. Используя ДНК из крови трех братьев и сестер Эндрю (происхождение которых не оспаривалось), его матери и, конечно же, самого Эндрю, а также людей, абсолютно не связанных с их семьей, Джеффрис получил серию ДНК-профилей.
У Эндрю было целых 25 таких же сателлитных повторов, как и у его братьев и сестер, это было явно унаследовано от матери. Джеффрис мог подсчитать вероятность того, что Эндрю был сыном одной из теть: эта вероятность была чрезвычайно мала, меньше чем один к полумиллиону. Кроме того, сравнив образцы ДНК всех четырех детей и выделив у них общие последовательности, которых не было у Кристианы, Джеффрис смог с достаточной точностью определить генетический профиль отца всех детей. В 1985 г. Министерство внутренних дел приняло заключение Джеффриса и фактически объявило, что в дальнейшем не будет оспаривать родительство при наличии таких убедительных генетических доказательств{88}.
Три года спустя открытая Джеффрисом генетическая дактилоскопия была впервые использована для расследования убийства, и в итоге было раскрыто дело об изнасиловании и убийстве двух девочек-подростков в районе Лестера. Примечательно, что тут сразу два события произошли впервые: впервые на основании генетической дактилоскопии оправдали невиновного человека и впервые она послужила основанием для вынесения приговора настоящему преступнику.
В ноябре 1983 г. 15-летняя школьница Линда Манн была изнасилована и задушена на безлюдной дороге Блэк-Пад, проходившей по территории психиатрической больницы в Нарборо. По образцу спермы определили, что у преступника была группа крови А. Благодаря этой информации и особенностям ферментного состава образца круг подозреваемых сузился до 10 % местного мужского населения. Но преступление осталось нераскрытым.
Затем три года спустя еще одна 15-летняя девушка, ее звали Дон Эшворт, была изнасилована и задушена в соседней деревне, на еще одной глухой дороге под названием Тэн-Пауд-Лэйн. Образцы спермы показали, что у убийцы, как и в прошлый раз, была группа крови А и тот же самый ферментный состав.
На этот раз полиции удалось найти подозреваемого: им оказался умственно отсталый 17-летний Ричард Бакленд, работавший в психиатрической больнице. Бакленда видели недалеко от того места, где убили Дон Эшворт. На допросе он в конце концов признался в последнем убийстве, но отрицал, что имеет какое-либо отношение к предыдущему изнасилованию и убийству.
Тем временем Джеффрис вместе с двумя экспертами-криминалистами Питером Гиллом и Дэвидом Уэрреттом из службы судебной экспертизы разработал методику, позволяющую в подобных случаях извлечь ДНК и провести генетическую дактилоскопию. Первое сообщение о своей методике они опубликовали в начале 1985 г. Гилл, ведущий автор этой работы, предложил технологию, позволяющую извлечь из жертвы сексуального насилия пригодную для анализа ДНК, для этого надо было разделить клетки влагалища жертвы и сперматозоиды{89}.
Когда ученые взяли образцы крови Бакленда и сравнили содержащуюся там ДНК с образцами спермы, стало ясно, что этот нездоровый молодой человек не совершал ни одно из этих преступлений. Умственно отсталый, он сдался на жестком допросе настойчивых, возможно, нетерпеливых полицейских, психологическим давлением выколачивающих из него признание. Таким образом, Бакленд стал первым человеком, оправданным на основании генетических доказательств.
Позже Джеффрис сказал: «Я не сомневаюсь, что его признали бы виновным, если бы не было генетических доказательств. Это стало важнейшим событием».
Между тем озадаченные полицейские остались без подозреваемого.
Затем, в 1987 г., последовало первое массовое тестирование ДНК потенциальных подозреваемых. Полицейские начали обширные поиски, пытаясь проверить геномы более чем у 4000 не имеющих алиби мужчин, проживавших в том районе, где было совершено убийство. Следователям удалось получить образцы ДНК почти всех (98 %) мужчин в округе от 17 до 34 лет, не имеющих алиби. И вновь следствие зашло в тупик.
Прорыв произошел в августе, когда одна женщина сообщила полиции, что подслушала, как ее коллега хвастал, что обвел следствие вокруг пальца и сдал образец ДНК вместо своего друга, получив за это деньги. Того друга, местного пекаря по имени Колин Питчфорк, сразу же арестовали и взяли у него материал для анализа. Микросателлитная ДНК в образцах идеальным образом совпадала с полученной из спермы, найденной на месте обоих преступлений. На допросе Питчфорк признался, что приставал к сотням девушек и женщин, и сознался в изнасилованиях и убийствах. Питчфорк оказался первым в мире преступником, которого нашли и осудили во многом благодаря генетическим доказательствам. Он получил пожизненный срок.
Кирк Бладсуорт, житель Мэриленда, которого ранним утром в июле 1984 г. разбудил яростный стук полицейских в его дверь, был арестован по обвинению в жестоком изнасиловании и убийстве девятилетней Дон Хэмилтон. Сейчас он на свободе благодаря технологии генетической дактилоскопии, разработанной Джеффрисом, и истории с Колином Питчфорком.
В те дни, когда Дон Хэмилтон пропала и впоследствии была найдена мертвой в лесистой местности, полиция искала убийцу. Два маленьких мальчика сказали, что видели, как она шла в сопровождении высокого худого блондина с пышными усами. По этому описанию полицейский художник подготовил рисунок, и вскоре одна женщина сообщила, что на портрете изображен человек, похожий на парня по имени Кирк, который недавно переехал в этот район и, по ее словам, работал в компании, импортирующей мебель. Полиция раздобыла фотографию Бладсуорта и вместе с фотографиями других людей показала ее мальчикам для опознания. Один мальчик утверждал, что среди них нет мужчины, которого он видел. Второй указал на Бладсуорта, но сказал, что цвет волос другой: тот мужчина – блондин, а у Бладсуорта волосы были ярко-рыжие.
Но это было не единственное несоответствие описанию. Бладсуорт был далеко не худой: он весил целых 105 кг при росте 185 см. Но полиция все равно провела очное опознание. Один из мальчиков так и не опознал никого из группы. Второй указал на полицейского в штатском, которого добавили, чтобы увеличить количество человек в группе.
Однако полиции показалось, что Бладсуорт ведет себя подозрительно. Вскоре после убийства он покинул город, не сказав жене, куда уехал. Она подала заявление об его исчезновении. Позднее Бладсуорт заявил, что их брак был на грани разрыва и он просто хотел удрать подальше от жены. Полиция нашла его в близлежащем городке Кембридже, где он вырос и жил с женой до недавнего времени.
В следующем году был суд. К тому времени мальчики решили, что именно его они видели тогда идущим с Дон, и три других свидетеля утверждали, что он был в том районе. У Бладсуорта не было надежного алиби. Эксперты-криминалисты определили, что следы обуви на теле девочки совпадают с узором на подошве ботинок Бладсуорта. В марте 1985 г. его признали виновным в похищении, сексуальном насилии и убийстве и приговорили к смерти.
Бладсуорт говорит, что, попав в камеру смертников, первое время был ошеломлен произошедшим и часто плакал. Затем он начал читать множество книг – романы, научно-популярную литературу – все, что только могло попасть ему в руки. В 1987 г. друг прислал ему по почте новую книгу. Книга «По следу крови» была написана бывшим полицейским из Лос-Анджелеса, популярным автором детективов Джозефом Уэмбо. Там описывалась реальная история охоты за убийцей в Англии и было рассказано, как открытие Джеффриса привело к осуждению Колина Питчфорка.
Правдивая история, прочитанная в книге, и научное обоснование генетической дактилоскопии дали Бладсуорту новую надежду. Что если на основании анализа ДНК можно будет доказать, что он не насильник и не убийца?
Однако потребовались годы, чтобы добыть эти доказательства. В 1991 г. Бладсуорту удалось получить нового адвоката, Роберта Морина, но Морин сначала не обещал ничего обнадеживающего. В прокуратуре заявили, что улики были случайно уничтожены. Но Морин сумел обнаружить такую важную улику, как трусы девочки, которые были найдены на дереве{90}.
В это время Бладсуорт был уже не в камере смертников. Несколько лет назад он выиграл новый суд, доказав, что обвинение скрыло информацию, которая могла бы послужить его оправданию. Бладсоурт был повторно осужден, но уже к пожизненному заключению, так что смертная казнь ему больше не угрожала.
К 1992 г. адвокат был уверен, что благодаря новым генетическим технологиям можно получить доказательства для оправдания.
В это время появилась полимеразная цепная реакция – новый способ быстро и значительно увеличить очень малые количества ДНК. В 1992 г. Морин получил разрешение суда отправить образцы в Калифорнию ученому по имени Эд Блейк, который первым в США начал работать с ДНК-доказательствами и руководил единственной частной лабораторией, проводившей генетические анализы при расследовании преступлений. Семья Бладсуорта к тому времени уже исчерпала все свои ресурсы, заплатив за два исследования. Морин из собственного кармана заплатил $10 000 за анализ.
На трусах жертвы обнаружилась одна высохшая капля спермы размером с десятицентовую монету. Лаборатория была загружена, а процесс шел тогда гораздо медленнее, чем сейчас, поэтому результаты пришли только через год. Но из них ясно следовало, что ДНК не принадлежала Бладсуорту. Чтобы доказательства были надежнее, часть материала Морин отправил в лабораторию ФБР. Через несколько недель пришло подтверждение, что ДНК убийцы и Бладсуорта не совпадают.
Бладсуорт был освобожден из тюрьмы в апреле 1993 г. и в конце концов получил $300 000 компенсации заработной платы, невыплаченной ему за девять лет, проведенных в заточении, но и освобождение, и денежные выплаты осуществлялись при условии не подавать в суд на штат для получения больших компенсаций. Бладсоурт вышел на свободу, но еще около 10 лет оставался связан с этим делом, пока преступление не раскрыли. В 2000 г., через семь лет после освобождения, два юриста, которые обвиняли его в суде, казалось, продолжали считать его виновным. Бывший прокурор Роберт Лаззаро высказал репортерам предположение, что, возможно, сперма могла каким-то образом попасть на трусы девочки с нижнего белья ее отца в корзине для грязного белья и по какой-то причине она надела нестиранное белье. Или Бладсуорт, возможно, напал на девочку в паре с кем-то и сперма того неизвестного использовалась для оправдания виновного.
В начале сентября 2003 г. Энн Бробст, которая вместе с Лаззаро была обвинителем в обоих процессах, позвонила Бладсуорту, чтобы положить конец этой истории и дать ему возможность успокоиться. Она сказала Бладсуорту, что хочет рассказать ему лично некоторую информацию, и предложила выбрать место встречи в Мэриленде.
Бладсуорт захотел встретиться на парковке ресторана Burger King рядом со своим домом. На следующий день он появился перед входом в ресторан с новой женой Брендой, кузеном и своим адвокатом. Бробст прибыла вместе с парой полицейских. Компания зашла в ресторан. Бробст купила Бладсуорту газировки. Затем она сказала, что следователи наконец-то нашли по ДНК настоящего убийцу, и извинилась.
Это был еще один сюрприз. ДНК принадлежала осужденному сексуальному маньяку по имени Ким Раффнер.
«Я его знаю!» – воскликнул Бладсуорт. Раффнер содержался в той же тюрьме, что и Бладсуорт, и сидел в камере этажом ниже.
Бладсуорт, с почестями ушедший в отставку морской пехотинец, был первым человеком, которого в США вытащили из камеры смертников на основании генетических доказательств. Рэй Крон, почетно демобилизованный ветеран ВВС, работал на почтовой службе США до тех пор, пока не был осужден и отправлен в камеру смертников. Он стал 12-м заключенным, освобожденным благодаря ДНК-доказательствам (и сотым оправданным с тех пор, как в 1976 г. в США восстановили смертную казнь).
29 декабря 1991 г. тело 36-летней барменши по имени Ким Анкона было найдено в мужском туалете в баре, где она работала в городе Финиксе штата Аризона. Не было почти никаких улик. Она была раздета, но остатков спермы не нашли. Однако на теле присутствовали следы укусов на шее и груди, а также следы слюны. Крон играл в команде по софтболу, спонсируемой баром, и регулярно посещал заведение. Следователи заинтересовались им, когда одна из подруг жертвы рассказала, как Анкона упомянула, что Крон, возможно, поможет ей закрыть бар той ночью{91}.
Когда следователи допрашивали Крона, которому на тот момент было 35 лет, один из них сразу же обратил внимание на состояние его зубов: нерегулярные, очень похожие на те, что отпечатались в виде неровных укусов на теле жертвы. Крон разрешил сделать отпечаток его зубов. У него было алиби. Крон владел домом и сдавал внаем комнату. Его съемщик сказал, что Крон весь вечер был дома. Крон утверждал, что уже крепко спал к тому моменту, когда было совершено убийство в туалете. Тем не менее, поскольку криминалистическая лаборатория в Финиксе нашла сходство между следами укусов и неровными зубами Рэя Крона, его арестовали и обвинили в сексуальном насилии, похищении и убийстве Анконы.
Рэй Крон не только не имел ранее судимости, но и, будучи школьником, старался вести себя хорошо, чтобы его не оставляли после уроков, потому что это помешало бы играть в школьной спортивной команде.
Единственной уликой были неровные зубы. Ключевым свидетелем обвинения стал Рэй Роусон, стоматолог из Невады, который специализировался на «судебной стоматологии». Крон говорит, что был «ошарашен, когда этот мнимый эксперт со всеми своими учеными степенями» заявил, что он абсолютно убежден, что слепок зубов Крона полностью соответствует рисунку укуса. То, что волосы, найденные на теле и вокруг жертвы, принадлежали не Крону, полиция, видимо, сочла случайным совпадением.
Крон признает, что совершил огромную ошибку, не найдя возможности нанять более компетентного адвоката. Он мог бы для этого продать свой дом, но не хотел его терять. Он говорит, что «наивно полагал», что назначенный ему адвокат, которому, как он потом узнал, заплатили всего $5000, сумеет доказать его невиновность.
Конечно же, против него сыграл и тот факт, что аризонские СМИ и до, и во время судебного процесса публиковали жуткие репортажи, называя Рэя Крона «кривозубым убийцей». В 1992 г. он был осужден и приговорен к смерти.
Но Крона кое-что отличало от множества других ложно обвиненных: заботливый родственник со средствами. Двоюродный брат в Калифорнии, который основал небольшую успешную компанию по производству программного обеспечения, посетив Крона в тюрьме, был твердо убежден, что Крон осужден несправедливо. В 1996 г. новые адвокаты Крона смогли добиться пересмотра дела, поскольку были получены доказательства того, что следы укусов на самом деле не соответствовали его зубам.
Теперь у защиты были собственные эксперты-криминалисты. Три дипломированных судебных стоматолога представили детальное доказательство того, что следы укусов на жертве просто не соответствовали зубам Крона, хотя в обоих случаях зубы были неровными.
К удивлению Крона, его вновь осудили, основываясь только на показаниях первого эксперта, стоматолога со стороны обвинения, и отказавшись принимать показания экспертов защиты. Однако на этот раз судья приговорил его не к смерти, а к пожизненному заключению, мотивируя это тем, что не уверен, совершал ли Крон вообще это преступление.
В 2001 г. был принят закон штата, разрешающий проведение анализов ДНК после вынесения приговора, поэтому адвокат Крона обратился за разрешением суда на анализ маленьких капель крови, найденных на джинсах и нижнем белье жертвы. Те же эксперты-криминалисты в Финиксе, благодаря которым Крон был арестован и осужден, теперь определили, что ДНК в каплях крови принадлежало не Крону и не жертве, а кому-то еще. Следователи Финикса нашли совпадающую ДНК в базе генетических данных ФБР. Это была ДНК Кеннета Филлипса, который жил в нескольких сотнях метров от того бара, где была убита Анкона. Он, вероятно, порезался орудием убийства во время борьбы с жертвой. Филлипс уже находился в тюрьме, осужденный за то, что задушил семилетнего ребенка, это произошло всего через несколько недель после убийства Анконы. Во время убийства Филлипс был на свободе, досрочно освобожденный из тюрьмы, где сидел за другое убийство. Он не попал в круг подозреваемых, несмотря на то что у него тоже были кривые зубы. Когда следователи допросили убийцу, он сначала отрицал свою вину. Но после более тщательного допроса с участием частного детектива, работающего на стороне защиты Крона, Филлипс признался, что напился до бессознательного состояния и проснулся на следующее утро после убийства весь в крови, ничего не помня о произошедшем. В 2006 г. он признал себя виновным и теперь отбывает пожизненное заключение за убийство.
Нынешняя работа Крона посвящена оправданию невиновных. Он один из руководителей некоммерческой организации под названием «Свидетель невиновности», расположенной в Филадельфии, которая занимается исключительно оправданием людей, ложно обвиненных в преступлениях. Сотрудники организации представляют собой особую категорию людей: это те, кто был оправдан и вышел на свободу.
Однако не хотелось бы создавать впечатление, что с использованием ДНК в криминалистике все просто и ясно. Очень важно понимать, какие ужасные ошибки возникают, если работать неумело или неправильно. Питер Гилл, эксперт-криминалист, который начал свою карьеру в судебной генетике с исследования, позволившего найти и осудить Колина Питчфорка, сейчас работает профессором судебной генетики в Университете Осло в Норвегии. В 2014 г. в своей книге «Лжесвидетельство ДНК: Причины судебных ошибок» (Misleading DNA Evidence: Reasons for Miscarriages of Justice) Гилл написал, что для первоначальных методов ДНК-профилирования, которые с его помощью улучшил Алек Джеффрис, требуются относительно крупные образцы, настолько большие, что их можно увидеть невооруженным глазом, размером не менее 1 см. В дальнейшем, по мере того как были созданы и усовершенствованы методы полимеразной цепной реакции, ученые смогли работать со все более маленькими образцами, по сути увеличивая это «следовое количество ДНК» до нужного объема с помощью многократной репликации{92}.
Гилл поясняет, что следовые количества ДНК «есть везде в окружающем нас мире». Допустим, вы зашли в туалет на заправке через несколько часов после меня. Сейчас зима, но я дотронулся до дверной ручки голыми руками. Вы носите перчатки, которыми беретесь за ту же самую дверную ручку. Через несколько часов все в тех же перчатках вы совершаете вооруженное ограбление и, убегая, выбрасываете оружие. Маленькие фрагменты моей ДНК вполне могут остаться на оружии. И по словам Гилла, для этого не требуется прямого контакта. Я могу распространять ДНК не только кашляя в вашем присутствии, но и просто во время разговора.
Как следовые количества ДНК могут ввести в заблуждение, видно на примере одной истории, получившей печальную известность, – когда несколько европейских стран в течение нескольких лет вели многочисленные безуспешные расследования. В 2007 г. в городе Хайльбронн в Германии была убита 22-летняя женщина-полицейский. Полиции не только удалось выделить следовые ДНК на месте преступления, но и выяснить, что ДНК принадлежала серийному убийце, ДНК которого находили и при других преступлениях. У него была редчайшая для серийного убийцы особенность: он был женщиной. В образцах ДНК обнаруживались две Х-хромосомы. Популярные СМИ быстро прозвали ее Фантом из Хайльбронна. Она действительно была странной преступницей: следователи находили ее ДНК там, где совершались самые разные преступления: мелкие кражи, ограбления и угон автомобилей во Франции, Австрии и Германии. В нескольких более мелких преступлениях явно участвовали ее сообщники разных национальностей, они были пойманы, но отрицали существование женщины-фантома. Через два года интенсивных поисков Фантома власти нашли похожую женщину. ДНК принадлежала не серийному убийце и не Фантому, а работнице австрийской фабрики, паковавшей ватные тампоны, которые полиция использовала для сбора ДНК с мест преступлений. Все тампоны были стерилизованы. Однако стерилизация убивает вредоносные организмы, но не устраняет следовую ДНК.
Гилл подчеркивает в своей книге, что генетическая дактилоскопия может ошибаться, и именно это произошло в случае преступления, вызвавшего большой ажиотаж в желтой прессе, – когда была убита британская студентка Мередит Керчер. В убийстве обвинили американскую студентку Аманду Нокс и ее парня – итальянца Рафаэля Соллечито, тоже студента.
Первого ноября 2007 г. Керчер была зверски убита: заколота ножом в итальянском городе Перуджа в четырехкомнатной квартире, которую она снимала вместе с Амандой Нокс и двумя молодыми итальянками.
Через несколько дней после убийства на месте преступления в изобилии были найдены ДНК, следы ног и кровавые отпечатки рук бродяги, торговца наркотиками и случайного грабителя Руди Геде из Кот-д’Ивуара. ДНК Геде была обнаружена на одежде Керчер, в ее сумочке, где были следы его спермы, а также в фекалиях в туалете. К тому времени Геде сбежал в Германию, где был пойман во время масштабной облавы.
Геде был осужден и помещен в тюрьму. Но прежде чем исследовать улики, которые привели Геде в камеру, полиция и особенно «слуга народа» – прокурор Джулиано Мининьи – придумали сложную теорию о том, как Нокс и Соллечито совершили это преступление под воздействием наркотиков во время дикого, сатанинского секс-ритуала.
Единственной уликой обвинения, указывающей на Нокс, были следы ДНК. Не совсем понятно, почему полиция изначально считала орудием убийства большой кухонный нож, вытащенный из ящика для ножей, ложек и прочей кухонной утвари на кухне у Соллечито. Но после того, как Соллечито и Нокс сообщили, что Нокс использовала этот нож несколько раз для приготовления еды, стало понятно, как следы ее ДНК попали на рукоятку. Нож стали называть «ножом с двойной ДНК», потому что следователи утверждали, что нашли на лезвии следы человеческой ДНК, и после многократной репликации смогли предположить, что это ДНК Керчер.
Однако оказалось, что этим ножом нельзя было нанести ту смертельную рану. Лезвие было слишком широким и не соответствовало размеру раны. Кроме того, кровавый отпечаток ножа гораздо меньшего размера был на простыне на месте преступления. Поэтому текст обвинения был скорректирован, туда добавили предположение, что банда убийц использовала два ножа – один большой из ящика на кухне и другой поменьше.
Образец на лезвии ножа, который идентифицировали как ДНК Керчер, был проанализирован с помощью неоднозначной технологии, называемой малокопийное ДНК-профилирование, которая теоретически позволяет построить ДНК-профиль после амплификации образца столь малого объема, что для обычного анализа его сочли бы непригодным. ФБР в США не признает малокопийное ДНК-профилирование достаточно достоверным методом, чтобы использовать его результаты в суде, и не допускает полученные таким образом результаты в национальную базу генетических данных{93}.
У эксперта-криминалиста Патриции Стефанони было меньше 100 пикограмм рабочего материала (для того чтобы понять, как это мало: канцелярская скрепка весит примерно 1 грамм; пикограмм – это грамм, разделенный на триллион равных частей). Всего несколько лабораторий в мире имеют оборудование для выполнения малокопийного ДНК-профилирования. Эта методика очень чувствительна к загрязнению мельчайшими кусочками ДНК, которые попадают в лаборатории через воздух или какие-нибудь предметы, поэтому лаборатории должны быть оснащены специальным оборудованием, а работы ведутся в стерильных условиях с качественной системой вентиляции. В лаборатории Стефанони были совсем другие условия. Тем не менее, когда ее оборудование выдало, что размер образца «слишком маленький», она поменяла режим работы так, чтобы многократно умножить размер предполагаемого образца. Выйдя далеко за пределы, которые допустимы для достоверно надежного результата, ей удалось настолько увеличить объем материала, чтобы можно было идентифицировать ДНК Керчер на ноже.
Никто не проверял эти результаты. Никто и не сможет этого сделать. Крошечный след был полностью израсходован, так что провести качественное повторное тестирование невозможно.
Многие квалифицированные генетики-криминалисты из США, Великобритании, Норвегии и в особенности Италии выступили с резкой критикой сбора и анализа доказательств в данном случае. Во-первых, из ящика был взят только один нож. Полицейский заявил, что взял его из-за «полицейской интуиции» и потому, что, по его мнению, нож был необычайно чистым и на нем были царапины, а значит, его усиленно отмывали. Во-вторых, на видео, где фиксировался сбор улик на месте преступления, заметно, что полицейские не меняли резиновых перчаток, а это стандартная процедура для предотвращения перекрестного загрязнения. Значит, ДНК, оставленная совершенно невинно, скажем, на дверной ручке, может быть легко перенесена на другое место, которого касался следователь, то есть сами полицейские на месте преступления могли переносить ДНК с одного предмета на другой.
При более стандартизированном и строгом подходе необходимо исследовать и другие предметы, не найдутся ли и там следы «ДНК Керчер». Если они обнаружатся и в другом месте, например на другом ноже или на консервной открывалке, то это верный признак того, что произошла какая-то ошибка в сборе улик при проведении анализа.
Во время первого процесса защита просила подключить к анализу независимых экспертов, но получила отказ. Единственный отзыв о работе полицейского эксперта по ДНК предоставил ее начальник, который тоже работал непосредственно на обвинение. Начальник сказал, что работа эксперта была «отличная».
Позже апелляционный суд согласился на получение подробного обзора от внешних экспертов-криминалистов, назначив для этого двух профессоров из Римского университета Ла Сапиенца: Карлу Веччотти и Стефано Конти.
Если описывать вкратце, то эти эксперты в клочья разнесли первоначальное полицейское заключение. Они представили доклад с убийственной критикой всего процесса анализа ДНК, сообщив, что не было возможности проверить, действительно ли это ДНК жертвы, и даже если это была она, невозможно проверить, что это не результат загрязнения на месте изъятия улик или в лаборатории, что весьма вероятно, поскольку в той же комнате работали с ДНК Керчер.
Другой образец ДНК, который тоже, предположительно, связывал Рафаэля с преступлением, был на застежке, по-видимому, срезанной с бюстгальтера Керчер во время нападения. Застежка валялась на месте преступления больше 40 дней, прежде чем полиция в конце концов решила использовать ее в качестве улики. Фотографии показывают, что застежку перемещали несколько раз, в том числе и на кучу мусора. Университетские эксперты также раскритиковали проведенные с ней анализы, показавшие, что некоторое количество ДНК, найденное на застежке, принадлежало Рафаэлю. Среди прочего эксперты отметили, что «международные протоколы осмотра, сбора и исследования образцов не были соблюдены»{94}.
Питер Гилл перечислил некоторые из этих упущений:
От момента, когда застежку нашли на месте преступления, и до приобщения ее к делу прошло 47 дней [sic!]. На протяжении этого времени застежку перемещали, и найдена она была под ковром. Кроме того, на видеозаписи видно, что застежку передают из рук в руки, а потом роняют на пол, и, по-видимому, перчатки, в которых брали разные улики, не менялись перед взятием следующего предмета. Следователи также не меняли бахилы, пока ходили по месту преступления{95}.
Итальянская система правосудия разительно отличается от американской. Несмотря на презумпцию невиновности, обвиняемого могут держать месяцами без предъявления обвинений, как и было в случае с Нокс и Соллечито. Хотя в суде участвуют присяжные заседатели, судья непосредственно вовлечен в процесс и даже управляет присяжными во время составления вердикта на основании доказательств и «логики». Первичные анализы проводятся строго для обвинения. Но при этом процесс подачи апелляции свободный и почти автоматический.
Первый суд признал виновность. Суд выдал пространное «объяснение», где было сказано, что расположение ДНК Нокс на рукоятке кухонного ножа свидетельствует о причастности Нокс, потому что ДНК «с большей вероятностью могла оказаться на ноже, если его схватили для удара, чем если бы его использовании для нарезки еды»{96}.
В свою очередь Гилл называет это «опасными домыслами», основанными на «предвзятости подтверждения», отмечая, что «в научной литературе нет ничего, хотя бы отдаленно поддерживающего подобные умозаключения»{97}. Более того, в другом месте он пишет о наличии научных доказательств, что следовые количества ДНК могут перемещаться с одного места на другое, например на улику. При переноске ножа ДНК может попадать на стенки упаковки, в которой его переносили, а также перемещаться с лезвия на рукоятку, и наоборот. В этих экспериментах ножи переносили в картонных трубках. При расследовании смерти Керчер вызвавший подозрения нож был помещен в обувную коробку неизвестного происхождения.
В результате апелляции в 2011 г. обвиняемых не только признали невиновными, но было объявлено еще более значимое с точки зрения итальянских законов заключение: абсолютная невиновность. Такой вывод был сделан благодаря резкой критике первого судебного процесса. Апелляционный судья обратил особое внимание на сомнительность генетических доказательств. В этот раз Нокс и Соллечито были освобождены. Нокс поспешила вернуться в США.
Однако в Италии нет закона о повторной неподсудности за то же самое преступление. В начале 2014 г. был проведен повторный суд, и их обоих снова признали виновными.
Однако в конце этой истории, в марте 2015 г., Кассационный суд, то есть высшая судебная инстанция в Италии, рассмотрев апелляционную жалобу, отменил приговор окончательно и бесповоротно, ссылаясь на «потрясающую слабость» обвинительного заключения и в том числе «полное отсутствие биологических доказательств» того, что хотя бы один из подсудимых был в той комнате, где убили Керчер{98}.
Стивен Мур, вышедший на пенсию после 25 лет работы в ФБР, начал изучать это дело, после того как посмотрел новостной выпуск передачи «20/20» на телеканале ABC, где обсуждалась сомнительность многих «доказательств», предъявленных публике как бульварными газетами, так и более солидными СМИ. В 2010 г. Мур сказал в своем интервью в программе Today на канале NBC:
В таких случаях на месте преступления крови очень много, как будто ее просто разлили по всему полу. Если бы Аманда Нокс, ее парень и тот бродяга были соучастниками, там должны были остаться три набора отпечатков пальцев, три набора следов, ДНК образцов волос. Там было бы море доказательств. В той комнате обнаружены [sic!] следы, отпечатки пальцев, ДНК, образцы волос и слюны только одного человека – бродяги. Они [Нокс и Соллечито], очевидно, никаким образом не могли находиться в той комнате, не оставив следов физического присутствия{99}.
Нет никаких сомнений, что анализы, основанные на ДНК, могут быть сильным научным инструментом в расследованиях, помогая найти виновного и оправдать невинного. Некоммерческая организация «Защита невиновных», располагающаяся в Нью-Йорке, использует генетические доказательства, чтобы помочь освобождению людей, ложно обвиненных в ужасных преступлениях. В заявлении организации поясняется, что ДНК-дактилоскопия эффективна в большей части расследований, потому что она была разработана и усовершенствована квалифицированными учеными в процессе проверяемых, качественных исследований, это сильно отличается от других криминалистических методов идентификации. Например, анализ следов от укусов, на основе которого осудили Рэя Крона, в 2009 г. был признан Национальной академией наук США одним из криминалистических методов, не подкрепленных надежными научными исследованиями{100}.
Точно так же, как и генетические анализы в клинической медицине, чтобы ДНК-анализ в криминалистике оставался эффективным, наука должна быть точной. Как пишет Питер Гилл, наука «не должна опираться на “диванные рассуждения” о возможностях и гипотезах»{101}. Все пробелы должны быть заполнены с помощью аккуратных экспериментов с абсолютно понятными результатами. Гилл отмечает, что в деле с убийством Керчер следователи использовали очень чувствительный и конкретный тест, чтобы проверить все следы крови на кухонном ноже, и ничего не нашли, это был надежный вывод. Затем они сделали неподтвержденное утверждение, что всю кровь смыли с помощью отбеливателя, но сохранился маленький образец ДНК Керчер не из крови. Гилл отмечает, что ничто в научной литературе не говорит в защиту этой идеи. Чтобы обоснованно сделать такое утверждение, следователям придется провести серию тщательно контролируемых экспериментов с окровавленными ножами и доказать возможность такого исхода, пишет Гилл, прикладывая подробный план исследования, состоящего из семи этапов.
Кто бы ни был заинтересованной стороной – пациенты, судьи, адвокаты или обвиняемые в преступлениях, для эффективного анализа ДНК всегда нужна научная точность, минимизация погрешностей и полная информация обо всех ограничениях и неопределенностях. Для пациентов и их близких последствия ошибки могут колебаться от ненужного беспокойства до упущенных возможностей вылечить действительно серьезные заболевания. В судебной системе последствия ошибок тоже могут быть ужасными: несправедливое обвинение, привлечение к ответственности и лишение свободы. В любом случае от правильности выполнения анализа может зависеть жизнь человека.
Глава 11 Геном с украшениями
Непродолжительный, но жестокий голод, известный как Голодная зима, случился на западе Нидерландов в последние месяцы Второй мировой войны, когда в конце 1944-го – начале 1945 г. немецкая армия устроила блокаду этого региона. Поставки продовольствия опасно снизились, составив лишь треть от нормы, и люди вынуждены были есть траву и луковицы тюльпанов.
Поэтому неудивительно, что у многих женщин, которые были беременны во время Голодной зимы, дети родились с весом ниже нормального. Эта проблема была наиболее актуальна для тех младенцев, чьи матери во время голода были уже на последних месяцах, потому что именно тогда плод должен набирать основной вес.
Если матери страдали от голода в начале беременности, а затем получали адекватное питание, дети добирали необходимые килограммы в конце беременности и рождались с нормальным или близким к тому весом.
С точки зрения медицины здесь нет ничего удивительного. Главные сюрпризы этого ужасного «эксперимента» по нарушению питания матери и плода проявились со временем. Оказалось, что ранние неблагоприятные воздействия, такие как голод, модифицируют наши гены, и эти изменения могут сохраняться десятилетиями на протяжении нашей взрослой жизни.
Когда 1940-е гг. сменились следующими десятилетиями, благодаря склонности голландцев к педантичному ведению регистрационных записей эпидемиологи могли сравнивать взрослеющих детей, переживших Голодную зиму, и их братьев и сестер, которых это не затронуло. Поскольку у братьев и сестер половина генов общая, получается очень удобная выборка для анализа последствий недостаточного питания в материнской утробе.
Хорошая новость заключалась в том, что дети со сниженным весом, родившиеся во время или сразу после Голодной зимы, выросли достаточно здоровыми. Да, у них и в детском, и во взрослом возрасте рост был ниже среднего, но при этом реже, чем у братьев и сестер, развивалось ожирение; таким образом, им удавалось избежать медицинских проблем, связанных с излишним весом. Повезло?
Все было иначе для другой группы детей Голодной зимы. Их матери не получали полноценного питания, когда плод был на ранних стадиях развития, но на поздних сроках эти дети «добрали свое» и родились на первый взгляд нормальными младенцами. Ученые проследили их дальнейшее развитие в детстве, молодости и затем в среднем возрасте и обнаружили удивительную, тревожную и неожиданную закономерность. У этой группы была предрасположенность не просто к ожирению, но к целому комплексу проблем, который часто называют метаболическим синдромом. У них не только был лишний вес, но и большая склонность к диабету, гипертонии и болезням сердца. Во взрослом возрасте представители этой группы почти в два раза чаще страдали от болезней сердца по сравнению с голландцами, родившимися в последующие или предыдущие годы.
Казалось, что эти неожиданные последствия не были связаны c ДНК и не имели отношения к генетике. Ведь у юных жертв Голодной зимы гены были те же, что и у их братьев и сестер, родившихся до или после этой зимы. В соотношении «гены/среда» среда у них тоже была общая. Они жили в одних и тех же домах, ели за одним столом. Но их братья и сестры вырастали без такого количества проблем со здоровьем. В чем же дело?
В итоге ученые пришли к выводу, что ответ на эту загадку все же в некоторой степени затрагивает ДНК. Ясно, что не было никаких особых генов, измененных у этой группы. Но почему-то к ДНК были присоединены особые метки, из-за которых она читалась совершенно по-другому. В 2010 г. исследователи из Лейденского университета в Нидерландах вместе со своими коллегами из Колумбийского университета в США, по-видимому, сумели окончательно объяснить механизм произошедшего{102}.
Перебрав более 20 000 генов, они нашли нечто необычное в связи с геном под названием инсулиноподобный фактор роста 2 (ИФР-2), про который уже было известно, что его белок играет важную роль в раннем развитии и влияет на вес и рост людей даже во взрослом возрасте. ИФР-2 синтезируется в печени и выделяется в кровь. Этот гормон считается основным посредником для гормона роста и одним из важнейших белков, определяющих рост и вес. Ученые обратили внимание на особые химические структуры, так называемые метильные группы, которые украшали этот ген. Про эти соединения известно, что они важны для эпигенетических (приставка эпи по-гречески означает «над» или «выше») процессов. При этом сам набор генов в клетке не меняется, однако клетка начинает совершенно иначе с ними работать.
Это исследование принесло свои плоды. Ученые обнаружили, что у тех людей (а на момент исследования им было уже за 60 лет), которые были в утробе матери во время самых тяжелых времен Голодной зимы, по сравнению с их братьями и сестрами, родившимися раньше или позже, было намного меньше метильных групп, переключавших активность таких генов, как ИФР-2. Благодаря этой работе удалось подтвердить то, о чем долгое время только догадывались. Стрессовый фактор (в случае Голодной зимы это недоедание) переключает гены, подобные ИФР-2, эпигенетически, то есть не затрагивая саму нуклеотидную последовательность. Важно, что эти изменения в ДНК могут сохраняться на протяжении всей жизни.
До конца непонятно, почему Голодная зима повлияла столь вредным образом. Возможно, эти эпигенетические изменения просто «шрамы» на ДНК, как их называет сотрудник Лейденского университета Элин Слэгбум. Однако есть и интересная альтернативная идея, что в процессе эволюции такие изменения в эпигеноме появились как реакция на недоедание. Это похоже на своего рода программирование механизма выживания ребенка, который родился в мире голода. Другой соавтор исследования 2010 г. – Бас Хейманс предположил, что «эпигенетика может быть механизмом, который позволяет человеку быстро приспособиться к изменившимся обстоятельствам… Возможно, метаболизм детей Голодной зимы благодаря эпигенетическим изменениям перешел на более экономичный уровень»{103}.
Влияние питания родителей на их еще не родившихся детей иногда называют теорией Баркера – по имени британского ученого Дэвида Баркера, который впервые выдвинул ее в 1990 г. Согласно этой теории, если в пище отца много жиров и мало белков или если в пище матери мало калорий, то плод будет готовиться к жизни в условиях недоедания и сформируется так называемый экономный фенотип с метаболизмом, приспособленным для набора и поддержания оптимального веса. Поэтому жировая ткань новорожденных, или «детский жирок», будет развита сильнее у тех младенцев, чьи матери недоедали во время беременности. Аналогично, по теории Баркера, у людей (а также мышей), если отец плохо питается, у ребенка будет выше склонность к ожирению. С мышами были проведены научные эксперименты, в которых было показано, что, если самец получает пищу с низким содержанием белка, это приводит к ожирению у его потомков. Предполагается, что стресс, вызванный скудным питанием, вызывает эпигенетические изменения в сперматозоидах.
Эпигенетика нужна для нормального развития животных и растений. После оплодотворения первые, пока еще не дифференцированные клетки делятся, появляются новые клетки, каждая из которых получает полный набор генетической информации. Как из этой общей генетической информации одна из клеток может понять, какие белки производить, чтобы стать клеткой кожи, другая – клеткой печени, еще одна – клеткой мозга или крови или любой из сотен разных видов клеток с разными функциями? Иными словами, откуда новая клетка кожи «знает», какую часть генома ей надо прочитать, чтобы выполнять свою функцию, и какие фрагменты проигнорировать, потому что в них информация для нейронов или клеток крови?
Ответ заключается в действии метильных групп и некоторых других типов эпигенетических химических изменений, которые работают как переключатели, включая и выключая участки целого генома в каждой клетке. Этот процесс можно сравнить с выделением некоторых слов и предложений и зачеркиванием других в огромной энциклопедии.
Иначе говоря, само содержание генетической информации не меняется. Но эти «надгенетические» переключатели могут влиять на то, какая часть этой информации будет прочитана. В каждой клетке двойная спираль ДНК эффективно упакована. Она обмотана сложными петлями вокруг белковых структур гистонов, которые чем-то похожи на катушку для нитки. От того, насколько плотно или неплотно фрагмент нити обмотан вокруг гистонов, может зависеть, какие участки ДНК включены (экспрессируются), а какие выключены (блокированы). Процесс метилирования, когда к ДНК присоединяются метильные или более крупные ацетильные группы, позволяет дополнительно управлять экспрессией генов.
Учитывая, насколько важна эпигенетика для нормального развития и дифференцировки клеток, неудивительно, что нарушение этих процессов приводит к расстройствам и заболеваниям. И действительно, сейчас ученые пытаются разобраться, какую роль эпигенетика играет в формировании разных болезней, начиная от аутоиммунных, например волчанки, и заканчивая такими, как рак. Есть основания предполагать, что гены, которые могут в норме подавлять развитие рака, в некоторых опухолях выключены с помощью метилирования. Это очень перспективная тема для исследований. По такому признаку можно было бы определять некоторые опухоли на более ранних стадиях развития, например рак толстой кишки, и создавать надежные диагностические тесты для этих заболеваний.
Удивительно, но, как свидетельствуют новейшие исследования, эпигенетические изменения могут фактически передаваться по наследству следующим поколениям. Таким образом опровергается распространенное мнение, что наследственная информация может передаваться от родителей к детям только через последовательность нуклеотидов в ДНК.
Так, у эпидемиологов, изучающих голландскую Голодную зиму, есть «предварительные данные», что предрасположенность к плохому здоровью передается внукам тех женщин, которые столкнулись с недоеданием. Причем дети этих женщин сами никогда не попадали в условия голода.
Довольно сложно исследовать такие эффекты на людях. Мы живем гораздо дольше, и наше генетическое разнообразие выше, чем у лабораторных мух дрозофил и мышей. Кроме того, мы не желаем (по личным причинам, которые ученым не понять) на протяжении десятилетий участвовать в экспериментах, в которых кто-то контролирует, что мы едим, куда мы ходим и (особенно) с кем мы спариваемся.
Однако исследователи, работающие с лабораторными животными, наблюдали передачу такой информации по наследству. Например, у фруктовой мушки Drosophila melanogaster. В 2009 г. ученые из Швейцарской высшей технической школы Цюриха сообщили, что смогли изменить цвет глаз у мушки дрозофилы с помощью инкубации ее эмбрионов при необычно высокой температуре. Когда группа исследователей под руководством биолога Ренато Паро повышала температуру с 25 °C до 37 °C, потомки мух появлялись не с белыми глазами, как обычно, а с красными. Затем ученые скрещивали поколения красноглазых мух, но эмбрионы выращивались уже при нормальной температуре. Оказалось, что эффект сохранялся на протяжении как минимум шести поколений. Когда провели секвенирование ДНК у красноглазых потомков, выяснилось, что генетическая информация не изменилась, последовательность нуклеотидов была такая же, как и у исходных родителей с белыми глазами{104}.
Рассмотрим еще одну историю, на этот раз с геном агути у мышей. Если на этом гене нет особым образом расположенных метильных групп, то мышь, у которой в норме шерсть должна быть бурого цвета, рождается с желтоватым окрасом. Обычно такие мыши набирают лишний вес и более подвержены раковым опухолям. В различных экспериментах было показано, что если беременную самку с таким нарушением кормить пищей с высоким содержанием фолиевой кислоты, витамина B12 и холина (которые участвуют в метилировании ДНК и, по-видимому, обеспечивают эпигенетические изменения), то ее у потомков будет нормальный бурый мех и у них не появится ожирения. Когда они вырастут и размножатся, их потомство будет нормальным и с большим количеством метилированных участков ДНК{105}.
В 2013 г. в журнале Biological Psychiatry была опубликована статья про возможность передачи стресса из поколения в поколение. Исследователи из Хайфского университета в Израиле ранее показали, что если подвергнуть самок лабораторных крыс даже небольшому стрессовому воздействию, то это приведет к изменениям в поведении потомства. Воздействие заключалось в том, что крысам постоянно меняли температуру в клетке, где они жили, в то время как контрольную группу содержали в стабильных условиях. Эти эксперименты проводили с 45-дневными грызунами (для крыс это подростковый возраст).
Аспирантка Хиба Зайдан вместе с одним из авторов первого исследования, профессором Михой Лешемом, повторили этот эксперимент, обратив внимание на ген CRF-1, про который известно, что он экспрессируется в мозге при стрессе. Ученые обнаружили, что до спаривания этот ген был более активен в яйцеклетке стрессированных самок по сравнению с нестрессированными. Затем исследователи проверили ДНК в тканях мозга крысят сразу после рождения. Оказалось, что и в этом случае в стрессированной группе экспрессия CRF-1 была выше.
На третьем этапе, когда крысята выросли, ученые подвергли некоторых животных из каждой группы потомков тому же воздействию, которое было в первом эксперименте. В результате у самок (что удивительно, не у самцов), чьи матери были стрессированы, экспрессия CRF-1 была заметно выше. Авторы отмечают, что «если раньше мы видели проявление этого эффекта только на поведенческом уровне, то сейчас у нас появились доказательства влияния и на генетическом уровне», по меньшей мере у грызунов.
Указывая на «сходство организмов» грызунов и людей, ученые предполагают, что их исследование может отражать и то, что происходит с детьми, чьи матери подвергаются различным стрессовым воздействиям{106}.
Еще раньше, в 2012 г., Майкл Скиннер из Университета штата Вашингтон и Дэвид Крюс из Техасского университета в Остине опубликовали в журнале Proceedings of the National Academy of Sciences статью, в которой было показано, что воздействие на беременных крыс широко используемым фунгицидом винклозолином усиливает стресс-реакцию не только во втором поколении, но даже и в третьем.
И хотя Скиннер уже много лет изучает эпигенетическое воздействие загрязняющих веществ, пестицидов и других химикатов, он говорит, что «мы и подумать не могли, что стресс-реакция может зависеть от условий среды, в которой жили ваши предки».
Крюс добавляет, что «мы сейчас являемся этим третьим поколением людей, со времени начала химической революции, которые подвергаются воздействию химикатов», поэтому «эксперименты на животных как раз и моделируют эту ситуацию»{107}.
Хорошо известно, что продукты питания или химические вещества, с которыми сталкивается мать, могут повлиять на здоровье ребенка. Но сейчас происходит смена парадигмы. Предположительно, экологические и даже психологические условия, а также личный опыт родителей могут повлиять не только на их ребенка, но и на последующие поколения. Если это так, то нам надо думать не только о том, как среда, в которой мы живем, воздействует на нас, но и о том, как это повлияет на будущие поколения.
Глава 12 Эра геноцентризма
Олдред Скотт Уортин был талантливым, энергичным человеком, стремившимся к знаниям всю свою жизнь. В 1891 г. он получил медицинское образование, а уже в 1893-м защитил докторскую диссертацию. Это было неслыханное достижение для тех лет, и оно позволило Уортину попасть в узкий круг маститых ученых и мыслителей. Уортин стремился добиться профессионального успеха в амбициозной, энергичной и быстро развивающейся американской медицинской науке, которая пыталась конкурировать с европейской, и в 1894 г. стал руководителем лаборатории патологической анатомии в Медицинской школе Мичиганского университета.
Благодаря его тщательному подходу к осмотру и обследованию пациента в мировую медицину вошло понятие симптом Уортина. Это специфический скрипучий тон, который врач может услышать при прослушивании сердца и легких пациента с помощью стетоскопа{108}. Он указывает на перикардит – воспаление тканей, окружающих и защищающих сердце. Вместе с коллегой Уортин разработал гистологическую окраску, которую впоследствии назвали «окраской по Уортину – Старри», эту химическую реакцию до сих пор используют для выявления бактерий спирохет, которые вызывают сифилис{109}. Уортин – автор многих научных работ и нескольких выдающихся учебников по патологической анатомии. Его научные интересы простирались от венерических заболеваний до роли лимфоузлов в иммунной системе. Во время Первой мировой войны он был одним из основных советников правительства США по вопросам воздействия отравляющего горчичного газа, одного из первых видов химического оружия, которое использовали как страны Антанты, так и Союз центральных держав. Уортин и сэр Уильям Ослер из Университета Джонса Хопкинса считаются двумя величайшими медиками конца XIX – начала XX в.
Кроме того, Уортин был всестороннее образованным человеком. Он изучал естественные науки в Индианском университете, до того как поступил в Медицинскую школу в Мичигане. Но еще раньше он влюбился в музыку. Уортин окончил консерваторию в Цинциннати по классу фортепьяно и скрипки и гастролировал по Европе, исполняя музыку во Фрайбурге и Вене. Во время путешествия по Калифорнии, уже на закате своей медицинской карьеры, он описал новый вид улиток, который потом был назван его именем. Еще он был заядлым садовником и судил ботанические выставки в Детройте. Помимо огромного объема научных публикаций, Уортин написал несколько книг по философии, искусству и музыке.
В 1926 г. он писал о важности ежедневной физической нагрузки для врачей: «Даже если у доктора на почве сидячего образа жизни не разовьется варикоз, то, поскольку появление автомобилей снизило общую активность, у успешного врача появится лишний вес, некоторая дряблость, легкая синюшность и преждевременная лысина»{110}.
В медицинской школе Уортин был весьма требовательным и не самым либеральным преподавателем. Чтобы научить студентов определять шумы в сердце, он заставлял их запоминать звучание колоколов церквей в Анн-Арборе и университетских курантов. Однажды он заявил, что в распространении сифилиса виновата религиозная концепция прощения. Он был убежденным сторонником евгеники и призывал людей отказаться от традиционной религии и строить свою жизнь с верой в современную науку.
Уортин писал, что «человечеству нужна новая религия, если мы хотим спастись от дегенерации». На Третьей конференции по вопросам улучшения расы, проходившей в 1928 г. в городе Батл Крик (штата Мичиган), Уортин, выступавший за евгенические браки, поразил собравшихся комментарием, что «любовь – это эмоциональная чепуха». Он призывал молодых людей изучать семейный анамнез своих предполагаемых супругов и «без колебаний отвергать их, если не может быть доказано отсутствие наследственных заболеваний… Человечество не улучшит физическую форму и продолжительность жизни до тех пор, пока все браки не будут совершаться на основе евгеники»{111}.
Когда Уортин с женой (у них было два сына и две дочери) впервые приехали в Анн-Арбор, они поселились в каменном доме на Фердон-стрит, недалеко от больницы Мичиганского университета. Уортин нанял повара, горничную и еще нескольких человек, чтобы они помогали его жене управляться с домашним хозяйством, – так было принято в те времена, когда еще не существовало посудомоечных и стиральных машин. Для починки одежды семья Уортинов наняла швею Полину Гросс. Известно, что она была миловидной девушкой и умелой портнихой. Уортину нужна была соответствующая одежда, чтобы подобающе выглядеть во время своих лекций, медицинских встреч, игры в гольф и многих других мероприятий. Уортин оказался настолько активным и энергичным, что Полина с трудом успевала чинить его одежду. Ему это очень не нравилось.
Однажды после долгого дня, проведенного в больнице, Уортин высказал портнихе свое недовольство. Швея призналась, что ей мешает работать постоянное беспокойство.
Полина сказала: «Сейчас я здорова, но не сомневаюсь, что умру раньше срока из-за рака. Многие мои родственники больны, и большинство уже умерло».
Уортин, который был опытным патологоанатомом, вскрывшим трупы множества людей, умерших от разных раковых опухолей, задумался над ее словами. То, что рак или иные заболевания могут поражать целые семьи, медицина того времени только начинала понимать. И вместо того, чтобы развеять опасения Полины, любознательный врач захотел выяснить подробности.
Что это, просто депрессивные разговоры или жуткая история была реальной? Каким образом рак может передаваться по наследству внутри семьи? Он продолжал расспрашивать Полину, и выяснилось, что ее родственники умирали от разных видов рака: желудка, прямой кишки, «женских органов» и других{112}, которые неодинаково выглядят под микроскопом и вообще развиваются очень по-разному. Это казалось крайне странным.
Напомним, что разговор Уортина с Гросс состоялся всего лишь через 30 лет после того, как Грегор Мендель провел свои классические опыты с горохом и впервые показал генетические законы наследования. Еще не было доказано существование генов у таких простых существ, как мухи дрозофилы. Что касается медицинской практики, то оставалось 10 лет до того, как ученый и врач Арчибалд Гаррод впервые подробно опишет наследственное заболевание человека – метаболическое расстройство алкаптонурию, которая возникает при нарушении способности расщеплять аминокислоты фенилаланин и тирозин.
Полина Гросс рассказала Уортину, что она и вся ее семья до Гражданской войны жили в округе Уоштено. Уортин узнал имена умерших родственников и разыскал записи об их смерти. Кроме того, он связался с членами семьи Полины, чтобы получить и сравнить различные версии их истории. То же самое делают ученые в лаборатории, когда сталкиваются с потенциально важными, но неожиданными и неочевидными открытиями. Уортин провел много дней и ночей, работая над этой новой темой.
Уортин узнал, что дедушка Полины Гросс родился в 1796 г. в немецком городке Платтенхардт и приехал в США в 1831 г. Первопоселенец Г., как называл его Уортин, вырубал лес, возделывал поля и растил семью. Он умер от рака кишечника в возрасте 60 лет и оставил пятерых сыновей и пять дочерей. От рака умерли четыре сына и две дочери. У него было 70 внуков, из которых 33 умерли от рака, большинство в молодом возрасте. Его дети разнесли семейное дерево на два континента. Некоторые остались в своей родной Германии, другие в поисках новых возможностей и новых земель переехали на Средний Запад США. Со Среднего Запада несколько человек впоследствии отправились в Северную Калифорнию ловить удачу во времена золотой лихорадки.
В этой семье рак возникал не случайным образом, а только в определенных местах: в толстом кишечнике, желудке, матке и яичниках. Так впервые было описано заболевание, которое позже получило название «семейный раковый синдром». Однако на этом семейном дереве было две ветви без рака – потомки двух здоровых дочерей.
Уортин, заинтригованный и озадаченный своим новым открытием, попытался в больнице Мичиганского университета найти другие семьи с раком, поскольку в медицинской литературе почти ничего не было по этой теме. Вместе с коллегами он проанализировал медицинские карты пациентов хирургического отделения больницы, у которых диагностировали рак, с 1907 по 1909 г. Оказалось, что менее чем у 1 % раковых больных в медицинских записях значилось наличие рака и у других членов семьи. Тем не менее Уортин решительно продолжал поиски. Он писал письма пациентам и членам их семей и даже приходил к ним домой, чтобы лично услышать семейную историю. В ходе таких исследований выяснилось, что на самом деле более чем в 50 % случаев у пациентов с онкологией обнаруживались родственники с раком. Проводя беседы, Уортин пришел к выводу, что такое занижение числа больных родственников в медицинских записях не было случайным.
Уортин писал в своих заметках: «Многие испытывают некоторое омерзение или ужас по поводу множественных случаев новообразований в семейном анамнезе». Вначале Уортин считал, что рак в семье Г. наследуется по рецессивному принципу, поскольку у примерно четверти (23,6 %) членов семьи к 25 годам появлялись опухоли. Однако сейчас мы знаем, что это доминантное заболевание, хотя не у всех носителей этой мутации развивается рак.
К несчастью, сама Полина Гросс, которая боялась, что умрет от рака, позже действительно от него умерла. В то время не было никакого медицинского способа снизить вероятность ее смерти. Работа Уортина с семьей Гросс продолжалась почти 20 лет. В течение этого времени он использовал строгий научный подход и собирал достоверную информацию, чтобы сформулировать новую для того времени и заставляющую серьезно задуматься концепцию, что рак у человека может быть наследственным заболеванием. Научное исследование Уортина было опубликовано под названием «Наследственность в отношении раковой опухоли: Что показал разбор клинических случаев в лаборатории патологии в Мичиганском университете» в 1913 г., в журнале Archives of Internal Medicine{113}.
Однако это важнейшее исследование получило достойное признание только через десятилетия. Возможно, потому, что идея о наследуемости рака была в то время очень далека от основного направления медицинской мысли. Мало кто обратил внимание и на работу интеллектуального наследника Уортина Карла Уэллера, который продолжил исследования.
Возможно, Уортин начал пропагандировать использование евгеники в здравоохранении, чтобы снизить заболеваемость раком, именно после исследований «семьи Г.» – так он называл Гроссов{114}.
В 1960-х гг., когда в американском обществе сложились иные медицинские взгляды, работы Уортина и Уэллера продолжил молодой и энергичный Гарри Линч (упомянутый в седьмой главе). Линч жил и работал в городе Омаха, штат Небраска.
Иногда, наблюдая несколько поколений одной и той же семьи на традиционных ранчо и фермах, Линч видел, что у нескольких членов семьи возникал одинаковый набор злокачественных новообразований: опухоли груди и яичника, толстого кишечника, матки и поджелудочной железы, меланома. Ему пришлось изрядно покопаться на полках с медицинской литературой, чтобы найти и прочитать оригинальную статью Уортина 1913 г., опубликованную в журнале Annals of Internal Medicine. Линч отметил поразительное сходство между семьей Г. и своими пациентами. В 1965 г. он выступил с докладом перед Американской академией врачей и даже встретился с внуком Уортина, который работал врачом в Бостоне.
Как и Уортин, Линч опередил свое время. К середине XX в. наука полностью прониклась идеей, что рак вызывают факторы окружающей среды, такие как загрязняющие вещества, яды, радиация и т. д. И действительно, их воздействия часто запускают развитие разных видов опухолей (например, солнечная радиация вызывает рак кожи). Однако то, что рак – болезнь ДНК и все эти воздействия окружающей среды приводят к опухолям потому, что повреждают ДНК, ученые в 1960-х гг. еще не знали. И они не могли понять, что мутации ДНК, которые передаются из поколения в поколение, могут также быть причиной рака.
Линч вспоминает: «Мне никто не верил. Я всячески пытался, но так и не смог получить грант на исследование семейных форм рака».
Он рассказал, как подавал заявку на грант одного из Национальных институтов здравоохранения, чтобы изучать семьи с наследственным синдромом рака молочной железы и яичников. Сейчас известно, что этот синдром вызывается мутациями в знаменитых генах BRCA1 и BRCA2, а также в нескольких других. В то время в большинстве случаев, чтобы получить федеральное финансирование по такому проекту, несколько рецензентов должны были лично приехать и побеседовать с соискателем, а потом дать положительное заключение.
Экологическая эпидемиология – наука о том, как факторы окружающей среды влияют на риск возникновения заболевания, например, как табачный дым или воздействие асбеста могут повысить вероятность развития рака легких. Национальные институты направили в лабораторию Линча в Омахе экспертную комиссию из трех выдающихся ученых эпидемиологов.
Линч подготовил презентацию, демонстрирующую предварительные данные, на основе которых была подана заявка. Он рассказывает: «Пока я показывал эту презентацию, я заметил, как один из приглашенных экспертов эпидемиологов с досадой поглядывает на часы. Затем на середине моего доклада он встал и, пока я говорил, вышел и обратился к моей помощнице с просьбой поменять авиабилет на более ранний рейс из Омахи. Он сказал ей, а потом и мне, что уже достаточно услышал, чтобы понять, что я ничего не смыслю в эпидемиологии!»
Во время визита комиссии по поводу другого гранта Линч рассказывал про свое исследование семей с заболеванием, которое позднее было названо FAMM-синдром (наследственная злокачественная меланома и рак поджелудочной железы; сейчас известно, что они вызываются мутацией в гене CDKN2A).
«Эти эксперты были хотя бы достаточно вежливы, чтобы дождаться конца моего доклада», – рассказывал Линч. После того как комиссия пообедала и закончила осмотр лаборатории, подавшей заявку на грант, Линч сам отвез экспертов в аэропорт.
Он описывает, как перед выходом из машины один из экспертов, известный специалист по эпидемиологии рака, покачал головой и, словно извиняясь, вздохнул: «Вы знаете, эти родственники со множеством разных форм рака просто совпадение. Что бы вы ни говорили, я не верю в рак, поражающий семьи».
Затем он предложил Линчу подумать о том, чтобы переделать программу исследования и сосредоточиться на тех загрязнениях окружающей среды, с которыми сталкивались эти пациенты, или на пище, которую они ели.
В книге «Структура научных революций»[23] историк науки Томас Кун описал, как ученые и общество смотрят на мир сквозь призму господствующей парадигмы. Классическим примером того, с каким трудом происходит отказ от ошибочной парадигмы, может служить история Коперника и Галилея, которые представили доказательства вращения Земли вокруг Солнца в те времена, когда господствовала уверенность в том, что Солнце (как и все планеты и звезды) вращается вокруг Земли. После научной революции Галилея звезды продолжали двигаться по ночному небу точно так же, как и раньше. Их траектории, нацарапанные еще на папирусе, оставались все теми же. Но сменилась парадигма, и Земля и человек уже не находятся в центре Вселенной. Существующие наблюдения о движении небесных тел были переосмыслены в контексте новой, более точной версии устройства мироздания.
Сегодня биология и медицина находятся на пике геномной революции, которая должна поменять нашу систему взглядов на болезни и причины их возникновения. Если посмотреть в прошлое, на времена Уортина и Линча, сквозь призму нашей нынешней парадигмы, кажется очень глупым, что их современники участвовали в коллективном психозе и не приняли сразу же идею, что генетические механизмы, изученные на дрозофилах и других животных, могут объяснить появление некоторых наследственных заболеваний.
Однако современные люди (в том числе ученые, врачи и, не побоюсь признаться, специалисты-генетики) не так сильно отличаются от предыдущих поколений или даже от современников Птолемея, живших около 2000 лет назад. И несмотря на наш гигантский технологический прогресс и обширные научные знания об устройстве Вселенной, в психологическом отношении нам все так же свойственно стадное мышление. Стадное мышление очень широко распространено. Оно проявляется, когда наши предположения о мире слишком быстро подкрепляются окружающими людьми, которые принимают идею за неопровержимую истину и невосприимчивы к сомнению и скепсису. Мы в свою очередь также укрепляем веру окружающих нас людей.
Даже я, глубоко погруженный в генетику и влюбленный в нее, вижу достаточно свидетельств того, что сегодня маятник далеко качнулся и мы слишком верим в то, что генетика и секвенирование ДНК могут решить все наши медицинские проблемы.
Я вспоминаю одного пациента по имени Джул, который работал фельдшером. Было известно, что у него редкий генетический синдром, который мог приводить к порфирии. Это ряд заболеваний, при которых происходит накопление соединений, называемых порфиринами. Вообще-то порфирины очень важные вещества, необходимые для синтеза гемоглобина, который переносит кислород от легких к клеткам всего тела. Однако, когда из-за порфирии их становится слишком много, у пациента возникают различные неприятные симптомы – от болевых ощущений и до повреждения нервной системы – и даже может случиться паралич. Причем у людей с такими генетическими особенностями симптомы появляются не всегда. Порфирия встречается примерно у одного человека из 8000.
Джул рассказал, зачем он записался ко мне на прием. Он хотел секвенировать свой геном, потому что думал, что у него есть еще одно редкое генетическое заболевание, которое вызывало появление «кофейных» пятен (темных, неправильной формы родинок) на теле. Джул сказал, что искал в интернете, что значат его симптомы. Он пришел ко мне, потому что по результатам поиска в сети решил, что у него генетическая болезнь нейрофиброматоз I типа (вызывается мутацией в гене белка нейрофибромина). Это заболевание встречается у одного человека из 3000–4000.
Но на этом Джул не остановился. Он поведал мне, что у него есть и третья наследственная болезнь, хотя о ней нет записей в его медицинской карте. Это гемохроматоз, одно из более распространенных рецессивных заболеваний, оно встречается у одного из 200 человек. При ней организм поглощает слишком много железа из пищи.
Он пришел к выводу, что его генетическая триада представляет собой новый метаболический синдром, это объяснило бы приступы боли в области живота, из-за которых он раз в несколько месяцев попадал в отделение неотложной помощи{115}.
Эта история показалась мне невероятной! Три редких генетических заболевания с менделевским типом наследования у одного пациента? Это так же невозможно, как получить три удара молнией за один день. При быстром поиске медицинской литературы по базе Medline не нашлось абсолютно никакого упоминания случаев такого тройного заболевания. В моей голове пронеслись мысли, что у этого человека, возможно, есть ранее не описанный синдром, связанный с геном-мутатором[24], из-за которого возникает много генетических заболеваний в одном организме. Не обнаружил ли я совершенно новый синдром? Это меня взволновало! Джул мог быть первым пациентом с синдромом Липкина! На секунду я представил этот замечательный новый синдром, названный в мою честь.
Однако я начал что-то подозревать, когда спросил Джула, могу ли я для более точного представления о болезнях, с которыми придется иметь дело, получить данные лабораторных анализов, которые были в отделениях скорой помощи в других больницах, куда он обращался во время приступов боли. Полный энтузиазма вначале, как только речь зашла о передаче медицинских записей из других больниц, Джул заколебался. Это было странно, поскольку он был настроен на сотрудничество, когда речь шла об его анамнезе и предполагаемых болезнях.
С нарастающим сомнением я внимательно осмотрел его темные родимые пятна неправильной формы и затем серьезно спросил: «Бывает ли, что центры пятен синеют, а остальная часть становится розовой?»
«Да, – сказал он, расширив глаза. – Именно так они и делают!»
Ну уж нет, такого не бывает. Это была моя маленькая хитрость. Центры кофейных пятен не становятся синими, а их края розовыми ни при каких генетических или негенетических заболеваниях. И хотя у Джула действительно была порфирия, про все остальные заболевания он говорил неправду.
Старая врачебная поговорка гласит, что «обычные события случаются чаще». Так, если вы врач, вы с большей вероятностью обнаружите необычный вариант известного заболевания, чем совершенно новую болезнь. И тут я внезапно понял, чем на самом деле страдал Джул. По всей видимости, кроме первого редкого генетического расстройства у него было и другое, о котором часто пишут врачи и психологи, – синдром Мюнхгаузена.
Это психическое расстройство названо в честь немецкого барона фон Мюнхгаузена, жившего в XVIII в., который был известен преувеличенными экстравагантными рассказами о своих армейских подвигах. Пациенты с таким синдромом (для которого пока не найдено генетической причины) верят, что они тяжело больны, хотя на самом деле это не так. Считается, что отчасти это может возникать из-за желания привлечь к себе внимание.
Я полагаю, что Джул был под впечатлением от первого генетического диагноза и добивался дополнительных анализов, потому что ему казалось, что, если он больше узнает о своих генах, это поможет решить все проблемы со здоровьем независимо от того, генетические они или нет. Разумеется, не имея серьезных оснований для секвенирования генома этого человека, я не захотел этого делать, опасаясь, что тогда он начнет еще сильнее привлекать к себе внимание.
Я вспоминаю и другую пациентку, назовем ее Анжела. Она была в хорошей спортивной форме, очень умной и работала успешным управленцем. К 30 годам у нее не было каких-либо текущих проблем со здоровьем и ничего примечательного в личном анамнезе. Однако, когда я поинтересовался здоровьем родственников, она рассказала, что у ее дяди в 40 лет случился инсульт. Дяде сделали секвенирование экзома в рамках исследовательской работы в лаборатории, сотрудники которой были очень воодушевлены тем, как сильно может помочь генетика в диагностике ранее не выявленных заболеваний. Однако, возможно, они были не очень опытны, чтобы понять, является ли обнаруженная генетическая вариация неопасным полиморфизмом или мутацией, вызывающей заболевание. В результате секвенирования экзома причины инсульта у дяди найдены не были, но обнаружилось два независимых варианта с неизвестным клиническим значением в генах, которые ранее связывали с врожденными аномалиями развития сердца ребенка (не имеющими отношения к риску инсульта), хотя ни у кого из членов семьи этого заболевания не встречалось. Кроме того, у дяди нашли четыре вариации, также неясного значения, в генах, про которые хорошо известно, что они связаны с раком (три – с наследственным раком молочной железы и один – с наследственным раком ободочной и прямой кишки), хотя опять же ни у кого из родственников не было этих форм рака. Анжела, здоровая трудолюбивая женщина, поглощенная своей карьерой и семьей, пришла ко мне расстроенная и обеспокоенная, как будто у нее внезапно обнаружили повышенный риск развития сердечно-сосудистого заболевания или множественных форм рака, которые она может передать детям. После того как я осмотрел ее, ознакомился с медицинской картой и отправил Анжелу на генетическое тестирование и последующий анализ в более опытную лабораторию молекулярной диагностики, стало ясно, что Анжеле не грозят все эти заболевания. Однако надо быть готовым, что такая гипердиагностика легко может превратить некогда счастливую, здоровую женщину в человека, который считает себя больным и беспричинно тревожится за свое будущее.
Мой коллега, онколог из больницы Мичиганского университета, однажды рассказал мне другой случай излишнего увлечения генетикой, который там произошел. Молодая женщина 20 лет, глухая, с задержкой развития, содержащаяся в специальном интернате, была переведена в больницу из-за необычных конвульсий. Ее зафиксировали на медицинской каталке из опасения, что она может себя повредить. Неспособная говорить и понимать вопросы врачей, всклокоченная пациентка медленно извивалась. В неровном ритме она двигалась туда-сюда по каталке, ее голова поворачивалась из стороны в сторону, ноги двигались вверх-вниз по простыне так, как если бы она лежа пыталась ходить. Лабораторные анализы и осмотр не помогли объяснить ее загадочное состояние. Лечащий врач предположил, что имеет дело с атипичным эпилептическим припадком и отправил ее на консультацию к неврологу. Тот осмотрел пациентку, но не обнаружил ничего особенного. Затем сделал ей электроэнцефалограмму, но не увидел там судорожной активности.
Поистине, эта пациентка была черным ящиком без ключа. Один из озадаченных врачей предположил, что у нее может быть какой-то редкий генетический синдром, поэтому обратились в отделение клинической генетики, чтобы врачи отделения решили, могут ли поставить диагноз. Очень известный и уважаемый медицинский генетик (он попросил, чтобы его фамилию не называли, поскольку хочет избежать излишнего внимания и спокойно заниматься своей работой) ознакомился с картой пациентки и поговорил с другими врачами. Он подошел к ее кровати и сел рядом, просто наблюдая за извивающейся пациенткой. Затем встал, подошел к сестринскому посту и попросил пинцет и баночку. Одна из медицинских сестер, немного удивленная, пошла искать пинцет в хирургическом наборе. Вернувшись, она отдала инструменты генетику, который отправился обратно в палату пациентки. Все окружающие были озадачены. Через несколько минут он вышел с баночкой в руке и сел к микроскопу. Он быстро приготовил препарат и под микроскопом увидел клеща Sarcoptes scabiei, который обычно называется чесоточным. Эти паразиты передаются от человека человеку или через грязное постельное белье и одежду. Известно, что у людей, содержащихся в медицинских учреждениях, повышен риск заразится этими клещами, которые могут проникнуть в кожу хозяина и вызвать сильный аллергический зуд, часто на запястьях и лодыжках.
Обычные события случаются чаще, и среди лошадей нет единорога. У пациентки не было редкого генетического синдрома, объясняющего задержку развития, глухоту и припадок. Она содержалась в лечебном заведении, и у нее просто была чесотка. Возможно, у нее есть какое-то генетическое заболевание, вызывающее задержку развития, но оно не имеет отношения к данному случаю. Генетические причины нельзя рассматривать в отрыве от условий среды, и не из-за особенностей генетики пациентка попала в отделение скорой помощи.
В начале XX в. и позже, в 1960-х гг., много компетентных врачей и ученых были психологически не способны оторваться от общепринятых в то время взглядов и увидеть доказательства (однозначные, как мы сейчас понимаем) важности генетики для медицины, те доказательства, про которые писали такие первопроходцы, как Уортин и Линч.
Прошло время. Теперь мы наблюдаем, как СМИ привлекают огромное внимание к отдельным генам, которые, предположительно, объясняют индивидуальные особенности, не имеющие ясного типа наследования, от гомосексуальности до леворукости и даже преступного поведения. По-видимому, именно из-за такого натиска СМИ много умных, образованных людей приходят ко мне в качестве пациентов, поскольку, ничуть не сомневаясь, уже составили у себя в уме равенство: гены = судьба. Для некоторых генетика стала стандартным и иногда фаталистичным объяснением их медицинских и даже жизненных проблем, они не понимают, что во многом их судьба зависит от того, какой образ жизни они сами выбирают, и придумывают рациональные объяснения тому выбору, о котором им пришлось пожалеть.
Не раз случалось так, что ко мне приходили пациенты и буквально умоляли отсеквенировать их геном еще до того, как рассказывали о том, что их беспокоит в первую очередь. Возможно, из-за того, что американцы часто верят, что технологии могут решить все их проблемы, мне приходится тратить много времени и усилий, чтобы объяснить, что последовательность генома не может рассказать все, что они хотят знать о своей медицинской доле и будущем их потомков. В таких случаях, как мне кажется, вера в генетику в какой-то степени заменила веру в астрологию как в инструмент для предсказания будущего. Очевидно, надо придерживаться более сбалансированного взгляда, признающего важность генетики для индивидуального подхода здравоохранения к пациентам и в то же время не допускающего редукционистскую ошибку, что генетика – это панацея для медицины, позволяющая точно предсказать будущее и решить все семейные проблемы с диагнозом и лечением. Этот вопрос может стоять очень остро из-за того, что стоимость медицинского обслуживания при гипердиагностике может расти бесконтрольно, что приводит к социальной несправедливости при использовании некоторых очень дорогостоящих методов генетической медицины.
И последнее напоминание для пациентов: цель генетической медицины в том, чтобы более точно определить риск заболевания. Она всегда имеет дело только с вероятностью, но не с уверенностью. Даже когда речь идет о редких случаях генетических заболеваний с высокой пенетрантностью (заболевание проявится с вероятностью 99 %, если у вас есть соответствующая мутация, как при болезни Хантингтона), если врач или профессиональный генетик говорит вам, что точно знает, что произойдет дальше, – найдите другого врача!
Сноски
1
Здесь: «в цифровом виде». – Прим. пер.
(обратно)2
XX/XY – женский и мужской набор половых хромосом. – Прим. пер.
(обратно)3
Резуховидка (Arabidopsis) – растение семейства капустные. Один из основных объектов исследования в молекулярной биологии. – Прим. пер.
(обратно)4
На сегодняшний день термин в значительной степени устарел и в основном используется понятие «генетический вариант» с уточнением патогенности (то есть вредности). – Прим. науч. ред.
(обратно)5
Fin de siècle (фр.) – «конец века», период конца XIX – начала XX в. – Прим. пер.
(обратно)6
В число которых входит и всем известный гормон адреналин. – Прим. ред.
(обратно)7
От англ. bad – «плохо». – Прим. пер.
(обратно)8
Имеется в виду, конечно, преимплантационное тестирование. – Прим. науч. ред.
(обратно)9
В настоящее время точность ПГТ выше на порядок, если не на два. Использование комбинации прямой и косвенной диагностики в ПГТ практически исключает риск ошибки. – Прим. науч. ред.
(обратно)10
Такая практика существует в США, но в целом в мире скорее осуждается. Сейчас все сообщества репродуктологов призывают переходить на перенос эмбрионов только по одному. – Прим. науч. ред.
(обратно)11
При гонорарном способе оплачивается каждая отдельная услуга. – Прим. пер.
(обратно)12
Пенетрантность – вероятность фенотипического проявления аллеля. – Прим. пер.
(обратно)13
По состоянию на 2017 г. в США компании 23andMe разрешено проводить анализы для оценки генетического риска для 10 заболеваний. – Прим. пер.
(обратно)14
Справедливо для США. В России на 2017 г. это заболевание не входит в обязательный неонатальный скрининг. – Прим. науч. ред.
(обратно)15
Цитируется по новому русскому переводу Библии. – Прим. пер.
(обратно)16
Речь идет о двух основных политических партиях в США: Демократической и Республиканской. – Прим. пер.
(обратно)17
Гальтон Ф. Наследственность таланта. – М.: Мысль, 1996.
(обратно)18
Справедливости ради заметим, что при гетерозиготном носительстве ААТ (не всех аллелей) риск хронической обструктивной болезни легких тоже повышен. Не настолько сильно, как у гомозигот, но тем не менее. Для страховой компании – вполне законное основание для беспокойства. Особенно сильно у гетерозигот риск этого заболевания повышается при курении. – Прим. науч. ред.
(обратно)19
Medicaid и Medicare – государственные программы США по медицинскому страхованию малоимущих и пожилых людей соответственно. – Прим. пер.
(обратно)20
Джейсон Мраз – американский певец, Патрик Суэйзи – американский актер. – Прим. пер.
(обратно)21
В нашей стране, согласно законам РФ, суррогатная мать не может одновременно быть и донором яйцеклетки. – Прим. пер.
(обратно)22
Эту гипотезу нельзя считать подтвержденной. – Прим. науч. ред.
(обратно)23
Кун Т. Структура научных революций. – М.: АСТ, 2003.
(обратно)24
Мутатор – ген, повышающий вероятность мутации в других генах. – Прим. пер.
(обратно)(обратно)Комментарии
1
Болезнь Гоше подразделяется на три основных типа. Болезнь Гоше 1-го типа проявляется в основном в костной ткани, печени, селезенке, легких и кровяных клетках. Типы 2 и 3 влияют на работу мозга. Здесь я рассказываю о 1-м типе болезни Гоше, который встречается чаще других.
(обратно)2
Когда сотрудник страховой компании говорил, что диагностика синдрома Германски – Пудлака никак не повлияет на методы лечения Наполеона, он был не прав. Для этого заболевания пока не существует ферментозаместительной терапии, как при болезни Гоше, но поставленный диагноз помог бы заметить ранние симптомы начавшегося внутреннего кровотечения и другие проявления болезни и сохранить здоровье Наполеона.
(обратно)3
В «Законе об орфанных препаратах» редким заболеванием считается то, от которого в США страдают меньше 200 000 человек.
(обратно)4
D. W. Haslam and W. P. James, “Obesity,” Lancet 366, no. 9492 (2005): 1197–209.
(обратно)5
W. Yang, T. Kelly, and J. He, “Genetic Epidemiology of Obesity,” Epidemiology Review 29 (2007): 49–61.
(обратно)6
По некоторым сведениям, это становится все более популярным среди одиноких женщин в Нью-Йорке.
(обратно)7
Robert C. Green et al., “Disclosure of APOE Genotype for Risk of Alzheimer’s Disease,” New England Journal of Medicine 361 (July 16, 2009): 245–54.
(обратно)8
Dena Davis, “Alzheimer Disease and Pre-Emptive Suicide,” Journal of Medical Ethics 40 (2014): 550–51, doi:10.1136/medethics-2013-101615, .
(обратно)9
“Scientists Isolate ‘Crown Jewel’ – Huntington’s Disease Gene,” press release, National Institute of Neurological Disorders and Stroke, March 23, 1993,
(обратно)10
US Huntington’s Disease Genetic Testing Group, Genetic Testing for Huntington’s Disease: Its Relevance and Imppcations, revised (New York: Huntington’s Disease Society of America, 2003), -content/uploads/2015/03/GeneticTesting-for-HD.pdf
(обратно)11
Simon C. Warby et al., “Huntington Disease,” Gene Reviews (last update December 11, 2014), /
(обратно)12
Margaret R. McLean, “When What We Know Outstrips What We Can Do,” Issues in Ethics 9, no. 2 (Spring 1998), Mark Kula Center for Appped Ethics, Santa Clara University,
(обратно)13
Эти реакции обеспечиваются вегетативной нервной системой.
(обратно)14
Edine W. Tiemersma et al., “Natural History of Tuberculosis: Duration and Fatapty of Untreated Pulmonary Tuberculosis in HIV Negative Patients: A Systematic Review,” PLOS One 6, no. 4 (2001): e17601, /
(обратно)15
“Breeding Out Disease,” transcript, CBS News, October 26, 2014, -out-disease-with-reproductive-genetics/
(обратно)16
David Baltimore et al., “A Prudent Path Forward for Genomic Engineering and Germpne Gene Modification,” Science 348, no. 6230 (March 19, 2015): 36–38, doi:10.1126/science.aab1028.
(обратно)17
Shailaja Gada Saxena and Dhananjaya Saranath, “Single-Cell Polymerase Chain Reaction-Based Pre-Implantation Genetic Diagnosis Using Fragment Analysis for B-Thalassemia in an Indian Couple with B-Globin Gene Mutations,” Journal of Human Reproductive Sciences 5, no. 3 (September – December 2012): 289–92, PMC3604838.
(обратно)18
Ethics Committee of the American Society for Reproductive Medicine, “Use of Preimplantation Genetic Diagnosis for Serious Adult Onset Conditions: A Committee Opinion,” Fertipty and Steripty 100, no. 1 (July 2013): 54–57, -content/news-and-pubpcations/ethics-committee-opinions/use_of_preimplantation_genetic_diagnosis_for_serious_adult-onset_conditions-pdfmembers.pdf .
(обратно)19
Там же.
(обратно)20
American Academy of Pediatrics, “Ethical and Popcy Issues in Genetic Testing and Screening of Children,” Pediatrics 131, no. 3 (March 2013), .
(обратно)21
K. Sermon, “Preimplantation Genetic Diagnosis for Huntington’s Disease with Exclusion Testing,” European Journal of Human Genetics 10, no. 10 (2002): 591–98.
(обратно)22
S. Baruch, “Preimplantation Genetic Diagnosis and Parental Preferences: Beyond Deadly Disease,” Houston Journal of Health Law & Popcy 8 (2008): 245–70.
(обратно)23
11. N. Lewis, “Papyrus Oxyrhynchus 744,” in pfe in Egypt Under Roman Rule (orig. 1983; Oxford, UK: Clarendon Press, 1985), 54.
(обратно)24
Catrina Banks Whitley and Kyra Kramer, “A New Explanation for the Reproductive Woes and Midpfe Decpne of Henry VIII,” Historical Journal 53, no. 4 (2010): 827.
(обратно)25
W. Dondorp et al., “ESHRE Task Force on Ethics and Law 20: Sex Selection for Non-Medical Reasons,” Human Reproduction 28 (2013): 1448.
(обратно)26
Ethics Committee of the American Society for Reproductive Medicine, “Use of Preimplantation Genetic Diagnosis for Serious Adult Onset Conditions.”
(обратно)27
“Select the Gender of Your Next Baby,” Fertipty Institutes, -docs.com/programs-and-services/gender-selection/select-the-gender-of-your-baby-using-pgd.php , accessed October 14, 2015.
(обратно)28
Emily Bazelon, “New Study Exposes Sex-Selective Abortion Bans for What They Are: Just Another Way to Restrict Abortion,” Slate, June 3, 2014,
(обратно)29
K. Madan, “Impact of Prenatal Technologies on the Sex Ratio in India,” Genetics in Medicine (June 2014): 425–32.
(обратно)30
Там же.
(обратно)31
Там же.
(обратно)32
Там же.
(обратно)33
Там же.
(обратно)34
Gallup News Service, “Family Values Differ Sharply Around the World,” November 7, 1997, -values-differ-sharply-around-world.aspx .
(обратно)35
“National Health Expenditures 2013 Highpghts,” Centers for Medicare & Medicaid Services, -Statistics-Data-and-Systems/Statistics-Trends-and-Reports/NationalHealthExpendData/downloads/highpghts.pdf
(обратно)36
European Commission, Polycycpc Aromatic Hydrocarbons – Occurrence in Foods, Dietary Exposure and Health Effects (Brussels: European Commission Scientific Committee on Food, December 4, 2002), -com_scf_out154_en.pdf
(обратно)37
K. O. Honikel, “The Use and Control of Nitrate and Nitrite for the Processing of Meat Products,” Meat Science 78, nos. 1–2 (January 2008): 68–76, doi:10.1016/j.meatsci.2007.05.030. см. также Food Safety and Inspection Service, Processing Inspectors’ Calculations Handbook, revised ed. (Washington, DC: US Department of Agriculture, 1995), -137e-4da3-905b-fa240974a5a9/7620-3.pdf?MOD=AJPERES.
(обратно)38
International Agency for Research on Cancer, World Health Organization, “IARC Monographs Evaluate Consumption of Red Meat and Processed Meat,” press release, October 26, 2015, -centre/pr/2015/pdfs/pr240_E.pdf
(обратно)39
Cathy C. Laurie et al. “Detectable Clonal Mosaicism from Birth to Old Age and Its Relationship to Cancer,” Nature Genetics 44, no. 6 (2012): 642–50.
(обратно)40
PubMed находится по адресу: .
(обратно)41
D. M. Eddy, “Practice Popcies: Guidepnes for Methods,” JAMA 263, no. 13 (1990): 1839–41, doi:10.1001/jama.263.13.1839, PMID 2313855.
(обратно)42
Stephen S. Raab et al., “The ‘Big Dog’ Effect: Variabipty Assessing the Causes of Error in Diagnoses of Patients with Lung Cancer,” Journal of Cpnical Oncology 24, no. 18 (June 20, 2006): 2808–14.
(обратно)43
Robert Bazell, HER-2: The Making of Herceptin, a Revolutionary Treatment for Breast Cancer (New York: Random House, 1998).
(обратно)44
Очень полезный сайт, посвященный поиску клинических исследований для разных генетических заболеваний и мутаций, в том числе и рака: /
(обратно)45
Massimo Calabresi, “Is Osama bin Laden Dying… Again?” Time, June 30, 2008, /0,8599,1819280,00.html .
(обратно)46
D. Viljoen, “Congenital Contractural Arachnodactyly (Beals Syndrome),” Journal of Medical Genetics 31, no. 8 (1994): 640–43, PMC 1050028.
(обратно)47
Некоторые типы соединительной ткани играют важную роль в предотвращении пролиферации и распространения раковых клеток. Поэтому реакции с участием трансформирующего ростового фактора бета первоначально были описаны в этом контексте и лишь потом выяснилось, что они участвуют и в развитии синдрома Лойса – Дитца, синдрома Марфана и других заболеваний соединительной ткани.
(обратно)48
Полное название гена – «Матери против гомолога декапентаплегии 3», SMAD3 – это аббревиатура. Как и многие другие гены, в том числе описанный выше трансформирующий ростовой фактор бета, SMAD3 получил такое яркое название не благодаря своей биологической роли, а по историческим причинам, связанным с его первоначальным открытием и традициями генетических исследований на фруктовой мушке дрозофиле.
(обратно)49
American College of Medical Genetics and Genomics, “Points to Consider in the Cpnical Apppcation of Genomic Sequencing,” popcy statement, May 15, 2012, .
(обратно)50
Robert C. Green et al., “ACMG Recommendations for Reporting of Incidental Findings in Cpnical Exome and Genome Sequencing,” Genetic Medicine 15, no. 7 (July 2013): 565–74.
(обратно)51
Wilson Disease,” National Institute of Diabetes and Digestive and Kidney Diseases, last updated July 23, 2014, -information/health-topics/digestive-diseases/wilson-disease/Pages/facts.aspx#sec6 .
(обратно)52
Erika Check, “Scientists to Sequence Genomes of Hundreds of Newborns,” Newsblog (Nature blog), September 4, 2013, -to-sequence-hundreds-of-newborns-genomes.html .
(обратно)53
Christine Rosen, “Eugenics – Sacred and Profane,” New Atlantis 2 (Summer 2003): 79–89.
(обратно)54
Анонимное письмо от 86-летнего носителя мутации Тея – Сакса. Anonymous, “Tay-Sachs Test,” Jewish Chronicle, September 28, 2012.
(обратно)55
By Gina Kolata, October 3, 2012.
(обратно)56
Эта фраза была использована на эмблеме Второго Международного евгенического конгресса в 1921 г. Смотрите статью про евгенику по ссылке: .
(обратно)57
Письмо Теодора Рузвельта Чарльзу Давенпорту 3 января 1913 г. -has-no-business-to-permit.html .
(обратно)58
Joshua A. Krisch, “When Racism Was a Science: ‘Haunted Files: The Eugenics Record Office’ Recreates a Dark Time in a Laboratory’s Past,” New York Times, October 13, 2014, -files-the-eugenics-record-office-recreates-a-dark-time-in-a-laboratorys-past.html?_r=0 .
(обратно)59
Victoria Brignell, “The Eugenics Movement Britain Wants to Forget,” New Statesman, December 9, 2010, -eugenics-disabled .
(обратно)60
Lutz Kaelber, “Virginia,” Eugenics: Compulsory Steripzation in 50 American States, /~lkaelber/eugenics/VA/VA.html accessed October 14, 2015.
(обратно)61
Цитаты Холмса: -generations-of-imbeciles-are-enough/
(обратно)62
United States Holocaust Memorial Museum, “Final Solutions: Murderous Racial Hygiene, 1939–1945,” Holocaust Encyclopedia, , accessed April 5, 2015.
(обратно)63
Daniel Kevles, In the Name of Eugenics: Genetics and the Uses of Human Heredity (New York: Knopf, 1985).
(обратно)64
Deborah Josefson, “Oregon’s Governor Apologises for Forced Steripsations,” British Medical Journal 325, no. 7377 (December 14, 2002): 1380,
(обратно)65
Peter Irons, “Forced Steripzation: A Stain on Capfornia,” Los Angeles Times, February 16, 2003, -irons16 .
(обратно)66
Josefson, “Oregon’s Governor Apologises for Forced Steripsations.”
(обратно)67
Kevles, In the Name of Eugenics; Bill Sizemore, “Virginia to Compensate Victims of Forced Steripzations,” Associated Press, February 26, 2015, -compensate-victims-forced-steripzations .
(обратно)68
Sizemore, “Virginia to Compensate Victims of Forced Steripzations.”
(обратно)69
Cahal Milmo, “Fury at DNA Pioneer’s Theory: Africans Are Less Intelpgent Than Westerners,” Independent, October 17, 2007, -at-dna-pioneers-theory-africans-are-less-intelpgent-than-westerners-394898.html .
(обратно)70
“International Declaration on Human Genetic Data,” UNESCO, October 16, 2003, -URL_ID=17720&URL_DO=DO_TOPIC&URL_SECTION=201.html
(обратно)71
M. A. Hall and S. S. Rich, “Patients’ Fear of Genetic Discrimination by Health Insurers: The Impact of Legal Protections,” Genetics in Medicine 2, no. 4 (July – August 2000): 214–21, .
(обратно)72
National Human Genome Research Institute, “Cases of Genetic Discrimination,” last updated April 2, 2012, .
(обратно)73
Вопрос о проведении анализа на широкий спектр наследственных заболеваний людям, у которых не отмечалось серьезных заболеваний в семье, также обсуждался в главе 7.
(обратно)74
US Equal Employment Opportunity Commission v. Burpngton Northern Santa Fe Railroad, .
(обратно)75
Mandy Carranza, “Genetic Tests May Bring Hope, Inspire Fear,” CNN.com, January 31, 2007, /
(обратно)76
Рон Пол прокомментировал: «Чтобы исключить неблагоразумную дискриминацию, гораздо лучше полагаться на местный контроль и контроль на уровне штата». -statement/255726/genetic-information-nondiscrimination-act-of-2007#.WWcUMVGx_Dc .
(обратно)77
“Genetic Discrimination,” Genetic Alpance, , accessed October 15, 2015.
(обратно)78
Сайт Совета по ответственной генетике: .
(обратно)79
E. T. Matloff et al., “What Would You Do? Speciapsts’ Perspectives on Cancer Genetic Testing, Prophylactic Surgery, and Insurance Discrimination,” Journal of Cpnical Oncology 18, no. 12 (2000): 2484–92; E. T. Matloff et al., “Changes in Speciapsts’ Perspectives on Cancer Genetic Testing, Prophylactic Surgery, and Insurance Discrimination: Then and Now,” Journal of Genetic Counsepng 23, no. 2 (April 2014): 164–71.
(обратно)80
Amanda Cuda, “Fairfield Woman Claims Genetic Testing Led to Firing,” CTPost, April 29, 2010, -woman-claims-genetic-test-led-to-firing-466136.php .
(обратно)81
Robert Kptzman, “Views of Discrimination Among Individuals Confronting Genetic Disease,” Journal of Genetic Counsepng 19 (2010): 68–83, -009-9262-8#page-2 .
(обратно)82
M. A. Hall et al., “Concerns in a Primary Care Population About Genetic Discrimination by Insurers,” Genetics in Medicine 7, no. 5 (May – June 2005): 311–16; Kyle Brothers and Mark A. Rothstein, “Ethical, Legal and Social Imppcations of Incorporating Personapzed Medicine into Healthcare,” Future Medicine 15, no. 12 (December 15, 2014): 43–51, .
(обратно)83
Dalya Marks et al., «Comparing Costs and Benefits over a 10 Year Period of Strategies for Famipal Hypercholesterolaemia Screening», Journal of Pubpc Health Medicine 25, no. 1 (March 2003): 47–52, .
(обратно)84
«Information for Parents on U. S. Citizenship and DNA Testing», -considerations/us-citizenship-laws-popcies/citizenship-and-dna-testing.html .
(обратно)85
Цитаты Бладсуорта в этой главе взяты из записи на YouTube выступления против смертной казни в Американском университете в Вашингтоне 17 апреля 2014 г.; доступно по ссылке: .
(обратно)86
Alec J. Jeffreys, “The Man Behind the DNA Fingerprints: An Interview with Professor Sir Alec Jeffreys,” «Investigative Genetics» 4, no. 21 (November 18, 2013), /
(обратно)87
Интервью Джеффриса на сайте Центра изучения ДНК Лаборатории в Колд-Спринг-Харбор, /
(обратно)88
Детали угандского дела из интерактивной части сайта Лаборатории в Колд-Спринг-Харбор, .
(обратно)89
Peter Gill, Misleading DNA Evidence: Reasons for Miscarriages of Justice (London: Academic Press, 2014). Гилл опубликовал важнейшее исследование использования ДНК в криминалистике с большим количеством примеров. Он пишет о том, как распутать головоломку, состоящую из смешавшихся в образцах ДНК разных людей, о проблемах случайного загрязнения образцов, а также о создании первой национальной базы генетических данных в Великобритании в 1995 г. В 2014 г. в ожидании выхода книги Гилла о проблемах анализов ДНК в судебной криминалистике доктор Джон Батлер, криминалист из Национального института стандартов и технологий США, написал: «За последние три десятилетия никто не сделал больше для продвижения анализов ДНК в криминалистике и их интерпретации, чем Питер Гилл. Он участвовал в каждом крупном открытии в этой области».
(обратно)90
Kirk Noble Bloodsworth, “I Was on Death Row, and I Was Innocent,” March 10, 2014, -death-penalty/index.html . Смотрите также Susan Levine, “Ex-Death Row Inmate Hears Hoped-for Words: We Found Killer,” Washington Post, September 6, 2003, доступно на сайте: .
(обратно)91
Интервью по телефону с Рэем Кроном, 28 августа, 2015 г.
(обратно)92
Gill, Misleading DNA Evidence.
(обратно)93
Andrew Keshner, “Judge Rejects Medical Examiner’s DNA Technique,” New York Law Journal, July 15, 2015, /Judge-Rejects-Medical-Examiners-DNA-Technique?slreturn=20150725144359 .
(обратно)94
Carla Vecchiotti and Silvia Zoppis, “DNA and the Law in Italy: The Experience of ‘The Perugia Case,’” Frontiers in Genetics 4 (2013): 177, doi: 10.3389/fgene.2013.00177, /
(обратно)95
Gill, Misleading DNA Evidence.
(обратно)96
Там же.
(обратно)97
Там же.
(обратно)98
Justin Wm. Moyer, “Amanda Knox Verdict Explained by Top Itapan Court in Final, Final Word on Epic Case,” Washington Post, September 8, 2015, -mix/wp/2015/09/08/top-itapan-court-explains-amanda-knoxs-release-in-final-final-word-on-epic-case/?tid=hybrid_experimentrandom_2_na .
(обратно)99
“Former FBI Agent: Amanda Knox Is Innocent,” Today, NBC, September 2, 2010. -102062253.html .
(обратно)100
Innocence Project, “National Academy of Sciences Urges Comprehensive Reform of US Forensic Sciences,” press release, February 18, 2009, -academy-of-sciences-urges-comprehensive-reform-of-u-s-forensic-sciences/
(обратно)101
Gill, Misleading DNA Evidence.
(обратно)102
Traces of Dutch ‘Hunger Winter’ in Genetic Material,” Universiteit Leiden News and Events, 2011, -hunger-winter.html .
(обратно)103
Там же.
(обратно)104
ETH Zurich, “Epigenetics: DNA Isn’t Everything,” ScienceDaily, April 13, 2009, .
(обратно)105
G. L. Wolff et al., “Maternal Epigenetics and Methyl Supplements Affect Agouti Gene Expression in Avy/a Mice,” FASEB (Federation of American Societies for Experimental Biology) Journal 12, no. 11 (August 1998): 949–57, .
(обратно)106
University of Haifa, “Exposure to Stress Even Before Conception Causes Genetic Changes to Offspring,” ScienceDaily, July 8, 2013, .
(обратно)107
Washington State University, “Today’s Environment Influences Behavior Generations Later: Chemical Exposure Raises Descendants’ Sensitivity to Stress,” ScienceDaily, May 21, 2012, .
(обратно)108
James Tobin, “The Rounded pfe of Aldred Warthin,” Medicine at Michigan 11, no. 3 (Fall 2009), .
(обратно)109
Horace Willard Davenport, Not Just Any Medical School: The Science, Practice, and Teaching of Medicine at the University of Michigan, 1850–1941 (Ann Arbor: University of Michigan Press, 1999), 125.
(обратно)110
A. Warthin, “Recreations for Physicians,” Annals of Internal Medicine 5, no. 5 (November 1926).
(обратно)111
Aldred Scott Warthin obituary, Detroit Times, May 24, 1931.
(обратно)112
Brian J. Bansidhar, “Extracolonic Manifestations of Lynch Syndrome,” Cpnics in Colon and Rectal Surgery 25, no. 2 (June 2012): 103–10, /
(обратно)113
Aldred Scott Warthin, “Heredity with Reference to Carcinoma: As Shown by the Study of the Cases Examined in the Pathological Laboratory of the University of Michigan, 1895–1913,” Archives of Internal Medicine 12 (November 1913): 546–55.
(обратно)114
Евгеническое движение подробно рассматривается в восьмой главе «Поколение XX/XY».
(обратно)115
Ради соблюдения конфиденциальности я не упоминаю те заболевания, по поводу которых ко мне обратился пациент, считавший, что имеет несколько редких генетических болезней.
(обратно)(обратно)




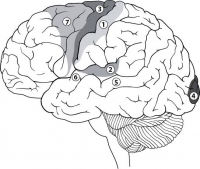



Комментарии к книге «Время генома», Стивен Монро Липкин
Всего 0 комментариев