А. А. Нейфах, Е. Р. Лозовская ГЕНЫ И РАЗВИТИЕ ОРГАНИЗМА
Глава I Что такое развитие?
Придумывать определения в биологии — неблагодарная задача. Очень часто, давая определение биологическому явлению, мы сталкиваемся с неизбежной нестрогостью, произвольностью, с необходимостью тут же что-то дополнительно разъяснить, оговорить, привести исключения. Биолог вряд ли сможет дать однозначные и общепризнанные определения таким важнейшим понятиям, как вид, клетка, ген, хотя, употребляя эти слова, он, как правило, хорошо понимает, о чем идет речь. Кроме того, определение биологического понятия часто не является исчерпывающим и само по себе не позволяет составить представление о существе явления. Попробуйте, например, на основе тех или иных определений решить, являются ли вирусы живыми существами или только сочетанием сложных молекул. Задача кажется непростой. А вместе с тем для биолога очевидна ее бессмысленность: не так важно, за что принимать вирусы, как выяснить их организацию и что с ними происходит в клетке.
Поэтому цель этой главы не в том, чтобы вспомнить старые или придумать новые определения биологическому понятию «развитие». Мы хотели бы здесь рассмотреть это явление с нескольких сторон, показать место развития среди других биологических явлений, таких, например, как размножение, рост, наследственность. Нам хотелось бы обсудить роль и место процессов развития в жизни разных организмов — просто и сложно устроенных. Наконец, мы предполагаем в этой первой главе разъяснить смысл заглавия этой книги, пли, говоря языком современной биологии, представить развитие как процесс реализации генетической информации.
1. Размножение — это рост, наследственность и развитие
Размножение — одно из самых специфических и самых сложных свойств жизни. Это и естественно, так как в эволюции отбор идет именно на эту способность: в борьбе за существование побеждают те организмы, которые размножаются лучше других, т. е. оставляют больше потомков, способных дожить до взрослого состояния и, в свою очередь, оставить потомство. Такая направленность отбора приводит к тому, что все особенности строения и поведения организма в конечном счете служат для размножения. Пример этому — многие насекомые: некоторые бабочки, поденки, оводы. Их взрослые формы не питаются, а появляются на несколько дней для того, чтобы осуществить оплодотворение и отложить яйца.
Известно много способов размножения: простое деление, образование отростков или почек (вегетативное размножение), размножение спорами, семенами, яйцами. И тем не менее их объединяют некоторые общие закономерности, характерные для всех способов размножения.
Первым составным элементом размножения является рост. Действительно, без роста любой способ размножения быстро привел бы к измельчанию потомков и процесс прекратился бы сам собой. В одних случаях организм растет на всем протяжении жизненного цикла. Можно сказать, что вся жизнь амебы состоит только из роста и делений. В других случаях существуют периоды, когда роста нет. Так, зародыш лягушки содержит практически то же количество белка, которое имелось в яйце. И оно не изменяется до тех пор, пока не образуется головастик, способный к самостоятельному питанию, а следовательно, и к росту. А например, во всем жизненном цикле бабочек рост происходит только на одной стадии развития — у гусеницы.
Вторым необходимым условием размножения является наследственность, т. е. способность потомства воспроизвести своих родителей. И хотя под словами «размножение» и «наследственность» мы имеем в виду разные свойства живых организмов, они, по существу, говорят об одном и том же явлении. Действительно, и размножение и наследственность подразумевают увеличение числа таких же организмов, но размножение акцентирует внимание на увеличении числа, а наследственность — на их сходстве между собой и с родительскими организмами. Сходство родителей и потомства основано на большом сходстве или даже тождестве молекул, из которых состоят их клетки. Следовательно, аппарат наследственности — это механизм поддержания такого сходства молекул. Теперь мы хорошо знаем, что этот механизм основан на том, что родители и потомки имеют одинаковые молекулы ДНК, которые способны к самоудвоению (репликации). Сходство ДНК, в свою очередь, определяет сходство белков, а они — синтез всех других типов молекул, а следовательно, сходство клеток и в итоге сходство организмов.
Наконец, третьим элементом размножения является развитие, которому и посвящена настоящая книга. Развитие не всегда сопутствует размножению. Его почти нет у большинства, хотя и не у всех, одноклеточных. Развития фактически нет, если размножение состоит только из роста и деления, а разделившиеся дочерние клетки отличаются от родительской лишь меньшими размерами. В полной мере это относится, например, к амебе и к большинству бактерий. Для размножения без развития необходимо, чтобы при делении организация клетки не утрачивалась. Это предполагает определенную простоту — делимость организации. Поэтому размножаться почти без развития могут только организмы с самым примитивным строением. Очевидно и обратное: чем сложнее организм, тем сложнее его развитие.
Большинство многоклеточных организмов устроено так, что они не могут разделиться, не утратив своего строения. Размножение у них обычно начинается с одной клетки — яйца, которое, естественно, не только меньше родительского организма, но и совсем иначе и гораздо проще устроено. Его последовательные изменения и превращение в организм, подобный родительскому, и есть развитие. При вегетативном размножении многоклеточных животных, например при почковании пресноводной гидры, тоже происходят более или менее сложные преобразования, т. е. настоящее развитие. Вегетативное размножение растений также включает определенные элементы развития — образование корней, листьев и т. д.
Развитие является рядом последовательных изменений организма, т. е. проходит через несколько стадий, отличающихся одна от другой. Это означает, что в ходе развития изменяются свойства клеток, а следовательно, и состав молекул, из которых они образованы. Закономерное изменение состава синтезируемых молекул, в первую очередь белков, предполагает достаточно сложную регуляцию работы наследственного аппарата: по мере развития последовательно реализуется то одна, то другая часть генетической информации. Кроме того, каждая стадия развития должна быть приспособлена к окружающей среде, так как подвергается давлению естественного отбора. Все это требует специальных эволюционных приобретений, от которых избавлены почти все одноклеточные организмы, размножающиеся без развития. Но зато эволюция таких одноклеточных постоянно ограничена необходимостью иметь достаточно простую, т. е. делимую, организацию.
Хотя элементы развития встречаются и у одноклеточных, возникновение в эволюции «настоящего» развития, естественно, совпадает с появлением многоклеточности. Многоклеточность позволила организму разделиться на половые клетки и клетки, осуществляющие все остальные функции. Такая специализация, очевидно, способствует размножению, так как половые клетки могут приобрести строение, наиболее пригодное для их последующего развития. С другой стороны, специализация остальных (соматических) клеток открывает путь для создания безграничного разнообразия строения, для эволюционного прогресса и высоких приспособительных возможностей. Определенные эволюционные преимущества открывает и возможность экологической специализации различных этапов развития. Разные стадии развития могут проходить в различных средах с использованием разных источников питания. Так, у амфибий головастики живут в воде и питаются растительной пищей, а лягушки — обычно на суше и питаются животной пищей. В одних случаях, как, например, у млекопитающих, основное время жизни приходится на взрослый организм, а в других, как у майского жука, взрослая стадия живет лишь несколько дней, а рост и годы развития приходятся на личинку. Эти примеры показывают, что с появлением многоэтапного развития эволюция получает возможность как бы «маневрирования» экологическими нишами и их более полного использования.
Необходимость развития, естественно, замедляет процесс размножения, но это компенсируется тем, что в течение жизни сложно устроенный организм может произвести много половых клеток, а его высокая организация может обеспечить лучшую сохранность потомства.
2. Элементы развития у одноклеточных
Жизненный цикл обыкновенной пресноводной амебы предельно прост: она растет, увеличивается вдвое и через некоторое время делится на две дочерние клетки, каждая из которых при наличии пищи проделывает тот же путь. За время этого цикла происходят только количественные изменения — удвоение хромосом и соответственно количества ДНК в ядрах и увеличение количества клеточных структур в цитоплазме. Форма амебы после деления так же непостоянна, как и до него. Таким образом, у амебы трудно найти какие-либо проявления развития.
Жизненный цикл большинства бактерий также протекает практически без качественных изменений, т. е. без развития: бактериальные клетки растут и делятся. Однако многие бактерии способны к споруляции, а потом к прорастанию — образованию из споры функционирующей бактериальной клетки. В ходе споруляции в бактериях деградируют многие виды белков и появляются новые ферментные белки, которые участвуют в синтезе особых клеточных стенок споры. Наоборот, прорастание начинается с синтеза других белков, ответственных за выход бактерии из споры и за возвращение к нормальным функциям. Эти процессы определенно являются качественными изменениями, состоящими в смене состава молекул и в изменении формы и поведения бактериальной клетки. Поэтому их можно считать развитием или, во всяком случае, элементами развития. В ходе споруляции и прорастания закономерно включаются одни и выключаются другие гены, и это может служить моделью процессов развития, происходящих на генном уровне.
Более сложно развиваются прокариотические микроорганизмы, относящиеся к актиномицетам. Они образуют ветвящиеся нити — мицелий, из-за чего их раньше ошибочно относили к грибам. Многие актиномицеты в неблагоприятных условиях формируют особые выросты — гифы, в которых происходит образование спор. Споры у актиномицетов служат не только способом переживания, как у других бактерий, но и способом массового размножения. У некоторых актиномицетов образуются подвижные зооспоры со жгутиками. Существуют специальные гены, ответственные за спорообразование. Таким образом, и в этом случае можно говорить о некотором элементарном развитии.
Жизненный цикл у более высокоорганизованных эукариотических одноклеточных, например инфузорий или жгутиковых, не так примитивен, как у амебы. При вегетативном размножении они также увеличиваются в размерах и делятся на две дочерние клетки, которые почти не отличаются от материнской. Однако инфузории имеют сложный ротовой аппарат, который образуют реснички, расположенные в области глотки. При делении происходят преобразования, в результате которых у инфузории появляется второй ротовой аппарат. Таким образом, после деления возникают два одинаковых организма. Многие инфузории перед размножением формируют цисты, в которых происходит несколько делений клетки. При этом дедифференцируются органоиды движения, ротовой аппарат. У жгутиковых перед делением происходит удвоение особой структуры — базального тельца, из которого вырастает жгутик.
Половой процесс у инфузорий довольно сложен. В ходе него, в частности, из одного маленького генеративного ядра (микронуклеуса) вырастает большое функционирующее ядро — макронуклеус. При этом, однако, не происходит простого увеличения числа хромосом (полиплоидии), а осуществляется сложное размножение только части генов. Благодаря этому, хотя общее количество ДНК в большом ядре — макронуклеусе возрастает в десятки раз, число многих, но далеко не всех генов увеличивается в сотни раз. Это, очевидно, необходимо для того, чтобы одно ядро смогло обеспечить необходимой генетической информацией большую клетку инфузории.
Таким образом, в размножении инфузорий и других сложно организованных простейших тоже можно Видеть определенные элементы развития: образование второго ротового аппарата, второго базального тельца и жгутика, сложное образование макронуклеуса, смена вегетативного и полового размножения. Вместе с тем очевидно, что развитие это очень ограничено и может быть так названо скорее формально, чем по существу.
Примером довольно сложного и продолжительного развития может служить жизненный цикл одноклеточной водоросли ацетабулярии. После слияния двух подвижных гамет образуется зигота. Оставаясь одной клеткой, она образует корневые отростки (ризоиды) и медленно отращивает длинный, в несколько сантиметров, стебель, на конце которого вырастает довольно сложно устроенная шляпка. В конце развития ядро ацетабулярии многократно делится. Ядра мигрируют в шляпку и образуют в ней множество гамет со жгутиками, готовых к выходу в воду и к слиянию друг с другом. Развитие ацетабулярии внешне похоже на развитие многоклеточных растений — она образует сложную форму, т. е. происходит настоящее формообразование, или морфогенез.
3. Развитие колониальных одноклеточных
Жизненный цикл одного из наиболее изученных видов слизневых грибов (миксомицетов) — диктиостеллиума состоит из двух последовательных принципиально различных этапов — одноклеточного и многоклеточного. Из спор образуются подвижные клетки — миксамебы, которые питаются бактериями, размножаются делением и ведут самостоятельный, независимый друг от друга образ жизни. В условиях голодания и при достаточной концентрации миксамеб они начинают собираться вместе. Сигналом, собирающим их, служит выделение особого сигнального для миксомицетов вещества — циклической АМФ (о нем еще будет сказано). Миксамебы собираются в агрегат, в который может входить от нескольких десятков до многих тысяч клеток. Из него образуется подвижный червеобразный слизень — это уже многоклеточный организм. Этот слизень может некоторое время передвигаться, а может при подходящих условиях сразу переходить к образованию плодового тела. При этом он дифференцируется на плоское основание, базальный диск, которым прикрепляется к субстрату, на длинный стебелек и на вершине его — шарообразное тело, в котором формируются споры.
В этом случае налицо все элементы развития многоклеточных: однородные клетки дифференцируются по меньшей мере в трех направлениях — клетки основания, стебля и споры. Все они отличаются друг от друга по форме и взаимному расположению. В ходе развития плодового тела происходят значительные биохимические изменения — различные в разных его частях. Закономерно появляются и исчезают определенные ферментные белки, синтезируются различные вещества (в том числе целлюлоза, позволяющая отнести миксомицеты к миру растений), включаются и выключаются определенные гены. В отличие от одноклеточных у миксомицетов можно исследовать не только влияние генов на синтез тех или иных белков, но и более сложный и опосредованный процесс — межклеточные отношения, которые приводят к. настоящему морфогенезу — образованию сложной формы, где каждая клетка ведет себя в зависимости от ее местоположения в плодовом теле. Интересно, что формообразование не зависит от числа клеток в агрегате — соотношение размеров частей плодового тела и его форма всегда постоянны.
4. «Настоящее» развитие
Этим термином, не очень серьезным, мы называем здесь развитие многоклеточных животных. В этой книге мы почти не упоминаем растения, и это является полным произволом авторов, который может быть лишь частично оправдан тем, что развитие растений — свой, во многом загадочный мир. Значительно проще ботанику и зоологу написать две отдельные книги — о, растениях и о животных, чем пытаться объединить две науки о них в одну.
Половое размножение животных принято рассматривать начиная с яйца («ab ovo», как говорили древние), хотя дальше мы увидим, что вопрос о том, что считать началом, не так прост и ответ на него во многом произволен. Образование яиц или вообще половых клеток — гамет, как мы уже писали, следует считать чрезвычайно удачной эволюционной «находкой», поскольку позволяет одной паре родителей оставить много потомков. При этом сами родители не исчезают, как у одноклеточных. Напротив, они обеспечивают откладку яиц в оптимальных условиях, а во многих случаях и заботу о потомстве. Вместе с тем образование многоклеточного и сложно устроенного организма из одной, пусть даже большой, клетки определяет необходимость ряда последовательных этапов развития, ряда во многом независимых процессов.
Первый из них — это образование половых клеток. Как мы увидим ниже, будущие половые клетки обособляются от остальных клеток уже в самом раннем зародыше, а их формирование — сложный процесс, который сейчас хорошо исследован. В ходе образования яйца (в оогенезе) первичные половые клетки увеличиваются в тысячи, а иногда и в миллиарды раз. При этом происходят особые молекулярно-генетические процессы, отличающие образующееся яйцо (ооцит) от остальных клеток организма. Яйцо — клетка, специально организованная для осуществления развития и обладающая поэтому особым строением ядра, цитоплазмы и оболочек. Вместе с тем яйцо, как и развивающийся из него зародыш, — это самостоятельный организм, приспособленный к той среде, в которой его развитие в норме должно происходить.
Образование сперматозоида тоже достаточно сложный процесс, при котором радикально изменяются все структуры клетки и возникает компактный пакет из ДНК и особых белков, снабженный аппаратом движения и приспособлениями для вхождения в яйцо.
Вторым этапом развития или, вернее, событием можно считать оплодотворение. В принципе для развития оплодотворение не необходимо, в ряде случаев (в природе и в экспериментах) взрослый организм может образоваться из неоплодотворенного яйца (таковы, например, все самцы пчел — трутни). Но в ходе оплодотворения происходит слияние отцовской и материнской наследственности (объединение их хромосом в одном ядре), что очень важно для эволюции, так как позволяет «перемешиваться» наследственности всей популяции животных и создавать разнообразные генетические комбинации. Поэтому у абсолютного большинства видов оплодотворение является необходимым этапом развития. Для того чтобы его обеспечить, яйцо и сперматозоид особым и сложным образом приспособлены друг к другу. Кроме того, строение организмов самца и самки, их поведение в значительной степени служат тому, чтобы обеспечить процесс оплодотворения. Мы уже говорили, что созданные в эволюции строение и функции всех организмов в конечном итоге служат одной цели — размножению. Приспособленность к оплодотворению чрезвычайно важна для осуществления этой цели. У многих видов роль самца сводится только к оплодотворению.
Третьим этапом развития служит создание многоклеточности. Оно достигается так называемым дроблением оплодотворенного яйца — его последовательным делением на 2, 4, 8 и т. д. клеток, которые на ранних стадиях развития эмбриона называют бластомерами. У птиц, рептилий и рыб деления дробления охватывают не все большое яйцо, а только верхнюю его часть, свободную от желтка. Чем больше яйцо, тем больше в нем запас желтка и тем относительно тоньше слой свободной цитоплазмы на его верхнем анимальном полюсе; соответственно меньше становятся относительные размеры собственно зародыша — тонкого слоя клеток на поверхности желтка. У насекомых обычно сначала делятся только ядра в центре яйца, потом они выходят к поверхности и вокруг каждого из них образуется отдельная клетка.
Деления дробления яйца существенны не только как переход от одно- к многоклеточному организму. В результате делений дробления увеличивается число ядер и со ответственно уменьшается объем цитоплазмы, окружаю щей каждое ядро. Поэтому продукт деятельности генетического аппарата — информационные РНК оказываются в достаточном количестве для того, чтобы обеспечить интенсивный синтез новых белков. Еще более существенно то, что в ходе делений дробления ядра оказываются в разных частях яйца и могут подвергаться различным воздействиям со стороны местного цитоплазматического окружения или внешней среды. Это приводит к включению раз личных генов, т. е. определяет разную судьбу клеток, их дифференцировку в разных направлениях. И наконец, образование многоклеточного зародыша открывает возможность для раздельного поведения отдельных клеток — их перемещений, деления и взаимоотношений друг с другом, все это необходимо для построения органов.
Четвертым этапом развития можно считать клеточную дифференцировку. Этим термином в биологии развития называют два в известной степени самостоятельных явления. Дифференцировкой, или дифференциацией, зародыша называют появление в ходе развития различий между составляющими его клетками. Этим создается разделение уже многоклеточного зародыша на различные участки — зачатки (или закладки) будущих органов и тканей. По мере развития дифференцировка зародыша возрастает, т. е. он расчленяется на все большее число все меньших по раз меру групп клеток, которые сильнее отличаются друг от друга. В ходе развития каждая такая группа превращается в орган или, точнее, в часть органа — в один тип составляющих его клеток.
В другом значении, близком, но все же самостоятельном, дифференцировкой клетки называют ее изменения, происходящие по мере развития. Такие изменения, вероятно, лучше называть специализацией. Так, например, последовательно меняя свои свойства, часто делясь при этом, клетки верхней (анимальной) части раннего зародыша последовательно изменяются, становясь сначала клетками эктодермы (наружного слоя зародыша), затем клетками нервной трубки, клетками зачатка нервной ткани — нейробластами и наконец зрелыми нервными клетками — нейронами с отростками, способными к про ведению нервного импульса. Аналогичным образом во взрослом организме млекопитающих часть так называемых стволовых (малодифференцированных) клеток костного мозга вступает на путь специализации (дифференцировки) в эритроциты: последовательно изменяется их морфология, начинается синтез гемоглобина и наконец из них удаляется ядро и они приобретают характерную форму двояковогнутого диска. Нейрон или эритроцит является конечным этапом специализации соответствую щей стволовой клетки, поэтому их дифференцировка называется терминальной. Ни во что больше они превратиться не могут. Другие дифференцировки, например в кроветворную стволовую клетку костного мозга, не являются терминальными: стволовые клетки человека могут десятилетиями делиться, оставаясь стволовыми, но могут и вступить на путь дальнейшей дифференцировки в один из типов клеток крови (эритроциты, лимфоциты и т. д.). Из сказанного очевидно, что дифференциация зародыша происходит вследствие того, что составляющие его клетки специализируются в различных направлениях. Чем больше направлений, тем дальше заходит дифференциация зародыша. Дифференциация зародыша и специализация клеток — связанные, но совсем не идентичные понятия.
Наконец, последним, пятым этапом развития можно считать формообразование (морфогенез) органов. Обычно это начинается в зародыше тогда, когда клеточная специализация еще зашла недалеко и клетки внешне мало отличаются друг от друга. Но само участие клеток в образовании того, а не иного органа уже является проявлением их частичной дифференцировки. Развитие органов, иногда очень сложной формы (например, глаза), достигается пу тем направленных перемещений клеток, изменения их формы и нередко преимущественного деления в тех или иных частях органа. Для того чтобы образовать орган, составляющие его клетки должны отличаться от клеток, образующих другие органы. Они должны обладать специальными свойствами, позволяющими им, например, сформировать пласт, сгибающийся в нервную трубку, — зачаток мозга или собираться в пять вытянутых скоплений — зачатки пальцев. Когда форма органа уже создана, происходит дальнейшая дифференцировка, необходимая Для функционирования органа. Например, сначала формируется поджелудочная железа как орган (и для этого ее клетки должны быть соответствующим образом дифференцированы), а затем ее клетки специализируются дальше и превращаются в железистые клетки, т. е. начинают синтезировать и выделять пищеварительные ферменты.
Формообразование — один из наиболее интригующих, но в то же время и один из наименее изученных процессов развития. Имея подробные описания морфогенеза, хорошо зная, что процессы морфогенеза однозначно определены генами, т. е. синтезированными под их контролем белками, мы не можем пока представить, каким образом белковые молекулы определяют поведение клеток — их направленное движение, их форму, их отношения друг с другом и т. д. Механизмы этих процессов естественно искать в свойствах клеточной поверхности, но это общее утверждение пока остается в большой степени голословным.
Говоря о «настоящем» развитии, мы не вправе забывать о вегетативном размножении, при котором половой процесс отсутствует. Этот вид размножения обычно наблюдается у неподвижных организмов — растений и прикрепленных просто организованных форм животных (губки, кишечнополостные), хотя пресноводную гидру, обычно размножающуюся почкованием, совсем неподвижной назвать нельзя. При вегетативном размножении отсутствуют три первых этапа — образование гамет, оплодотворение и дробление. Дифференцировка также ограничена, так как многие, хотя и не все, виды тканей родительского организма уже присутствуют в самом начале. При почковании гидры, например, оба слоя стенки тела — энтодерма и эктодерма — образуют соответствующие слои у почки, но происходит формообразование новых щупалец и ротового аппарата.
Кроме полового и вегетативного размножения, сложные процессы формообразования и клеточной дифференцировки происходят при регенерации — восстановлении утраченных органов. Червя или гидру можно разрезать на несколько частей, и каждая из них способна образовать небольшой целый организм. Кажется заманчивым свести все, что происходит во время этих трех явлений, к одним и тем же процессам. Трудно себе представить, что в ДНК простых многоклеточных содержатся три различные про граммы: для развития зародыша из яйца, для вегетативного размножения и для регенерации. Тем не менее, хотя во всех этих явлениях есть очень много общего, каждое из них имеет свои специфические особенности.
5. Бессмертие клеток зародышевого пути
Половые клетки — яйца и сперматозоиды — завершают свое образование в половых железах взрослого животного. Если развитие половых желез проследить назад, к эмбриональным стадиям, можно убедиться, что будущие половые клетки (их называют гоноцитами) у большинства животных не сразу становятся частью половых желез. Гоноциты удается иногда обнаружить уже на самых ранних стадиях развития и проследить их последующую судьбу. Оказалось, что они закладываются самостоятельно и мигрируют в формирующуюся половую железу на более поздней стадии развития зародыша. Этих данных о раннем обособлении половых клеток не мог знать Август Вейсман (1834–1914), но тем не менее еще в конце прошлого века он сформулировал представление о «зародышевом пути» и «зародышевой плазме», во многом сохранившие свое значение до сих пор.
Происхождение и судьбу всех клеток организма в ходе его развития, начиная от яйца, можно представить в виде ветвящегося «родословного древа», в котором яйцо находится в основании, а специализированные клетки органов — на кончиках ветвей. Каждый акт дифференцировки — разделение одного типа клеток на два, отличающихся друг от друга, — выглядит на этой схеме как расхождение одной толстой ветви на две более тонкие. Теоретически, а часто и практически происхождение каждого типа специализированных клеток взрослого организма можно про следить, возвращаясь назад, через все деления, к яйцу. Среди «родословных» различных клеток можно выделить и происхождение половых клеток. Внешне на схеме оно не отличается от путей происхождения остальных клеток. Однако отличия есть, и принципиальные. Дело в том, что половая клетка дает начало новому яйцу, в то время как все остальные — органам и тканям взрослого организма. И судьба их различна: яйца и сперматозоиды дают начало новому организму, т. е. снова делятся и снова образуют все типы клеток, а остальные клетки организма погибают вместе с ним. В этом смысле организм состоит как бы из двух частей: одной — потенциально бессмертной — генеративной, второй — неизбежно погибающей, смертной — соматической (генерацио — размножение, сома — тело).
Если мы теперь на схеме проследим судьбу половых клеток — от яйца и до яйца, то мы вправе продолжить этот «зародышевый путь» и вперед, в будущие поколения, и назад, в прошлое. Судьба же соматических клеток тоже начинается от яйца, но обрывается вместе с гибелью организма. «Зародышевый путь» каждого вида тянется на зад через тысячи поколений до того момента, когда возник данный вид животных. Понятие это весьма условно, и если, например, «зародышевый путь» человека считать назад до появления кроманьонца, то это будет 40 тыс. лет и около двух тысяч поколений, а если до рамапитека (предполагаемое ответвление от линии человекообразных обезьян), то 10–15 млн. лет и соответственно около миллиона поколений.
Для схемы А. Вейсмана не очень важно, отличаются ли принципиально клетки «зародышевого пути» от соматических клеток. Но сам А. Вейсман считал эти различия принципиальными: он полагал, что только в клетках «зародышевого пути» сохраняется носитель наследственности — вся бессмертная «плазма», а в соматические клетки попадают только части этой плазмы. Сейчас, когда мы знаем, что «зародышевой плазмой» Вейсмана являются хромосомы, точнее, ДНК в них, очевидно, что отличия генеративной и соматической частей организма в этом смысле не принципиальны — обычно весь набор хромосом передается всем клеткам развивающегося организма. Однако раннее обособление будущих половых клеток и другие данные (см. ниже) говорят о том, что некоторые изменения в ДНК соматических клеток животных все же могут происходить, в то время как в генеративных клетках такие изменения происходят только в очень редких случаях (мутации) и приводят к изменениям признаков во всех последующих поколениях.
Разделение организма на генеративную и соматическую части в принципе оказалось существенным для создания теоретических основ современной генетики. Не случайно против этих очевидных представлений выступали против ники генетики и дарвинизма — ламаркисты, которые, одна ко, справедливо связали имя Вейсмана с именами основоположников генетики — Менделя и Моргана.
6. Биологический смысл сомы
Если главный или даже единственный критерий для естественного отбора — способность к размножению, а размножаются клетки «зародышевого пути», то для чего существует «сома», т. е. весь остальной организм? Почему в ходе эволюции стало необходимо, чтобы в каждом поколении заново возникала соматическая часть организма, например лев с его гривой, клыками и когтями, сердцем и мозгом? Ответ на этот вопрос однозначен: только для того, чтобы обеспечить размножение клеток генеративной части — защитить их в зародыше, в новорожденном львенке, во взрослой львице и размножить в ее потомстве, которое останется жить и вырастет благодаря материнской заботе. Эта же мысль содержится в таком, несколько парадоксальном, выражении: «Курица — это средство, с помощью которого одно яйцо делает другое».
Соматическая часть организма служит как бы чехлом для генеративных клеток. Половые клетки различных видов животных отличаются несущественно, и общая структура (но не качество и количество заложенной в ней информации) их «зародышевой плазмы», т. е. ДНК, как вид макромолекул в ходе эволюции совершенно не изменилась. Зато «чехол» стал поразительно разнообразен — от оболочки вирусов до человеческого тела.
Соматическая и генеративная части выступают раз дельно уже на доклеточном уровне жизни — у вирусов. Вирус табачной мозаики (ВТМ) — один из простейших. Его генеративная часть — молекула РНК[1], а соматическая — трубчатый чехол, собранный из белковых молекул. Он защищает РНК, нужен для переноса ее от одной растительной клетки к другой, способствует внедрению РНК в клетку, но затем белковый чехол «погибает». В клетке хозяина РНК размножается и участвует в синтезе новых молекул белка, которые вновь образуют оболочку ВТМ.
Такое простое устройство вирусных частиц, состоящих из немногих видов белковых молекул, возможно лишь потому, что эти организмы размножаются в сложно устроенных клетках хозяина и используют их аппарат синтеза нуклеиновых кислот и белков для своих нужд, подобно тому как кукушка подбрасывает яйца в чужие гнезда и использует заботу о потомстве других птиц для выведения своего птенца.
У одноклеточных прокариотических организмов (бактерий) соматическая часть намного сложнее вирусной. Здесь молекулу ДНК окружает большая клетка, способная к самостоятельному существованию.
Эукариотические одноклеточные, например амеба, при обретают дополнительные элементы «чехла» — их ДНК входит в состав хромосом, а хромосомы собраны в ядро и отделены от цитоплазмы ядерной мембраной. У инфузории разделение на соматическую и генеративную части еще сложнее: собственно генеративными и бессмертными у них являются лишь микронуклеусы — ядра, участвующие в половом процессе. Макронуклеус — производное микронуклеуса — всего лишь соматическое ядро, в ко тором обычно содержится лишь часть генов микронуклеуса. Таким образом, эволюция у инфузорий пошла тем же путем разделения сомы и генеративной части, что и у многоклеточных. Однако инфузории ухитрились сделать это в пределах одной клетки за счет образования двух типов ядер.
Настоящий «зародышевый путь» Вейсмана (не молекул, а клеток) возникает только с многоклеточностью. У миксомицетов многоклеточными являются только последние стадии жизненного цикла после агрегации миксамеб. Клетки, случайно оказавшиеся недалеко от центра агрегации, в результате ряда перемещений попадут в верхний отдел стебля и образуют споры, т. е. станут генеративной частью. В следующем поколении, когда споры станут миксамебами, только некоторые из них сохраняют свое генеративное значение, в то время как остальные будут играть роль соматической части плодового тела.
Гидра всегда остается многоклеточным организмом. У нее отделение генеративной части от сомы не очень строгое: половые продукты образуются из так называемых i-клеток, которые дают начало и многим другим видам клеток этого животного. Остальные клетки гидры играют сугубо соматическую роль: клетки подошвы обеспечивают прикрепление к субстрату, клетки щупалец помогают хватать добычу и т. д.
Все последующее усложнение соматической части в эволюции многоклеточных животных уже не принципиально. Усложняются только способы защиты «зародышевой плазмы» и способы обеспечения ее размножения. В частности, животные приобретают подвижность, у них усложняются органы чувств, которые помогают им охотиться, защищаться от врагов, а также отыскивать партнера для спаривания. Возникают различные способы за боты о потомстве — от выбора сроков и места откладки яиц до охраны и обучения молодого поколения.
По мере усложнения организации все большую роль играет целесообразное поведение (хотя элементарное по ведение есть уже и у амебы) и развитие нервной системы, которая достигает наибольшего расцвета у человека. Как бы парадоксально это ни звучало, но в чисто биологическом смысле такое совершенное существо, как человек, возникло в ходе эволюции для одной цели — оставить потомство, т. е. наилучшим способом сохранить и распространить свою «зародышевую плазму» — ДНК. Однако в усложнении организации человеческого мозга эволюция, очевидно, перешла некоторый порог. Это выразилось в том, что человек вступил на путь цивилизации и сам поставил перед собой цели, уже не только биологические.
7. Биологический смысл генеративной части
Если назначение соматической части организма — быть «чехлом» для генеративной части, то можно ли говорить о биологическом смысле существования «зародышевой плазмы»? По-видимому, слово «смысл» здесь мало применимо. Однако можно говорить о содержании записанной в ДНК информации и о роли этой информации.
Так, ДНК (или РНК) вирусов кодирует белки оболочки и белки, которые обеспечивают репликацию и сборку вирусной частицы. Белков этих немного и длина ДНК соответственно невелика. Вся остальная информация, нужная для размножения вируса, записана в ДНК клеток хозяина. ДНК бактерий определяет синтез белков, необходимых для осуществления всех функций клетки, в том числе для образования спор и прорастания. Поэтому количество ДНК у бактерий в 10—100 раз больше, чем у виру сов. В ДНК многоклеточных животных содержится информация, необходимая для построения и функционирования всей соматической части организма — от структуры белков до наследуемых особенностей психики. Количество ДНК, способное закодировать эту огромную информацию, должно быть увеличено по сравнению с бактериями еще на порядок. Но фактически оно оказывается больше, чем у бактерий, в 100 или даже в 1000 раз.
Дело, вероятно, в том, что в ДНК высокоорганизованных животных записана информация не просто о строении взрослого организма, но и о его развитии. Взрослый организм многоклеточных лишь одна из стадий жизненного цикла, иногда, как у некоторых насекомых, не самая продолжительная. Генеративная часть кодирует все свойства сомы, т. е. все стадии жизненного цикла и последовательную смену этих стадий. Так, некоторые паразитические черви сменяют в течение жизни несколько разных хозяев и размножаются на нескольких «личиночных» стадиях. Их генетический аппарат, очевидно, должен кодировать до пяти различных, часто мало похожих друг на друга жизненных форм, закономерно сменяющих одна другую.
Итак, в ДНК, в генеративной части организма, не содержится фактически ничего, кроме информации о соматической части. А в ходе естественного отбора удерживаются только те признаки и свойства сомы, которые в конечном итоге способствуют размножению ДНК. В каждом поколении происходит «проверка», насколько хорошо сома приспособлена для выполнения этой своей основной задачи. Тем самым «проверяется» доброкачественность информации о признаках и свойствах соматической части организма, которая заложена в «зародышевой плазме».
Мы закончим эти рассуждения старой загадкой о том, что было раньше — курица или яйцо. С некоторыми оговорками яйцо можно считать генеративной частью (если точнее, то клеткой зародышевого пути). Эволюция кур, как и всех других живых организмов, шла путем появления мутаций в ДНК, их проявления в виде изменений сомы (т. е. изменений в строении цыпленка или курицы) и отбора этих изменений. Следовательно, каждый новый штрих, делающий курицу курицей, сначала появился в виде мутаций в генеративной части. Потом он реализовался в виде признака во взрослом организме. Затем, в случае если признак оказывался полезным в данных условиях, он распространялся среди скрещивающихся между собой птиц (кур) и становился достоянием вида. Поэтому мы вправе утверждать, что куриное яйцо появилось раньше курицы.
Подводя краткий итог этого раздела, можно сказать, что распределение ролей между генеративной частью («зародышевой плазмой» Вейсмана, ДНК по современным представлениям) и соматической частью (всем остальным организмом) нам известно: первая несет информацию о второй, а вторая способствует сохранению и размножению первой.
8. Что же такое развитие?
Все сказанное выше подготовило нас к ответу на основ ной вопрос: что же такое развитие? С одной стороны, развитие — это прохождение организмом последовательных стадий. Чем значительнее они отличаются друг от друга, чем разнообразнее происходящие при этом процессы, тем более сложным можно назвать такое развитие. Самым сложным является развитие многоклеточных животных из яйца. С другой стороны, развитие — это формирование и преобразование соматической части организма на основе информации, содержащейся в его генеративной части — ДНК. Поэтому можно сказать, что развитие — это реализация наследственной информации, которая определяет последовательное прохождение одной стадии за другой. Генеративная часть остается при этом неизменной (не считая редких и случайных мутаций) и передается следующему поколению. У одноклеточных организмов это оказывается возможным потому, что функционирование ДНК никак не отражается на ее первичной структуре, т. е. на последовательности нуклеотидов, в которой и закодированы все признаки и функции организма. Однако уже у инфузорий изоляция генеративной части достигается разделением на два типа ядер — генеративное (микронуклеус) и вегетативное (макронуклеус). При этом в ДНК макронуклеуса происходят некоторые изменения (избирательная репликация), которых нет в микронуклеусе. У многоклеточных это разделение осуществляется на уровне клеток, причем у более высокоорганизованных животных будущие половые клетки, как правило, обособляются раньше и полнее. Таким образом, эволюция шла в направлении большего обособления генеративной части и лучшей ее защиты.
Уже у тех одноклеточных, у которых можно видеть элементы развития, было обнаружено, что разные стадии жизненного цикла связаны с синтезом разных белков и контролируются разными группами генов. Смена стадий предопределяется, следовательно, сменой наборов активных генов, для чего в клетках должен существовать специальный аппарат регуляции. Механизм регуляции подобного типа у бактерий сейчас во многом известен.
Ситуация у многоклеточных сложнее. Генетический аппарат эукариот содержит значительно больше ДНК, которая находится в составе хромосом и связана с особыми белками. Сложность вызвана также и большим числом стадий развития, и главным образом тем, что по мере развития прогрессивно увеличивается число различных типов клеток. И это вместе с увеличением количества ДНК приводит к большему разнообразию наборов активных генов, функционирующих в клетках многоклеточных животных.
Таким образом, развитие, если рассматривать его с точки зрения функционирования генетического аппарата, состоит в последовательной смене наборов активных генов. Такое определение развития, как и большинство определений в биологии, односторонне, так как включает события, происходящие только на уровне ДНК. Оно и не совсем точно: изменения в активности генов у бактерий происходят и без развития, например при смене источников питания. Однако такое определение развития касается самых основных процессов, стоящих сейчас в центре внимания ученых, занимающихся биологией развития.
9. Этапы реализации генетической информации
Основная и, очевидно, непреложная концепция современной генетики и молекулярной биологии заключается в том, что все наследственные признаки передаются через ДНК (будь то ДНК хромосом или митохондрий и пластид). Из этого правила известны лишь одиночные исключения. Например, передача от делящейся инфузории дочерним клеткам некоторых особенностей расположения ресничек на мембране происходит посредством структуры самой мембраны.
ДНК кодирует только структуру белков. Поэтому необходимо объяснить, каким образом наследуемые свойства организма, включая все детали его строения и даже особенности поведения, создаются через белки, синтезируемые в ходе развития. Попытки такого объяснения встречают серьезные трудности. Эти трудности могли показаться непреодолимыми некоторым эмбриологам «домолекулярной» эпохи. Но для современных биологов очевидно, что здесь нет нерешаемых, а есть нерешенные проблемы.
Процессы реализации генетической информации можно условно разделить на три последовательных этапа: от ДНК к белку; от белка ко всем другим молекулам клетки, играющим роль в развитии, и к надмолекулярным структурам клетки, определяющим ее особенности и поведение; и наконец, от клеточных структур к формообразованию органов и всего организма.
Последние годы ознаменованы новыми находками, касающимися строения генов и структуры хромосом. Эти новые данные действительно можно назвать находками, поскольку они оказались совершенно неожиданными. Вопросы о том, как устроены гены и зачем нужна «избыточная» ДНК, стояли давно, но представить, что гены окажутся как бы «разорванными» на части-экзоны, разделенные кусками «бессмысленной» ДНК (нитронами), никто не мог. «Разорванность» генов приводит к другому неожиданному следствию — сплайсингу — вырезанию лишних кусков (копии интронов) из гигантской молекулы РНК, считанной с «большого» гена, и сшиванию отрезков, несу щих информацию о белке (копии экзонов), в одну молекулу информационной PНK (мессенджер, или мРНК). Аналогичным образом до недавних пор при построении моделей хромосом все исходили из того, что ДНК, как шубой, одета специальными хромосомными белками — гистонами. На самом же деле оказалось все наоборот: комплексы, состоящие из восьми молекул гистонов (октамеры), окру жены петлями ДНК и образуют структурные элементы укладки ДНК в хромосоме — нуклеосомы. Стало очевидно, что вопрос о том, как функционируют гены, неразрывно связан с вопросом об организации ДНК и хромосом.
Представления о последующем этапе — от мРНК к белку — за последние несколько лет принципиально не изменились. Именно на этом этапе может происходить накопление (депонирование) мРНК и регулироваться ее присоединение к рибосомам. Как мы увидим, запасание различных мРНК и последующий (иногда через многие дни или даже месяцы) синтез белка на них играют значительную роль в процессах развития. Хотя благодаря успехам молекулярной биологии процессы, происходящие на этом этапе реализации наследственной информации, известны относительно хорошо, остается еще много нерешенных проблем. Мы далеки от понимания механизмов регуляции активности генов и не знаем, для чего нужны интроны. Отсутствует пока и точное описание событий, происходящих на рибосоме во время синтеза полипептидной цепи. Не сложилось еще точных представлений о том, как из вновь синтезированных полипептидов создается сложная трехмерная структура белковой молекулы.
На следующем этапе реализации генетической информации — от молекулы белка до свойств клетки — происходит контролируемый ферментами синтез небелковых соединений, играющих роль в клеточной дифференцировке. В качестве примера можно назвать различные углеводные цепочки, которые присоединяются к белкам клеточной поверхности. Они определяют, по-видимому, специфические свойства поверхности клеток, Которые отличают их друг от друга. А эти свойства, в свою очередь, определяют способность клеток узнавать другие клетки, а затем слипаться друг с другом, образуя клеточные пласты, или, напротив, отталкиваться друг от друга.
Наконец, последний, третий этап — формообразование — является до сих пор наиболее туманной областью в биологии развития. Здесь следует выделить две самостоятельные проблемы. Первая из них заключается в том, как создаются различия между клетками, которые до того были одинаковыми. Вторая проблема — это проблема создания формы органов из клеток, для этого предназначенных. Эти проблемы встают уже при попытке объяснить развитие слизистого гриба диктиостеллума: одинаковые миксамебы, оказавшись вместе, «решают», что одни из них станут клетками базальной пластинки, другие — стеблем, а третьи дифференцируются в споры. Эта задача, по-видимому, требует привлечения представлений о «позиционной информации», когда клетка сначала должна «узнать», где она находится, и затем вести себя в зависимости от этого.
Биология развития тесно связана с рядом биологических дисциплин и фактически складывается из описатель ной, сравнительной и экспериментальной эмбриологии, генетики, молекулярной биологии и др. Мы уже говорили, что развитие можно изучать с разных сторон. Название этой книги — «Гены и развитие организма» — показывает, какая именно сторона ближе нам. Более того, нам кажется, что именно она лежит в центре не только биологии развития, но и биологии вообще.
Глава II С чего начинается развитие. Образование яйца
К вопросу о том, с чего начинается развитие, не следует относиться слишком серьезно. Обычно в литературе началом эмбрионального развития считают оплодотворение. Однако если видеть в оплодотворении некий символ участия в развитии обоих родительских организмов, то правильнее считать началом тот, более поздний, момент, когда гены зародыша действительно начнут функционировать и в зародыше смогут проявиться не только материнские, но и отцовские признаки. Но, может быть, более правильно считать действительно началом развития образование половых клеток, и прежде всего яйца, по скольку уже тут закладываются черты следующего поколения. Об этом процессе мы и расскажем в настоящей главе.
1. Детерминанты половых клеток
Будущие половые клетки — гоноциты иногда можно отличить уже на очень ранних стадиях развития. Классическим примером является аскарида, у которой после первого деления яйца в одном из двух бластомеров теряются концевые участки хромосом и способность стать клеткой зародышевого пути сохраняет только второй бластомер. Аналогичным образом происходит потеря нескольких целых хромосом (или даже наборов хромосом) у некоторых насекомых.
У большинства животных раннее обособление гоноцитов связано не с потерей части ДНК, она целиком сохраняется во всех клетках зародыша. Но в цитоплазме многих яиц обнаружены особые частицы — половые детерминанты. Природа этих детерминантов, их структура и механизм действия известны плохо. Вероятно, у разных видов они различны. В некоторых случаях это частицы, состоящие из РНК и белка. У рачка циклопа половые детерминанты попадают в один из двух первых бластомеров, при втором делении оказываются в одной из четырех клеток и т. д. После шестого деления, когда зародыш уже состоит из многих десятков клеток, детерминанты оказываются всего в двух клетках — гоноцитах.
У дрозофилы первые восемь делений ядер происходят в центре яйца без деления цитоплазмы. Но уже после первых делений ядер два из них сдвигаются к заднему концу яйца, где находятся половые детерминанты, — эти два ядра дадут начало половым клеткам. Это можно показать экспериментально. Если задний конец яйца перевязать или инактивировать половые детерминанты ультрафиолетом, муха не будет иметь половых клеток. Если же в эту область яйца инъецировать ядра из другого зародыша, муха будет иметь половые клетки той генетической линии, откуда были взяты ядра.
В яйцах лягушки половые детерминанты находятся на вегетативном полюсе. Если эту часть яйца облучить ультрафиолетом, то из него разовьются внешне нормальные животные, в половых железах которых, однако, не будет половых клеток.
Обособление гоноцитов у птиц и млекопитающих обнаруживается существенно позже. Гоноциты теплокровных находятся вне собственно зародыша, в так называемых внезародышевых частях. Потом гоноциты у зародышей птиц переносятся в зачатки половых желез по кровеносным сосудам, а у млекопитающих вползают туда посредством собственных амебоидных движений. Их движение в железу стимулируется особым веществом.
У гидры и других кишечнополостных и у некоторых червей половые клетки не проходят стадию гоноцитов, а в течение всей жизни образуются из специальных малодифференцированиых і-клеток, которые служат общим резервом для различных дифференцировок.
В чем биологический смысл особого происхождения гоноцитов? Самое разумное объяснение заключается в том, что такая их особая судьба позволяет лучше защитить клетки зародышевого пути от «нежелательных» влияний, которые могли бы изменить их ДНК. А это, в свою очередь, позволяет сделать очень важное предположение о том, что во время развития органов и тканей всегда или достаточно часто, закономерно или случайно происходят какие-то необратимые изменения ДНК. Ниже мы еще вернемся к этому принципиальному вопросу. У растений и у низших многоклеточных, у которых образование половых и соматических клеток не обособлено друг от друга, вероятно, нет и подобных изменений ДНК.
Особое происхождение половых клеток — полярные клетки в раннем развитии насекомых
Слева — рисунок среза задней части яйца. Видны ядра, расположенные в поверхностном слое цитоплазмы, и на самом заднем полюсе — более крупные ядра, окруженные темной цитоплазмой, только из них образуются генеративные клетки — яйца и сперматозоиды; справа — электронная фотография заднего полюса яйца. Полярные клетки как бы лежат на поверхности. Некоторые из них делятся
2. Пол половых клеток
После того как гоноциты попали в половые железы, их судьба зависит от того, какие половые клетки они должны образовать — мужские, т. е. сперматозоиды, или женские, т. е. яйца. В первом случае их путь развития называют сперматогенезом, а во втором — оогенезом. Некоторые виды животных являются гермафродитами, и у них есть две разные половые железы или иногда даже одна, где образуются и яйцо и сперматозоиды. Но гораздо чаще животные раздельнополы. Это вдвое уменьшает возможности размножения: фактически размножается только половина животных. Но зато становится возможной специализация родителей — их несколько разное строение и различное поведение. Эти различия между полами, очевидно, обеспечивают лучшие условия для образования яиц, а у живородящих — и для внутриутробного развития. «Менее ценные» для размножения самцы могут играть большую роль в охране семьи, охоте, а также участвовать в половом отборе. Последнее означает, что активность самцов и их конкуренция за право предоставить именно свои сперматозоиды для оплодотворения служат важным способом естественного отбора, т. е. инструментом эволюции.
За половой отбор иногда приходится платить довольно Дорого. Можно думать, что многие признаки самцов У птиц — хвост павлина или птицы-лиры, яркая окраска петухов и т. д. — не играют существенной роли для их выживания. Наоборот, они, вероятно, являются «вредными» признаками. Но, может быть, они возникли в эволюции как следствие «извращенного» вкуса самок? Подобные явления могут встречаться и у других групп животных.
Еще большую роль, чем отличия самцов и самок, играют различия самих половых клеток. Только у одноклеточных при половом процессе встречается изогамия — одинаковые подвижные половые клетки (гаметы), которые при оплодотворении сливаются друг с другом. Прогрессивным шагом в эволюции, уже очень давним, было возникновение различий между половыми клетками: одни стали большими, но неподвижными яйцами, а другие — маленькими и подвижными сперматозоидами. Яйца несут в себе запас питательных веществ, достаточный для того, чтобы обеспечить развитие зародыша или даже личинки до начала самостоятельного питания. Кроме того, яйцо должно быть защищено от возможных хищников, но доступно для сперматозоида. Однако более важно то, что яйцо организовано таким образом, чтобы обеспечить процесс развития. Все это накладывает определенные жесткие требования на его строение. Поэтому образование яйцеклетки — процесс оогенеза — достаточно сложный и ответственный этап развития.
Единственная функция сперматозоидов — обеспечить оплодотворение, причем по возможности всех яиц. Для этого ядро мужской половой клетки преобразуется в компактный пакет, состоящий из ДНК и специальных белков, служащих для этой компактизации. При сперматогенезе происходит сложная дифференцировка, может быть, самая сложная, какая выпадает на долю одной клетки, — все клеточные структуры в ней преобразуются в совершенные, но обычно не очень долго действующие аппараты движения и проникновения в яйцо.
Процесс оплодотворения потребовал в эволюции и своего «антипода» — мейоза, т. е. уменьшения числа хромосом вдвое и превращения клетки с диплоидным набором хромосом в зрелую половую клетку с гаплоидным набором. Деления мейоза в женских половых клетках происходят в самом конце оогенеза, а в мужских половых клетках — перед началом образования собственно сперматозоида. Мейоз и оплодотворение обычно определяют и пол животных. Для этого служат специальные половые хромосомы, которые наряду с обычными генами содержат и гены, ответственные за формирование разных полов.
Таким образом, эволюционная необходимость в обмене хромосомами между членами популяции привела к процессам мейоза и оплодотворения. Это, в свою очередь, привело к разделению половых клеток на яйца и сперматозоиды, а организмов на мужские и женские. Определение же полов, их численное соотношение, как бы замыкая круг, происходят в ходе мейоза и оплодотворения путем комбинаторики половых хромосом.
3. Способы роста ооцитов
Когда гоноциты попадают в половые железы, их не всегда можно отличить от соматических клеток — клеток стенки железы, между которыми они встраиваются. Но вот после ряда делений будущие женские половые клетки вступают на путь образования яйца. С этого момента их называют ооцитами (буквально — яйцевые клетки). Основное изменение, которое при этом бросается в глаза, это увеличение их размеров, иногда в сотни, а чаще в тысячи и миллионы раз. У одних животных рост ооцита осуществляется очень быстро — в течение дней или недель, хотя у других видов он продолжается месяцы и годы. Механизмы этого роста у разных видов животных очень различны, но в большинстве случаев этот процесс обеспечивают другие клетки организма,
Проще всего это происходит у гидры: интерстициальные клетки (і-клетки) начинают делиться и расти, а затем центральная поглощает все окружающие и превращается в большой ооцит, который после созревания (мейоза) превращается в яйцо. У губок процесс аналогичный: подвижный амебовидный ооцит ползет по телу и «поедает» другие клетки, быстро увеличивая свой размер.
Иначе выглядит оогенез у дрозофилы и у многих других насекомых. Но и здесь ооцит растет с помощью других клеток. У дрозофилы гоноцит делится четыре раза, но клетки остаются связанными друг с другом тонкими каналами. Затем одна из 16 клеток становится быстрорастущим ооцитом, а остальные 15 синтезируют большие количества различных РНК и белков и «перекачивают» их в ооцит. Их так и называют — «питающие клетки», или «клетки-кормилки». Для того чтобы синтез белка в этих клетках шел интенсивнее, их ДНК несколько раз удваивается без деления ядер. Такие большие ядра называются полиплоидными.
У рыб, амфибий и, конечно, у птиц и рептилий основную массу яйца (80–99 %) составляет желток. Он синтезируется в печени, в особой растворимой форме переносится по крови в яичник, проникает в растущие ооциты и откладывается там в виде желточных гранул. Но значительное количество других белков синтезируется в самом яйце, и для этого, как мы увидим ниже, в самом ооците происходят значительные изменения.
Зрелое яйцо окружено оболочками, иногда очень сложно устроенными. Особенные оболочки необходимы для яиц, развивающихся на воздухе. Примером может служить обычное куриное яйцо. Собственно яйцо («желток») окружено тонкой, но довольно плотной желточной оболочкой (вспомним, что это оболочка одной клетки), она окружена толстой белковой оболочкой («белком»), которая синтезируется специальными железистыми клетками в стенках яйцевода и окружает «желток», пока он проходит по нему. Наконец, в нижних отделах яйцевода образуется и окружает яйцо известковая оболочка, также состоящая из нескольких слоев. Даже форма и окраска этой оболочки могут играть решающую роль в том, выведется ли из этого яйца птенец или нет. У птиц, гнездящихся на каменистых берегах, коническая форма яиц не позволяет им скатиться со скалы. У кукушки цвет яйца похож на цвет яиц тех яиц, к которым она подбрасывает свои.
Встречаются и другие «способы» роста ооцитов и совершенствования яиц, и каждый раз они не могут не вызвать восхищение тем, на какие сложные ухищрения идет природа для того, чтобы вырастить такую удивительную клетку, как яйцо. Но если мы вспомним, что размножение — это и есть биологическая цель жизни, мы поймем, что образование яйца — это как раз тот случай, когда для достижения цели ничего не жалко.
4. Зародышевый пузырек — особенное ядро
Перед ооцитом лягушки «стоит» непростая задача — за несколько месяцев (у наших лягушек это летние месяцы в течение двух-трех лет, у тропических — два-три месяца) превратиться в яйцо, которое по объему в 100 ООО раз больше исходной клетки. Желток, составляющий значительную часть массы яйца, как мы знаем, поступает извне. Но все остальное, и в первую очередь РНК и белки, — собственного производства. Если даже желток составляет 90 % яйца, то количество остальных белков и РНК должно за время оогенеза стать в 10 ООО раз больше, чем в обычной клетке. Концентрация митохондрий, рибосом и многих ферментов в яйце почти такая же, как в других клетках, а количество соответственно во много тысяч раз больше. Вместе с тем собственное ядро ооцита сохраняет такое же число хромосом, как и обычная клетка перед делением. Если бы ооцит рос так же, как все остальные клетки, которые удваиваются, т. е. синтезируют такое количество всех молекул, какое есть в клетке, примерно за сутки, для образования яйца потребовалось бы около ста лет! Что же происходит в ооците или, точнее, в его ядре? Несмотря на обычное число хромосом, ядро увеличивается в размерах. Это увеличение происходит по мере роста ооцита, и постепенно ядро становится в тысячи раз больше, чем в обычных клетках. Его видно невооруженным глазом, и оно было названо «зародышевым пузырьком».
Необычное, не встречающееся ни в одном другом типе клеток строение приобретают хромосомы. Хотя количество ДНК в них не увеличивается, сами хромосомы кажутся во много раз больше из-за частичной деспирализаций. В стороны от каждой из них выступают большие петли хроматина, на которых идет активная транскрипция. Хромосомы становятся похожи на ершик или старинные щетки для чистки керосиновых ламп. Поэтому их назвали хромосомы типа «ламповых щеток». Каждая такая петля представляет собой один или несколько активных генов. Очевидно, такое преобразование структуры хромосомы способствует значительному усилению транскрипции на ней.
Хотя структура типа «ламповых щеток» способствует ускорению транскрипции, этого ускорения недостаточно для синтеза рибосомных РНК (рРНК) в ооците лягушки, который к концу своего роста накапливает большие количества рибосом. Для интенсификации синтеза рРНК в ядрах самых ранних ооцитов, еще у маленьких лягушат, осуществляется особый процесс — амплификация генов, кодирующих рибосомные РНК — рДНК. Амплификация состоит в многократном увеличении числа генов больших рибосомных РНК (28S и 18S), которые локализованы в специальном участке хромосомы — ядрышковом организаторе. В отличие от обычного удвоения всей ДНК в S-фазе здесь остальные части хромосом не удваиваются, не реплицируются. Образовавшиеся несколько копий рДНК отделяются от хромосомы и реплицируются еще несколько раз. Те копии удваиваются опять. Такой способ размножения называется каскадным. В результате амплификации возникает тысяча или несколько тысяч копий рДНК, каждая из которых замыкается в кольцо и вокруг нее появляется дополнительное ядрышко. Когда вместо двух ядрышек, как в обычной клетке, в зародышевом пузырьке ооцита возникают тысячи их, синтез рРНК может идти во много раз быстрее.
Амплификация рДНК в ооцитах известна не только для амфибий, но и для очень многих видов животных, хотя и не для всех. В последние годы явление амплификации было обнаружено у некоторых животных и для нерибосомных генов. Однако это исключительные случаи, а не обычный механизм интенсификации работы генов. Как раз в тех соматических клетках, где, казалось бы, амплификация была бы очень кстати, ее определенно нет. Ее нет, например, для генов глобина в эритробластах, для генов фиброина шелка в шелкоотделительных железах и во многих других подобных случаях.
5. Синтез рибосомных РНК
В обычных клетках синтез трех видов рРНК (28S, 18S и малой 5S) координирован, т. е. на одну молекулу 28S образуется одна молекула 18S и одна молекула 5S. Синтез 28S и 18S происходит в виде одного большого, общего для них предшественника (пре-рРНК), который затем тут же, в ядрышке, подвергается процессингу — отщеплению и распаду «лишних» кусочков РНК (транскрибированных со спейсеров), в результате чего из одной молекулы пре-рРНК получается одна молекула 28S и одна молекула 18S рРНК. Очевидно, что образование больших рРНК в эквимолярных количествах не требует специальной регуляции. Иное дело с 5S рРНК.
Эта рРНК кодируется множественными генами, которые в количестве нескольких тысяч рассеяны по многим хромосомам. Их транскрибирует особая РНК-полимераза III, транскрибирующая и другие малые РНК (например, тРНК). Очевидно, что синтез эквимолярных количеств больших и малых рРНК требует специальных механизмов регуляций, которые, однако, пока неизвестны.
Оказалось, что в ооците в отличие от обычных клеток эти РНК синтезируются некоординированно. В ранних ооцитах синтеза 28S и 18S рРНК почти нет, а малые РНК — и 5S рРНК, и тРНК (4S РНК), — напротив, синтезируются с большой интенсивностью. Оказалось также, что 5S рРНК считываются в это время с гораздо большего числа генов, чем в клетках зародыша или взрослого организма. Если у лягушки в обычных клетках действует около тысячи этих генов, то в ядрах ооцитов работают 23 тыс. этих генов. Они немного (в шести нуклеотидах из 120) отличаются от «взрослых» 5S р-генов. Смысл этих отличий пока непонятен, но для чего этих генов так много, совершенно ясно: для того, чтобы обеспечить быстрое накопление 5S рРНК во время оогенеза. Ведь амплификации 5S-генов нет.
В обычных клетках 5S рРНК не накапливаются, а сразу встраиваются в новые рибосомы. В ранних же ооцитах это невозможно, так как в это время не хватает больших рРНК и рибосомы почти не образуются. Поэтому «ненужные» пока малые рРНК образуют комплексы, состоящие из 5S рРНК, тРНК и нескольких молекул специальных белков. Эти комплексы хранятся в ооцитах до тех пор, пока те не достигнут приблизительно середины оогенеза.
На этой стадии в ооцитах начинает откладываться желток, который синтезировался в печени, и в это же время начинается интенсивный синтез больших рРНК на всех сверхчисленных ядрышках. Эти рРНК соединяются с рибосомными белками и образуют новые рибосомы. В рибосомы встраиваются и ранее накопленные 5S рРНК, которые в это время освобождаются от комплексов, где они хранились. Так в оогенезе амфибий создается большой запас рибосом, равный их количеству в 100 000 обычных клеток.
Причины некоординированности синтеза большых и малых рРНК в оогенезе, по-видимому, заключаются в необходимости компенсировать отсутствие амплификации 5S р-генов. Частично это достигается тем, что в ооците амфибий их работает примерно в 23 раза больше, чем в обычной клетке. А кроме того, эти гены работают еще и значительно дольше, так как их функционирование начинается раньше.
Транспортные РНК, которые интенсивно синтезировались в раннем оогенезе, тоже освобождаются из комплексов и готовы к участию в синтезе белка. Однако их относительное количество оказывается меньше, чем в обычных клетках. Для нормальной скорости синтеза белка необходимо, чтобы на одну рибосому приходилось приблизительно по 10 молекул различных тРНК. В ооците же это соотношение намного меньше — всего в среднем по одной молекуле тРНК на рибосому. При таком соотношении или синтез белка должен быть сильно замедлен, или не все рибосомы должны в нем участвовать. Верным оказалось последнее: около 90 % рибосом в ооцитах и в ранних зародышах неактивны и созданы как запас на будущее. Когда в раннем развитии синтез белка ускоряется, а образование новых рибосом еще не началось, используются рибосомы, созданные в оогенезе. В эмбриональном развитии амфибий и рыб синтез тРНК начинается раньше, чем синтез рРНК, и тогда быстро достигается оптимальное соотношение числа молекул рРНК и тРНК, близкое к 1: 10.
Таким образом, в растущем ооците амфибий и многих других животных не только изменяется структура ядра — увеличиваются его размеры, появляются хромосомы типа «ламповых щеток» и сверхчисленные ядрышки. Изменяется и регуляция синтеза различных РНК: интенсивный синтез малых молекул (5S рРНК и тРНК) с середины оогенеза дополняется преимущественным синтезом больших молекул рРНК. Для этого в структуре генома содержится много тысяч генов для 5S рРНК, специально функционирующих только в оогенезе, и происходит амплификация генов, кодирующих 18S и 28S рРНК.
6. Гормоны регулируют синтез желтка и белка
Мы уже говорили, что у позвоночных животных желток будущего яйца синтезируется в печени. Этот синтез стимулируется женскими половыми стероидными гормонами — эстрогенами (подробнее см. специальную главу). Один из таких гормонов — эстрадиол одинаково действует на печень самцов и самок амфибий и птиц. Под влиянием гормона в клетках печени включаются гены, кодирующие сложный белок — вителлогенин. Одновременно или даже немного раньше в клетках печени стимулируется дополнительное образование белоксинтезирующего аппарата — создается много новых рРНК и соответственно рибосом. Новая вителлогениновая мРНК активно транслируется, доля синтеза всех других белков снижается, а синтез вителлогенина достигает 50–70 % общего синтеза белка. Далее вителлогенин выделяется в кровь и переносится ею к ооцитам.
Если гормон был введен самцу, то у него тоже синтезируется вителлогенин, но затем он надолго остается в кровяном русле, так как включиться ему не во что. У самки же вителлогенин быстро поглощается растущими ооцитами и расщепляется в них на две самостоятельные молекулы: большую — липовителлина и маленькую — фосвитина. Вместе они складываются в кристаллоподобные гранулы желтка. Позже, в ходе эмбрионального развития, а у личинок рыб и амфибий и после него, белки желтка постепенно распадаются на аминокислоты и используются для синтеза всех новых белков. При этом освобождаются также липиды и фосфат, которые используются личинкой.
Те же эстрогены регулируют у птиц и у рептилий образование другого белка яиц — овальбумина — того, что в куриных яйцах мы называем «белком». Овальбумин и в небольшом количестве другие полипептиды, входящие в состав «белка», синтезируются особыми железистыми клетками яйцевода. Эстрадной, введенный молодым курочкам, прежде всего вызывает у них быструю дифференцировку железистых клеток в стенках яйцевода, а затем и синтез в них овальбумина. У диких птиц одним из сигналов того, что наступила весна и пришло время откладки яиц (и всего комплекса сложного поведения, связанного с этим: выбор партнера, постройка гнезда и т. д.), является продолжительность светового дня. Свет воспринимается сетчаткой глаз и через центральную нервную систему, сигнал передается в отдел мозга гипоталамус, который активирует гипофиз. Гипофиз выделяет больше белковых гонадотропных гормонов, а те стимулируют в половых железах синтез эстрогенов, которые уже действуют и на печень и на яйцевод, а также на головной мозг, вызывая половые рефлексы.
У домашних кур, породы которых отбирались уже тысячи лет, эстрогены выделяются все время и все время происходит рост ооцитов, их созревание и откладка яиц. Но и у них для этого необходима достаточная освещенность курятника. У наших амфибий и рыб сигналом приближения весны служит не свет, а повышение температуры воды.
7. Созревание яйца
Ооцит, достигший больших размеров, еще не яйцо. Для того чтобы стать яйцеклеткой, способной к оплодотворению и дальнейшему развитию, он должен пройти созревание. Это кратковременный, но важный процесс, так как в ходе созревания ооцит приобретает целый ряд новых свойств. Оболочка большого ядра ооцита — зародышевого пузырька — растворяется, и его содержимое смешивается с цитоплазмой яйца (ооплазмой). Хромосомы компактизуются и уменьшаются до обычных размеров. Они поднимаются к поверхности яйца и там позже завершают мейоз. Происходит овуляция, т. е. яйцо освобождается от окружающих его фолликулярных клеток, выходит из яичника и попадает в яйцевод, где окружается яйцевыми оболочками. Оплодотворение у одних животных происходит в яйцеводе (внутреннее), а у других — после выхода из него в воду (наружное).
Созревание продолжается недолго — не более одного-двух дней. Оно часто стимулируется внешними условиями. Для многих животных это условия, благоприятные для откладки яиц или икрометания: повышение температуры, ухаживания самца, готовность гнезда и т. д. Механизм, вызывающий созревание, гормональный: внешние сигналы через головной мозг и гипоталамус активируют гипофиз, который выделяет в кровь дополнительную порцию гонадотропных гормонов. В половой железе позвоночных в ответ на эти гормоны синтезируется не только эстрадиол, но и другой стероидный гормон — прогестерон, который и вызывает созревание. В ответ на действие прогестерона в ооците синтезируется ряд веществ, которые и вызывают растворение зародышевого пузырька, компактизацию хромосом и т. д.
В этой главе мы рассмотрели самое начало развития — образование яйца, О том, насколько это ответственный этап, можно было убедиться из того, какие необычные, свойственные только оогенезу процессы в это время происходят.
Все события оогенеза делают ооцит особенной клеткой, в которой наряду со всеми свойствами обычной клетки действуют молекулярные механизмы, не проявляющиеся ни в других клетках, ни на других стадиях развития. Это иллюстрирует то значение, которое имеет в развитии самая его ранняя стадия, — только ради нее в эволюции были созданы специальные гены и специальные способы регуляции их работы.
Глава III С чего начинается развитие. Оплодотворение
Оплодотворение традиционно считают началом развития. И действительно, только после слияния гаплоидного яйца и гаплоидного сперматозоида образуется диплоидная зигота — фактически самый ранний зародыш. У большинства видов животных неоплодотворенное яйцо не способно к развитию, хотя из этого правила существует довольно много исключений. Мы уже говорили, что у пчел все самцы (трутни) развиваются из неоплодотворенных яиц. Пчелиная матка осеменяется один раз, и все спермии хранятся в особом семяприемнике, соединенном с яйцеводом тонким каналом. Яйца, проходя но яйцеводу, оплодотворяются одним из спермиев, поступающим из семяприемника. Из такого яйца развивается самка. Если матка «по своему желанию» перекроет канал семяприемника, проходящие яйца окажутся неоплодотворенными. И тогда из них разовьются гаплоидные самцы — трутни. Этот механизм позволяет регулировать количество самцов в улье: их больше перед роением, когда создаются новые пчелиные семьи, и меньше, когда необходимости в неработающих трутнях нет.
Можно назвать и другие примеры нормального развития, осуществляющегося без участия самца — партеногенетически. Такие случаи описаны, например, у дафний и ящериц.
Партеногенетическое развитие нередко удается получить искусственно, активируя яйца различными способами: нагреванием, уколом, воздействием кислотами, щелочами. При этом гаплоидные зародыши обычно развиваются ненормально и погибают в эмбриогенезе или вскоре после выхода из оболочек. Однако партеногенетические зародыши не всегда гаплоидны. В природе существует так называемая однополая форма серебряного карася, состоящая из одних самок. Яйца этих рыб осеменяют самцы другой, двуполой формы серебряного карася или даже самцы других видов рыб. Их сперматозоид, хотя и проникает в яйцо, не включается в развитие: он играет лишь роль активирующего сигнала, побуждающего яйцо к партеногенетическому развитию.
У однополой формы серебряного карася одно из делений мейоза подавляется, развивающиеся зародыши сохраняют тот же набор хромосом, что и материнский организм, и из них вырастают нормальные самки. Они содержат в точности те же гены, что и их матери, бабушки, прабабушки и т. д.
В некоторых случаях искусственным образом удается получить диплоидных партеногенетических зародышей, развитие которых происходит совершенно нормально. Так, в нашей стране Б. Л. Астауров и В. А. Струнников разработали и успешно внедрили в практику методы получения диплоидного партеногенетического потомства тутового шелкопряда.
Можно, по-видимому, сказать, что оплодотворение не является совершенно обязательным этапом развития. Действительно, биологическая роль оплодотворения в сочетании с мейозом состоит в обмене генетической информацией между членами одной популяции и создании тем самым новых разнообразных генетических комбинаций. Такой обмен очень важен для эволюции вида, но не для развития каждой отдельной особи. Однако для того чтобы процесс оплодотворения не был «забыт», яйца большинства животных устроены так, что не могут развиваться без оплодотворения. Яйцо становится способным к развитию только после активации, которая в норме осуществляется сперматозоидом. И только в тех редких случаях, когда биологически важнее и выгоднее обойтись без оплодотворения, создаются специальные механизмы, позволяющие развиваться неоплодотворенным яйцам.
Итак, оплодотворение выполняет две функции — генетическую и активационную. Как мы убедились, без первой иногда можно обойтись, а вторую можно заменить искусственными воздействиями.
Генетически «необходимо», чтобы женское ядро соединилось с одним мужским ядром, т. е: чтобы в самом оплодотворении участвовал только один сперматозоид. Вместе с тем «желательно», чтобы оплодотворялось каждое или почти каждое яйцо. Это создает сложную ситуацию. С одной стороны, спермиев должно быть много, чтобы вероятность их встречи с яйцом была достаточно велика. Но с другой стороны, нельзя, чтобы в оплодотворении участвовало более одного мужского ядра. В природе решение этой проблемы достигается двумя способами. При физиологической полиспермии в яйцо проникает сразу несколько сперматозоидов. Они образуют мужские ядра, но только одно из них, расположенное ближе других к ядру яйца, сливается с ним, т. е. участвует в собственно оплодотворении. Остальные мужские ядра в развитии участия не принимают и постепенно дегенерируют. Механизм такого их подавления неизвестен.
Однако у большинства видов животных в яйцо проникает только один спермий (физиологическая моноспермия) и существуют специальные механизмы, препятствующие вхождению других. Если у этих видов в яйцо проникают несколько сперматозоидов, то дальнейшее развитие нарушается и зародыш обычно погибает.
В процессе оплодотворения надо различать три этапа: встреча спермия и яйца, проникновение спермия в яйцо и слияние мужского и женского ядер. Разные виды животных сильно различаются по биологии оплодотворения, строению яиц и сперматозоидов и по механизмам, препятствующим полиспермии. Мы обсудим только наиболее хорошо известные данные, полученные на морских ежах, рыбах и амфибиях.
1. Встреча яйца и сперматозоида
У рыб во время нереста самцы и самки обычно находятся в непосредственной близости друг от друга. Самка мечет икру, а самец в это же время выделяет спермии. Нередко это происходит в текущей воде. В таких условиях для оплодотворения необходимо, чтобы встреча гамет осуществилась в течение нескольких секунд. Однако в это время вокруг яиц создается высокая концентрация сперматозоидов, которые недолго, но активно движутся. Вероятность встречи гамет велика, и благодаря этому достигается высокий процент оплодотворения. Но вместе с тем возрастает вероятность того, что одновременно достигнет яйца не один, а много сперматозоидов. Поэтому у костистых рыб оболочка яиц имеет единственное отверстие — микропиле, в которое может войти только один сперматозоид. Проблемы полиспермии у костистых рыб просто нет. У осетровых рыб в оболочке яйца несколько микропиле и такая проблема возникает. Но в полной мере эта проблема «стоит» перед яйцами морского ежа, у них же ее «решение» лучше всего изучено.
У морских ежей половые продукты — яйца и спермии — также выбрасываются прямо в воду, причем самцы и самки могут находиться друг от друга на значительном расстоянии. Вероятность встречи спермии с яйцом в этих условиях не слишком велика. В связи с этим вся поверхность яйца способна реагировать со сперматозоидом, и эта способность сохраняется много часов.
Спермии морских ежей могут двигаться в воде долгое время, иногда более суток. Таким образом, низкая концентрация их вокруг яиц может компенсироваться большей поверхностью яйца, доступной для спермиев, и большим временем готовности гамет к встрече друг с другом. Но у морских ежей самка и самец могут оказаться и вблизи друг друга. Тогда концентрация спермиев вокруг яйца станет настолько высокой, что несколько спермиев смогут достигнуть яйца почти одновременно. В этих условиях для яйца возникает реальная опасность полиспермии.
С первого взгляда кажется очень вероятным, что яйца могут привлекать к себе спермии, выделяя какие-нибудь привлекающие вещества. Однако механизмы такого рода — хемотаксис — были обнаружены только у некоторых гидроидов и у низших растений (папоротники, мхи, оплодотворение которых происходит в воде). Женские половые клетки этих организмов выделяют в воду яблочную кислоту, и их сперматозоиды способны направленно двигаться в сторону более высокой концентрации этого вещества. У животных (кроме гидроидов) встреча яйца и сперматозоида происходит случайно.
Сперматозоиды животных движутся беспорядочно по траектории, напоминающей спираль. Их движение осуществляется благодаря энергии АТФ, синтезируемой митохондриями и преобразованной в механические движения хвоста. В зависимости от вида животного, среды и температуры спермин способны двигаться различное время — от минуты до часов или даже суток. Скорость их поступательного движения также колеблется от 3 до 20 мм/мин. У видов, у которых отложенные в воду яйца дольше сохраняют способность к оплодотворению, спермии также способны двигаться большее время.
Хотя спермии животных не способны к хемотаксису, яйца и сперматозоиды выделяют в воду определенные вещества, влияющие на оплодотворение. Яйца выделяют два типа веществ (их называют гиногамон І и гиногамон ІІ). Первое из них ускоряет движение спермиев, что, по-видимому, должно увеличивать вероятность встречи гамет. Второе вещество вызывает склеивание спермиев друг с другом. Оно не может повлиять на поведение одиночных сперматозоидов, но связывает спермии друг с другом, когда их много, препятствуя тем самым их участию в оплодотворении и уменьшая вероятность полиспермии. Можно предполагать, что той же цели служит выделяемый спермиями андрогамон I — он подавляет действие гиногамона I, замедляя движение сперматозоидов, если они присутствуют в большей концентрации. Таким способом организована защита яиц морского ежа от встречи с избыточным числом спермиев в тех случаях, когда самка и самец в момент выделения гамет оказываются рядом.
Таким образом, надежность осеменения и вместе с тем низкая вероятность встречи со многими спермиями обеспечиваются несколькими обстоятельствами: поведением самца и самки, организацией яйцеклетки и сперматозоида и, наконец, выделяемыми ими веществами. Тем не менее этих условий для защиты от полиспермии недостаточно и главные механизмы защиты действуют при вхождении спермия в яйцо.
2. Проникновение спермия в яйцо
При контакте сперматозоида с яйцом в обеих гаметах происходят сложные процессы, обеспечивающие проникновение спермия в цитоплазму яйца. У многих видов первым на контакт реагирует сперматозоид. Эта реакция называется акросомной и состоит в том, что спермий выбрасывает вперед тонкую акросомную нить или вырост — трубочку, которая возникает в течение нескольких секунд путем выворачивания и вытягивания оболочки акросомы— структуры, которая находится на передней части головки спермия. Коснувшись мембраны яйца, акросомный вырост сливается с ней в одно целое. С этого момента спермий утрачивает подвижность, а его плазматическая мембрана оказывается как бы продолжением мембраны яйца. У многих видов в яйце в месте контакта со спермием поднимается воспринимающий бугорок, который окружает сперматозоид и втягивает его внутрь яйцеклетки.
После контакта со спермием в поверхностном (кортикальном) слое цитоплазмы яйца происходит кортикальная реакция. У неоплодотворенных яиц в этом слое располагаются особые кортикальные гранулы. Реакция состоит в том, что содержимое этих гранул как бы изливается под оболочку яйца, которая при этом отслаивается и отходит от поверхности яйца, часто на значительное расстояние. Кортикальная реакция начинается в месте прикрепления сперматозоида и довольно быстро распространяется по всей поверхности яйца. В маленьком яйце морского ежа при температуре 15–20° это занимает 10–20 с, в большом яйце белуги — 5 мин. Полагают также, что активация яйца приводит к выделению им в воду ионов кислорода (О-), инактивирующих другие сперматозоиды.
Отделение оболочки оплодотворения не только препятствует проникновению новых спермиев, но и как бы оттаскивает от яйцеклетки те, которые уже успели войти в оболочку чуть позже первого. Этот механизм сокращает до нескольких секунд то время, в течение которого второй сперматозоид еще может проникнуть в яйцо. Тем не менее, если поместить яйца морского ежа или осетровых рыб в густую суспензию спермиев, которая не встречается в естественных условиях, часть яиц оказывается полиспермной. Все они в конце концов погибают. Очевидно, механизмы защиты от полиспермии не всемогущи и гарантируют эту защиту только при «разумных» (близких к естественным) концентрациях сперматозоидов.
Сложный механизм оплодотворения, требующий особого поведения партнеров, специальной организации половых клеток, ряда последовательных, друг друга обусловливающих событий на микроскопическом и молекулярном уровнях, вызывает изумление и часто наивный вопрос: неужели все это могло возникнуть в эволюции путем естественного отбора случайных мутаций? Дело в том, что естественный отбор в данном случае чрезвычайно эффективен. Даже небольшие отклонения в организации процесса оплодотворения приведут либо к полиспермии, либо к тому, что яйцеклетка останется неоплодотворенной.
3. События, происходящие внутри яйца
Сперматозоид втягивается в яйцо не целиком. У многих видов животных он оставляет снаружи хвост, а иногда и среднюю часть. Фактически внутрь яйца проникают лишь ядро и центриоли— компоненты аппарата клеточного деления. Вместе со средней частью в яйцо могут попасть и отцовские митохондрии, но никакой роли в последующем развитии они не играют. Вошедшее ядро быстро изменяется. Оно набухает и приобретает вид светлого пузырька. В нем происходит смена белков хроматина: специальные белки головки сперматозоида, обеспечивающие особо компактную укладку ДНК, заменяются на обычные — гистоны и негистоновые белки. Такое ядро называется мужским пронуклеусом.
Одновременно с мужским пронуклеусом образуется и женский. У одних видов (например, у морского ежа) он уже сформирован к моменту оплодотворения. Чаще же зрелое неоплодотворенное яйцо останавливается на стадии первого деления мейоза. Проникновение спермия или искусственная активация запускает этот процесс, и он быстро заканчивается образованием гаплоидного ядра — женского пронуклеуса. Два пронуклеуса сближаются друг с другом. Через некоторое время начинается первое деление дробления. При этом отцовские и материнские хромосомы объединяются в одном, теперь уже диплоидном, ядре.
События, происходящие в яйце в момент оплодотворения и вскоре после него, не ограничиваются защитой от полиспермии, сближением двух пронуклеусов и образованием диплоидной зиготы. Между оплодотворением и первым делением у многих видов происходят значительные и важные перемещения цитоплазмы — ооплазматическая сегрегация, определяющая начальные этапы дифференцировки (см. ниже).
Оплодотворение или только активация яйца вызывает в нем целый ряд биохимических процессов, которые лучше всего изучены у морского ежа. Уже в первые секунды после проникновения сперматозоида в яйцо увеличивается активность многих ферментов, усиливается дыхание, начинается интенсивный синтез белка. Активацию белкового синтеза при оплодотворении исследуют уже много лет, но точный механизм этого явления до сих пор не ясен. В неоплодотворенном яйце мРНК связаны с белком в виде информосом и неактивны. Рибосомы также почти не функционируют. После оплодотворения информосомы, как полагают, распадаются, мРНК присоединяют рибосомы, образуют с ними полирибосомные комплексы и начинают активно транслироваться. Процесс этот начинается сразу, но количество мРНК, вовлекаемых в синтез~белка, нарастает в течение нескольких часов.
В первые часы после оплодотворения синтез РНК в ядрах незначителен и основная масса синтезируемых белков образуется на мРНК, заранее запасенных в оогенезе. Что препятствовало присоединению мРНК к рибосомам и участию их в белковом синтезе до оплодотворения, остается пока неизвестным.
Итак, оплодотворение является если и не началом развития вообще, то, во всяком случае, началом эмбрионального развития. И хотя мейоз и оплодотворение необходимы только для эволюции, к ним привязан целый ряд важных процессов эмбриогенеза: ооплазматическая сегрегация, начало делений дробления, активация многих биохимических процессов. Обеспечению надежности оплодотворения подчинены ряд особенностей организации яйца, все функции и строение сперматозоида, а также многие черты анатомии, физиологии и поведения родительских организмов.
Глава IV С чего начинается развитие. Начало работы генов
При оплодотворении хромосомы обоих родителей только объединяются в одном ядре. Однако функционировать в качестве источника генетической информации они начинают не всегда сразу. Поэтому начало развития зародыша, если рассматривать его как процесс реализации отцовской и материнской наследственности, может быть, правильнее считать не с момента оплодотворения, а позже.
Молекулярным проявлением функции генов, как мы знаем, является их транскрипция, т. е. синтез РНК. У видов, яйцеклетки которых невелики, синтез РНК можно обнаружить довольно рано — уже после первых делений яйца. Ho у рыб и амфибий, имеющих крупные яйца, транскрипция обнаруживается только тогда, когда число клеток достигает нескольких тысяч. У всех животных РНК начинает синтезироваться не позже бластулы и первый процесс формообразования всегда происходит под контролем собственного генома зародыша.
Следует различать саму работу генов (транскрипцию мРНК на ДНК) и проявление этой работы, т. е. появление тех или иных признаков. В генетике такое проявление называют экспрессией генов. В простом случае экспрессия выражается в синтезе какого-либо белка, а в более сложных — в таких проявлениях развития, как образование органов, т. е. морфогенез. Между собственно работой генов, т. е. транскрипцией, и их экспрессией должно пройти некоторое время. Иногда это минуты, но нередко и часы, и тогда становится небезразличным, что мы примем за точное время начала работы генов — начало транскрипции или начало экспрессии.
Ну и наконец, нам, вероятно, следует договориться, включение каких генов мы условимся считать началом генетического контроля и началом развития. Надо ли считать таким началом синтез рРНК или тРНК? Они ведь определяют не само развитие, а лишь образование аппарата синтеза белка. Можно ли считать таким началом транскрипцию гистоновых мРНК? Ведь гистоны тоже не определяют развитие и нужны лишь для формирования новых хромосом при делении клеток. Или же нам считать за начало развития лишь включение тех генов, которые контролируют само развитие, т, е, морфогенез? На эти вопросы, очевидно, не может быть строгого ответа. Просто, обсуждая результаты опытов, мы будем каждый раз оговаривать, о чем идет речь.
1. До начала работы генов
В оплодотворенном яйце, зиготе, синтез РНК редко начинается сразу, а если и начинается, то играет малоспецифическую роль, т. е. определяет не собственно процессы развития, а синтез рРНК, тРНК, образование гистонов и т. д., которые необходимы для построения хромосом и создания белоксинтезирующего аппарата. Начало ядерной функции, определяющей развитие, или морфогенез (отсюда — морфогенетическая функция ядер), очевидно, зависит от многих обстоятельств, и прежде всего связано с размерами яйца: у всех видов, имеющих «маленькие» яйца (30—200 мкм в диаметре), гены начинают работать раньше, а у видов с «большими» яйцами (от 0,3 мм и выше), как у рыб и амфибий, — значительно позже. Птицы в этом отношении изучены хуже.
Причины таких различий легко объяснить. РНК, синтезированная в одном или даже в нескольких десятках ядер, в течение первых часов раннего развития не может оказать существенное влияние и изменить синтез белка в огромных объемах цитоплазмы большого яйца. И только на стадии многих сотен или тысячи клеток, когда каждое ядро будет окружено небольшим участком цитоплазмы, синтез новых РНК сможет заметно повлиять на состав синтезируемых белков в данной клетке.
Определенную роль играет также и то, что на самых ранних стадиях развития (во время быстрых делений яйца) значительную часть клеточного цикла занимают репликация ДНК и митоз. Во время дробления яиц рыб и амфибий синтез ДНК происходит всего за 15 мин, но и весь клеточный цикл не превышает 30 мин. У дрозофилы же первые деления ядер происходят еще быстрее — каждые 9 мин. Это означает, что в каждый момент времени значительные участки ДНК заняты репликацией, что, вероятно, затрудняет транскрипцию.
Есть и другая, более важная причина, по которой синтез мРНК на самых ранних стадиях не может играть специфическую роль в развитии. Во время первых делений дробления малочисленные ядра еще не занимают в яйце окончательную позицию. Только после 10–15 митозов ядра будут распределены по яйцу и каждое из них будет окружено своим, отличающимся от других участком цитоплазмы, вместе с которым оно образует эмбриональную клетку, способную к дальнейшему развитию. Эти участки отличаются не только своим местоположением в яйце, они могут отличаться и по химическому составу, так как цитоплазма яиц у многих животных неоднородна.
Вот, например, как происходит раннее развитие у насекомых, и прежде всего у хорошо изученной дрозофилы. Первые семь-восемь делений ядер происходят в центре яйца без деления цитоплазмы, и в это время только ядра будущих половых клеток обособляются от остальных и перемещаются к заднему полюсу яйца. После того как после восьми делений число ядер достигнет 256, они, продолжая делиться, перемещаются из центра на периферию и распределяются в тонком слое цитоплазмы под яйцевой оболочкой. Там они образуют клетки, составляющие бластодерму. Только после этого темп делений замедляется, начинается синтез РНК и происходит детерминация — предопределение основных частей будущей личинки и мухи. Очевидно, что, пока ядра находились в общей для них цитоплазме в центре яйца, они ничем не отличались друг от друга и, следовательно, не могли синтезировать разные РНК. Только заняв различные места в яйце, попав в окружение своей цитоплазмы, они «узнали», какие именно гены в них должны работать. Иначе говоря, ядра получили от цитоплазмы, как сейчас говорят, «позиционную информацию». После этого они начинают синтезировать те виды мРНК, которые необходимы в их новой позиции.
Вместе с тем синтез белков в яйце достаточно интенсивен с самого начала развития: у одних видов он не прекращается со времени оогенеза, у других (например, у морского ежа) синтез белка сразу после оплодотворения возрастает в десятки раз. Для обеспечения этого процесса и происходит в оогенезе создание мощного белоксинтезирующего аппарата и накопление мРНК, часть из которых используется с самого начала развития, а часть вступает в действие наиболее поздних стадиях. Среди этих материнских мРНК, вероятно, отсутствуют те, которые специфически необходимы для таких процессов развития, как гаструляция или последующие этапы морфогенеза. Ведь в ходе этих событий разные клетки ведут себя по-разному, следовательно, они должны отличаться по некоторым белкам (и соответственно по мРНК). Вот тут уже, даже несколько раньше и необходима специфическая морфогенетическая функция ядер — разная в разных частях зародыша.
2. Как можно судить о начале работы генов
Начало работы генов, точнее, их экспрессию можно заметить по проявлению отцовских признаков, если эти признаки отличаются от материнских. Действительно, когда у зародыша появляются черты, присущие отцовскому организму, но отсутствующие у материнского, не остается сомнений, что отцовские гены начали работать (одновременно с ними обычно начинают работать и гены в хромосомах, полученных от матери). Трудность тут состоит в том, что обычно признаки, отличающие двух животных одного вида (например, окраска), проявляются только на поздних стадиях, когда мы и без того знаем, что гены давно уже начали работать.
Эту трудность можно частично преодолеть, если использовать межвидовые, межродовые и даже межсемейственные гибриды, у которых отличия родительских организмов были бы достаточно велики и могли бы проявляться на более ранних стадиях. Получение отдаленных гибридов хорошо удается у морских ежей, у рыб, хуже — у птиц и почему-то совсем плохо у амфибий. Во всех опытах, проведенных на гибридах, было показано, что их развитие начинается неотличимо от развития материнского организма. Этого и следовало ожидать: ведь на самых ранних стадиях гены, в том числе и отцовские, еще не работают. Отцовские признаки проявляются обычно позже — у более дифференцированных зародышей или даже только у ранней личинки.
Этот метод имеет тот очевидный недостаток, что эмбриональное развитие даже довольно далеких видов обычно протекает очень похоже и на ранних стадиях бывает трудно отыскать видовые или родовые различия. Кроме этого, при отдаленной гибридизации нет полной уверенности в том, что гены, находящиеся в различных (отцовских и материнских) хромосомах, будут включаться одновременно. Поэтому более надежные данные о начале функционирования генов были получены при изучении летальных гибридов.
При скрещивании далеких видов, даже если оплодотворение и произошло, дальнейшее развитие часто протекает ненормально и в результате заканчивается ранней или поздней гибелью. Такие гибриды называются летальными. При изучении многих летальных гибридов рыб и особенно амфибий было показано, что их развитие останавливается на одной и той же ранней стадии — поздней бластуле. Через определенное время гибридные зародыши, так и не преодолев эту стадию, погибают, очевидно, из-за каких-то несоответствий в работе отцовских генов в чужой им материнской цитоплазме. Важно, что, исследовав десятки гибридных комбинаций, никому не удалось обнаружить гибриды рыб или амфибий, у которых развитие останавливалось бы ранее поздней бластулы. На этой стадии гены рыб и амфибий определенно начинают работать. Ho выяснить в таких опытах, не произошла ли активация генов раньше, невозможно. Дело в том, что остановка развития — это типичное проявление морфогенетической функции ядер, т. е. экспрессия их генов. Очевидно, что их функционирование начинается несколько раньше остановки развития.
Рассмотрим в этой связи наши опыты с гибридами рыб. Если яйца вьюна оплодотворить спермиями рыб из других родов и семейств, но того же отряда карпообразных, то их развитие вначале идет нормально, но потом все более отклоняется от нормы. Тем не менее из таких гибридных зародышей выклевываются подвижные, хотя и уродливые личинки, которые погибают через несколько дней. Эти опыты ничего не могут сказать о том, когда происходит активация ядер зародыша, так как, раннее развитие таких гибридов внешне идет нормально и влияние отцовских генов обнаружить трудно. Однако эти эксперименты можно модифицировать. Если до оплодотворения яйца вьюна облучить высокой дозой рентгеновской радиации (10–20 тыс. рад), то их ядра будут разрушены, в то время как цитоплазма практически не пострадает. При оплодотворении таких яиц спермиями своего вида образуются андрогенетические (андрос — мужской) гаплоидные зародыши. Они содержат материнскую цитоплазму и отцовское гаплоидное ядро. Такие зародыши будут развиваться нормально, хотя все личинки в конце концов погибнут, так как гаплоиды нежизнеспособны.
Иной результат получается, если облученные, т. е. фактические безъядерные, яйца вьюна оплодотворить спермиями других видов рыб. При этом образуются андрогенетические гаплоидные гибриды, у которых цитоплазма яйца принадлежит вьюну, а гаплоидные ядра — другому, отцовскому виду. Мы использовали спермин золотой рыбки, барбуса, данио рерио и других аквариумных рыб. И во всех этих случаях развитие доходило только до стадии поздней бластулы, останавливалось и через некоторое время зародыши погибали. Это означает, что гены одного вида не способны обеспечить развитие в чужой цитоплазме. Однако время гибели разных гибридов оказалось неодинаковым: одни погибали почти сразу же после остановки развития, другие жили еще несколько часов. Для каждой гибридной комбинации было свое характерное время выживания. Так как цитоплазма у всех этих зародышей была одна и та же, то очевидно, что время их жизни зависело от активности чужеродных ядер.
Опыты показали, что чужеродные гены, оказавшись в цитоплазме вьюна, все же функционируют и начинают свою работу не позже стадии поздней бластулы.
Есть и более простой способ узнать о начале экспрессии генов зародыша. Если облучить яйцо рентгеновыми лучами уже после оплодотворения, то убиты будут оба ядра — и мужское и женское. Можно также оплодотворить облученное яйцо облученными спермиями. Результат был везде совершенно одинаков: развитие таких безъядерных зародышей всегда останавливалось на стадии поздней бластулы, перед самой гаструляцией.
Очевидно, что развитие безъядерного яйца может происходить только до той стадии, до какой оно было обеспечено запасом белков и мРНК, синтезированных в оогенезе. Остановка развития таких зародышей, по-видимому, наступит как раз тогда, когда возникает необходимость в новых белках, синтезированных на новых мРНК, транскрибированных не в оогенезе, а уже в собственных ядрах зародыша. Эти результаты не оставляют сомнений в том, что именно гаструляция является первым проявлением активности генов у рыб и амфибий.
Иные результаты были получены, однако, при инактивации ядер у других типов и классов животных. Кроме действия высоких доз радиации, инактивация генетического аппарата может быть эффективно достигнута действием специфических веществ, подавляющих транскрипцию, — актиномицина D или а-аманитина. Подавление транскрипции в яйцах морского ежа, вызванное этими веществами или радиацией, приводит к остановке развития на более ранних стадиях, чем у рыб и амфибий, — уже во время ранней — средней бластулы. У представителя моллюсков — большого прудовика развитие останавливается на стадии 16 клеток, у круглого червя аскариды — на стадии двух — четырех бластомеров. Опыты, проведенные на зародышах мыши, показали, что ингибиторы синтеза РНК или большие нехватки хромосом приводят
у млекопитающих к очень ранней остановке развития — после двух первых делений.
Перечисленные примеры показывают, что экспрессия генома зародыша в каждой группе животных начинается на своей стадии. В маленьких яйцах (моллюски, круглые черви, млекопитающие) это всегда более ранние стадии, чем в больших (амфибии, рыбы).
Эти опыты, как мы уже говорили, позволяют обнаружить только начало проявления морфогенетической функции ядер. Можно ли выяснить, на какой именно стадии начинается само функционирование генома? Ведь эти два события могут разделять минуты или даже часы. Метод для решения этой задачи был предложен нами уже много лет назад. И хотя с тех пор появились новые, более прямые подходы, этот метод сохранил свое значение и используется в некоторых работах. Опыты были проведены на яйцах вьюна. Здесь хочется сказать несколько слов об этом прекрасном объекте. Роль объекта к биологии может быть очень важна. Вспомним, что законы генетики были открыты на горохе и на дрозофиле, и трудно сказать, па сколько лет задержалось бы развитие этой пауки, если бы выбор объектов оказался менее удачен.
Классическим объектом эмбриологии всегда считалась лягушка. Сейчас особенно широко используют африканскую шпорцевую лягушку — ксенопуса. Развитие экспериментальной эмбриологии рыб явно отстает и, как нам кажется, во многом из-за того, что не было найдено подходящего объекта.
Когда в нашей лаборатории были начаты первые эксперименты на зародышах вьюна, мы убедились в его необыкновенных достоинствах. Возможность получать и хранить этих неприхотливых рыб круглый год и круглый год получать от них икру, прозрачность ее оболочек, разработанный нами метод отделять зародыш от желтка и культивировать в солевой среде, наконец, возможность использовать таких зародышей для изотопных исследований — вот лишь краткий перечень достоинств вьюна как эмбриологического объекта. Поэтому вьюн сейчас широко используется в различных исследованиях в нашей стране и в странах Восточной Европы, т. е. в тех странах, где он обитает.
Если высокой дозой рентгеновской радиации (20 тыс. рад) инактивировать ядра яиц вьюна тотчас после оплодотворения, то развитие, как мы уже знаем, пойдет внешне нормально только до стадии поздней бластулы, на которой оно остановится. У вьюна при температуре 21 °C стадия поздней бластулы наступает через 9 ч после оплодотворения, и эту стадию удобно так и называть — «стадия 9 часов», всегда имея в виду температуру 21 °C. Если инактивацию ядер произвести через 1 или через 2 ч после оплодотворения, все произойдет точно так же: развитие блокируется на стадии 9 часов, т. е. на поздней бластуле. Это наступит соответственно через 8 или через 7 ч после инактивации ядер. Даже если мы облучим зародышей уже на стадии ранней или средней бластулы, т. е. после 4 или 6 ч нормального развития, остановка все равно произойдет на стадии 9 часов, т. е. через 5 или через 3 ч после облучения. Это означает, что запас белков и мРНК, синтезированных в оогенезе вьюна, достаточен на первые 9 ч развития и этот запас не возрастает за первые шесть часов, а как бы постепенно тратится. Имел ли зародыш неповрежденные ядра только 1 или все первые 6 ч развития, никакой роли не играет: результат будет все тот же — остановка на стадии 9 часов.
Результат этих опытов может быть истолкован только одним образом: в первые 6 ч развития ядра зародыша не осуществляют морфогенетической функции. В это время они активно делятся и соответственно в них синтезируется ДНК. В них в принципе могло бы даже синтезироваться немного РНК, но такие ее виды, которые морфогенеза (конкретно гаструляции) не определяют.
Иной результат получается, если зародыш облучить рентгеновской радиацией и инактивировать в нем ядра в конце стадии средней бластулы, через семь часов после начала развития. Такие зародыши явно начинают гаструляцию и останавливаются на стадии ранней гаструлы, приблизительно эквивалентной 12–13 ч развития. Инактивация ядер через 8 ч после оплодотворения блокирует развитие на еще более поздней стадии —16–17 ч, когда гаструляция близка к завершению. Наконец, действие радиации на стадии 9 часов останавливает развитие уже после завершения гаструляции. Следовательно, позволив ядрам работать в течение всего 3 ч (от 6 до 9 ч), мы как бы предопределили последующее развитие на 8–9 ч вперед.
Эти опыты показали, что морфогенетическая функция ядер начинает осуществляться со стадии средней бластулы или, точнее, через 6 ч после оплодотворения. Это на 3 ч раньше, чем ее первое проявление (поздняя бластула — 9 ч). Все другие методы, о которых речь шла выше, действительно не позволяли судить о начале работы генов.
Точнее всего определить момент начала ядерной активности можно по начавшемуся синтезу РНК. Этот метод не только дает возможность установить, на какой стадии включаются гены зародыша, но и позволяет узнать, какие именно РНК образуются — рРНК, тРНК или мРНК. Более того, в некоторых случаях мы можем сказать, входят ли в состав вновь синтезированных мРНК интересующие нас индивидуальные мРНК, например гистоновые, т. е. мы можем узнать, какие гены начали работать. Однако нам неизвестно, какие мРНК кодируют белки, определяющие морфогенез. Поэтому судить о начале работы генов, определяющих морфогенез, мы можем пока только при помощи метода инактивации ядер на последовательных стадиях развития.
3. Включение индивидуальных генов
Когда мы до сих пор говорили о начале функционирования ядер, или, конкретно, о начале синтеза РНК, речь, естественно, шла об одновременном включении сотен, если не тысяч генов, — включение одного или десяти генов мы просто бы не заметили. По-видимому, в раннем развитии существует общий механизм, включающий одновременно транскрипцию сразу в очень многих точках хромосом. Однако должна существовать и другая регуляция, определяющая, почему в число этих тысяч генов попал именно данный ген, а не соседний. По другой развиваемой сейчас гипотезе, которую мы подробно обсудим в одной из последующих глав, включаются и работают, может быть, почти все гены, но некоторые из них транскрибируются намного интенсивнее, и, помимо этого, процессинг затрагивает только нужные про-мРНК, а остальные разрушаются и даже не выходят из ядра. Пока же мы будем обсуждать эту проблему в «классических» представлениях о включении и выключении генов.
Включение отдельных (индивидуальных) генов происходит не только в раннем развитии, но и на всем протяжении клеточной дифференцировки. Этот процесс является одной из главных проблем и для молекулярной биологии, и для биологии развития. Хорошей моделью для его исследования может служить включение в эмбриональном развитии отдельных генов, кодирующих тот или иной фермент, о чем мы можем судить по появлению самого фермента.
Если этот фермент впервые появляется в развитии зародыша, то его появление, как правило, происходит лишь немногим позже включения соответствующего гена. Так, например, перед началом движений зародыша в нем начинается синтез холинэстеразы — фермента, важного для передачи на мышцу нервного импульса. До начала движений зародыша этого фермента почти нет. При дифференцировке поджелудочной железы в ней появляются отсутствующие до этого пищеварительные ферменты. У зародышей змей еще в яйце формируются ядовитые железы и в них начинают накапливаться особые ферменты змеиного ядра. В свежеотложенном яйце их, естественно, не было.
Хотя конкретные механизмы включения таких генов неизвестны, сам факт их включения на той, а не на другой стадии кажется достаточно понятным. Дифференцировка, например, поджелудочной железы на генетическом уровне и состоит в последовательном включении генов, сначала определяющих формообразование железы, а затем синтез в ней пищеварительных ферментов. В этом смысле менее понятно, а потому более интересно включение генов для тех ферментов, которые присутствуют во всех клетках и на всех стадиях развития.
Действительно, в каждой клетке имеется относительно немного видов особенных ферментов, характерных только для данного типа клеток. Известный биолог Эфрусси назвал такие белки белками «роскоши», имея в виду, что сама клетка могла бы без этих белков и обойтись. Ho вместе с тем в клетках присутствует большое количество (порядка тысячи) ферментов, необходимых всем видам клеток. Это так называемые «хаус-кипинг»-ферменты, т. е. ферменты «домашнего хозяйства». Они определяют и контролируют такие общеклеточные процессы, как дыхание и вообще энергетический обмен, проницаемость клеточных мембран, синтез белка и нуклеиновых кислот, образование различных биологически важных веществ и т. д. Естественно, что все эти «хаус-кипинг»-ферменты действуют и накапливаются в ооците, имеются в яйце и во всех клетках зародыша, присутствуют в тканях взрослого организма. Их концентрация и количественные соотношения могут меняться в зависимости от стадии развития и вида ткани, хотя в ходе раннего эмбриогенеза многие из них поддерживаются на довольно постоянном уровне.
Время жизни каждого вида фермента различно и варьирует от десятков минут до нескольких дней. Поэтому они должны почти все время синтезироваться для того, чтобы в клетке поддерживалось постоянное количество ферментных молекул. Для этого в клетке должны постоянно присутствовать мРНК для этих ферментов, а так как срок жизни мРНК также ограничен, то должны работать гены, пополняющие их количество.
Эта равновесная ситуация (транскрипция и распад мРНК, трансляция и распад ферментных белков) нарушается в яйце и в самом раннем эмбриональном развитии, когда работа генов прерывается, а зародыш содержит накопленный в оогенезе запас самих ферментных белков, а также мРНК для синтеза этих белков. Очевидно, что и эти ферменты и мРНК такие же, как в материнском организме, — ведь они были созданы благодаря активности генов ооцита. Неизвестно, содержатся ли в яйце мРНК для всех видов белков, присутствующих в яйце. Поэтому то или иное время эмбриональные клетки живут за счет накопленного фермента, причем его убыль может некоторое время пополняться благодаря трансляции на запасенной мРНК. Ho в какой-то момент развития должны включиться собственные гены зародыша (на отцовской и материнской хромосомах) и появиться новосинтезированные мРНК, а на них должен начать транслироваться новый (точно такой же или аналогичный) фермент зародыша, который постепенно вытесняет чисто материнский фермент.
С чем связано включение генов данного «хаус-киппинг»-фермента на определенной стадии развития и какие механизмы это включение определяют? Это пока неясно, хотя для многих ферментов уже известно, когда в зародыше включаются гены, которые их контролируют. Судить о времени включения такого гена просто по проявлению ферментной активности нельзя, так как «хаус-кипинг»-фермент присутствует и активен на всех стадиях развития. О том, когда материнский фермент заменяется ферментом зародыша, можно судить по тому, когда впервые появляется отцовский фермент. Для этого можно использовать гибриды. У близких видов, которые хорошо скрещиваются, и даже у разных особей внутри вида одни и те же по названию и действию ферменты могут немного различаться.
Чаще всего материнский и отцовский ферменты различают по электрофоретической подвижности, т. е. по скорости движения молекул фермента в электрическом поле.
Оказалось, что многие ферменты присутствуют в клетках в нескольких похожих вариантах, их называют изоферментами и различают также по электрофоретической подвижности. Скрещивая два организма, отличающиеся по изоферментам, можно обнаружить, когда в ходе развития впервые появляется отцовский изофермент. Это означает, что включились и проявились отцовские гены данного фермента.
Скрещивание внутри одного вида и использование индивидуальных различий в изоферментах предпочтительны потому, что в этом случае есть уверенность, что оба гена — отцовский и материнский — включаются одновременно. Если же речь идет о межвидовых скрещиваниях или о более отдаленных гибридах, то полной уверенности в этом нет, так как у разных видов стадии, на которых включается тот или иной ген, могут несколько различаться.
Однако некоторые ферменты, принадлежащие к разным видам, электрофоретически не различаются. Многие ферменты трудно или даже невозможно подвергнуть электрофорезу или не удается потом выявить их место в геле с помощью цветной реакции, например такой важный митохондриальный фермент дыхания, как цитохромоксидаза. В составе митохондрий подвергнуть его электрофорезу, естественно, нельзя, а при выделении из них он сразу теряет активность. Для таких случаев в совместной работе нашей лаборатории биохимической эмбриологии (Москва, Институт биологии развития) и лаборатории сравнительной цитологии (Ленинград, Институт цитологии) было предложено использовать различия в теплоустойчивости ферментов.
Действительно, как показали ленинградские ученые В. Я. Александров и Б. П. Ушаков, у хладнокровных животных, обитающих в теплом климате, устойчивость белков к высоким температурам обычно оказывается выше, чем устойчивость аналогичных белков у видов, обитающих в холодном климате. Теплоустойчивость легко измерить, если образцы экстракта белков нагревать при разных температурах в течение определенного времени и потом смотреть процент активности фермента, которая после такого прогрева сохранилась. Температура, при которой сохраняется половина активности фермента, и есть показатель теплоустойчивости.
Первоначально нами совместно с А. А. Кусакиной (Ленинград) было показано, что один из ферментов углеводного обмена — альдолаза у вьюна имеет теплоустойчивость на 5–6° ниже, чем у тропических аквариумных рыб, которых можно скрещивать с вьюном (данио, барбус, разбора и др.). У гибрида вьюна (♀) с данио (♂) (яйца вьюна, сперма данио) на ранних стадиях теплоустойчивость альдолазы была такой же, как у вьюна. Так продолжалось до стадии 23 часа (появление зачатков первых органов), когда теплоустойчивость внезапно стала повышаться. В течение нескольких часов она поднялась на 2,5–3° и далее осталась на том же уровне. Это означало, что именно со стадии 23 часа начинается проявление отцовского гена альдолазы и в результате у гибридов возникает смесь двух ферментов — отцовского и материнского. Когда мы взяли реципрокных гибридных зародышей данио (♀) × вьюн (♂), их теплоустойчивость сначала была высокой, как у данио, а затем на той же стадии 23 часа стала снижаться и также достигла промежуточного значения.
В литературе накопилось довольно много данных о начале экспрессии генов, кодирующих различные ферменты. Такие данные получены в основном методом электрофореза на гибридах лягушек, двух видов форели, курицы и перепела и др. В нашей лаборатории при использовании обоих методов — по электрофоретической подвижности и по теплоустойчивости — на гибридах вьюна и других рыб получены данные о начале экспрессии генов, кодирующих несколько ферментов.
Оказалось, что ни у одного из исследованных нами ферментов гены не начинают проявлять свою активность тогда, когда начинается морфогенетическая функция генов, т. е. на стадии бластулы. Самое раннее проявление отцовских генов было обнаружено для цитохромоксидазы: повышение ее теплоустойчивости у гибридов вьюн × данио было замечено на стадии поздней гаструлы (14 ч развития при 21 °C). Однако некоторые гены, кодирующие такие важные ферменты, как глюкозо-6-фосфатдегидро- геназу или эстеразу, впервые начинают проявляться только в конце эмбрионального развития, а лактатдегидрогеназа еще позже — у ранней личинки.
Во многих случаях, хотя и не во всех, начало экспрессии генов совпадает с началом повышения общей активности фермента. Для эстеразы не только была обнаружена стадия, на которой начинается образование фермента, кодируемого генами зародыша, но и показано, как постепенно после этого исчезает материнский фермент. Однако почему одни ферменты начинают заменяться новыми, кодируемыми генами зародыша относительно рано, а другие — гораздо позже, остается непонятным.
Может быть, это связано со временем жизни самих белков и их мРНК, запасенных в оогенезе. Может быть, на той или иной стадии один изофермент должен заменяться другим. Может быть, быстрый рост отдельных органов зародыша требует соответствующего синтеза ферментов в клетках этого органа. Наконец, рост всего зародыша или личинки предполагает и увеличение количества фермента. Во всех этих случаях может оказаться необходимым появление нового фермента, а для этого необходимо включение собственных генов зародыша.
Подводя итог всей главе, можно сказать, что включение генетического аппарата на определенной стадии развития или включение отдельных генов требует участия специального механизма регуляции. В этом механизме должен быть какой-то датчик стадии развития, запускающий всю цепь событий, в конце которой много генов или один из них начинает транскрибироваться.
В трех последовательных главах мы рассмотрели три «начала» развития — от начала оогенеза, от момента оплодотворения и от начала работы генов зародыша — и убедились, что существенно не то, что называть началом развития, а те последовательно наступающие процессы, которые и составляют раннее развитие. Все они проходят под генетическим контролем. Разница между ними лишь в том, чьи это гены и когда они функционируют. В оогенезе это непосредственный эффект действия материнских генов; при созревании яйца, при оплодотворении и на начальных стадиях развития это отдаленный эффект тех же материнских генов, но опосредованный через запасенные в оогенезе мРНК и белки. Наконец, все последующее развитие происходит снова под непосредственным контролем генов, но уже генов зародыша.
Глава V Как возникают различия между клетками
Проблема возникновения различий между клетками имеет длительную историю: попытки ее экспериментального решения предпринимались еще в конце прошлого столетия, а теоретические споры преформистов и эпигенетиков восходят к XVII в. Сейчас уже стали известны некоторые важные механизмы, ответственные за дифференцировку клеток зародыша в разных направлениях. Однако до сих пор в этой области больше неясного, а многое еще остается совершенно непонятным.
Этот раздел биологии развития находится почти вне всякой связи с генетикой и молекулярной биологией, а существующие гипотезы носят пока умозрительный характер. Поэтому здесь во многом сохранились чисто феноменологические понятия, т. е. используемые термины являются лишь условными обозначениями того или иного явления. В связи с этим нам кажется правильным начать эту главу с общих представлений, без которых трудно войти в мир экспериментальной эмбриологии, или, как ее еще называли, механики развития.
Различия в размерах и морфологии клеток млекопитающих
Все клетки нарисованы при одинаковом увеличении: 1 — многоядерная «клетка» — волокно поперечно-полосатой мышцы; 2 — шванновская клетка, окружающая аксон нейрона; 3 — большая нервная клетка головного мозга; 4 — клетка Пуркинье из мозжечка; 5 — коллагенообразующая клетка соединительной ткани; 6 — клетки гладкой мускулатуры; 7 — палочки и колбочки сетчатки глаза; 8 — клетки реснитчатого эпителия; 9 — полиморфно-ядерные нейтрофилы — один из типов «белой» крови; 10 — антителообразующий лимфоцит; 11 — поперечный срез капилляра, образованного одной клеткой эндотелия, в просвете видны эритроциты; 12 — эритроциты; 13 — клетка хряща; 14 — клетка печени; 15 — слизистая клетка желудка; 16 — жировая клетка соединительной ткани, почти целиком заполненная жиром; 17 — ооцит и окружающие его фолликулярные клетки; 18 — сперматозоид
1. Что происходит при возникновении различий
В 20-е годы немецкий ученый Фогт сумел проследить судьбу разных частей яйца в развитии. Для этого он окрашивал небольшие участки бластулы амфибий безвредными витальными красителями и наблюдал движение этих участков во время гаструляции и их последующую судьбу. Так была составлена нанесенная на рисунок бластулы карта презумптивных зачатков, т. е. обозначены те клеточные территории, которые при нормальном развитии станут теми или иными зачатками, а потом и органами. Важно подчеркнуть, что презумптивная судьба клеток реализуется только при нормальном развитии. В эксперименте же их судьбу на этой стадии еще нетрудно изменить. Задача биологии развития во многом и заключается в том, чтобы выяснить во всех подробностях, как происходит реализация этой карты. Или, иначе, каким образом расположенные рядом районы, состоящие на стадии бластулы фактически из одинаковых клеток, становятся зачатками разных органов, клетки которых по мере развития все больше отличаются друг от друга.
Эта задача складывается из двух других в значительной степени самостоятельных проблем, хотя на первый взгляд их трудно разграничить. Первую проблему можно сформулировать так: как происходит дифференциация зародыша, т. е. каким образом он распадается на группы неодинаковых клеток и как достигается строго определенное расположение сначала зачатков, а затем и органов развивающегося организма. Вторая проблема состоит в попытке понять, как происходит специализация клеток, т. е. последовательные изменений, превращающие эмбриональную клетку или ее потомков в высокоспециализированные клетки взрослого организма характерного строения и с узко ограниченной функцией.
Оба явления — дифференциацию и специализацию — в принципе можно представить независимо друг от друга. Можно вообразить искусственную ситуацию, когда возникнет правильное расположение зачатков и произойдет морфогенез органов, хотя клетки их внешне почти не будут отличаться друг от друга (в действительности этого никогда не бывает). А можно представить и обратную картину — беспорядочное скопление высокодифференцированных клеток: нервных, мышечных, эпителия кожи и т. д. (нечто похожее встречается в особых опухолях — тератомах).
В этой главе речь идет только о первой проблеме, т. е. о том, как происходит закономерное и прогрессирующее разделение зародыша на все большее число составляющих его зачатков различных органов. Мы будем здесь больше говорить о том, как возникают различия между клетками, и меньше о том, в чем эти различия состоят.
Напомним элементарные основы эмбриологии амфибий. В результате сложных перемещений из верхней (анимальной) части бластулы образуется эктодерма, из нижней (вегетативной) — энтодерма, а из промежуточной, или экваториальной, зоны — мезодерма. В конце гаструляции все эти три зародышевых листка располагаются концентрическими слоями: эктодерма снаружи, энтодерма внутри, мезодерма между ними. Из части эктодермы на спинной стороне зародыша образуется нервная пластинка, которая свертывается в нервную трубку. Передняя ее часть образует головной мозг и глаза, а задняя — спинной мозг. Остальная эктодерма образует в основном эпителий кожи. Из энтодермы развиваются кишечник и его производные — печень, легкие, поджелудочная железа. Мезодерма дифференцируется наиболее сложно: ее центральная часть, которая при гаструляции оказывается на спинной стороне, образует хорду и спинную мускулатуру, далее по обе стороны от хорды располагаются части мезодермы, из которых образуются соединительная ткань, хрящ и кости, еще ниже (ближе к брюшной стороне) возникают почки, а на брюшной стороне — сердце, сосуды и клетки крови. Таким образом, в раннем эмбриогенезе зародыш сначала разделяется на три части, а затем каждая из них тем или иным путем дифференцируется еще на ряд зачатков. На более поздних стадиях каждый из этих зачатков образует органы и дифференцируется еще на ряд тканей и клеточных типов,
У других позвоночных гаструляция происходит иначе, но в итоге создается похожий трехслойный эмбрион, зародышевые листки которого дифференцируются приблизительно так же, как у амфибий. Особенностью позвоночных является то, что уже бластула состоит из тысяч клеток и все зачатки даже в начале дифференцировки состоят из очень многих клеток,
У беспозвоночных, у которых также различают и бластулу и гаструляцию, число клеток обычно меньше и дифференциация зародыша нередко происходит на очень ранних стадиях, когда отдельные зачатки состоят из немногих клеток или даже представлены одним бластомером. Уже на стадии 50—100 клеток такой зародыш представляет собой как бы мозаику, у которой судьба каждой клетки уже точно определена. Поэтому развитие многих беспозвоночных, хотя и не всех, называют мозаичным. Этот термин обычно противопоставляют другому — регуляционное развитие. Мозаичным называют такое развитие, когда различия между частями зародыша с самого начала практически необратимы. При регуляционном развитии на ранних стадиях (бластула — гаструла) судьба клеток еще может быть искусственно изменена. Если ранний зародыш лягушки на стадии двух клеток или на стадии тысячи клеток разделить на две части, то каждая из частей обычно способна образовать целый зародыш, только меньшего размера. Если на стадии бластулы удалить значительную часть клеток эктодермы (т. е. на анимальном полюсе), то зародыш все равно будет вполне пропорционален. Очевидно, что в обоих этих экспериментах многие клетки должны дифференцироваться не в то, чем бы они стали, если бы в их судьбу не вмешался экспериментатор. Иными словами, развитие части (половинки или большей части) может регулироваться до целого. Такой способностью к регуляционному развитию обладают в большей или меньшей степени зародыши амфибий, рыб, иглокожих, млекопитающих и некоторых других групп животных.
Различия мозаичного и регуляционного типов развития в определенном смысле количественные: в первом случае судьба клеток необратимо определяется раньше, чем во втором. Ho эти количественные различия говорят и о качественной разнице: у мозаичных яиц большую роль играют одни механизмы развития, а у регуляционных — другие.
При описании клеточной дифференцировки используют два важных понятия — «компетенция» и «детерминация». Компетенцией называют способность клеток при соответствующих внешних воздействиях дифференцироваться в нескольких (обычно немногих) направлениях. Классическим примером компетенции является способность эктодермы под влиянием зачатка хорды и прилегающей к ней мезодермы (хордомезодермы) дифференцироваться в нервную ткань, а без такого влияния — в эпидермис кожи. Хвост головастика лягушки компетентен к тому, чтобы резорбироваться (рассосаться), но эта компетенция реализуется только под действием гормонов, выделяемых щитовидной железой. Другие части головастика, хотя и получают ту же дозу гормона, не резорбируются, так как имеют другую компетенцию (см. следующую главу). Стволовые клетки крови в костном мозгу или селезенке взрослого организма компетентны к дифференцировке по меньшей мере в трех направлениях: в красные клетки крови — эритроциты, в белые клетки — различные лейкоциты и в мегакариоциты.
В эмбриогенезе компетенция быстро меняется во времени: будущая эктодерма (анимальная часть бластулы) компетентна к дифференцировке почти в любом направлении (тотипотентна), на стадии гаструлы она сохраняет компетенцию к дифференцировке в эпидермис и нервную систему, еще немного позже компетенция к развитию нервной ткани теряется. Компетенция энтодермы, напротив, с самого начала очень узка и ограниченна. В ходе дифференцировки одна компетенция закономерно сменяет другую: собственно каждый этап дифференцировки это приобретение не только некоторых новых свойств, но и новой компетенции. И только достигнув окончательного высокоспециализированного состояния — терминальной дифференцировки, как, например, эритроциты или ороговевающий эпидермис кожи, клетки теряют всякую компетенцию. Молекулярная природа компетенции неизвестна, но, очевидно, она должна заключаться в каком-то особом состоянии регуляторного аппарата клетки или определенных генов, которые хотя еще не активны, но более других готовы к активации.
Детерминация, пожалуй, более четкое понятие. Это такое состояние клеток, когда они уже (часто необратимо) вступили на путь определенной дифференцировки, но внешне сама дифференцировка еще никак не выражается. Молекулярная природа детерминации также неизвестна, но, вероятно, включение определенных генов — если не первый, то непременный этап всякой детерминации. Широкая компетенция эктодермы не позволяет считать ее окончательно детерминированной, хотя при отсутствии особых влияний она дифференцируется в эпидермис. Напротив, компетенция энтодермы так узка, что ее можно называть детерминированной в направлении развития кишечника. Из этого примера ясно, что детерминация — это сужение компетенции. При описании процессов кроветворения чаще употребляют термин «коммитирование». Коммитированной называют клетку, уже осуществившую выбор направления дифференцировки, например в красные или в белые клетки крови.
Между детерминацией и дифференцировкой не может быть четкой границы. Это видно из самого определения детерминации. Оно говорит лишь о том, что доступными нам сейчас средствами мы не видим в клетках проявлений дифференцировки. Может быть, завтра эти проявления мы уже сможем увидеть, например в виде синтеза определенных мРНК. Считать ли их проявлением дифференцировки или условиться называть дифференцировкой только появление особенностей клетки, начиная с синтеза в ней новых белков, — дело вкуса. Поэтому, наверное, правильнее считать детерминацию не процессом, предшествующим дифференцировке, а ее начальным этапом.
И в заключение еще один круг вопросов. В механике развития часто говорили (и иногда используют эти понятия до сих пор) о самодифференцировке и зависимой дифференцировке. В первом случае предполагается, что клетки способны дифференцироваться в каком-либо направлении благодаря их внутренней структуре и свойствам. Как мы увидим дальше, это действительно часто бывает в раннем развитии — целые районы зародыша или отдельные бластомеры исходно различаются особенностями цитоплазмы. На более поздних этапах развития представить самодифференцировку труднее: для того чтобы две действительно одинаковые клетки развивались разным путем, необходимо, чтобы одна из них получила извне какое-то воздействие или информацию, которую не получила другая. Однако и в этом случае, возможно, существует механизм спонтанного вступления на путь дифференцировки, когда отдельные клетки выбирают то или иное направление развития с определенной вероятностью, может быть, под влиянием некоего внутреннего устройства, чем-то напоминающего рулетку.
Однако основным механизмом возникновения различий между клетками являются локальные внешние воздействия. Такая дифференцировка называется зависимой. Эти воздействия могут быть различными — от совсем простых и неспецифических до высокоспецифических, если их вызывают такие соединения, как белки. В настоящее время нам известны десятки примеров зависимой дифференцировки, но, вероятно, ни в одном случае мы не знаем точного механизма таких воздействий. Поэтому мы можем только предполагать, хотя и с большими основаниями, что все локально действующие факторы, вызывающие дифференцировку, в конце концов приводят к активации (включению) определенного набора генов.
Карта презумптивных зачатков — схема расположения в яйце на стадии ранней гаструлы лягушки материала будущих частей зародыша
Карта могла быть нарисована с большими подробностями, но в действительности на этой стадии между собой различаются только клетки эктодермы, мезодермы и энтодермы. 1 — зачаток эктодермы — будущий эпидермис; 2 — зачаток эктодермы — будущая нервная трубка; 3 — зачаток мезодермы — будущая хорда; 4 — зачаток мезодермы — будущие мышцы спины; 5 — зачаток мезодермы — будущая соединительная ткань, почки, кровь; 6 — зачаток энтодермы — будущий кишечник и его производные (легкие, поджелудочная железа, печень); 7 — бластопор — место, с которого начинается гаструляция: вворачивание энтодермы и мезодермы внутрь зародыша
2. Ооплазматическая сегрегация
Этим термином обозначают возникновение различий между разными частями цитоплазмы яйца (ооплазмы), разделение (сегрегацию) яйца на зоны с несколько различными свойствами. Обычно ооплазматической сегрегацией называют те перемещения компонентов цитоплазмы, которые происходят после оплодотворения и до начала дробления яйца. В действительности же многие процессы ооплазматической сегрегации осуществляются еще в оогенезе, а некоторые продолжаются и в ходе первых делений дробления.
Простейшая ооплазматическая сегрегация происходит в яйцах морского ежа. После четырех делений дробления бластомеры отличаются по способности образовывать некоторые структуры зародыша (султан на анимальном полюсе и кишку на вегетативном). Эта способность меняется вдоль анимально-вегетативной оси. Такое постепенное изменение свойств яйца называют градиентами. У некоторых видов морских ежей эти градиенты проявляются в виде распределения пигментных гранул, располагающихся близко к одному полюсу или образующих кольцо в области экватора.
Более сложно выглядит ооплазматическая сегрегация в яйце амфибий. Еще в ооците создается неравномерное распределение желтка и пигмента вдоль анимально-вегетативной оси: желтка больше на вегетативном полюсе, пигмент покрывает анимальную половину яйца. Ядро оплодотворенного яйца сильно сдвинуто к анимальному полюсу и окружено цитоплазмой, свободной от желтка. После оплодотворения происходит дальнейшая сегрегация: на одной из сторон яйца (она станет спинной стороной) в области экватора возникает более светлая область — серый серп (будущая хордо-мезодерма). Внутри яйца происходят и другие перемещения. В итоге в яйце амфибий можно различать три различно окрашенные зоны: пигментированную анимальную, или эктодермальную; светлую вегетативную, или энтодермальную; экваториальную кольцевую, более широкую в области серого серпа, — мезодермальную. Если до оплодотворения яйцо имело только одну анимально-вегетативную ось, то теперь в нем можно провести и перпендикулярную ей дорсовентральную ось от спины к животу. Две оси образуют плоскость симметрии, которая делит будущий зародыш на правую и левую половины.
В яйце асцидий до оплодотворения никакой сегрегации не обнаруживается: яйцо можно разрезать пополам в любой плоскости и половина, содержащая ядро, образует нормальный зародыш. Такое яйцо изотропно. После оплодотворения в яйце происходят сложные перемещения, которые удается видеть благодаря наличию в цитоплазме различно окрашенных гранул. В итоге в яйце асцидий можно различить не менее четырех зон — анимальную, вегетативную и две серповидные различно окрашенные области, лежащие на уровне экватора друг против друга.
Очень сложные перемещения происходят в яйцах моллюсков. После оплодотворения на вегетативном полюсе образуется так называемая полярная плазма, которая затем движется вдоль поверхности яйца к анимальному полюсу. У некоторых морских моллюсков ооплазматическая сегрегация выражается еще драматичнее: перед первым делением дробления на вегетативном полюсе временно выпячивается особый вырост — полярная лопасть, которая в ходе первого деления достается одному из двух бластомеров, а после второго деления — одному из четырех. В состав этой лопасти попадает полярная плазма и значительная часть митохондрий яйца.
У морских кишечнополостных — гребневиков оплодотворенные яйца имеют у поверхности зеленый слой — эктоплазму, которая в начале дробления равномерно попадает во все бластомеры. Однако в результате последующих делений образуются две группы клеток: одни из них содержат только эктоплазму, другие лишены ее.
Приведенные здесь примеры относятся к тем случаям, когда за ооплазматической сегрегацией можно следить визуально благодаря различной окраске цитоплазматических компонентов. Ho, наверное, чаще — у большинства видов морских ежей, у костистых рыб, птиц и т. д. — ее просто не видно, хотя она, по всей вероятности, существует. Например, яйцо дрозофилы, как и других насекомых, почти не обнаруживает признаков ооплазматической сегрегации, если не считать особых гранул (половых детерминантов), находящихся на заднем конце яйца. Мы уже говорили, как они определяют судьбу ядер, попавших в эту часть яйца. Почти все остальные ядра — после восьми делений их около 250 — перемещаются из центра яйца к его поверхности, где образуют бластодерму. В это время, как было показано экспериментально, определяется их судьба и ядра, попавшие в определенные зоны поверхностной цитоплазмы, образуют клетки так называемых имагинальных дисков. Из каждого диска (они парные) впоследствии образуются определенные органы взрослой мухи (имаго — взрослая). Поэтому можно утверждать, что цитоплазма поверхности яйца неоднородна и что, хотя она вся внешне выглядит одинаково, в действительности в оогенезе происходит ооплазматическая сегрегация, в ходе которой и возникают различные по свойствам зоны цитоплазмы. Некоторые ядра остаются в центре яйца и образуют специальные желточные клетки.
Из сказанного здесь уже ясен смысл ооплазматической сегрегации: создавая первичные различия в составе цитоплазмы, она в результате делений дробления приводит к образованию клеток, отличающихся по составу цитоплазмы. А это, в свою очередь, определяет их дальнейшую судьбу. Таким образом, ооплазматическая сегрегация является первым фактором, создающим исходные различия между клетками, или, иначе, первым (по времени) фактором дифференцировки.
Роль ооплазматической сегрегации доказывается не только описательно, когда различно окрашенные зоны яйца (там, где эти зоны можно видеть и проследить их судьбу) образуют в нормальном развитии строго определенные зачатки зародыша и затем органы. Экспериментальный метод доказательства обычно состоит в разделении ранних зародышей, на стадии двух, четырех и более клеток, на отдельные бластомеры или на их группы и затем в наблюдении за их судьбой. Возвратимся к приведенным выше примерам.
Если яйцо морского ежа на стадии восьми бластомеров разделить на две или четыре части в плоскости анимально-вегетативной оси, то из каждой части, состоящей из четырех или двух клеток, разовьется нормальный зародыш. Если же такой зародыш разделить на две части по экватору, то образуются два ненормальных зародыша: один будет лишен кишки, которая образуется у вегетативного полюса, а другой — султана из длинных ресничек, который расположен с анимальной стороны. Более детальные эксперименты с разделением 16-клеточного зародыша и комбинацией разных клеток показали, что «анимальные» свойства постепенно падают вдоль оси яйца, а навстречу ей так же постепенно нарастают «вегетативные» свойства. Речь, очевидно, идет о градиентах концентраций каких-то веществ или структур вдоль анимально-вегетативной оси.
У амфибий судьба двух разделенных бластомеров зависит от того, как прошла плоскость первого деления. Если она прошла через серый серп и разделила его на две, пусть неравные, части, то оба изолированных бластомера разовьются в нормальных зародышей. Но если случайно первая плоскость деления оставила весь серый серп в одном бластомере, то только он даст нормального зародыша. Другие разнообразные эксперименты показали, что три зоны яйца определяют образование трех зародышевых листков.
В последние годы, однако, получены новые данные, которые говорят о том, что у амфибий первично возникают только две зоны — анимальная и вегетативная, а промежуточная между ними — будущая мезодерма — появляется позже как результат взаимодействия первых двух. Как сочетать эти данные с предыдущими надежными результатами, показывающими ведущую роль серого серпа, пока неясно. Сейчас появились работы, где пересматриваются эти, казалось бы классические, представления о роли серого серпа.
Мы видим, что понятия мозаичного и регуляционного развития должны быть близко связаны с ооплазматической сегрегацией. У мозаичных яиц она обычно более выражена, т. е. яйцо содержит больше различных зон (6–8). Ho главное в том, что различия между участками цитоплазмы яйца у них, очевидно, более глубоки, так как необратимо предопределяют судьбу клеток, которые эту цитоплазму получают. В яйцах регуляционного типа и зон меньше (2–3), и судьба клеток лишь отчасти зависит от состава цитоплазмы. В не меньшей степени она зависит от взаимоотношений между клетками. Благодаря этим взаимным влияниям зародыш, лишенный части клеток, способен нормально развиваться. Яйца же мозаичного типа образуют группу правильно расположенных, но относительно независимых клеток. Если часть их удалить, другие клетки уже не могут изменить свой путь развития и заменить отсутствующие. Таким образом, ооплазматическая сегрегация является важным и первым фактором дифференциации. Вероятно, только при развитии зародышей млекопитающих она не играет заметной роли.
Механизмы создания ооплазматической сегрегации известны плохо. Важнейшие события самой сегрегации или подготовки к ней происходят в оогенезе. Так, в оогенезе амфибий возникают различия вдоль анимально-вегетативной оси, да и сами анимальный и вегетативный полюсы яйца определяются уже в ооците. Предполагают, что полюсы и неравномерное отложение желтка создаются благодаря ориентировке ооцита по отношению к кровеносным сосудам, из которых в яйцо поступает предшественник желтка — вителлогенин.
Место образования серого серпа во многом, если не целиком определяется внешними к яйцу факторами, уже после оплодотворения. Одним из них может служить место вхождения сперматозоида — серый серп образуется с противоположной стороны. Однако этот фактор не единственный, а у большинства видов он, по-видимому, совсем не играет роли.
Если яйцо амфибий (или осетровых рыб) в первое время после оплодотворения наклонить набок и дать ему снова подняться анимальным полюсом вверх, то серый серп образуется в плоскости поворота на той стороне, которая была внизу. Эту манипуляцию можно повторить несколько раз: серый серп образуется в плоскости последнего поворота. Ho через 30–40 мин положение серого серпа детерминируется и изменить его уже нельзя.
Механизм ооплазматической сегрегации у других видов животных практически не изучен. Можно, по-видимому, утверждать, что в оогенезе, например, асцидий образуются различные вещества и структуры, которые до оплодотворения распределены в яйце более или менее равномерно. Ho после оплодотворения эти вещества каким-то образом концентрируются и локализуются в виде полярных плазм, «серпов» и других образований, которые затем закономерно перемещаются по яйцу.
Важную роль в ооплазматической сегрегации, по-видимому, играет поверхность яйца, служащая своеобразным каркасом. Это иллюстрируется опытами, в которых яйца амфибий центрифугировали так, что вся организация яйца нарушалась. Однако после этого происходило постепенное восстановление нормальной организации яйца, включая ту, что была достигнута в результате ооплазматической сегрегации.
Ооплазматическая сегрегация костистых рыб изучалась в нашей лаборатории. У вьюна только что отложенное яйцо шарообразно. Однако в течение первого получаса на его поверхности выделяется тонкий прозрачный свободный от желтка слой, который стягивается к анимальному полюсу и в итоге образует на нем бластодиск — цитоплазматический бугорок, который у вьюна занимает 1/5—1/10 часть объема всего яйца (у разных видов рыб бластодерма составляет от 1/3 до 1/20 всего объема). В бластодиске находится ядро, и только бластодиск делится во время дробления яйца, образуя на анимальной стороне «шапочку» клеток — бластодерму. Оказалось, что в бластодерме сконцентрированы многие (хотя и не все) ферменты яйца — их в ней от 50 до 80 %, т. е. концентрация ферментов в бластодерме в 10–25 раз выше, чем в остальной части яйца, заполненной желтком. Каков механизм такой концентрации? Исследуя это явление разными методами, мы обнаружили, что в бластодерме происходит связывание ферментных молекул со структурами клетки.
Очевидно, ооплазматическая сегрегация у рыб происходит в два этапа. Сначала на поверхности яйца образуется цитоплазматический бугорок — бластодиск. Механизм этого процесса остается неизвестным, но в нем, по-видимому, участвуют структурные белки клеточного скелета, каким-то образом отделяющиеся от массы желтка. Затем уже эти структурные белки связывают ферменты и как бы насасывают их в бластодерму. Этим создается неравномерность распределения ферментов по яйцу, в результате чего запасенные в оогенезе ферментные белки оказываются собранными в клетках зародыша, где они и должны функционировать.
Нам осталось рассмотреть вопрос о том, каким образом ооплазматическая сегрегация создает различия между клетками, т. е. почему некоторые (может быть, небольшие) различия в составе цитоплазмы приводят к разным направлениям дифференцировки. Сами исходные различия в цитоплазме между бластомерами, очевидно, не следует называть дифференцировкой: до определенного времени эти различия никак не сказываются на форме и поведении клеток. Ho затем, часто с началом гаструляции, различия в метаболизме и поведении клеток становятся очевидными. Можно предполагать, что даже небольшие различия цитоплазмы приводят к активации разных наборов генов. Однако каковы те конкретные химические вещества, которые создают различия зон цитоплазмы яйца, и каким образом эти вещества определяют включение разных генов, неизвестно.
3. Индукция
В «классической» механике развития эмбриональной индукцией называют такое влияние одной ткани на другую, соседнюю, которое вызывает в месте контакта новую дифференцировку. Иногда (обычно в искусственной экспериментальной ситуации) индуцирующая ткань (индуктор) уподобляет индуцируемую ткань себе (гомотипичная индукция). Ho в нормальном развитии индуктор вызывает в индуцируемой части второй ткани новую, третью дифференцировку. Таким образом, эмбриональная индукция приводит к увеличению числа клеточных типов и этим усиливает дифференциацию зародыша.
Главной моделью и объектом большинства исследований была и есть так называемая первичная эмбриональная индукция у амфибий, когда в ходе гаструляции или тотчас после нее зачаток хордомезодермы вдоль спинной стороны зародыша индуцирует в эктодерме над собой зачаток нервной системы — нервную пластинку, которая свертывается в нервную трубку и дифференцируется в головной и спинной мозг. Остальная эктодерма почти целиком становится эпителием кожи, и только на границе эктодермы и нервной пластинки узкая полоска ткани (нервный гребень) превращается в мигрирующие клетки, которые участвуют в образовании хряща и пигментных клеток кожи. Если зачаток хордомезодермы еще в самом начале гаструляции удалить, нервной системы не образуется, если же этот зачаток пересадить под раннюю эктодерму на боку или животе другого зародыша, то там образуется вторая нервная система.
Первичная эмбриональная индукция является региональной. Это означает, что передняя часть зачатка хордомезодермы индуцирует в эктодерме передние отделы мозга, следующая за ней — средний и задние отделы головного мозга, а задняя половина хордомезодермы индуцирует спинной мозг. Позже, когда уже образуется хорда, а нервная пластинка замыкается в трубку и погружается под эктодерму, она сама становится индуктором и индуцирует в окружающих ее свободноподвижных мезенхимных клетках дифференцировку в хрящ позвонков.
Второй классической моделью индукции, традиционно изучаемой в нашей стране, является развитие глаз. У нас есть эмбриологи, успешно работающие над этой проблемой более 40 лет. Зачатки глаз (глазные пузыри) вначале являются парными выростами переднего мозга. Глазной пузырь подходит к эктодерме, касается ее, а затем его передняя поверхность начинает вворачиваться внутрь наподобие того, как можно вдавить плохо надутый мяч. Так из глазного пузыря возникает глазной бокал. Внутренняя стенка бокала станет очень сложно устроенной сетчаткой, а наружняя — очень просто организованным пигментным эпителием. Когда глазной пузырь касается эктодермы, он индуцирует в ней образование хрусталика (линзы). Клетки эктодермы впячиваются в полость глазного бокала и образуют эпителиальный однослойный пузырек, который отделяется от эктодермы. Далее клетки задней стенки этого пузырька вытягиваются и заполняют всю его полость. Это и есть готовый хрусталик.
Если глазной пузырь удалить до того, как он коснется эктодермы, линзы обычно не образуется; если же глазной пузырь пересадить под эктодерму в любом месте зародыша (но в довольно узкий период развития), то линза образуется там. В следующий период развития, когда глазной бокал и линза в нем уже образованы, они еще раз становятся индукторами и снова действуют на эктодерму. На этот раз они вызывают в ней просветление — образование прозрачной роговицы глаза.
Явление эмбриональной индукции было открыто в первые десятилетия нашего века и связано с именем Ганса Шпемана. Ho относительно недавно был показан еще один случай индукции, действующей на самых ранних стадиях, еще до индукции нервной системы. Голландский ученый Ньюкоп удалял у тритона экваториальную часть бластулы, т. е. будущую мезодерму. В этом случае мезодерма у таких зародышей все же возникала — она индуцировалась в эктодерме, очевидно, под влиянием энтодермы. Из этих опытов следует, что ооплазматическая сегрегация определяет только два зачатка, а третий возникает между ними как результат индукции. Однако многочисленные данные о роли серого серпа и другие факты не позволяют так легко отказаться от ужо имеющихся представлений.
Представления о механизме индукции имеют длинную и сложную историю, в которой пока нет ясного конца. Проще всего представить, что индуктор выделяет, а индуцируемая ткань получает некое индуцирующее вещество. Это вещество не обязательно должно быть очень сложным и специфичным, важно, чтобы на данной стадии развития оно попадало в индуцируемую ткань только в необходимом месте и тем самым определяло место новой дифференцировки.
Низкая специфичность индуктора очевидна из ряда опытов. Если под эктодерму одного вида животных пересаживать индуктор от другого вида, то характер индуцируемой нервной трубки всегда идет не в соответствии с видом индуктора, а в соответствии с видовыми особенностями индуцируемой эктодермы. Индукцию можно получить при действии очень различных чужеродных источников индукции. Например, из зародыша цыпленка, причем на поздней стадии, удалось выделить индуцирующие вещества, действующие на амфибий. Все это показывает, что специфическую роль играет компетенция индуцируемых клеток — она существует только у определенной ткани и обычно только в течение короткого периода раз- вития. Тем не менее те индуцирующие вещества, которые удалось очистить, оказались белками, т. е. достаточно сложными веществами.
Из недавних опытов немецкого ученого Тидемана следует, однако, что чистый индуктор, который вызывает индукцию нервной системы (нейральный индуктор), не проникает в клетки эктодермы, а, очевидно, остается на поверхности клеток (ниже мы увидим, что так же действуют все белковые гормоны). Следовательно, вряд ли имеет смысл говорить, что индукторы могут дать клетке программу дифференцировки, скорее они лишь осуществляют выбор среди тех немногих программ, которые уже имеются в компетентных клетках.
Впрочем, вопрос этот в большой степени терминологический: что значит определить саму программу или осуществить выбор среди программ? Зависит ли от индуктора, быть или не быть данной дифференцировке? Конечно, зависит. Содержит ли вещество индуктора, пусть самое сложное, информацию о том, какой должна быть дифференцировка, какова будет форма клеток или органа и т. д.? Конечно, нет. В таком случае, кажется, удобнее говорить о выборе программ, а не о самой программе. Иначе термин «программа» теряет всякий смысл.
В истории изучения индукции большое место занял период, когда индукцию вызывали, действуя самыми различными факторами, включая убитые ткани и солевые растворы. Финский исследователь Тойвонен показал, что региональность индуцирующего действия хордомезодермы у лягушки можно хорошо имитировать, действуя в разных соотношениях экстрактами убитых кипячением кусочков печени и костного мозга морской свинки. Даже чистые индукторы, полученные Тидеманом, никак нельзя считать естественными: ведь в тканях большого зародыша цыпленка не может случайно оказаться тот же самый белок, который вызывает индукцию нервной системы в нормальном развитии раннего зародыша амфибий.
Очевидно, подобные вполне чистые вещества можно выделить из очень разных источников, в том числе и из амфибий, но это лишь свидетельствует об их низкой специфичности. Получить же в чистом виде естественный индуктор, т. е. то самое вещество, которое поступает из хордомезодермы в эктодерму, пока еще не удалось никому.
Иногда предполагают, что сами индуцируемые клетки содержат много разных индукторов, но в неактивном виде.
Далее одни клетки выделяют эти индукторы наружу, а другие, напротив, концентрируют их в себе или активируют внутри себя. Подобные построения позволяют создать много различных схем. Проверить их пока одинаково трудно, поэтому ценность таких схем невелика.
Об индукции можно говорить еще очень много, но это скорее следствие не обилия, а, напротив, недостатка знаний. Мы знаем много фактов на клеточном уровне, но мало — на молекулярном. В результате мы не имеем пока хорошей теории, в которую бы укладывались все известные факты. Подводя итоги, можно сказать, что индукции играют важнейшую роль в эмбриональных дифференцировках и некоторую роль в дифференцировках во взрослом организме. Однако ими можно объяснить далеко не все случаи дифференцировки, часто действуют другие, пока еще неизвестные механизмы.
Индукция, по определению, может произойти при близком контакте индуцирующей и индуцируемой тканей, во всех случаях она, по-видимому, происходит путем миграции определенных веществ. Однако в одних случаях эти вещества могут, преодолевая некоторое расстояние, мигрировать из клеток индуктора в клетки индуцируемой ткани, а в других — необходим прямой контакт между этими клетками. Вероятно, это свидетельствует о различной природе индуцирующих факторов. Хотя естественный индуктор ни в одном случае не выделен, похоже, что это белки небольшого молекулярного веса.
Однако то, что пока не смогли сделать на высокоорганизованных амфибиях, удалось на представителях низших многоклеточных животных — кишечнополостных актиниях и гидре. У них в самое недавнее время группой американских ученых был обнаружен и выделен в чистом виде индуктор, определяющий формирование головного конца животного. Индуцирующим веществом оказался олигопептид — цепочка, состоящая из одиннадцати определенных аминокислот. У морских актиний и пресноводной гидры (два разных класса) последовательность аминокислот оказалась тождественной, т. е. за много миллионов лет раздельной эволюции этих групп животных индуцирующее вещество не изменилось. Механизм индукции неясен, но трудно сомневаться в том, что в конечном итоге он состоит в активации определенных генов, запускающих всю программу дифференцировки. Роль индукции в развитии состоит в определении места дифференцировки, т. е. индуцирующее вещество — это источник позиционной информации, по которому индуцируемая клетка «узнает», где она оказалась и кем ей «следует стать». Поэтому индукцию следует считать важным (но не единственным) инструментом пространственной организации зародыша и его развития.
4. Другие механизмы возникновения различий
В эту категорию попадают многочисленные случаи, когда мы почти ничего не знаем о механизмах дифференцировки. Пожалуй, наиболее изучена сейчас первичная дифференциация зародыша млекопитающих на собственно зародыш и внезародышевое образование — трофобласт, из которого потом возникает часть плаценты.
До стадии 16 клеток зародыш млекопитающих практически не дифференцирован, хотя наружные клетки уже площе внутренних. При нормальном развитии эти наружные клетки станут трофобластом, а внутренние (по некоторым данным, их всего три) — собственно зародышем. Ho если на этой стадии клетки механически перемешать, разделить зародыш пополам (по восемь клеток) или, напротив, соединить два зародыша вместе — развитие будет идти нормально. Это означает, что на стадии 16 клеток их судьба еще не предопределена, они не детерминированы.
Оказалось, что фактором дифференцировки является само положение клеток: если они на стадии 16 клеток и позже окажутся снаружи, их развитие необратимо пойдет в сторону трофобласта. Неясно, происходит ли это потому, что нечто в среде индуцирует в наружных клетках этот путь развития, или, наоборот, его детерминирует вымывание из наружных клеток каких-то компонентов в среду. Очевидно, что в этом случае раннему зародышу «было нужно» найти какой-либо сигнал, который позволил бы по-разному определить судьбу наружных и внутренних клеток. Для этого и был использован один из двух способов отыскания такой позиционной информации: преимущественное получение или выделение веществ наружными клетками.
Похожий механизм направляет по разным путям развитие тканей глаза: оказавшаяся внутри часть глазного бокала дифференцируется в сетчатку, а оставшаяся снаружи — в пигментный эпителий. Искусственные нарушения этой ситуации приводят к передифференцировке сетчатки в пигментный эпителий и наоборот.
Вероятным фактором дифференцировки является плотность клеточной популяции. Многие дифференцировки (хрящей, кости и т. д.) начинаются с собирания рассеянных мезенхимных клеток в плотные скопления. Неясно, что тут первично: собираются ли эти клетки вместе потому, что детерминированы стать хрящом, или становятся хрящом оттого, что собираются вместе. Так или иначе, при высокой плотности клеток концентрация выделяемых ими веществ становится выше, и это может служить фактором определенной дифференцировки для клеток, которые были к ней компетентны.
По-видимому, определенную роль в некоторых дифференцировках играет случайность. Например, при делении камбиальных (стволовых) клеток эпителия кожи одна из дочерних клеток случайно оказывается ниже (ближе к базальному слою) и остается стволовой, а другая — выше (ближе к наружной поверхности) и дифференцируется в эпидермис, наполняется кератином (ороговевает) и в конце концов слущивается. Аналогично определяется судьба клеток в основании ворсинки кишечника, хотя здесь случайности уже нет места: при делении та дочерняя клетка, которая остается ближе к основанию, сохраняется как стволовая, а та, которая расположена ближе к стенке ворсинки, движется вдоль нее до вершины, дифференцируется в кишечный эпителий и, достигнув вершины, погибает.
Мы видим, что существует несколько механизмов возникновения различий между клетками. Общим для них является, по-видимому, то, что факторы дифференцировки обычно малоспецифичны. Так, например, отличия цитоплазмы в случае ооплазматической сегрегации не приводят к необратимой дифференцировке, а лишь как бы «намечают» план расположения будущих зародышевых листков. Даже такие, казалось бы, высокоспецифические вещества, как индуцирующие белки, могут быть получены из очень разных и явно чужеродных источников, а следовательно, являются различными, хотя и осуществляют одну и ту же индукцию. Это и есть выражение их низкой специфичности. Ясно, что такой фактор дифференцировки не может нести программу развития, а в лучшем случае осуществляет выбор одного из немногих путей, предопределенных компетенцией. Еще в большей мере понятие неспецифичности относится к другим факторам дифференцировки. Ho в отдельных случаях, например при определении судьбы будущих половых клеток, решающую роль играют какие-то рибонуклеопротеидные. гранулы, функция которых может быть и очень специфичной.
Специфичность дифференцировки — действительные различия между клетками возникают лишь тогда, когда в них синтезируются разные белки, а следовательно, активируются разные гены. Механизмы же включения генов, которые к этому уже готовы (компетентны), могут быть не очень сложными.
В эволюции естественным отбором задаются такое строение организма, взаимное расположение и относительные размеры составляющих его органов, которые обеспечивают его наилучшую выживаемость или, точнее, наилучшую способность к воспроизведению. Следовательно, механизмы, создающие в развитии форму, подчинены этому доминирующему условию. Для создания формы необходимо создание различий между клетками по определенному пространственному плану. Для этого эволюция использует «любые» возможности: наличие хорды, различия условий внутри и снаружи глазного бокала, различия между внутренними и наружными клетками раннего зародыша млекопитающих и т. д. А далее естественные, пусть небольшие, различия в особенностях метаболизма, например, клеток будущей хорды используются в качестве фактора дифференцировки. С одной стороны, эти особенности метаболизма могут усиливаться и приводить к выделению уже специального индуктора, а с другой — повышается чувствительность дифференцирующихся клеток даже к небольшим отличиям в среде, к действию ничтожных концентраций индуктора. Так можно себе представить постепенное появление в эволюции механизмов, определяющих пространственную организацию зародыша путем создания различий между клетками.
Глава VI Гормоны определяют время включения генов
Гормонами называют биологически активные вещества, которые синтезируются в одном органе, а действуют на клетки других органов. В отличие от индуцирующих веществ гормоны обычно не распространяются путем диффузии к соседней ткани, а равномерно с кровью или гемолимфой разносятся по всему организму и в принципе могли бы действовать на все виды клеток. Однако гормоны действуют только на определенные клетки («клетки-мишени») и в разных видах чувствительных к ним клеток вызывают различный эффект. Это означает, что, как и в случае контактной индукции, специфика ответа больше зависит от клеток-мишеней, а гормон определяет лишь время наступления эффекта.
Гормоны начинают действовать на довольно поздних стадиях развития, когда уже есть гемолимфа или кровь, и осуществляют свою регуляторную роль во взрослом организме. Вызываемые ими эффекты можно, правда не всегда строго, разделить на регуляцию процессов развития (метаморфоз, дифференцировка клеток, созревание ооцитов, синтез белков яйца и т. д.) и регуляцию обратимых физиологических процессов (взаимопревращения сахаров и гликогена, расширение сосудов, сексуальное поведение и др.). Мы будем здесь говорить только о роли гормонов в развитии. Это обычно осуществляется посредством действия гормонов на активность генов.
1. Роль гормонов в процессах развития
Если гормон равномерно распределяется по всему организму, то он принципиально не может создавать различий между совершенно одинаковыми клетками. Действительно, если клетки одинаковы, то и их реакция на любые внешние воздействия, в том числе и на гормон, будет одинакова. Если же две группы клеток реагируют на один и тот же гормон различно, то это само по себе означает, что чем-то эти клетки отличались и до того, как на них подействовал гормон.
Некоторые наблюдения, казалось бы, не согласуются с этим утверждением. Например, клетки кожи, покрывающей спину и хвост головастика, внешне (под микроскопом) не отличаются друг от друга. Ho под влиянием гормона щитовидной железы — тироксина клетки кожи хвоста лизируются (рассасываются) вместе со всем хвостом. В то же время клетки кожи спины не погибают, а подвергаются характерным изменениям, которые превращают кожу головастика в кожу лягушки: она иначе пигментирована, имеет многочисленные железы и т. д. Если кусочек кожи хвоста пересадить на спину, то после действия тироксина она и на новом месте начинает рассасываться. Эти опыты показывают, что в действительности кожа
Хвоста головастика чем-то отличалась от кожи спины. Отличия клеток-мишеней от клеток, нечувствительных к гормону, или, как в данном случае, от клеток-мишеней, реагирующих на гормон иначе, могут внешне никак не выражаться и обнаруживаться только в реакции на гормон.
Итак, гормоны не вызывают различий между одинаковыми клетками и, следовательно, не вызывают дальнейшей дифференциации организма. Они не могут в принципе увеличить в нем число видов клеток и тканей. Этим гормоны отличаются от индукторов и других факторов дифференцировки. Однако гормоны являются факторами, усиливающими дифференцировку, способствующими продвижению клеток по пути дальнейшей специализации и превращающими небольшие различия между клетками в значительные морфологические и функциональные отличия.
Так, например, гормоны вызывают развитие молочных желез и начало лактации, активируют у птиц синтез яичного желтка в печени и овальбумина в яйцеводе, вызывают метаморфоз у личинок насекомых и амфибий и при этом стимулируют целый ряд процессов разрушения личиночных тканей и дифференцировки тканей взрослого организма. Во всех случаях, когда это было детально исследовано, процессы дифференцировки, стимулированные гормонами, начинались с активации новых, не работавших до того генов. Это было достоверно показано для клеток слюнных желез при метаморфозе у дрозофилы, для клеток печени при метаморфозе у головастиков, для белоксинтезирующих желез в яйцеводе птиц.
В чем же биологический смысл использования гормонов для стимулирования дифференцировок, если и без того эти клетки уже являются клетками-мишенями? Ведь они уже отличаются от других клеток и, казалось бы, могли идти по пути своей специализации и дальше, не нуждаясь в дополнительных стимулах. Дело в том, что гормоны определяют не место, а время дифференцировки. Они появляются или их концентрация возрастает как раз в тот момент, когда дальнейшая дифференцировка необходима: личинки мухи или головастики достигли достаточного размера для метаморфоза, появилась необходимость в функции молочной железы или желез яйцевода, пришло время для созревания и откладки яиц и т. д.
В одних случаях наступление времени действия гормона определяется событиями внутри организма: достижение нужного размера и необходимость метаморфоза у личинок, рождение потомства и необходимость лактаций у млекопитающих.
В других случаях определяющими являются внешние факторы: например, повышение температуры или удлинение светового дня весной стимулирует у многих животных откладку яиц и весь комплекс сексуального поведения.
Мы уже говорили, что обычно, а может быть и всегда, один гормон одновременно вызывает различные эффекты в нескольких видах клеток-мишеней. Половые гормоны сразу влияют на созревание яиц и на синтезы в железистых клетках яйцевода, часто вызывают появление брачной окраски и стимулируют сексуальное поведение. Гормоны щитовидной железы одновременно вызывают у головастика самые разнообразные превращения — резорбцию хвоста, сокращение длины кишечника, появление новых ферментов в печени, стимуляцию развития конечностей и легких и т. д.
Необходимость одновременного действия гормонов на разные ткани очевидна: все эти процессы должны происходить сразу или в быстрой последовательности друг за другом. Таким образом, гормоны координируют во времени те процессы развития, которые, хотя и происходят в разных частях организма, функционально связаны друг с другом и составляют один общий этап развития (например, метаморфоз).
Для выполнения этой роли сами эндокринные железы часто связаны с нервной системой и органами чувств, которые «информируют» их, например, о наступлении сезона размножения. Посредником в этом процессе у позвоночных служит особая эндокринная железа — гипофиз. Она является придатком головного мозга и морфологически связана с особым его отделом — гипоталамусом. От него гипофиз получает стимулирующие сигналы в виде особых действующих местно веществ — рилизинг-факторов, которые вызывают синтез и выделение из гипофиза в кровь «тропных» гормонов, стимулирующих другие эндокринные железы. Так, различают гонадотропный гормон, действующий на половые железы, тиреотропный гормон, стимулирующий щитовидную железу, и т. д.
Итак, биологическая роль гормонов, регулирующих процессы развития, состоит в координации этих процессов и стимуляции их в оптимальные периоды времени. Как мы уже говорили, это их действие осуществляется через активацию и инактивацию генов.
2. Действие стероидных гормонов
Стероидные гормоны являются относительно простыми органическими соединениями с небольшим молекулярным весом. О механизме их действия известно сейчас больше, чем о действии других гормонов. Скелет стероидных гормонов образован четырьмя углеводородными кольцами, и все разнообразие достигается за счет боковых групп — метальных, гидроксильных и др. Хотя сейчас известны десятки стероидных гормонов и их активных аналогов, общее число этих соединений, которые в принципе могут существовать, не превышает двухсот. Тем не менее в это число у позвоночных входят гормоны с совершенно различным действием — мужские половые гормоны (андростероны), женские половые гормоны (эстрогены), а также неполовые стероидные гормоны надпочечников — кортикостероиды.
Половые стероидные гормоны у позвоночных синтезируются в половых железах, и их синтез стимулируется гонадотропными гормонами гипофиза. У личинок насекомых стероидный гормон линьки — экдизон (экдистерон) синтезируется параторакальными железами.
Хорошей моделью действия женских половых стероидных гормонов (например, эстрадиола) служит синтез желточного белка ооцитов — вителлогенина в печени кур или овальбумина в яйцеводе цыплят. Для исследования начала синтеза вителлогенина часто используют петухов или самцов лягушек. У них в норме нет эстрогенов, вителлогенин не синтезируется и кодирующий его ген, очевидно, полностью не активен. Ho при введении эстрадиола синтез этого белка начинается и в печени самцов. Кроме генов вителлогенина, активируется также транскрипция рибосомных РНК и образование новых рибосом, в то время как активность других генов уменьшается. На новых мРНК и новых рибосомах интенсивно синтезируется вителлогенин и происходит его быстрый выход в кровяное русло. Однако, так как ооцитов у самцов нет, этот белок длительное время остается в плазме крови.
Введение эстрадиола молодым курочкам и даже цыплятам стимулирует дифференцировку клеток в их яйцеводах. Часть клеток эпителия яйцевода под влиянием эстрадиола дифференцируется в железистые клетки, в которых активируются гены овальбумина. Через несколько дней начинается синтез самого овальбумина.
В слюнных железах личинок дрозофилы или комара хирономуса (его личинки — это мотыль, живой корм для аквариумных рыб) действие стероидного гормона линьки — экдизона на активность генов можно видеть прямо под микроскопом. Политенные хромосомы значительно длиннее и толще обычных, и активные гены у них выглядят как утолщение хромосомы. Они называются пуфы. Уже через 5—10 мин после введения личинкам экдизона можно видеть появление нескольких новых пуфов (один — у хирономуса, два — у дрозофилы). Ho только через несколько часов у них возникает еще несколько десятков новых пуфов, появление которых характерно для личинки, вступившей в метаморфоз. Можно предполагать, что первые пуфы являются результатом прямого действия экдизона. Недавно при введении радиоактивного экдизона было показано, что он концентрируется в первых активирующихся пуфах. Более позднее включение остальных генов уже не требует прямого влияния экдизона и, вероятно, регулируется теми генами, которые активируются экдизоном в первые минуты. Механизм влияния «гена на ген» пора практически неизвестен, хотя такие влияния хорошо укладываются во многие схемы генной регуляции. Ингибиторы синтеза РНК подавляют включение второй очереди новых пуфов, но не препятствуют появлению первых пуфов.
Механизмы действия стероидных гормонов сейчас хорошо изучены. Эти гормоны проникают в клетки. В цитоплазме клеток-мишеней находится специфический белок-рецептор, который «опознает» тот гормон, к которому клетка компетентна, связывается с ним и образует гормон-рецепторный комплекс. Такие комплексы мигрируют в ядро и связываются, как предполагают, с теми участками хромосом, где находятся гены, которые гормон в этих клетках активирует. Один и тот же стероидный гормон в разных видах клеток активирует разные гены, например эстрадиол активирует в печени гены вителлогенина, а в яйцеводе — гены овальбумина. Следовательно, эти клетки должны отличаться или своими рецепторами, или состоянием хромосом. Сейчас преобладает мнение, что рецепторы в разных видах клеток одинаковы. Если это так, то различными являются хромосомы. Предполагается, что в ядрах клеток-мишеней на соответствующих генах находятся особые белки — акцепторы, с которыми может связываться гормон-рецепторный комплекс и каким-то (пока неясным) образом активировать данный ген.
Таким образом, компетентность клетки к стероидному гормону (ее свойства как клетки-мишени) определяется двумя обстоятельствами: наличием в цитоплазме рецепторного белка, способного «опознать» свой гормон, и наличием на определенных генах акцепторных белков, способных «опознать» гормон-рецепторный комплекс. Если эта схема верна, то наличие рецепторов делает клетку «мишенью», а положение на хромосоме акцепторных белков определяет специфичность реакции на гормон у данного вида клеток.
3. Действие белковых гормонов
Полипептидные гормоны известны, по-видимому, еще далеко не все. Среди них есть настоящие белки, хотя и небольшого молекулярного веса, а есть и полипептиды, состоящие всего из 8—11 аминокислот, замкнутых в кольцо. Настоящие белки синтезируются обычным для белков путем: ген->мРНК — > белок. Некоторые же короткие полипептиды синтезируются без трансляции на рибосомах, но при помощи нескольких ферментов, которые последовательно «приставляют» по одной аминокислоте к строящейся цепочке.
Большая часть белковых гормонов синтезируется в гипофизе. Среди них можно назвать уже упоминавшийся гонадотропный гормон, стимулирующий целый ряд процессов, связанных с размножением, и в том числе синтез половых гормонов в половых железах; тиреотропный гормон, активирующий синтез тироксина в щитовидной железе; гормон роста (соматомедин), необходимый для роста животных и человека (без него люди и животные остаются карликами); пролактин, стимулирующий дифференцировку молочных желез и синтез в них казеина — белка молока. Кроме того, в гипофизе образуются и низкомолекулярные полипептидные гормоны, действующие не на дифференцировку клеток, а на физиологические процессы. Это окситоцин и вазопрессин, влияющие на работу сердца и на кровяное давление.
Белковые гормоны, контролирующие углеводный обмен, — инсулин и глюкагон синтезируются в поджелудочной железе. Эта железа является в основном экзокринной и образует многочисленные пищеварительные ферменты, которые выводятся в 12-перстную кишку. Ho около I % ее клеток находится в составе островков Лангерганса, в которые входят два вида особых клеток, работающих как эндокринные железы и выводящих в кровь инсулин (бета-клетки) или глюкагон (альфа-клетки). Оказалось, однако, что действие инсулина не ограничивается, как считали раньше, только стимуляцией превращения в печени глюкозы в гликоген. Он также необходим для ряда процессов клеточной пролиферации и дифференцировки.
В почках синтезируется белковый гормон — эритропоэтин, регулирующий дифференцировку эритроцитов в костном мозгу и селезенке.
Синтез белковых гормонов регулируется сложным образом. В этой регуляции участвует, как мы говорили выше, центральная нервная система, действующая через рилизинг-факторы. Кроме того, советским ученым М. М. Завадовским в 30-е годы была обнаружена система регуляции, которую он назвал «плюс-минус-взаимодействие» и этим намного предвосхитил открытие принципа обратной связи. Этот механизм можно показать на системе синтез тиреотропного гормона в гипофизе — синтез тироксина в щитовидной железе. Тиреотропный гормон стимулирует синтез тироксина (плюс-действие по Завадовскому), но тироксин подавляет в гипофизе синтез тиреотропного гормона (минус-действие). Таким образом поддерживается постоянный уровень тироксина в крови: при его избытке функция щитовидной железы подавляется, при недостатке — стимулируется.
Белковые гормоны не проникают в клетку. Однако на поверхности клеток-мишеней находятся специфические белковые рецепторы, которые «опознают» гормон и связываются с ним. Это связывание активирует фермент, находящийся на внутренней стороне клеточной мембраны, — аденилатциклазу, которая превращает АТФ в циклическую АМФ (цАМФ). Мы уже упоминали цАМФ, когда говорили о сигнале, собирающем миксамебы диктиостелиума в агрегат. Аналогично в других случаях из ГТФ образуется цГМФ. Далее цАМФ (или цГМФ) поступает в ядра, где активирует особые ядерные протеинкиназы — ферменты, фосфорилирующие гистоновые и негистоновые белки хроматина. Как осуществляется выбор протеинкиназ (их более десятка) и как они, в свою очередь, осуществляют выбор фосфорилируемых белков, неизвестно, Ho в итоге происходит активация определенных генов (например, в клетках половой железы активируются гены, ответственные за синтез стероидов) и начинается соответствующая дифференцировка. Мы видим, что здесь, как и в случае стероидных гормонов, нам лучше известны начальные этапы действия гормона на клетку, но по-прежнему неясны процессы, происходящие непосредственно на хромосомах.
4. Другие гормоны
Тироксин (или, точнее, тироксины) представляет собой низкомолекулярное соединение, состоящее из двух молекул тирозина, к которым присоединено несколько атомов йода. Поэтому нехватка йода в пище приводит в некоторых горных районах к тяжелой болезни щитовидной железы — зобу. Эта болезнь, однако, легко предупреждается добавлением в пищу микроколичеств йода. Другие заболевания щитовидной железы, создающие избыток тироксина, вызывают у человека базедову болезнь с характерными выпученными глазами. У взрослых животных тироксин является гормоном, влияющим в основном на интенсивность метаболизма и, в частности, энергетического обмена. Объектом такого действия тироксина являются митохондрии, в которые он проникает. Однако в эмбриогенезе и личиночном развитии действие тироксина совсем иное — он влияет на морфогенез, и это его действие осуществляется через генетический аппарат.
Мы уже упоминали о действии тироксина на метаморфоз личинок амфибий. Он действительно объединяет целый ряд одновременно протекающих процессов, ведущих к превращению головастика в лягушонка. Особенностью этого метаморфоза является то, что он происходит при сохранении всех жизненных функций животного (в отличие от метаморфоза насекомых, который происходит в неподвижной куколке). В связи с этим метаморфоз головастика продолжается более одной-двух недель и нормально происходит при строгом соблюдении последовательности составляющих его процессов. Если головастику дать сразу большую дозу тироксина, то метаморфоз начнется одновременно во всех органах и будет происходить некоординированно. В результате образуется нежизнеспособное существо без хвоста, но еще с короткими конечностями и другими аномалиями строения, не способное жить ни в воде, ни на суше.
При нормальном развитии концентрация тироксина в крови растет постепенно, вместе с ростом всего головастика и особенно щитовидной железы. Чувствительность разных органов головастика к тироксину неодинакова, и благодаря этому они вступают в метаморфоз по определенному расписанию. В результате даже в ходе метаморфоза головастик сохраняет способность к движению, может прятаться от врагов и т. д., пока не выходит на берег маленькой лягушкой.
Кроме тироксина, можно, по-видимому, назвать еще ряд веществ, которые рассматриваются вместе с гормонами лишь условно, хотя роль их в развитии может быть очень велика. Один класс веществ — кейлоны, которые будто бы выделяются различными органами в кровь и концентрация которых регулирует рост и размножение этих органов. Действительно, если у взрослого животного удалить часть печени, то оставшаяся часть восстанавливается в размерах в течение двух-трех дней. Если удалить одну почку, то так же быстро вторая почка достигает двойного размера. При этом в печени и в почках происходит волна клеточных делений, которые до того в них почти отсутствовали. Можно предполагать, что при уменьшении размеров печени концентрация кейлонов печени в крови падает и это стимулирует рост печени. Когда размер печени достигнет нормы, до нормы повысится и концентрация в крови кейлона печени и затормозит дальнейший рост. Эта красивая схема, однако, пока имеет очень немного надежных экспериментальных оснований, и само существование кейлонов остается под вопросом.
Другую группу факторов еще труднее отнести к гормонам, так как они действуют диффузно и местно, хотя, по-видимому, не так локально, как индуцирующие вещества. Речь идет о вполне реальных веществах белковой природы, называемых факторами роста. Лучше других известен «нервный фактор роста», открытый итальянской ученой Леви-Монтальчини. Он может быть получен из различных органов, но особенно много его почему-то в слюнной железе позвоночных. Он стимулирует рост нервных волокон (аксонов) и, как считают, определяет и направляет рост нервов в тканях. Возможно, что он может стимулировать рост и размножение и других типов клеток.
Кроме того, известны «эпидермальный фактор роста» и некоторые другие. «Эпидермальный фактор роста» является небольшим белком. Он стимулирует рост и деление многих видов клеток и, вероятно, играет важную роль в регуляции регенерации поврежденных органов. Ho недавно «эпидермальный фактор роста» был обнаружен в зародышах млекопитающих. Это означает, что он может играть важную роль и в процессах морфогенеза.
Несколько гормонов было открыто и у растений. Это органические вещества небелковой природы, которые стимулируют рост и цветение (ауксины, гиббереллины и др.).
Глава VII Гибриды животных и гибриды клеток
Разнообразные методы гибридизации заключаются в объединении в яйце различных хромосом (половая гибридизация), в одной клетке — двух ядер разного происхождения (гибриды соматических клеток) или в одном организме — клеток с разным генотипом (химеры). Создание необычных, неестественных комбинаций как бы размыкает невидимые до того связи между генами, между ядром и цитоплазмой и между клетками. Это позволяет исследователю увидеть взаимоотношения частей того, что выглядело как неразрывное целое, — генотип, клетка или организм. Несколько в стороне стоят методы и задачи другого уровня гибридизации — молекул ДНК и РНК, их мы рассмотрим в следующей главе.
При половой гибридизации взаимодействие двух генотипов в одном ядре зависит от того, одинаково ли гены двух видов отвечают на сигналы цитоплазмы, «понятные» для генов материнского вида, но, может быть, чужеродные для генов отцовского вида. Это взаимодействие будет зависеть и от продукции этих генов, т. е. от совместимости кодируемых ими белков. Таким образом, проблема гибридизации животных — это во многом проблема совместимости двух генотипов.
При гибридизации соматических клеток путем их искусственного слияния сначала возникают гетерокарионы — клетки, содержащие по два различающихся ядра. Это могут быть ядра двух видов, иногда очень далеких, или ядра двух типов клеток одного вида. На таких гетерокарионах можно исследовать многие проблемы ядерно-цитоплазматических взаимоотношений, и прежде всего влияние цитоплазмы на работу ядер. Аналогичные проблемы можно решать в опытах, когда ядра, полученные из зародышей разных тканей, переносятся (трансплантируются) в цитоплазму ооцита или оплодотворенного яйца.
В ходе первых делений гетерокарионы часто образуют клетки с объединенным ядром, содержащим хромосомы двух видов. Так, удается, правда только в культуре тканей, получить гибридные клетки между очень далекими видами, такими, например, как мышь и человек. Этот метод сейчас широко используется для картирования хромосом человека — установления того, какие гены находятся в каждой из хромосом.
На гибриды животных несколько похожи химерные организмы, искусственно создаваемые путем смешивания на ранней стадии развития клеток двух линий одного вида. Эти работы сейчас в основном проводятся на млекопитающих, но химерные организмы получают на дрозофиле, а также у зародышей морских ежей и амфибий. У химер также происходит взаимодействие двух генотипов, но уже не в одном ядре, а на уровне целых клеток. В этих случаях соединяют клетки очень похожих зародышей. Поэтому развитие химер обычно происходит нормально, а различия между клетками могут служить хорошим маркером для решения некоторых проблем эмбриологии.
1. Гибриды животных
Изучение гибридов в биологии развития обычно состоит в обнаружении проявления отцовских признаков на различных стадиях развития. При выборе скрещиваемых пар исследователь сталкивается с противоречием: чем ближе скрещиваемые особи, тем лучше развивается гибрид, но тем труднее обнаружить различия между материнским и отцовским видами, особенно в раннем развитии. Действительно, различия между близкими видами обычно затрагивают лишь детали строения, которые проявляются на поздних стадиях развития.
Несовместимость при скрещивании близких и более далеких видов сама по себе может быть предметом изучения, так как позволяет понять многие важные особенности процессов развития. На пути развития гибридов существует несколько препятствий, или порогов. Первый из них: невозможность оплодотворения из-за несовместимых свойств поверхности яйца и сперматозоидов. Это препятствие мешает скрещиванию многих, даже близких, видов амфибий. Его, однако, иногда удается обойти, если зрелые ооциты одного вида поместить в полость тела лягушки другого вида. Такие ооциты проходят через яйцевод, окружаются чужими наружными оболочками и после этого становятся доступными для оплодотворения. Вместе с тем, например у рыб, оплодотворение часто удается не только между близкими видами, но и между видами из разных родов и даже отрядов и не требует специальных ухищрений.
Если оплодотворение осуществилось и хромосомы обоих видов оказались в одном ядре, их последующая судьба может быть различной. При отдаленном скрещивании часто происходит элиминация (потеря) всех или некоторых чужеродных отцовских хромосом. Механизмы элиминации до конца неизвестны, но элиминируются в первую очередь хромосомы, которые сильнее отличаются по размеру от хромосом материнского вида. Элиминация, как предполагают, происходит из-за того, что нити веретена «не умеют» растаскивать в митозе чужие хромосомы, или из-за того, что репликация отцовских хромосом происходит в иное время, чем синтез ДНК в материнских хромосомах. В результате элиминации зародыш по многим хромосомам, а значит, и генам оказывается гаплоидным. Поэтому развитие таких зародышей нарушается, а отцовские признаки не проявляются.
О других препятствиях для гибридизации мы можем только догадываться. Вероятно, одним из них является отсутствие «общего языка» между отцовскими генами и активирующими сигналами материнской цитоплазмы. Из-за этого отцовские гены вообще не активируются или активируются не те, которые нужны. Однако, как мы уже рассказывали выше (гл. 6), у андрогенетических гаплоидных гибридов рыб (материнское ядро убито и в ядрах находится лишь один набор отцовских чужеродных хромосом) гибель разных гибридов происходит в разные сроки. Это указывает на какое-то участие ядер в процессе развития и скорее согласуется с тем, что в отцовских хромосомах активируются «неправильные» гены.
Другой порог гибридизации может состоять в том, что чужеродные белки, которые синтезируются под контролем отцовских генов, в лучшем случае не способны обеспечить осуществление процессов развития, а в худшем — нарушают нормальный и сбалансированный ход метаболизма, что приводит к остановке развития и гибели зародьшей. Этим можно объяснить то, что в обычных диплоидных гибридах самок вьюна с самцами из другого отряда, т. е. в присутствии собственных хромосом, развитие ранних стадий протекает относительно нормально, но позже нарушается и в конце концов завершается гибелью всех зародышей или ранних личинок. Развитие же андрогенетических гибридных гаплоидов, лишенных материнских хромосом, обычно останавливается на стадии бластулы.
Наконец, последним порогом гибридизации может быть полноценное участие геномов обоих родителей, в результате чего создаются организмы с «промежуточными» признаками, не способные к жизни. Об этом говорят многочисленные опыты, когда кусочки тканей гибрида, пересаженные на один из родительских организмов, жили нормально, в то время как целые гибридные организмы погибали.
Интересной особенностью многих гибридных комбинаций является различная судьба реципрокных гибридов, когда, например, курица скрещивается с перепелом и перепелка — с петухом. В то время как в первом варианте выводятся жизнеспособные птенцы, во втором они погибают в яйце. Различна судьба у реципрокных гибридов ручьевой и озерной форели. В некоторых случаях было показано, что появление определенных признаков (например, пигментация глаз) у реципрокных гибридов происходит на разных стадиях. Все эти случаи можно объяснить, если предположить, что гены одного вида чувствительны к регуляторным белкам другого вида, а гены второго вида плохо воспринимают регуляцию со стороны первого вида.
Выше мы уже подробно рассматривали, как в биологии развития гибриды используются для установления времени начала работы генов. Возможности, которые они открывают для других исследований, еще далеко не исчерпаны. Дело тут, очевидно, в том, что при гибридизации взаимоотношения между двумя видами происходят одновременно на многих этажах: между хромосомами и генами двух видов, между генами одного вида и цитоплазмой другого, между белками двух видов и т. д. Разобраться в этом обычно не просто. Поэтому метод гибридизации, так много давший для генетики, гораздо меньше мог пока дать для решения проблем биологии развития.
2. Трансплантация ядер и гибриды соматических клеток
Изучение половых гибридов животных ограничено тем, что в цитоплазму яйца попадают ядра только в одном состоянии — ядра сперматозоида и что это обычно ядра достаточно близких видов. Новые возможности для исследования ядерно-цитоплазматических взаимоотношений открыли опыты по инъекции в цитоплазму ооцитов или зрелых яиц амфибий ядер различного происхождения. В этих опытах экспериментатор имеет в своем распоряжении два вида цитоплазмы: из ооцитов, в которых происходит активный синтез РНК, но не ДНК, и из активированных яиц, в которых синтеза РНК нет, но активно синтезируется ДНК. Ядра могут быть изолированы на различных стадиях развития и из разнообразных тканей: от бластулы, когда идет активный синтез ДНК и еще нет синтеза РНК, и до нервных клеток, где синтеза ДНК уже нет.
Трансплантации такого рода показали полную зависимость поведения ядер от цитоплазмы: в ооцитах синтез ДНК во всех трансплантированных ядрах быстро прекращался и начинался синтез РНК. Наоборот, в ядрах, помещенных в цитоплазму зрелых яиц, прекращался синтез РНК и начиналась репликация ДНК. Изменялся и состав синтезируемых РНК: при пересадке в ооцит ядер из взрослых тканей другого вида амфибий прекращался синтез тех РНК, которые транскрибировались до трансплантации, и начинался синтез мРНК (и соответственно белков) ооцита, но РНК и белков, свойственных тому виду, чьи ядра были использованы.
Иной подход был использован при получении гибридов соматических клеток в условиях культуры тканей. Если в один сосуд для культуры тканей поместить два вида клеток и добавить туда же агент, обратимо повреждающий их оболочки, часть клеток сольется друг с другом. Слияние клеток происходит случайно, но с достаточной частотой сливаются две (или больше) различные клетки, в результате чего образуется клетка с разными ядрами — гетерокарион. В таких гетерокарионах можно наблюдать взаимоотношения разных ядер и влияние веществ из цитоплазмы одного типа клеток на ядра другого типа.
Гетерокарионы часто вступают в митоз одновременно, хромосомы при этом смешиваются и после деления образуются две одноядерные клетки (синкарионы), содержащие хромосомы обоих типов клеток. Такие клетки продолжают делиться и дают начало клонам соматических гибридов. Если для гибридизации использованы клетки разных видов животных, то обычно в ходе последующих делений часть хромосом постепенно утрачивается (элиминируется, как у отдаленных половых гибридов) и возникают клоны клеток, содержащие весь хромосомный набор одного вида и лишь несколько или даже одну хромосому другого вида. Это дает возможность исследовать функцию генов одной или немногих хромосом.
Для того чтобы выяснить, чем регулируется в клетке синтез ДНК, были получены гетерокарионы из двух клеточных линий, отличающихся по длине предсинтетического периода — G1 и периода синтеза ДНК — S. Оказалось, что в гетерокарионе синтез ДНК начинается одновременно в обоих ядрах, подчиняясь тому ядру, которое вступило в S-период раньше. Это означает, что в цитоплазме клеток в конце G1-периода появляется некое вещество, стимулирующее начало репликации. Однако продолжительность S-периода в каждом из ядер гетерокариона осталась прежней, свойственной каждой исходной линии, — этот признак, следовательно, зависит от каких-то особенностей структуры хромосом, а не от цитоплазмы.
При слиянии интерфазной и делящейся клеток в интерфазном ядре начинается преждевременная конденсация хромосом и разрушение ядерной мембраны аналогично тому, что происходит в начале митоза. В этом случае очевидно, что перед началом деления клетки в ней появляются особые факторы (белки), вызывающие спирализацию (конденсацию) хромосом и растворение ядерной мембраны.
Хариссом были получены гетерокарионы между крупными опухолевыми клетками человека линии HeLa и куриными эритроцитами, мелкие ядра которых неактивны. Попадая в окружение цитоплазмы активных клеток, эти ядра разбухают, в них входят ядерные белки человека и начинается синтез различных ГНК. В результате в таком гетерокарионе синтезируются куриные ферменты и белки мембран. В конце концов в этих ядрах начинается синтез ДНК, происходит митоз и образование одноядерных клеток, при делении которых хромосомы кур быстро утрачиваются. На этом примере видно, что при слиянии клеток с активными и неактивными ядрами происходит стимуляция синтезов РНК и ДНК в неактивном ядре, а не подавление этих процессов в активном. Отсюда следует важный вывод о том, что регуляция синтеза нуклеиновых кислот обычно осуществляется позитивно, т. е. с помощью активирующих, а не подавляющих веществ. Дальше мы увидим, однако, что это не общее правило.
При гибридизации клеток человека и хомячка или человека и мыши и длительном перевивании гибридов происходит элиминация хромосом человека, так что в итоге остаются одна — три человеческие хромосомы. Как и у многих отдаленных половых гибридов, это происходит, по-видимому, из-за некоторого несоответствия между нитями веретена и хромосомами или из-за нарушения репликации. Так как процесс элиминации в значительной степени происходит случайно, то возникают синкарионы с различными хромосомами человека, оставшимися в ядре. Это позволяет, используя селективные среды с теми или иными предшественниками биологически важных молекул и ингибиторами, блокирующими пути их синтеза, создавать искусственные условия для размножения только тех клеток, в которых сохранилась не любая, а определенная хромосома человека (их можно отличить друг от друга по размерам, форме и характеру окрашивания). А далее можно выяснить, какие белки человека синтезируются в гибридных клетках, и тем самым определить, какие гены находятся в каких хромосомах, т. е. картировать геном человека.
Может быть, наиболее интересная проблема, которую позволяют изучать соматические гибриды, — это механизмы включения и выключения генов. Однако до сих пор, несмотря на большие усилия, в этом направлении получены лишь отдельные результаты. Так, оказалось, что часто гибридные клетки — синкарионы, пройдя через много клеточных делений, сохраняют активность тех генов, которые были активны в родительских клетках перед гибридизацией. В гибридах клеток, например, крысы и мыши или даже человека и мыши продолжается синтез многих ферментов обоих видов. Ho в других случаях в гибридах работа одного из активных ранее генов подавляется. Так, например, клетки мышиной опухоли меланомы синтезируют черный пигмент — меланин, а другой вид клеток (L-клетки) его не синтезирует. При гибридизации этих клеток синтез меланина прекращается, хотя в синкарионе сохраняются хромосомы обоих типов клеток.
Клетки печени в ответ на действие стероидных гормонов резко увеличивают активность одного из ферментов — тирозинаминотрансферазы (ТАТ). При гибридизации печеночных клеток крысы с фибробластами человека способность к такой стимуляции гормоном утрачивается. Однако после ряда делений эти гибриды теряют Х-хромосому человека, и сразу после этого способность гибридных клеток реагировать активацией TAT на действие гормона восстанавливается. Этот опыт позволяет сделать два важных заключения. Во-первых, одни гены могут подавлять активность других генов. В данном случае даже известно, что этот подавляющий ген находится в Х-хромосоме. А во-вторых, оказывается, что стабильная способность к стимуляции гормоном, свойственная клеткам печени, может сохраняться как бы в «скрытом» виде, никак не проявляясь в течение многих клеточных поколений. Ho как только исчезает (с Х-хромосомой человека) подавляющий ее ген, она восстанавливается снова. Подробнее вопрос о механизмах сохранения дифференцировки в ряду клеточных поколений, т. е. об эпигенетической наследственности, мы обсудим в одной из последующих глав.
В некоторых случаях гибридизация приводит к активации генов. Об общей активации генной активности в ядрах куриных эритроцитов после их гибридизации мы уже говорили. Ho вот еще один пример. Клетки печени (и опухоли печени — гепатомы) синтезируют сывороточный альбумин. При гибридизации клеток гепатомы крысы с различными непеченочными клетками мыши или человека (фибробласты, лейкоциты и др.) у гибридов начинается синтез сывороточного альбумина, и не только крысы, но и соответственно мыши или человека. Очевидно, тот фактор, который активирует ген альбумина в печени крысы, действует и на соответствующие гены мыши и человека.
Техника гибридизации соматических клеток в последние годы дополнилась также новыми методами, позволяющими комбинировать ядра и цитоплазму из различных клеток и создавать различные варианты «реконструированных» клеток. Все эти методы получили название «клеточной инженерии». Однако они не привели пока еще к принципиальным открытиям, позволяющим понять механизмы включения генов и дифференцировки.
Развитие полноценной лягушки из ядра дифференцированной клетки (A)
Неоплодотворенное яйцо (1) облучают ультрафиолетом (2) для того, чтобы убить его собственное ядро. У большого головастика (3) выделяют кусочек кишечника (4), диссоциируют его эпителий на отдельные клетки (5) и ядро одной из них (6) пересаживают в безъядерное яйцо (7). Часть таких яиц не развивается совсем (8), часть образует уродливых зародышей (9), но из небольшой части образуются нормальные головастики (10), из которых вырастают нормальные лягушки (11)
Схема гибридизации соматических клеток (Б)
Клетки разных тканей одного или разных видов при помощи факторов, повреждающих мембрану (инактивированный вирус Сендая, полиэтиленгликоль и т. д.) сливают друг с другом, получают клетку, содержащую ядра обоих типов — гетерокарион. В ходе клеточного деления хромосомы обоих ядер образуют одно общее ядро и создают гибридную клетку — синкаркон, которая может стать родоначальницей клона гибридных клеток. В ходе дальнейших делений хромосомы одного вида могут постепенно теряться
3. Химеры животных
Техника получения химерных, или, как их еще называют, аллофенных, зародышей сейчас лучше всего освоена на млекопитающих. Этому способствует отсутствие у них ооплазматической сегрегации и, следовательно, полное равенство всех клеток на ранних стадиях. Два зародыша на стадиях двух — восьми бластомеров, извлеченных из мышей разных генетических линий (часто используют линии с разной окраской шерсти), помещают в капельку питательной среды и сближают друг с другом, так что они сливаются в один зародыш. Затем химерный зародыш переносят в матку третьей мыши, в которой и происходит его развитие. В большом проценте случаев из таких составных зародышей развиваются и рождаются совершенно нормальные мышата, состоящие из клеток двух линий. Если эти линии различались по окраске шерсти (например, черные и белые), то шкурка этих мышат будет содержать полосы черного и белого цвета.
Другой способ получения химер называется инъекционным. В этом случае используют более поздний зародыш, содержащий около ста клеток и представляющий собой полый пузырек — бластоцисту, в которой только несколько клеток — зародышевый узелок или внутренняя клеточная масса — дадут начало самому эмбриону. В такую бластоцисту инъецируют клетки зародыша другой линии. Часть этих клеток прилипает к зародышевому узелку и включается в состав развивающегося эмбриона.
При обоих методах клетки двух линий мышей распределяются в зародыше совершенно случайно, и поэтому полосы разного цвета у химерных мышат располагаются также случайно. Тем не менее американской исследовательнице Минц удалось при изучении сотен таких мышат показать, что в распределении полос того или иного цвета по шкурке есть некоторая закономерность. Существенно уже то, что окраска образует полосы, а не пятна или точки. В черный или белый цвет может быть окрашена та или иная из 17 поперечных полос, причем отдельно для правой или левой стороны головы, для спины и хвоста, т. е. всего таких полос может быть 34. Каждая из этих полос может быть белой или черной с равной вероятностью. Легко подсчитать, что в этом случае из десятков аллофенных мышат трудно встретить двух одинаково окрашенных.
Из этих опытов Минц сделала важный вывод о том, что в тот момент развития, когда пигментные клетки детерминировались, их было всего 34. Далее каждая из них в результате ряда делений образовала популяцию пигментных клеток, которые перемещались очень ограниченно, только вдоль узкой зоны кожи, идущей от хребта к животу, и каждая из них определила окраску одной полосы. Однако провести такой же анализ клеток пигментного эпителия глаза оказалось невозможно: в ходе развития черные и неокрашенные клетки перемешиваются и группу пигментированных клеток нельзя считать потомством одной первично-детерминированной клетки. Опыты с химерами позволили получить и другие интересные данные, хотя их интерпретация не всегда может быть однозначной.
Пол восьмиклеточных зародышей в момент их слияния друг с другом неизвестен, и поэтому в 50 % случаев возникают химеры, состоящие из смеси женских клеток с двумя Х-хромосомами (XX) и мужских клеток с половыми хромосомами (XY). Оказалось, что чаще, хотя и не всегда, пол таких химер мужской, причем нередко возникают гермафродиты, у которых одна половая железа мужская, а другая — женская. Можно думать, что пол железы определяется случайно возникающим соотношением в ней клеток с XX- и XY-генотипами, причем XY-клетки оказывают более сильное влияние.
У химерных мышей в крови присутствуют эритроциты обеих линий, но оказалось, что доля эритроцитов одной из линий мышей (С57В1) всегда больше, чем другой (СЗН). Очевидно, способность кроветворных клеток к размножению у разных линий мышей различна. Зато в печени у этих химер преобладают клетки линии СЗН.
Кровь химерных мышей содержит лимфоциты обеих линий, которые толерантные (совместимы) с тканями обеих линий. Это означает следующее: кусочки кожи линии С57В1, пересаженные на тело мыши СЗН, быстро отторгаются. He толерантны и обратные пересадки с СЗН на С57В1. Ho кусочки кожи обеих «родительских» линий мышей хорошо приживаются на химерных мышах, полученных из этих двух линий. Мы вернемся к вопросу о тканевой совместимости в главе об иммунитете.
Очень интересны химеры в отношении их способности к образованию опухолей. Так, линия мышей АКР отличается высокой частотой опухолей лимфатической ткани — лимфом, а линия СЗН — опухолей печени — гепатом. У химер между этими линиями возникают и те и другие опухоли, причем лимфомы всегда образуются из клеток АКР, а гепатомы — из СЗН. Создается впечатление, что опухоли возникают совершенно автономно от остального организма и определяются только генотипом клеток. Однако если получать химеры различных высокораковых линий с низкораковой линией СВА, то частота образования опухолей заметно снижается. Механизм этого важного явления пока непонятен.
Особо следует остановиться на опытах с инъекционными химерами, когда в бластоцисту вводили клетки особой опухоли — тератокарциномы. Эту опухоль можно получить искусственно, если пересадить нормальный зародыш какой-либо линии мышей под кожу взрослой мыши и потом регулярно переносить растущий трансплантат от мыши к мыши. В результате возникает тератокарцинома — перевиваемая опухоль, в центре которой находятся быстро размножающиеся недифференцированные клетки, а по периферии образуются участки самых различных дифференцированных тканей. Но при инъекции в бластоцисту центральной части такой опухоли ее клетки входят в состав зародыша и перестают быть опухолевыми. Они ведут себя как обычные химеры, т. е. становятся нормальными клетками различных органов взрослой мыши. Вероятно, это первый пример того, как опухолевые клетки под влиянием эмбриональных тканей превращаются в нормальные клетки организма. Однако потомство с генотипом опухолевой линии от этих химерных мышей получить пока не удалось. Клетки тератокарциномы, являясь опухолевыми, сохраняют большие потенции и могут дифференцироваться во многих направлениях, но способность образовывать нормальные половые клетки ими, вероятно, все же утрачивается. Особые химеры были получены в нашей стране Н. Г. Хрущовым. Облученной мыши, чьи кроветворные клетки были убиты, в кровяное русло вводили клетки костного мозга или селезенки крысы. У мыши образовывались кроветворные колонии крысиных клеток. Их судьбу и дальнейшие превращения было легко проследить благодаря особенностям мышиных и крысиных клеток, легко различимым под микроскопом.
У дрозофилы химеры создаются при инъекции эмбриональных ядер одной линии мух в оплодотворенное яйцо другой линии, имеющее свои ядра. Судьба инъецированных ядер зависит от места их введения. На заднем конце яйца они становятся половыми клетками. В других частях яйца они попадают в ту или иную область поверхностной цитоплазмы и соответственно образуют клетки, входящие в состав тканей личинки или взрослой мухи. При этом они сохраняют отличительные особенности своей генетической линии. Сходный результат получают и при инъекции в яйцо ядер из некоторых многократно перевиваемых культур клеток дрозофилы, но половые клетки при этом не образуются. Очень важно, что при некоторых обстоятельствах клетки еще не теряют способности к дифференцировке, но уже не могут образовать половые клетки. Это заставляет взглянуть на зародышевый путь не как на полезную абстракцию, а как на определенную реальность.
В этой главе мы старались показать, как различные способы гибридизации создают комбинации двух генотипов и цитоплазмы или комбинации клеток с разными генотипами. Возможности, которые открывают эти методические подходы, еще не исчерпаны, и работа в этих направлениях (особенно с соматическими гибридами и с химерами) активно продолжается. Гибридизация животных и растений уже привела к огромным практическим достижениям в получении новых пород и сортов. Можно ожидать, что и методы «клеточной инженерии» дадут не только важные теоретические, но и чисто практические результаты.
Слияние ранних зародышей приводит к появлению аллофенных мышей (химер)
Эмбрионы мышей разных линий (например, с черной и белой окраской) на стадии восьми клеток извлекают из материнских организмов, освобождают от оболочек и сближают. При этом образуется один зародыш смешанного происхождения. Его пересаживают в третью мышь — «мать-воспитательницу», которая и рождает химерных мышат
Глава VIII Манипуляции с молекулами
В предыдущих главах мы неоднократно говорили о роли ДНК, о функции генов, о синтезе РНК как о первом этапе реализации генетической информации. Почти во всех случаях об этих молекулярных процессах судят, не видя самих молекул, фактически не дотрагиваясь до них. В лучшем случае синтез РНК или белка определяют по скорости включения в эти вещества их радиоактивных предшественников — нуклеотидов или аминокислот. В этой главе речь пойдет об опытах, Которые проводят почти исключительно в пробирках с чистыми препаратами ДНК и РНК, выделенными из клеток. Если исследование скорости синтеза макромолекул фактически заканчивается их выделением, то в работах, которые мы здесь обсудим, исследования с этого только начинаются.
При нагревании ДНК выше 80–90° водородные связи, соединяющие комплементарные пары нуклеотидов друг с другом, разрываются и двойная спираль ДНК распадается на две одиночные нити. Это называется денатурацией ДНК. Если теперь несколько понизить температуру раствора и поддерживать ее такой достаточное время (это называется отжиг), то водородные связи между отдельными комплементарными основаниями (А и Т, Г и Ц) будут возникать снова. Однако устойчивая двойная спираль ДНК образуется лишь в том случае, если эти связи восстановятся на достаточно большом протяжении молекулы, т. е. если случайно встретятся две одиночные нити, комплементарные друг другу. Это называется ренатурацией ДНК.
Ренатурация происходит с тем большей скоростью, чем выше в растворе концентрация комплементарных друг другу отрезков ДНК. Поэтому если ренатурация происходит быстро, то данная последовательность ДНК представлена в геноме большим числом копий. И наоборот, если какая-то последовательность нуклеотидов редка и составляет лишь небольшую долю всей ДНК, то и случайная встреча двух таких комплементарных нитей происходит редко, а ренатурация такой уникальной ДНК будет идти очень медленно. Так, по скорости ренатурации можно судить о том, как часто представлены в геноме те или иные гены.
Одиночная нить ДНК может связываться водородными связями и с комплементарной ей нитью РНК, образуя гибридную ДНК-РНКовую молекулу. Естественно, что комплементарными ДНК могут быть только те РНК, которые ранее были транскрибированы с нее или с точно такой же ДНК. Это позволяет исследовать, какая часть ДНК участвует в синтезе РНК и, наоборот, какие виды РНК присутствуют в клетке на разных стадиях развития или в разных тканях организма.
Манипуляции с молекулами нуклеиновых кислот стали особенно разнообразными и эффективными после того, как появились методы генной инженерии. С их помощью удалось обнаружить в эмбриональных клетках слабую активность многих тысяч генов, которые до того считались «молчащими», а также подсчитать количество копий различных мРНК, и в том числе мРНК для некоторых отдельных белков. Эти данные заставляют сейчас по-новому пересмотреть многие, казалось бы уже устоявшиеся, представления.
1. Ренатурация ДНК с ДНК
Для исследования ренатурации ДНК ее предварительно разрезают на небольшие куски, но 300–600 пар нуклеотидов, денатурируют нагреванием, а затем подвергают длительному отжигу при температуре 70–80°, при которой случайные короткие комплементарные последовательности распадаются, а ренатурируют лишь большие комплементарные участки ДНК, фактически те самые, которые оказались разделенными при денатурации.
Ренатурация ДНК вирусов происходит очень быстро. Так как скорость ренатурации зависит от концентрации ДНК (C0), то точнее говорить, что для вирусной ДНК низко произведение концентрации на время ренатурации (C0t). Это и понятно, так как количество генов в геноме вирусов мало (порядка сотни) и вероятность одиночной нити ДНК «найти» «свою» вторую половину достаточно велика. Ренатурация ДНК бактерий происходит значительно дольше — число различных генов и, следовательно, число различных последовательностей ДНК в этом случае выше в десятки раз.
Казалось, можно было предсказать, что ренатурация ДНК животных должна идти еще намного медленнее (величина C0t должна быть выше). Однако фактически это не совсем так. Определенная часть ДНК (около 10 %) ренатурирует очень быстро, как у вирусов или еще быстрее. Еще некоторая, иногда значительная часть ДНК ренатурирует тоже довольно быстро, хотя и медленнее, чем у вирусов и бактерий. И лишь остальные 50–70 % ДНК (иногда меньше) ренатурируют так медленно, как это и ожидалось (C0t в 103 раз выше, чем для ДНК бактерий).
Объяснение этому факту — в том, что часть ДНК в геноме животных и растений состоит из повторяющихся последовательностей ДНК. Действительно, если какие-либо гены повторяются сотни или тысячи раз, то их концентрация в растворе соответственно возрастает и скорость их ренатурации будет выше, чем для генов, которые уникальны, т. е. представлены в геноме только один раз. He все повторяющиеся последовательности являются настоящими генами, т. е. несут информацию о структуре белка. Так, особенно высоко повторяющиеся последовательности (104—105 раз на геном) состоят из одинаковых коротких, идущих друг за другом (тандемных) участков и находятся на концах хромосом и в тех точках, к которым прикрепляются нити веретена при митозе. Очевидно, что эти ДНК служат не для кодирования белков, а выполняют в хромосоме какую-то механическую роль.
Среди умеренных повторов (102-103 раз) роль некоторых известна; Это прежде всего те участки ДНК, которые кодируют РНК для белоксинтезирующей машины. Хотяэти участки ДНК и не кодируют белки, но их тоже часто называют генами. Так, гены больших рРНК (18S и 28S) повторяются от нескольких десятков раз у насекомых до тысяч раз у отдельных рыб и амфибий.
Еще чаще повторяются гены для маленького компонента рибосомной РНК — 5S РНК: у ксенопуса их 24 000, а у человека 2000. Наконец, гены для транспортных РНК(их более 40 видов) также повторяются сотни и тысячи раз, но для разных видов тРНК число этих повторов различно.
Смысл таких повторов для генов рРНК и тРНК, очевидно, состоит в том, чтобы обеспечить достаточное количество рибосом и скорость трансляции на них в тех клетках, где синтез белка особенно интенсивен. В первую очередь это относится к ооцитам, в которых гены больших рРНК еще и амплифицируются (гл. 2).
Оказалось, что повторяются, хотя и не в такой степени, и некоторые настоящие гены, кодирующие белки. В наибольшей степени это относится к генам гистонов: в хромосомах морского ежа каждый из них повторяется несколько сот раз. Гены многих других белков повторяются два— четыре раза.
Эти повторы в ДНК создают определенную проблему для понимания процессов эволюции. С одной стороны они должны замедлять течение эволюции. Случайная мутация, затронувшая один из повторяющихся генов, в принципе не должна подвергаться действию отбора. Так, например, мутация в одном из генов рРНК или в одном из гистоповых генов окажет очень небольшое полезное или вредное влияние на работу рибосом или ядер: ведь вся остальная, подавляющая масса рРНК или гистонов окажется неизменной. Ho если это так, то с течением времени такие «неотбираемые» мутации должны накапливаться в геноме и создавать все большие отличия между ранее одинаковыми генами. Ho в действительности таких различий нет или очень мало. Отсюда возникли предположения, которые уже нашли некоторые фактические подтверждения, о том, что в клетках существует какой-то механизм коррекции, который исправляет постоянно возникающие отличия между повторами или скорее заменяет каждый набор повторяющихся генов точными копиями одного из них. Тогда в эволюции естественный отбор сохранит лишь те организмы, у которых гены рРНК или гистонов остались неизменными пли стали «лучше», чем были.
Скорость эволюции гистонов очень мала, т. е. они чрезвычайно сходны даже у далеких видов. Это и понятно: у всех животных и растений гистоны тесно связаны с ДНК, химическая природа которой остается неизменной. Очевидно, эволюция гистонов в основном закончилась более миллиарда лет назад, когда возникли эукариоты с настоящими хромосомами. Каждое изменение в структуре гистонов настолько затрагивает все строение и функционирование хромосом, что крайне редко оказывается полезным или хотя бы безвредным.
Ho с другой стороны, повторение некоторых генов, кодирующих белки, открывает для эволюции новые возможности. Если вдоль хромосомы происходит удвоение участка ДНК и появляются два одинаковых гена, то далее один из них может выполнять свою обычную функцию, в то время как второй будет изменяться в эволюции, не нарушая работу клетки убийственным для нее образом. Таким путем, очевидно, возникли варианты одного фермента — изоферменты, а также многие различные сейчас ферменты, имеющие, однако, общие черты строения. Сравнивая порядок аминокислот в разных белках и обнаруживая их большое сходство (такие сравнения сейчас делают на ЭВМ), можно детально проследить, какой белок от какого произошел и примерно когда это было.
Хорошим примером такой молекулярной эволюции могут служить гены, кодирующие белковую часть гемоглобина — глобин. Сейчас насчитывается около десяти видов глобинов, причем одни из них отличаются друг от друга незначительно, а у других произошла замена десятков аминокислот. Большинство из них участвует в образовании гемоглобина крови, но один из них, наиболее отличающийся от других, — миоглобин находится в мышцах.
Возвращаясь к повторяющимся последовательностям ДНК, надо сказать, что сегодня мы можем удовлетворительно объяснить назначение только небольшой их части. Некоторые повторы транскрибируются, но не кодируют белки. Предполагается, что они могут играть регуляторную роль. Ho многие повторы, а их большинство, вообще не транскрибируются, и роль их неизвестна.
2. Гибриды ДНК и РНК
При отжиге смеси РНК и денатурированной ДНК происходит образование гибридных двуспиральных молекул ДНК — РНК, причем РНК гибридизуется с комплементарными ее нитями, т. е. с теми же генами, с которых она была ранее транскрибирована. Этот опыт можно ставить в двух вариантах и в зависимости от этого решать две разные задачи. Если в растворе создать большой избыток ДНК, то на нее можно собрать значительную часть мРНК и таким образом судить о количестве различных РНК: чем меньший избыток ДНК требуется, тем меньше молекул данного вида РНК приходится на один активный ген. Наоборот, если в растворе создать избыток РНК, она «закроет» все гены, на которых она была ранее транскрибирована. Если теперь определить долю ДНК, образовавшей гибриды с РНК, можно будет сказать, какая часть генов была активной на этой стадии развития.
Недостатком этих методов и большинства работ, проведенных в минувшие годы с их помощью, является то, что в обычных условиях в первую очередь происходит гибридизация повторяющихся генов, а уникальные гены, представляющие наибольший интерес, так просто не выявляются: для них необходимы, как мы знаем, очень высокие концентрации ДНК и долгое время отжига. В последующие годы появились новые методы — сначала выделяли только уникальные гены, а затем уже проводили с ними эксперименты по гибридизации.
Методами гибридизации ДНК — РНК были получены многие интересные результаты. Так, было показано, что мРНК, запасенная в оогенезе, сохраняется в зародыше долгое время и используется для синтеза белка. Постепенно ее количество уменьшается и она замещается новосинтезированными РНК. Разнообразие этих новых РНК все время возрастает, очевидно, за счет того, что в зародыше по мере развития увеличивается количество различных органов и видов тканей, в которых синтезируются свои специфические белки и, значит, работают особые гены.
Было также показано, что уже в ооците лягушки активно около 2 % всей ДНК. Эта цифра в 60-е годы не показалась удивительной, так как тогда было неизвестно, какая часть ДНК представлена настоящими генами, а какая — участками, не кодирующими белки. Сейчас известно, что белки кодируются лишь небольшой частью ДНК, составляющей у амфибий менее 5 %. Ho если это так, то 2 %всей ДНК — это почти половина от общего числа генов. К таким же выводам приводит и другой расчет. Общее число уникальных генов у амфибий, по-видимому, не превышает 40–50 тыс. Ho 2 % всей ДНК соответствует приблизительно 20 тыс. генов среднего размера, т. е. половине всех генов. К таким же удивительным результатам привели и измерения числа активных генов у зародышей морского ежа. Ho для этого потребовались уже другие, более совершенные методы манипуляции с молекулами ДНК и РНК.
3. Генная инженерия
Этим термином называют различные методы, в основе которых лежит синтез различных ДНК invitro, их размножение в бактериальных клетках и затем использование для выяснения структуры и функции генов. Для методов генной инженерии используют ферменты, полученные из бактерий или клеток, зараженных вирусами. Среди них набор рестриктаз — ферментов, разрезающих ДНК в совершенно определенных точках. Для каждой рестриктазы (их сейчас известно более 70) характерна своя определенная последовательность из четырех-шести пар нуклеотидов ДНК, которую фермент «опознает» и выбирает для своего действия.
Решающую роль в генной инженерии играет особый вирусный фермент, который называется «обратная транскриптаза». С его помощью осуществляется синтез ДНКна РНК. Это позволяет как бы синтезировать гены, точнее, получать точную ДНКовую копию всех или одного вида РНК. Этот «ген» не будет настоящим уже потому, чтов нем не будет копий интронных участков, которые не попадают в состав мРНК.
Наконец, существует возможность «встроить» готовую ДНК — синтезированный ген (копию мРНК) — в особую кольцевую ДНК-плазмиду, способную автономно размножаться в бактериальных клетках. Это позволяет получить нужный нам вид ДНК практически в неограниченном количестве.
Размножение бактерий, содержащих введенную Плазмиду, позволяет получить «библиотеку» генов. Если ДНК, выделенную из клеток, разрезать на части, встроить в плазмиду, ввести в бактерии и их выращивать, то в культуре будут расти бактерии, в принципе содержащие все районы ДНК, т. е. все гены. Из такой культуры можно выделить по одной бактерии и из каждой выращивать отдельный клон бактерий вместе с плазмидами и вставленными в них ДНК животного. В каждом таком клоне будет содержаться только один отрезок ДНК животного, ведь бактерия — родоначальница клона была заражена только одной плазмидой с одной встроенной в нее молекулой (отрезком) ДНК. Если размеры такого отрезка ДНК невелики, то он будет содержать не более одного-двух генов. Размножая бактерии одного клона, можно выделять из них любые количества совершенно одинаковых отрезков ДНК. Часто это будут отдельные гены с окружающими их районами. Вырастив из одиночных бактерий сотни или тысячи разных клонов, можно таким путем получить большой набор отдельных генов, разделенных по разным клонам. Это и есть «библиотека» генов.
В принципе в такой «библиотеке» содержатся все гены, отделенные друг от друга и многократно размноженные, т. е. клонированные. Однако найти в такой «библиотеке» нужный ген не так просто, Для этого используют такие клетки животных, где этот ген активно работает. Для генов глобина это будущие эритроциты — эритробласты, длягена овальбумина это клетки яйцевода кур. Из таких клеток получают мРНК, а из них пытаются выделить в чистомвиде один вид мРНК, например глобиновую. Имея такую мРНК, можно путем гибридизации проверить все клоныДНК и, если удастся, найти тот, в котором окажется нужный нам ген. Далее уже клон бактерий, содержащий этотген, будет постоянным его источником.
Используя эти сложные и трудоемкие методы, мы получили такие данные, которые вполне оправдали все усилия. Были, например, изучены гены глобина, овальбумина и десятки других и установлено их сложное строение с чередованием экзонов, кодирующих часть полипептидной цепи, и интропов, не несущих информации о белке. Очень немногие гены не содержали интронов, часто их было от двух до семи, но иногда попадались гены, расколотые на десятки экзонов, отделенных друг от друга нитронами. Смысл этого пока непонятен.
Часть генов была секвенирована, т. е. в них была определена последовательность нуклеотидов как в самом гене, так и в непосредственной близости от него. Наконец, некоторые гены (5SРНК и гены гистонов) были подвергнуты «хирургическим операциям»: от них отрезали кусочки различной длины и после этого проверяли, сохранил ли такой ген способность к быстрой и правильной транскрипции. Это позволило выявить вблизи гена или в нем самом регуляторные участки.
Имея клонированные и идентифицированные гены, можно исследовать не только их строение, но и функцию в клетке. Так, их можно, например, гибридизировать с политенными хромосомами дрозофилы и установить локализацию отдельных генов. Их можно гибридизировать с РНК из различных клеток или из разных стадий развития. Такой метод очень чувствителен и позволяет обнаружить такие РНК, которые содержатся в количестве одной-двух молекул на клетку. С помощью этих методов можно оцепить, сколько видов РНК синтезируется в клетке и в каком количестве копий представлены эти виды. Можно также выявить, сколько копий, в какой ткани и на какой стадии развития содержит клетка отдельных конкретных (индивидуальных) мРНК. Работа во всех этих направлениях ведется сейчас в десятках лабораторий мира, но возможности таких исследований еще далеко не исчерпаны.
4. Число активных генов и число копий мРНК
Методы генной инженерии, примененные к эмбриологическим объектам, показали, что в их клетках активно значительно больше генов, чем это считали раньше. Так, в ооцитах морских ежей активно около 40 тыс. генов, на бластуле и гаструле — не менее 20 тыс. и т. д. Только в дифференцированных тканях взрослого организма эти числа снижаются до 2–3 тыс. Такое же большое число активных генов было найдено и в других типах клеток: в культуре тканей млекопитающих — 20–40 тыс. генов, в культуре клеток дрозофилы — более 5 тыс., т. е. почти все ее гены.
Создается парадоксальная ситуация — в клетках активно слишком много генов. Некоторое понимание происходящего оказалось возможным тогда, когда удалось определить число копий одинаковых мРНК, приходящихся на одну клетку. Оказалось, что по числу копий эти мРНК можно разбить на три класса: очень немногие виды мРНК, которых в клетке содержится много тысяч копий, десятки или сотни видов мРНК, представленных сотнями и тысячами копий, и, наконец, много тысяч видов мРНК, каждый из которых содержится в клетке в количестве от 1до 10 копий. Так, например, в железистых клетках яйцевода, синтезирующих овальбумин и другие компоненты куриного белка, содержатся три вида мРНК: представленные в среднем 25 тыс. копий на клетку, еще 90 видов мРНК содержатся в клетке по 450 копий каждая и 24 тыс. генов функционируют так слабо, что в клетке содержится в среднем менее трех копий каждой такой мРНК. У морского ежа на стадии гаструлы 90 % всей мРНК представлено лишь всего 100 видами молекул (по 1000 копий каждой), а остальные 10 % составляют 10 тыс. видов мРНК по I—10 копий на клетку.
Итак, наряду с относительно небольшим числом активно работающих генов в эмбриональных и дифференцированных клетках большое число генов (может быть, все?) функционируют очень слабо, так что нельзя определить, синтезируется ли тот белок, который мог бы ими кодироваться. О возможной функции этих слабоактивных генов можно сделать несколько предположений, впрочем не исключающих друг друга. Может быть, некоторые виды ферментов или белковых структур в клетке нужны в таких небольших количествах, что для их синтеза достаточно и нескольких молекул мРНК. Таковыми, например, должны быть белки центриоли, которых в клетке всего одна или две. Может быть, это регуляторные белки, действующие на отдельные гены, и тогда их содержание в клетке или на хромосомах тоже измеряется десятками молекул. Например, у кишечной палочки нормальная концентрация одного из регуляторных белков всего 10 молекул на клетку. И наконец, можно предположить, что слабая функция генов не имеет никакого значения, а отражает некоторое несовершенство регуляторного аппарата, запирающего гены. Что-то вроде неплотно прикрытых «подтекающих» кранов. Здесь опять напрашивается сравнение с хорошо изученными бактериями. У них ген в активном состоянии транскрибирует РНК в 1000 или даже в 10 000 раз быстрее, чем в неактивном, но это же означает, что и на неактивном гене происходит транскрипция одиночных молекул мРНК. Вместе с тем выше уже говорилось, что на разных стадиях развития животных количество слабо работающих генов различается. Оно уменьшается по ходу развития от 20–40 до 10–15 тыс., а в дифференцированных тканях падает до 2–3 тыс.
Метод гибридизации с ДНК отдельных генов позволяет оценить, как в ходе дифференцировки происходит накопление мРНК. Так, в клетках яйцевода молодых курочек содержится в среднем на клетку около одной молекулы мРНК овальбумина. После четырех ежедневных инъекций эстрадиола их становится 20 тыс., а через десять дней — 50 тыс. Если после этого инъекции прекратить, то количество молекул мРНК снова падает до пяти в одной клетке. Ho после однократной повторной инъекции гормона уже через 30 мин их становится 10, через час — 100, через три часа — 1000, а через сутки — 10 тыс. У взрослых кур мРНК синтезируются со скоростью около 30 молекул в минуту и половина их распадается приблизительно за сутки. При таком соотношении скоростей транскрипции и распада в каждой железистой клетке яйцевода курицы их накапливается более 100 тыс., что и обеспечивает интенсивный синтез овальбумина.
Этот пример показывает, что количество мРНК в клетке в равной мере зависит от скоростей их синтеза и распада и может регулироваться как той, так и другой величиной. Американский ученый Кафатос исследовал у бабочки павлиноглазки синтез особого фермента — коконазы, с помощью которого молодая бабочка растворяет стенку кокона и выходит из него. Оказалось, что мРНК коконазы в специальной железе вылупления образуется (транскрибируется) не быстрее многих других видов мРНК. Однако у большинства мРНК в клетках железы время жизни половины молекул 2,5 ч, в то время как для мРНК коконазы это время в 40 раз больше (100 ч). Только благодаря этому доля мРНК коконазы увеличивается от 8 % (от количества всей мРНК) в начале ее синтеза до 70 % через два-три дня. В результате клетки железы почти целиком заполняются ферментным белком, который в нужный момент обеспечивает выход бабочки.
В начале развития мышц уже в эмбриональных миобластах начинает синтезироваться мРНК основного сократительного белка — миозина. Время полураспада этих мРНК 10 ч, и их количество в миобластах невелико. Ho когда миобласты сливаются друг с другом и начинают образовывать собственно мышцы, время жизни мРНК миозина увеличивается до 50 ч и резко увеличивается количество этих мРНК в молодых мышцах, в которых начинается быстрое накопление самого миозина.
Мы видим, что манипуляции с молекулами — методы молекулярной биологии и особенно методы генной инженерии — открыли совершенно новую главу в понимании проблем биологии развития. Молекулярный уровень этой науки, который казался самым недоступным, напротив, оказался более легким для изучения, чем, например, взаимоотношения более сложных систем — клеток и тканей. Успех молекулярных исследований показывает, что каждый новый шаг связан с развитием нового метода. Это, очевидно, должно стимулировать создание новых подходов и методов в тех направлениях биологии развития, которые пока отстают от молекулярных.
Глава IX Изменяются ли гены в развитии?
Обсуждение этой проблемы началось, по-видимому, с А. Вейсмана, который предположил, что при делении соматических клеток раннего зародыша «зародышевая плазма» (нынешняя ДНК) распределяется между дочерними клетками так, что в них попадают разные ее части — детерминанты (нынешние гены). В пользу этих представлений Вейсмана свидетельствовали наблюдения над потерей частей хромосом в соматических клетках во время первых делений дробления у аскариды. Сейчас, когда известно, что феномен утраты части генома аскариды и другие случаи явной потери генетического материала являются отнюдь не общим правилом, эти идеи Вейсмана имеют лишь исторический интерес.
Сегодня проблема, поставленная Вейсманом, может быть сформулирована иначе: происходят ли в ходе развития необратимые изменения в организации генетического материала и какое значение эти изменения, если они есть, имеют для механизмов развития? Уже первые опыты по разделению двух-четырехклеточных зародышей амфибий и морского ежа на отдельные бластомеры и по получению из них полноценных зародышей показали, что в ходе делений генетический материал сохраняется в обеих дочерних клетках полностью и необратимо не изменяется. Далее Г. Шпеман подтвердил это остроумным опытом и для стадии 16 клеток. Если яйцо тритона перетянуть петлей не полностью, то делиться будет только одна половина, в которой оказалось ядро. На стадии 16 клеток одно ядро пропускали во вторую половину зародыша и
Затем перетягивали зародыш на две части полностью. И тот зародыш, который получил 15 ядер из 16, и тот, что получил только одно, образовали нормальных зародышей.
Эти опыты показали неверность гипотезы Вейсмана, но не могли осветить современный аспект проблемы: не происходят ли в ходе дифференцировки в ядрах необратимые изменения, ограничивающие их тотипотентность — способность обеспечить развитие целого зародыша, т. е. дифференцировку во всех направлениях? На стадии 16 клеток у амфибий дифференцировки еще нет. Для этого было необходимо испытать ядра на более поздних стадиях.
Дальнейшее развитие техники ядерных трансплантаций, как мы увидим, тоже не дало окончательного ответа на эти вопросы. Новые молекулярные методы дали в самые последние годы совершенно неожиданные результаты, однако вопрос еще далек от полного разрешения.
1. Трансплантация ядер
В 1953 г. американские ученые Бриггс и Кинг осуществили знаменательный эксперимент: из неоплодотворенного яйца лягушки было удалено собственное ядро и на его место пересажено ядро другого зародыша, взятое со стадии бластулы. Фактически трансплантировали всю клетку бластулы, но мембрана ее была разрушена всасыванием в тонкую пипетку, а ядро оставалось неповрежденным. Яйцо с ядром из бластулы в значительном проценте случаев начинало нормально делиться, образовывало зародыш, головастика и наконец лягушку. На всех этих стадиях часть животных погибала, но во многих случаях были получены взрослые нормальные лягушки, которые дали потомство. Техника пересадки была усовершенствована Гёрдоном, и процент удачных трансплантаций был повышен.
Однако, если брать ядра на более поздних стадиях — гаструлы, хвостовой почки и т. д., процент удачных опытов будет все более уменьшаться. Даже ядра из клеток кишечника головастика в некоторых случаях дали начало нормальному эмбриональному развитию. Сходный результат был получен, когда для пересадки использовали ядра из клеток опухоли и из клеток кожи взрослой лягушки, хотя в таких опытах далее головастика развитие не шло. Ядра, полученные из клеток разных тканей, сильно отличались по их пригодности к трансплантации. Ho в целом стало очевидно, что в ходе дифферёнцировки способность ядер давать начало нормальному развитию яйца падает.
Эти опыты были успешно повторены различными исследователями на разных видах амфибий. Однако ни в одном случае из ядер клеток взрослого животного не было получено ни одного взрослого животного. Поэтому если в начале шла речь о том, что на поздних стадиях ядра легче травмируются (и такие повреждения действительно часто обнаруживались), то сейчас очевидно, что одним этим объяснить неудачи нельзя.
Опыты на дрозофиле дали в принципе сходные результаты. Здесь ядра инъецировались в оплодотворенное яйцо, где в момент трансплантации происходили деления собственных ядер. Трансплантированные ядра со стадии бластулы, взятой от другой, иначе пигментированной линии мух, смешивались с собственными ядрами и участвовали в образовании различных органов, показывая тем самым свою тотипотентность. Более того, когда ядра бластулы попадали в заднюю часть яйца, они образовывали нормальные половые клетки, из которых получали мух той линии, чьи ядра были трансплантированы.
Однако, если в оплодотворенное яйцо трансплантировали ядра из клеток культуры тканей, участие этих ядер в образовании различных органов было существенно реже, чем при инъекции эмбриональных ядер. И в этом случае полученные мухи уже никогда не давали потомства с генетическими признаками трансплантированной линии, т. е. половые клетки из таких ядер не возникали. Это тоже свидетельствует о каких-то ограничениях потенций.
Может быть, со временем дифференцированные ядра удастся каким-то неизвестным пока образом перевести в менее дифференцированное состояние и тогда их трансплантация с поздних стадий или из клеток взрослого организма окажется успешной. В пользу такой возможности свидетельствуют неудачи трансплантации ядер из клеток зародышевого пути — мужских половых клеток на стадии сперматогоний, когда они еще не начали дифференцироваться в сперматозоиды. В этом случае генетический материал явно не имеет необратимых изменений. Поэтому неудачи легче объяснить техническими трудностями трансплантации, чем принципиальной невозможностью. Тем не менее проще допустить, что в ходе дифференцировкп в ядрах нарастают необратимые изменения.
Такой проблемы, по-видимому, практически не существует у растений. Там из некоторых видов отдельных клеток взрослого растения удается выращивать целые растения. Этот результат может служить подтверждением отличий растений от животных: у растений многие клетки взрослого организма могут стать клетками зародышевого пути и давать начало новым поколениям.
Если действительно окажется, что у взрослого животного ядра дифференцированных клеток необратимо теряют способность к нормальному развитию, то значительно осложнится заманчивая идея о «клонировании людей», уже обыгранная фантастами и обсужденная с разных сторон учеными. Мы коснемся здесь только биологической стороны вопроса.
Для практического использования метода «клонирования людей» необходимо: а) трансплантировать ядра из клеток взрослого организма и получать нормальное развитие вплоть до взрослого организма; б) распространить эти опыты на млекопитающих: недавно поступили сведения, что после долгих усилий у мышей удалась трансплантация ядер, но пока только из ранних эмбриональных клеток; в) получить уверенность, что результаты всегда будут успешными. Тогда пересадка в безъядерную яйцеклетку человека ядра из клетки взрослого человека и возвращение такой яйцеклетки в женский организм привели бы к рождению ребенка, который генетически был бы однояйцовый близнец донора, от которого было получено ядро. Это означает, что не только внешний вид, но с большой вероятностью и умственные способности были бы тождественны или близки у донора и его «близнеца», который отличался бы от обычных близнецов лишь разницей в возрасте. Если все это оказалось бы так, то перед человечеством открылась бы возможность «повторять» отдельных гениальных ученых или деятелей искусства и даже увеличить их число в большом числе копий. Мы можем не касаться деталей и возникающих проблем — слишком все это пока фантастично. Ho если бы такая идея была осуществлена, это могло бы значительно повысить интеллектуальный и творческий потенциал всего человечества.
2. Молекулярные методы изучения изменений ДНК в ядрах
В предыдущей главе мы уже говорили о гибридизации молекул ДНК. Этот метод позволяет сравнивать, в частности, ДНК, полученные из разных стадий развития одного вида. Если гибридизация ДНК раннего зародыша и взрослого животного полная, то можно говорить, что потерь ДНК в ходе развития не происходит. Имеющиеся сегодня данные говорят именно об этом. Однако точность гибридизации ДНК — ДНК хотя и велика, но еще недостаточна, чтобы говорить о неизменности отдельных генов. Поэтому пока можно утверждать лишь отсутствие существенных потерь в ДНК, но не отсутствие более мелких изменений в отдельных генах.
Долгое время в дифференцированных клетках шли поиски явления амплификации генов, подобного тому, что происходит в ооцитах с генами рибосомной РНК. Казалось, что амплификация должна быть в терминальных и узкоспециализированных дифференцировках, таких, например, как в клетках шелкоотделительной железы шелкопряда, синтезирующей почти исключительно фиброин шелка, и где должны быть исключительно активны лишь один или несколько генов. Однако оказалось, что как раз в этих клетках амплификации обнаружить не удалось, а преимущественный синтез одного белка достигается иными способами — например, большим временем жизни мРНК, в результате чего они накапливаются в клетке. В последние годы амплификацию, однако, удалось обнаружить в нескольких, пока немногих, случаях.
Особый круг явлений был обнаружен при действии па клетки культуры тканей метотрексата — ингибитора фермента дигидрофолатредуктазы. При этом происходит постепенное, в течение многих клеточных поколений, многократное увеличение числа генов этого фермента, так что его активность в клетках возрастает в сотни и тысячи раз. Этот процесс часто называют амплификацией, хотя в данном случае речь идет не о процессе развития (как в оогенезе), а о процессе клеточной эволюции. Число генов дигидрофолатредуктазы умножается лишь у очень немногих клеток, которые единственно и остаются живыми в среде, содержащей ингибитор, т. е. отбираются. Увеличение количества генов происходит, однако, не в результате обычных мутаций: было показано, что на первых этапах увеличивается число генов фермента во внехромосомных фрагментах ДНК, которые лишь позже (при непрерывном действии отбора) встраиваются в хромосомы, создавая в них большие повторяющиеся участки, содержащие ген фермента. Таким образом, речь все же идет об эволюционных изменениях генома, но в нем участвуют плохо пока изученные механизмы выщепления генов из хромосомы, их размножения и последующего, через ряд поколений клеток, встраивания в геном.
Об изменении генома можно, по-видимому, говорить и при политенизации хромосом (например, у дрозофилы): в некоторых их участках (высоко- и среднеповторяющиеся последовательности, и в том числе рРНК) репликация происходит меньшее число раз и в результате возникают недореплицированные районы хромосом.
Амплификацию генов в процессах развития, безусловно, можно отнести к изменению генетического материала, но необратимой ее назвать нельзя: ведь сама хромосома при этом не изменяется. К тому же амплификация проходит совершенно «безвредно» для клеток зародышевого пути — ооцитов, где ее и обнаружили. Этого нельзя сказать об эволюционной амплификации, так как после встраивания многократно повторенных генов в хромосомы, эти изменения генома являются необратимыми, хотя могут подвергаться обратным эволюционным изменениям. Клетки — носители таких изменений — имеют преимущества только при размножении в среде, содержащей метотрексат. Без него их преимущества, очевидно, утрачиваются.
Некоторые свидетельства в пользу изменений генетического материала в развитии были получены при сравнении репликации в различно дифференцированных клетках человека одним из авторов этой книги. Так, оказалось, что включение разных предшественников (нуклеотидов) в ДНК фибробластов и лимфоцитов происходит неодинаково. При радиоавтографическом исследовании было обнаружено, что в гетерохроматические районы некоторых хромосом в фибробластах включается больше аденина и тимина (АТ-пары), чем в лимфоцитах. Это может означать, что состав ДНК в ходе дифференцировки этих двух типов клеток несколько различается, т. е. изменяется.
В последние годы большое внимание уделяется переносу генетического материала внутри генома и между клетками. Известно, что многие ДНК-содержащие вирусы могут встраиваться в ДНК клеток хозяина, некоторое время размножаться вместе с его хромосомами, а затем вновь выходить из состава хромосом, чтобы через некоторое время встроиться в ДНК других клеток. При этом нередко вирусы захватывают с собой и тем самым переносят часть ДНК хозяина. Сейчас этот механизм генетического переноса рассматривается как один из возможных факторов эволюционного процесса, значение которого пока трудно оценить.
Перенос генетического материала внутри геномов и между ними был обнаружен у бактерий и без участия вирусов. Он осуществляется специальными последовательностями ДНК, которые получили названия «i-элементы» и «транспазоны». В последние годы похожее явление переноса было обнаружено и у эукариот. Так, в ходе развития дрозофилы ген white (белые глаза) может перемещаться и в другие участки генома, и это сказывается на его экспрессии. Происходит это, по-видимому, случайно и редко, а поэтому не может играть роли в развитии. Ho если вероятность таких переносов не очень мала, то это может быть реальным механизмом изменения генома в развитии, делающим соматические ядра не способными начать нормальное развитие заново. Эти явления изучены еще недостаточно, чтобы говорить о них больше.
Наконец, самое, может быть, захватывающее открытие последних лет сделал американский ученый Тонегава. Он обнаружил закономерные изменения структуры ДНК в лимфоцитах, продуцирующих иммуноглобулины. Подробнее проблему иммунитета мы разберем в одной из следующих глав, но здесь можно коснуться лишь явления изменений ДНК, происходящего при дифференцировке лимфоцитов. Гены иммуноглобулинов состоят из трех или даже четырех компонентов, каждый из которых представлен в геноме несколькими вариантами. Один из компонентов — вариабельный представлен в геноме несколькими сотнями генов, другой — соединительный — всего четырьмя или пятью, а третий — константный. Ho и константный компонент гена иммуноглобулина в зависимости от этапа и характера дифференцировки представлен одной из шести — восьми последовательностей. Во время дифференцировки лимфоцита происходит объединение этих компонентов в один составной ген, кодирующий полипептидную цепь молекулы иммуноглобулина. Пока не очень понятно, происходит ли такое объединение за счет переноса вариабельной части к соединительной или скорее за счет делеции — потери большого района ДНК (около 20 000 пар оснований), лежащего между одним из вариабельных компонентов и одним из соединительных. В таком переносе можно различать и закономерное и случайное. Закономерно, что перенос происходит только при дифференцировке лимфоцитов и всегда состоит в сближении определенных элементов. Однако выбор того, какой из вариабельных участков сблизится с одним из соединительных, происходит случайно, и этим создаются необходимые различия генов иммуноглобулинов у разных лимфоцитов. Перенос частей гена друг к другу, очевидно, необратим, и, следовательно, ядро лимфоцита уже не содержит всего набора генов: часть вариабельных генов теряется при переносе.
Может быть, этот перенос, или делеция, и не препятствует тому, чтобы ядро лимфоцита, если его трансплантировать в яйцо, участвовало в дифференцировке различных типов клеток. Ho очевидно, что образование разных лимфоцитов из потомков такого ядра будет затруднено, если вообще возможно. К тому же если механизм такой закономерно возникающей делеции в принципе существует, то он может использоваться не только в случае дифференцировки лимфоцитов.
Для того чтобы выяснить, не происходят ли подобные изменения структуры генома при других диффереицировках, было проведено изучение последовательности нуклеотидов, лежащих вокруг гена. Сравнивались гены глобина, овальбумина и другие в тех клетках, где они активны (эритробласты, клетки яйцевода), и в тех клетках, где они не работают. Если бы изменения структуры генома происходили, порядок нуклеотидов в активных и неактивных клетках отличался бы (так и было сделано открытие Тонегавы). Однако ни для глобина, ни для нескольких других исследованных генов таких отличий найдено не было. Это означает, что случай с генами иммуноглобулинов является совсем не общим правилом, а скорее исключением и, может быть, даже единственным.
Заключая эту главу, можно сказать, что в ходе развития животных (в отличие от растений) в соматических клетках, по-видимому, происходят и случайные и закономерные изменения организации и расположения генетического материала. Изменения эти, вероятно, не очень часты и велики, но они все же могут сказываться на ходе развития. Этим, в частности, могут быть объяснены неудачи в попытках получить нормальное развитие до взрослого организма при трансплантации ядер из дифференцированных взрослых клеток. В случае с иммуноглобулинами эти изменения наступают закономерно, и смысл их очевиден. В других случаях изменения генома могут быть и случайными. Они могут не сказываться на развитии тканей и органов, где каждая отдельная клетка выполняет ограниченную функцию и может быть заменена другой клеткой. Ho эти же изменения, повторенные во всех клетках зародыша (при трансплантации ядер), делают, очевидно, полноценное развитие из ядер дифференцированных клеток редким или даже невозможным. Проблема эта, однако, требует новых, более достоверных данных.
Глава X Что такое эпигенетическая наследственность?
В предыдущих главах мы неоднократно говорили, что запись информации в виде последовательности нуклеотидов в ДНК (или в РНК у некоторых вирусов) является единственной формой наследственности. В качестве исключения мы приводили преемственность кортикальных структур ротового аппарата у инфузорий, описанную Соннеборном. Однако существует еще один вид наследственности, занимающий в биологии значительно большее место, чем кортикальная наследственность у инфузорий. Это эпигенетическая наследственность дифференцированных клеток. Этим термином называют способность клеток сохранять свое состояние специализации и передавать его в ряду клеточных поколений.
Каждое состояние клеточной дифференцировки, как уже не раз говорилось, основано на активности и экспрессии определенного набора генов. Следовательно, эпигенетическая наследственность — это передача в ряду клеточных поколений информации о том, какие гены должны быть активны, а какие нет в данном типе клеток. Этот вид наследственности, естественно, не может быть записан в ДНК половых клеток, так как из них образуются сотни типов клеток и каждый тип отличается своей эпигенетической наследственностью. В ДНК половых клеток записана только способность клеток приобретать ту или иную эпигенетическую наследственность, но не она сама. Таким образом, этот вид наследственности как бы стоит над или вне обычной наследственности, почему ее и назвали эпи(над, вне, при)генетической.
Если сам факт существования эпигенетической наследственности не может вызывать сомнения (иногда спорят о том, называть ли это явление наследственностью или как-либо иначе), то о ее природе, о материальном носителе нет почти никаких экспериментально установленных данных. Что же касается теоретических представлений, то они могут быть сведены к двум принципиально различным схемам, которые мы назовем метаболической и структурной гипотезами.
1. Стабильность дифференцировки и эпигенетическая наследственность
Факторы, вызывающие дифференцировку, обычно действуют короткое время, в то время как само дифференцированное состояние может сохраняться гораздо дольше. Например, нервная ткань у позвоночных возникает на ранних стадиях эмбрионального развития, а высокоспециализированные нервные клетки остаются в принципе неизменными на протяжении всей жизни. Практически не изменяются и очень многие другие типы клеток взрослого организма. То, что они за месяцы и годы не изменяют своей дифференцировки, что одни гены в них сохраняют свою активность, а другие так никогда и не начинают работать, требует объяснения. Должен существовать какой- то механизм стабильности этого, а не другого дифференцированного состояния.
Еще сложнее объяснить сохранение дифференцировки у делящихся клеток. В этом случае термин «наследственность» имеет все права, так как состояние дифференцировки поддерживается в ряду клеточных поколений и количество клеток — потомков одной дифференцированной — в ходе делений часто значительно возрастает. Даже в нервной ткани клетки, прежде чем они приобретут окончательно дифференцированное состояние и потеряют способность делиться, детерминируются, становятся нейробластами и проходят несколько клеточных делений. Печень как орган начинает дифференцироваться тоже очень рано. За время эмбрионального развития и последующего роста размер печени увеличивается в тысячи раз, т. е. составляющие ее клетки должны пройти не менее 10–15 клеточных делений, оставаясь все время клетками печени.
Клетки печени взрослого животного практически не делятся. Однако если в эксперименте удалить половину или две трети печени, то она в течение двух суток достигает прежних размеров, а ее клетки проходят одно-два деления. Эта операция может быть повторена несколько раз. Клеточные деления можно вызвать также действием специфических ядов, приводящих к гибели значительной части клеток печени. Однако, проходя дополнительные деления, эти клетки остаются клетками печени, гепатоцитами, со всем комплексом их свойств: формой, активностью специфических ферментов и синтезом белков плазмы крови. Даже после злокачественного перерождения гепатоцитов в клетках гепатомы сохраняются многие признаки клеток печени, хотя перевиваемые или культивируемые in vitro клетки могут проходить сотни и тысячи делений. Выше мы уже рассказывали, что при соматической гибридизации клеток гепатомы крысы с фибробластами человека одно из свойств клеток печени — увеличивать синтез тирозинаминотрансферазы в ответ на действие стероидных гормонов — подавляется. Однако при утрате гибридами Х-хромосомы человека это свойство возобновляется, т. е. много поколений клеток оно сохраняется, никак не проявляясь. Многие другие лабораторные линии опухолевых клеток, культивируемые в течение ряда лет, также сохраняют некоторые, хотя и не все свойства тех тканей, от которых произошли: синтез определенных белков, чувствительность к гормонам и т. д.
В условиях культуры тканей частично дифференцированные клетки могут долгое время размножаться, не приобретая окончательной дифференцировки. Так, например, будущие клетки мышц — миобласты — могут в культуре размножаться в течение нескольких лет. Ho при создании условий для дифференцировки — коллагеновой подложки и среды замедляющей деления, — миобласты сливаются друг с другом, образуют мышечные волокна, в них синтезируются миозин и другие мышечные белки. Естественно, что такой дифференцировке в мышцы могут подвергаться только миобласты, а не другие виды клеток. Следовательно, не только информация о свойствах миобласты, но и информация об активации генов миозина сохранилась и после сотен клеточных делений, хотя сами эти гены еще не функционировали.
Проблема состоит в том, как объяснить сохранение активности определенных генов у клеток, проходящих митотический цикл. За этот цикл хромосомы проходят два процесса, изменяющих их структуру, — репликацию и образование митотических хромосом (конденсацию хроматина). При образовании митотических хромосом происходит многократная спирализация и компактная укладка хроматиновой нити. Процесс транскрипции при этом прекращается. Необходимо, следовательно, объяснить, почему после завершения митоза, когда хромосомы деспирализуются, в них возобновляется активность тех же генов.
He менее сложно объяснить и поддержание стабильности дифференцнровки в процессе репликации. При удвоении ДНК возникают две двойные спирали, к которым присоединяются гистоны и негистоновые белки, образуя нуклеопротеидный комплекс — хроматин. Каким образом в этом случае активное состояние одного гена переходит в активное состояние двух генов в двух дочерних двойных спиралях ДНК? Иными словами, как удваивается, размножается, реплицируется не только сама ДНК, но и состояние избирательной активности в отдельных ее участках? К этим не решенным пока вопросам и сводится сейчас проблема стабильности дифференцнровки, или эпигенетической наследственности.
2. «Метаболическая» и «структурная» гипотезы
Группу «метаболических» гипотез составляют все те представления о природе стабильности, в которых фигурирует какое-то активирующее вещество: оно может некоторое время находиться вне ДНК, но оно должно быть способно опознавать и активировать определенные гены, и в том числе тот ген, который определяет синтез самого этого вещества. Природа вещества не имеет принципиального значения, но, вероятнее всего, им может быть или РНК или белок. Согласно «метаболической» гипотезе, в дифференцированной клетке возникает замкнутый круг: на специальном гене транскрибируется мРНК, на этой мРНК транслируется белок, а этот белок активирует и «свой собственный» ген, и все другие гены, характерные для данной дифференцнровки.
Эта схема легко объясняет все трудности сохранения активности определенных генов в течение митотических циклов. Во время репликации ДНК и во время митоза ранее синтезированное активирующее вещество находится в цитоплазме, а после удвоения хромосом или после образования дочерних ядер вновь активирует те же самые гены, характерные для данной дифференцнровки (и в их числе и тот ген, активность которого пополняет в клетке запас активирующего вещества). Такая система, раз возникнув, далее поддерживает сама себя и уже не нуждается в тех факторах дифференцировки, которые ее однажды создали, т. е. запустили в менее дифференцированных клетках. Очевидно, что генов, определяющих синтез таких активирующих веществ, должно быть по меньшей мере столько, сколько типов дифференцированных клеток может быть в организме.
Никаких прямых доказательств «метаболической» гипотезы пока нет, но кандидатами на активирующие вещества могут быть и РНК, и негистоновые белки хроматина, о которых уже известно, что они участвуют в активации генов. Все как будто свидетельствует в пользу этой гипотезы, если бы не несколько случаев, которые очень трудно, а вероятно и невозможно объяснить с позиций «метаболической» гипотезы.
Вторую гипотезу можно назвать «структурной», потому что она не требует синтеза каких-либо специальных веществ, но предполагает изменения в структуре ДНК или всего хроматина. Согласно этой гипотезе, при возникновении дифференцировки в структуре генов и хроматина происходят такие изменения, которые делают эти гены активными. Изменения в структуре, раз возникнув, способны «помнить» о своей активности и сохраняться во время таких сложных процессов, как образование метафазных хромосом при делении клетки. Более того, эти особенности структуры должны во время репликации распространяться на обе двойные спирали ДНК.
Согласно нашим сегодняшним знаниям о природе хроматина, таким требованиям надежно удовлетворяют только изменения в первичной структуре ДНК, т. е. замена одних нуклеотидов другими или перемещения более крупных участков ДНК. Такие изменения (замены или перемещения), если они возникли, естественно, сохраняются в митозе, а при репликации ДНК оказываются в обеих новообразованных хромосомах, т. е. удваиваются. До сих пор, однако, неизвестно, существуют ли в дифференцированных клетках, кроме лимфоцитов, изменения в первичной структуре ДНК, и если да, то каков механизм их возникновения и обратимы ли они?
Значительно труднее представить сохранение и удвоение изменений не в виде последовательности нуклеотидов ДНК, а в конфигурации ее двойной спирали (вторичная структура ДНК) или в ее связях с белками, хотя такие гипотетические схемы существуют. И тем не менее, хотя представить себе «структурную» гипотезу значительно сложнее, чем «метаболическую», некоторые факты легче объяснить первой, чем второй.
3. Факты, не согласующиеся с «метаболической» гипотезой
Прежде всего мы обсудим явление, открытое английской исследовательницей М. Лайон, которое получило название «лайонизация Х-хромосомы». Как известно, самки млекопитающих имеют две Х-хромосомы, в то время как самцы — только одну. Х-хромосома несет много важных генов, и, очевидно, должен быть механизм, который бы как-то уравнивал количество генетической продукции (мРНК) в мужских и женских клетках. Оказалось, что у ранних зародышей млекопитающих на стадии 100–400 клеток происходит инактивация одной из Х-хромосом, которая образует компактный высокоспирализованный комочек, т. е. становится гетерохроматином. Эту компактную глыбку, так называемое тельце Барра, можно видеть только в ядрах клеток женского организма. Возможность определить пол, в идеале по одной клетке, уже используется в судебной медицине, а также в спорте для подтверждения пола у женщин-спортсменок. В ближайшем будущем этот метод будет использоваться для прижизненного определения пола у эмбрионов человека в первые месяцы беременности. Развитие этого метода позволит в перспективе регулировать пол потомства (путем отказа от продолжения беременности при нежелательном варианте).
Гетерохроматизация, или «лайонизация», одной из Х-хромосом происходит в каждой эмбриональной клетке случайно, но затем во всех потомках этой клетки гетерохроматинизированной остается та же самая хромосома. Если обе Х-хромосомы не идентичны, т. е. некоторые гены у них представлены разными аллельными вариантами, то весь организм становится мозаичным: в одних клетках работают одни варианты генов, а в других — другие мутантные варианты. Возникает вопрос: каким образом после того, как данная Х-хромосома гетерохроматинизировалась, она, вернее, ее потомки подвергаются такому же процессу снова и снова, после каждого митоза? Ведь в митозе обе Х-хромосомы суперспирализованы (компактизованы) одинаково и не отличаются друг от друга.
В чистых линиях животных обе Х-хромосомы совершенно одинаковы, и невозможно себе представить, чтобы какое-либо вещество отличило одну Х-хромосому от другой. Следовательно, лайопизированная Х-хромосома даже в метафазе митоза как-то «сама помнит» о своей лайонизации и возобновляет ее снова после митоза. Единственное разумное объяснение этому явлению состоит в том, что в действительности структура однажды лайонизированной Х-хромосомы становится в чем-то отличной от другой, но это отличие не удается заметить во время митоза и оно способно передаваться при репликации обоим потомкам данной Х-хромосомы.
Второй пример, который мы рассмотрим, также касается функционирования Х-хромосом у самцов и самок. Ho на этот раз речь идет о дрозофиле, у самок которой обе Х-хромосомы остаются активными. Компенсация дозы гена у них достигается иным путем: единственная Х-хромосома самца в клетках дрозофилы функционирует вдвое активнее, чем в клетках самок, т. е. на ней одной транскрибируется столько же РНК, сколько на двух Х-хромосомах самки. Р. Б. Хесин и Б. А. Лейбович в нашей стране получили препараты политенных хромосом из клеток слюнных желез самцов и самок. Распластанные на стекле и обработанные смесью спирта и уксусной кислоты, эти хромосомы были лишены не только всех белков цитоплазмы, но и части белков самих хромосом. Для того чтобы обнаружить активность этих хромосом, к ним добавляли бактериальную РНК-полимеразу и радиоактивные предшественники синтеза РНК. Оказалось, что и в этих условиях, хотя порядок транскрипции нарушался (из-за использования чужеродной РНК-полимеразы), на Х-хромосоме самца РНК синтезировалась вдвое интенсивнее, чем на каждой из двух Х-хромосом самок. И в этом случае «метаболическая» гипотеза оказывается бессильной. Так как все растворимые метаболиты клеток отсутствовали, то Х-хромосомы самца и самки могли отличаться только структурно. При этом, правда, нельзя исключить, что какие-то специфические белки, ответственные за интенсивность транскрипции, сохраняются на хромосомах.
Таким образом, несмотря на всю привлекательность и простоту «метаболической» гипотезы, существуют некоторые факты (мы привели только два из них), которые с ней никак не согласуются. Это заставляет нас искать какие-либо разумные варианты структурной гипотезы.
4. Варианты структурной гипотезы
Итак, несколько экспериментальных данных говорят о возможности таких структурных изменений, которые сохраняются при митозе и при репликации, могут передаваться в ряду клеточных поколений и обеспечивают эпигенетическую наследственность и стабильность дифференцировки.
Наиболее простым объяснением структурных изменений в хромосомах является возможность изменения первичной структуры ДНК. Если такие изменения происходят в обеих или даже в одной из двух цепей ДНК, то естественно, что далее они передаются путем обычной репликации всем потомкам той клетки, в которой эти изменения в первый раз произошли. Ho половыми клетками эти клетки уже стать не могут, или надо предусмотреть механизм, восстанавливающий первоначальную первичную структуру ДНК.
В литературе существует несколько гипотетических схем, объясняющих, как мог бы в ходе развития в результате действия определенных ферментов один нуклеотид, оставаясь в составе ДНК, превратиться в другой. И действительно, в отдельных работах такие изменения были отмечены, хотя механизм и молекулярная природа этих изменений неясны, да и сами факты требуют подтверждения. Кроме того, изменения в отдельных нуклеотидах так незначительно сказываются на общем составе ДНК, что заметить их обычными методами невозможно.
Существует еще один путь изменения ДНК — это ее модификация посредством метилирования. В клетке известен особый класс ферментов — метилазы, которые присоединяют CH3-группу к некоторым цитозиновым основаниям ДНК. Метилируются далеко не все цитозины, и доступность метилазам зависит от окружающих нуклеотидов. А это означает, что метилирование может быть достаточно специфичным. И действительно, есть данные, показывающие, что метилирование ДНК заметно выше в неактивных генах. Вместе с тем есть и менее специфичные метилазы, которые метилируют цитозин, лежащий вблизи метилцитозина, но на другой нити ДНК. Это создает возможность сохранения метилирования во время репликации. При образовании двух новых двойных спиралей ДНК старая нить в них сохранит метильные группы. Ho малоспецифическая метилаза тут же восстановит метилирование и на другой нити.
Факты самых последних лет подтверждают эти представления: содержание метилцитозина намного ниже в активных генах в клетках многих животных. Более того, подтвержден и механизм репликации метилированных состояний, т. е, поддержания метилированных оснований в ряду клеточных поколений. Однако получены и другие факты: в ядрах дрозофилы ДНК оказалась совершенно неметилированной.
Если изменения первичной структуры ДНК путем замещения отдельных нуклеотидов остаются проблемой и, во всяком случае, требуют подтверждений, то изменения путем переноса больших участков ДНК и, может быть, потери некоторых последовательностей определенно доказаны. В последнее время обнаружено, что в развитии дрозофилы происходит, по-видимому, случайный перенос участков ДНК в другие части хромосомы, что сказывается на проявлении действия генов. Ho наиболее убедительными являются изменения строения генов иммуноглобулинов, для которых было показано, что при дифференцировке лимфоцитов происходит закономерное сближение нескольких районов ДНК. Подробнее мы рассмотрим этот вопрос в следующей главе. Если такие переносы или делеции показаны для одних случаев дифференцировки, то мы вправе ожидать, что и в других случаях события такого порядка тоже возможны.
Среди структурных механизмов эпигенетического наследования можно говорить также о «недо- и перерепликации» ДНК. Известно, что при образовании политенных хромосом у насекомых некоторые их участки реплицируются меньшее число раз, чем остальные части хромосом. Наоборот, при амплификации ДНК в ооцитах группа рибосомных генов реплицируется избирательно. Возможность подобных явлений позволяет предположить и такие способы изменения генома. Изменения «высших» структур ДНК, т. е. изменения характера ее спирализации или укладки в хромосоме, изменения характера связи ДНК с белками и т. д., также могут выдвигаться в качестве эпигенетических механизмов. Так, в ряде работ болгарского ученого Цанева и американца Вайнтрауба обсуждаются возможности сохранения в процессе репликации ДНК особенностей строения нуклеосом. Авторы этих гипотез предполагают, что местные модификации гистонов путем, например, их фосфорилирования или ацетилирования (такие модификации гистонов действительно происходят при активировании репликации или транскрипции) могут передаваться на обе вновь образующиеся молекулы ДНК и таким образом размножать раз созданные отличия гистонов, лежащих в районе того или иного гена. Эти представления, однако, встречают пока много трудностей и не получили еще надежного экспериментального подтверждения.
Мы можем заключить эту главу приблизительно тем же, с чего она началась. Эпигенетическая наследственность, или, иначе, сохранение дифференцировки в ходе клеточных делений, — факт, требующий своего объяснения. Несмотря на всю привлекательность «метаболических» гипотез, они не могут объяснить ряд фактов, что заставляет прибегать к созданию гипотез о «структурном» механизме эпигенетического наследования. И хотя сегодня мы не располагаем надежными экспериментальными данными о «структурных» механизмах такого наследования (что верно и для «метаболических» гипотез), некоторые гипотезы об изменении структуры ДНК не кажутся совсем невероятными.
Глава XI Стволовые клетки
Дифференцированные клетки взрослого организма отличаются одна от другой не только строением и функциями. Они отличаются и временем жизни. Некоторые из них, например нервные, обычно живут столько, сколько живет сам организм. Клетки крови или эпителия кожи существуют значительно меньше — их время жизни измеряется неделями или месяцами. Наконец, эпителиальные клетки кишечника сохраняются не более одного-двух дней.
Если почему-либо погибают нервные клетки (например, при мозговой травме), их уже невозможно восстановить: нервные клетки, как известно, не делятся. При потере части клеток печени (это бывает не только при хирургическом удалении доли печени, но и при некоторых тяжелых отравлениях и болезнях) происходит полное восстановление нормального числа клеток за счет деления оставшихся. В отличие от нервных клеток дифференцированные клетки печени сохраняют полную способность к делениям, хотя в норме почти не делятся.
Поддержание постоянного количества дифференцированных клеток крови, таких, например, как эритроциты, за счет деления их самих совершенно невозможно. У млекопитающих эритроциты вообще лишены ядра, но и ядерные эритроциты у других позвоночных настолько специализированны, что необратимо потеряли способность к делению. Также не способны делиться наполненные кератином клетки поверхностных слоев эпителия кожи и обращенные в полость кишки клетки, лежащие на концах ворсинок. Поддержание нормального числа специализированных клеток во всех этих случаях, а также во многих других происходит путем их постоянной дифференцировки из менее дифференцированных делящихся клеток. В различных органах содержится запас таких малодифференцированных клеток. Некоторая их часть дифференцируется и при этом теряет способность к делению, а часть делится и этим поддерживает постоянное число малодифференцированных клеток.
Если эти процессы изобразить схематически, они будут выглядеть, как дерево с прямым стволом и боковыми ветвями. Ствол — это ряд непрерывно делящихся малодифференцированных клеток, а боковые ветви — это клетки, вступившие на путь дифференцировки и после нескольких делений превращающиеся в полностью дифференцированные клетки, которые через некоторое время погибают. Эта схема привела к термину «стволовые клетки», которым и называют малодифференцированные клетки, способные к делению и к дифференцировке в одном или нескольких направлениях. Раньше в этих случаях обычно использовали ботанический термин — «камбиальные клетки».
Внешне стволовые клетки трудно или даже невозможно отличить от других малодифференцированных клеток, уже начавших свою дифференцировку. В случае эпителия кожи или кишечника эта задача решается проще и не требует специальных методов.
1. Эпителий кожи и кишечника
Эпителий кожи многослойный, и его стволовые клетки находятся в нижнем (базальном) слое, лежащем на мембране, отделяющей эпителий от соединительной ткани. Клеточные деления происходят в базальном слое, и часть клеток при этом вытесняется в верхние слои, вступая тем самым на путь терминальной дифференцировки. Эта дифференцировка в основном состоит в накоплении нерастворимого белка кератина, который постепенно заполняет всю клетку, превращая ее в часть роговой чешуйки, которая слущивается с наружной поверхности кожи. Одна стволовая клетка делится несколько раз и образует в базальном слое группу из 8—10 клеток, которые затем передвигаются в сторону поверхности кожи и в конце концов образуют одну роговую чешуйку.
Кишечный эпителий образует ворсинки, выдающиеся в полость кишки. Дифференцированные клетки нескольких типов выстилают поверхность ворсинки, контактируют с пищей, способствуют ее перевариванию и осуществляют всасывание растворимых пищевых веществ. На кончике ворсинки клетки сохраняются не более одного дня, затем они погибают и отторгаются. На смену им вдоль боковых стенок ворсинки движутся эпителиальные клетки, которые дифференцируются из стволовых клеток.
Между ворсинками в стенке кишки находятся углубления — крипты, около дна которых располагаются и делятся стволовые клетки. После деления, очевидно случайно, одна из клеток оказывается ближе к краю крипты — она и вступает на путь дальнейшей, терминальной дифференцировки. В начале дифференцировки клетка проходит еще несколько делений, так что число дифференцирующихся потомков одной стволовой клетки увеличивается во много раз. Ta же клетка, которая после деления исходной стволовой клетки случайно оказывается вблизи дна крипты, сохраняет свой малодифференцированный характер, т. е. остается стволовой. Немногие клетки в результате деления попадают на самое дно крипты. Они дифференцируются в особые клетки Пеннета.
В результате делений число клеток в крипте увеличивается, их избыток переходит в ворсинку, движется вдоль нее от основания к верхушке, и на этом пути клетки завершают свою дифференцировку. Деление клеток, попавших в ворсинку, прекращается. Дифференцировка их выражается в основном биохимически: в клетках транскрибируются долгоживущие мРНК, а на них транслируются пищеварительные ферменты. Скорость трапскрипции в ядрах по мере дифференцировки замедляется.
В ворсинках эпителия кишечника дифференцировка происходит в нескольких направлениях. Основным видом клеток являются каемчатые клетки. На их наружной поверхности, обращенной в полость кишки, вырастают микроворсинки (их длина 1–1,5 мкм, а диаметр — менее 0,10 мкм), между ними и происходит основная часть пищеварения. Ho кроме того, в эпителии встречаются и особые бокаловидные клетки, выделяющие слизь, а также энтероэндокринные клетки. Все они, по-видимому, образуются из одних и тех же стволовых клеток, каждая из которых, следовательно, может дифференцироваться в одном из четырех направлений или оставаться стволовой. Когда дифференцированные клетки, достигнув вершины ворсинки, отторгаются, они попадают в полость кишки и погибают, а пищеварительные ферменты, освободившиеся из них, начинают функционировать.
2. Клетки крови
Система кроветворения сложнее других систем с постоянным обновлением дифференцированных клеток. В этом случае нет такого простого пространственного разделения стволовых клеток, дифференцирующихся клеток и клеток, достигших терминальной дифференцировки, какое мы видели в коже и в кишке. Кроветворение у взрослых животных происходит в костном мозге и в селезенке, где и располагаются вместе стволовые клетки и клетки на всех стадиях дифференцировки. Поэтому отличить стволовую клетку от тех, которые уже вступили на путь дальнейшего развития, не удается. Дифференцировка клеток крови происходит во многих направлениях. Из единой стволовой кроветворной клетки образуются не только эритроциты, хотя их большинство, но также и белые клетки крови (гранулоциты, макрофаги) и мегакариоциты. Кроме того, из тех же стволовых клеток возникают и клетки иммунной защиты — лимфоциты, о которых подробнее говорится в следующей главе.
Дифференцировка клеток крови проходит через ряд стадий, подробное описание которых занимает много страниц в соответствующих руководствах. Особенно подробно, и с морфологической и с биохимической точек зрения, прослежено образование эритроцитов. Ho в этой главе нам важны не конкретные описания, а некоторые общие принципы или правила, по которым в организме происходит пополнение числа дифференцированных клеток и поддерживаются определенные количественные соотношения между ними. В зависимости от состояния организма и внешних условий за счет деятельности органов кроветворения осуществляется регуляция числа клеток крови. После кровопотери происходит быстрое восстановление числа эритроцитов, а в горах, где воздух разрежен, — постепенное увеличение их количества. При воспалениях количество лейкоцитов увеличивается. He случайно анализ состава клеток крови позволяет диагностировать многие заболевания.
Отличить дифференцирующиеся клетки друг от друга удается только да относительно поздних этапах, когда выбор направления дифференцировки уже осуществлен. Для того же чтобы выяснить, что происходит на более ранних этапах дифференцировки, нужны специальные методы исследования. Прежде всего возникает вопрос: на каком основании мы полагаем, что все клетки крови и лимфоциты образуются из одних и тех же стволовых клеток, сохраняющихся на протяжении всей жизни организма? Было бы легче представить, что уже в раннем развитии возникают зачаточные клетки, судьба которых однозначно определена, и что из одних путем деления и дифференцировки возникают только эритроциты, из других — только лимфоциты, из третьих — мегакариоциты и т. д. Ответ на этот вопрос дали опыты с радиационными маркерами.
С помощью облучения можно получить различные хромосомные перестройки, многие из которых безвредны, и их легко видеть в делящейся клетке под микроскопом. Раз возникнув, такая перестройка сохраняется во всех потомках этой клетки. Например, при транслокации часть одной хромосомы переносится на другую, причем исследователь точно знает, какие из 20 разных хромосом мыши в данной перестройке участвуют. Каждый вид транслокации достаточно редок и при облучении одной мыши два раза в одной ткани произойти практически не может. Поэтому, если через несколько дней после облучения мы видим две клетки с одинаковой хромосомной перестройкой, можно уверенно утверждать, что они произошли от одной клетки. Такие перестройки были названы радиационными маркерами, так как позволяли надежно метить клетки и их потомков. Обнаружив один и тот же маркер и в делящихся эритробластах, и в делящихся промиэлоцитах — предшественниках гранулоцитов, можно было с уверенностью утверждать, что они образовались из общего предшественника — стволовой клетки, которая еще была таковой во время облучения этой мыши. Именно так и было установлено, что все виды клеток крови происходят от одних стволовых клеток.
Вместе с тем в аналогичных опытах было найдено, что нередко радиационные маркеры обнаруживаются только в клетках-предшественниках различных более узких групп клеток крови. Например, только в лимфоцитах или, напротив, только в клетках «красного ряда» — предшественниках эритроцитов. Это показывает, что, кроме полипотентных стволовых клеток, существуют и клетки-пред- шественники с ограниченными возможностями дифференцировки. Из них образуются два, три или только один тип клеток. Такие, уже более дифференцированные, предшественники были названы полустволовыми клетками.
Увидеть кроветворную стволовую клетку не удается, так как до сих пор неизвестны морфологические признаки, позволяющие отличить ее в массе клеток костного мозга или селезенки. Однако изучать их все же можно. Один из методов такого изучения был предложен американскими исследователями Тиллом и Маккуллохом. Если мышь облучить высокой дозой радиации, около 1000 р, то процесс кроветворения у нее постепенно прекратится, так как при такой дозе погибают все кроветворные стволовые клетки, как наиболее радиочувствительные. Такую мышь можно, однако, спасти, если ввести ей в кровяное русло взвесь клеток костного мозга, выделенную из необлученной мыши. Уже через несколько дней после такой инъекции в селезенке облученной мыши можно увидеть очаги кроветворения — сначала небольшие колонии, которые, однако, растут и в конце концов захватывают всю селезенку. Чем больше клеток костного мозга ввести мыши, тем больше колоний возникает одновременно. Метод радиационных маркеров показал, что каждая такая колония — потомки одной стволовой клетки.
Многие колонии дифференцируются только в клетки «красного ряда» — эритроциты, некоторые — только в клетки «белого» ряда — лейкоциты, а в некоторых образуются и те и другие. Интересно, что если клетки одной из таких колоний, например целиком «красной», снова ввести в кровь облученной мыши, то в ее селезенке опять появятся «красные», «белые» и смешанные колонии. Эти опыты показывают, что полипотентные стволовые клетки, образующие колонию и сохраняющиеся в ней, способны дифференцироваться в различных направлениях и эта их способность сохраняется в непрерывном ряду стволовых клеток.
Возникают важные вопросы: от чего зависит, оставаться ли клетке стволовой или вступить на путь дифференцировки, и каковы механизмы, определяющие направление дифференцировки? Играют ли роль в этих процессах факторы, внешние по отношению к стволовым клеткам (их непосредственное окружение, гормоны), или все определяется внутри самих клеток? Однозначного ответа на эти вопросы пока нет. Можно было бы, например, думать, что в результате деления образуются две различные клетки: одна остается стволовой, а другая дифференцируется.
Более правдоподобным кажется предположение, что стволовые клетки вступают на путь деления или дифференцировки с той или иной степенью вероятности. Такой механизм обеспечивает и поддержание постоянного числа стволовых клеток, и непрерывный переход к дифференцировке части клеток. Представления о случайном механизме могут быть справедливыми и для выбора направлений дифференцировки, хотя вероятность того или иного направления неодинакова. В главе о механизмах возникновения различий между клетками мы уже упоминали о таком способе «рулетки». Можно представить, что в стволовых клетках на самом деле действует подобный механизм, не зависящий от внешних условий и подчиняющийся только законам случайности.
Вместе с тем мы хорошо знаем, что конечное число терминально дифференцированных потомков кроветворной стволовой клетки — регулируемая величина. Образование эритроцитов, например, ускоряется в ответ на кровопотери, на недостаток кислорода и т. д., количество лейкоцитов увеличивается при воспалении. Сейчас очевидно, что регуляция осуществляется за счет числа и скорости делений субстволовых клеток и клеток, уже вступивших на путь дифференцировки. Одним из факторов такой регуляции является гормон «красного» кроветворения — эритропоэтин. Этот полипептидный гормон синтезируется в почках в количествах, обратно пропорциональных количеству кислорода в крови. Таким образом, и уменьшение числа эритроцитов, и снижение кислорода в воздухе вызывают усиленную продукцию эритропоэтина. Уже невысокие концентрации этого гормона ускоряют деление и дифференцировку клеток, вступивших на путь эритропоэза. Самые ранние стадии эритропоэза менее чувствительны к эритропоэтину — можно думать, что стимуляция их деления происходит в случае лишь особенно большой нехватки эритроцитов. Предполагается, что в «красном» кровяном ряду клетки проходят около пятнадцати делений, т. е. из каждой полустволовой клетки, вступившей на этот путь, образуется 215 (около 30 тыс.) зрелых эритроцитов. Эритропоэтин может ускорять эритропоэз и увеличивая число митозов в ряду кроветворения, и уменьшая продолжительность митотических циклов. Предполагается, что аналогично действуют гормоны и на дру гих направлениях дифференцировки, хотя сами гормоны лейкопоэза и лимфопоэза еще не обнаружены.
Особую роль в кроветворении играют клетки, в окружении которых случайно оказались стволовые клетки — так называемое микроокружение. Его образуют клетки стромы костного мозга и селезенки, которые сами в клетки крови дифференцироваться не могут. Достаточно заметить, что, если стволовые клетки попадают в костный мозг, они чаще дифференцируются по «белому ряду», а если в селезенку, то чаще но «красному». Может быть, и в пределах одного органа, например селезенки, выбор пути развития зависит от случайных соседей: одни клетки стромы стимулируют, например, лейкопоэз, а другие — эритропоэз. С этих позиций, а в их пользу говорят и другие экспериментальные данные, направление дифференцировки определяется тем, где случайно окажется стволовая клетка. В принципе эта та же «рулетка», которая находится не внутри клетки, а снаружи ее.
Система стволовых клеток, очевидно, «удобна» тем, что открывает возможности для регуляции количества дифференцированных клеток. Ho факторы регуляции (такие, как эритропоэтин) не определяют направления дифференцировки, а лишь ускоряют пролиферацию клеток, уже дифференцирующихся в раз выбранном направлении. Такой путь регуляции, очевидно, проще и эффективнее, чем ранняя детерминация отдельных зачатков для красных, белых и всех других типов клеток крови.
Есть и еще одно соображение о биологическом смысле системы стволовых клеток. Во время дифференцировки, видимо, возрастает вероятность генетических повреждений, например ведущих к злокачественному перерождению клетки. В стволовых клетках вероятность таких повреждений меньше и делений они проходят относительно мало. А клетки, вступившие на путь дифференцировки, хотя и проходят много делений, но в конце концов все погибают, освобождая организм от своего присутствия. Для понимания этих проблем нам, однако, необходимо знать механизмы, определяющие стабильность стволовых клеток и их вступление на путь дифференцировки.
Глава XII Клетки и молекулы иммунной защиты
Иммунитет особенно отчетливо проявляется и лучше всего изучен у млекопитающих, хотя те или иные его проявления можно наблюдать и у просто организованных животных. У позвоночных, в первую очередь у теплокровных, иммунитет проявляется в двух видах — образования в крови антител против чужеродных белков и других антигенов и несовместимости клеток одного организма (хозяина — реципиента) с клетками другого организма (донора).
В ответ на введение антигена (ими могут быть не только чужеродные белки, но и другие большие молекулы) через некоторое время (одну-две недели) в крови появляются антитела — особые белки, относящиеся к группе иммуноглобулинов, специфически связывающиеся только с тем антигеном, который вызвал их появление. Каждая молекула антитела имеет два одинаковых активных центра, что позволяет им связывать по две молекулы антигена. Антитела синтезируются в В-лимфоцитах, и приобретенная способность к образованию определенного вида антител (иммунитет) сохраняется в организме годами, часто всю жизнь.
Несовместимость клеток проявляется при пересадках органов и тканей от одного животного (или человека) к другому. Она выражается в отторжении чужеродной ткани через 10–15 дней после трансплантации. Именно этим объясняется неуспех большинства пересадок и замен органов у человека. Чтобы такие трансплантации, например сердца или почки, удались, нужны специальные сродства, подавляющие иммунную систему организма-хозяина. В процессе отторжения участвуют Т-лимфоциты и макрофаги. В то же время пересадки ткани между генетически идентичными животными — однояйцевыми близнецами или чистопородными животными одной линии — удаются, они иммунологически толерантны, т. е. их ткани совместимы. Это означает, что Т-лимфоциты опознают и отторгают лишь клетки с иной генетической природой. Более точный генетический анализ показал, что у мышей есть особая группа генов Н-2, расположенных вместе, которая в основном и отвечает за толерантность или, наоборот, несовместимость при трансплантациях между животными. Если две мыши имеют в участке H-2 идентичные гены, то органы, пересаженные от одного животного к другому, не отторгаются.
Проблема иммунитета состоит в том, чтобы объяснить, каким образом введение чужеродного белка приводит к синтезу специфического вида антител, способных связывать именно данный вид антигена. Поскольку антигенов существует, казалось бы, бесконечное количество, то и антител к ним должно быть также бесконечное множество. Поэтому естественно, что все первые теории иммунитета на протяжении более 50 лет исходили из того, что антитела создаются при прямом участии молекулы антигена, как бы на ее поверхности и приспособительно (комплементарно) к ее строению.
Раскрытие механизмов синтеза белка поставило практически непреодолимые трудности перед такими гипотезами. Ho вот в начале 60-х годов появилась клональная теория австралийского ученого нобелевского лауреата Барнетта, завоевавшая в настоящее время общее признание и объясняющая иммунитет исходной гетерогенностью лимфоцитов, синтезирующих разные виды антител. Следующий шаг — объяснение молекулярно-генетических механизмов гетерогенности лимфоцитов — был сделан в самые последние годы в связи с именем Тонегавы. Иммунитет оказался не только важной биологической и медицинской проблемой, но и исключительной моделью дифференцировки, на которой впервые были показаны закономерные изменения в структуре генома, происходящие в ходе развития.
1. Клональная теория иммунитета
Принципиальные отличия клональной теории Барнетта от всех предыдущих становятся понятнее, если антиген сравнить с замком, а антитело к нему — с ключом, которое отпирает именно этот замок, выбирая его из множества других. Трудность решения — откуда к каждому «замку» находятся свои «ключи» — состоит прежде всего в том, что количество различных белков практически безгранично (теоретически для белков среднего размера в 300 аминокислот возможно 20300 вариантов молекул). Это число возрастает еще во много раз, так как даже небольшие химические модификации белка, например разные варианты гликозилирования, изменяют их антигенные свойства.
Однако эти астрономические величины имеют чисто теоретическое значение. В действительности активные центры антитела не могут быть комплементарны целой молекуле белка, а всегда лишь какой-то ее части с характерной поверхностью и не очень большой площадью. Эта часть — ее называют детерминантом — образована ограниченным количеством аминокислот (их всего 5–7), взаимное положение которых, правда, зависит от структуры остальной молекулы. Можно думать, что число возможных детерминантов не так велико, как возможное разнообразие белков. По очень приблизительным подсчетам оно может быть порядка 104-106.
В прошлом многочисленные теории иммунитета исходили из того, что в организме для каждого нового «замка» — антигена изготовляется новый вид «ключа» — антитело. Оказалось, однако, что в основе иммунитета лежит другой принцип — подбирание подходящего «ключа» из числа уже имеющихся в организме. Действительно, если связка ключей достаточно велика, а требования к точности подгонки не беспредельны, то найти нужный ключ, да обычно и не один, всегда удается.
Клональная теория Барнетта полагает (и это действительно так), что каждый лимфоцит производит только один вид антител и что в организме существует столько видов (клонов) лимфоцитов, сколько видов антител этот организм может производить. По современным подсчетам, число это имеет порядок от одного до десяти миллионов.
Согласно клональной теории, антиген, попавший в организм, случайно встречается с теми, пока немногими, лимфоцитами, которые способны к образованию антител против этого антигена. Некоторые молекулы антител, как бы «образцы продукции», находятся на поверхности таких лимфоцитов, где и происходит их первая встреча с антигеном. Контакт с антигеном, согласно теории, стимулирует данный лимфоцит к активному размножению и синтезу антител, в результате чего образуется большая популяция лимфоцитов одного клона, продуцирующих только один вид антител.
При попадании в организм другого антигена стимулируется размножение другого клона лимфоцитов и соответственно синтез другого вида антител. Так как исходно имеется не менее миллиона видов антител, то каждый новый антиген находит один или более видов антител, которые ему комплементарны и с ним связываются. При этом соответственно активируется размножение новых клонов лимфоцитов.
В принципе антитело может быть комплементарно не к одному, а к ряду антигенов со сходными детерминантами, но практически найти второй антиген (точнее, детерминант) к тому же антителу обычно очень трудно.
Таким образом, в организме — в крови, в лимфоузлах и кроветворных органах — должно содержаться около миллиона различных клонов лимфоцитов, каждый из которых представлен, как правило, очень небольшим количеством, может быть всего сотнями, клеток. Ho организм почти всегда иммунизирован против ряда антигенов, которые посредством инфекции успевают в течение жизни в него попасть. Число таких антигенов, вероятно, не очень велико, может быть десятки или сотни. Te клоны лимфоцитов, которые вырабатывают антитела против этих антигенов, уже успевают размножиться, и число лимфоцитов в каждом таком «работающем» клоне должно быть в миллионы раз выше. Лимфоциты этих относительно немногих клонов составляют значительную долю всей популяции лимфоцитов в организме (у мыши их миллиард, у человека еще в тысячу раз больше).
При попадании в организм нового антигена иммунизация происходит не сразу: на отыскание немногих лимфоцитов «своего» клона, на их размножение и выбрасывание в кровь достаточных количеств антител обычно уходит около двух недель. Этот срок является критическим при многих опасных инфекционных заболеваниях. Если микробы, попавшие в организм, быстро размножаются, а токсины, которые они вырабатывают, очень ядовиты, то организм погибает, не успев создать иммунной защиты. Если же ему удалось прожить с инфекцией хотя бы одну-две недели, то далее образование антител в В-лимфоцитах блокирует токсины, а Т-лимфоциты уничтожают и сами микроорганизмы.
Существует еще одна важная проблема, без решения которой не может быть теории иммунитета, Теория должна ответить на вопросы: почему не вырабатываются антитела к своим собственным белкам? почему лимфоциты не «считают» их антигенами? Клональная теория Барнетта полагает, что все лимфоциты, которые могли бы синтезировать антитела против собственных антигенов, встречаются с ними в раннем постэмбриональном или даже эмбриональном развитии и эта ранняя встреча подавляет размножение подобных лимфоцитов или даже убивает их.
Ho проблему отсутствия антител к своим белкам еще нельзя считать до конца решенной. Она имеет важное значение для понимания того, как организм защищается против появления новых белков, кодируемых своими же генами, например при злокачественных перерождениях клеток.
2. Клеточные механизмы иммунитета
Иммунитет осуществляется лимфоцитами, которые, как и все клетки крови, образуются из одного источника — стволовых клеток крови в костном мозге и селезенке. Начальным этапом образования лимфоцитов являются полустволовые клетки — предшественники лимфоидных клеток, которые затем дифференцируются в лимфоциты двух типов — T- и В-клетки. Дифференцировка Т-клеток происходит в зобной железе — тимусе, куда они мигрируют из костного мозга. В тимусе образуется несколько разновидностей Т-клеток, которые выходят в кровь и становятся киллерами (убийцами), хелперами (помощниками) и супрессорами (подавителями). Функция Т-клеток-киллеров состоит в том, чтобы опознать чужеродную клетку и убить ее.
Т-клетки образуют клоны, различающиеся по их способности опознавать чужеродные клетки. Это происходит потому, что Т-клетки каждого клона по своей поверхности несут молекулы какого-то одного типа антител. Когда в организм попадают чужие клетки, антигены, находящиеся на их поверхности, взаимодействуют с антителами поверхности различных Т-клеток. Среди многих разных Т-клеток находятся и те, чьи антитела способны связываться с антигеном чужой клетки. Когда такая встреча происходит, Т-клетки этого клона быстро размножаются и убивают те чужеродные клетки, которые индуцировали их размножение. Механизм «убийства» до конца неизвестен, но Т-киллеры нарушают у чужеродной клетки проницаемость ее мембраны, что и приводит к ее гибели.
Роль В-лимфоцитов иная. Они не только синтезируют иммуноглобулины, но и выделяют их в кровь. Если Т-клетки в основном участвуют в защите организма от чужих клеток, то В-клетки защищают организм от чужих молекул.
Таким образом, иммунную защиту осуществляют специфические лимфоциты, которые надо различать по нескольким параметрам. Главный из них состоит в «выборе» одного типа иммуноглобулинов. Этот выбор происходит задолго до встречи с антигеном, где-то в начале дифференцировки лимфоцитов, и осуществляется на генном уровне (мы рассмотрим его в следующих разделах). Затем происходит разделение на два пути дифференцировки — на T- и В-лимфоциты с их различным назначением. И наконец, Т-клетки подразделяются на типы клеток с различной функцией (киллеры, хелперы и т. д.). Пути дифференцировки и механизмы действия лимфоцитов еще не вполне понятны.
В последние годы получило большое развитие искусственное создание опухолевых клеток, производящих антитела одной антигенной специфичности, или, иначе, моноклональные антитела. Такие клетки называют гибридомами, так как их получают путем соматической гибридизации опухолевых (миэломных) клеток с В-лимфоцитами, синтезирующими антитела. Это обеспечивает неограниченное размножение таких клеток в культуре. Схематично метод состоит в том, чтобы гибридизировать миэломные клетки с лимфоцитами от мыши, иммунизированной определенным антигеном. Далее гибридные клетки расселяют с тем, чтобы вырастить из каждой отдельный клон. Антитела, производимые каждым клоном, испытывают на их связывание с интересующим нас антигеном. Так как мышь была иммунизирована, то определенная часть гибридных клонов производит антитела к выбранному антигену. Каждый такой клон производит антитела только одного вида, и получать их можно в любом количестве, так как, приобретя опухолевые свойства, гибридные клетки легко размножаются в культуре. Моноклональные антитела сейчас начинают широко использовать не только в научных целях. Изучается возможность применять их для лечения таких, например, заболеваний, как рак. Метод может стать основой для промышленного получения моноклональных антител против различных заболеваний.
3. Молекулы иммуноглобулинов
Молекула антитела — иммуноглобулина (ИГ) состоит из четырех полипептидных цепей — двух одинаковых больших (тяжелых) и двух одинаковых меньших (легких), связанных друг с другом S — S-мостиками. Специфичность взаимодействия молекулы ИГ с антигеном создается уникальностью самих цепей — тяжелой нелегкой, а также их уникальным сочетанием. Иначе говоря, сложная молекула ИГ узнает «свой» антиген благодаря деталям строения, которыми данный вид ИГ отличается от ИГ других видов (хотя каждая молекула ИГ содержит две тяжелые и две легкие цепи с похожим, но не тождественным строением). Упрощая дело, можно сказать, что миллион вариантов ИГ получается как произведение тысячи вариантов легких цепей на тысячу вариантов тяжелых цепей.
Структура ИГ сейчас изучена во всех деталях. Задача была очень трудной из-за того, что обычно в крови одновременно находится множество различных ИГ (каждая в малом количестве) и получить чистый препарат казалось невозможным. «Помогло» несчастье. У некоторых людей, больных особой формой лейкоза — миэломой, патологически размножается один клон лимфоцитов, производящий в очень большом количестве какой-либо один вид антител. Исследование однородных препаратов ИГ, полученных от таких больных, позволило детально изучить, что общего и что разного у разных видов молекул ИГ.
Особенность каждого варианта полипептидной цепи создается, как всегда, в белках за счет их первичной структуры, т. е. последовательности аминокислот. Каждая легкая цепь ИГ состоит из двух примерно равных частей — вариабельной (V) и константной (C), содержащих по 110–120 аминокислот. Константные части легких цепей могут быть двух типов — каппа и лямбда. Вариабельную же часть легких цепей в разных ИГ представляют около 1000 разных вариантов последовательностей аминокислот.
Тяжелые цепи ИГ тоже состоят из вариабельной части и константной, но гораздо большего размера. Вариабельные части тяжелой цепи также имеют около тысячи разных вариантов. Ho и вариабельные части ИГ отличаются друг от друга не по всей длине, а имеют несколько совсем коротких (6—10 аминокислот) гипервариабельных участков, которые в разных ИГ имеют совсем различный порядок аминокислот.
Участок, связывающий вариабельную и константную части, благодаря высокому содержанию в нем аминокислоты — пролина обладает повышенной подвижностью, что, очевидно, играет важную роль при связывании антитела с антигеном. Этот «пограничный» участок молекулы называют соединительным и обозначают буквой «джей» (J).
Инактивация антигенов антителами становится возможной не только из-за того, что вариабельные концы тяжелой и легкой цепей образуют специфический антиген-опознающий центр. He менее важно и то, что молекула ИГ содержит по две тяжелые и легкие цепи и у нее имеется два одинаковых центра. Благодаря этому одна молекула ИГ соединяется с двумя молекулами антитела, точнее, с ее детерминантами. В пробирке при достаточных концентрациях антител и комплементарных к ним ИГ образуются нерастворимые большие комплексы, которые выпадают в осадок.
Теперь мы можем рассмотреть, как создаются антитела, т. е. каким образом достигается такое их исходное разнообразие и, в частности, почему клетки одного клона лимфоцитов синтезируют только один вид иммуноглобулинов.
4. Гены иммуноглобулинов
Прежде всего мы должны рассмотреть, как организованы гены ИГ у будущих лимфоцитов до того, как эти клетки стали отличаться друг от друга, т. е. до того, как образовались разные их клоны. Очевидно, что так же организованы гены ИГ и у всех других клеток организма, у тех, которые дифференцируются в иных направлениях и никогда не станут лимфоцитами.
Гены легких цепей расположены в двух разных хромосомах, а гены тяжелых — в третьей. Каждая из них в диплоидной клетке, естественно, представлена парой гомологичных хромосом. Это в принципе создает возможность для образования в одной клетке не одного, а двух видов легких цепей (каппа- и лямбда-типа), а с учетом возможных различий гомологичных хромосом и пары хромосом с генами тяжелых цепей — восьми видов ИГ. Фактически же в одном лимфоците всегда образуется только один вид ИГ. Это достигается путем так называемого аллельного исключения. Если в ИГ-продуцирующих клетках перестраивается и затем активируется ген легкой цепи каппа в первой хромосоме, то гены легких цепей каппа в гомологичной хромосоме не перестраиваются и не активируются, а как бы исключаются из состава генов данной клетки — родоначальницы клопа. Такое же исключение происходит и во всех потомках этой клетки, т. е. во всем клопе. Если в данном лимфоците активируется ген каппа-цепи в одной из хромосом, то не включаются и оба гена лямбда-цепей в другой паре хромосом. Наоборот, включение одного из лямбда-генов выключает тем самым оба каппа-гена. В итоге из четырех возможных активным в лимфоците остается только один ген легких цепей. Аналогичным образом активируется ген тяжелой цепи только в одной из двух гомологичных хромосом. В другой гомологичной хромосоме аллельный ген тяжелой цепи исключается. Благодаря аллельному исключению достигается то, что в клетках каждого клона работают только два гена ИГ — одной легкой цепи (каппа или лямбда) и одной тяжелой — и каждый лимфоцит продуцирует только один вид антител. Механизм аллельного исключения неизвестен. Он представляет в генетике один из очень немногих примеров такого рода,
«Ген» каждой цепи ИГ представляет собой сложную многокомпонентную систему, располагающуюся вдоль хромосомы на значительное расстояние, в десятки тысяч пар оснований (килобаз). Называть эту систему одним геном было бы так же неверно, как и считать ее десятком или сотней генов. Это именно система, состоящая из множества вариабельных и нескольких константных последовательностей, которые собираются в один ген иммуноглобулина только, в результате довольно сложных преобразований, которые происходят при появлении первых лимфоцитов, еще в эмбриогенезе.
Система гена легких цепей каппа состоит из следующих компонентов (рассматривая их в порядке считывания слева направо). В начале системы (слева) находится большая группа участков ДНК, кодирующих вариабельную часть гена. Каждый из них содержит 291 пару нуклеотидов и кодирует соответственно 97 аминокислот. Всего таких участков около трехсот. Далее (правее) через значительное расстояние (около 2700 пар нуклеотидов) находится группа небольших участков «джей» (их четыре или пять), кодирующих по 13 аминокислот, соединяющих вариабельную и константную части ИГ. Наконец, дальше (еще правее) располагается участок, кодирующий константную часть ИГ.
Во время дифференцировки лимфоцитов в одной из хромосом, несущих систему каппа-гена легких цепей, происходит сближение одного из вариабельных участков (V) с одним из участков «джей» (J) и с участком, кодирующим константную часть гена (С). Пока не до конца ясно, каков конкретный механизм сближения: это может быть делеция, т. е. выбрасывание части ДНК так, что одна из F-последовательностей оказывается рядом с одним из J. Ho может быть это и транспозиция, т. е. перенос одной из V к одному из J. Важно то, что процесс этот случаен и рядом с любой из V (их 300) может оказаться любая из J (их 4). В итоге создаются комбинации, общее возможное число которых нетрудно подсчитать: 300 × 4 = 1200. Это число и означает количество теоретически возможных вариантов каппа-гена легких цепей. В лямбда-генах такой принципиальной перестройки не происходит, но самих этих генов у мыши 20 и если в лимфоците образуется легкая лямбда-цепь, то одна из двадцати возможных.
Приблизительно так же, как и каппа-ген, устроена и система гена тяжелых цепей. Различия состоят в том, что число вариабельных участков там меньше-(около 120), но зато между ними и «джей» находится еще 20 вариантов элемента D. Кроме того, в систему гена тяжелой цепи входит не один, а несколько константных участков, от которых, однако, антиген-узнающая специфичность антител не зависит. При случайном сближении элементов V, J и D (путем делеции ДНК между ними или путем их транспозиции) теоретически возможно следующее количество вариантов: 120V × 20D × 4J = 9600.
В итоге в лимфоците случайным образом создаются два гена — для легких и для тяжелых цепей. Так как в молекуле ИГ (антитела) свойства центра связывания антигена определяются вариабельными частями и легкой и тяжелой цепей совместно, то в принципе число вариантов строения такого центра равно числу возможных сочетаний и превышает десять миллионов: 1200×9600=11,5-108. Действительно ли число возможных вариантов так велико, как это представляется из этих расчетов, точно пока неизвестно. Полагают, что оно несколько меньше.
Механизм делений, или транспозиций, также неизвестен, но подобный процесс определенно происходит, так как еще в первых работах Тонегавы было показано, что строение гена ИГ в лимфоците отличается от строения этого участка в ДНК недифференцированной или иначе дифференцированной клетки. Пока это единственный известный случай, когда в ходе дифференцировки происходит непременная, хотя и случайная перестройка генома. Что же касается деталей и точных механизмов такой перестройки, то на них сейчас обращено внимание стольких квалифицированных исследователей, что решение проблемы — это вопрос только времени.
Выше мы говорили, что система гена тяжелых цепей содержит не один, а несколько константных частей. Действительно, по ходу дифферепцировки лимфоцита в нем происходит смена этих частей. Сначала в состав гена входит только ближайшая константная часть и синтезируется антитело класса М, которое располагается на поверхности лимфоцита и является как бы выставкой, образцом его продукции. Если антиген окажется комплементарным этому образцу, то их соединение стимулирует лимфоцит к размножению и синтезу антител следующего класса (используется следующая константная часть класса G). Эти антитела уже секретируются в кровь и создают иммунитет.
Так, в результате преобразований в относительно небольшой части генома создается более миллиона различных клонов лимфоцитов, способных создавать иммунитет практически против любого антигена, случайно или искусственно попавшего в организм. Количество этих клонов намного превышает общее число генов. Оно, конечно, никак не могло быть получено «обычным путем», т. е. за счет наличия в геноме многих различных генов иммуноглобулинов и включения одного из них. Перестройка генов для образования разных антител — еще один пример того, что эволюция способна создавать такие «чудеса», которые не может предугадать ничья фантазия. Биологический смысл появления в эволюции подобного механизма очевиден — создание большого и случайного разнообразия за счет относительно небольшого участка ДНК.
Можно ли ожидать, что механизм, подобный этому, встретится и в других дифференцировках? Подобный механизм может оказаться целесообразным только там, где существенна не определенность, а разнообразие, даже случайное. Может быть, мы встретимся с чем-то подобным при изучении связей между отдельными нервными клетками мозга. А может быть, нечто похожее происходит при образовании пятнистой окраски, там, где положение пятен должно быть случайным. А может быть, перестройка генетической системы синтеза ИГ — это уникальный механизм и мы не встретим его больше нигде.
Схема образования молекулы иммуноглобулина (ИГ)
Системы генов легких (слева) и тяжелых (справа) цепей ИГ расположены в разных хромосомах и состоят из отделенных друг от друга участков ДНК, кодирующих разные части молекулы ИГ: L— лидерную последовательность, V— вариабельные части ИГ, D— участок ИГ, увеличивающий разнообразие V-части тяжелых цепей, J— соединительную часть и С — константные части молекулы ИГ (в тяжелых цепях их несколько классов). В эмбриональных клетках-предшественниках лимфоцитов ДНК содержит много генов для V-участков ИГ (для легких каппа-цепей их 300, для тяжелых цепей их 120), несколько последовательностей для D-участков (около 20) и четыре-пять последовательностей для J-участков (I). При дифференцировке (созревании) лимфоцитов происходит перемещение и исключение генетического материала, в результате чего создаются гены ИГ зрелых лимфоцитов (II). В них оказываются сближенными по одному из V-, D- и J-генов и ген константной части (С). Выбор V-, D-, J-участков при соэревании лимфоцитов происходит случайно. В результате создается один составной ген ИГ. При экспрессии генов ИГ в зрелом лимфоците транскрибируются пре-мРНК (III), которые теряют некодирующие белок интроны и становятся молекулами мРНК (IV). С них транслируются легкие и тяжелые полипептиды — пре-ИГ (V), содержащие на одном конце лидерную последовательность аминокислот, необходимую для прохождения полипептида через мембраны. После процессинга пре-ИГ образуются готовые субъединицы ИГ (VI), которые собираются в молекулу ИГ, состоящую ив двух одинаковых легких и двух одинаковых тяжелых субъединиц (VII). При созревании одного эмбрионального предшественника лимфоцитов (I → II) возникает уникальное сочетание V-и J-участков легких цепей и V-, D- и J-участков тяжелых цепей. Эта клетка дает начало клону лимфоцитов, синтезирующих только один вид ИГ, отличающийся от ИГ лимфоцитов других клонов. СЦ — специальные центры, образованные между вариабельными частями легких и тяжелых цепей ИГ, в которых происходит связывание ИГ с антигеном
Глава XIII Регуляция экспрессии генов
О проблеме регуляции экспрессии генов мы в этой книге говорим фактически во всех главах, рассматривая ее с разных сторон. Существует такое, может быть несколько одностороннее, определение развития: «Понять развитие — это значит объяснить, почему гены в клетках зародыша работают в нужное время п в нужном месте». Говоря о регуляции экспрессии генов, мы можем говорить о нескольких уровнях пли этапах этого процесса.
Первым таким уровнем являются события, которые происходят на хромосоме, т. е. те процессы, которые определяют и регулируют транскрипцию. Здесь мы рассмотрим новые данные, которые сейчас получены о строении регуляторных участков гена, так называемых промоторов. Кроме того, мы обсудим взаимоотношения ДНК с теми белками хроматина, которые создают организацию хромосомы и определяют включение определенных генов.
Вторым уровнем регуляции экспрессии генов можно считать события, происходящие в ядре с уже транскрибированной молекулой про-мРНК, т. е. процессинг и транспорт мРНК из ядра в цитоплазму. Регуляция на этом уровне, как считают некоторые исследователи, так же важна, как на уровне транскрипции, но механизмы ее почти совершенно неизвестны.
Молекула мРНК не обязательно сразу присоединяется к рибосоме и начинает транслироваться. Часто мРНК
сначала образуют комплексы с белками — информосомы, которые служат как бы депо для мРНК, и выход из этого депо может служить механизмом регуляции экспрессии, который в процессах развития играет особенную роль.
Наконец, сам процесс трансляции тоже может быть местом регуляции экспрессии генов, и это выражается не только в изменении скорости синтеза белка, но иногда и в быстрой смене состава транслируемых мРНК. Наконец, когда белок уже синтезирован и даже занял в клетке свое место, это еще не означает, что проявление действия гена неизбежно. При недостатке субстрата признак — если это продукт реакции, катализируемой ферментом, — не проявится.
1. Промоторы генов
В этом разделе мы кратко расскажем о том, какие нуклеотидные последовательности, прилегающие к генам, а иногда и внутри гена, ответственны за процесс транскрипции. У прокариот эти участки, с которыми связывается молекула РНК-полимеразы и откуда начинается считывание, известны уже давно и хорошо. Они называются промоторами. Для эукариот сведения о промоторах были получены совсем недавно. Для этого использовали два метода. По одному из них гены изолировали путем клонирования, а затем с помощью специальных ферментов — рестриктаз — из них вырезали кусочки ДНК с одного или с другого конца гена или даже посередине. В последнее время исследователи пошли еще дальше и научились искусственно комбинировать гены — «пришивать» регуляторный район одного гена к структурной части другого. После этого способности таких реконструированных генов к эффективной и правильной транскрипции проверяли в пробирке или помещая эти ДНК в ядро ооцита.
Второй метод состоит в том, что последовательность нуклеотидов в частях ДНК, прилегающих к гену, исследуется у возможно большего числа разных генов. У них обнаруживаются сходные (гомологичные) последовательности, расположенные на некотором расстоянии от стартовой точки, с которой начинается транскрипция. Эти гомологичные последовательности и рассматривают как потенциальные промоторные участки или, во всяком случае, как участки, имеющие отношение к регуляции работы генов. При таком методе анализа должны, однако, ускользать те регуляторные последовательности ДНК, которые у разных генов не одинаковые, а различные и которые, очевидно, ответственны за специфическую регуляцию работы генов — индивидуальную для каждого из них.
Для обозначения места, занимаемого нуклеотидом в области начала считывания и промоторов, принят такой порядок. Тот нуклеотид, с которого начинается считывание (стартовая точка), обозначается +1, следующий (его помещают правее) — +2, +3 и т. д. Нуклеотид, предшествующий стартовой точке (левее ее), не считывается РНК-полимеразой и его обозначают —1. Следующий перед ним —2, затем в направлении, обратном считыванию, идут —3, —4 и т. д.
Сегодня показано, что в положении +1 почти всегда стоит А, а вслед за ним идет четыре-пять пиримидиновых нуклеотидов, т. е. T или Ц. Если этот порядок нуклеотидов нарушить, то транскрипция пойдет неправильно, т. е. начнется не со стартовой точки, а по соседству с ней. Если теперь посмотреть назад (налево), на нуклеотиды, которые не должны считываться, то у бактерий в положении — 10 находится так называемая Прибнов-последовательность (по имени автора): ТАТААТА. Очевидно, это то место, на которое «садится» молекула бактериальной РНК-полимеразы, и в этом случае активный центр фермента, который собственно и начинает транскрипцию, окажется в районе стартовой точки.
У структурных генов эукариот в положении —10 ничего подобного нет, но зато очень похожая последовательность была обнаружена в районе —30 (у разных генов это место варьирует от —29 до —33). Эта последовательность выглядит, как ТАТА и по имени обнаруживших ее ученых названа Голдберг — Хогнесс-последовательность, или, короче, «ТАТА-бокс». Нарушение этой последовательности или ее изъятие приводит к замедлению транскрипции (она реже начинается) и, главное, к неправильному считыванию, т. е. к изменению стартовой точки на несколько нуклеотидов вперед или назад.
Можно думать, что РНК-полимераза, которая у эукариот по размеру больше, чем бактериальная, занимает больший участок на ДНК. Между ее «центром узнавания», который присоединяется к ТАТА-последовательности, и «активным центром», который должен находиться над стартовой точкой, расстояние равно длине в 30 пар нуклеотидов (— 10 нм). Для бактериального фермента это расстояние втрое меньше.
Te участки ДНК, о которых мы здесь рассказали, не представляют принципиального интереса, так как они определяют лишь точность стартовой точки. Ими нельзя объяснить, почему один ген работает, а другой нет. Поэтому большее внимание сейчас уделяется участкам, которые располагаются еще дальше от стартовой точки, чем «ТАТА-бокс». И действительно, у эукариот в районе от —70 до —80 нуклеотидов находится область с похожей последовательностью у разных генов. Роль этого участка цока не установлена. Может быть, более интересно, что скорость транскрипции сильно меняется (модулируется) в зависимости от наличия участка, располагающегося па расстоянии от —80 до —200 нуклеотидов от стартовой точки. Там, хочется думать, и находится регуляторный участок гена, к которому присоединяется регуляторный белок и уменьшает или увеличивает активность гена.
Сейчас уже накапливаются данные о последовательности нуклеотидов в этих регуляторных участках, которые называют модуляторами или энхансерами (усилителями). Пока не очень ясно, насколько строго должна соблюдаться такая последовательность. По одним данным, даже значительные ее изменения оказывают небольшой эффект, по другим — замена всего одной пары нуклеотидов увеличивает (или уменьшает) активность гена во много раз. Неясно и следующее. Никакой белок, даже самый длинный, не может протянуться на 100 и более нуклеотидов. Следовательно, остается не так много возможностей. Либо регуляторный белок действует на стартовую точку на расстоянии, либо молекула ДНК в этом районе сложена так, что регуляторный белок оказывается вблизи РНК-полимеразы и может контролировать ее поведение. Сейчас обсуждается и такая идея: модуляторный участок — это то место в районе гена, где РНК-полимераза может присоединиться к ДНК. Далее она уже легко «проскальзывает» до ТАТА-участка и точно со стартовой точки начинает транскрипцию,
2. Белки хроматина
Мы уже знаем, что хроматин состоит из ДНК и гистонов в равном весовом количестве и негистоновых белков (НГБ), которых в неактивных районах хромосомы всего 0,2 веса ДНК, а в активных — более чем 1,2 (в среднем НГБ мепьше, чем ДНК). Мы знаем также, что гистоны вместе с ДНК образуют нуклеосомы, и роль гистонов. очевидно, должна быть прежде всего структурная — поддерживать нуклеосомную организацию ДНК и также создавать высшие уровни ее укладки. Ho если роль гистонов так пассивна, почти механическая, то чем объяснить, что существуют варианты гистонов, которые синтезируются на разных стадиях развития морского ежа? Почему гистона H1 заметно меньше в активно работающих генах? Чем также объяснить химические модификации гистонов: перед образованием митотических хромосом в гистонах возрастает число присоединенных к ним фосфатных групп, а перед началом активной транскрипции — число ацетильных групп?
Все эти факты показывают, что гистоны играют существенную роль не только в организации хроматина, но и в происходящей на нем транскрипции. С гистонами или, точнее, с характером их связи с ДНК связана такая важная особенность ДНК, как ее повышенная чувствительность к действию нуклеаз (ферментов, разрывающих нить ДНК) именно в активных генах или в генах, готовых начать свою функцию. Похоже, что ДНК в районе таких генов менее связана с гистонами, более доступна атаке ферментов.
Негистоновые белки хроматина (НГБ) — очень разнородная группа белков, но каждый из них представлен в небольшом количестве. Выше уже рассказывалось, как новая техника использования антител против различных белков хроматина и флюоресцентных красителей позволила различить по меньшей мере две группы НГБ с различными свойствами и локализацией. Одни НГБ располагаются вдоль всей хромосомы — вероятно, это НГБ, связанные со структурой хромосом. Другие НГБ располагаются дискретно и связаны с отдельными генами. Они-то и могут быть специфически регулирующими белками, определяющими работу отдельных генов.
Часть НГБ, очевидно, играет такую же структурную роль, как и гистоны. Например, есть группа белков хроматина, которые движутся в электрофорезе быстрее других. Их так и называют — «быстродвижущаяся группа» (БДГ, или, по-английски, HMG). По своему строению и составу аминокислот они напоминают гистоны и, возможно, когда-то произошли от них. Оказалось, что некоторые белки БДГ, а именно БДГ-14 и БДГ-17 преимущественно располагаются в районах активно работающих генов. Их функция, очевидно, не только структурная.
Итак, разнообразие НГБ, аналогия с прокариотами, у которых функции регуляции осуществляют негистоновые белки, и монотонность расположения гистонов вдоль всех ДНК позволяют думать, что именно среди НГБ и следует искать специфические регуляторы транскрипции. Поэтому в большинстве схем включения и выключения генов, которые фигурируют сегодня в литературе, специфическая роль отводится именно НГБ. Это не означает, что гистоны никак не участвуют в транскрипции, но им обычно отводится неспецифическая роль.
Гены могут находиться по меньшей мере в трех состояниях: неактивном и не подготовленном к активации, неактивном, но готовом к активации (компетентном) и, наконец, в активном, работающем состоянии. В действительности различных состояний, вероятно, больше, например гены могут транскрибироваться с большей или меньшей активностью. Участки хромосом, не готовые к активации, часто образуют плотно компактизованные (спирализованные) глыбки гетерохроматина. Возможно, что гетерохроматинизация создается гистонами, например их фосфорилированием. Ho для этого необходимо, чтобы гистоны были изменены именно в данном типе клеток и только в данном участке хромосомы: в других клетках эти гены могут оказаться как раз активными. А для такой строгой локализации необходимы белки, способные не только изменить гистоны (например, фосфорилировать их), но и отличить один участок хромосомы от других, т. е. в конечном счете отличить одну последовательность ДНК от другой. Такими способностями могут, очевидно, обладать только высокоспецифичные негистоновые белки.
В клетках, компетентных к включению определенных генов, эти гены должны как-то отличаться от тех, которые к включению не готовы. Так, например, стероидные гормоны вызывают включение генов только в компетентных клетках, причем в разных клетках-мишенях они включают различные гены (см. гл. 7). Полагают, что с «компетентными» генами связан особый белок-акцептор, способный связаться с гормон-рецепторным комплексом. Такие акцепторные белки должны быть достаточно специфичны, у них две задачи: опознать последовательность в ДНК, чтобы найти тот ген, который они сделают компетентным, а затем опознать гормон-рецепторный комплекс, чтобы, связавшись с ним, включить свой ген. Выше мы говорили, что уже при возникновении компетентности гена он приобретает большую чувствительность к нуклеазам, т. е. структура хроматина изменяется. Молекулярных механизмов этого явления мы не знаем, как не знаем и механизмов компетенции во всех других случаях.
Включение генов, превращение их из компетентных в активно транскрибирующиеся тоже требует определенной специфичности. Таким образом, существенную часть НГБ должны составлять именно такие высокоспецифичные регуляторные белки. Их должно быть много видов — может быть, тысячи. С другой стороны, каждый из них может присутствовать в очень небольшом количестве — может быть, несколько молекул на клетку. У нас пока нет методов, которые могли бы выявить все белки без исключения, и особенно самые малочисленные. Ho с каждым годом техника разделения и выявления белков приближается к этому пределу.
В заключение нам следует упомянуть еще об одной возможности регуляции — посредством не белков, а низкомолекулярных РНК. Исследованы они до сих пор недостаточно — мы знаем только те их виды, которых в клетке много. У РНК, если рассматривать их как кандидатов на роль высокоспецифичных регуляторов, есть важное достоинство. Даже короткая их последовательность, длиной в 20–30 нуклеотидов, может точно опознать тот ген, который имеет участок ДНК, комплементарный к этой РНК. Белок, способный на такое опознавание, должен быть во много раз больше и сложнее. Каким образом низкомолекулярные ядерные РНК осуществляют регуляторную функцию (если они ее осуществляют), совершенно неизвестно. Схемы, которые могут быть предложены, без фактов большой ценности не имеют. Поэтому гипотеза о РНК как о регуляторах генетической активности остается пока не более чем интересной идеей.
3. Посттранскрипционная регуляция
Из молекулярной биологии мы знаем, что на генах транскрибируются большие молекулы пре-РНК, которые, прежде чем стать мРНК и выйти из ядра в цитоплазму, должны пройти процессинг. На том конце, который транскрибируется первым и который присоединяется к рибосоме, образуется «кэп» — молекула метилированной ГТФ. К противоположному концу присоединяется поли-А — отрезок, состоящий из 100–200 аденинов. Наконец, участки, считанные с экзонов, соединяются друг с другом, а участки, считанные с интронов, вырезаются и деградируют. Существуют экспериментальные данные, показывающие, что скорость процессинга и время выхода мРНК из ядра могут быть различными, т. е. они могут регулироваться.
Более важно другое: оказалось, что многие РНК могут вовсе не выходить в цитоплазму, а вскоре после синтеза деградировать в ядре. Из этих фактов родились важные представления о том, что транскрибируется очень много генов, а из ядра в цитоплазму выходит гораздо меньше видов различных мРНК. Эти взгляды, которые развивают американские ученые Бриттен и Давидсон, предполагают, что на уровне транскрипции, на хромосомах происходит только частичная регуляция и активными являются многие или даже все гены. Главная же регуляция, согласно этим взглядам, происходит на посттранскрипционном уровне, т. е. при разделении на те виды пре-мРНК, которые подвергнутся процессингу и выйдут в цитоплазму, и те, которые быстро распадутся в ядре, не выходя из него. Проблема избирательной экспрессии ограниченного набора генов в разных клетках, таким образом, отодвигается на следующий уровень регуляции.
О механизмах этого явления мы пока ничего не знаем. Нет и строгих доказательств того, что в ядре транскрибируются все или почти все гены. Все это заставляет большинство ученых пока очень сдержанно относиться к гипотезе Бриттена и Давидсона и не спешить с отказом от традиционных представлений о том, что основная регуляция работы генов происходит путем их избирательного считывания.
Тем не менее действительно существуют факты, свидетельствующие о том, что в ядрах находится значительно больше видов РНК, чем в цитоплазме (приблизительно в 10 раз), и это требует своего объяснения. Может быть, Бриттен и Давидсон правы-только отчасти и в ядрах транскрибируются РНК не со всех, но с большого числа генов. Потом в ходе процессинга происходит дальнейшая выбраковка первичных транскриптов. Если это справедливо, то выбор активных генов происходит как бы в два тура: сначала на хромосомах — предварительный и менее строгий, а затем при процессинге — окончательный.
Догадаться, как происходит регуляция, невозможно: даже правильная догадка, пока она не доказана фактами, всего лишь догадка и ценность ее невелика. Вопрос о действительной роли процессинга будет, очевидно, разрешен в ближайшие годы.
4. Информосомы — депо генетической информации
Большие молекулы РНК всегда или почти всегда связаны с белком. В ядрах они образуют рибонуклеопротеидные комплексы, которые открывшие их Г. П. Георгиев и его сотрудники назвали «информоферы». Роль их не вполне ясна. Может быть, она чисто структурна и связь про-мРНК с белком защищает их от распада или необходима для правильного процессинга. А может быть, она более специфичная и белки информофер участвуют в регуляции процессинга, т. е. в том, о чем говорилось в предыдущем разделе.
Еще до открытия ядерных рибонуклеопротеидов (РНП) комплексы РНК с белком в цитоплазме были обнаружены А. С. Спириным у ранних зародышей вьюна. Двадцать лет назад он предположил, что эти комплексы играют роль в регуляции синтеза белка и содержат мРНК. В соответствии с этим они были названы информосомами. Почти одновременно сходная идея была высказана американским биологом А. Тейлором, который предложил термин «маскированные мРНК».
Ситуация в то время была такова, что, перефразируя известное выражение, можно сказать — если бы информосомы не были открыты, их надо было выдумать. Действительно, активация синтеза белка у оплодотворенных или даже у просто активированных яиц морского ежа происходит без участия ядер. Без участия ядер происходит раннее развитие и синтез белка и у зародышей рыб и амфибий. Следовательно, увеличение интенсивности синтеза белка — резкое, как у морского ежа, или умеренное, как у рыб и амфибий, — после оплодотворения могло происходить только на мРНК, синтезированных ранее и запасенных. Если эти мРНК к моменту оплодотворения уже были, то почему они не включились в трансляцию сразу? Очевидно, они были каким-то образом изолированы от белоксинтезирующего аппарата (рибосом), т. е. маскированы.
А. С. Спирин и его сотрудники показали, что информосомы принципиально отличаются от других комплексов РНК с белком. Эти отличия состоят в ином соотношении в них белка и РНК. Для рибосом это соотношение равняется приблизительно 1: 1, и плотность рибосом, измеренная в растворах хлористого цезия, равна 1,51. Для информосом эта плотность всегда меньше и близка к 1,4. Это соответствует соотношению РНК и белка, как 3:1.
Роль информосом кажется очевидной: создать депо матриц, которое позволило бы накапливать их без немедленного синтеза белка и регулировать их переход к трансляции. Такая регуляция может быть количественной, и тогда состав мРНК на рибосомах и в информосомах одинаков — меняется только их доля в этих двух структурах. Ho она, как оказалось, может быть и качественной, и выход мРНК из информосом регулирует не только интенсивность синтеза, но до известной степени и состав синтезируемых белков.
Можно привести несколько примеров, когда участие информосом очень существенно. О накоплении мРНК в оогенезе и об их постепенном переходе на рибосомы мы уже говорили. При дифференцировке мышц мРНК мышечного белка — миозина накапливаются в миобластах заранее, еще до того, как эти клетки сольются в мышечные трубочки. Ho как только такое слияние произошло и необходим быстрый синтез миозина, его матрицы переходят из информосом в полисомы и сразу начинается активный синтез этого белка.
Последний пример касается такой очень сложной дифференцировки, как образование сперматозоидов. Этот процесс имеет еще ту особенность, что после мейоза синтез новых РНК почти или совсем не происходит. Белки же синтезируются на всех стадиях спермиогенеза, и для каждой стадии характерен синтез своих белков. Последними синтезируются белки головки спермия: у рыб это примитивные белки — протамины, у других животных — особые протаминоподобные гистоны. Их единственная функция — очень плотная упаковка ДНК в головке сперматозоида. Матрицы для синтеза протаминов или гистонов спермия транскрибируются заранее, еще до образования головки. И мРНК хранятся все это время (несколько дней) в маскированном состоянии, не транслируясь. Они начинают транслироваться только в самом конце дифференцировки, на той ее стадии, на какой это необходимо.
Механизмы, определяющие судьбу новосинтезированных мРНК, т. е. их путь в информосомы или прямо на рибосомы, неизвестны. Также неизвестно, чем регулируется выход мРНК из информосом и, что особенно сложно, чем определяется выход одних мРНК и хранение других.
5. Скорость трансляции
В синтезе белка участвуют десятки компонентов: мРНК, рибосомы, ГТФ, восемь различных факторов инициации трансляции, факторы элонгации и терминации, более 40 аминоацил-тРНК и образующие их (столько же) тРНК, АТФ, 20 разных аминокислот и 20 аминоацил-тРНК-синтетаз. Существует некоторое оптимальное соотношение между количеством всех этих компонентов. Даже небольшая нехватка любого из компонентов должна уменьшать скорость трансляции. Одни компоненты, по-видимому, всегда присутствуют в достаточных количествах и никогда не становятся лимитирующим звеном. Другие же, напротив, обычно находятся в клетке в низкой концентрации, и то одна, то другая из них ограничивает скорость синтеза белка.
Вместе с тем клетка должна иметь некоторые «излюбленные» звенья, через которые скорость трансляции регулируется чаще всего и на которые «выходят» многие регуляторные внутриклеточные связи. Одним из таких звеньев является фактор инициации — elF-2. Он может находиться в двух состояниях — фосфорилированном и нефосфорилированном (неактивном и активном). Существует специфический фермент — протеинкиназа, которая фосфорилирует elF-2, и фосфатаза, которая его дефосфорилирует. Как показал С. Очоа, именно таким путем происходит регуляция синтеза белка при многих очень различных ситуациях: синтез глобина в зависимости от присутствия гема; активация синтеза белков при пробуждении развития у высохших зародышей солоноводного рачка артемии, после попадания их в воду; замедление синтеза при действии интерферона и т. д. При других ситуациях «узким звеном» становится другой фактор инициации, например elF-3.
Факторы инициации являются, таким образом, характерными точками регуляции, но в принципе им может стать любое недостающее звено. В первую очередь таким звеном могут быть компоненты, поступающие в клетку извне, — некоторые аминокислоты и источники энергии — фосфорилированные нуклеотиды (АТФ и ГТФ). У бактерий, которые очень часто оказываются в условиях белкового или энергетического голодания, существуют специальные механизмы остановки синтеза белка. В клетках многоклеточных такая ситуация возникает, вероятно, реже, но и они могут оказаться в условиях, не способствующих максимальному синтезу белка, т. е. росту.
Перечисленные выше механизмы регуляции синтеза белка неснецифичны; они в равной степени должны замедлять или ускорять синтез всех белков. Однако существуют механизмы регуляции, действующие избирательно, т. е. подавляющие синтез одних белков больше, чем других. Один из таких известных сегодня механизмов — это регуляция посредством состава тРНК. Дело в том, что включение в белок почти каждой аминокислоты может, как мы знаем, кодироваться не одним, а двумя, четырьмя и даже шестью разными триплетами. Во многих случаях для этого необходимы различные тРНК. В то же время количество разных изоакцепторных (несущих одну аминокислоту) тРНК в клетке неодинаково, и та из них, которой меньше, может стать «узким звеном», или, как говорят англичане, «горлышком бутылки».
В то же время в генах и соответственно в мРНК одна и та же аминокислота может быть закодирована часто используемым кодоном, для которого соответствующие тРНК находятся в клетке в избытке, а также редким кодоном, который хотя и кодирует ту же самую аминокислоту, но встречается в генах редко. Для такого кодона нужна особая тРНК, и если ее концентрация в клетке мала, синтез данного белка по отношению к другим белкам будет замедляться.
Судя по тому, что количественное соотношение разных тРНК в различно дифференцированных клетках неодинаково, клетки приспособлены к тем мРНК, которые в них преимущественно транслируются. Например, при дифференцировке шелкоотделительной железы у гусеницы шелкопряда в ней увеличивается концентрация тех тРНК, триплеты которых чаще используются при кодировании фиброина (белка шелка). Ho может быть и другая ситуация, когда нехватка каких-то тРНК позволяет клетке замедлять синтез некоторых белков и этим поддерживать скорости синтеза разных белков в оптимальном соотношении.
Однако существуют и другие, неизвестные пока механизмы регуляции трансляции, которые как-то стимулируют синтез одних белков и, напротив, препятствуют образованию других. Один пример такой регуляции, на уровне трансляции, мы обсудим в последнем разделе этой главы.
6. Тепловой шок — модель для изучения регуляции на многих уровнях
В заключение этой главы мы рассмотрим один особый случай, который может служить иллюстрацией для почти всех предыдущих разделов. Этот пример показывает, что, вероятно, всегда экспрессия генов регулируется не одним механизмом и не на одном уровне, а более сложным путем с вовлечением всех путей регуляции в клетке.
Речь идет о характерных изменениях состава синтезируемых белков, которые происходят при попадании организма в условия повышенной, сублетальной температуры, или, иначе, теплового удара, а по-английски — «хит-шока». Этот процесс был открыт и лучше всего изучен на личинках дрозофилы, где смену работающих генов можно наблюдать визуально благодаря появлению или исчезновению пуфов на политенных хромосомах.
Если личинку дрозофилы из оптимальной температуры 25 °C перенести в повышенную температуру, например 37°, у нее наступает «хит-шок». Он выражается в том, что в течение нескольких минут меняется состав работающих генов в слюнных железах, а также и во всех других тканях личинки. У них активируется несколько генов, которые называют генами теплового шока. Все остальные гены, работавшие при нормальной температуре, в начале «хит-шока» выключаются. Соответственно этому начинается и синтез особых белков «хит-шока», которые, очевидно, защищают личинку от высокой температуры. Синтез же всех старых белков (за исключением гистонов) при этом быстро прекращается: прерывается их трансляция.
Феномен «хит-шока» во многом остается непонятным. Неясно, в частности, каков конкретный механизм действия повышенной температуры на активность генома. Дело в том, что эти же гены можно активировать не только нагреванием, но и действием некоторых веществ, в особенности тех, которые нарушают дыхание. Среди них, однако, есть и витамин B6, с дыханием непосредственно не связанный.
Пуфы образуются в ядрах, а вызывает их появление нагревание цитоплазмы. Нагревание изолированных ядер к появлению пуфов «хит-шока» не приводит, а помещение ненагретых ядер в цитоплазму из прогретой клетки сразу вызывает в ней исчезновение старых и появление новых пуфов. Даже добавление к ядрам только прогретых митохондрий уже достаточно для стимуляции «хит-шока».
В соответствии с новыми пуфами в нагретых клетках прекращается синтез старых видов РНК (кроме рибосомных и транспортных) и начинается синтез новых. За первые несколько минут в новые пуфы перемещается большая часть молекул РНК-полимеразы II. Через 20–30 мин размер новых пуфов и интенсивность транскрипции в них достигают максимума. Одни пуфы работают сильнее, а другие слабее. Ho эти соотношения зависят от температуры: при 33° сильнее работают одни гены, а при самой высокой (37°) — другие.
Пожалуй, самые загадочные явления при «хит-шоке» происходят в цитоплазме. Всего в течение немногих минут прекращается трансляция тех белков, которые синтезировались в клетке до «хит-шока», а освободившиеся рибосомы используются для синтеза новых, теперь уже «хит-шоковых» белков. Как это происходит, остается непонятным, так как старые мРНК не деградируют, а сохраняются в цитоплазме. По-видимому, аппарат синтеза белка после прогрева как-то начинает отличать одни мРНК от других и отдает предпочтение немногим видам мРНК «хит-шока». В белоксинтезирующей системе in vitro, полученной от прогретых клеток, рибосомы транслируют преимущественно мРНК теплового шока, в то время как в такой же системе, но из непрогретых клеток одинаково транслируются и те и другие.
Функция белков «хит-шока» не очень понятна: большая их часть после синтеза мигрирует в ядра. Можно думать, что при их участии происходит подавление синтеза РНК на других генах и осуществляется какая-то защита уязвимых частей клетки от перегревания. После снятия «хит- шока» синтез РНК на ранее активных генах возобновляется.
Обнаружена и мутация, которая нарушает способность мух отвечать на действие повышенной температуры. Естественно, что такие мухи более чувствительны к нагреванию и погибают при тех температурах, которые с помощью белков «хит-шока» переносят нормальные мухи. Оказалось также, что у этих мутантов гены «хит- шока» включаются нормально, но белки «хит-шока» образуются в гораздо меньшем количестве. Создается впечатление, что у этих мутантов как-то нарушается процессинг «хит-шоковых» РНК.
Система «хит-шока» обнаружена не только у дрозофилы, а почти у всех исследованных животных и растений, в том числе и у теплокровных. По-видимому, мы имеем здесь дело с каким-то общим и древним механизмом. Об этом, в частности, свидетельствует и сходство «хит-шоковых» белков у далеких друг от друга групп животных.
На примере приспособительной реакции организма на повышение температуры среды мы встречаемся с разнообразными механизмами регуляции экспрессии генов. Здесь и внешние к клетке, й внутренние факторы, которые способны включать одни гены и выключать другие (это называется позитивная и негативная регуляция). Поскольку существует мутация, нарушающая процессинг «хит-шоковых» РНК, этот этап реализации генетической информации также имеет свою систему регуляции. При «хит-шоке» образуются некоторые новые РНК, которые, однако, не выходят из ядер. На примере «хит-шока» обнаруживается возможность очень тонкой регуляции трансляции. Это не просто ее ускорение или замедление и даже не ускорение трансляции одних РНК по сравнению с другими. Здесь происходит необычный процесс — избирательное прекращение трансляции одних матриц и включение трансляции других. Чем глубже исследуется эта в общем-то исключительная ситуация, тем большие подробности о механизмах регуляции экспрессии генов становятся известными. При тщательном исследовании многих явлений в организме мы как бы случайно открываем возможность подойти почти ко всем механизмам, действующим в клетке, а часто и обнаружить такие, которые ранее не были известны.
Несмотря на то что регуляция экспрессии генов у эукариот изучается давно и многими научными коллективами, успехи науки в этом направлении довольно скромны. Они несравнимы с тем, как много мы знаем о механизмах регуляции работы генов у прокариот и особенно у вирусов. Дело здесь в том, что по мере повышения организации — от вирусов к бактериям, от бактерий к низшим эукариотам и от тех к многоклеточным — в еще большей степени возрастает сложность систем управления. Это усложнение носит качественный характер: добавляются новые механизмы и новые принципы регуляции. Поэтому было бы неверно думать, что исследователи вирусов и бактерий работали хорошо, а исследователи животных — хуже. Просто перед ними стояли несравнимые по сложности задачи. Впрочем, надо признать, что доступность прокариот привлекла к ним лучшие научные силы и большие средства. Сейчас успехи изучения регуляции экспрессии генов у эукариот стали намного ощутимее. В первую очередь это относится к проблеме строения промоторов (энхансеров) и их положения относительно структурного гена. Ho еще более впечатляют успехи в изучении такой старой, сложной и важной проблемы, как механизм малигнизации — злокачественного перерождения клеток. В заключение главы мы кратко коснемся этой темы.
В последние годы работами американских, английских и шведских ученых было показано, что процесс преобразования нормальной клетки в раковую проходит в два этапа, каждый из которых контролируется своими генами и вызывается своими причинами. Известно, что клетки, пока они нормальны, могут пройти лишь несколько десятков делений (см. гл. XIV). Ho под влиянием вирусов или изменений в собственных хромосомах некоторые клетки каким-то образом теряют тот контрольный механизм, который ограничивает число их делений. Такие клетки могут делиться бесконечное число раз, то есть становятся «бессмертными». В культуре ткани или в организме приобретение «бессмертности» происходит неоднократно, хотя и редко. Ho само по себе это свойство еще не означает злокачественности. Для ее возникновения необходим второй этап — значительное увеличение активности одного из онкогенов. Так называют некоторые нормальные гены клетки из-за их способности в исключительных ситуациях вызывать рак. Для возникновения этой ситуации необходимо, чтобы в одной из клеток, прошедших первый этап, произошло такое редкое событие, как попадание активного промотора в район онкогена. Это может возникнуть, например, при случайной хромосомной перестройке или включении в геном вируса. Активация онкогена в уже трансформированных клетках приводит к ненормальному увеличению количества того белка, который этим геном кодируется. Такая одиночная клетка, пока непонятно почему, становится злокачественной — она быстро и бесконтрольно делится и дает начало клону клеток, образующих опухоль.
То, что благодаря успехам в изучении строения и функции генов мы приблизились к пониманию механизмов возникновения рака делает более перспективной и борьбу с ним.
Глава XIV Как в развитии создается форма
Форма, возникающая в развитии, — форма целого организма, форма органа или форма клетки — это такой же важный признак организма, как и его биохимические свойства. Ho создание формы — значительно более сложный процесс. Это очевидно уже потому, что образование формы (морфогенез) складывается из многих отдельных молекулярных событий — синтеза специальных белков и химических процессов, происходящих при участии этих белков.
Мы уже знаем, что синтез одного простого белка кодируется одним геном, образование сложных белков контролируется двумя или несколькими генами. Химическая реакция в клетке — уже более сложное явление. Хотя она катализируется одним ферментным белком (и соответственно контролируется одним или двумя-тремя генами), но обычно также зависит от притока исходных субстратов, скорости использования продукта реакции, от условий и структур клетки, в которых она протекает. Все это вовлекает в контроль каждого химического процесса дополнительные гены. В сложных процессах, таких, например, как синтез ДНК, участвуют, вероятно, десятки и сотни генов.
Образование же формы включает десятки различных химических реакций, взаимодействие макромолекул и низкомолекулярных веществ и соответственно предполагает контроль со стороны множества генов. Казалось бы, этому противоречат данные классической генетики: нам известны отдельные гены, определяющие у дрозофилы число щетинок, форму крыла, размер глаза и т. д. Однако в действительности каждый такой ген является лишь одним из многих генетических элементов, участвующих в контроле формы. Их мутации нарушают нормальное строение органов, но оно может быть нарушено и многими другими путями, т. е. мутациями в иных генах.
Форма клеток и форма органов — это два разных явления, которые хотя и тесно связаны, но не всегда могут быть сведены друг к другу. Образование формы клеток еще не обязательно предопределяет форму органов, а форма органов обычно создается до того, как клетки приобретут свое окончательное строение. Вместе с тем надо четко понимать, что форма органов создается только благодаря специфическому поведению клеток и никаких сил, действующих «над» клетками, вне их (имеются в виду таинственные биополя и прочая мистика), не обнаружено и, по всей очевидности, не существует. Предположение о том, что, до того как возникнут сами органы, существуют некие биополя, которые уже имеют форму органов, является удобным выходом из тех трудностей, которые реально возникают перед исследователем морфогенеза. У нас есть единственный способ понять механизмы формообразования — обходиться теми силами, которые можно обнаружить. Этими силами являются взаимодействия клеток, изменения их формы и поведения, которые и приводят к возникновению формы органов, какой бы сложной она ни была.
1. Форма клеток
Форма клеток зависит от их внутренней структуры и свойств клеточной оболочки и от их окружения — соседних клеток и поверхностей контакта. Так, при культивировании отдельных клеток на поверхности стекла все клетки стремятся распластаться по субстрату. Аналогичным образом они распластываются и па различных поверхностях внутри организма. Одни клетки при этом неподвижны и имеют округлую форму, другие двигаются и вытягивают многочисленные отростки — псевдоподии — в направлении движения.
Одни клетки «стараются» как бы избегать контактов и соприкасаются одна с другой лишь отростками. Так, например, ведут себя клетки соединительной ткани — фибробласты или, у зародыша, мезенхимные клетки. Другие клетки могут, напротив, образовывать тесные скопления, «стараясь» соприкоснуться с соседями всей своей свободной поверхностью. Таковы, например, клетки печени. Клетки могут образовывать одно- или многослойные пласты — эпителии, где они соприкасаются только боковыми поверхностями и сохраняют свободными и различными наружную и внутреннюю (верхнюю и нижнюю) поверхности. Полярность — непременное свойство каждого эпителия. Между этими крайними вариантами есть много промежуточных способов взаимного расположения клеток, что, естественно, отражается на их форме. Особо можно сказать о нервных клетках с их многочисленными короткими отростками — дендритами и одним длинным отростком — аксоном.
Внутренние структуры клетки, которые определяют её форму, называются цитоскелетом. Цитоскелет образован волокнами разного диаметра, собранными из различных специальных белков. Каждый вид волокон имеет свои механические свойства, по-своему образуется или распадается п играет свою роль в образовании формы клетки и в определении ее поведения. Кроме белков собственно цитоскелета, составляющих существенную часть клеточных белков, есть еще группа плохо изученных минорных белков, которые определяют сборку цитоскелета и поэтому более ответственны за создание клеточной формы, чем белки самого цитоскелета. О механизмах деятельности этих белков сборки мы знаем пока очень мало.
Самые крупные волокна клетки называются микротрубочками. Их наружный диаметр 25 нм (1 нм =10-9 м), толщина стенки 5 нм. Эти трубочки собираются из глобулярных молекул особого белка — тубулина, которые располагаются в виде плотной спирали, так что вдоль одного ее оборота умещается 13 молекул тубулина, связанных друг с другом. Микротрубочки ориентированы, и их сборка обычно происходит с одного конца, а разборка — с другого. В сборке принимают участие специальные белки в очень небольших количествах и в качестве источника энергии — ГТФ. Сборка и разборка микротрубочек происходят быстро, иногда в течение нескольких минут.
Микротрубочки принимают участие в делении клетки, образуя нити веретена, которые «растаскивают» хромосомы к разным полюсам — дочерним ядрам, Предполагается, что движение хромосомы в митозе происходит за счет разборки нитей веретена, «тянущих» хромосомы, и сборки нитей, лежащих между хромосомами и «толкающих» их в разные стороны. Микротрубочки принимают участие и в создании цитоскелета. Они являются основой структуры жгутиков и ресничек (например, у многих одноклеточных, но не только у них). В жгутиках они образуют характерный скелет, состоящий из двух микротрубочек в центре и девяти двойных микротрубочек, расположенных вокруг по периферии. Микротрубочки достаточно упруги и не могут изгибаться под большими углами. Ho в составе жгутиков и ресничек они способны к небольшим изгибам и передают механические колебания вдоль по жгутику, способствуя тем самым движению таких свободно плавающих клеток, как инфузории или сперматозоиды. Сами эти колебания создаются частичной сборкой — разборкой микротрубочек. Они играют также важную роль в организации структуры нервных клеток, составляя механическую опору аксонов.
Существуют вещества колхицин и колцемид, которые проникают в клетку и, связываясь с микротрубочками, блокируют их сборку. Этим они нарушают динамическое равновесие между сборкой и разборкой, что приводит к исчезновению микротрубочек в клетке. Колхицин блокирует митоз на стадии метафазы, т. е. подавляет те процессы, которые происходят при расхождении хромосом. Эти свойства колхицина (и колцемида) нередко используются экспериментаторами для накопления клеток, остановившихся на стадии метафазы.
Вероятно, основным видом волокон цитоскелета являются микрофиламенты. Их диаметр 6 нм, и они образованы из фибрилярного белка — актина. Актин долгое время считали специфическим белком мышц. Однако оказалось, что в клетке могут синтезироваться различные актины, отличающиеся друг от друга заменами некоторых аминокислот. Актин микрофиламентов, например, отличается от мышечных актинов по 25 аминокислотам. Сами мышечные актины тоже различны: один актин входит в скелетные мышцы, другой — в гладкие, третий — в сердечную мышцу. Все они, естественно, кодируются разными генами.
Актин микрофиламентов, по-видимому, самый обильный белок в клетке. На его долю приходится до 10 % всех клеточных белков. Локализацию микрофиламентов удается выявить с помощью антител, выработанных против актина и сцепленных с флюоресцирующим красителем. В движущихся клетках, обработанных такими антителами, можно видеть, что микрофиламенты ориентированы в направлении движения клетки. Пучки микрофиламентов подходят к плазматической мембране в тех точках, где она прикрепляется к поверхности субстрата, и участвуют в движении клетки. В делящихся клетках, когда микротрубочки осуществляют расхождение хромосом, микрофиламенты осуществляют цитокинез — деление самой клетки. Для этого они под поверхностью клетки образуют кольцо, которое, сжимаясь, перетягивает клетку пополам.
Цитохалазин — вещество, выделяемое из грибов, — блокирует образование микрофиламентов и разрушает уже образованную ими сеть. Цитохалазин останавливает движение клеток, в его присутствии клетки теряют характерную для них форму и округляются. Как и следовало ожидать, он не препятствует расхождению хромосом, но блокирует цитокинез. Это приводит к образованию двухъядерных клеток.
Предполагается, что актин микрофиламентов, как и актин в мышцах, связан с другими сократительными белками, в первую очередь с миозином. При их участии микрофиламенты осуществляют механическое подтягивание всей клетки к точке прикрепления ее отростков к субстрату. Этим они определяют ее движение.
В сборке микрофиламентов из свободных молекул актина участвуют специфические белки, присутствующие в клетке в малых количествах. Об их функции, о том, как они собирают микрофиламенты в нужное время, в нужных местах и в нужной ориентации, мы пока знаем мало.
О соотношении функций микротрубочек и микрофиламентов можно судить по действию колхицина и цитохалазина на рост аксона нервной клетки. Из тела дифференцирующейся нервной клетки вытягивается длинный аксон, на конце которого находятся многочисленные тонкие короткие отростки — микрошипики. С их помощью, вероятно, определяется направление роста аксона. При действии цитохалазина эти микрошипики исчезают и рост аксона почти прекращается, хотя сам он остается неизменным. Очевидно, что вытягивание микрошипиков осуществляется с помощью микрофиламентов. При действии же колхицина неизменными остаются шипики, но начинает укорачиваться сам аксон. Постепенно он втягивается в тело клетки целиком. Очевидно, что рост и поддержание структуры аксона определяются микротрубочками.
В клетках имеется и третий вид волокон, имеющих промежуточные размеры. В эпителии они, например, образуются из нитей кератина, в других клетках это иные белки. В целом цитоскелет клетки представляет собой сложную сеть нитей различного диаметра, белкового состава и назначения. Важной особенностью цитоскелета является его высокая динамичность — способность быстро перестраиваться в зависимости от состояния клетки и ее окружения. Когда специфичные ингибиторы блокируют сборку волокон, то уже существующие элементы цитоскелета разрушаются, что приводит к нарушению формы и поведения клетки. При удалении ингибиторов из среды волокна цитоскелета быстро восстанавливаются.
Как мы увидим ниже, цитоскелет через изменения формы клеток и их движения участвует в создании структуры тканей и формы органов, хотя они создаются не только за счет изменений цитоскелета.
Микрофиламенты и микротрубочки преимущественно ориентированы в направлении движения фибробласта
Пучки актиновых микрофиламентов (1) выявляются на препарате с помощью антител к актину, а микротрубочки (2) — с помощью антител к тубулину. К антителам присоединяют флюоресцирующее вещество. Препараты А. Д. Бершадского и В. И. Гельфанда
2. Поведение клеточных пластов
Очень многие процессы формообразования осуществляются клеточными пластами, или эпителиями. Для эпителия характерно, что клетки достаточно прочно связаны боковыми поверхностями друг с другом. Клетки эпителия всегда полярны, т. е. две их поверхности отличаются друг от друга. В зависимости от соотношения высоты и ширины говорят о плоской, кубической или столбчатой форме эпителиальных клеток. Можно, например, думать, что эти различия в форме определяются степенью взаимного сродства клеток друг с другом: чем больше площадь контактирующих поверхностей, тем, очевидно, менее плоским будет такой эпителий. Ho есть и другая точка зрения: форма эпителиальных клеток определяется ориентацией в них микротрубочек. В столбчатом эпителии они ориентированы вдоль длинной оси.
Для большинства клеточных пластов характерно стремление к расширению, распластыванию, обрастанию, замыканию в полый шар. Благодаря этим свойствам, очевидно, осуществляются многие процессы морфогенеза: например, в ходе гаструляции эктодермальный эпителий обрастает вокруг остальных частей зародыша. Ho при формообразовании клеточные пласты способны не только к обрастаниям. Они могут выгибаться наружу или внутрь. В результате изгибов эктодермального пласта у зародышей амфибии и многих других животных образуется нервная трубка. Она возникает как два валика, выгибающихся наружу. Валики сближаются, а желобок между ними, напротив, прогибается внутрь и замыкается в нервную трубку — зачаток всей нервной системы. На следующем этапе за счет выгибания стенок нервной трубки в некоторых местах наружу образуются мозговые пузыри — зачатки отделов головного мозга или зачатки глаз. За счет прогибания в этих же зачатках глаз передней стенки внутрь происходит разделение на будущую сетчатку и пигментный эпителий. Сходные процессы составляют существо многих других морфогенетических процессов.
Пока мы просто описываем то, что происходит во время развития и давно известно каждому эмбриологу. Значительно меньше известно о механизмах этих процессов. Л. В. Белоусовым был предложен красивый метод выявления тех натяжений, под действием которых совершаются морфогенетические движения клеточных пластов. Если вырезать кусочек такого эпителия и поместить его в солевую среду, то изменение его формы в первые минуты — выгибание в ту или иную сторону, распластывание или сжатие — покажет направление сил, которые определяли поведение пласта в момент его изоляции. Если изолировать такие кусочки из разных мест зародыша и на разных стадиях можно составить целостную картину морфогенеза. Однако и эти опыты только констатируют существование сил, которые определяют морфогенез, но еще не объясняют их происхождение.
Есть основания думать, что движения и изгибания клеточных пластов определяются цитоскелетом клеток, составляющих эти пласты. Это было показано, например, для инвагинации эктодермального эпителия при формировании нервной трубки или хрусталика глаза. До начала этого процесса микротрубочки и микрофиламенты располагаются в клетке достаточно хаотично. Затем эпителий в месте будущего прогибания утолщается, т. е. составляющие его клетки удлиняются. Это сопровождается ориентацией микротрубочек вдоль длинной оси клеток. То, что их ориентация является причиной вытягивания клеток, а не следствием, доказывается опытами с колхицином: он подавляет вытягивание клеток.
Прогибание клеточного пласта, по существу, состоит в том, что та поверхность клеток, которая в результате прогибания окажется внутри, становится меньше той, которая окажется наружу. Это естественно, так как наружная поверхность трубки меньше внутренней. Так возникает желобок, который затем сворачивается в трубку. Как оказалось, этот процесс осуществляется посредством стягивания «внутренних» концов клеток кольцом из микрофиламентов и превращения клеток в своего рода конусы. Как и ожидалось, цитохалазин блокирует этот процесс и останавливает прогибание желобка — будущей нервной трубки — и даже приводит к его обратному развертыванию, если он уже образовался.
He следует думать, что теперь мы понимаем процесс образования нервной трубки и других похожих морфогенезов до конца. В лучшем случае мы просто сделали еще один шаг в описании этого процесса и, если угодно, довели его до клеточного и даже до внутриклеточного уровня. Ho остается неизвестным, каким образом производится сборка молекул актина в кольцо микрофиламентов. Мы еще не знаем, почему она происходит в виде кольца, а не иным образом, почему она происходит именно на том конце клеток, который должен быть обращен внутрь будущей нервной трубки.
Выше, в гл. 6, мы уже говорили, что детерминация клеток эктодермального эпителия в нервную ткань происходит посредством индукции со стороны зачатка будущей хорды. Предполагается, что такая индукция каким-то образом (точный механизм индукции неизвестен) включает в клетках будущей нервной трубки те гены, которые ответственны за дифференцировку этих клеток в нервную ткань. Теперь мы, может быть несколько упрощенно, представляем и завершающие этапы образования нервной трубки: образование и стягивание в нужных местах микрофиламентов, изменение формы клеток и их свертывание в трубку. О событиях, происходящих между действием генов п образованием микрофиламентов, в наших знаниях лежит не заполненная пока брешь, которую в будущем займут сведения о том, как синтезируются белки, определяющие сборку микрофиламентов, и как определяется место их действия в клетках.
Такая длинная и сложная цепь событий лежит, очевидно, в основе каждого процесса формообразования! А ведь мы еще не касались того, как на последующих стадиях развития создается характерная форма нервной трубки с ее стенками неравной толщины (будущий спинной мозг), как она дифференцируется вдоль своей осп на отделы головного мозга и спинной мозг, как, наконец, составляющие ее клетки преобразуются в различные нервные клетки.
3. Перемещения отдельных клеток
Многие процессы формообразования происходят не путем перемещения клеточных пластов, а путем перемещения отдельных клеток. Иногда движение клеточного пласта происходит при частичной потере его эпителиальной структуры. Так, например, осуществляется гаструляция у амфибий. Процесс начинается с изменения формы клеток будущей мезодермы. В том месте, где затем происходит впячивание клеток в полость бластулы (эмбриологи называют это место верхней губой бластопора), клетки принимают форму бутылки с вытянутым горлышком. Утолщенная часть клетки (дно бутылки) устремляется внутрь зародыша, а ее узкая часть (горлышко) остается связанной с тонкой пленкой, покрывающей весь зародыш, и тянет ее за собой. Контакты между соседними клетками при этом почти теряются — каждая из них движется в полость бластулы как бы независимо. Ho в действительности они находятся в одной упряжке, так как связаны общей поверхностной пленкой, которую они втягивают за собой внутрь.
На более поздних стадиях эмбрионального развития еще ряд клеточных пластов теряют свое эпителиальное строение: они рассыпаются на отдельные клетки, двигающиеся независимо друг от друга. Так ведут себя, например, клетки нервного гребня — структуры, образующейся на границе нервной трубки и эктодермального эпителия. Эти клетки вползают под эктодерму и двигаются под пей, вдоль ее внутренней поверхности. Позднее они дифференцируются в очень различных направлениях: в хрящевые клетки, в пигментные клетки — меланофоры, в клетки надпочечников.
Еще разнообразнее производные мезодермы. Значительная часть мезодермалыюго пласта рассыпается на отдельные клетки, так называемую мезенхиму — эмбриональные фибробластоподобные подвижные клетки с вытянутыми в разные стороны отростками. Эти клетки расползаются по всему зародышу и участвуют в образовании множества органов: соединительной ткани кожи, всего скелета, крови, сосудов и др.
В ходе этих формообразовательных процессов клетки занимают те позиции, в которых они дифференцируются в ткани различных органов. В определенных местах они сгущаются и образуют плотные скопления. Так выглядят, например, зачатки конечностей или окружающие спинной мозг зачатки позвонков. В других местах, напротив, клетки как бы расступаются, образуя полости различного размера и назначения.
Биологический смысл такого рассыпания клеточных пластов, направленной миграции клеток и их скопления в различных местах зародыша кажется понятным. Многие органы просто нельзя образовать из пластов, как бы их ни изгибать. Это невозможно или очень трудно по так сказать топологическим причинам. В то же время из рассеянных клеток можно в принципе собрать любую, самую сложную форму. Иное дело, как сложны должны быть те механизмы, которые «заставляют» клетки расположиться нужным образом. Понять это — значит понять в биологии развития очень многое.
Движение клеток, если у них нет специальных жгутиков и ресничек, не может происходить в жидкой среде. Клетки всегда двигаются или, точнее, ползут по какой- либо поверхности — субстрату. В эксперименте это может быть поверхность стекла или специальной подложки. Ho в развивающемся, да и во взрослом, организме субстратом движения клеток могут быть или другие клетки, или неклеточные образования — сформированные другими клетками мембраны или сеть коллагеновых волокон.
Перед исследователями развития стоит несколько связанных, но не вполне тождественных задач. Необходимо знать, как вообще происходит движение клетки. Далее следует выяснить, каким образом клетка выбирает направление своего движения. И наконец, что определяет тот непростой маршрут, по которому клетки из одной части зародыша попадают в другую, нередко довольно отдаленную.
О механизме движения клеток мы уже говорили. Он, очевидно, складывается из нескольких элементов. Сначала клетка выпускает в различных направлениях несколько плазматических отростков (псевдоподий), которые отыскивают на субстрате точки прикрепления. Когда одна или несколько рядом лежащих псевдоподий прикрепляются к субстрату, в цитоплазме образуются пучки микрофиламентов, которые тянутся от мест прикрепления на мембране к телу клетки. Далее эти микрофиламенты подтягивают всю клетку к месту прикрепления. Здесь неясными пока остаются молекулярные процессы, которые определяют движение псевдоподий, структура рецепторных молекул, которыми псевдоподии прикрепляются к субстрату, и механизмы образования микрофиламентов, ориентированных от мест прикрепления к центру клетки.
В определении направления движения клетки, как это показали Ю. М. Васильев и его сотрудники, участвуют не только микрофиламенты, подтягивающие клетку, но микротрубочки, определяющие ее ориентацию. После того как псевдоподии нашли «лучшее» место прикрепления и клетка оказывается вытянутой в определенном направлении, в ней собираются микротрубочки, ориентированные в том же направлении. Таким образом, выбор направления движения клетки исходно зависит от субстрата и возможности прикрепления к нему, а затем клетка как бы стабилизируется в этом направлении и двигается вдоль него. Изменить направление ее движения могут теперь серьезные изменения в структуре субстрата или прямые препятствия.
Можно ли таким путем объяснить движение клеток по длинным и сложным маршрутам? Этот вопрос не решен, и здесь обсуждаются две, впрочем не конкурирующие, а, может быть, дополняющие друг друга, гипотезы. Одна из них предполагает, что весь путь клетки определяется субстратом, что клеточные потоки — это маршруты, образованные поверхностью других клеток и неклеточных образований. Другая гипотеза основана на хемотаксисе — движении клеток в направлении большей концентрации некоторых «привлекающих» клетку веществ. Эти два механизма используются и для объяснения направленного роста аксонов нервных клеток. Можно представить и еще один механизм привлечения клеток, похожий на хемотаксис, но как бы противоположный ему по знаку. Это — локальное торможение движения клеток. Случайно мигрирующие клетки, попав в такую «ловушку», остаются в ней и скапливаются в определенных участках зародыша.
4. Взаимоотношения между клетками
О взаимоотношениях между клетками в морфогенезе мы говорили и в предыдущих разделах этой главы. Изменения формы клеток, их движение и другие виды поведения в организме всегда осуществляются совместно многими клетками и в зависимости их друг от друга. В этом разделе мы обсудим, как клетки «выбирают» характер своих отношений с другими клетками, как они «узнают» друг друга и как ведут себя в зависимости от этого.
Взаимное узнавание клеток осуществляется их поверхностями. Межклеточные отношения можно нарушить разными факторами, которые действуют на клеточную поверхность. Ее белковые или углеводные компоненты можно, например, повредить, обрабатывая клетку снаружи соответствующими ферментами (протеазами и карбогидразами). Эти же молекулы на поверхности клетки можно заблокировать антителами, полученными против них. Контакты между клетками могут быть нарушены также веществами, связывающими кальций. Роль кальция очень велика и, очевидно, определяется его двухвалентностью и способностью образовывать межмолекулярные мостики. Однако точных данных о механизме действия кальция на межклеточные контакты до сих пор нет.
Многие белки клеточной поверхности связаны с различными короткими цепочками углеводов, в которых чередуется несколько видов сахаров. Аналогичные углеводные цепочки обнаружены и на липидах клеточной мембраны. Можно думать, что основной функцией этих углеводных цепочек является увеличение разнообразия свойств клеточной поверхности, которое достигается без существенных изменений структуры самих мембранных белков и липидов. Возможно, что роль таких маркеров, создающих своеобразный орнамент на поверхности клетки, могут играть и другие химические соединения.
В отношении самого механизма узнавания существует много гипотез и схем, что служит верным признаком недостаточности наших знаний в этой области. Одна из гипотез принадлежит Роземану, и ее обычно приводят не потому, что она всем кажется более верной, а потому, что она основана на оригинальном новом принципе. Предполагается, что на поверхности клеток находится фермент, узнающий определенные углеводные группы и, если он действует в растворе, отрезающий их. Такие ферменты среди белков поверхности действительно находят. На поверхности клеток обнаружены различные углеводные группы, в том числе и те, которые могут быть субстратом для этих ферментов. Гипотеза состоит в том, что фермент на поверхности одной клетки «узнает» свой субстрат на поверхности другой клетки и связывается с ним благодаря комплементарности субстрата и активного центра фермента. Ho из-за особенностей структуры всей углеводной цепочки, как предполагает гипотеза, осуществить свою реакцию, т. е. «откусить» конечный сахар, фермент не может, а так и остается связанным, соединяя тем самым клетку с к леткой. Так как узнавание ферментами субстратов действительно очень специфично, эта гипотеза объясняет высокую специфичность узнавания одинаковыми клетками друг друга.
Опыты по узнаванию между клетками были начаты Гольтфретером уже более 40 лет назад. Он диссоциировал клетки гаструлы амфибий, т. е. отделял их друг от друга. Для этого достаточно убрать из солевой среды кальций или, что еще эффективнее, добавить в среду вещество, связывающее кальций. Если к диссоциированным и перемещенным клеткам снова добавить кальций, то клетки всех трех зародышевых листков слипаются в бесформенный комок, состоящий из беспорядочной смеси всех трех сортов клеток. Однако через сутки клетки оказываются «рассортированными», так что эктодермальные клетки лежат, как им и полагается, снаружи, энтодермальные — внутри, а клетки мезодермы — между ними. У морского ежа после такой диссоциации и реассоциации развивается нормальный зародыш. Нам пока важно отметить, что если беспорядочно расположенные клетки смогли собраться вместе и правильно расположиться, то, значит, они действительно как-то узнают друг друга и предпочитают себе подобных.
Стейнберг сделал следующий шаг: он исследовал образование контактов между шестью типами эмбриональных клеток цыпленка, которые теоретически могут образовывать 15 различных вариантов смешанных пар. Такие пары действительно образуются, но при свободном выборе (в смеси) одни пары возникают чаще (или они прочнее), чем другие, и можно установить постепенный ряд степеней сродства (аффинитета) между клетками. Эта работа придает проблеме «узнавания» и связывания количественный подход: нельзя утверждать, что клетки одного типа узнают или не узнают другие, а можно лишь говорить, что одни пары клеток связываются прочнее, чем другие.
Сказанное здесь не следует понимать слишком упрощенно. Межклеточные контакты еще далеко не ясное явление: в них, очевидно, участвуют не только поверхности обеих клеток и ионы кальция, но и, возможно, специальные белки, так называемые факторы адгезии.
Последний пример подобного узнавания, который мы рассмотрим, был исследован на диссоциированных клетках сетчатки и связан с именами Москоны и затем Барберы и Готлиба. Сначала Москона показал, что между клетками сетчатки существует избирательное узнавание и слипание. Барбера и потом Готлиб изучали сцепление между диссоциированными клетками сетчатки и зрительного отдела мозга — тектума. На достаточно поздних стадиях развития от сетчатки к тектуму подрастают аксоны нервных клеток сетчатки. Важно, что определенные районы сетчатки посылают аксоны не случайно, а к определенным районам тектума. Диссоциированные клетки ранней сетчатки можно пометить радиоактивным фосфором и измерять их прилипание к кусочкам тектума количественно, по радиоактивности. Оказалось, что клетки, полученные из вентральной (нижней) половины сетчатки, значительно сильнее прилипают к дорсальной (верхней) половине тектума и гораздо слабее — к вентральной его части. Клетки дорсальной половины сетчатки ведут себя как раз наоборот. Удивительно, что и при нормальном развитии нервных связей глаза и мозга точно так же ведут себя аксоны: из дорсальной половины сетчатки они тянутся в вентральную половину тектума, а из вентральной части сетчатки — в дорсальные районы тектума.
Таким образом, от проблемы «узнавания» мы перешли к проблеме «сортинга», т. е. способности клеток не только узнать друг друга, но и разобраться по сортам, как это было обнаружено еще Гольтфретером на гаструле амфибий. А от проблемы «сортинга» мы естественным образом переходим к проблеме морфогенеза. Узнавание клетками друг друга оказывается в то же время и механизмом создания в развитии их правильного расположения.
Каковы же механизмы «сортинга»? Предполагается, что эмбриональные клетки (а у низших многоклеточных — губок и кишечнополостных — и взрослые клетки) вступают друг с другом не в постоянные, а в динамические контакты, т. е., двигаясь друг относительно друга, образуют то менее, то более прочные связи, зависящие от обоих типов клеток, степени их аффинитета, или, что то же самое, от свойств их поверхности. Чем прочнее такой контакт, тем дольше он удерживается и реже нарушается. Клетки двигаются друг относительно друга до тех пор, пока не возникнет наиболее стабильная система, обладающая, если говорить языком физики, минимумом свободной энергии.
Кажется вероятным, что и в нормальном эмбриональном развитии клетки контактируют друг с другом так, что всегда образуют наиболее стабильные контакты. Иначе бы ход эмбриогенеза постоянно нарушался из-за того, что клетки уползали бы в другие места, завязывали бы «неправильные», но более прочные контакты и т. д. Перемещения клеточных пластов, собирание клеток в массы, контакты одних типов клеток с другими во многом, хотя и не целиком происходят благодаря этим силам сродства и взаимного «узнавания» — притяжению и иногда отталкиванию (его называют отрицательным аффинитетом). Неудивительно поэтому, что и искусственный «сортинг» беспорядочно расположенных клеток создает большее или меньшее подобие нормальной организации ранних, просто устроенных стадий развития.
Наибольшую роль эти механизмы играют, по-видимому, в морфогенезе одного из самых простых многоклеточных — губок. Они состоят всего из трех — пяти сортов клеток, и если их «диссоциировать» путем простого протирания через сито, то они снова собираются в простой, но правильно устроенный организм. Можно думать, что все развитие губок состоит лишь в создании нескольких типов клеток. Их нормальное взаимное расположение не требует специально программированных клеточных перемещений и совершается путем «ползания» клеток в агрегате друг по другу, пока не возникнет правильная (и она же наиболее стабильная) организация.
У других простых многоклеточных — кишечнополостных уже определенно можно говорить о процессах морфогенеза. Тем не менее если гидру диссоциировать на клетки, то она соберется в новый полноценный организм. Здесь, правда, трудно отделить этот процесс от очень высокой способности гидры к регенерации (почти из любой части тела).
У животных, организованных более сложно, таких, как морской еж и особенно амфибии, удачная сборка удается только на стадии гаструлы — с той разницей, что у морского ежа она приводит к нормальному развитию, а у амфибий — лишь к некоторой аналогии нормы.
Когда речь идет о «сортинге», например, гаструлы амфибий, необходимо объяснить не только саму сортировку клеток, т. е. объединение себе подобных. Существенно понять, почему клетки эктодермы в итоге оказываются снаружи, а энтодермы — внутри. Это объясняется различными свойствами этих типов клеток. Эктодерма стремится обрасти все другие типы клеток снаружи, — это же самое она совершает в ходе нормальной гаструляции. Это свойство клеток эктодермы можно, вероятно, выразить и в более строгих терминах — в стремлении увеличить наружную поверхность клеточного пласта и т. д. Вместе с тем клетки эктодермы и энтодермы «испытывают» отрицательный аффинитет друг к другу: их искусственная смесь быстро разобщается на два отдельных шара, соприкасающиеся в одной точке. В то же время мезодермальные клетки одинаково хорошо контактируют и с эктодермой и с энтодермой — так они ведут себя и в ходе нормальной гаструляции. Поэтому не только «сортинг», но и воссоздание подобия гаструлы из смеси всех трех сортов клеток отражает и их взаимное узнавание, и их различное поведение. Естественно, что свойства клеток, которые участвуют в осуществлении нормального хода гаструляции, проявляются и в экспериментах по реассоциации.
На более поздних стадиях реассоциация клеток воссоздать нормальную структуру уже не может. Организация зародыша уже настолько сложна, что ее определяют не только свойства клеток (а именно их мы исследуем при реассоциации), но и предшествующая история развития данного зародыша. Ho в пределах отдельных органов эти силы межклеточных взаимоотношений все еще играют свою роль. Поэтому-то оказывается возможным воссоздание из диссоциированных клеток такого органа, как, например, эмбриональная сетчатка птиц.
Известен «естественный эксперимент», иллюстрирующий и возможности и ограниченность сил межклеточных взаимоотношений. Это эмбриональные тератомы — опухоли из малодифференцированных «эмбриональных» клеток. В центре такой опухоли происходит деление недифференцированных клеток, но на периферии они оказываются способными, если не ко всем, то ко многим дифференцировкам. Там можно видеть фрагменты различных тканей и даже органов. Однако ничего похожего на организм из такой опухоли не возникает, так как у тератом отсутствуют программированные процессы последовательного морфогенеза.
Можно заключить, что механизмы, обеспечивающие взаимное узнавание клеток, их сортировку, степень слипания и другие особенности поведения, играют очень важную роль в морфогенезе. Эта роль тем выше, чем проще само формообразование. Ho сложный морфогенез невозможен без участия программированных перемещений клеток, которые создаются, очевидно, не только силами сродства между клетками и, главное, происходят в определенном порядке и последовательности.
5. Программы размножения и гибели клеток
По мере развития количество клеток, из которых состоит зародыш, увеличивается. Деления клеток (дробление яйца) на самых ранних стадиях развития происходят равномерно (синхронно). Ho у одних видов раньше, у других позже эта синхронность нарушается и клетки, из которых образуются зачатки разных органов, начинают делиться с разной скоростью. Эти различия в скорости деления можно рассматривать как одно из первых проявлений их дифференцировки.
У зародышей млекопитающих уже после стадии 16–32 бластомеров большая часть клеток начинает делиться быстрее и образует трофобласт — зачаток будущей плаценты. Сам будущий зародыш состоит на этих ранних стадиях всего из нескольких клеток. Однако позже в ходе развития и роста зародыш и затем плод становятся во много раз больше плаценты.
У амфибий на стадии бластулы, состоящей из нескольких тысяч клеток, будущая мезодерма составляет менее одной трети всех клеток. Ho по мере развития мезодермальные производные — все мышцы, почти весь скелет, система кровообращения, почки и др. — занимают не менее 80 % всей массы головастика.
Особенно нагляден неодинаковый темп деления клеток в морфогенезе многих беспозвоночных. У видов с мозаичным развитием уже на стадии 30–60 клеток зачатки всех основных органов определены и представлены очень немногими клетками (иногда всего двумя). Далее деления клеток в каждом зачатке строго программируются. Так, например, ранний зародыш асцидий содержит 52 клетки эктодермы, 10 клеток энтодермы и всего 8 клеток мезодермы. В течение последующего развития число клеток эктодермы возрастает в 16 раз, энтодермы — в 20, а мезодермы — в 50. Благодаря программированности делений число клеток у некоторых взрослых беспозвоночных (например, у нематод) строго постоянно и каждый орган представлен определенным числом клеток. Далеко не всегда местоположение органа и место, где делятся составляющие его клетки, совпадают. Часто митозы происходят только в особой зоне размножения и оттуда клетки мигрируют к месту своей дифференцировки. Примеры такого рода мы уже видели при рассмотрении системы стволовых клеток. То же происходит, например, и при развитии головного мозга.
Программа клеточных делений не всегда очень строга и предопределяет точное их число. Чаще, вероятно, деления происходят до тех пор, пока количество клеток или размер органа не достигнет определенной величины. Речь идет, таким образом, о двух принципиально различных механизмах регуляции клеточных делений.
В одном случае (как в яйцах с мозаичным развитием) он, по-видимому, заключен в самой делящейся клетке, которая должна «уметь отсчитывать» свои деления. В другом же случае должна существовать некоторая «петля обратной связи», когда масса органа или число клеток, достигая некоторой величины, начинает тормозить дальнейшие деления.
Оказалось, что число делений в нормальных клетках, не трансформированных в злокачественные, вообще не беспредельно и обычно не превышает 50–60 (большинство клеток делится меньше, так как если бы яйцо равномерно разделилось 60 раз, то число клеток в организме (260) оказалось бы в тысячи раз выше, чем в действительности). Однако ни механизм такого предела числа клеточных делений (называемого по имени открывшего его ученого предел Хайфлика), ни его биологический смысл пока непонятен.
Что же является «датчиком» в системе регуляции — размер органа или число клеток? Однозначный ответ на этот вопрос дают опыты с получением животных с измененной плоидностью — гаплоидные, триплоидные или тетраплоидные. Их клетки соответственно в 2 раза меньше или в 1,5 или 2 раза больше нормальных диплоидных. Тем не менее и размер самих животных, и размер их органов, как правило, нормальные, т. е. они содержат больше или меньше клеток, чем в норме. Регулируемой величиной, следовательно, является не количество клеток, а масса органа или всего организма.
Иначе обстоит дело у растений. Клетки тетраплоидных растений, как и у животных, соответственно больше диплоидных. Но и размеры частей тетраплоидных растений — листьев, цветков, семян — часто оказываются больше обычных почти в 2 раза. Похоже, что у растений «датчиком» при определении числа клеточных делений является не размер органа, а само число клеток.
Механизмы, регулирующие клеточные деления — пролиферацию клеток, изучаются очень интенсивно и с разных сторон. Одним из стимулов такой активности ученых является то, что отличия раковых клеток от нормальных во многом и состоят в нарушении регуляции клеточных делений, в выходе клеток из-под такой регуляции.
Примером одного из механизмов регуляции клеточных делений может служить поведение клеток, посеянных на дно флакона с питательной средой, — клеточной культуры. Их деления в хороших условиях происходят до тех пор, пока они не покроют все дно и клетки не коснутся друг друга. Далее наступает так называемое контактное торможение, или торможение, зависимое от плотности клеток. Его можно нарушить, как это делал Ю. М. Васильев, расчистив от клеток небольшое окошко на поверхности стекла. В это окошко со всех сторон устремляются клетки, вокруг него проходит волна клеточных делений. Можно думать, что и в организме контакты с соседними клетками являются механизмом, сдерживающим клеточные деления.
У опухолевых клеток эта регуляция нарушается — они не подчиняются контактному торможению, а продолжают делиться, громоздясь друг на друга. Аналогично, увы, они ведут себя и в организме.
Ho контактное торможение не является единственным механизмом регуляции: ее барьер может быть преодолен и у вполне нормальных клеток. Так, например, плотно прижатые друг к другу клетки печени у молодого животного тем не менее делятся и печень растет вместе с ростом всего животного. У взрослых животных эти деления практически прекращаются. Однако если две доли печени удалить, то в оставшейся доле очень быстро начнутся массовые деления клеток — регенерация печени. Если удалить одну почку, то в течение немногих дней вторая почка за счет клеточных делений увеличится вдвое. Очевидно, что в организме существуют механизмы, способные стимулировать клеточные деления в органе, активировать его рост и приводить размеры органа тем самым в некоторое количественное соответствие с размерами всего организма.
В этом случае действуют не контактные механизмы, а какие-то химические факторы, может быть связанные с функцией печени или почек. Можно представить, что недостаточность функции этих органов, при удалении части их или при отставании их роста от роста всего организма, так нарушает весь метаболизм в организме, что это вызывает компенсаторную стимуляцию клеточных делений именно в данных органах. Есть и другие гипотезы, объясняющие, например, подобные явления действием особых ингибиторов клеточных делений — кейлонов, выделяемых самим органом; если орган меньше, то меньше и кейлонов и больше клеточных делений в этом органе. Если такой механизм и существует, то действует он не везде. Например, потеря одной ноги не приводит сама по себе к увеличению размеров другой ноги.
Деления стволовых и дифференцирующихся клеток крови стимулируются, как мы уже говорили, гормонами, такими, как, например, эритропоэтин. Гормоны стимулируют клеточные деления и во многих других случаях. Например, стимуляция роста числа клеток яйцевода у кур активируется женским половым гормоном. Существуют химические факторы — обычно это небольшие белки, которые действуют не как гормоны, т. е. не разносятся с кровью по всему организму, а влияют более ограниченно, на соседние ткани. Это известные сейчас факторы роста — эпидермальный и др. Однако в большинстве случаев конкретные химические факторы регуляции клеточных делений и механизмы их действия нам неизвестны.
Еще меньше мы знаем о регуляции клеточных делений во время основных процессов морфогенеза — в эмбриональном развитии. Мы уже говорили, что здесь способность одних клеток делиться быстрее, чем другие, является проявлением их дифференцировки. В то же время нельзя не заметить, что дифференцировка и клеточные деления в определенном смысле противостоят друг другу и иногда даже исключают друг друга. В некоторых случаях это связано с невозможностью деления при далеко зашедшей, терминальной дифференцировке клеток. Может ли, например, разделиться эритроцит с его очень специализированной структурой, жесткой оболочкой и почти полной утратой большинства клеточных функций, а у млекопитающих еще и с потерей ядра? Нервные клетки хотя и сохраняют очень высокий темп метаболизма, но их длинный аксон и дендриты, связанные с другими клетками, служат очевидными препятствиями к делению. Если бы такое деление у нервной клетки все же произошло, это привело бы к потере связи этой клетки с другими и, следовательно, к потере ее функции.
Поэтому обычной последовательностью событий является сначала период пролиферации клеток, а уже затем дифференцировка, носящая терминальный характер. Более того, ряд ученых предполагают, что как раз во время клеточных делений хромосомы как бы «освобождаются» для следующего этапа дифференцировки, — последнему митозу перед дифференцировкой придается особое значение. Эти представления носят пока во многом умозрительный характер п не имеют на молекулярном уровне хороших экспериментальных оснований.
Ho и не зная конкретных механизмов регуляции клеточных делений, мы вправе рассматривать их программированный характер как такое же проявление программы развития, каким являются и все остальные его процессы.
В заключение мы кратко остановимся и на явлении, как бы обратном размножению клеток, — их гибели, которая в определенных случаях формообразования является необходимым этапом развития. Так, например, при образовании пальцев в зачатках кисти передних и задних конечностей клетки мезенхимы собираются в плотные тяжи, из которых потом формируются хрящи фаланг. Среди клеток, оставшихся между ними, происходит массовая гибель, за счет которой отчасти пальцы отделяются друг от друга. Нечто похожее происходит и при дифференцировке зачатка крыла у птиц. Механизмы гибели клеток в этих случаях — факторы, внешние по отношению к клеткам, и события внутри клеток — остаются малоизвестными. А. С. Уманский предполагает, например, что гибель клетки начинается с деградации ее ДНК.
Размножение клеток, несмотря на всю его важность, нельзя считать основным механизмом морфогенеза: в создании формы оно участвует все же косвенно, хотя такие важные параметры, как общая форма органа и его относительные размеры, могут регулироваться именно на уровне клеточных делений. Еще меньшую роль играет в морфогенезе программированная гибель клеток. Ho тем не менее они являются в нормальном развитии совершенно необходимыми компонентами. В регуляции этих явлений участвуют практически все компоненты клетки и ее генетический аппарат. Это показывает нам, что в развитии не бывает простых процессов. Попытка до конца разобраться в любом из них заставляет нас обращаться к основным молекулярным механизмам работы клетки. А здесь еще много нерешенного.
Для того чтобы оценить всю сложность развития многоклеточного организма, надо представить себе этот процесс происходящим как бы в многомерном пространстве. Одну ось составляет длинная цепь этапов реализации генетической информации — от гена до признака. Второй такой осью можно назвать всю совокупность генов в хромосомах. В ходе развития продукты различных генов взаимодействуют друг с другом. Развертывание событий но двум осям образует как бы сеть на плоскости. Однако существует п третья ось — разнообразие событий, происходящих в разных частях зародыша. События эти могут происходить относительно автономно, как у животных с мозаичным развитием. Ho частично и у них, а в полной мере у видов с регуляционным типом развития между частями организма осуществляются большие или меньшие взаимодействия и всегда сложные перемещения клеток. Рассматривать их все как одну ось можно, только идя на значительные упрощения. И наконец, все развитие (гаметогенез, эмбриогенез и постэмбриональное развитие) происходит во времени, масштаб которого совершенно иной, чем время, измеряемое на пути от гена до белка. По этой (условно четвертой) оси вся многомерная картина радикально изменяется — яйцо превращается в размножающийся организм. Эта многомерность иллюстрирует сложность всех процессов и их взаимоотношений и трудности их понимания.
Заключение
Нам осталось сказать несколько общих слов. В биологии развития есть решенные и нерешенные проблемы. Трудно сказать каких больше. Ho, как это свойственно всякой науке, в ней сначала решались более легкие проблемы, а менее доступные остались под конец. Однако предугадать, какой вопрос окажется простым, а какой потребует чрезвычайных усилий, обычно не удается. Можно ли было, например, думать до Дженнера и Пастера, что проблема сравнительно редкого в те годы рака окажется такой сложной, а страшный бич человечества — оспа — будет окончательно побежден и довольно легким путем?
Такая же неопределенность характерна и для биологии развития. Сейчас, например, мы почти разобрались в строении и функции невидимых глазу генов. А вот как и почему изменяется форма клеток, хорошо видимых под микроскопом, мы еще не знаем, хотя вероятно и приближаемся к решению этого вопроса. Ho понять как, благодаря перемещению тех же клеток, создается форма органов, видимых уже невооруженным глазом, мы не можем и, честно говоря, не знаем, как к этой проблеме лучше подойти. Решение обычно приходит тогда, когда возникает новый, часто совсем неожиданный подход к проблеме и создаются новые методы ее решения. Угадать правильное направление, обычно, не удается. Поэтому вероятность успеха тем выше, чем разнообразнее и неожиданнее выбираемые пути исследования.
В этой книге основное внимание было уделено генетическому аспекту развития потому, что он представлялся нам главным. Успехи в этом направлении стали возможны благодаря прогрессу молекулярной биологии.
Решение других проблем биологии развития потребует союза с другими науками. Тогда мы напишем другую книгу.
Примечания
1
У части вирусов роль наследственного вещества выполняет не ДНК, а сходная с ней по строению РНК.
(обратно)










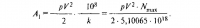
Комментарии к книге «Гены и развитие организма», Александр Александрович Нейфах
Всего 0 комментариев